LAPORAN PRAKTIKUM KIMIA ORGANIK DASAR
PERCOBAAN I ALKOHOL DAN FENOL
NAMA : DIAN EKA PERTIWI
NIM : H311 14 029
KELOMPOK : 3 (TIGA)
HARI/TGL. PERCOBAAN : RABU/11 MARET 2015
ASISTEN : ASRAR RAHMAN S.
LABORATORIUM KIMIA ORGANIK DASAR JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS HASANUDDIN
BAB I PENDAHULUAN
1.1 Pendahuluan
Kata alkohol segera mengingatkan kita pada etanol, yaitu senyawa memabukkan yang terdapat dalam anggur dan bir. Etanol adalah salah satu dari keluarga senyawa organik yang disebut alkohol yang terdapat di alam. Alkohol alami meliputi 2-feniletanol, yaitu senyawa yang menyebabkan bau memabukkan dari bunga mawar, sukrosa yaitu gula untuk memenuhi rasa manis; dan banyak lagi. Gugus hidroksil terdapat dalam banyak molekul yang penting secara biologis. Empat alkohol jenuh yang penting dalam metabolisme ialah 3-metil-2-buten-1-ol, 3-metil-3-buten-1-ol, geraniol, dan fernesol (Hart, dkk., 2003).
Fenol kurang terlibat dibandingkan dengan alkohol dalam proses metabolisme mendasar. Namun, ada tiga alkohol fenolik yang membentuk blok pembangun dasar dari lignin, yaitu zat polimer rumit, yang bersama-sama dengan selulosa, membentuk bagian berkayu pada pohon. Beberapa bahan alam fenolik yang harus dihindari ialah urushiol, yaitu bahan alergen aktif dalam racun tumbuhan ivy dan oak (Hart, dkk., 2003).
1.2 Maksud dan Tujuan Percobaan
1.2.1 Maksud Percobaan
Maksud dari percobaan ini adalah untuk mempelajari beberapa sifat fisika dan kimia dari alkohol dan fenol serta membedakan antara alkohol primer, sekunder, dan tersier.
1.2.2 Tujuan Percobaan
Tujuan dari percobaan ini adalah:
1. Untuk mengetahui kelarutan metanol dan fenol dalam air dan n-heksana. 2. Untuk membedakan alkohol primer, sekunder dan alkohol tersier.
3. Untuk mengetahui beberapa reaksi alkohol dan fenol dengan Na2CO3, NaHCO3 dan FeCl3.
1.3 Prinsip Percobaan
1.3.1 Kelarutan dalam air dan n-heksana
Prinsip dari percobaan ini adalah menentukan kepolaran alkohol dan fenol dengan cara mencampurkan dengan air dan n-heksana, jika larut dalam air dan tidak larut dalam heksana bersifat polar, jika tidak larut dalam air namun larut dalam n-heksana bersifat nonpolar, dan jika larut di keduanya maka sifatnya semipolar.
1.3.2 Membedakan alkohol primer, sekunder dan tersier dengan cara Lukas Prinsip dari percobaan ini adalah membedakan jenis alkohol primer, sekunder, dan tersier serta fenol (sebangai pembanding) dengan menggunakan pereaksi lukas, kecepatan reaksi dari alkohol primer ke tersier semakin besar.
Prinsip dari percobaan ini adalah menentukan keasaman alkohol dan fenol dengan mereaksikannya dengan Na2CO3 dan NaHCO3, jika bereaksi ia asam dan jika tidak bereaksi ia basa.
1.3.4 Reaksi dengan FeCl3
Prinsip dari percobaan ini adalah membedakan senyawa alkohol dan fenol dengan mereaksikannya dengan FeCl3, jika bereaksi dengan FeCl3 maka ia fenol dan jika tidak bereaksi dengan FeCl3 maka ia alkohol.
TINJAUAN PUSTAKA
Alkohol adalah senyawa yang mempul mempunyai gugus fungsi hidroksil yang terikat pada atom karbon jenuh. Alkohol mempunyai rumus umum ROH, dimana R merupakan alkil, alkil tersubstitusi, atau hidrokarbon siklik. alkohol disini tidak termasuk fenol (gugus hidroksil berikatan dengan cincin aromatik), enol (gugus hidroksil berikatan dengan karbon vinilik) karena sifatnya kadang berbeda. Alkohol dapat dianggap merupakan turunan dari air (H—O—H), di mana satu atom hidrogennya diganti dengan gugus alkil (Riswiyanto, 2009).
Alkohol digolongkan ke dalam alkohol primer (1o), sekunder (2o), atau tersier (3o), bergantung apakah satu, dua, atau tiga gugus organik yang berhubungan dengan atom karbon pembawa hidroksil.
Metil alkohol, yang tidak secara ketat disebut dalam penggolongan ini, biasanya
dikelompokkan sebagai alkohol primer. Penggolongan ini serupa dengan penggolongan pada karbokation. Akan kita lihat bagaimana sifat kimiawi alkohol kadang-kadang bergantung pada golongannya (Hart, dkk., 2003).
Fenol merupakan senyawa yang memiliki gugus hidroksil terikat langsung ke benzen atau cincin benzenoid. Induk senyawa kelompok ini, C6H5OH, disebut fenol,
merupakan bahan kimia industri yang penting. Banyak sifat fenol yang serupa dengan alkohol, tapi kesamaan ini adalah sesuatu penyederhanaan yang berlebihan.
aromatik berinteraksi kuat, mempengaruhi reaktivitas masing-masing. Interaksi ini menyebabkan beberapa sifat dan kegunaan baru dari fenol. Sebuah langkah penting dalam sintesis aspirin, misalnya, tanpa paralel dalam reaksi baik alkohol atau
arena (Carey, 2000).
Seperti halnya air, alkohol dan fenol merupakan asam lemah. Gugus hidroksil dapat bertindak sebagai pendonor proton, dan disosiasi terjadi mirip seperti pada air:
Basa konjugat suatu alkohol ialah ion alkoksida (contohnya, ion metoksida dari metanol, ion etoksida dari etanol dan seterusnya) (Hart, dkk., 2003).
Metanol dan etanol memiliki keasaman yang hamper sama dengan air; alkohol meruah seperti t-butil alkohol sedikit lebih lemah karena keruahannya membuatnya sukar disolvasi, tidak seperti ion alkoksidanya (Hart, dkk., 2003).
Fenol ialah asam yang lebih kuat daripada alkohol terutama karena ion fenoksidanya distabilkan oleh resonansi. Muatan negatif pada ion alkoksida terkonsentrasi pada atom oksigen, tetapi muatan negatif pada ion fenoksida dapat didelokalisasi pada posisi cincin orto dan para melalui resonansi (Hart, dkk., 2003).
Muatan negatif dalam ion fenoksida distabilkan baik oleh solvasi dan dengan elektron delokalisasi ke dalam cincin.
Delokalisasi elektron dalam fenoksida diwakili oleh resonansi antara struktur:
Muatan negatif dalam ion fenoksida dibagi oleh oksigen dan karbon yang orto dan para untuk itu. Delokalisasi muatan negatif kuat menstabilkan ion fenoksida (Carey, 2000).
Alkoksida, yaitu basa konjugat dari alkohol, merupakan basa kuat seperti halnya ion hidroksida. Alkoksida ialah senyawa ionik yang sering digunakan sebagai basa kuat dalam kimia orgaik. Ion ini dapat dibuat melalui reaksi alkohol dengan logam natrium atau kalium atau dengan hidrida logam. Reaksi ini berlangsung tak reversible (tidak dapat balik), menghasilkan alkoksida logam yang sering kali dapat diisolasi berupa padatan putih (Hart, dkk., 2003).
Gugus fungsi alkohol (dan fenol) tidak saja berfungsi sebagai asam lemah melainkan juga sebagai basa lemah. Golongan tersebut memiliki pasangan elektron bebas pada oksigen dan dengan demikian merupakan basa lewis. Golongan ini dapat diprotonasi oleh asam kuat. Produknya, analog dengan ion oksonium, H3O+, yaitu ion alkiloksonium (Hart, dkk., 2003).
Berbagai kondisi reaksi basa dan asam termasuk penggunaan asam Lewis telah diaplikasikan pada reaksi antara gliserol dan o-metoksi fenol sebagai upaya dalam pemanfaatan gliserol dari hasil samping produksi biodiesel berbahan dasar minyak jelantah. Reaksi ini nantinya akan digunakan pada pembuatan obat batuk gliseril guaiakolat. Kondisi reaksi yang dilakukan belum menghasilkan suatu reaksi yang berjalan secara optimal sehingga masih diperlukan penelitian berikutnya (Ritmaleni, 2013).
BAB III METODOLOGI PERCOBAAN
3.1 Bahan Percobaan
Bahan-bahan yang digunakan dalam percobaan alkohol dan fenol yaitu metanol, etanol, 1-propanol, 2-propanol, amil alkohol, 1-butanol, 2-butanol, 2-metil-2-propanol, fenol, akuades, n-heksana, pereaksi lukas, Na2CO3, NaHCO3, FeCl3, dan tissue roll.
3.2 Alat Percobaan
Alat-alat yang digunakan dalam percobaan alkohol dan fenol yaitu tabung reaksi, rak tabung reaksi, pipet tetes, dan sikat tabung.
3.3 Prosedur Percobaan
3.3.1 Kelarutan dalam air dan n-heksana
Sebanyak dua buah tabung reaksi disediakan, masing-masing diisi dengan 0,5 mL air dan 0,5 mL n-heksana. 10 tetes metanol ditambahkan kemudian dikocok dan diperhatikan kelarutannya dan dicatat hasilnya. Prosedur di atas dilakukan kembali dengan metanol diganti dengan alkohol lainnya (etanol, 1-propanol, 2-propanol, amil alkohol, 1-butanol, 2-butanol, 2-metil-2-propanol) dan fenol.
dibiarkan selama 3–5 menit (pada tempratur kamar). Perubahan yang terjadi diperhatikan dan dicatat.
3.3.3 Reaksi dengan Na2CO3 dan NaHCO3
Empat buah tabung reaksi disediakan, tabung pertama diisi dengan 1 mL butil alkohol, tabung kedua diisi dengan 1 mL isopropil alkohol, tabung reaksi ketiga diisi dengan 1 mL fenol, dan tabung reaksi keempat diisi dengan 1 mL asam asetat. Masing-masing tabung reaksi ditambahkan 0,5 mL Na2CO3. Tabung reaksi dikocok dan dibiarkan selama 3–5 menit (pada tempratur kamar). Perubahan yang terjadi diperhatikan dan dicatat. Prosedur di atas dilakukan kembali dengan Na2CO3 diganti dengan NaHCO3.
3.3.4 Reaksi dengan FeCl3
BAB IV HASIL DAN PEMBAHASAN
4.1 Hasil pengamatan kelarutan dalam air dan n-heksana
A. Tabel 1. Kelarutan dalam air dan n-heksana
Alkohol/ Fenol Kelarutan dalam Air Kelarutan dalam n-heksana Keterangan Air n-heksana
Warna Kepolaran Warna Kepolaran
Metanol √ ×
Tidak berwarna → tidak berwarna Polar Tidak berwarna →
putih keruh Polar
Etanol √ ×
Tidak berwarna →
tidak berwarna
Polar berwarna →Tidak putih keruh
Polar
1-propanol √ √
Tidak berwarna → tidak berwarna Semi polar Tidak berwarna → tidak berwarna Semi polar
2-propanol √ √
Tidak berwarna → tidak berwarna Semi polar Tidak berwarna → tidak berwarna Semi polar Amyl
alkohol √ √
Tidak berwarna → tidak berwarna Semi polar Tidak berwarna → tidak berwarna Semi polar
1-butanol × √
Tidak berwarna → tidak berwarna Nonpolar Tidak berwarna → tidak berwarna Nonpolar
2-butanol × √
Tidak berwarna → tidak berwarna Nonpolar Tidak berwarna → tidak berwarna Nonpolar
2-metil-2-propanol √ ×
Tidak berwarna →
tidak berwarna
Polar berwarna →Tidak putih keruh
Polar
-B. Reaksi
H3C OH
OH OH H O H + H O H + H O H +
H3C O
C. Pembahasan
Pada percobaan ini, alkohol dan fenol diuji kepolarannya dengan menggunakan air dan n-heksana. Air (H2O) merupakan senyawa polar dan n-heksana (CH3CH2CH2CH2CH2CH3) merupakan senyawa nonpolar. Jadi, jika zat uji larut dalam air dan tidak larut pada n-heksana maka zat itu polar, jika jika zat uji tidak larut dalam air dan larut pada n-heksana maka zat itu nonpolar, dan jika larut dalam air dan n-heksana maka zat itu semipolar.
Dari hasil pengamatan dapat dilihat bahwa kepolaran alkohol berkurang secara bertahap sesuai bertambahnya gugus karbonil dan dapat bersifat semi polar bahkan bersifat nonpolar. Adanya gugus OH dalam air, membuat alkohol memiliki polaritas yang hampir sama dengan polaritas air, sehingga alkohol dapat larut dalam air. Namun, kepolaran yang dimiliki oleh alkohol tidak akan sebanding dengan polaritas air. Hal ini dipengaruhi oleh kehadiran gugus alkil pada molekulnya. Gugus alkil merupakan gugus nonpolar, semakin panjang alkil yang dimiliki oleh suatu senyawa maka akan semakin besar juga sifat nonpolarnya. Oleh karena itu, senyawa alkohol yang berantai pendek atau memiliki atom C 1-5 akan larut dalam beberapa pelarut polar seperti air. Sedangkan, untuk senyawa alkohol yang berantai panjang atau memiliki atom C ≥ 6 akan sukar larut dalam pelarut polar, tapi larut dalam pelarut nonpolar seperti n-heksana dan pelarut organik lainnya.
1-propanol, 2-propanol, dan amil alkohol (n-pentanol) dapat larut dalam air maupun n-heksana. Hal ini berarti ketiga senyawa tersebut merupaka senyawa semi polar. Berdasarkan teori atau data pustaka 1-propanol dan 2-propanol merupakan senyawa polar dimana keduanya bercampur sempurna dengan air. Kesalahan terjadi dimungkinkan karena adanya human error, ataupun pada zat yang digunakan. Hasil percobaan yang menyatakan bahwa amil alkohol merupakan senyawa semi polar sudah sesuai dengan teori dan data pustaka dimana kelarutan amil alkohol adalah 27 g/L (pada suhu 20 °C). Hal ini dikarenakan amil alkohol (n-pentanol) memiliki gugus alkil berantai sedang, sehingga keelektronegatifan sedikit berubah akibat pengaruh ketidakpolaran yang dimiliki gugus alkil, sehingga gugus hidroksil (-OH) dan gugus alkil (R) pada zat tersebut mengambil bagian yang hampir sama besar dalam molekulnya yang menyebabkannya bersifat semi polar.
1-butanol dan 2-butanol tidak larut dalam air namun larut dalam n-heksana, yang berarti kedua zat ini bersifat nonpolar. Hal ini tidak sesuai dengan teori yang menyatakan bahwa senyawa alkohol yang berantai pendek atau memiliki atom C 1-5 akan mempunyai sifat menyerupai air yang berarti dapat larut dalam beberapa pelarut polar seperti air. 1-butanol dan 2-butanol merupakan alkohol 1o dan 2o yang memiliki 4 atom C yang seharusnya bersifat nonpolar, namun dalam percobaaan ini kedua senyawa tersebut tidak larut dalam air, hal ini mungkin dikarenakan perbandingan air dan alkohol yang tidak sesuai dimana kelarutan 1-butanol dalam air adalah 79 g/L
Dari percobaan yang dilakukan didapatkan bahwa senyawa fenol tidak larut dalam air dan n-heksana. Hal ini tidak sesuai dengan teori yang menyatakan bahwa fenol memiliki sifat yang cenderung asam yang berarti fenol merupakan senyawa polar. Jadi berdasarkan teori fenol seharusnya larut dalam air. Pada percobaan didapatkan fenol tidak larut dalam air kemungkinan karena air yang ditamambahkan terlalu banyak sehingga kelihatannya fenol tidak larut. Fenol memiliki kelarutan terbatas dalam air, dimana kelarutan fenol dalam air sebanyak 8.3 g/100 mL (pada suhu 20 °C). Dapat ditarik kesimpulan bahwa fenol larut dalam air namun dalam jumlah yang terbatas.
4.2 Hasil pengamatan alkohol primer, sekunder, tersier, dan fenol dengan pereaksi lukas
A. Tabel 2. Membedakan Alkohol primer, sekunder, tersier, dan fenol dengan pereaksi lukas
Alkohol/ Fenol Pereaksi Lukas
Keterangan
Laju
Reaksi Fasa Warna
1-butanol + Lama Atas: 1-butanolBawah: air
Atas: tidak berwarna Bawah: tidak
berwarna
2-butanol ++ Sedang 1 Tidak berwarna
2-metil-2-propanol +++ Cepat 1 Tidak berwarna
Fenol —
-Atas: fenol Bawah: pereaksi lukas
Atas: Oranye Bawah: tidak
OH
OH
OH
OH
+ +
+
+ H Cl
H Cl
H Cl
H Cl
ZnCl2
ZnCl2 ZnCl2
ZnCl2
Cl
Cl
Cl
+
+
+
H O
H
H O
H H
O H
C. Pembahasan
Percobaan ini bertujuan untuk membedakan alkohol primer, sekunder, dan tersier dengan menggunakan pereaksi lukas serta mereaksikan fenol dengan pereaksi lukas sebagai pembanding. Pereaksi lukas terdiri atas campuran larutan ZnCl2 ditambah dengan HCl pekat. Reaksi antara alkohol dengan hidrogen klorida akan menghasilkan suatu alkil halida. Cara menandai cepat atau lambatnya bereaksi yaitu dengan terjadinya larutan yang keruh saat bercampur dan cepat kembalinya keadaan larutan seperti semula saat sebelum dicampurkan.
gugus hidroksil untuk berlangsungnya reaksi subtitusi karena ketidakstabilan atom karbon yang berikatan langsung dengan gugus hidroksil dapat diminimalisir oleh atom karbon lain yang berada disekelilingnya. Pada pernyataan ini, alkohol tersier lebih banyak memiliki atom karbon yang menyebabkan kurangnya kestabilan atom karbon yang berikatan langsung dengan gugus hidroksil. Selanjutnya, alkohol sekunder dan disusul alkohol primer. Selain itu, kecepatan dan mekanisme reaksi alkohol dengan hidrogen klorida bergantung pada struktur alkohol tersebut. Semakin banyak atom yang dapat membantu menstabilkan karbokation (keadaan stabil pada karbokation mempercepat laju reaksi). Sehingga alkohol tersier yang memiliki banyak gugus alkil lebih cepat bereaksi dibandingkan dengan alkohol sekunder dan alkohol primer. Sehingga urutan kereaktifan alkohol dengan pereaksi Lukas yaitu alkohol tersier > alkohol sekunder > alkohol primer.
Adapun Fenol saat dimasukkan dalam pereaksi Lukas, tidak menghasilkan reaksi sedikitpun. Hal ini disebabkan karena gugus hidroksil pada fenol sukar diputuskan akibat adanya delokalisasi elektron dari ikatan rangkap ke ikatan sebelahnya, resonansi terjadi pada gugus aromatik (aril) yang terkonjugasi sempurna, yaitu yang memiliki ikatan tunggal dan rangkap dua secara selang-seling. Sehingga fenol hanya mampu melepaskan atom hidrogen pada gugus hidroksil bukan OH−. Hal ini juga yang menyebabkan fenol lebih asam daripada alkohol.
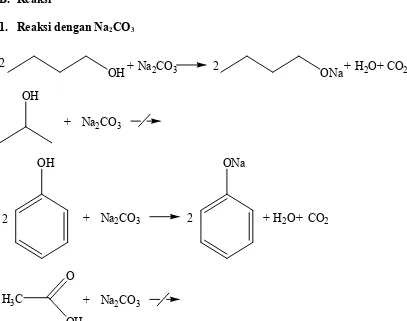
4.3 Reaksi dengan Na2CO3 dan NaHCO3
A. Tabel 3. Hasil pengamatan reaksi alkohol dan fenol dengan Na2CO3 dan Na2HCO3
Zat Na2CO3 Na2HCO3
Keterangan
Na2CO3 NaHCO3
Warna Sifat Warna Sifat
Butil alkohol Sedikit gelembung Sedikit gelembung Tidak berwarna → kuning Asam Tidak berwarna → tidak berwarna Asam Isopropil alkohol Tidak ada gelembung Tidak ada gelembung Tidak berwarna → tidak berwarna Basa Tidak berwarna → tidak berwarna Basa
Fenol gelembungBanyak gelembungBanyak Oranye →Krem Asam Oranye →Krem Asam
Asam asetat Tidak ada gelembung Tidak ada gelembung Tidak berwarna → tidak berwarna Basa Tidak berwarna → tidak berwarna Basa B. Reaksi
1. Reaksi dengan Na2CO3
OH OH
Na2CO3 +
Na2CO3 +
ONa+ H2O+CO2
2 2
OH
H3C
O
OH
Na2CO3 +
Na2CO3 +
ONa
H2O
+ + CO2
2 2
OH OH
NaHCO3 +
NaHCO3 +
ONa+ H2O+CO2
OH
H3C
O
OH
NaHCO3 +
NaHCO3 +
ONa
H2O
+ + CO2
C. Pembahasan
Percobaan ini dilakukan untuk mengetahui keasaman dari suatu zat dengan mereaksikannya dengan basa kuat yakni Na2CO3 dan NaHCO3. Jika zat uji bersifat asam maka zat itu dapat bereaksi dengan kedua basa tersebut dan sebaliknya jika bersifat basa maka zat itu tidak dapat bereaksi dengan kedua basa tersebut.
akan sulit terlepas. Jadi berdasarka teori isopropil alkohol memiliki rantai karbon yang pendek sehingga daya dorong elektron tidak terlalu besar sehingga ion H+ tidak terikat kuat dengan ion alkoksida sehingga ion H+ masih bisa terlepas. Asam asetat yang merupakan suatu asam lemah namun lebih tinggi dibanding alkohol dan fenol, seharusnya dapat bereaksi dengan Na2CO3 dan NaHCO3 membentuk natrium alkoksida, air, dan gelembung gas CO2. Kekeliruan ini mungkin disebabkan oleh konsentrasi isopropil alkohol dan asam asetat yang digunakan sangat kecil ataupun kedua zat tersebut sudah tidak bagus digunakan.
Pada percobaan ini, didapatkan bahwa butil alkohol dan fenol dapat bereaksi dengan Na2CO3 dan NaHCO3 yang ditandai dengan adanya gelembung gas (CO2). Karena bahwa kedua zat ini dapat bereaksi dengan basa (Na2CO3 dan NaHCO3) maka kedunya bersifat asam. Hal ini sesuai dengan teori dimana butil alkohol merupakan asam lemah dan jika direaksikan dengan basa maka akan menghasilkan garam alkoksida dan air. Seperti halnya butil alkohol fenol juga merupakan asam lemah yang lebih kuat dibanding alkohol dan jika direaksikan dengan basa maka akan menghasilkan garam fenoksida dan air. Fenol ialah asam yang lebih kuat daripada alkohol terutama karena ion fenoksidanya distabilkan oleh resonansi. Muatan negatif pada ion alkoksida terkonsentrasi pada atom oksigen, tetapi muatan negatif pada ion fenoksida dapat didelokalisasi pada posisi cincin orto dan para melalui resonansi.
4.4 Hasil pengamatan alkohol dan fenol dengan FeCl3
A. Tabel 4. Reaksi Alkohol dan Fenol dengan FeCl3
Warna Fasa
Metanol Tidak bereaksi Kuning 2
Etanol Tidak bereaksi Kuning 2
2-butanol Tidak bereaksi Kuning keruh 2 Fenol Bereaksi Merah kecoklatan 1
B. Reaksi
H3C OH
OH
OH
OH FeCl3
+
FeCl3 +
FeCl3 +
FeCl3 +
OFeCl2
HCl +
C. Pembahasan
Tes Ferri Klorida digunakan untuk membedakan alkohol alifatik (rantai
terbuka) dengan alkohol aromatik. FeCl3 digunakan untuk membedakan antara senyawa alkohol dan fenol, karena FeCl3 mempunyai kemampuan untuk beraksi dengan fenol (alkohol alifatik) dan tidak beraksi dengan alkohol alifatik. Adanya reaksi ditandai dengan melihat perubahan warna sesaat setelah dicampurkan. Jika bereaksi larutan akan berubah warna menjadi merah sampai ungu kehitaman.
bereaksi dengan FeCl3. Hal ini sesuai dengan teori, bahwa alkohol tidak dapat bereaksi dengan FeCl3. Warna kekuning-kuningan berasal dari larutan FeCl3 bukan hasil reaksi.
Sedangkan pada fenol ketika dicampukan dengan FeCl3 larutan menjadi merah kecoklatan. Hal ini menunjukkan bahwa telah terbentuk senyawa kompleks
dari Fe3+ dengan fenol. Fenol merupakan senyawa yang mengandung gugus hidroksil yang terikat pada karbon tak jenuh, sehingga dapat bereaksi dengan FeCl3 menghasilkan senyawa kompleks berwarna merah kecoklatan.
BAB V
5.1 Kesimpulan
Adapun kesimpulan dari percobaan ini adalah sebagai berikut:
1. Fenol bersifat polar sementara pada alkohol semakin panjang gugus alkil alkohol semakin rendah kepolarannya.
2. Kecepatan reaksi pada alkohol primer, sekunder, dan tersier dengan pereaksi lukas adalah tersier > sekunder > primer.
3. Fenol merupakan asam lemah namun lebih kuat dibanding alkohol.
5.2 Saran
5.2.1 Saran untuk Percobaan
Sebaiknya percobaan yang dilakukan lebih banyak agar praktikan dapat lebih memahami materi yang diujicobakan.
5.2.2 Saran untuk Laboratorium
Sebaiknya kondisi kelayakan alat dan bahan untuk praktikum seperti wastafel yang tersumbat dan bocor dan pipet tetes yang pecah dan karetnya rusak diperhatikan dan ditangani agar percobaan yang dilaksanakan dapat berjalan dengan lancar.
DAFTAR PUSTAKA
Hart, H., L.E.,Craine, dan D.J., Hart, 2003, Kimia Organik Suatu Kuliah Singkat edisi kesebelas, Erlangga, Jakarta.
Pẚca, J., E. Komẚrkov, A. Prell, M. Stiborovẚ, dan M. Sobotka, 2002, Kinetics of Phenol Oxidation by Candida tropicalis: Effects of Oxygen Supply Rate and Nutrients on Phenol Inhibition, Folia Microbiol, online, (http ://www. biomed, cas. cz/mbu/folia/), 47(6): 701-707.
Riswiyanto, 2009, Kimia Organik, Erlangga, Jakarta.