LAPORAN PRAKTIKUM
KIMIA DASAR II
Oleh:
Indrawan Nurhadi (A1M012054)
KEMENTERIAN PENDIDIKAN DAN KEBUDAYAAN UNIVERSITAS JENDERAL SOEDIRMAN
FAKULTAS PERTANIAN
JURUSAN TEKNOLOGI PERTANIAN
PROGRAM STUDI ILMU DAN TEKNOLOGI PANGAN PURWOKERTO
LAPORAN KIMIA DASAR II
Acara I
UJI SIFAT ASAM DAN BASA SENYAWA ORGANIK
Oleh:
Indrawan Nurhadi (A1M012054)
KEMENTERIAN PENDIDIKAN DAN KEBUDAYAAN UNIVERSITAS JENDERAL SOEDIRMAN
FAKULTAS PERTANIAN
JURUSAN TEKNOLOGI PERTANIAN
PROGRAM STUDI ILMU DAN TEKNOLOGI PANGAN PURWOKERTO
2013
A. LatarBelakang
Asam (yang sering diwakili dengan rumus umum HA) secara umum merupakan senyawa kimia yang biladilarutkandalam air akan menghasilkan larutan dengan pH lebih kecil dari 7. Dalam definisi modern, asam adalah suatu zat yang dapat memberi proton (ion H+) kepada zat lain (yang disebutbasa), atau dapat menerima pasangan elektron bebas dari suatu basa. Suatu asam bereaksi dengan suatu basa dalam reaksi penetralan untuk membentuk garam. Contoh asam adalah asam asetat (ditemukan dalam cuka) dan asam sulfat (digunakan dalam baterai atau aki mobil).
Secara sederhana asam dapat didefinisikan sebagai zat yang bila dilarutkan dalam air akan mengalami disosiasi (penguraian) dengan pembentukan ion hydrogen sebagai satu-satunya ion positif. Sedangkan basa merupakan zat yang apabila dilarutkan dalam air akan mengalami disosiasi dengan pembentukan ion-ion hidroksil sebagai satu-satunya ion-ion negatif.
Menurut J.N Bronsted dan T.M Lowry pada tahun 1923 mendefinisikan asam sebagai setiap zat sembarang (baik dalam bentuk molekul ataupun ion) yang menyumbang proton H+ (donor proton) danbasasebagaisetiapzatsembarang (molekulatau ion) yang menerima proton (akseptor proton) (vogel,1982)
Pengujian sifat asam dan basa senyawa anorganik dapat menggunakan kertas lakmus. Jika lakmus biru oleh zat berubah merah maka zat bersifat asam sebaliknya jika lakmus merah oleh zat berubah biru maka zat bersifat basa. Sedangkan untuk mengukur tingkat keasaman dengan menggunakan pH paper universal dan pH meter.
Praktikum ini bertujuan untuk menguji sifat asam dan basa beberapa senyawa anorganik dengan menggunakan kertas lakmus serta mengukur pH dengan pH paper universal atau pH meter.
B. Tujuan
Menguji sifat asam dan basa beberapa senyawa anorganik dengan menggunakan kertas lakmus serta mengukur pH dengan pH paper universal atau pH meter.
II. TINJAUAN PUSTAKA
Terdapat tiga definisi asam yang umum diterima dalam kimia, yaitu definisi Arrhenius, Bronsted-lowry, dan Lewis.
Arhenius : Menurut definisiini, asam adalah suatu zat yang meningkatkan konsentrasi ion hidronium (H3O+) ketika dilarutkan dalam air. Deinisi yang pertama dikemukakan oleh Svante Arrhenius ini membatasi asam dan basa untuk zat-zat yang dapat larut dalam air.
Bronsted-lowry :Menurut definisi ini, asam adalah pemberi proton kepada basa, Asam dan basa bersangkutan disebut sebagai pasangan asam-basa konjugat. Bronsted dan lowr y secara terpisah mengemukakan definisi ini, yang mencakup zat-zat yang tidak larut dalam air (tidak seperti pada definisi Arhenius).
Lewis :Menurut definisi ini, asam adalah penerima pasangan elektron dari basa. Definisi yang dikemukakan oleh Gilbert N. Lewis ini dapat mencakup asam yang tidak mengandung hydrogen atau proton yang dapat dipindahkan, seperti besi (III) klorida. Definisi Lewis dapat pula dijelaskan dengan teori orbital molekul. Secara umum, suatu asam dapat menerima pasangan electron pada orbital kosongnya yang paling rendah (LUMO) dari orbital terisi yang tertinggi (HOMO) dari suatu basa. Jadi, HOMO dari basa dan LUMO dari asam bergabung orbital molekul ikatan. (Anonim,Diakses 24 Juni 2010)
Asam berkaitan dengan salah satu tanggapan indra pengecap kita terhadap suatu rasa masam. Kata asam berasal dari bahasa Latin, yaitu acidus yang berarti masam. Secara kimia, kita dapat mendefinisikan asam sebagai senyawa yang menghasilkan ion hidrogen ketika larut dalam pelarut (biasanya air). Senyawa asam banyak kita temukan dalam kehidupan sehari – hari, seperti pada makanan dan minuman. Selain itu, senyawa asam dapat pula kita temukan di dalam lambung. Di dalam lambung terdapat asam klorida yang berfungsi membunuh kuman.
Untuk mengetahui suatu zat bersifat asam atau tidak, dapat dilihat dari sifat yang dimiliki oleh asam tersebut. Berikut ini akan beberapa hal mengenai sifat asam, antara lain :
Rasa Asam
Cuka merupakan salah satu asam yang kita kenal dalam kehidupan sehari-hari. Nama cuka dalam ilmu kimia adalah asam asetat (asam etanoat).
Mengubah Warna Indikator
Selain rasa asam yang kecut, sifat asam yang lain dapat mengubah warna beberapa zat alami ataupun buatan. Sifat inilah yang selanjutnya akan digunakan untuk mengidentifikasikan sifat asam dari beberapa senyawa asam. Dengan menggunakan indikator. Indikator yang sering digunakan adalah kertas lakmus biru menjadi merah, sedangkan kertas lakmus merah akan tetap berwarna merah.
Menghantarkan Arus Listrik
Asam dapat menghantarkan arus listrik. Hal itu dikarenakan asam dapat melepaskan ion–ion dalam larutannya yang mampu menghantarkan arus listrik. Asam kuat merupakan elektrolit yang baik. Semakin kuat suatu asam, akan semakin baik pula daya hantar listriknya. (memiliki sifat elektrolit yang baik). Contohnya adalah asam sulfat yang terdapat pada aki mobil.
Bereaksi dengan Logam Menghasilkan Gas Hidrogen
Asam bereaksi dengan beberapa jenis logam menghasilkan gas hidrogen. Logam magnesium, besi, tembaga dan seng merupakan contoh logam yang dapat bereaksi dengan asam sehingga menghasilkan gas hydrogen dan senyawa garam.
Reaksi :
Bila kita mereaksikan dua asam yang berbeda pada logam yang sama, maka kita akan memperoleh hasil yang berbeda. Hal itu disebabkan perbedaan kekuatan asam yang kita gunakan.
2. Kekuatan Asam
Berdasarkan sifat kuat lemahnya asam, kita mengenal adanya asam kuat dan asam lemah. Kuat lemahnya suatu asam ditentukan oleh jumlah ion hidrogen yang terionisasi dalam larutan. Asam kuat adalah asam yang banyak menghasilkan air dalam larutannya (asam yang terionisasi sempurna dalam larutannya), sedangkan asam lemah adalah asam yang sedikit menghasilkan ion dalam larutannya (terionisasi sebagian dalam larutan). Konsentrasi larutan berkaitan dengan banyaknya zat yang terlarut dalam suatu volume pelarut tertentu. Semakin banyak zat yang terlarut, konsentrasi larutan tersebut semakin tinggi (semakin pekat). Pada larutan encer terdapat sejumlah kecil zat terlarut dalam pelarutnya. Untuk menyatakan konsentrasi larutan lazim digunakan istilah molar (M).
3. Peranan Asam dalam Kehidupan
dalam sejumlah besar volume air, maka kita katakana bahwa konsentrasi asam tersebut rendah atau disebut juga sebagai asam encer. Konsentrasi suatu asam meningkat seiring dengan semakin berkurangnya jumlah air yang melarutkannya.
Secara kimia, kita dapat mengidentifikasikan basa sebagai senyawa yang menghasilkan ion hidroksida (OH-) ketika larut dalam pelarut air. Perhatikanlah bahwa rumus senyawa basa selalu memiliki gugus OH (kecuali untuk ammonium hidroksida). Adanya gugus OH inilah yang menyebabkan senyawa basa memiliki sifat – sifat khas sebagai suatu basa.
1. Sifat Basa
Basa memiliki beberapa sifat yang dapat kita gunakan untuk pengidentifikasian. Beberapa sifat basa akan dipelajari berikut ini.
Pahit dan Terasa Licin di Kulit
Rasa licin pada sabun disebabkan oleh basa yang terdapat pada sabun tersebut. Basa pembuat sabun adalah natrium hidroksida. Selain terasa licin, basa pun memiliki rasa yang pahit. Akan tetapi, kamu tidak dianjurkan untuk memeriksa apakah suatu zat itu suatu basa atau tidak dengan cara menyentuh atau mencicipinya. Hal itu karena basa kuat bersifat korosif yang dapat menyebabkan tanganmu teriritasi dan terbakar.
Mengubah Warna Indikator
Seperti halnya asam, larutan basa pun akan bereaksi dengan indikator sehingga dapat mengubah warna indikator tersebut. Basa akan mengubah warna kertas lakmus merah menjadi biru, sedangkan lakmus biru akan tetap berwarna biru.
Menghantarkan Arus Listrik
Menetralkan Sifat Asam
Salah satu sifat basa adalah meniadakan atau menghilangkan sifat suatu asam yang direaksikan dengan basa tersebut. Asam yang kita miliki akan berkurang sifat keasamannya, bahkan dapat berubah menjadi tidak asam. Apabila basa direaksikan dengan asam, maka akan membentuk garam dan air. Reaksi itu disebut dengan reaksi penetralan (netralisasi). Sebagai contohnya adalah kalsium hidroksida direaksikan dengan asam sulfat akan membentuk kalsium sulfat dan air.
Reaksi :
Kalsium Hidroksida + Asam Sulfat Kalsium Sulfat + Air Ca(OH)2 (aq) + H2SO4 (aq) CaSO4 (aq) + 2H2O (l)
Kapur merupakan salah satu contoh dari basa yang dapat mengurangi tingkat keasaman tanah. Tablet obat sakit mag terbuat dari basa magnesium hidroksida, karena konsentrasi asam lambung yang terlalu tinggi dapat dikurangi dengan memakan obat sakit mag. Jadi, pada dasarnya konsentrasi asam pada suatu zat dapat kita kurangi dengan cara menambahkan suatu basa ke dalamnya.
Basa merupakan istilah kimia yang digunakan untuk semua zat yangdapat menetralkan asam. Selain karena kemampuan basa yang dapat menetralkan asam, basa pun memiliki kemampuan untuk melarutkan minyak dan debu, sehingga basa digunakan untuk berbagai keperluan. Sebagai contoh, pembersih alat dapur yang ada di pasaran mengandung natrium hidroksida yang berfungsi membersihkan noda minyak atau mentega. Pembersih lantai mengandung ammonia yang dapat membersihkan debu.
2. Kekuatan Basa
jangan menyentuh basa (murni ataupun larutannya) sembarangan. Contoh senyawa yang tergolong basa kuat adalah natrium hidroksida (NaOH), kalium hidroksida (KOH), dan kalsium hidroksida (Ca(OH)2), sedangkan ammonia (NH3) tergolong sebagai basa lemah.
Kaustik merupakan istilah yang digunakan untuk basa kuat. Jadi, kita menggunakan nama kaustik soda untuk natrium hidroksida (NaOH) dankalium hidroksida (KOH).
3. Peranan Basa dalam Kehidupan
Basa dapat dengan mudah kita temukan, baik itu di rumah maupun di industri. Ketika kita membuat rumah, kita menggunakan semen. Semen dibuat dari basa kalsium hidroksida. Basa pun dapat kita temukan pada aneka bahan pembersih dan ketika membuat kue. Pada saat membuat kue, kita sering menambahkan baking soda agar kue yang kita buat mengembang. Baking soda merupakan suatu basa.
III. METODE PRAKTIKUM
A. BahandanAlat 1. Alat :
a. Tabun greaksi
b. pH paper universal / pH meter c. Kertas Lakmus
a. Alkohol b. Asam Asetat c. Asam Sitrat d. Glukosa e. Fruktosa B. Cara Kerja
Diambil sejumlah tabung reaksi dan cawan petri
Masing – Masing diisi dengan 1 ml larutan alcohol, asam asetat, asam benzoate, etil asetat, glukosa, fruktosa, fenol, aniline
Masing – masing larutan diisi dengan kertaslakmus dan diukur pHnya dengan pH paper universal atau pH meter
Dicatat hasilnya
IV. HASIL DAN PEMBAHASAN A. Hasil Pengamatan
N
o Bahan pH Keterangan
Foto
1
2
Asam asetat 2 Asam
3
Asam sitrat 1 Asam
4
Glukosa 3 Asam
5
Fruktosa 4 Asam
Alkohol mempunyai gugus fungsi R – OH. Alkohol mudah larut dalam air karena dapat membentuk ikatan hidrogen. Alkohol dapat bersifat asam. Semakin panjang ikatan karbon maka akan semakin besar pHnya.
Sudah jelas sekali bahwa Alkohol adalah basa, karena perbedaan keelektronegatifan antara Oksigen dan Hidrogen pada gugus hidroksil, yang memampukan Hidrogen lepas dengan mudah. Bila di dekat Karbon Hidroksi terdapat gugus penarik elektron seperti fenil atau halogen, maka keasaman meningkat. Sebaliknya, semakin banyak gugus pendorong elektron seperti rantai alkana, keasaman menurun. Di sebutkan di atas bahwa Alkohol merupakan asam dengan hasil praktikum di sebutkan alkohol mempunyai Ph 11.
Asam asetat
Asam asetat adalah senyawa kimia asam organik yang dikenal sebagai pemberi rasa asam dan aroma dalam makanan. Asam asetat murni (disebut asam asetat glasial) adalah cairan higroskopis tak berwarna, dan memiliki titik beku 16.7°C.
Asam Sitrat
Asam sitrat merupakan asam organik lemah yang ditemukan pada daun dan buah tumbuhan genus Citrus (jeruk-jerukan). Senyawa ini merupakan bahan pengawet yang baik dan alami, selain digunakan sebagai penambah rasa masam pada makanan dan minuman ringan. Dalam biokimia, asam sitrat dikenal sebagai senyawa antara dalam siklus asam sitrat yang terjadi di dalammitokondria, yang penting dalam metabolisme makhluk hidup. Zat ini juga dapat digunakan sebagai zat pembersih yang ramah lingkungan dan sebagai antioksidan.
Asam sitrat terdapat pada berbagai jenis buah dan sayuran, namun ditemukan pada konsentrasi tinggi, yang dapat mencapai 8% bobot kering, pada jeruk lemon dan limau (misalnya jeruk nipis danjeruk purut). Struktur asam ini tercermin pada nama IUPAC-nya, asam 2-hidroksi-1,2,3-propanatri karboksilat. Praktikan mendapatkan hasil pengamatan dari percobaan menggunakan sampel asalm sitrat memiliki pH 1 aldosa berkabon enam. Dalam cincin ini, tiap karbon terikat pada gugus samping hidroksil dan hidrogen kecuali atom kelimanya, yang terikat pada atom karbon keenam di luar cincin, membentuk suatu gugus CH2OH. Struktur cincin ini berada dalam kesetimbangan dengan bentuk yang lebih reaktif, yang proporsinya 0.0026% pada pH 7. Trayek pH antara 5-7 (Petrucci, 1987), sedangkan hasil praktikumnya sendiri di peroleh pH 3.
Fruktosa
merupakan salah satu dari tiga gula darah penting bersama dengan glukosa dan galaktosa. Dengan di peroleh hasil praktikum fruktosa asam dengan pH 4.
V. KESIMPULAN DAN SARAN .
A. Kesimpulan
B. Saran
Praktikan harus memperhatikan alat-alat yang dibersihkan setelah pakai karena jika tidak bersih sekali akan membuat ketidakakuratan hasil percobaan, dan sebaiknya jumlah peralatan diperbanyak sehingga membuat praktikum lebih cepat selesai
DAFTAR PUSTAKA
Darjanto dkk.1989.Ilmu Kimia Organik. UniversitasJenderalSoedirman, Purwokerto.
Fessenden Rale dan Joan S. Fessenden. 1982. Kimia Organik dan Hayati. ITB, Bandung.
Petrucci, Ralph H. 1987. Kimia Dasar. Erlangga, Bandung.
Vogel. 1982. Analisa Anorganik Kualitatif. PT. Kalman Media Pusaka, Jakarta. Wilbraham, Antony dan Michael S.Matta. 1992. Pengantar Kimia Organik dan
LAPORAN KIMIA DASAR II
Acara II
Oleh:
Indrawan Nurhadi (A1M012054)
KEMENTERIAN PENDIDIKAN DAN KEBUDAYAAN UNIVERSITAS JENDERAL SOEDIRMAN
FAKULTAS PERTANIAN
JURUSAN TEKNOLOGI PERTANIAN
PROGRAM STUDI ILMU DAN TEKNOLOGI PANGAN PURWOKERTO
2013
I. PENDAHULUAN
A. Latar belakang
Hidrokarbon merupakan persenyawaan organik yang paling sederhana yang hanya terdiri dari atom karbon dan atom hidrogen. Meskipun secara biologis persenyawaan-persenyawaan hidrokarbon tidak penting, akan tetapi persenyawaan-persenyawaan biologis dapat dipandang sebagai turunan dari hidrokarbon (hidrokarbon dipandang sebagai persenyawaan induk). Keluarga hidrokarbon dapat dilukiskan oleh gambar berikut:
Hidrokarbon alifatik Hidrokarbon siklik (lingkaran)
Alkana Alkena Alkuna Jenuh Tak jenuh (siklo alkana) (hidrokarbon aromatik)
Semua persenyawaan hidrokarbon bersifat non-polar, sehingga ikatan antar molekulnya sangat lemah. Karena itu hidrokarbon yang berat molekulnya rendah berbentuk gas. Karena sifat non-polarnya maka hidrokarbon akan mudah larut dalam pelarut-pelarut berpolaritas rendah seperti karbontetrakhlorida, khloroform, benzena, dan eter; selain itu hidrokarbon mempunyai kerapatan yang lebih kecil dari air.
Pentingnya praktikum ini dilakukan karena agar praktikan dapat mengetahui hidrokarbon dan senyawa karbon yang menunjukkan ada atau tidaknya ikatan rangkap pada senyawa tersebut.
B. Tujuan
II. TINJAUAN PUSTAKA
Senyawa hidrokarbon merupakan senyawa karbon yang paling sederhana. Dari namanya, senyawa hidrokarbon adalah senyawa karbon yang hanya tersusun dari atom hidrogen dan atom karbon. Dalam kehidupan sehari-hari banyak kita temui senyawa hidrokarbon, misalnya minyak tanah, bensin, gas alam, plastik dan lain-lain.
Hidrokarbon yang paling sederhana adalah alkana, yaitu hidrokarbon yang hanya mengandung ikatan kovalen tunggal. Hidrokarbon merupakan senyawa yang struktur molekulnya terdiri dari hidrogen dan karbon. Molekul yang paling sederhana dari alkana adalah metana. Metana berupa gas pada suhu dan tekanan baku, merupakan komponen utama gas alam (Wilbraham, 1992).
1. Hidrokarbon jenuh, yaitu hidrokarbon yang pada rantai karbonnya semua berikatan tunggal. Hidrokarbon ini disebut juga sebaai akana.
2. Hidrokarbon tak jenuh, yaitu hidrokarbon yang pada rantai karbonnya terdapat ikatan rangkap dua atau rangkap tiga. Hidrokarbon yang mengandung ikatan rangkap dua disebut alkena dan yang mengandung ikatan rangkap tiga disebut alkuna.
Hidrogen dan senyawa turunannya, umumnya terbagi menjadi tiga kelompok besar yaitu:
1. Hidrogen alifatik terdiri atas rantai karbon yang tidak mencakup bangun siklik. Golongan ini sering disebut sebagai hidrokarbon rantai terbuka atau hidrokarbon siklik. Contoh hidrokarbon alifatik yaitu :
C2H6 (etana) CH3CH2CH2CH2CH3 (pentana)
2. Hidrokarbon alisiklik atau hidrokarbon siklik terdiri atas atom karbon yang tersusun dalam satu lingkar atau lebih.
3. Hidrokarbon aromatik merupakan golongan khusus senyawa siklik yang biasanya digambarkan sebagai lingkar enam dengan ikatan tunggal dan ikatan rangkap bersilih–ganti. Kelompok ini digolongkan terpisah dari hidrokarbon asiklik dan alifatik karena sifat fisika dan kimianya yang khas (Syukri, 1999).
zat “anesthetik” yang campurannya dengan udara mudah meledak. Etilena juga diketajui berperan dalam pematangan buah-buahan (Wilbraham, 1984).
Sedangkan alkuna dalam molekulnya ditandai dengan adanya ikatan ganda tiga antara dua atom karbon. Atom-atom karbon yang membentuk ikatan ganda tiga ini berhibridasi sp. Alkuna tergolong hidrokarbon tak jenuh. Dua ikatan yang timbul dari sepasang karbon berikatan ganda tiga membuat sudut 180. Jadi, etuna (C2H2) adalah alkuna paling sederhana dan berbentuk linear.
Contoh alkuna yang paling sederhana adalah asetilena (gas karbid) CHCH, yang campurannya dengan udara meledak. Gas ini dibentuk oleh reaksi kalsium karbida (karbid) dengan air.
Alkena dapat dioksidasi menjadi anekaragaman produk, bergabung pada reagensia yang digunakan. Reaksi yang melibatkan oksidasi ikatan rangkap karbon – karbon dapat dikelommpokkan menjadi dua gugus umum: (a). Oksidasi ikatan pi tanpa memutuskan ikatan sigma, dan (b). Oksidasi ikatan pi yang memutuskan ikatan sigma.
Reagensia yang paling populer untuk mengubah alkena menjadi suatu 1,2 – diol ialah larutan kalium permanganat (dalam air) basa dan dingin (meskipun biasanya reagensia ini memberikan rendemen rendah). Osmium tetroksida (OsO4) diikuti reduksi dengan reagensia seperti Na2SO3 atau NaHSO3 menghasilkan diol dengan rendemen yang lebih baik, tetapi penggunaanya terbatas karena mahal dan bersifat racun. (Tetapi osmium tetroksida perlu ada dalam kuantitas katalitik jika digunakan bersama hidrogen peroksida). Oksida permanganat dan OsO4 berlangsung lewat ester anorganik siklik, yang mengakibatkan cis – diol jika produk itu mampu berisometri geometrik.
CH
2= CH
2 MnO4ˉCH
2CH
2 OHˉCH
2CH
2+
MnO
2
etilena
O O OH OH
Rumus Umum:
OH OH
R
2C=CR
2 MnO4ˉ atau OsO4 dinginR
2C
CR
2sin-adisi
suatu alkena suatu 1, 2-diol
Reagensia permanganat dingin merupakan uji baeyer untuk ketidakjenuhan dalam senyawa yang tak diketahui strukturnya. Larutan uji (KMnO4) berwarna ungu. Ketika reaksi berjalan, warna ungu menghilang dan nampak endapan MnO2 coklat (Fessenden, 1982).
III. METODE PRAKTIKUM
A. Alat dan Bahan
Alat : Bahan :
- Tabung reaksi - Air
- Pipet tetes - Aseton
- 95 % etanol - Minyak kelapa - Minyak sawit
B. Prosedur Kerja
IV. HASIL DAN PEMBAHASAN
A. Hasil
No Pelarut Sampel +KMnO4 Setelah 2
menit Foto Dimasukkan 2 tetes senyawa sampe :
a. minyak kelapa b. minyak sawit
Pada masing-masing tabung ditambahkan 4-5 tetes larutan KMnO4, sambil dikocok.
Dibiarkan selama 1-2 menit.
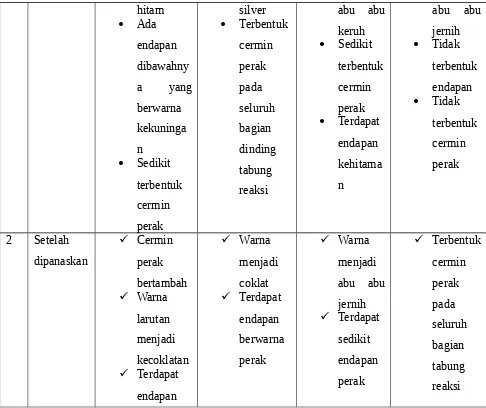
5. Etanol warna ungu dari KMnO4 yang menghilang dan nampak endapan warna coklat dari mangan dioksida (MnO2).
pergeseran warna di dalam larutan yaitu dari ungu ke cokelat menandakan minyak sawit menghasilkan larutan berwarna ungu kecokelatan dan terdapat banyak endapan berwarna cokelat. Sedangkan pada sampel minyak kelapa menghasilkan larutan berwarna ungu keruh tetapi terjadi endapan berwarna cokelat juga namun sedikit. Pada minyak sawit terdapat reaksi karena terjadinya pergeseran warna di dalam larutan dari ungu berubah menjadi kecokelatan dan adanya ikatan rangkap pada larutan karena terdapat endapan cokelat.
Uji coba yang terakhir dilakukan dengan etanol atau alkohol. Sampel minyak sawit dan KMnO4 menghasilkan larutan berwarna ungu dan pelarut tercampur serta terdapat sedikit lapisan minyak diatas pelarut. Pada minyak kelapa yang ditambah etanol dan KMnO4 menghasilkan larutan berwarna ungu dan pelarut tercampur, terdapat lapisan minyak diatas pelarut. Pada etanol yang di tambahkan minyak sawit, minyak kelapa dan KMnO4 tidak terjadi pergeseran warna dan tidak adanya ikatan rangkap.
V. KESIMPULAN DAN SARAN
A. Kesimpulan
Pada uji baeyer yang dilakukan dengan pelarut air, aseton dan etanol 98 % dengan sampel minyak kelapa dan minyak sawit yang ditambahkan KMnO4, terbentuk ikatan rangkap yaitu alkena dan alkuna pada uji coba saat menggunakan aseton dengan sampel minyak sawit karena terdapat banyak endapan berwarna cokelat.
Praktikum ini sebaiknya dilaksanakan dengan kondusif dan kerjasama antar kelompok harus terjaga dengan baik untuk kelancaran acara praktikum iu sendiri.
DAFTAR PUSTAKA
Dana, Adrian. 2011. Identifikasi Hidro karbon (On-line).
http://dannaadriann.blogspot.com. Diakses 08 Juni 2013
Day, R,A and Underwood, A,L. 1990. Analisa Kimia Kuantitatif. Jakarta: Erlangga
Fessenden, Ralph J, dan Fessenden, Joan S. 1997. Dasar-dasar Kimia Organik. Jakarta: Bina Aksara
Syukri, S. 1999. KImia Dasar 3. Bandung: ITB
Wilbraham, Antony. 1992. Pengantar Kimia Organik Dan Hayati. Bandung: ITB
LAPORAN KIMIA DASAR II
Acara III
Oleh:
Indrawan Nurhadi (A1M012054)
KEMENTERIAN PENDIDIKAN DAN KEBUDAYAAN UNIVERSITAS JENDERAL SOEDIRMAN
FAKULTAS PERTANIAN
JURUSAN TEKNOLOGI PERTANIAN
PROGRAM STUDI ILMU DAN TEKNOLOGI PANGAN PURWOKERTO
2013
I. PENDAHULUAN A. LATAR BELAKANG
Ester merupakan sebuah hidrokarbon yang diturunkan dari asam karboksilat. Sebuah asamkarboksilat mengandung gugus -COOH, dan pada sebuah ester, hidrogen di gugus inidigantikan oleh sebuah gugus hidrokarbon dari beberapa jenis.Ester diturunkan dari asam dengan mengganti gugus – OH oleh gugus – OR. Penamaan ester sama dengan garam asam karboksilatnya. Contoh beberapa senyawa ester :
CH3C – OCH3 CH3C – OCH2CH3 CH3CH2CH2C– OCH3
metil asetat etil asetat metil butanoat
Pada umumnya ester merupakan zat yang berbau enak dan menyebabkan cita rasa dan harum dari banyak buah-buahan dan bunga. Diantaranya yang lazim adalah pentil asetat (pisang), oktil asetat (jeruk), etil butanoat (nanas), dan pentil butanoat (aprikot). Campuran ester digunakan pada parfum dan cita rasa buatan. Ester dengan boboy molekul rendah juga digunakan oleh serangga dan hewan untuk memancarkan sinyal. Gajah betina melepas (Z) – 7 – dodesen – 1 – il asetat untuk memberi sinyal mengenai kesiapannya untuk kawin. Banyak kepik melepas ester yang sama untuk menarik jantannya.
Esterifikasi adalah salah satu jenis reaksi yang bertujuan untuk menghasilkan ester.Ester dapat dihasilkan dengancara mereaksikan antara sebuah alkohol dengan asam karboksilat. Berikut ini adalah reaksi keseluruhan atau reaksi esterifikasi secara umum:
Contoh
Dalam pembuatan etil etanoat, asam karboksilat dan alkohol sering dipanaskan bersama dengan adanya beberapa tetes asam sulfat pekat untuk mengamati bau ester yang terbentuk.Untuk melangsungkan reaksi dalam skala tabung uji, semua zat (asam karboksilat, alkohol dan asam sulfat pekat) yang dalam jumlah kecil dipanaskan di sebuah tabung uji yang berada di atas sebuah penangas air panas selama beberapa menit.
Reaksi yang terjadi berlangsung lambat dan dapat balik (reversibel), sehingga ester yang terbentuk tidak banyak. Bau khas yang dimiliki ester seringkali tertutupi atau terganggu oleh bau asam karboksilat. Cara yang sederhana untuk mendeteksi bau ester adalah dengan menambahkan air secukupnya pada tabung uji. Terkecuali pada ester-ester yang dihasilkan sangat kecil, pada umumnya ester kurang dapatlarut dalam air dan cenderung membentuk sebuah lapisan tipis pada permukaan. Asam dan alkohol yang berlebih akan larut dan terpisah di bawah lapisan ester.Ester-ester kecil seperti pelarut-pelarut organik sederhana memiliki bau yang mirip dengan pelarut-pelarut organik (etil etanoat merupakan sebuah pelarut yang umum misalnya pada lem).Semakin besar ester, maka aromanya cenderung lebih ke arah perasa buah buatan – misalnya "buah pir".
Aplikasi pembentukan ester sangat banyak di dijumpai pada bidang industri. Seperti pada proses dasar saatpembuatan plastik, senyawa aroamatik dan lain-lain. Oleh karena itu pembelajaran mengenai reaksi esterifikasi sangat dibutuhkan, walaupun dalam skala laboratorium.
B. TUJUAN
II. TINJAUAN PUSTAKA
reaksi reversible yang sangat lambat. Tetapi bila menggunakan katalis asam sulfat atau asam klorida, kesetimbangan reaksi akan tercapai dalam beberapa jam. Esterifikasi dipengaruhi oleh beberapa faktor diantaranya adalah; struktur molekul dari alkohol, suhu proses dan konsentrasi katalis maupun reaktan.
Ester merupakan senyawa yang penting dalam industri dan secara biologis. Lemak adalah ester yang mempunyai rantai panjang asam karboksilat dengan trihidroksi alkohol(gliserol). Bau yang enak dan buah-buahan adalah campuran yang kompleks dari ester volatil.
Bau dari isopentenil asetat adalah mirip dengan aroma buah pisang ataupun buah pir. Butil butanoat seperti aroma nanas, sedangkan propil 2-metilpropanoat memberi aroma rum (minuman). Sedangkan berton-ton senyawa polimer p-dimetil terephtalat disintesis setiap tahunnya untuk membuat produk dengan nama Dacron, yang merupakan polimer dari ester.
Dalam kimia, ester adalah suatu senyawa organik yang terbentuk melalui penggantian satu (atau lebih) atom hidrogen pada gugus hidroksil dengan suatu gugus organik (biasa dilambangkan dengan R’). Asam oksigen adalah suatu asam yang molekulnya memiliki gugus -OH yang hidrogennya (H) dapat terdisosiasi menjadi ion H+.
Ester dapat dibuat dari reaksi antara lain klorida asam dengan suatu alkohol dalam media basa seperti piridin, dari reaksi asam anhidrida dengan suatu alkohol, dan juga reaksi antara asam karboksilat dengan alkohol menggunakan katalis karboksilat dan alkohol direfluks secara bersama-sama dengan adanya asam sebagai katalis.
Ada dua metode yang digunakan dalam esterifikasi yaitu proses batch dan proses kontinyu. Proses esterifikasi berlangsung dibawah tekanan pada suhu 200-250°C. Pada reaksi kesetimbangan, air dipindahkan secara kontinyu untuk menghasilkan ester. Henkel telah mengembangkan esterifikasi countercurrent kontinyu menggunakan kolom reaksi dodel plate. Teknologi ini didasarkan pada prinsip reaksi esterifikasi dengan absorpsi simultan superheated metanol vapor dan desorpsi metanolwater mixture.
Reaksi ini menggunakan tekanan sekitar 1000 Kpa dan suhu 240 °C. Keuntungan dari proses ini adalah kelebihan metanol dapat dijaga secara nyata pada rasio yang rendah yaitu 1,5 : 1 molar metanol : asam lemak dibandingkan proses batch dimana rasionya 3-4 : 1 molar. Metil ester yang melalui proses distilasi tidak memerlukan proses pemurnian. Kelebihan metanol di rectified dan digunakan kembali. Esterifikasi proses kontinyu lebih baik daripada proses batch. Dengan hasil yang sama, proses kontinyu membutuhkan waktu yang lebih singkat dengan kelebihan metanol yang lebih rendah.
Proses esterifikasi merupakan proses yang cenderung digunakan dalam produksi ester dari asam lemak spesifik Laju reaksi esterifikasi sangat dipengaruhi oleh struktur molekul reaktan dan radikal yang terbentuk dalam senyawa antara. Data tentang laju reaksi serta mekanismenya disusun berdasarkan karakter kinetiknya, sedangkan data tentang perkembangan reaksi dinyatakan sebagai konstanta kesetimbangan. Secara umum laju reaksi esterifikasi mempunyai sifat sebagai berikut :
1. Alkohol primer bereaksi paling cepat, disusul alkohol sekunder, dan paling lambat alkohol tersier.
2. Ikatan rangkap memperlambat reaksi.
4. Makin panjang rantai alkohol, cenderung mempercepat reaksi atau tidak terlalu berpengaruh terhadap laju reaksi.
Sistem pemroses yang dirancang untuk menyelesaikan reaksi esterifikasi dikehendaki untuk sedapat mungkin mencapai 100%. Oleh karena itu reaksi esterifikasi merupakan kesetimbangan, maka konversi sempurna tidak mungkin tercapai, dan sesuai informasi yang ada konversi yang dapat dicapai hanya sampai 98%. Nilai konversi yang tinggi dapat dicapai dengan ekses reaktan yang besar. Proses esterifikasi secara umum harus diketahui untuk dapat mendorong konversi sebesar mungkin. Secara umum ada tiga golongan proses, dan penggolongan ini bergantung kepada volatilitas ester.
Golongan 1
Dengan ester yang sangat mudah menguap, seperti metil format, metil asetat, dan etil format, titik didih ester lebih rendah daripada alkohol, oleh karena itu ester segera dapat dihilangkan dari campuran reaksi. Produksi metil asetat dengan metode distilasi Bachaus merupakan sebuah contoh dari golongan ini. Metanol dan asam asetat diumpankan ke dalam kolom distilasi dan ester segera dipisahkan sebagai campuran uap dengan metanol dari bagian atas kolom. Air terakumulasi di dasar tangki dan selanjutnya dibuang. Ester dan alkohol dipisahkan lebih lanjut dalam kolom distilasi yang kedua.
Golongan 2
Ester dengan kemampuan menguap sebaiknya dipisahkan dengan cara menghilangkan air yang terbentuk secara distilasi. Dalam beberapa hal, campuran terner dari alkohol, air dan ester dapat terbentuk. Kelompok ini layak untuk dipisahkan lebih lanjut: dengan etil asetat, semua bagian ester dipindahkan sebagai campuran uap dengan alkohol dan sebagian air, sedangkan sisa air akan terakumulasi dalam sistem. Dengan butil asetat, semua bagian air dipindahkan ke bagian atas dengan sedikit bagian dari ester dan alkohol, sedangkan sisa ester terakumulasi dalam system.
Dengan ester yang mempunyai volatilitas rendah, beberapa kemungkinan timbul. Dalam hal butil dan amil alkohol, air dipisahkan sebagai campuran biner dengan alkohol. Contoh proses untuk tipe seperti ini adalah pembuatan dibutil ftalat. Untuk menghasilkan ester dari alkohol yang lebih pendek (metil, etil, propil) dibutuhkan penambahan hidrokarbon seperti benzena dan toluena untuk memperbesar air yang terdistilasi.dengan alkohol bertitik didih tinggi (benzil, furfuril, b-feniletil) suatu cairan tambahan selalu diperlukan untuk menghilangkan kandungan air dari campuran.
Beberapa Reaksi Ester : . Reduksi
. Hidrolisis . Ammonolisis
Reaksi antara ester dengan ammonia menghasilkan suatu amida disebut Amonolisis. Reaksi ammonolisis tidak memerlukan katalis.
. Transesterifikasi
Reaksi antara ester dengan alkohol menghasilkan ester baru dengan gugus alkil (pada oksigen karbonil) dari alkohol yang baru. Pada reaksi ini terjadi substitusi gugus alkil pada oksigen karbonil ester.
. Reaksi dengan Grignard
Reaksi bereaksi dengan 2 molekul reagen Grignard menghasilkan alkohol.
Variabel yang berpengaruh pada reaksi esterifikasi yaitu: . Suhu
Hal ini di karenakan sifat dari reaksi eksotermis, dan suhu dapat mempengaruhi harga konstanta kecepatan reaksi
Dikarenakan sifatnya yang reversible,maka salah satu perekatan harus di buat berlebih agar optimal saat pembentukan ester
. Pencampuran
Dengan adanya pengadukan pada saat pencampuran,molekul-molekul pereaktan dapat mengalami tumbukan yang lebih sering sehingga reaksi dapat berjalan secara optimal
. Katalis
Adanya katalisator dalam reaksi dapat mempercepat jalannya suatu reaksi. Kereakifan dari katalis bergantung dari jenis dan konsentrasi yang digunakan. . Waktu reaksi
Jika waktu bereaksi lama maka kesempatan molekul-molekul pertumbukan semakin sering
III. METODE PRAKTIKUM A. ALAT
a. Tabung reaksi b. Gabus
B. BAHAN
a. Larutan alcohol b. Asam cuka pekat c. Asam sulfat pekat d. Air
IV. HASIL DAN PEMBAHASAN A. HASIL
No Sampel
Ditambah asam cuka 5
tetes
Hasil Gambar
1
1 ml alcohol + 5 tetes
asam sulfat Warna cairan keruh
Beraroma wangi
Data pengamatan proses:
5 tetes asam cuka pekat
Ditambahkan pada campuran 1 ml alkohol dan 5 tetes asam sulfat
Dipanaskan dengan hati-hati
Diamati apa yang terjadi
Campuran 1 ml kelompok menunjukkan data yang sama. Larutan akhir yang dihasilkan berwarna bening dan menimbulakan bau seperti balon yang dapat memudar semakin lama larutan dibiarkan. Namun, ada beberapa poin yang kurang begitu diamati oleh praktikan.
Ditinjau dari tujuan diadakannya praktikum ini, setiap kelompok sudah mampu mengahsilkan larutan etil asetat. Namun, ada beberapa kelompok yang kurang memperhatikan hasil dari reaksi tersebut.
Ada beberapa faktor yang mengakibatkan perubahan tersebut kurang diperhatikan. Diantaranya yaitu warna larutan yang bening kurang mampu menunjukkan adanya perubahan yang terjadi. Faktor yang lain seperti volume air yang ditambahkan tidak disesuaikan, ataupun karena penggunaan pipet tetes yang tidak sesuai dengan aturan.
dibawahnya merupakan sisa asam dari asam karboksilat dan alkohol yang membentuk air.
V. KESIMPULAN DAN SARAN A. KESIMPULAN
Ester dibuat dengan cara mereaksikan asam karboksilat dan alkohol dengan bantuan katalis
Ester memiliki aroma yang khas
B. SARAN
DAFTAR PUSTAKA
Anonim.2011. http://www.chem-is-try.org/materi_kimia/sifat_senyawa organik /alkohol1/ reaksi_pengesteran esterifikasi/ ( Diakses tanggal 13 April, pada 18:26)
Anonim.2011.http://matekim.blogspot.com/2010/05/esterifikasi.html ( ril , pada 18:14)
Darjanto, Trisnowati, Santosa S. S. 1989. Himpunan Bahan Kuliah Ilmu Kimia Organik. Purwokerto : Fakultas Pertanian.
Fessenden, Ralp J., Fessenden, Joan S. 1982. Kimia Organik Edisi Ketiga. Jakarta: Erlangga.
Geissman, T. A., 1962. Principles of Organik Chemistry. W. H Freeman and Company.
LAPORAN KIMIA DASAR II
Acara IV
UJI TOLLENS UNTUK ALDEHID DAN KETON
Oleh:
Indrawan Nurhadi (A1M012054)
FAKULTAS PERTANIAN
JURUSAN TEKNOLOGI PERTANIAN
PROGRAM STUDI ILMU DAN TEKNOLOGI PANGAN PURWOKERTO
2013
I. PENDAHULUAN A. LATAR BELAKANG
Aldehid dan keton merupakan dua dari sekian banyak contoh kelompok senyawa organik yang mengandung gugus karbonil. Aldehid itu sendiri merupakan salah satu senyawa karbon yang mengandung gugus karbonil (-CO-), dimana satu tangan mengikat gugus alkil dan tangan yang lain mengikat atom hidrogen. Sedangkan keton hampir sama dengan aldehid, hanya saja pada keton kedua tangan atom karbon mengikat gugus alkil.
Struktur umum aldehid yaitu R-CHO.Struktur umum keton yaitu R-CO-R’.
Aldehid dan keton banyak terdapat dalam sistem makhluk hidup.Seperti gula ribosa dan hormon progesteron merupakan contoh dari aldehid dan keton. Aldehid dan keton mempunyai bau yang khas, yang pada umumnya aldehid berbau merangsang sedangkan keton berbau harum.
Aldehid dan keton menyumbangkan manfaat yang cukup besar dalam kehidupan. Salah stu contohnya yaitu metanal yang merupakan contoh dari senyawa aldehid. Metanal ini lebih dikenal dengan nama formaldehida. Larutan formaldehida 40% digunakan sebagai antiseptik atau yang dikenal dengan sebutan formalin. Sedangkan pada keton yang pailing banyak dikenal yaitu aseton yang digunakan sebagai pelarut dan pembersih kaca. Oleh karena banyak manfaatnya maka kita harus mampu membedakan mana senyawa keton dan senyawa aldehid agar tidak terjadi kekeliruan dalam pemanfaatannya.
B. TUJUAN
II. TINJAUAN PUSTAKA
Aldehid adalah suatu senyawa yang mengandung sebuah gugus karbonil yang terikat pada sebuah atau dua buah atom hidrogen. Nama IUPEC dari aldehida diturunkan dari alkana dengan mengganti akhiran “ana“ dengan “al“. Nama umumnya didasarkan nama asam karboksilat ditambahkan dengan akhiran dehida (Petrucci, 1987).
Aldehid dan keton bereaksi dengan berbagai senyawa, tetapi pada umumnya aldehid lebih reaktif dibanding keton. Kimiawan memanfaatkan kemudahan oksidasi aldehid dengan mengembangkan beberapa uji untuk mendeteksi gugus fungsi ini (Willbraham, 1992).
Uji Tollen merupakan salah satu uji yang digunakan untuk membedakan mana yang termasuk senyawa aldehid dan mana yang termasuk senyawa keton. Selain dengan menggunakan Uji Tollen untuk membedakan senyawa aldehid dan keton dapat juga menggunakan Uji Fehling dan Uji Benedict.
Aldehid lebih mudah dioksidasi dibanding keton. Oksidasi aldehid menghasilkan asam dengan jumlah atom karbon yang sama ( Hart, 1990). Hampir setiap reagensia yang mengoksidasi alkohol juga dapat mengoksidasi suatu aldehid.
Pereaksi Tollens sering disebut sebagai perak amoniakal, merupakan campuran dari AgNO3 dan amonia berlebihan. Gugus aktif pada pereaksi tollens adalh Ag2O yang bila tereduksi akan menghasilakan endapan perak. Endapan perak ini akan menempel pada tabung reaksi yang akn menjadi cermin perak. Oleh karena itu Pereaksi Tollens sering juga disebut pereaksi cermin perak (Sudarmo, 2006).
Aldehid dioksidasi menjadi anion karboksilat, ion Ag+ dalam reagensia Tollens direduksi menjadi logam Ag. Uji positf ditandai dengan terbentuknya cermin perak pada dinding dalam tabung reaksi.Reaksi dengan pereaksi Tollens mampu mengubah ikatan C-H pada aldehid menjadi ikatan C-O. Alkohol sekunder dapat dioksidasi menjadi keton selanjutnya keton tidak dapat dioksidasi lagi dengan menggunakan pereaksi Tollens. Hal ini disebabkan karena keton tidak mempunyai atom hidrogen yang menempel pada atom karbon karbonil. Keton hanya dapat dioksidasi dengan keadaan reaksi yang lebih keras dibandingkan dengan aldehid. Ikatan antara karbon karbonil dan salah satu karbonnya putus, memberikan hasil-hasil oksidasidengan jumlah atom karbon yang lebih sedikit daripada bahan keton asalnya. Kekecualian adalah dalam oksidasi keton siklik, karena jumlah atom karbonnya tetap sama. Misalnya, sikloheksanon dioksidasi secar besar-besaran menjadi asam dipat, bahan kimia pentinh dalam pembuatan Nylon.
Bila senyawa aldehid ditambahkan pada pereaksi tollens dan dipanaskan maka aldehid akan teroksidasi menjadi asam karboksilat yang segera membentuk garam amonia.
Sedangkan pereaksi tollens akan tereduksi sehingga dibebaskan logam perak yang segera melekat pada dinding tabing reaksi.
Untuk melakukan uji dengan pereaksi Tollens, beberapa tetes aldehid atau keton dimasukkan ke dalam pereaksi Tollens yang baru dibuat, dan dipanaskan secara perlahan dalam sebuah penangas air panas selama beberapa menit. Pada keton, tidak ada perubahan pada larutan yang tidak berwarna. Sedangkan aldehid, larutan tidak berwarna menghasilkan sebuah endapan perak berwarna abu-abu, atau sebuah cermin perak pada tabung uji.
III. METODE PRAKTIKUM A. Alat dan Bahan:
1. Pipet tetes 2. Tabung reaksi 3. Alat pemanas b) Bahan:
a. NaOh 10% e. Cinnamaldehid b. AgNO3 10% f. Aseton
c. NH4OH g. Glukosa d. Asetaldehid h. Sruktosa i. air
c) prosedur kerja
20 tetes larutan 10%NaOH ditambahkan kedalam 20 tetes larutan 10% AgNO3. Kemudian ditambahkan NH4OH tetes demi tetes hingga endapannya hilang. (ini
merupakan pereaksi tollen)
Satu tetes sample atau satu spatula sample padat dilarutkan dengan etanol 95%
Sample ditambahkan tetes demi tetes kedalam pereaksi tollen sambil dikocok,diamati terbentuknya endapan
IV. HASIL DAN PEMBAHASAN
A. HASIL PENGAMATAN N
O
Pereaksi Ditambah glukosa Ditambah fruktosa
Ditambah formaldehid
Ditambah aseton
muncul endapan cermin perak pada dinding tabung reaksi maka dapat dikatakan bahwa sampel itu merupakan salah satu dari senyawa aldehid.
Pada praktikum kali ini menggunakan empat jenis sampel yang diuji apakah dia termasuk ke dalam senyawa aldehid atau senyawa keton. Sampel-sampel tersebut antara lain asetaldehid, aseton, glucosa, dan fructosa.
Pada percobaan terhadap asetaldehid mula-mula ditambah dengan air, warnanya tetap bening dan tidak ada endapan sama sekali pada dasar tabung reaksinya. Kemudian ditambahkan dengan pereaksi tollens, maka terjadi perubahan. Warna larutan menjadi keruh dan munculnya endapan. Lalu larutan ini dipanaskan, dan terjadi perubahan yaitu warna larutan agak keruh abu-abu dan timbal cermin perak pada dinding tabung. Warna larutan berubah menjadi gelap. Dengan munculnya cermin perak pada dinding tabung reaksi pada percobaan kali ini maka dapat dinyatakan bahwa asetaldehid merupakan salah satu contoh dari senyawa aldehid.
Selanjutnya menggunakan sampel kedua yaitu aseton. Aseton ditambahkan dengan air, warna bening dan tidak terbentuk endapan. Kemudian ditambahkan pereaksi tollens, tidak terjadi perubahan. Warna tetap bening dan tidak terbentuk endapan. Kemudian larutan ini dipanaskan, warna larutan menjadi keruh coklat kehitaman dan tidak terbentuk cermin perak melainkan terbentuk endapan warna kehitaman. Dari pengamatan ini dapat dinyatakan bahwa aseton bukan merupakan salah satu senyawa aldehid, tetapi aseton merupakan senyawa keton,
Sampel yang terakhir yaitu fruktosa. Sama dengan glukosa, fruktosa juga merupakan salah satu jenis karbohidrat monosakarida. Apabila fruktosa ditambahkan dengan air warna yang terjadi tetap bening dan tidak ada endapan. Kemudian ditambahkan dengan pereaksi tollens maka warna berubah menjadi keruh coklat kehitaman dan terdapat endapan. Kemudian larutan ini dipanaskan maka warna menjadi keruh coklat dan terbentuklah endapan cermin perak pada dinding tabung reaksi. Jadi sama seperti glukosa, fruktosa juga merupakan salah satu senyawa aldehid.
Dari keempat sampel yang digunakan, yang bukan senyawa aldehid melainkan keton adalah Aseton. Ketiga larutan yaitu asetaldehid, glukosa, dan fruktosa termasuk ke dalam senyawa aldehid. Aseton tidak dapat membentuk cerminperak karena aseton tidak mempunyai atom hidrogen yang terikat pada gugus karbon. Kedua tangan gugus karbonnya sudah mengikat dua gugus alkil sehingga aseton tidak mengalami oksidasi ketika ditambah pereaksi tollens dan dipanaskan. Pada asetaldehid, glukosa dan fruktosa oksidasi terjadi denagn mudah karena ketiganya lebih reaktif.
VI. KESIMPULAN DAN SARAN
A. KESIMPULAN
direaksikan dengan pereaksi tollens kemudian dipanaskan akan terbentuk cermin perak pada dinding tabung reaksinya. Sedangkan sampel dapat dikatakan bahwa ia merupakn senyawa keton apabila terjadi reaksi negatif pada saat ditambah pereaksi tollens dan dipanaskan. Sampel ini tidak akan menunjukkan adanya cermin perak pada dinding tabung.
B. SARAN
Dalam percobaan-percobaan berikutnya sebaiknya menggunakan sampel lain yang lebih berbeda. Praktikan sebaiknya dapat mendeskripsikan hasil perubahan ynag terjadi dari percobaan secara lebih jales lagi.
DAFTAR PUSTAKA
Hart, Harold.1990.Kimia Organik.Jakarta : Erlangga.
Staley, Dennis.1992.Penuntun Belajar Untuk Kimia Organik dan Hayati.Bandung : ITB.
Sudarmo, Unggul.2006.Kimia 3.Jakarta : Erlangga.
Wilbraham, Antony C. 1992. Pengantar Kimia Organik 1. Bandung: Penerbit ITB
Willbraham, and Michael S. Matta.1992.Kimia Organik dan Hayati.Bandung : ITB
http://diaharrazy.files.wordpress.com/2010/12/lap-kimor-5-6-3rd-fa09.pdf diakses tanggal 11 juni 2013 pukul 12.00 WIB
http://diaharrazy.files.wordpress.com/2010/12/lap-kimor-6.pdf diakses tanggal
13 juni 2013 pukul 19.15 WIB
LAMPIRAN
( NaOH campur AgNO3) (NaOH AgNO3
(Tollen + Aseton) (Tollen + Aseton dipanaskan)
(Tollen + Formaldehid) (Tollen +
(Tollen + Glukosa)
LAPORAN KIMIA DASAR II
Acara V
Oleh:
Indrawan Nurhadi (A1M012054)
KEMENTERIAN PENDIDIKAN DAN KEBUDAYAAN UNIVERSITAS JENDERAL SOEDIRMAN
FAKULTAS PERTANIAN
JURUSAN TEKNOLOGI PERTANIAN
PROGRAM STUDI ILMU DAN TEKNOLOGI PANGAN PURWOKERTO
2013
Karbohidrat adalah hasil alam yang melakukan banyak fungsi penting dalam tanaman dan hewan. Melalui fotosintesis, tanaman mengubah karbon dioksida menjadi karbohidrat, yaitu dalam bentuk selulosa, pati dan gula-gula lain. Selulosa adalah komponen struktur pada tanaman yang digunakan untuk membangun dinding sel yang kaku, serat, dan jaringan kayu. Pati adalah bentuk umum penyimpan karbohidrat yang digunakan sebagai sumber makanan atau energi.
Karbohidrat adalah zat gizi yang fungsi utamanya sebagai penghasil energi yang setiap gramnya menghasilkan empat kalori.Walaupun lemak menghasilkan energi lebih besar, namun karbohidrat lebih banyak dikonsumsi.Karbohidrat banyak ditemukan pada serelia (beras, gandum, jagung, kentang, dan sebagainya).
Karbohidrat tersusun dari tiga jenis unsur, yakni karbon, hidrogen, dan oksigen.Rumus umum karbohidrat adalah (CH2O)n.
Satuan unit terkecil penyusun karbohidrat adalah monosakarida atau disebut dengan gula sederhana yang hanya mengandung 3 sampai 7 atom hidrogen.Karbohidrat terbentuk pada saat proses fotosintesis, sehingga merupakan senyawa perantara awal dalam pengaturan CO2, hidrogen, oksigen serta cahaya matahari
kedalam bentuk hayati. Karbohirat dapat digolongkan ke dalam monosakarida, oligosakarida, dan polisakarida. Karbohidrat merupakan hidrat suatu karbon Cx(H2O)y berupa polihidroksi
aldehid dan keton. Macam-macam karbohidrat bervariasi pada struktur isomer dan kemurniannya, sedangkan solubilitas karbohidratlengket satu sama lain.
dan menyisakan karbon (arang). Berdasarkan hal tersebut karbohidrat dianggap sebagai senyawa organic yang mempunyai rumus umum CnH2nOn. Karbohidrat merupakan senyawa aldehid
atau keton beserta turunannya yang mengikat banyak gugus hidroksil, dengan kata lain karbohidrat merupakan senyawa polihidroksil dari keton atau aldehid.
Karbohidrat atau sakarida adalah segolongan besar senyawa
organik yang tersusun hanya dari atom karbon, hidrogen, dan
oksigen. Bentuk molekul karbohidrat paling sederhana terdiri dari
satu molekul gula sederhana. Banyak karbohidrat yang merupakan polimer yang tersusun dari molekul gula yang terangkai menjadi rantai yang panjang serta bercabang-cabang.
Karbohidrat merupakan bahan makanan penting dan sumber tenaga yang terdapat dalam tumbuhan dan daging hewan. Selain itu, karbohidrat juga menjadi komponen struktur penting pada makhluk hidup dalam bentuk serat (fiber), seperti selulosa,
pektin, serta lignin.
Karbohidrat menyediakan kebutuhan dasar yang diperlukan tubuh. Tubuh menggunakan karbohidrat seperti layaknya mesin mobil menggunakan bensin. Glukosa, karbohidrat yang paling sederhana mengalir dalam aliran darah sehingga tersedia bagi seluruh sel tubuh. Sel-sel tubuh tersebut menyerap glukosa dan mengubahnya menjadi tenaga untuk menjalankan sel-sel tubuh.
Karbohidrat dapat diidentifikasikan dengan pereaksi benedict, seliwanoff, pembentukan osazon, uji iod, pereaksi fehling dan molisch. Dalam praktikum ini digunakan yang pertama pereaksi molisch untuk mengetahui terjadinya reaksi dehidrasi yang merupakan sifat karbohidrat jika direaksikan dengan asam mineral kuat. Kedua yaitu pereaksi fehling untuk mengetahui kandungan gula pereduksi dengan dipanaskan.
B. TUJUAN
Praktikum kimia dasar II ini dalam acara yang ke 5 terdapat 2 sub bahasan yaitu :
a. Uji Molisch untuk mengetahui adanya kandungan karbohidrat
II. TINJAUAN PUSTAKA
Karbohidrat merupakan senyawa karbon, hydrogen dan oksigen yang terdapat di alam yang mempunyai rumus umum CnH2nOn. Karbohidrat dialam umumnya merupakan suatu polimer,
tetapi ada pula karbohidrat sederhana. Hasil hidrolisis ketiga kelas utama karbohidrat saling berkaitan. (Fessenden, 1982)
Polisakari da
H2O Oligosakari
da
H2O
Monosakarida
H+ H+
Menurut Fessenden, ditinjau dari hasil hidrolisisnya karbohidrat dikelompokkan sebagai berikut :
Glukosa adalah monosakarida yang terpenting, kadang-kadang disebut gula darah (karena dijumpai dalam darah). Fruktosa juga disebut levulosa karena memutar bidang polirasisasi kekiri adalah gula termanis. Galaktosa terdapat dalam disakarida laktosa, dalam keadaan terikat dengan glukosa. Ribosa membentuk sebagian kerangka polimer dari asam-asam nukleat.
2. Disakarida
Suatu disakarida adalah suatu karbohidrat yang tersusun dari 2 satuan monosakarida yang dipersatukan oleh suatu hubungan glikosida dari karbon 1 dari satu-satuan ke suatu OH satuan yag lain. Disakarida merupakan dimer monosakarida yang sejenis atau berbeda jenis, sehingga bila dihidrolisis akan menghasilkan 2 monosakarida.
Disakarida yang banyak dikenal adalah sukrosa atau gula tebu (dimmer dari glukosa dan fruktosa), maltosa (dimer dari dua glukosa), dan laktosa atau gula susu (dimer dari glukosa dan galaktosa). (Soetopo, 2002).
Sukrosa dan laktosa tidak dapat difermentasikan sedangkan maltosa dapat difermentasikan menghasilkan alcohol (etanol). Sukrosa tidak dapat mereduksi larutan fehling sebab gugus aldehidnya sudah terikat pada fruktosa. Maltosa dan laktosa dapat mereduksi larutan fehling sebab salah satu monomernya (glukosa dan galaktosa) masih memiliki gugus aldehid bebas (belum terikat).
misalnya sebuah molekul sukrosa tersusun dari sebuah satuan glukosa dan sebuah satuan fruktosa yang digabungkan seperti dibawah ini (Keenan, 1986) :
3. Oligosakarida
Oligosakarida adalah karbohidrat yang apabila dihidroisis akan terurai menjadi 3 sampai 10 monosakarida, misalnya dektrin dan maltopentosa. Oligosakarida yang saling berhubungan misalnya disakarida, trisakaridadan sebagainya (Soetopo, 2002).
4. Polisakarida
Suatu polisakarida adalah senyawa dalam man molekul-molekul mengandung banyak satuan monosakarida yang dipersatukan dengan ikatan glukosida. Hidrolisis lengkap akan mengubah suatu poisakarida menjadi monosakarida. Polisakarida memenuhi 3 maksud dalm system kehidupan : sebagai bahan bangunan (architectural), bahan makanan (nutritional), dan sebagai zat spesifik. Polisakarida architectural misal selulosa, komponen struktur dari kerangka luar serangga. Polisakarida nutrisi yang lazim adalh pati dan glikogen, karbohidrat yang siap dipakai dalam tubuh hewan. Heparin adalah salah satu contoh zat spesifik, adalah suatu polisakarida yang mencegah koagulasi darah (Fessenden, 1982).
larut). Hidrolisis lengkap amilosa menghasilkan D-glukosa, hidrolisis parsial menghasilkan maltosa sebagai satu-satunya disakarida. Amilopektin adalah suatu polisakarida yang mengandung 1000 satuan glukosa atau lebih per molekul. Hidrolisis lengkap amilopektin menghasilkan D-glukosa, namun hidrolisis tak lengkap menghasilkan suatu campuran disakarida maltosa dan isomaltosa (Fessenden, 1982).
Gula Pereduksi
Suatu gugus aldehid sangat mudah dioksidasi menjadi suatu gugus karboksil. Uji kimiawi untuk aldehid tergantung mudahnya oksidasi ini. Gula pereduksi adalah karbohidrat yang dapat mereduksi senyawa pengoksidasi lemah seperti Cu dalam pereaksi fehling. Agar berfungsi sebagai gula pereduksi, karbohidrat harus mempunyai fungsi aldehid atau gugus fungsi hemi asetal yang dapat membuka menjadi aldehid. Dari ketiga bentuk glukosa, hanya bentuk asiklik yang dioksidasi oleh pereaksi fehling. Akhiran -osa digunakan dalam tatanama karbohidrat sistematik untuk menyatakan suatu gula pereduksi (Keenan, 1986).
membentuk waran persenyawaan berwarna dengan α-naphthol atau persenyawaan aromatic lain. Uji molisch berdasarkan sifat ini yaitu pembentukan kompleks violet / ungu dengan α-naphthol (Darjanto et all,1988). Uji fehling menggunakan pereaksi fehling yang terdiri dari campuran kupri sulfat, Na-K-tartrat dan natrium hidroksida dengan gula pereduksi dan dipanaskan akan terbentuk endapan yang berwarna merah kecoklatan (Sudarmadji et all, 1986).
Analisa kualiatif karbohidrat
furfural, sedangkan dehidrasi pentosa menghasilkan senyawa fulfural.
Uji positif jika timbul cincin merah ungu yang merupakan
kondensasi antara furfural atau hidroksimetil furfural dengan alpha-naftol dalam pereaksi Molisch.Bila larutan karbohidrat diberi beberapa tetes larutan alfa-naftol, kemudian H2SO4 pekat secukupnya sehingga terbentuk 2 lapisan cairan, pada bidang batas kedua lapisan itu terbentuk cincin ungu.
2. Uji Seliwanof
Merupakan uji spesifik untuk karbohidrat yang
Pereaksi Seliwanoff terdiri dari serbuk resorsinol + HCl
gugus aldehid atau keton bebas dalam suasana alkalis.
Biasanya ditambahkan zat pengompleks seperti sitrat atau
tatrat untuk mencegah terjadinya pengendapan CuCO3.
Uji positif ditandai dengan terbentuknya larutan hijau,
merah, orange atau merah bata serta adanya endapan.
4. Uji Barfoed
Digunakan untuk menunjukkan adanya monosakarida
dalam sampel.
Uji positif ditunjukkan dengan terbentuknya endapan
merah orange.
2. Uji Iodin
Digunakan untuk menunjukkan adanya polisakarida.
Amilum dengan iodine dapat membentuk kompleks biru.
Amilopektin dengan iodin akan memberi warna merah
ungu sedangkan dengan glikogen dan dekstrin akan membentuk warna merah coklat.
3. Uji Fehling
Digunakan untuk menunjukkan adanya karbohidrat
pereduksi.
Uji positif ditandai dengan warna merah bata atau merah
(Mustahib, 2011)
Uji Fehling
Uji Fehling bertujuan untuk mengetahui adanya gugus aldehid.Reaksi yang terjadi dalam uji fehling adalah :
Pemanasan dalam reaksi ini bertujuan agar gugus aldehida pada sampel terbongkar ikatannya dan dapat bereaksi dengan ion OH- membentuk asam karboksilat.Cu
2O (endapan merah
Kedalammasing-masing tabung dialirkan dengan hati-hati 1 ml asam sulfat pekat (caranya dimiringkan tabung 45’ dan dialirkan asam sulfat pekat melalui dinding dengan pipet tetes perlahan-lahan
Diamati apa yang terjadi
UJI FEHLING
Dicampurkan larutan fehling A dan B dengan perbandingan 1 : 1
Diambil 2 ml campuran larutan fehling
Ditambahkan 5 tetes larutan yang diuji dan dididihkan
IV. HASIL DAN PEMBAHASAN
A. HASIL PENGAMATAN
1. Uji Molisch untuk karbohidrat
No
. Sample
Ditambah 2 tetes mollisch
Ditambah 1 ml H2SO4
1. Glukosa (0,02)
Biru pekat Biru keunguaan
3. Air
Biru pekat Biru tua
2. Uji Fehling
Jenis Larutan Larutan Hasil Keterangan Gambar
Sirup
Fehling A dan B
Larutan berwarna biru kemudian setelah dipanaskan menjadi hijau daun dan terdapat endapan merah kecoklatan
Karbohidrat oleh asam sulfat (H2SO4) pekat akan dihidrolisis
menjadi monosakarida dan selanjutnya monosakarida mengalami dehidrasi oleh asam sulfat pekat menjadi furfural. Furfural tersebut apabila ditambah dengan α-naphthol akan berkondensasi membentuk senyawa kompleks yang berwarna ungu.
Uji molisch digunakan untuk mengidentifikasi apakah suatu zat mengandung karbohidrat. Uji ini dilakukan dengan menambahkan dua tetes pereaksi molisch (dimana pereaksi molisch ini terbuat dengan melarutkan
a-naphthol dalamlarutan ethanol 95%) pada larutan uji dan ditambahkan H2SO4 pekat perlahan-lahan pada dinding tabung sampai terbentuk cincin berwarna ungu. Apabila suatu larutan uji menunjukan adanya cincin berwarna ungu, maka larutan uji tersebut mengandung karbohidrat.
Pereaksi molisch yang terdiri dari a-naphthol dalam alkohol akan bereaksi dengan furfural tersebut membentuk senyawa kompleks berwarna ungu. Uji ini bukan uji spesifik untuk karbohidrat, walaupun hasil reaksi yang negatif menunjukan bahwa larutan yang diperiksa tidak mengandung karbohidrat.
Pada hasil uji molisch tak ada satupun larutan uji yang ditambahkan pelarut molisch dan dialiri larutan asam sulfat pekat memberikan warna ungu. Pada air larutan teteap bening ini menunjukan bahwa air tidak mengandung karbohidrat. Sedangkan pada glukosa tidak terbentuk warna ungu, walaupun secara teori seharusnya pada larutan glukosa terbentuk warna ungu karena glukosa mengandung karbohidrat. Hal ini terjadi mungkin karena dalam pembuat larutan molisch praktikan kurang teliti dalam perbandingan campuran bahan.
UJI FEHLING
Uji fehling ini digunakan untuk mengetahui adanya kandungan gula pereduksi dalam karbohidrat. Gula pereduksi adalah karbohidrat yang dapat mereduksi senyawa pengoksidasi lemah seperti Cu dalam pereaksi fehling. Agar berfungsi sebagai gula pereduksi, karbohidrat harus mempunyai fungsi aldehid atau gugus fungsi hemi asetal yang dapat membuka menjadi aldehid. Dari ketiga bentuk glukosa, hanya bentuk asiklik yang dioksidasi oleh pereaksi fehling. Akhiran-osa digunakan dalam tatanama karbohidrat sistematik untuk menyatakan suatu gula pereduksi (Keenan, 1986).
V. KESIMPULAN DAN SARAN
A. KESIMPULAN
Kesimpulan yang dapat diambil pembahasan diatas adalah :
1. Suatu zat atau larutan yang mengandung karbohidrat dapat ditunjukkan dengan adanya cincin furfural berwarna ungu bila ditambahkan dengan pereaksi molisch yang biasa disebut dengan uji molisch.
2. Suatu zat atau larutan yang mengandung gula pereduksi dapat ditunjukkan dengan adanya endapan berwarna merah kecoklatan bila ditambahkan dengan pereaksi fehling yang biasa disebut dengan uji fehling.
3. Larutan glukosa 0,01M dan glukosa 0,02M termasuk karbohidrat jenis monosakarida.
B. SARAN
Dalam praktikum sebaiknya praktikan lebih fokus dan teliti
dalam mengamati apa saja perubahan yang terjadi.
Apabila memberi keterangan pada data pengamatan
sebaiknya yang lengkap.
Praktikan juga harus mematuhi prosedur kerja,
mengantisipasi agar tidak terjadi kesalahan dalam praktikum.
Disiplin dan hati-hati dibutuhkan karena bekerja dengan
zat-zat yang berbahaya (asam sulfat pekat)
DAFTAR PUSTAKA
Fessenden, R. J, J. S. Fessenden. 1982. Kimia Organik Jilid 2. Erlangga. Jakarta.
Keenan, Kleinfelter. 1986. Kimia Untuk Universitas II. Erlangga. Jakarta. Soetopo. 2002. Biokimia. Yudistira. Bandung.
Sudarmadji, Slamet, Bambang Haryono, Suhardi. 1986. Analisa Bahan Makanan dan Pertanian. Pusat Antar Universitas Ilmu Pangan dan Gizi. Yogyakarta
Mustahib. 2011. Karbohidrat dan Uji Karbohidrat. (On-Line):
http://biologi.blogsome.com. Diakses tanggal 14 Juni 2013
LAPORAN KIMIA DASAR II
Acara VI
Oleh:
PROGRAM STUDI ILMU DAN TEKNOLOGI PANGAN PURWOKERTO
2013
I. PENDAHULUAN
A. Latar belakang
Protein merupakan senyawa terpenting penyusun sel hidup, yang terdapat dalam semua jaringan hidup baik tumbuhan, hewan maupun tubuh kita. Protein sangat penting bagi makhluk hidup, antara lain sebagai sumber energi, mensintesis atau memperbaiki jaringan yang rusak, alat transport, melindungi kita dari berbagai penyakit, dan sebagai enzim yang mengkatalis berbagai reaksi metabolisme.
Protein merupakan salah satu contoh polimer alam yang mempunyai struktur paling kompleks diantara contoh polimer alam lainnya, misalnya: karbohidrat dan lemak. Molekul – molekul pada protein mempunyai bobot molekul yang tinggi, misalnya pada albumen pada telur yang mempunyai berat molekul(BM) yang tinggi yaitu 40.000 – 45.000.
Molekul protein yang besar menyebabkan protein mudah sekali mengalami perubahan fisik ataupun aktivitas biologisnya. Banyak agensai yang dapat menyebabkan perubahan sifat alamiah protein, misalnya panas, asam, basa, solven organic, garam, logam berat, dan radiasi sinar matahari. Sedangkan untuk perubahan fisik yang mudah diamati adalah penjedalan.
Protein dapat dianalisis baik secara kualitatif maupun kuantitatif, secara kuantitatif protein dapat dianalisis dengan cara uji kjeldahl(untuk menganalisis kadar protein kasar dalam bahan makanan secara tidak langsung) dan uji dumas.,Sedangkan secara kualitatif protein dapat dianalisis dengan cara biologis, PER(Protein Efficiency Ratio), NPU(Net Protein Utilization), NDpCal ,uji biuret, dsb.
Praktikum ini dilaksanakan dengan tujuan untuk mengidentifikasi protein dengan uji biuret. Prinsipnya adalah senyawa CuSO alkalia akan membentuk senyawa kompleks dengan protein. Reaksi ini terjadi pada ikatan peptida yang terdapat dalam molekul. Intensitas warna menunjukan jumlah ikatan peptida yang terdapat dalam molekul protein.
B. Tujuan
II. TINJAUAN PUSTAKA
Protein adalah makromolekul yang secara fisik dan fungsional kompleks yang melakukan beragam peran penting. Protein mengalami perubahan fisik dan fungsional yang mencerminkan siklus hidup organisme tempat protein berada. Protein biasanya “lahir” saat translasi, mengalami pematangan melalui pengolahan pascatranslasi dan mati setelah diuraikan menjadi asam-asam amino komponennya (Murray dkk, 2006).
Protein adalah senyawa polipeptida yang tersusun atas satuan – satuan dasar kimia, yaitu asam amino. Dalam molekul protein, asam – asam amino ini saling berhubung – hubungan dengan suatu ikatan yang disebut ikatan peptide (-CO-NH-). Ikatan peptida terbentuk jika gugus amino (-NH2) dari satu asam amino bereaksi dengan gugus karboksil (- COOH) dari asam amino berikutnya.
- NH – CH – CO – NH – CH – CO – NH – CH – CO –
Satu molekul protein dapat terdiri dari 12 sampai 18 macam asam amino dan dapat mencapai jumlah ratusan asam amino (Suharjo dan Clara M.Kusharto, 2003).
Protein secara kimia lebih kompleks lagi, tetapi seperti karbohidrat dan lipid, protein juga tersusun dari senyawa gabungan yang sederhana. Semua protein mengandung atom karbon, oksigen, hidrogen, dan nitrogen serta protein-protein yang mengandung sulfur dan fosfor (Sloane, 2004).
Adapun struktur protein yaitu terdiri dari rantai polipeptida memilin, melipat, dan membungkus diri ke dalam model yang membentuk protein dengan kesesuaian bentuk (conformation) yang berbeda-beda. Protein struktural atau fibrosa disusun dari makromolekul linear yang panjang. Contohnya meliputi kalogen;mioin (protein otot); fibrin; dan keratin pada rambut, kuku dan kulit. Selain itu juga dikenal protein globular adalah protein yang sangat terpilin dan terlipat dalam bentuk yang hampir sferikal, atau mirip gulungan benang kusut. Contohnya meliputi enzim, hormone, dan protein darah (Sloane, 2004).
Berat molekul protein bias mencapai empat puluh juta; bandingkan dengan berat molekul glukosa yang besarnya 180. Jenis protein sangat banyak, mungkin sampai 1010-1012. Ini dapat dibayangkan bila diketahui bahwa protein terdiri atas sekian kombinasi berbagai jenis dan jumlah asam amino. Ada dua puluh jenis asam amino yang diketahui sampai sekarang yang terdiri atas asam amino esensial (asam amino yang tidak dapat dibuat tubuh dan harus di datangkan dari makanan) dan sebelas asam amino non esensial (Almatsier, 2010).
Asam amino yang merupakan monomer (satuan pembentuk) protein amino adalah suatu senyawa yang mempunyai dua gugus fungsi yaitu gugus amino dan gugus karboksil. Pada asam amino, gugus amino terikat pada atom karbon yang berdekatan dengan gugus karboksil dalam asam amino terikat pada atom karbon yang sama.