PEMBAHASAN PAKET LATIHAN UAN
Paket 1
1. Mol H2SO4 =
6,72
22, 4= 0,3 mol
Berdasar perbandingan koefisien maka diketahui mol L = 0,2 mol Persamaan menjadi :
2L + 3H2SO4 Æ L2(SO4)3 + 3H2
0,2 0,3
Jika diketahui massa L = 5,4 gram, maka
Massa atom L = Ar L = 5, 4 0,2= 27 Diketahui netron L = 14, sehingga :
Nomor atom L = Massa atom L – netron L = 27 – 14 = 13
Nomor atom = proton = elektron Konfigurasi elektron :
13L = 2 8 3 Î 3+ ( logam ) 8M = 2 6 Î 2– ( non logam )
Sehingga L dan M akan membentuk ikatan kimia ionik atau elektrovalen. Dengan rumus : L3+ + M2–Æ L2M3
Jawaban : D
2. Sesuai aturan Aufbau maka orbital dengan tingkat energi lebih rendah akan terisi elektron terlebih dahulu sehingga, Ne yang mempunyai nomor atom 10 akan di tambah dengan elektron sebanyak 7 seperti berikut :
Jawaban : A
3. Konfigurasi Elektron :
11A = 1s2 2s2 2p63s1
Unsur A terletak pada periode 3 (kulit terluar) dan golongan IA (elektron valensi = 1)
Jawaban : E
4. Konfigurasi Elektron :
11A = 1s2 2s2 2p6 3s1 Î A = logam
17B = 1s2 2s2 2p6 3s2 3p5 Î B = non logam
Ikatan yang terbentuk adalah ikatan ionik atau elektrovalen ( elektron yang dilepas A akan diikat oleh B )
Jawaban : A
[Ne]
5. pemutihan gula tebu dan penjernihan air adalah adsorbsi
penyaringan debu dan pembentukan delta adalah koagulasi
pencucian darah adalah dialisis
Jawaban : A
6. Perhatikan diagram PT antara pelarut dan larutan non elektrolit !
Dari gambar diketahui bahwa :
ΔTb = 40 – 35 = 5o
ΔTb = Kb . m
5 = 1,82 . m Î jadi m = 5
1,82= 2,75 m
Jawaban : D
7. Suatu alat dirangkai sebagai berikut;
Jika dalam air suling tersebut dimasukkan zat-zat sebagai berikut maka yang menghantar listrik adalah natrium klorida (elektrolit)
etanol Înon elektrolit ( tidak menghantar listrik )
timbalÎlogam/bukan ion ( tidak menghantar listrik )
gula Înon elektrolit (tidak menghantar listrik)
belerangÎnon logam/bukan ion ( tidak menghantar listrik )
Jawaban : C
8. Suatu zat dengan jumlah ion sama, makin besar Ksp makin besar juga kelarutannya.
Untuk yang dua ion AgCl dan AgI, AgCl mem-punyai kelarutan yang lebih besar yaitu:
Ksp AgC l = 10–10Î kelarutannya = 10−10 = 10–5 M
Untuk yang tiga ion Ag2CrO4, Ag2S, dan Ag2C2O4, Ag2C2O4 mempunyai kelarutan yang
paling besar yaitu:
Ksp Ag2C2O4 = 1,1.10–11Î kelarutannya =
12 311.10
4
−
≈ 10–4 M
Jawaban : E
–20 –15 5 10 35 40 T P
X
C C lampu
9.
Sifat Uji kertas lakmus Biru Merah
NaCN BASA Biru Biru
K2SO4 NETRAL Biru Merah
NH4Cl ASAM Merah Merah
HCOOK BASA Biru Biru
KCl NETRAL Biru Merah
Jawaban : B
10. Perhatikan gambar, mula-mula pH larutan adalah sekitar 13, KOH Æ K+ + OH–
10–1 M 10–1 M 10–1 M
dan pada volume HNO3 sekitar 25 ml (sama seperti volume KOH) adalah merupakan titik
ekivalen yaitu sekitar pH = 7.
Jawaban : E
11. Cara menanggulangi sampah plastik yang paling benar
didaur ulang
mengurangi penggunaannya
menciptakan yang dapat dibiodegradasi
Jawaban : A
12. [H+] = Ka x M asam Lemah
= -5 -1
10 x 10
= -6
10 = 10–3 M
pH mula-mula = –log 10–3 = 3
Mr NaCH3COO = 82
Mol NaCH3COO =
0,82 82 = 10
–2
mol
Mol CH3COOH = 100 x 0,1= 10 mmol = 10–2 mol
Setelah reaksi, kita gunakan rumus Buffer :
[H+] = Ka . mol asam mol garam
[H+] = 10–5 .
-2 -2
10
10 = 10
–5
pH akhir =–log 10–5= 5
Jawaban : B
pH 7
Vol. HNO3
13. Jika dalam 2 hari = 60 ton silika (SiO2), maka dalam
1 hari = 30 ton = 30000 kg
Mr SiO2 = 28 + 2.16 = 60
mol SiO2 =
30000 kg
60 = 500 kmol
SiO2 (s) + 2 C (s) Æ Si (s) + 2 CO (g)
Sesuai persamaan reaksi maka Silikon yang terbentuk = 1
1x 500 kmol = 500 kmol Jadi massa silikon yang dihasilkan dalam 1 hari adalah:
500 kmol x 28 = 14000 kg = 14 ton
Jawaban : D
14. Mol HCl = 100 mL X 1 M = 100 mmol = 0,1 mol
Mol Al =0,54
27 = 0,02 mol Persamaan setaranya :
2 Al + 6 HCl Æ 2 AlCl3 + 3 H2
0,02 0,1 - -
0,02 0,06 0,02 0,03
- 0,04 0,02 0,03
Sesuai hukum :
Perbandingan koefisien = perbandingan mol, maka diperoleh H2 = 0,03 mol
Dalam STP berarti = 0,03 x 22,4 liter = 0,672 liter
Jawaban : C
15. Larutan Natrium tiosulfat 100 mL 1 M direaksikan dengan HCl 50 mL 1 M dengan persamaan : Na2S2O3 (aq) + 2 HCl (aq) Æ 2 NaCl (aq) + H2SO3 (aq) + S (s)
mol Na2S2O3 = 100 mL x 1 M = 100 mmol = 0,1 mol
mol HCl = 50 mL x 1 M = 50 mmol = 0,05 mol
Na2S2O3 (aq) + 2 HCl (aq) Æ 2 NaCl (aq) + H2SO3 (aq) + S (s)
0,1 mol 0,05 mol 0,025 mol 0,05 mol 0,075 mol -
Sesuai hukum:
Perbandingan koefisien = perbandingan mol yang bereaksi, maka diperoleh: sisa Na2S2O3 = 0,075 mol
Jawaban : E
16. Beberapa kegunaan makanan dalam tubuh di antaranya sebagai berikut :
sumber energi utama, fungsi karbohidrat
enzim pengkatalis metabolisme, fungsi protein
antibodi, fungsi protein
komponen utama kontrol genetika, fungsi asam nukleat
17. Asam amino essensial yaitu asam amino yang tidak dapat dibuat oleh tubuh manusia:
Arginin Lisin Histidin Isoleusin Leusin
Fenilalanin Metionin Treonin Triptofan Valin
Asam amino non essensial yaitu asam amino yang dapat dibuat oleh tubuh manusia:
Alanin Glutamin Serin Tirosin Asam glutamat
Asam aspartat Prolin Sistein Asparagin Glisin
Jawaban : C
18. Di bawah ini adalah jenis polimer alami yang berpolimerisasi secara kondensasi maupun adisi:
karet Îpolimerisasi adisi
protein Î polimerisasi kondensasi
DNA Î polimerisasi kondensasi
selulosa Î polimerisasi kondensasi
amilum Î polimerisasi kondensasi
Jawaban : A
19. Ciri alkohol tersier:
bukan 1-alkanol
ada unsur “kembar”
Ciri alkohol sekunder:
bukan 1-alkanol
ada unsur “beda”
isopropanol
Ciri alkohol primer:
1-alkanol
semua iso-alkanol kecuali isopropanol Jadi :
3-metil-2-butanol Îalkohol sekunder 2-metil-1-butanolÎalkohol primer 3-pentanolÎalkohol sekunder 2-pentanolÎalkohol sekunder 2-metil-2-butanolÎalkohol tersier
Jawaban : E
20. Dua molekul asam amino akan berikatan yang disebut ikatan peptida dengan melepaskan molekul air (H2O)
Jawaban : A
21. Isomer fungsional dari butanal adalah senyawa golongan alkanon (keton):
Butanal mempunyai jumlah karbon 4 buah maka yang tepat mempunyai 4 buah karbon dari keton adalah metilpropil keton, sehingga:
Isomer fungsional butanal CH3–CH2–CH2–CHO:
CH3 – C – CH2 – CH3
metil etil keton
Jawaban : B
22. Cara membedakan reaksi secara mudah :
Adisi
ikatan rangkap Îikatan tunggal
- ikatan rangkap tiga Îikatan rangkap dua
Substitusi
- ikatan tunggal Îikatan tunggal - ikatan rangkap Îikatan rangkap
Eliminasi
- ikatan tunggalÎikatan rangkap
Dari 3 macam reaksi :
(1) CH3CH=CHCH3 + Cl2Æ CH3–CHCl– CHCl–CH3 (adisi)
(2) CH2Cl2 + Cl2Æ CHCl3 + HCl (substitusi)
(3) CH3CH2Cl + KOH Æ CH2=CH2 + KCl + H2O (eliminasi)
Jawaban : D
23. Nama senyawa yang dihasilkan pada persamaan (1) pada soal di atas:
CH3–CHCl– CHCl–CH3
2,3-dikloro-butana
Jawaban : C
24. Perhatikan gambar !
2,4-dinitro-fenol
Jawaban : D
25. Menurut reaksi : CaCO3(s) ⇔ CaO(s) + CO2(g) ; ∆H > 0
Supaya CaO yang dihasilkan makin banyak dapat dilakukan dengan cara:
Menaikkan suhu, dengan menaikkan suhu maka reaksi akan bergeser ke kanan ( dalam hal ini reaksi endoterm = ∆H > 0 )
Menurunkan tekanan, dengan menurunkan tekanan maka kesetimbangan bergeser ke kanan, karena koefisien reaksi di kanan lebih besar ( ingat dalam kesetimbangan kita tidak dapat melibatkan solid, jadi koefisien di kanan = 1 )
Menaikkan volume, dengan menurunkan tekanan maka kesetimbangan bergeser ke kanan, karena koefisien reaksi di kanan lebih kecil.
Jawaban : B
26. Reaksi eksoterm adalah reaksi pelepasan panas sehingga ∆H = – dan entalpi lingkungan bertambah, sedangkan entalpi sistem berkurang.
Jawaban : C
NO2
NO2
27. Perhatikan siklus diagram berikut :
28. Laju tinggi jika luas permukaan sentuhan semakin besar jadi: serbuk > granula > lempeng Juga bila konsentrasi reaktan besar maka laju juga besar, dari data maka pada percobaan 5 mewakili kondisi yang dimaksud.
Jawaban : E
29. Pada reaksi 2A + B ´A2B diketahui bahwa reaksi berorde nol terhadap B, maka hubungan
reaksi awal dengan berbagai konsentrasi awal zat B itu diperlihatkan oleh grafik.
Jawaban : A
Perhatikan persamaan berikut:
2 H+ + 2e Æ H2
Cu2+ + 2e Æ Cu
2 F 1 mol
Jadi massa tembaga yang terbentuk adalah : mol x Ar Cu = 1 x 63,5 = 63,5 gram
Jawaban : C
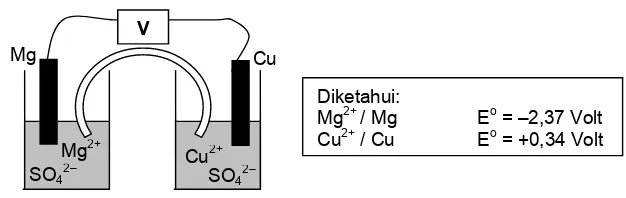
Gambar berikut digunakan untuk menjawab soal nomor 32 dan 33.
32. Yang mempunyai potensial reduksi lebih rendah akan mengalami oksidasi di anoda dan dalam notasi sel ditulis disebelah kiri dengan bilangan oksidasi bertambah besar.
Sedangkan yang mempunyai potensial reduksi tinggi akan mengalami reduksi di katoda ditulis disebelah kanan dengan bilangan oksidasi berkurang.
Jawaban : B
33. Potensial sel volta rangkaian tersebut = Eoreduksi – Eooksidasi
= 0,34 – ( –2,37 )
= 2,71 volt
Jawaban : E
34. Lemak terhidrolisis menjadi gliserol dan asam alkanoat dengan reaksi : Lemak + H2O Æ gliserol + asam alkanoat
Jawaban : D
35. KClO3 (s) + S (s) + H+ (aq) Æ KCl (aq) + SO2 (g) + H2O (l)
Zat yang merupakan oksidator yang mengalami reduksi.
Jawaban : E
36. kasiterit = SnO2 ( bijih utama logam timah )
kalkosit = Cu2S
cinabar = HgS
kalkopirit = CuFeS2
galena = PbS
Jawaban : A
37. Beberapa sifat gas mulia:
a. berwujud gas pada suhu kamar V
Mg2+ SO42–
Cu2+ SO42–
Mg Cu
Diketahui:
Mg2+ / Mg Eo = –2,37 Volt
Cu2+/ Cu Eo= +0,34 Volt
+5 –1 0 +4
reduksi
b. oksidator c. elektronegatif d. molekul monoatomik e. sukar bereaksi
Jawaban : D
38. Elektrolisis dalam proses pembuatan tembaga adalah untuk memurnikan tembaga hasil pengolahan.
Jawaban : A
39. Beberapa sifat unsur transisi:
1. tidak dapat dipakai sebagai katalis 2. bersifat logam
3. bilangan oksidasi lebih dari satu
4. umumnya membentuk senyawa berwarna 5. membentuk ion kompleks
6. reduktor yang baik
Jawaban : C
40. Unsur halogen yang mempunyai sifat oksidator terkuat yang mempunyai nomor atom paling kecil, seiring dengan bertambahnya nomor atom sifat oksidator berkurang.
Paket 2
1. Kesadahan sementara air terjadi karena dalam air terdapat senyawa yang mengandung salah satu atau semua ion-ion: Ca2+, Mg2+, HCO3–.
Kesadahan tetap air terjadi karena dalam air terdapat senyawa yang mengandung salah satu atau semua ion-ion: Ca2+, Mg2+, SO42–, F–, Cl–, Br–, I–.
Jawaban : E
2. 77Ir = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d7
Jawaban : B
3. 51X = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p3
Elektron valensi = s + p = 2 + 3 = 5 ( golongan VA ), Kulit terluar = 5 ( periode 5 ).
Jawaban : C
4. ikatan elektrovalen = ikatan ionik
Ikatan antara logam dengan non logam, dalam hal ini ion logam = Na+, Li+, K+, Ca2+, Pb2+ Ion non Logam = SO42–, H+, Cl–, Br–, O2–
Jawaban : D
5. Kelebihan elektrolit dalam suatu dispersi koloid biasanya dihilangkan dengan cara dialisis dengan menggunakan selaput semi permiabel.
Jawaban : C
6. ∆Tf = Kf x m 0,372 = 1,86 x m
m = 0,372
1,86 = 0,2 molal
∆Tb = Kb x m
= 0,52 x 0,2
= 0,104oC
Jawaban : B
7. karbon monoksida = menyebabkan keracunan karena mengikat Hb lebih kuat dari O2,
nitrogen = zat terbanyak di udara
detergen = menyebabkan polusi pada tanah dan air, merupakan pencemar karena zat-zat yang terkandung dapat mengganggu makhluk di tanah dan air.
helium = gas mulia dapat, bukan pencemar
Jawaban : B
8. Dari suatu eksperimen diperoleh data sebagai berikut;
Bahan Nyala Lampu
A + air Terang
B + air Tidak menyala
C + air Nyala redup
Kekuatan elektrolit sesuai dengan data di atas adalah A > C, sebab B bukan elektrolit
Jawaban : E
9. Perhatikan gambar berikut !
P = Xp . Po
P = mol pelarut
mol pelarut + mol zat terlarut . P
o
Dari formula tersebut maka dapat disimpulkan Tekanan uap larutan terbesar jika mol zat terlarutnya terkecil.
11. Jika diketahui Kb NH4OH = 10–5,
pH larutan garam NH4Cl yang mempunyai konsentrasi 0,1 molar ( 10–1 M )
NH4Cl Æ NH4+ + Cl–
x Konsentrasi NH 10
12. Perubahan pH pada titrasi CH3COOH dengan NaOH digambarkan oleh
Mula-mula pH sedikit di bawah 7 ( CH3COOH = asam lemah ), setelah ditambahkan NaOH
( basa kuat ) maka pH naik secara perlahan dan berakhir pada sedikit di bawah 14 .
Jawaban : D
Gunakan Rumus Gas Ideal:
n x R x T
14. Perhatikan persamaan berikut:
4 NH3 (g) + 5 O2 (g) ´ 4 NO (g) + 6 H2O (g)
50 cm3 60 cm3
amonia = 50 = 12,5 4
oksigen = 60 = 12
5 (habis bereaksi / reaktan pembatas, maka dijadikan “patokan” ) Susunan persamaan menjadi:
Ingat ! perbandingan volume yang bereaksi = perbandingan koefisien
Jawaban: C
15. Pada akhir reaksi didapatkan 8 L gas H2S, maka berlaku:
2
8
mol H S = x 1 mol = 0,4 mol 20
FeS + 2 HCl ´ FeCl2 + H2S
Bereaksi: 0,4 mol 0,4 mol
Perhatikan!
Perbandingan mol bereaksi = perbandingan koefisien
Massa FeS = mol FeS x Mr FeS = 0,4 mol x ( 56 + 32 ) = 35,2 gram
Jawaban : D
16. H H
CH3 – C – CH3 + NaOH ´ CH3 – C = CH2 + NaBr + H2O
Br
Adanya ikatan tunggal menjadi ikatan ganda mencirikan reaksi eliminasi.
Jawaban : C
17. Perhatikan senyawa karbohidrat di bawah ini :
glukosa Îmonosakarida
galaktosa Îmonosakarida
selulosa Î polisakarida fruktosa Î monosakarida sukrosa Î disakarida
Jawaban : E
18. Beberapa polimer yang terbentuk melalui proses kondensasi:
Nilon, dakron(poliester), protein, amilum, selulosa, DNA
Beberapa polimer yang terbentuk melalui proses adisi:
Karet, PVC, polipropilen, poliisoprena
Jawaban : A
19. [H+] = Ka x Konsentrasi Asam Lemah
[H+] = 5 1
2 x 10− x 2 x 10−
[H+] = 6 3
4 x 10− = 2 x 10−
pH = –log 2 x 10–3 = 3 – log 2
Jawaban : A
HA + LOH ´ LA + H2O
Mula: 20 mmol 10 mmol - -
Bereaksi: 10 mmol 10 mmol 10 mmol 10 mmol
10 mmol - 10 mmol 10 mmol
Untuk mencari pH gunakan rumus:
[H+] = Ka x Asam Lemah
Garam
Konsentrasi sisa Konsentrasi
[H+] = 1,75 x 10–5 x 10 mmol 10 mmol [H+] = 1,75 x 10–5
pH = 5 – log 1,75
Jawaban : E
21. Pada STP = 2,8 liter Î 2,8 x 1 mol = 0,125 mol 22, 4
Maka Mr gas = 4,25 0,125= 34
Jawaban : E
22. Perhatikan persamaan berikut:
2 N2O3 Æ 2 N2 + 3 O2
2 mol 2 mol 3 mol
2 NO Æ N2 + O2
4 mol 2 mol 2 mol
Mol N2 = 2 mol + 2 mol = 4 mol
Mol O2 = 3 mol + 2 mol = 5 mol
perbandingan gas nitrogen dan oksigen = 4 : 5
Jawaban : C
23. Perhatikan reaksi berikut:
2 S + 3 O2 Æ 2 SO3
0,1 mol 0,1 mol
SO3 =
8
80= 0,1 mol
Maka mol S = 0,1 mol ( perbandingan koefisien = perbandingan mol yang bereaksi )
Massa S = 0,1 mol x 32 = 3,2 gram
massa cuplikan 100%
=
massa S 80%
100%
massa cuplikan = x 3,2
80% = 4 gram
Jawaban : B
24. Protein berdasarkan bentuknya:
Kolagen (fiber)
Albumin (globular)
Keratin (fiber)
Protamin (globular)
Jawaban : B
25. Diketahui :
6 C + 3 H2 ´ C6H6 ; ∆H = + 83 kJ/mol
C + O2 ´ CO2 ; ∆H = –394 kJ/mol
H2 + ½ O2 ´ H2O ; ∆H = –286 kJ/mol
Perubahan entalpi pembakaran C6H6:
C6H6 ´ 6 C + 3 H2 ∆H = – 83 kJ/mol
6 C + 6 O2 ´ 6 CO2 ∆H = –394 kJ/mol
3 H2 + 1,5 O2 ´ 3 H2O ∆H = –286 kJ/mol
C6H6 + 7,5 O2 ´ 6 CO2 + 3 H2O ∆H =–3305 kJ/mol
Jawaban : B
26. Jika energi ikatan rata-rata dari:
C=C 146 kkal/mol
C–C 83 kkal/mol
C–H 99 kkal/mol
C–Cl 79 kkal/mol
H–Cl 103 kkal/mol
Maka perubahan entalpi pada adisi etena dengan asam klorida:
∆H = Σ energi ikatan pemutusan – Σ energi ikatan pembentukan
∆H = [(C = C + 4 . C – H + H – Cl) – (C – C + 5 . C – H + C – Cl)]
∆H = [(146 + 4 . 99 + 103) – (83 + 5 . 99 + 79)]
∆H = [(146 + 396 + 103) – (83 + 495 + 79)]
∆H = 645 – 657
∆H = – 12 kkal/mol
Jawaban : C
27. Dari data percobaan berikut :
[NO] [H2] Laju reaksi
0,6 M 0,1 M 3,2 M/s
0,6 M 0,3 M 9,6 M/s
0,2 M 0,5 M 1,0 M/s
0,4 M 0,5 M 4,0 M/s
Orde reaksi terhadap NO untuk : 2NO(g) + 2 H2(g) ´ N2(g) + 2 H2O(l)
H2 yang bernilai sama ada pada persamaan 3 dan 4, maka:
C = C
H H
H H
+ H – Cl Æ H – C – C – Cl
H H
m n
∆n = jumlah koefisien kanan – jumlah koefisien kiri
Perhatikan!
Kp dan Kc sama, jika nilai ∆n = 0 ( koefisien yang dihitung yang berfase aqueous dan gas )
Jawaban : D
29. Bensin dengan bilangan oktan 92, ini berarti bensin mengandung 92% isooktana dan sisanya n-heptana.
Pada suhu tertentu dalam ruang 1 liter terdapat kesetimbangan:
2 SO3(g) ⇔ 2 SO2(g) + O2(g)
Mula: 1 mol - -
Bereaksi: 2X 2X X
Setimbang: 1 – 2X 2X X
Dalam keadaan setimbang :
31. Sepotong logam seng dicelupkan dalam larutan CuSO4 yang berwarna biru. Ternyata warna
biru semakin luntur dan seng semakin mengecil. Berarti terjadi peristiwa kimia sebagai berikut,
Î Seng teroksidasi karena mempunyai potensial reduksi lebih kecil dari pada tembaga, terjadi perpindahan elektron dari Zn ke Cu2+ (Zn melepaskan elektron)
Î Ion tembaga akan tereduksi
34. Elektrolisis Larutan Na2SO4
Di Katoda yang tereduksi adalah air dengan persamaan : 2H2O(l) + 2e ´ 2OH–(aq) + H2(g) Karena potensial reduksi air lebih besar jika dibandingkan dengan natrium.
Jawaban : A
35. Perhatikan skema di bawah ini:
Besi akan mengalami korosi paling cepat jika dihubungkan dengan logam yang berpotensial reduksi lebih tinggi dari potensial reduksi besi dalam hal ini Pt (platinum).
Jawaban : C
36. Beberapa sifat logam alkali:
Î mudah bereaksi dengan air
Î berwarna putih mengkilap
Î lunak dan mudah diiris dengan pisau
Î di alam dalam bentuk senyawa
Jawaban : E
37. Pasangan unsur gas mulia, yang senyawanya paling dapat disintesis, dibanding dengan gas mulia lain adalah Ksenon dan Kripton.
Jawaban : E
Wacana berikut digunakan untuk menjawab soal nomor 38 - 40.
Reaksi bertahap reduksi bijih besi sebagai berikut : 3 Fe2O3 + CO Æ 2 Fe3O4 + CO2
Fe3O4 + COÆ 3 FeO + CO2
FeO + COÆ Fe + CO2
38. Fe3O4 = magnetit
Hematit = Fe2O3
Magnesit = MgCO3
Pirit = FeS2
Silvit = KCl
Jawaban : B
39. 112 kg besi murni = 112 = 2 kmol 56
Berdasar perbandingan mol = perbandingan koefisien maka:
FeO + CO Æ Fe + CO2
2 kmol 2 kmol
Fe3O4 + CO Æ 3 FeO + CO2
0,67 kmol 2 kmol
3 Fe2O3 + CO Æ 2 Fe3O4 + CO2
1 kmol 0,67 kmol
Fe2O3 yang dibutuhkan = mol Fe2O3 x Mr Fe2O3
= 1 kmol x ( 112 + 48 )
= 160 kg
Jawaban : E
40. Kegunaan besi yang dipadu dengan karbon kurang dari 2 %, kromium 14% - 18%, nikel ± 8 % adalah untuk membuat baja tahan karat untuk perkakas dapur.
Paket 3
1. Kesadahan sementara air terjadi karena dalam air terdapat senyawa yang mengandung salah satu atau semua ion-ion: Ca2+, Mg2+, HCO3–.
Kesadahan tetap air terjadi karena dalam air terdapat senyawa yang mengandung salah satu atau semua ion-ion: Ca2+, Mg2+, SO42–, F–, Cl–, Br–, I–.
Jawaban : B
2. 72Hf = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d2
Jawaban : E
3. 31X = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p1
Elektron valensi = s + p = 2 + 1 = 3 ( golongan IIIA ), Kulit terluar = 4 ( periode 4 ).
Jawaban : C
4. Ikatan kovalen koordinat terjadi antara non logam dengan non logam, salah satu unsur katakan unsur A memakai elektron unsur lain (B), tetapi unsur B tidak memakai elektron unsur A.
Jawaban : A
5. Partikel koloid bermuatan listrik karena penyerapan ion-ion pada permukaan koloid oleh koloid lain. Penyerapan pada permukaan inilah yang disebut adsorbsi.
Jawaban : A
6. ΔTf = 0,40oC massa = 5 gram pelarut = 250 gram Kf molal air = 1,8
Tf = Kf . m
massa 1000
Tf = Kf . .
Mr pelarut(gr)
5 1000
0, 4 = 1,8 . .
Mr 250
5 1000
Mr = 1,8 . .
0,4 250
Mr = 90 Δ
Δ
Jawaban : E
7. Diketahui:
Jika Q < KspÎ elektrolit belum mengendap/ masih melarut
9. Merubah lakmus merah menjadi biru ( larutan Basa ) Garam-garam:
(NH4)2SO4 = asam (hidrolisis)
(CH3COO)2Ba = basa (hidrolisis)
Ca(NO3)2 = netral
FeCl3 = asam (hidrolisis)
K2CO3 = basa (hidrolisis)
Jawaban : D
10. Titrasi larutan HCl dengan larutan NaOH 0,2 M menggunakan indikator PP didapatkan data:
No Volume NaOH 0,2 M
Volume HCl
1 25 cm3 41 cm3
2 25 cm3 39,5 cm3
3 25 cm3 39,5 cm3
Volume rata-rata HCl = 41 39,5 39,5 = 40 3
+ +
Konsentrasi larutan HCl : Masam . Vasam = Mbasa . Vbasa
Masam . 40 = 0,2 . 25
Masam = 0,125 M
Jawaban : A
11. Penambahan sedikit air dalam larutan buffer tidak menyebabkan terjadinya perubahan pH.
Jawaban : C
12. Polutan udara yang dihasilkan dari reaksi pembakaran tidak sempurna pada kendaraan bermotor adalah CO.
Jawaban : E
13. massa Mg = 2,4 gram
mol Mg = 2, 4 = 0,1
24 mol
Perhatikan reaksi berikut:
Mg + 2 HCl Æ MgCl2 + H2
0,1 mol 0,2 mol 0,1 mol 0,1 mol
Dalam STP 1 mol gas = 22,4 liter maka volume gas hidrogen adalah: 0,1 x 22,4 liter = 2,24 liter
Jawaban : C
14. Mol KClO3 =
50 122,5mol
Mol KCl yang terbentuk = 2 2.
50 122,5=
Mol O2 yang terbentuk =
Massa zat yang dihasilkan = Massa KCl + Massa O2
= 30,41 gr + 19,59 gr
= 50 gr
Hal ini sesuai dengan hukum Lavoisier di mana zat sebelum dan setelah reaksi mempunyai massa sama.
Jawaban : C
15. Pembakaran sempurna 0,2 gram senyawa hidrokarbon dihasilkan 0,66 gram CO2 dan 0,18
gram H2O.
Rumus empiris senyawa tersebut:
= mol C : mol H
0,18 gram 0,02 gram
= :
12 1
0,18 gram 0,02 gram
= :
16. Di antara senyawa di bawah ini yang disebut asam benzoat adalah....
Jawaban : E
18. Diketahui beberapa polimer berdasar jenis monomernya: 1. PVC Î monomernya vinil klorida
2. teflon Î monomernya tetra fluoro etena 3. polietilen Î monomernya etena
4. nilon 66 Î monomernya asam adipat dan heksa metilen diamina 5. dakron Î monomernya asam tereftalat dan etilen glikol
6. amilum Î monomernya glukosa
Yang merupakan polimer yang terdiri lebih dari satu jenis monomer:
Jawaban : D
19. Pereaksi yang digunakan untuk menunjukkan adanya protein yang mengandung belerang adalah Timbal asetat.
Jawaban : D
20. Reaksi yang dimaksud dalam soal adalah ESTERIFIKASI : Alkanol + Asam Alkanoat Æ Alkil Alkanoat + H2O
(Ester) Alkanol (alkohol) bergugus fungsi – OH
Jawaban : E
21. Nyala lampu redup bila larutan elektrolitnya berasal dari asam atau basa lemah.
Jawaban : A
massa NH Cl = 1,3375 gram
− −
−
−
−
23. Jika diketahui massa 1 atom A = X gram, massa 1 atom 12C = Y gram
12 1
12
massa satu atom unsur A Ar unsur A =
Perhatikan reaksi berikut:
CH3COOH + NaOH Æ CH3COONa + H2O
Berdasarkan reaksi :
26. Diketahui persamaan reaksi sebagai berikut; a Cl2 + b KOH Æ c KCl + d KClO3 + 3 H2O
reaksi akan setara jika harga koefisien a = 3, b = 6, c = 5, dan d = 1.
Jawaban : B
27. Diagram tingkat energi pembentukan CO2 :
Berdasarkan data di atas maka berlaku ∆H3 = ∆H1 + ∆H2, jadi ∆H2 = ∆H3 – ∆H1 Jawaban : A
28. Berdasarkan reaksi :
N2(g) + 3 H2(g) ´ 2 NH3(g) ; ∆H = –682 kJ
2 NH3 ´ N2(g) + 3 H2(g) ; ∆H = +682 kJ ( 2 mol, lihat koefisien NH3 )
Dapat dinyatakan bahwa pada penguraian 1 mol NH3
NH3 ´
1
2N2(g) + 3
2H2(g) ; ∆H = +341 kJ ( tanda “ + “ berarti reaksi endoterm )
Jawaban : B
29. Diagram di bawah ini menyatakan bahwa....
reaksi dapat berlangsung jika X >Y atau sebaliknya
reaksi tersebut adalah reaksi eksoterm ( melepas energi )
perubahan entalpi = Y
energi aktivasi = X
Jawaban : C
30. Reaksi :
N2O4 ⇔ 2 NO2
1 - 0,2 0,4 0,8 0,4 Perbandingannya:
2 : 1
Maka P N2O4 =
2
x 0,75 = 0,50
3
P NO2 =
1
x 0,75 = 0,25 3
Hasil reaksi Reaktan
X Y E
C + O2
∆H1
∆H2
∆H3 CO
2
32. Perhatikan gambar berikut !
Reaksi elektrolisis yang akan melarutkan anodanya jika anodanya bukan dari C, Pt,dan Au.
Jawaban : C
33. Oksidasi 1 mol ion sianida (CN–) menjadi ion sianat (CNO–)
CN– + H2O Æ CNO– + 2 H+ + 2 e
1 mol 2 mol
memerlukan muatan listrik sebanyak 2 faraday ( perhatikan jumlah elektron ) Ingat! Jumlah muatan = jumlah mol elektron.
Jawaban : B
34. Logam cadmium diletakkan dalam larutan CuSO4 0,1 M pada suhu 25oC, Eo Cd2+ | Cd = –0,40
V dan Eo Cu2+ | Cu = +0,34 V, yang terjadi adalah: ion Cu2+ mereduksi Cd, karena mempunyai potensial reduksi yang lebih tinggi daripada Cd.
Jawaban : D
35. Gas hidrogen di anoda, jika bereaksi dengan logam ( sebagai hidrida )
36. Pada elektrolisis larutan NaCl dengan elektroda C zat yang terjadi : Katoda : 2 H2O + 2 e Æ H2 + 2 OH–
Anoda : 2 Cl– Æ Cl2 + 2 e
Jawaban : B
37. Sifat-sifat unsur periode ke-3 adalah dari kiri ke kanan:
sifat logam berkurang
sifat basa berkurang
jari-jari atom berkurang
keelektronegatifan bertambah
sifat reduktor berkurang
Jawaban : D
Wacana berikut digunakan untuk menjawab soal no. 38 dan 39.
38. Beberapa mineral :
galena = PbS
kalsit = CaCO3
kalkopirit = CuFeS2
sfalerit = ZnS
hematit = Fe2O3
Jawaban : D
39. Sebanyak 29,1 ton ZnS = 29100 kg = 300 kmol 65 + 32
2 ZnS + 3 O2 Æ 2 ZnO + 2 SO2
300 kmol 300 kmol
ZnO + C Æ Zn + CO
300 kmol 300 kmol
Seng yang dihasilkan = mol Zn x Ar Zn
= 300 kmol x 65
= 19500 kg
Jawaban : E
40. Dalam kehidupan sehari-hari oksigen bersama dengan asetilena dapat digunakan untuk keperluan pengelasan baja.
Jawaban : A
Seng dapat dihasilkan dengan melakukan pemang-gangan seng sul-fida (ZnS), yang akan menghasilkan seng oksida (ZnO). Kemudian seng oksida ini direduksi dengan karbon pijar dengan persamaan seperti berikut :
2 ZnS + 3 O2Æ 2 ZnO + 2 SO2