i
PENINGKATAN SENSITIVITAS INDIKATOR
NANOPARTIKEL PERAK SEBAGAI KANDIDAT
PENDETEKSI LOGAM PENCEMAR PADA KERANG HIJAU
(Perna viridis
Linn.)
SKRIPSI
DITA ROSYITA DEWI
0806327761
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM PROGRAM STUDI FARMASI
DEPOK JULI 2012
PENINGKATAN SENSITIVITAS INDIKATOR
NANOPARTIKEL PERAK SEBAGAI KANDIDAT
PENDETEKSI LOGAM PENCEMAR PADA KERANG HIJAU
(Perna viridis
Linn.)
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar sarjana sains
DITA ROSYITA DEWI
0806327761
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM PROGRAM STUDI FARMASI
DEPOK JULI 2012
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia yang telah dilimpahkan sehingga penulisan skripsi ini dapat terselesaikan. Penulisan skripsi ini dilakukan dalam rangka memeuhi salah satu syarat untuk mencapai gelar Sarjana Farmasi pada Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Indonesia.
Penulis sangat berterima kasih atas dukungan, doa, bimbingan dan bantuan dari berbagai pihak. Penulis mengucapkan terima kasih kepada:
1. Ibu Dra. Maryati Kurniadi, M.Si., Apt., selaku dosen pembimbing I atas bimbingan, saran dan perhatian selama penyusunan hingga skripsi ini selesai.
2. Bapak Dr. Ing. Cuk Imawan, selaku dosen pembimbing II atas bimbingan, saran dan perhatian selama penyusunan hingga skripsi ini selesai.
3. Ibu Dr. Rani Sauriasari, M.Sc., Apt., selaku bagian dari tim penelitian atas bimbingan serta saran yang diberikan selama penyusunan hinggaskripsi ini selesai.
4. Ibu Prof. Dr. Yahdiana harahap, M.S., Apt., selaku ketua Departemen Farmasi Fakultas Matematika dan Ilmu Pengetahuan Alam.
5. Prof. Drs. Maksum Radji M.Biomed., Ph.D., Apt., selaku Pembimbing Akademis atas saran yang diberikan selama pendidikan.
6. Tim penelitian yang terdiri dari Kak Windri Handayani, Muhammad Irfan Hasan, Ilma Nafia dan Suci Tresnaeni atas diskusi dan bantuan yang luar biasa selama penelitian serta teman-teman Farmasi angkatan 2008 program reguler atas kebersamaan dan dukungan selama menjalani kuliah di Farmasi.
7. Seluruh Dosen, laboran serta karyawan Departemen Farmasi Fakultas Matematika dan Ilmu Pengetahuan Alam.
8. Bapak, Ibu, adik-adik dan seluruh keluarga atas semangat, dukungan materil maupun moril dan doa yang selalu diberikan selama ini.
vii
10.Seluruh pihak yang telah membatu yang tidak dapat penulis sebutkan satu per satu.
Akhir kata, penulis berharap semoga Tuhan Yang Maha Esa berkenan membalas segala kebaikan semua pihak yang telah banyak membantu. Semoga skripsi ini dapat membawa manfaat bagi pembaca maupun pengembangan dunia ilmu pengetahuan.
Penulis
ix Universitas Indonesia
ABSTRAK
Nama : Dita Rosyita Dewi Program Studi : Farmasi
Judul : Peningkatan Sensitivitas Indikator Nanopartikel Perak sebagai Kandidat Pendeteksi Logam Pencemar pada Kerang Hijau (Perna viridis Linn.)
Kemampuan nanopartikel perak (NPP) dalam mendeteksi cemaran logam berat secara kolorimetri memiliki sensitivitas yang masih rendah. Cemaran logam berat dapat terjadi pada makanan yang sering dikonsumsi manusia, salah satunya kerang hijau. Penelitian ini bertujuan untuk mengetahui selektivitas dan meningkatkan sensitivitas indikator NPP dalam mendeteksi larutan analit logam berat serta menganalisis kemampuan NPP termodifikasi kitosan 1% dalam mendeteksi larutan analit pada kerang hijau. Peningkatan sensitivitas dilakukan dengan penambahan NaCl 1 M, MgSO4 0,1 M dan KNO3 0,5 M pada NPP hasil
green synthesis menggunakan air rebusan daun bisbul. Modifikasi NPP dengan
kitosan 1% dibuat dengan perbandingan 10:3 (v:v). Hasil pengujian NPP pada larutan analit Cu2+ dan Zn2+ 100 ppm serta Hg2+ 500 ppm memberikan perubahan warna bening hingga kuning terang. NPP dengan penambahan NaCl 1 M memberi perubahan warna bening pada Hg2+ 100 ppm dan kuning terang pada Cu2+ 1 ppm. NPP termodifikasi kitosan dengan penambahan NaCl 1 M yang diujikan pada sampel dengan nilai LOD 0,048 ppm memberi perubahan warna kuning terang pada Cu2+ 1 ppm. Indikator NPP mampu mendeteksi ion logam Hg2+, Cu2+ dan Zn2+ dengan perubahan warna yang tidak selektif. NaCl 1 M dapat meningkatkan sensitivitas NPP dalam mendeteksi ion logam Hg2+ dan Cu2+. Pengujian NPP termodifikasi kitosan dengan penambahan NaCl 1 M pada sampel yang dicemari larutan analit Cu2+ mampu menghasilkan perubahan warna hingga 1 ppm.
Kata kunci : NPP, bisbul, NaCl, kitosan, kerang hijau, logam, analit, Cu2+, Hg2+ xviii +80 halaman ; 26 gambar; 1 tabel; 46 lampiran
x Universitas Indonesia
ABSTRACT
Name : Dita Rosyita Dewi Program Study : Pharmacy
Title : Sensitivity Increasement of Silver Nanoparticles Indicator as Polluted Metal Detector Candidate in Green Shells (Perna viridis Linn.)
Silver nanoparticles (NPP) ability in colorimetric detection of heavy metal contamination has low sensitivity. Heavy metal contamination can be found in foods commonly consumed by human, one of these green shells. This study aims to find out selectivity and improve sensitivity of NPP indicator in detecting heavy metal analyte solution and observating the ability of indicator modified chitosan 1% to detect analyte solution in green shells. Sensitivity increasement has done by adding NaCl 1 M, MgSO4 0.1 M and KNO3 0.5 M to NPP that green synthesized
using bisbul leaf broth. NPP was modified with chitosan 1% at ratio 10:3 (v:v). The test results of NPP give a clear color to bright yellow change in Cu2+ and Zn2+ 100 ppm also in Hg2+ 500 ppm. NPP with the addition of NaCl 1 M give a clear color change in analyte solution Hg2+ 100 ppm and Cu2+ 1 ppm in bright yellow. Testing of NPP modified chitosan with the addition of NaCl 1 M which LOD 0,048 ppm give bright color change in samples with Cu2+ 1 ppm. NPP indicator can nonselective detect Hg2+, Cu2+ and Zn2+. NaCl 1 M can increase the sensitivity of NPP in detecting Hg2+ and Cu2+. NPP modified chitosan with adding NaCl 1 M test result at samples contaminated with Cu2+ analyte solution give a color change up to 1 ppm.
Key Words: bisbul, NPP, NaCl, chitosan, green shells, metal, analyte, Cu2+, Hg2+ xviii+80 pages : 26 pictures; 1 tables; 46 appendixs
xi Universitas Indonesia
DAFTAR ISI
HALAMAN JUDUL... ii
SURAT PERNYATAAN BEBAS PLAGIARISME... iii
HALAMAN PERNYATAAN ORISINALITAS... iv
HALAMAN PENGESAHAN... v
KATA PENGANTAR... vi
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS... viii
ABSTRAK... ix
ABSTRACT... x
DAFTAR ISI... xi
DAFTAR GAMBAR... xiii
DAFTAR TABEL... xv
DAFTAR LAMPIRAN... xvi
BAB 1. PENDAHULUAN 1.1 Latar Belakang... 1
1.2 Tujuan Penelitian... 3
BAB II. TINJAUAN PUSTAKA... 4
2.1 Perkembangan Nanopartikel... 4
2.2 Nanopartikel Perak... 4
2.3 Green Synthesis Nanopartikel Perak... 5
2.4 Metode Kolorimetri Berbasis Nanopartikel Perak... 8
2.5 Efek Penambahan Tiga Senyawa Garam Anorganik pada Nanopartikel Perak... 9
2.6 Modifikasi Nanopartikel Perak Menggunakan Kitosan... 10
2.7 Karakterisasi Nanopartikel Perak... 11
2.8 Logam Berat... 14
2.9 Interaksi Larutan Analit Logam dengan Nanopartikel Perak Termodifikasi Kitosan... 17
2.10 Kerang Hijau (Perna viridis Linn.)... 18
BAB III. METODE PENELITIAN... 21
3.1 Lokasi dan Waktu Penelitian... 21
3.2 Alat... 21
3.3 Bahan... 21
3.4 Cara Kerja... 24
BAB IV. HASIL DAN PEMBAHASAN... 28
4.1 Green Synthesis Nanopartikel Perak... 28 4.2 Deteksi Larutan Analit Menggunakan Indikator Nanopartikel Perak
xii Universitas Indonesia
secara Kolorimetri... 30 4.3 Peningkatan Sensitivitas Nanopartikel Perak dengan Penambahan
NaCl 1 M, MgSO4 0,1 M dan KNO3 0,5 M... 33
4.4 Optimasi Waktu Penambahan NaCl 1 M... 37 4.5 Modifikasi Nanopartikel Perak dengan Kitosan 1%... 39 4.6 Deteksi Larutan Analit Logam Menggunakan Nanopartikel
Perak Termodifikasi Kitosan dengan Penambahan NaCl 1 M... 42 4.7 Pengujian Indikator Nanopartikel Perak Termodifikasi
Kitosan dengan Penambahan NaCl 1 M pada Sampel
Kerang Hijau yang Dicemari Logam Cu... 43 BAB V. KESIMPULAN DAN SARAN... 45
xiii Universitas Indonesia
DAFTAR GAMBAR
Gambar 2.1 Tanaman bisbul (Dyospyros discolor Willd.)... 6 Gambar 2.2 Mekanisme reduksi AgNO3 menjadi nanopartikel Ag
oleh geraniol pada ekstrak daun geranium... 7 Gambar 2.3 Struktur kitosan... 10 Gambar 2.4 Reaksi protonasi kitosan... 11 Gambar 2.5 Skema representasi osilasi permukaan plasmon (awan
elektron) dibawah efek zona elektromagnetik... 13 Gambar 2.6 Ilustrasi interaksi NPP termodifikasi ligan dengan analit.. 17 Gambar 2.7 Reaksi pengkelatan ion logam Cu2+ oleh kitosan... 18 Gambar 2.8 Kerang hijau (Perna viridis Linn.)... 19 Gambar 4.1. (a) larutan AgNO3 1 mM dan air rebusan daun bisbul;
(b) NPP yang terbentuk setelah 24 jam proses
biosintesis... 28 Gambar 4.2. Spektrum UV-Vis NPP hasil biosintesis menggunakan
larutan AgNO3 1 mM dan air rebusan daun bisbul
dengan rasio volume (10:1) 80:8 ml (v:v) selama 24
jam... 29 Gambar 4.3. Hasil pengamatan visual NPP terhadap larutan analit
berbagai konsentrasi selama 5 menit... 31 Gambar 4.4. Spektrum serapan NPP setelah direaksikan dengan
larutan analit: (a) Hg2+ dan (b) Cu2+... 32 Gambar 4.5. Grafik pengaruh konsentrasi larutan analit (a. Hg2+;
b.Cu2+) terhadap absorbansi NPP dan perubahan warna
larutan pada 422 nm... 33 Gambar 4.6. Penurunan absorbansi dan pergeseran λmaks NPP
setelah penambahan NaCl 1 M, MgSO4 0,1 M dan
KNO3 0,5 M... 34
Gambar 4.7. Hasil pengamatan visual (selama 5 menit) pengujian NPP terhadap larutan analit Hg2+ dengan penambahan:
(a) NaCl 1 M; (b) MgSO4 0,5 M; (c) KNO3 0,1 M... 35
Gambar 4.8. Hasil pengamatan visual (selama 5 menit) pengujian NPP terhadap larutan analit Cu2+ dengan penambahan:
(a) NaCl 1 M; (b) MgSO4 0,5 M; (c) KNO3 0,1 M... 36
Gambar 4.9. Hasil pengamatan visual pengujian NPP terhadap larutan analit Cu2+ dengan penambahan NaCl 1 M
setelah 15 menit... 36 Gambar 4.10. Perbandingan spektrum absorbansi NPP-NaCl A
(NaCl ditambahkan setelah NPP bereaksi dengan analit) dan NPP-NaCl B (NPP diaduk selama 15
menit dengan NaCl sebelum digunakan)... 37 Gambar 4.11. Pengujian terhadap larutan analit Hg2+ selama 5 menit
xiv Universitas Indonesia
NPP bereaksi dengan analit) dan (b) NPP-NaCl B (NPP diaduk selama 15 menit dengan NaCl sebelum
digunakan)... 38 Gambar 4.12. Pengujian terhadap larutan analit Cu2+ selama 5 menit
menggunakan: (a) NPP-NaCl A (NaCl ditambahkan setelah NPP bereaksi dengan analit) dan (b) NPP-NaCl B (NPP diaduk selama 15 menit dengan
NaCl sebelum digunakan)... 39 Gambar 4.13. Perbedaan warna hasil pengujian terhadap larutan analit
Cu2+ 0,1 ppm (kiri) dan 1 ppm (kanan) setelah 15 menit menggunakan NPP-NaCl B... 39 Gambar 4.14. Pengamatan visual dan spektrum serapan NPP selama
proses modifikasi dengan larutan kitosan 1%... 40 Gambar 4.15. Perbandingan nilai spectral bandwidth (SBW) NPP
dengan NPP termodifikasi kitosan selama 20 hari... 41 Gambar 4.16. Perbandingan spektrum serapan dan pengamatan visual
NPP termodifikasi kitosan sebelum dan setelah
pencampuran dengan NaCl... 42 Gambar 4.17. Pengujian terhadap larutan analit Cu2+ pada hasil
destruksi sampel kerang hijau menggunakan NPP
termodifikasi kitosan dengan penambahan NaCl 1 M... 43 Gambar 4.18. Spektrum serapan pengujian hasil destruksi sampel
(kerang hijau) dengan penambahan larutan analit Cu2+ berbagai konsentrasi NPP termodifikasi kitosan dengan
xv Universitas Indonesia
DAFTAR TABEL
Tabel 2.1. Ukuran partikel dan karakteristik spektrum
xvi Universitas Indonesia
DAFTAR LAMPIRAN
Lampiran 1. Hasil karakterisasi ukuran NPP menggunakan Particle
Size Analyzer (PSA)... 51 Lampiran 2. Gambar larutan analit Hg2+, Cd2+, Cu2+, Mn2+, Pb2+ dan
Zn2+ berbagai konsentrasi... 51 Lampiran 3. Gambar hasil pengujian NPP dengan larutan analit Pb2+ 52 Lampiran 4. Gambar hasil pengujian NPP dengan larutan analit Cd2+ 52 Lampiran 5. Gambar hasil pengujian NPP dengan larutan analit Mn2+ 52 Lampiran 6. Gambar hasil pengujian NPP terhadap larutan analit
Cd2+ dengan penambahan NaCl 1 M... 52 Lampiran 7. Gambar hasil pengujian NPP terhadap larutan analit
Mn2+ dengan penambahan NaCl 1 M... 53 Lampiran 8. Gambar hasil pengujian NPP terhadap larutan analit
Pb2+ dengan penambahan NaCl 1 M... 53 Lampiran 9. Gambar hasil pengujian NPP terhadap larutan analit
Zn2+ dengan penambahan NaCl 1 M... 53 Lampiran 10. Gambar hasil pengujian NPP terhadap larutan analit
Hg2+ dengan penambahan NaCl 1 M setelah 30 menit... 54 Lampiran 11. Spektrum serapan pengujian larutan analit Cu2+
menggunakan NPP dengan penambahan NaCl 1 M di
akhir deteksi... 54 Lampiran 12. Spektrum serapan pengujian larutan analit Hg2+
menggunakan NPP dengan penambahan NaCl 1 M di
akhir deteksi... 55 Lampiran 13. Gambar hasil pengujian NPP terhadap larutan analit
Cu2+, Hg2+, Pb2+, Mn2+, Zn2+ dan Cd2+ 1000 ppm
dengan penambahan MgSO4 0,5 M di akhir deteksi... 55
Lampiran 14. Spektrum serapan pengujian larutan analit Cu2+, Hg2+, Cd2+, Mn2+, Zn2+ dan Pb2+ 1000 ppm dengan
penambahan MgSO4 0,5 M di akhir deteksi... 56
Lampiran 15. Spektrum serapan pengujian larutan analit Cu2+ dengan
penambahan MgSO4 0,5 M di akhir deteksi... 56
Lampiran 16. Spektrum serapan pengujian larutan analit Hg2+ dengan
penambahan MgSO4 0,5 M di akhir deteksi... 57
Lampiran 17. Gambar hasil pengujian NPP terhadap larutan analit Cu2+, Hg2+, Pb2+, Zn2+, Mn2+ dan Cd2+ 1000 ppm
xvii Universitas Indonesia
Lampiran 18. Spektrum serapan pengujian larutan analit Cu2+ dengan
penambahan KNO3 0,1 M di akhir deteksi... 58
Lampiran 19. Spektrum serapan pengujian larutan analit Hg2+ dengan
penambahan KNO3 0,1 M di akhir deteksi... 58
Lampiran 20. Gambar hasil pengujian NPP dengan penambahan NaCl 1 M (pengadukan 15 menit) terhadap larutan analit
Zn2+,Cd2+, Pb, Mn2+, Cu2+ dan Hg2+ 1000 ppm... 59 Lampiran 21. Spektrum serapan pengujian NPP dengan penambahan
NaCl 1 M (pengadukan 15 menit) terhadap larutan
analit Zn2+, Cd2+, Pb, Mn2+, Cu2+ dan Hg2+ 1000 ppm.... 59 Lampiran 22. Spektrum serapan pengujian NPP dengan penambahan
NaCl 1 M (pengadukan 15 menit) terhadap larutan
analit Cu2+... 60 Lampiran 23. Spektrum serapan pengujian NPP dengan penambahan
NaCl 1 M (pengadukan 15 menit) terhadap larutan
analit Hg2+... 60 Lampiran 24. Perbandingan spektrum serapan NPP dengan NPP
termodifikasi kitosan saat 1, 6, 8 dan 20 hari... 61 Lampiran 25. Gambar hasil pengujian NPP termodifikasi kitosan
dengan penambahan NaCl 1 M (pengadukan 15 menit) terhadap larutan analit Pb2+, Mn2+, Zn2+, Cd2+, Cu2+
dan Hg2+ 1000 ppm... 62 Lampiran 26. Spektrum serapan pengujian NPP termodifikasi kitosan
dengan penambahan NaCl 1 M (pengadukan 15 menit) terhadap larutan analit Pb2+, Mn2+, Zn2+, Cd2+, Cu2+
dan Hg2+ 1000 ppm... 62 Lampiran 27. Gambar hasil pengujian NPP termodifikasi kitosan
dengan penambahan NaCl 1 M (pengadukan 15 menit)
terhadap larutan analit Hg2+ selama 5 menit... 63 Lampiran 28. Gambar spektrum serapan pengujian NPP termodifikasi
Kitosan dengan penambahan NaCl 1 M (pengadukan
15 menit) terhadap larutan analit Hg2+ selama 5 menit... 63 Lampiran 29. Gambar hasil pengujian NPP termodifikasi kitosan
dengan penambahan NaCl 1 M (pengadukan 15 menit) terhadap larutan analit Cu2+ selama 5 menit dan15
menit... 64 Lampiran 30. Gambar hasil pengujian NPP termodifikasi kitosan
dengan penambahan NaCl 1 M (pengadukan 15 menit)
terhadap larutan analit Cu2+ selama 15 menit... 64 Lampiran 31. Kurva kalibrasi hasil pengujian terhadap larutan analit
Cu2+ menggunakan larutan indikator (NPP
Termodifikasi kitosan dengan penambahan NaCl 1 M).. 65 Lampiran 32. Perhitungan LOD dan LOQ larutan indikator (NPP
termodifikasi kitosan dengan penambahan NaCl 1 M)
xviii Universitas Indonesia
Lampiran 33. Rangkuman hasil pengujian larutan indikator terhadap
larutan analit Hg2+ dan Cu2+... 67
Lampiran 34. Hasil penimbangan sampel kerang hijau... 67
Lampiran 35. Gambar hasil destruksi sampel kerang hijau tanpa Penambahan (nonspiked) dan dengan penambahan larutan analit Cu2+0,1; 1; 10; 20; 30 ppm... 68
Lampiran 36. Determinasi daun bisbul.(Diospyros discolor)... 69
Lampiran 37. Sertifikat analisis Kitosan... 70
Lampiran 38. Sertifikat analisis NaCl... 71
Lampiran 39. Sertifikat analisis Cu(NO3)2... 73
Lampiran 40. Sertifikat analisis Pb(NO3)2... 74
Lampiran 41. Sertifikat analisis MnSO4.H2O... 75
Lampiran 42. Spesifikasi CuCl2.2H2O... 76
Lampiran 43. Spesifikasi HgCl2... 77
Lampiran 44. Spesifikasi ZnCl2... 78
Lampiran 45. Spesifikasi MgSO4.7H2O... 79
1 Universitas Indonesia
BAB 1 PENDAHULUAN
I.1 Latar Belakang
Metode kolorimetri berbasis nanopartikel logam merupakan suatu metode deteksi yang mudah digunakan, biaya rendah, cepat dan tidak memerlukan alat yang rumit (Wang, Luconi, Adriana, & Liliana, 2010). Penggunaan nanopartikel perak (NPP) memiliki beberapa keunggulan dibandingkan nanopartikel emas karena sifat optis NPP yang lebih baik, meskipun NPP memiliki kestabilan kimia yang lebih rendah dibanding nanopartikel emas. Oleh karena itu, modifikasi NPP selain ditujukan untuk fungsionalisasi sebagai indikator kolorimetri, dilakukan pula untuk meningkatkan kestabilan NPP selama penyimpanan (Caro, Castillo, Klippstein, Pozo, & Zaderenko, 2010).
Kolorimetri berbasis nanopartikel logam memanfaatkan agregasi nanopartikel untuk menghasilkan perubahan warna (Caro, Castillo, Klippstein, Pozo, & Zaderenko, 2010). Agen pengagregasi yang ditambahkan pada NPP dapat menyebabkan penggabungan NPP serta meningkatkan interaksinya. Hal tersebut menghasilkan resonansi plasmon yang besar pada permukaan NPP sehingga mendorong perbaikan sifat indikator NPP dalam mendeteksi analit (Dong, Gu, Kang, Yuan, & Wu, 2010). Salah satu analit yang dapat dideteksi menggunakan metode kolorimetri berbasis NPP adalah ion logam berat. Namun sensitivitas indikator NPP terhadap ion logam berat masih rendah, di mana konsentrasi ion logam yang dapat memberikan perubahan warna masih terlalu besar(Bakir, 2011; Handayani, 2011).
Penelitian sebelumnya telah berhasil mengembangkan sintesis nanopartikel perak yang lebih ramah lingkungan (green synthesis) menggunakan tanaman bisbul (Diospyros discolor Willd.) dan mengaplikasikannya sebagai indikator kolorimetri ion logam Cu2+ dan Zn2+ pada konsentrasi 1000 ppm (Handayani, 2011; Bakir, 2011). Kemampuan NPP dalam mendeteksi ion logam berat pada konsentrasi yang besar menyebabkan perlu dilakukan peningkatan sensitivitas agar dapat mendeteksi ion logam pada konsentrasi yang rendah, mengingat beberapa logam berat bersifat toksik pada konsentrasi rendah.
2 Universitas Indonesia
Penelitian mengenai efek anion Cl-, SO42- dan NO3- terhadap agregasi NPP
telah dilakukan oleh Dong, Gu, Kang, Yuan dan Wu (2010). Dari ketiga jenis anion tersebut, Cl- memberikan efek agregasi yang terbesar. Penelitian yang dilakukan oleh Dong, Gu dan Liu (2012) menyatakan bahwa Cl- memiliki afinitas yang lebih kuat terhadap permukaan nanopartikel dibandingkan SO42- dan NO3-.
Namun, penggunaan ketiga anion tersebut untuk meningkatkan sensitivitas indikator NPP dalam mendeteksi logam berat belum pernah dilakukan. Oleh karena itu, dalam penelitian ini dilakukan penambahan ketiga jenis anion tersebut dalam bentuk garam NaCl, MgSO4 dan KNO3 untuk melihat pengaruh ketiganya
terhadap peningkatan sensitivitas indikator NPP dalam mendeteksi ion logam berat. Selanjutnya, anion dalam bentuk garam yang mampu meningkatkan sensitivitas pengujian secara signifikan dipilih sebagai agen peningkat sensitivitas. Pemanfaatan kitosan untuk menstabilkan nanopartikel perak telah diteliti oleh Twu, Chen dan Shih (2008). Wu, Lin, Chung dan Huan (2010) juga menggunakan kitosan untuk menstabilkan dan fungsionalisasi NPP yang digunakan sebagai sensor pendeteksi ion logam Hg2+. Sugunan, Thanachayanont, Dutta dan Hilborn (2005) memanfaatkan kitosan dengan tujuan yang sama pada nanopartikel emas untuk mendeteksi ion logam Zn2+ dan Cu2+. Oleh karena itu, pada penelitian ini digunakan kitosan sebagai modifikator NPP untuk fungsionalisasi NPP dalam mendeteksi logam berat pada sampel dan diharapkan dapat meningkatkan kestabilan NPP selama penyimpanan.
Logam berat memiliki sifat yang cenderung mengalami bioakumulasi dalam tubuh. Hal ini menjadi berbahaya apabila paparannya dalam tubuh manusia terjadi terus menerus (Darmono, 2001). Paparan tersebut dapat terjadi melalui makanan yang tercemar logam berat. Salah satu jenis sumber makanan dengan nilai gizi tinggi, digemari masyarakat namun berisiko tercemar logam berat dengan konsentrasi tinggi adalah kerang (Suharsono, 1999). Dibalik nilai gizinya yang tinggi, kerang juga memiliki kemampuan mengabsorbsi logam berat karena habitat hidupnya yang menetap dan sifat bioakumulatifnya terhadap logam (Darmono, 2001). Dari berbagai jenis kerang laut, kerang hijau (Perna viridis)
3 Universitas Indonesia
merupakan jenis kerang yang mengalami peningkatan volume produksi sangat besar pada tahun 2010 di Indonesia (Direktorat Jendral Perikanan Tangkap, 2011).
Beberapa penelitian mengenai evaluasi kandungan logam berat pada kerang hijau telah dilakukan. Sebuah penelitian di Hongkong menemukan adanya konsentrasi logam Cd, Pb, Mn, Cu dan Hg yang tinggi pada kerang hijau yang diambil dari beberapa lokasi (Liu & Kueh, 2005). Selain itu, kerang hijau yang diperoleh dari perairan Muara Angke pun memiliki kandungan logam Pb, Cd dan Cu yang melewati batas (Nurjanah, Hartanti, & Nitibaskara, 1999). Oleh karena itu, NPP dalam penelitian ini diaplikasikan pada kerang hijau yang telah didestruksi dan dicemari ion logam tertentu untuk menganalisis kemampuan indikator NPP dalam mendeteksi logam pencemar pada kerang hijau.
1.2Tujuan Penelitian
1. Mengetahui selektivitas indikator NPP (nanopartikel perak) dalam mendeteksi larutan analit logam berat.
2. Meningkatkan sensitivitas indikator NPP dalam mendeteksi larutan analit logam berat.
3. Menguji kemampuan NPP termodifikasi kitosan 1% dalam mendeteksi logam pencemar pada sampel kerang hijau (Perna viridis Linn.).
BAB 2
TINJAUAN PUSTAKA
2.1 Perkembangan Nanopartikel
Kemajuan terbaru dalam nanoteknologi memungkinkan pengembangan metode deteksi dengan sensitivitas tinggi dan selektif dibandingkan dengan teknologi deteksi konvensional (Caro, Castillo, Klippstein, Pozo, & Zaderenko, 2010). Kata ‘nanopartikel’ digunakan untuk mendeskripsikan partikel dengan ukuran antara 1 sampai 100 nm. Dalam rentang ukuran ini, sifat fisik, kimia dan biologi nanopartikel berubah dari sifat atom individual ataupun molekulnya (Nagarajan & Hatton, 2008).
Nanopartikel dapat dibuat melalui pendekatan sejumlah rute sintesis berbasis fase gas, liquid atau fase padat. Nanopartikel yang disintesis harus dimodifikasi permukaannya pada beberapa kasus untuk menstabilkan nanopartikel karena nanoskala menyebabkan nanopartikel sangat reaktif secara kimia dan/atau agregasi secara fisik. Nanopartikel menyediakan building block yang fundamental untuk bermacam-macam aplikasi nanoteknologi (Nagarajan & Hatlon, 2008).
Pengembangan nanoteknologi tidak hanya meliputi disiplin ilmu fisika dan kimia saja tetapi juga meliputi disiplin ilmu biologi. Berdasarkan perkembangan aplikasi nanoteknologi yang sangat pesat, terdapat ketertarikan diantara para peneliti untuk mengembangkan nanoteknologi dalam ketiga disiplin ilmu paling penting ini (Leela & Vivekananda, 2008). Pengembangan tersebut telah berhasil merevolusionerkan sistem pangan dan pertanian, kesehatan, tekstil, material, teknologi informasi dan komunikasi serta sektor energi di sejumlah negara berkembang (Gumbira-Sa’id, Nurul, Rosadi, Rahayu, & Evalia, 2009).
2.2 Nanopartikel Perak
Penggunaan nanopartikel logam mulia mengalami perkembangan yang cepat untuk aplikasi dalam bidang katalisis, biosensoring, elektronik dan optik. Di antara logam mulia yang efektif untuk dikembangkan sebagai nanopartikel, yaitu Ag, Pt, Au, dan Pd, nanopartikel perak (NPP) lah yang memiliki peran signifikan dalam ruang lingkup biologi dan obat (Moores & Goettmann, 2006; Leela &
Vivekananda, 2008). Dalam pengujian kolorimetri, NPP memiliki beberapa keunggulan dibanding nanopartikel emas karena NPP memiliki koefisien ekstingsi yang lebih tinggi dibanding nanopartikel emas pada ukuran yang sama. Namun, kekurangan dari NPP adalah kestabilan kimianya yang rendah sehingga pengembangan terbaru NPP meliputi juga usaha untuk melindungi NPP secara efisien sehingga stabilitas kimianya meningkat (Caro, Castillo, Klippstein, Pozo, & Zaderenko, 2010; Wang, Luconi, Adriana, & Liliana, 2010).
2.3 Green Synthesis Nanopartikel Perak
Nanopartikel perak dapat disintesis dengan beberapa metode. Teknik pembuatan dapat dibagi menjadi dua kategori: Pendekatan ‘bottom-up’ (dimulai dari molekular yang dikembangkan menjadi nanopartikel) dan ‘top-down’
(reduksi ukuran partikel menjadi nanopartikel). Namun demikian, metode fisika
(top-down) dan kimia (bottom-up) tersebut penuh dengan masalah seperti
penggunaan pelarut yang berbahaya, limbah yang dihasilkan dan memerlukan energi yang tinggi (Thakkar, Snehit, Mhatre, & Parikh, 2011; Nagarajan & Hatton, 2008).
Sintesis nanopartikel dengan ekstrak tanaman sekarang ini sedang mengalami eksploitasi (Leela & Vivekananda, 2008). Prinsip kerja tanaman dalam membentuk nanopartikel perak adalah dengan kemampuan tanaman dalam mereduksi AgNO3 menjadi nanopartikel Ag (Kumar, et al., 2008). Tanaman atau
ekstrak tanaman merupakan rute sintesis nanopartikel perak yang lebih ramah lingkungan (green synthesis). Kontrol terhadap bentuk dan ukuran nanopartikel yang dihasilkan sangat mudah dengan penggunaan tanaman (Kumar, et al., 2008).
2.3.1 Air Rebusan Daun Bisbul (Diospyros discolor Willd.) untuk Green
Synthesis Nanopartikel Perak
Indonesia sebagai negara yang kaya dengan sumber daya alam dan keanekaragaman hayati memiliki potensi untuk penelitian yang terkait dengan eksplorasi pemanfaatan tumbuhan sebagai agen sintesis nanopartikel yang lebih ramah lingkungan (green synthesis). Jenis-jenis tumbuhan tertentu diduga
memiliki senyawa kimia yang berperan sebagai agen pereduksi walaupun belum semua mekanisme diketahui (Handayani, 2011).
Handayani (2011) telah mengamati potensi delapan jenis air rebusan tumbuhan sebagai agen pereduksi perak serta variasi beberapa faktor yang mempengaruhi proses green synthesis tersebut. Dari delapan tanaman yang diteliti, yaitu Azadiracta indica (mimba), Centella asiatica (pegagan), Cerbera
manghas (bintaro), Dillenia indica (dillenia), Diospyros discolor (bisbul),
Murraya paniculata (kemuning), Pometia pinnata (matoa) dan Phalleria
macrocarpa (mahkota dewa), air rebusan daun bisbul menghasilkan NPP paling
banyak dan paling cepat. Penggunaan air rebusan daun kering bisbul cenderung lebih baik terkait tingkat kestabilan dan kecenderungan keseragaman ukuran nanopartikel yang dihasilkan.
[Sumber: Mark W, 1982]
Gambar 2.1. Tanaman bisbul (Dyospyros discolor Willd.)
Berikut adalah klasifikasi dari tanaman bisbul (National Plant Data Center, 2000). Kingdom : Plantae Subkingdom : Tracheobionta Superdivisi : Spermatophyta Divisi : Magnoliophyta Kelas : Magnoliopsida Subkelas : Dilleniidae Orde : Ebenales
Family : Ebenaceae Genus : Diospyros L.
Spesies : Diospyros discolor Willd.
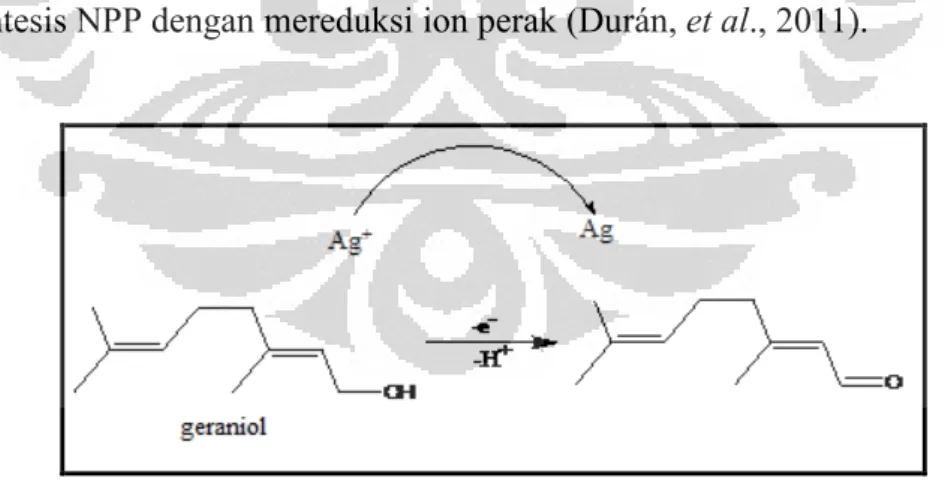
Hasil pengujian secara kualitatif terhadap kandungan metabolit sekunder pada air rebusan daun kering bisbul yang dilakukan Handayani (2011) menunjukkan hasil positif pada golongan terpenoid, fenol dan saponin. Air rebusan daun kering mahkota dewa yang tidak mampu menghasilkan NPP berdasarkan pengujian yang dilakukan juga menunjukkan kandungan metabolit sekunder yang sama seperti daun bisbul, namun tidak mengandung terpenoid. Genus Diospyros diketahui kaya akan terpenoid golongan triterpen (Mallavadhani, Panda, & Rao, 1998). Penelitian tentang pengaruh terpenoid pada pembentukan NPP telah dilakukan oleh Shankar, Ahmad dan Sastry (2003) menggunakan ekstrak daun geranium. Ekstrak daun geranium diketahui mengandung terpenoid jenis sitronelol dan geraniol dalam jumlah besar. Diduga, gugus hidroksil yang ada pada terpenoid tersebut dioksidasi menjadi gugus karbonil dan oleh karena itu berperan sebagai agen pereduksi ion perak. Untuk mendukung kesimpulan tersebut, Safaepour (2009) menggunakan ekstrak geraniol untuk mereduksi ion perak dan menemukan bahwa geraniol memiliki kemampuan mensintesis NPP dengan mereduksi ion perak (Durán, et al., 2011).
[Durán, et al., 2011]
Gambar 2.2. Mekanisme reduksi AgNO3 menjadi nanopartikel Ag oleh geraniol
pada ekstrak daun geranium
Berdasarkan penelitian tersebut, besar kemungkinan adanya peran terpenoid pada daun bisbul dalam proses pembentukan NPP. Namun, untuk mengetahui
senyawa apa yang benar-benar berperan perlu dilakukan isolasi metabolit sekunder pada tanaman tersebut kemudian mengujinya untuk green synthesis NPP (Shankar, Ahmad, & Sastry, 2003).
2.4 Metode Kolorimetri Berbasis Nanopartikel Perak
Selama ini, proses identifikasi dan analisis logam yang mencemari lingkungan masih menggunakan peralatan yang kurang praktis untuk diaplikasikan di lapangan. Salah satu pengembangan untuk pendekatan tersebut adalah kolorimetri berbasis nanopartikel logam. Sifat unik resonansi plasmon pada permukaan nanopartikel logam sangat berguna dalam analisis biomolekular dan ion logam karena mudah digunakan, sensitivitas tinggi, biaya yang rendah, cepat dan tidak perlu menggunakan alat yang rumit (Wang, Luconi, Adriana, & Liliana, 2010).
Prinsip dari indikator kolorimetri berbasis NPP adalah kemampuan NPP beragregasi dan terjadinya pergeseran LSPR (Localized Surface Plasmon
Resonance). Ketika nanopartikel beragregasi, agregrat tersebut akan menginduksi
penggabungan plasmon interpartikel sehingga akan menginduksi pergeseran LSPR yang bertanggung jawab terhadap pembentukan pita ekstingsi yang kuat oleh nanopartikel (Caro, Castillo, Klippstein, Pozo, & Zaderenko, 2010). Efek ini telah dieksplorasi untuk digunakan sebagai basis indikator kolorimetri yang mudah, sensitivitas tinggi dan biaya rendah, yang telah banyak diaplikasikan untuk mendeteksi molekul kecil, DNA, protein, ion logam yang berbahaya dan polutan (Caro, Castillo, Klippstein, Pozo, & Zaderenko, 2010).
Penggunaan indikator kolorimetri berbasis NPP untuk deteksi ion logam telah banyak diaplikasikan dengan memodifikasi permukaan NPP menggunakan ligan yang sesuai untuk meningkatkan sensitivitas maupun selektivitas NPP (Caro, Castillo, Klippstein, Pozo, & Zaderenko, 2010; Wang, Luconi, Adriana, & Liliana, 2010). Beberapa ligan yang dapat digunakan adalah kitosan untuk deteksi ion Cu2+ dan Zn2+ (Sugunan, Thanachayanont, Dutta, & Hilborn, 2005), L-sistein untuk deteksi ion Zn2+ (Handayani, 2011), PVA untuk deteksi ion Cu2+(Bakir, 2011) dan glutation untuk deteksi ion Ni2+ (Li, Cui, & Han, 2009).
2.5 Efek Penambahan Tiga Senyawa Garam Anorganik pada Nanopartikel Perak
Beberapa aplikasi nanopartikel memerlukan agregasi atau penggabungan nanopartikel dalam satu, dua atau tiga dimensi, seperti atom dan molekul yang bergabung menjadi suatu zat (Nagarajan & Hatton, 2008). Salah satu aplikasi yang memanfaatkan agen pengagregasi adalah NPP yang digunakan dalam bidang kolorimetri. Terbentuknya NPP hasil sintesis ditandai dengan perubahan warna larutan dari bening menjadi kuning kecoklatan akibat eksitasi vibrasi plasmon pada permukaan NPP (Shankar, Rai, Ahmad, & Murali, 2004). Apabila terjadi agregasi pada NPP, warna NPP akan berubah menjadi warna agregrat yang terbentuk (Solomon, Bahadory, Jeyarajasingam, Rutkowsky, & Boritz, 2007).
Agen pengagregasi yang ditambahkan pada NPP hasil sintesis kimiawi dapat menyebabkan penggabungan NPP dan meningkatkan interaksinya. Hal tersebut menghasilkan resonansi plasmon yang besar pada permukaan NPP sehingga mendorong perbaikan sifat permukaan NPP. Agregasi yang terjadi ditandai dengan penurunan nilai absorbansi NPP dan pergeseran λmaks ke arah
panjang gelombang yang lebih tinggi (Dong X., Gu, Kang, Yuan, & Wu, 2010; Caro, Castillo, Klippstein, Pozo, & Zaderenko, 2010). Agen pengagregasi yang sering digunakan adalah beberapa anion seperti Cl-, SO42- dan NO3- yang
ditambahkan dalam bentuk senyawa garam anorganik. Berdasarkan penelitian yang telah dilakukan, diperoleh urutan afinitas anion terhadap permukan NPP yaitu Cl-> NO3- >SO42-. Afinitas relatif Cl- lebih kuat dibanding anion lain pada
permukaan NPP dan Cl- kemungkinan memiliki interaksi elektrostatik terhadap NPP yang lebih besar dibanding NO3- dan SO42- (Dong, Gu, & Liu, 2012).
Rezankaa, Rezankováb, Matejkaa dan Klar (2010) telah meneliti pengaruh konsentrasi NaCl yang ditambahkan terhadap agregasi nanopartikel emas termodifikasi sistein. Hasil penelitian tersebut mengemukakan bahwa semakin tinggi konsentrasi NaCl yang ditambahkan, maka penurunan nilai absorbansi nanopartikel akan semakin meningkat, yang berarti tingkat agregasi yang terjadi semakin besar. Adanya konsentrasi NaCl yang tinggi akan menyebabkan nanopartikel saling mendekat hingga dengan adanya induksi, seperti interaksi
dipol, misalnya ikatan van der Waals atau ikatan hidrogen, akan menyebabkan terjadinya agregasi (Sperling & Parak, 2010).
2.6. Modifikasi Nanopartikel Perak menggunakan Kitosan
Modifikasi pada permukaan nanopartikel menggunakan suatu ligan dilakukan untuk meningkatkan kestabilan serta menentukan interaksi nanopartikel dengan analit yang diuji. Molekul ligan yang terikat pada permukaan nanopartikel dapat mencegah agregasi nanopartikel. Molekul ligan berikatan dengan permukaaan partikel dengan beberapa interaksi, baik adsorpsi kimiawi, interaksi elektrostatik atau interaksi hidrofobik (Sperling & Parak, 2010).
Partikel ligan yang menstabilkan nanopartikel dapat terdiri dari rantai molekular yang inert atau memiliki gugus fungsional. Salah satu ligan yang digunakan untuk modifikasi permukaan nanopartikel dapat berasal dari biomolekul. Contoh biomolekul yaitu lemak, peptida, gula maupun polimer alami seperti polisakarida (Sperling & Parak, 2010).
Kitosan, biopolimer polisakarida hasil deasetilasi dari kitin yang merupakan polisakarida alami kedua terbanyak di dunia, diketahui memiliki kemampuan untuk menstabilkan nanopartikel perak (Twu, Chen, & Shih, 2008). Kitosan merupakan polimer linear dari glukosamin atau poli-β -(1,4)-2-amino-2-deoksi-D-glukosa dengan bobot molekul antara 10.000-1.000.000 yang memiliki banyak gugus amino reaktif sehingga memungkinkan untuk mengalami modifikasi kimiawi (Dutta, Dutta, & Tripathi, 2004; Rowe, Sheskey, & Quinn, 2009).
Gambar 2.3. Struktur kitosan
O H O N H2 O H O O O H O N H2 O H O O H O N H2 O H O n
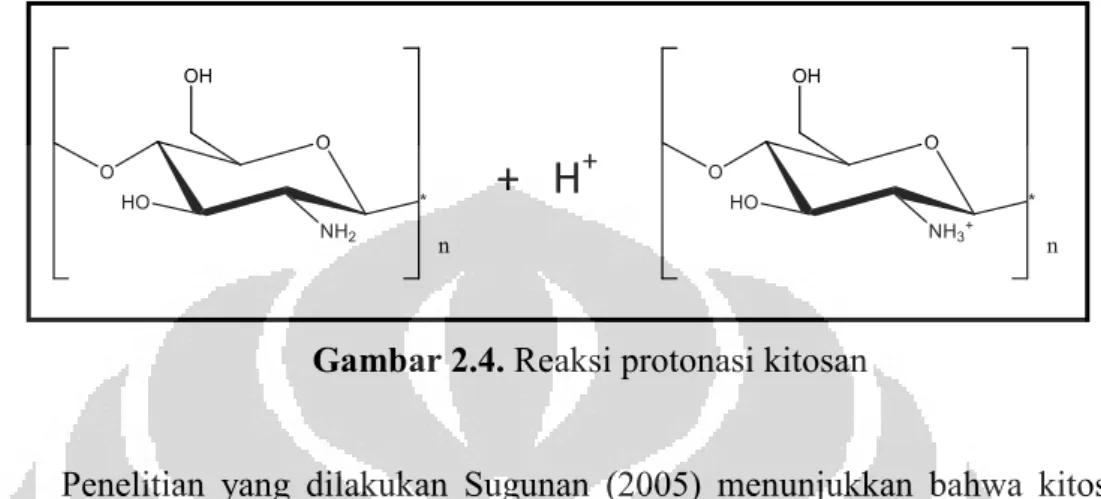
Kitosan tidak larut dalam pelarut organik, dalam asam dengan konsentrasi yang tinggi, dalam basa, dan air dengan pH ≥ 6. Kitosan larut dalam asam asetat, yang memfasilitasi terjadinya protonasi gugus amino (Terbojevich & Muzzarelli, 2004).
Gambar 2.4. Reaksi protonasi kitosan
Penelitian yang dilakukan Sugunan (2005) menunjukkan bahwa kitosan yang ditambahkan pada permukaan nanopartikel emas mampu menghasilkan kestabilan berdasarkan efek penolakan sterik pada permukaan nanopartikel. Selain itu, kitosan juga dapat digunakan untuk fungsionalisasi nanopartikel emas sebagai sensor ion logam Cu2+ dan Zn2+ berdasarkan kemampuannya dalam mengkelat logam. Wu, Lin, Chun dan Huan (2010) juga mengemukakan bahwa kitosan menciptakan efek penolakan sterik pada NPP yang diperoleh dari hasil sintesis kimiawi dan dapat digunakan untuk fungsionalisasi NPP sebagai sensor ion logam Hg2+ secara kolorimetri. Kitosan memiliki tiga gugus reaktif yaitu satu gugus amino serta dua gugus hidroksil, masing-masing pada posisi C-2, C-3 dan C-6 yang memungkinkan dapat terjadi pengkelatan ion logam (Shahidi, Arachchi, & Jeon, 1999).
2.7 Karakterisasi Nanopartikel Perak
Nanopartikel perak yang disintesis dapat dikarakterisasi menggunakan spektrofotometer UV-Vis sementara ukuran nanopartikel yang dihasilkan dapat diketahui menggunakan PSA (Particle Size Analyzer) (Harmami, Sondari, & Haryono, 2008). Bentuk atau gugus penyusun nanopartikel hasil sintesis dapat dikarakterisasi menggunakan XRD (X-ray diffraction), FTIR (Forier Transform
Infrared) (Shankar, Rai, Ahmad, & Murali, 2004), AFM (Atomic Force
O O HO NH2 * OH n O O HO NH3+ * OH n
+ H
+Microscope), SERS (Surface Enhanced Raman Spectroscopy) (Kumar & Yadav, 2009) dan SEM (Scanning Electron Microscope) (Leela & Vivekanandan, 2008) sedangkan TEM (Transmission Electron Microscope) dapat mengkarakterisasi ukuran dan bentuk nanopartikel (Patakfalvi, Virányi, & Dékány, 2004).
2.7.1 Spektrofotometer UV-Vis
Spektrum UV-Vis merupakan hasil interaksi antara radiasi elektromagnetik (REM) dengan molekul. REM merupakan bentuk energi radiasi yang mempunyai sifat gelombang dan partikel (foton). REM mempuyai vektor listrik dan vektor magnit yang bergetar dalam bidang-bidang tegak lurus satu sama lain dan masing-masing tegak lurus pada arah perambatan radiasi (Harmita, 2006).
Senyawa anorganik yang memiliki gugus kromoforik (gugus fungsional yang mengabsorpsi radiasi ultraviolet dan tampak jika mereka diikat oleh senyawa-senyawa yang bukan pengabsorpsi (auksokrom)) umumnya melibatkan beberapa atom misalnya MnO4- atau CrO72- atau dapat juga hanya melibatkan
atom tunggal yang memiliki d elektron terluar yang tidak lengkap. Spektrum serapan senyawa ini merupakan hasil dari proses transfer muatan dimana suatu elektron dipindahkan dari ion negatif menuju ion positif. Spektrum seperti ini akan mengalami perubahan dengan perubahan gugus pengompleks (Harmita, 2006).
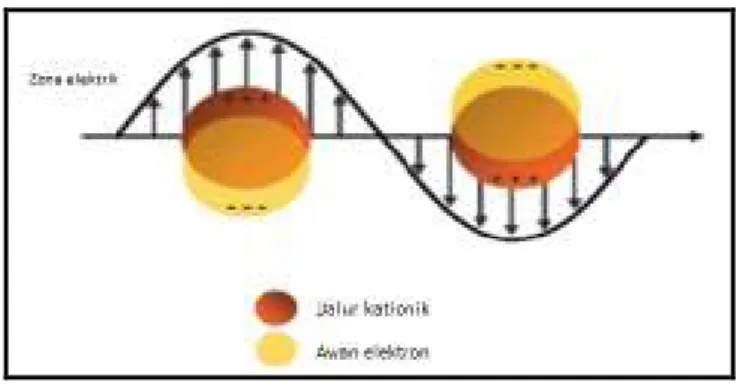
Seperti telah dijelaskan di atas, spektrofotometer UV-Vis digunakan untuk mengkonfirmasi apakah nanopartikel yang disintesis telah terbentuk. NPP memiliki absorpsi yang kuat pada panjang gelombang antara 400 hingga 500 nm. Interaksi antara medan elektromagnetik cahaya yang berosilasi dengan nanopartikel logam menyebabkan osilasi dalam penghantaran elektron pada permukaan nanopartikel menuju daerah kationik. Frekuensi cahaya ketika proses tersebut mengalami resonansi dikenal sebagai LSPR (Localized Surface Plasmon
Resonance) (Solomon, Bahadory, Jeyarajasingam, Rutkowsky, & Boritz, 2007;
[Sumber: Caro, Castillo, Klippstein, Pozo, & Zaderenko, 2010]
Gambar 2.5. Skema representasi osilasi plasmon (awan elektron) dibawah efek zona elektromagnetik
Panjang gelombang dari absorbansi plasmon maksimum dapat digunakan untuk memprediksikan ukuran partikel. Pada umumnya, semakin besar ukuran partikel maka puncak serapan akan bergeser ke arah panjang gelombang yang lebih besar dan puncak yang terbentuk lebih lebar. Sedangkan nilai spectral
bandwidth (SBW) yang merupakan lebar spektrum serapan pada setengah puncak
maksimum (Keppy & Allen, 2008) menunjukkan distribusi ukuran nanopartikel. Semakin rendah nilai SBW (semakin sempit) maka ukuran nanopartikel semakin terdistribusi merata (homogen). Hubungan antara ukuran partikel dengan panjang gelombang maksimum ditunjukkan pada Tabel 2.1 (Solomon, Bahadory, Jeyarajasingam, Rutkowsky, & Boritz, 2007).
Tabel 2.1. Ukuran partikel dan karakteristik spektrum nanopartikel perak
Ukuran Partikel (nm) λ max (nm) Spectral Bandwidth (nm) 10-14 395-405 50-70 35-50 420 100-110 60-80 438 140-150
2.8 Logam Berat
Logam berat terdiri dari berbagai macam elemen dengan sifat kimia dan fungsi biologi yang bervariasi (Raikwar, Kumarh, Singh, & Sing, 2008). Kata logam berat memiliki arti elemen logam yang memiliki densitas tinggi (≥ 5 gcm
-3
), toksik dan merupakan komponen alami pada lapisan kulit bumi. Logam berat tidak dapat didegradasi atau dihancurkan (Darmono, 2001).
Logam berat dapat diklasifikasikan berdasarkan pengaruhnya terhadap kesehatan tubuh sebagai berikut:
• Logam esensial
Logam ini disebut sebagai mikronutrien namun toksik jika konsentrasinya terlalu tinggi. Contoh: Cu, Zn dan Mn
• Logam dengan toksisitas tinggi
Logam jenis ini sangat toksik pada konsentrasi rendah. Contoh: Hg, Cd dan Pb (Raikwar, Kumarh, Singh, & Sing, 2008).
2.8.1 Tembaga (Cu)
Tembaga merupakan substansi esensial pada tubuh manusia yang dibutuhkan pada konsentrasi yang rendah. Tembaga dapat masuk dalam tubuh manusia melalui udara yang dihirup, minuman, makanan atau kontak kulit dengan tanah, air dan bahan-bahan yang mengandung tembaga. Paparan tembaga dalam konsentrasi yang tinggi dapat menyebabkan iritasi pada hidung, mulut, mata dan menyebabkan sakit kepala, mual dan muntah. Paparan yang berlangsung lama dapat membahayakan hati dan ginjal, bahkan dapat menyebabkan kematian (Division of Toxicology, 2004).
2.8.2 Merkuri (Hg)
Ion merkuri menyebabkan pengaruh toksik karena terjadinya proses presipitasi protein, menghambat aktivitas enzim dan bertindak sebagai bahan yang korosif. Tiga bentuk merkuri yang toksik terhadap manusia ialah merkuri murni, bentuk garam anorganik dan bentuk organik. Bentuk garam anorganik Hg dapat berbentuk merkuri (Hg2+) dan bentuk merkuro (Hg+), dimana bentuk garam
merkuri lebih toksik daripada merkuro. Bentuk organik Hg seperti aril, alkil, dan alkoksi alkil sangat beracun di antara bentuk garam lainnya.
Selama kurun waktu beberapa tahun, merkuri telah banyak digunakan untuk pengobatan, bidang pertanian dan industri. Bidang pengobatan telah menggunakan merkuri sejak abad ke-15, dimana Hg digunakan untuk pengobatan sifilis. Kalomel (HgCl) digunakan sebagai pembersih luka sampai diketahui bahwa bahan tersebut beracun sehingga tidak digunakan lagi. Komponen merkuri organik digunakan untuk obat diuretik sampai bertahun-tahun dan masih banyak lagi merkuri digunakan sebagai bahan untuk kosmetik (Darmono, 2001).
2.8.3 Timbal (Pb)
Selain dalam bentuk logam murni, timbal dapat ditemukan dalam bentuk senyawa anorganik dan senyawa organik. Semua bentuk Pb tersebut berpengaruh sama terhadap toksisitas pada manusia. Walaupun pengaruh toksisitas akut agak jarang dijumpai, tetapi pengaruh toksisitas kronis paling sering ditemukan. Pengaruh toksisitas kronis ini sering dijumpai pada pekerja di pertambangan dan pabrik pemurnian logam, pabrik mobil (proses pengecatan), penyimpanan bakteri, percetakan, pelapisan logam dan pengecatan sistem semprot.
Timbal adalah logam toksik yang bersifat kumulatif dan mempengaruhi berbagai sistem dalam tubuh, diantaranya sistem hemopoietik, sistem saraf pusat dan tepi, ginjal, gastrointestinal, sistem kardiovaskular, sistem reproduksi dan sistem endokrin, serta disfungsi ginjal (Darmono, 2001).
2.8.4 Kadmium (Cd)
Sumber utama kadmium dalam udara adalah berasal dari pembakaran batu bara atau minyak bumi. Efek akut inhalasi kadmium dengan konsentrasi tinggi dalam tubuh manusia dapat menyebabkan iritasi pada paru-paru. Inhalasi kronik dan paparan melalui oral dapat merusak ginjal, termasuk menyebabkan proteinuria, pengurangan laju filtrat glomerulus dan meningkatkan frekuensi pembentukan batu ginjal. Studi toksisitas kadmium pada hewan menunjukkan peningkatan kanker paru pada inhalasi jangka panjang. EPA telah
mengklasifikasikan kadmium sebagai logam yang berpotensi karsinogen pada manusia (U.S. Environmental Protection Agency, 2000).
2.8.5 Zink (Zn)
Dibanding beberapa ion logam lain dengan sifat kimia yang sama, zink relatf tidak berbahaya. Zink merupakan elemen esensial yang dibutuhkan manusia dalam jumlah kecil. Makanan biasanya mengandung zink sekitar 2 ppm - 29 ppm. Zink juga banyak terdapat dalam air minum. Kontaminasi pada air minum dapat terjadi dari wadah yang mengandung logam atau dari pipa air yang dilapisi zink.
RDAs (Recommended Dietary Allowances) untuk asupan harian zink adalah 11 mg/hari untuk pria dan 8 mg/hari untuk wanita. Konsumsi zink yang berlebihan, baik dari makanan, minuman, atau suplemen, dapat menyebabkan keram perut, mual dan muntah. Efek jangka panjang dapat menyebabkan anemia dan merusak pankreas (Plum, Rink, & Haase, 2010; Division of Toxicology, 2005).
2.8.6 Mangan (Mn)
Mangan merupakan salah satu elemen esensial yang dibutuhkan untuk fungsionalisasi berbagai enzim dalam tubuh makhluk hidup (contoh: mangan superoksida dismutase, piruvat karboksilase) dan dapat mengaktifkan enzim lainnya (contoh: kinase, dekarboksilase, transferase dan hidrolase). Efek negatif mangan pada manusia dapat terjadi karena defisiensi atau konsumsinya yang berlebihan. Efek yang menyerupai sindrom parkinson dapat terjadi akibat menghirup mangan berlebihan. Gejala yang terjadi berupa lemah, anoreksia, nyeri otot, kecepatan berkurang, suara yang monoton, wajah tanpa ekspresi dan gerakan yang kaku. Fungsi motorik dapat pula dipengaruhi akibat paparan kronik (World Health Organization, 2011).
2.9 Interaksi Larutan Analit Logam dengan Nanopartikel Perak Termodifikasi Kitosan
Prinsip dari interaksi antara analit dengan NPP termodifikasi ligan adalah terjadinya agregasi pada nanopartikel akibat interaksi analit dengan ligan. interaksi tersebut dapat diilustrasikan pada Gambar 2.6.
[sumber: Caro, Castillo, Klippstein, Pozo, & Zaderenko, 2010]
Gambar 2.6. Ilustrasi interaksi NPP termodifikasi ligan dengan analit
Ketika nanopartikel beragregasi, agregrat tersebut akan menginduksi penggabungan plasmon interpartikel sehingga akan menginduksi pergeseran LSPR (Localized Surface Plasmon Resonance) yang akan memperpendek jarak rata-rata antar partikel sehingga terjadi perubahan warna larutan (Tolaymat, El Badawy, Genaidy, Scheckel, Luxton, & Suidan, 2010; Caro, Castillo, Klippstein, Pozo, & Zaderenko, 2010).
Beberapa penelitian mengenai penggunaan nanopartikel termodifikasi suatu ligan dalam berinteraksi dengan logam telah mencoba memaparkan mekanisme interaksi yang terjadi. NPP yang dimodifikasi oleh glutation mampu mendeteksi ion Ni2+ secara kolorimetri. Adanya gugus fungsional pada glutation, seperti -NH2 dan –COOH membentuk kompleks dengan Ni2+ dan menyebabkan
NPP termodifikasi glutation mengalami agregasi (Li, Cui, & Han, 2009). Sementara itu, penelitian terhadap kemampuan NPP termodifikasi ester triazol yang selektif terhadap Cd2+ menunjukkan bahwa ion logam tersebut memiliki ukuran yang sesuai untuk menduduki daerah pengikatan pada cincin 1,2,3-triazol sehingga menginduksi agregasi NPP yang termodifikasi ester triazol (Li, Yao, Han, & Zhan, 2009).
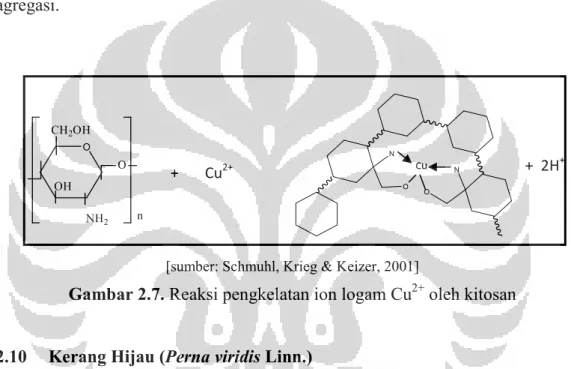
Sugunan, Thanachayanont, Dutta dan Hilborn (2005) berhasil mendeteksi ion Cu2+ dan Zn2+ menggunakan nanopartikel emas termodifikasi kitosan. Kitosan memiliki sejumlah gugus amino terprotonasi dalam larutan asam asetat. Gugus tersebut menciptakan tempat pengenalan yang berguna untuk mengkelat ion logam. Selain itu, gugus hidroksil pada kitosan juga terlibat dalam pengkelatan ion logam. Kemampuan kitosan dalam mengkelat ion logam Cu2+ diperlihatkan pada Gambar 2.7. Adanya pengkelatan logam oleh kitosan menyebabkan kitosan tidak mampu lagi menstabilkan nanopartikel sehingga nanopartikel mengalami agregasi.
[sumber: Schmuhl, Krieg & Keizer, 2001]
Gambar 2.7. Reaksi pengkelatan ion logam Cu2+ oleh kitosan
2.10 Kerang Hijau (Perna viridis Linn.)
Kerang laut hampir semuanya dapat dimakan dan mempunyai nilai gizi yang tinggi. Dari berbagai jenis kerang, kerang darah dan kerang hijau merupakan jenis kerang yang banyak dikonsumsi oleh masyarakat Indonesia (Suharsono, 1999). Menurut data statistik Perikanan Tangkap Indonesia (2010), dari total volume produksi perikanan tangkap di laut pada tahun 2010, volume produksi kerang hijau mengalami peningkatan yang cukup besar, yaitu sebesar 1.390,00%. Analisis kandungan kerang hijau terdiri dari protein 64,6% yang terdiri dari 19 asam amino, lemak 4,9%, abu 14%. Kandungan asam amino yang tinggi adalah dari asam glutamat dan glisin masing-masing 8,65% dan 7,20% (Tan, 1977 dalam Suharsono, 1999). Kerang mempunyai sifat “filter feeder”, yaitu menyaring makanan yang jatuh padanya dan mendepositokan zat organik dan anorganik di
O CH2OH O NH2 OH n + Cu2+ + 2H + N O O N Cu
dalam tubuhnya sehingga kerang pada daerah cemaran tidak boleh dikonsumsi (Suharsono, 1999).
[sumber: McGuire & Stevely, 2009]
Gambar 2.8. Kerang Hijau (Perna viridis Linn.)
Berikut klasifikasi kerang hijau (Perna viridis (Linnaeus, 1758)) Kingdom : Animalia Filum : Moluska Kelas : Bivalvia Subkelas : Pteriomorfia Orde : Mytiloida Superfamili : Mytiloidea Famili : Mytilidae Genus : Perna Spesies : Perna viridis
Beberapa sinonim dari spesies ini yaitu Mytilus opalus (Lamarck, 1819),
Mytilus smaragdinus (Gmelin, 1791) dan Mytilus viridis (Linnaeus, 1758)
(Huber, 2010)
2.10.1 Toksisitas Logam pada Kerang
Hewan air jenis kerang-kerangan (bivalvia) atau jenis binatang lunak (moluska), baik jenis klam (kerang besar) atau oister (kerang kecil), pergerakannya sangat lambat di dalam air. Mereka biasanya hidup menetap di suatu lokasi tertentu di dasar air. Stadium larva dari jenis kerang ini yang disebut
dewasanya, sehingga bila terjadi polusi dalam perairan, kecenderungan kepunahan spesies hewan ini sangat mungkin terjadi.
Jenis kerang baik yang hidup di air tawar maupun di air laut banyak digunakan sebagai indikator pencemaran logam. Hal ini disebabkan karena habitat hidupnya yang menetap atau sifat bioakumulatifnya terhadap logam berat. Karena kerang banyak dikonsumsi oleh manusia maka sifat bioakumulatifnya inilah yang menyebabkan kerang harus diwaspadai bila dikonsumsi terus menerus (Darmono, 1995).
Menurut Denton dan Jones (1981), seperti pada hewan lainnya (ikan dan udang) logam berat dapat juga terakumulasi pada jaringan kerang. Di antara logam Hg, Cd dan Pb, daya penetrasinya berturut-turut dari yang besar ke yang kecil adalah Hg>Cd>Pb. Faktor yang mempengaruhi tinggi rendahnya derajat akumulasi logam tersebut sama dengan faktor yang mempengaruhi akumulasi logam pada hewan air lainnya. Perbedaannya, jenis kerang dapat mengakumulasi logam lebih besar daripada hewan air lainnya karena sifatnya yang menetap, lambat untuk dapat menghindari diri dari polusi dan mempunyai toleransi yang tinggi terhadap konsentrasi tertentu. Oleh karena itu, jenis kerang ini merupakan indikator yang sangat baik untuk memonitor suatu pencemaran lingkungan (Darmono, 1995).
Produk pangan yang diproduksi, diimpor dan diedarkan di Indonesia harus memenuhi persyaratan keamanan, mutu dan gizi pangan termasuk batas maksimum cemaran logam berat. Batas cemaran kadmium (Cd) dan merkuti (Hg) pada kerang adalah 1,0 mg/kg. Sementara batas cemaran timbal (Pb) pada kerang adalah 1,5 mg/kg ( Badan Standarisasi Nasional, 2009). Menurut SK Dirjen POM no. 03752/B/SK/VII/89, batas logam tembaga (Cu) pada makanan adalah 20 mg/kg (C, Samin, & Kamal, 2007).
Salah satu tempat dengan tingkat cemaran logam berat yang tinggi adalah Teluk Jakarta. Pencemaran tersebut khususnya berasal dari limbah industri yang dibuang ke Kali Angke. Oleh karena itu, sampel kerang hijau diambil dari perairan tersebut (Lestari & Edward, 2004).
BAB 3
METODE PENELITIAN
3.1 Lokasi dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Fisiologi Tumbuhan Departemen Biologi FMIPA UI dari bulan Februari 2012 hingga bulan Mei 2012.
3.2 Alat
Alat-alat yang digunakan dalam penelitian meliputi:
Spektrofotometer UV-Vis (Thermo), Oven (LAB LINE), timbangan analitik (Shimadzu LIBROR AEL-200), pengaduk magnetik dan plat pemanas (IKAMAG RCT), mikropipet 0,5-5,5 ml (BOECO), pH specialized indicator dengan kisaran pH 1-14 (Merck), kuvet disposable 280-700 nm (Kartel), kamera digital 12 MP (Olympus). batang pengaduk magnetik, desikator, blender, botol vial 5 ml dan 10 ml, botol kaca 100 ml dan alat-alat gelas.
3.3 Bahan
Bahan yang digunakan dalam penelitian ini meliputi daun bisbul, sampel kerang hijau, AgNO3 (Duchefa Biochemie), kitosan (Biotech Surindo), Pb(NO3)2
99,6% (Merck), HgCl2 (Merck), CuCl2.2H2O (Merck), ZnCl2 (Merck),
MnSO4.H2O 99,7% (Merck), CdSO4.8/3H2O (Wako Pure Chemical Industries),
Cu(NO3)2 1000mg/ml (Merck), HNO3 65% (Meck), asam asetat 2% (Merck),
NaOH (Merck), Na2EDTA (Merck). Selain itu, bahan yang digunakan adalah
akuades, akuabides, alumunium foil, kertas saring whatman no.1 dan no.41.
3.3.1 Pembuatan Air Rebusan Daun Bisbul (Diospyros discolor Willd.)
Tanaman yang digunakan untuk green synthesis yaitu D.discolor (bisbul). Tanaman tersebut diperoleh di lingkungan kampus FMIPA UI, Depok, Jawa Barat. Bagian tanaman yang digunakan yaitu daun dalam kondisi segar dengan morfologi dan warna yang seragam. Daun tersebut dipetik lalu dicuci hingga bersih dengan akuades dan dikeringkan menggunakan oven dengan suhu 400±20C hingga bobot tetap. Setelah kering, daun diserbukkan dengan blender dan di ayak hingga terbentuk serbuk halus. Serbuk ditimbang seberat 1 gram lalu direbus
dengan 50 ml akuabides dalam Erlenmeyer 500 ml. Selanjutnya, rebusan dibiarkan hingga suhu 1000 selama 5menit. Setelah mencapai suhu ruang (230C), air rebusan daun bisbul dituang dan disaring dengan menggunakan kertas Whatman No.1 (Handayani, 2011) ke dalam wadah botol. Air rebusan dapat disimpan dalam lemari es bersuhu 60-80C selama 1 pekan (Bakir, 2011).
3.3.2 Pembuatan Larutan Analit Hg2+, Pb2+, Cd2+, Cu2+, Mn2+ dan Zn2+
Larutan analit (ion logam) 500 dan 1000 ppm dibuat melalui konversi bobot molekul logam dan bentuk garamnya dengan asumsi kadar 100% kecuali serbuk standar dengan sertifikat analisis (Pb(NO3)2 dan MnSO4.H2O).
3.3.2.1 Larutan Induk Merkuri 500 dan 1000 ppm
Serbuk merkuri klorida ditimbang sejumlah 0,0684 gram (500 ppm) dan 0,1359 gram (1000 ppm), kemudian masing-masing dimasukkan ke dalam labu ukur 100,0 ml dan ditambahkan 50 ml akuabides hingga terbentuk larutan yang homogen. Masing-masing larutan dicukupkan dengan akuabides hingga garis batas. Dengan demikian, larutan merkuri yang terbentuk memiliki konsentrasi 505,4 ppm dan 1004,1 ppm.
3.3.2.2 Larutan Induk Timbal 500 dan 1000 ppm
Serbuk timbal (II) nitrat ditimbang 0,0806 gram (500 ppm) dan 0,1603 gram (1000 ppm), kemudian masing-masing dimasukkan ke dalam labu ukur 100,0 ml dan ditambahkan 50 ml akuabides hingga terbentuk larutan yang homogen. Masing-masing larutan dicukupkan dengan akuabides hingga garis batas. Dengan demikian, larutan timbal yang terbentuk memiliki konsentrasi 502,7 ppm dan 999,8 ppm.
3.3.2.3 Larutan Induk Kadmium 500 ppm dan 1000 ppm
Serbuk kadmium sulfat 8/3 hidrat ditimbang 0,1148 gram (500 ppm) dan 0,2296 gram (1000 ppm), kemudian masing-masing dimasukkan ke dalam labu ukur 100,0 ml dan ditambahkan 50 ml akuabides hingga terbentuk larutan yang homogen. Masing-masing larutan dicukupkan dengan akuabides hingga garis
batas. Dengan demikian, larutan kadmium yang terbentuk memiliki konsentrasi 503,1 ppm dan 1006,1 ppm.
3.3.2.4 Larutan Induk Tembaga 500 ppm dan 1000 ppm
Serbuk tembaga klorida dihidrat ditimbang 0,1354 gram (500 ppm) dan 0,2705 gram (1000 ppm), kemudian masing-masing dimasukkan ke dalam labu ukur 100,0 ml dan ditambahkan 50 ml akuabides hingga terbentuk larutan yang homogen. Masing-masing larutan dicukupkan dengan akuabides hingga garis batas. Dengan demikian, larutan analit tembaga yang terbentuk memiliki konsentrasi 504,7 ppm dan 1008,3 ppm.
3.3.2.5 Larutan Induk Mangan 500 ppm dan 1000 ppm
Serbuk mangan sulfat hidrat ditimbang 0,1552 gram (500 ppm) dan 0,3107 gram (1000 ppm), kemudian masing-masing dimasukkan ke dalam labu ukur 100,0 ml dan ditambahkan 50 ml akuabides hingga terbentuk larutan yang homogen. Masing-masing larutan dicukupkan dengan akuabides hingga garis batas. Dengan demikian, larutan analit mangan yang terbentuk memiliki konsentrasi 502,9 ppm dan 1006,9 ppm.
3.3.2.6 Larutan Induk Zink 500 ppm dan 1000 ppm
Serbuk zink diklorida ditimbang 0,1056 gram (500 ppm) dan 0,2100 gram (1000 ppm), kemudian masing-masing dimasukkan ke dalam labu ukur 100,0 ml dan ditambahkan 50 ml akuabides hingga terbentuk larutan yang homogen. Larutan dicukupkan dengan akuabides hingga garis batas. Dengan demikian, larutan analit standar zink diklorida yang terbentuk memiliki konsentrasi 506,6 ppm dan 1012,3 ppm.
Selanjutnya, masing-masing larutan induk 1000 ppm diencerkan hingga diperoleh variasi konsentrasi sebesar 0,1; 1; 10 dan 100 ppm sehingga terdapat enam jenis variasi konsentrasi larutan analit pada masing-masing jenis logam, yaitu 0,1; 1; 10; 100; 500 dan 1000 ppm.
3.4 Cara Kerja
3.4.1 Green Synthesis Nanopartikel Perak
Green synthesis dilakukan dengan mencampurkan air rebusan daun kering
bisbul dan AgNO3 1 mM dengan rasio volume larutan (1:10) 8:80 ml (v:v).
Campuran air rebusan dan AgNO3 diaduk selama 2 jam (Handayani, 2011).
Setelah dibiarkan pada suhu ruang (230C) selama 24 jam, NPP yang terbentuk diamati secara visual dan dikarakterisasi menggunakan spektrofotometer UV-Vis. pH larutan sebelum dan setelah pencampuran diamati menggunakan pH indikator. Karakterisasi dilanjutkan selama 20 hari.
3.4.2 Deteksi Larutan Analit Menggunakan Indikator Nanopartikel Perak secara Kolorimetri
NPP hasil green synthesis setelah 24 jam digunakan untuk deteksi larutan analit secara kolorimetri. Setiap larutan analit yang mengandung ion Hg2+, Pb2+ ,Cd2+,, Cu2+, Mn2+ dan Zn 2+ sebanyak 1 ml dengan berbagai variasi konsentrasi yang telah dibuat ditambahkan dengan 2 ml larutan indikator pada vial. Perubahan warna larutan yang terjadi diamati selama 15 menit. Selanjutnya larutan hasil pengujian dikarakterisasi dengan spektrofotometer UV-Vis dikisaran 280-700 nm dan dilakukan pengukuran nilai pH (Handayani, 2011).
3.4.3 Peningkatan Sensitivitas Indikator Nanopartikel Perak dengan Penambahan NaCl 1 M, MgSO4 0,1 M dan KNO3 0,5 M
NaCl 1 M dibuat dengan menimbang 2,9220 gram. 2,5288 gram serbuk KNO3 dan 1,2322 gram serbuk MgSO4 ditimbang untuk membuat KNO3 0,5 M
dan MgSO4 0,1 M. Masing-masing garam yang telah ditimbang dilarutkan dalam
50,0 ml akuabides.
Setelah 2 ml larutan NPP ditambahkan ke dalam 1 ml larutan analit, masing-masing larutan NaCl 1 M, MgSO4 0,1 M dan KNO3 0,5 M sebanyak 1 ml
ditambahkan ke dalam campuran larutan tersebut. Perubahan warna larutan yang terjadi diamati hingga 15 menit kemudian dikarakterisasi menggunakan
spektrofotometer UV-Vis dikisaran 280-700 nm serta dilakukan pengukuran nilai pH.
3.4.3.1 Optimasi Waktu Penambahan NaCl 1 M
Penambahan NaCl dilakukan dengan dua metode: a. Penambahan NaCl di akhir proses deteksi (NPP-NaCl A)
1 ml larutan NaCl 1 M ditambahkan setelah NPP tanpa modifikasi digunakan untuk deteksi larutan analit. Perubahan warna yang terjadi diamati selama 15 menit. Selanjutnya larutan hasil pengujian dikarakterisasi dengan spektrofotometer UV-Vis dikisaran 280-700 nm serta dilakukan pengukuran nilai pH.
b. Pencampuran NaCl dengan larutan NPP sebelum digunakan dengan pengadukan selama 15 menit (NPP-NaCl B)
Larutan NPP tanpa modifikasi ditambahkan NaCl dengan rasio volume 10:2 (v:v). Campuran larutan di aduk selama 15 menit dengan bantuan pengaduk magnetik. Larutan indikator yang telah dicampur dengan NaCl digunakan untuk deteksi larutan analit. Perubahan warna yang terjadi diamati selama 15 menit. Selanjutnya larutan hasil pengujian dikarakterisasi dengan spektrofotometer UV-Vis dikisaran 280-700 nm serta dilakukan pengukuran nilai pH.
3.4.4 Pembuatan Nanopartikel Perak Termodifikasi Kitosan 1%
Serbuk kitosan ditimbang sebanyak 0,5001 gram, dimasukkan ke dalam gelas beker, kemudian dilarutkan dalam 30 ml larutan asam asetat 2% dengan bantuan pengaduk magnetik. Setelah larut, larutan kitosan dimasukkan ke dalam labu ukur 50,0 ml. Volume larutan dicukupkan dengan larutan asam asetat 2% hingga garis batas sehingga diperoleh larutan kitosan 1%.
Nanopartikel perak hasil green synthesis setelah 24 jam ditambahkan larutan kitosan 1% dengan rasio volume (10:3) 80:24 ml (v:v) dalam gelas beker. Campuran larutan indikator tersebut diaduk selama 2 jam dengan bantuan pengaduk magnetik.
3.4.4.1 Karakterisasi Nanopartikel Perak Termodifikasi Kitosan 1%
Karakterisasi terdiri dari pengamatan visual, pengukuran spektrum serapan dengan spektrofotometer UV-Vis dikisaran 280-700 nm dan kontrol nilai pH dengan kertas indikator pH. Karakterisasi proses modifikasi dilakukan setelah 2 jam proses modifikasi dan sesaat sebelum digunakan. Karakterisasi dilanjutkan selama 20 hari.
3.4.5 Deteksi Lautan Analit Menggunakan Nanopartikel Perak Termodifikasi Kitosan dengan Penambahan NaCl 1 M
Deteksi larutan analit dilakukan dengan metode seperti di atas. NPP termodifikasi kitosan ditambahkan larutan NaCl 1 M dengan metode penambahan yag paling optimum sebelum digunakan untuk deteksi analit. Perubahan warna yang terjadi diamati hingga 15 menit. Selanjutnya larutan hasil pengujian dikarakterisasi dengan spektrofotometer UV-Vis dikisaran 280-700 nm.
3.4.6 Preparasi Sampel
Sampel kerang hijau diambil dari tempat pelelangan ikan di daerah Muara Angke, Teluk Jakarta dengan panjang 5 – 8 cm. Sampel yang dikumpulkan segera disimpan dalam wadah yang berisi es dan dibawa ke laboratorium. Sampel yang digunakan untuk analisis adalah bagian daging sehingga dilakukan pemisahan bagian daging dari cangkangnya. Sampel yang sudah dipisahkan dari bagian cangkang dikumpulkan kemudian ditiriskan dari kelebihan air dan disimpan dalam satu wadah pada suhu -100C sampai analisis logam dilakukan.
Logam pencemar pada sampel dipilih berdasarkan hasil pengujian yang paling sensitif menggunakan larutan indikator. Dibuat enam jenis sampel yang terdiri dari satu sampel tanpa penambahan ion logam dan lima sampel masing-masing ditambahkan ion logam dengan konsentrasi yang dipersempit, yaitu 0,1; 1; 10; 20 dan 30 ppm. Preparasi sampel dimulai dengan penghalusan sampel menggunakan blender. Setelah terbentuk padatan halus, sampel diletakkan dalam cawan penguap kemudian dikeringkan pada suhu 1050C menggunakan oven hingga diperoleh bobot tetap.
3.4.6.1 Destruksi Sampel
Destruksi dilakukan menggunakan metode destruksi basah. Ditimbang ± 2 gram sampel kemudian dimasukkan ke dalam erlenmeyer. 10 ml larutan HNO3
65% ditambahkan ke dalam sampel kemudian dibiarkan selama 12 jam. Larutan tersebut dipanaskan di atas plat pemanas hingga larut. Setelah didinginkan hingga suhu kamar, larutan disaring menggunakan kertas saring Whatman no.41 lalu ditampung dalam labu ukur 100,0 ml dan dicukupkan dengan akuabides.
Untuk sampel yang ditambahkan logam pencemar sebesar 0,1; 1; 10; 20 dan 30 ppm, destruksi sampel dilakukan dengan metode yang sama. Penambahan logam (spiking) dilakukan sebelum penambahan larutan HNO3 65%. Proses
spiking dilakukan sebagai berikut:
a) Sampel A1 (0,1 ppm): Sampel yang telah ditimbang ditambahkan 10,0 ml larutan analit dengan konsentrasi 1 ppm.
b) Sampel A2 (1 ppm): Sampel yang telah ditimbang ditambahkan 10,0 ml larutan analit dengan konsentrasi 10 ppm.
c) Sampel A3 (10 ppm): Sampel yang telah ditimbang ditambahkan 1,0 ml larutan analit dengan konsentrasi 1000 ppm.
d) Sampel A4 (20 ppm): Sampel yang telah ditimbang ditambahkan 2,0 ml larutan analit dengan konsentrasi 1000 ppm.
e) Sampel A5 (30 ppm): Sampel yang telah ditimbang ditambahkan 3,0 ml larutan analit dengan konsentrasi 1000 ppm.
3.4.7 Pengujian Indikator Nanopartikel Perak Termodifikasi Kitosan dengan Penambahan NaCl 1 M pada Sampel Kerang Hijau yang Dicemari Larutan Analit Logam
NPP termodifikasi kitosan ditambahkan larutan NaCl 1 M dengan metode penambahan yag paling optimum sebelum digunakan untuk deteksi. Larutan sampel yang telah didestruksi masing-masing diambil sebanyak 1 ml kemudian ditambahkan dengan 2 ml NPP termodifikasi kitosan. Perubahan warna larutan yang terjadi diamati hingga 15 menit. Selanjutnya larutan hasil pengujian dikarakterisasi dengan spektrofotometer UV-Vis dikisaran 280-700 nm serta dilakukan pengukuran nilai pH.
BAB 4
HASIL DAN PEMBAHASAN
4.1 Green Synthesis Nanopartikel Perak
Larutan AgNO3 dengan air rebusan daun bisbul pada awal pencampuran
diaduk selama 2 jam untuk mempercepat reaksi pembentukan NPP. Nilai pH masing-masing larutan sebelum direaksikan adalah 5 dan tidak mengalami perubahan selama proses sintesis berlangsung. Salah satu indikator terbentuknya NPP pada proses sintesis adalah terjadinya perubahan warna larutan dari bening menjadi kuning kecoklatan setelah 24 jam (Gambar 4.1). Perubahan warna terjadi akibat eksitasi vibrasi plasmon pada permukaan NPP (Shankar, Ahmad, & Sastry, 2003).
(a) (b)
Gambar 4.1. (a) larutan AgNO3 1 mM dan air rebusan daun bisbul; (b) NPP yang
terbentuk setelah 24 jam proses sintesis
Selain perubahan warna larutan, hasil spektrum absorpsi UV-Vis menjadi salah satu karakter yang dapat digunakan untuk konfirmasi telah terbentuknya NPP. Nilai Localized Surface Plasmon Resonance (LSPR) dari NPP memiliki puncak pada kisaran λmaks 400-450 nm (Solomon, Bahadory, Jeyarajasingam,
Rutkowsky, & Boritz, 2007).
NPP 24 jam
AgNO3 air
rebusan Bisbul
100 200 300 400 500 600 700 0,0 0,5 1,0 1,5 2,0 2,5 3,0 3,5 4,0 4,5 5,0 5,5 abs or bans i ( a. u .) panjang gelombang (nm) AgNO 3
Air rebusan daun bisbul NPP 24 jam
Gambar 4.2. Spektrum UV-Vis NPP hasil sintesis menggunakan larutan AgNO3 1
mM dan air rebusan daun bisbul dengan rasio volume (10:1) 80:8 ml (v:v) selama 24 jam
Berdasarkan spektrum absorpsi UV-Vis di atas (Gambar 4.2), larutan AgNO3 1 mM sebelum direaksikan memiliki puncak pada daerah sekitar 220 nm
sedangkan air rebusan daun bisbul memiliki puncak-puncak yang sangat lebar pada daerah 280 – 330 nm. Setelah direaksikan selama 24 jam, hasil campuran AgNO3 dengan air rebusan daun bisbul membentuk serapan baru pada daerah 400
– 500 nm yang membuktikan bahwa proses green synthesis ini menghasilkan NPP. Nilai absorbansi menunjukkan kecenderungan jumlah NPP yang dihasilkan. Handayani (2011) menyatakan bahwa penggunaan air rebusan daun bisbul untuk
green synthesis NPP akan menghasilkan absorbansi tertinggi saat 24 jam.
Semakin tinggi nilai absorbansi maka jumlah NPP yang dihasilkan semakin banyak (Solomon, Bahadory, Jeyarajasingam, Rutkowsky, & Boritz, 2007).
Ukuran dan distribusi NPP yang terbentuk dapat diprediksi berdasarkan nilai λmaks dan spectral bandwidth (SBW) yang menunjukkan nilai lebar setengah
puncak spektrum serapan maksimum. Pada umumnya, semakin besar ukuran
partikel NPP maka puncak serapan akan bergeser ke arah panjang gelombang yang lebih besar pada rentang 400 – 450 nm dan puncak yang terbentuk lebih lebar. Sementara semakin rendah nilai SBW maka distribusi NPP cenderung tersebar dan seragam. Nilai SBW yang diperoleh 99,12 nm sementara nilai λmaks
NPP setelah 24 jam adalah 422 nm sehingga dapat diprediksi ukuran NPP yang terbentuk berada pada kisaran 50-60 nm (Solomon, Bahadory, Jeyarajasingam,