Unit Kegiatan
Belajar Mandiri
Kim/3.4/4.4/1/4
KEPERIODIKAN
SIFAT UNSUR
b. Materi PembelajaranBuku Teks Pelajaran (BTP) Ilmu Kimia untuk Kelas X SMA/MA karangan Unggul Sudarmo, Penerbit Erlangga pada pokok bahasan Keperiodikan Sifat Unsur
f. Tujuan Pembelajaran :
Melalui diskusi, tanya jawab, penugasan, presentasi dan studi kepustakaan
peserta didik dapat menganalisis kemiripan sifat unsur dalam golongan dan
keperiodikannya sehingga peserta didik dapat menghayati kebesaran sang
pencipta dan mengamalkan ajaran agama yang dianutnya melalui belajar,
mengembangakan sikap jujur, peduli, dan bertanggungjawab, serta dapat
mengembangkan kemampuan berpikir kritis, komunikatif, kolaboratif, dan
kreatif (4C).
3.4. Menganalisis kemiripan sifat unsur
dalam golongan dan
Keperiodikannya
4.4. Menyajikan hasil analisis data-data
unsur dalam kaitannya dengan
kemiripan dan sifat keperiodikan
unsur
I. IDENTITAS
a. Nama Mata Pelajaran : KIMIA
b. Semester : 1
c. Materi Pokok : SIFAT PERIODIK UNSUR
d. Alokasi Waktu : 6 JP
1. Pendahuluan a) Apersepsi
Sebelum belajar pada materi ini, silahkan kalian membaca dan memahami cerita di bawah ini.
Sampai saat ini, sudah dikenal 118 macam unsur dengan
sifat yang khas untuk setiap unsur. Jika unsur-unsur itu tidak
disusun secara tepat maka akan mengalami kesukaran dalam
mempelajari sifat-sifatnya. Oleh sebab itu, sejak dulu para
ilmuwan berusaha menggolongkan unsur-unsur berdasarkan
sifat-sifatnya .
Para ahli berusaha membuat pengelompokan sehingga
unsur-unsur tersebut tertata dengan baik. Puncak dari usaha
tersebut adalah terciptanya suatu tabel unsur yang disebut
sistem periodik unsur. Sistem periodik unsur ini mengandung
banyak sekali informasi tentang sifat-sifat unsur, sehingga sangat
membantu dalam mempelajari unsur-unsur .
Bagaimanakah unsur-unsur disusun dalam sistem
periodik?
Apakah yang dimaksud dengan sistem periodik unsur?
Bagaimanakah perkembangan dari penyusunan sistem
periodik?
Untuk dapat menyelesaikan persoalan tersebut, silahkan
kalian lanjutkan ke kegiatan belajar berikut dan ikuti
b) Peta Konsep
1.
Pastikan dan fokuskan apa yang akan anda pelajari hari ini.
2.
Baca dan pahami Pendahuluan (Apersepsi) untuk membantu
anda memfokuskan permasalahan yang akan dipelajari.
3.
Cari referensi/buku-buku teks yang terkait dengan
topik/permasalahan yang anda hadapi.
4.
Jangan lupa browsing internet untuk menda-patkan
pengetahuan yang up to date.
5.
Selalu diskusikan setiap persoalan yang ada dengan
teman-teman dan atau guru.
6.
Presentasikan hasil pemahaman anda agar bermanfaat bagi
orang lain.
2. Kegiatan Inti
a.
Petunjuk Umum UKBPetunjuk Umum UKM
Ayo……ikuti kegiatan belajar 1 berikut
dengan penuh kesabaran dan
1.
Pelajari materi perkembangan tabel sistem Periodik Unsur mulai dari sistem Triad Dobreiner hingga sistem periodik unsur modern seperti pada gambar berikut.Gambar: Tabel Sistem Periodik Unsur Modern
1. Lengkapi tabel perkembangan SPU berikut ini :
No Sistem SPU Dasar Pengelompokan Unsur-unsur Hukum Periodik Kelemahan / Kelebihan
1.
Sistem Triade- Dobreiner2.
Sistem Oktaf- Newland3.
SPU-Mendeleyev4.
SPU-Lothar Meyer5.
SPU ModernTugas : Latihan Soal
KEGIATAN BELAJAR
1
Setelah
kalian
memahami
materi
perkembangan SPU, ayo berlatih dengan
mengerjakan tugas berikut !
2. Perhatikan tabel dibawah ini : A B K C D E G L F H I N M
a. Sebutkan kelompok unsur segolongan yang terdapat dalam tabel di atas! b. Sebutkan kelompok unsur seperiode yang terdapat dalam tabel di atas! c. Bila B mempunyai nomor atom 7, berapakah nomor atom G?
d. Sebutkan beberapa kelompok unsur yang mempunyai sifat kemiripan!
3. Lengkapi tabel berikut:
No Lambang
Unsur Susunan Elektron
Letak Unsur Dalam Sistem Periodik Periode Golongan 1. 7Li 2. 13Al 3. 20Ca 4. 29Cu 5. 32Ge 6. 35Br 7. 37Rb 8. 47Ag 9. 54Xe 10. 56Ba
4. Suatu ion A2- mempunyai konfigurasi elektron 1s2 2s2 2p6 3s2 3p6. Tentukan letak unsur A dalam sistem periodik !
5. Di antara unsur-unsur 4A, 12B, 16C dan 18 D, unsur-unsur manakah yang terletak dalam
golongan yang sama?
6. Suatu unsur yang elektron terakhirnya memiliki bilangan kuantum n = 3; l = 2; m = - 1 dan s = +12 dalam sistem periodik teletak pada golongan …… dan perode ….
.
Apabila kalian telah mampu memahami materi
pada kegiatan belajar 1 di atas, maka kalian bisa
melanjutkan pada kegiatan belajar 2 berikut
Pelajari materi sifat periodik unsur dan silahkan kalian membaca dan memahami cerita di bawah ini.
A. Sifat Periodik Unsur
No Sifat Periodik Unsur Definisi Aturan dalam Periode (dari kiri ke kanan) Golongan ( dari atas ke bawah)
1.
Jari-jari atom2.
Energi ionisasi3.
Afinitas Elektron4.
ElektronegativitasKEGIATAN BELAJAR
2
Sifat periodik unsur merupakan sifat unsur yang
berhubungandengan letak unsur dalam tabel periodik
(periodedan golongan). Sifat periodik yang akan dibahas di sini
meliputisifat atom yang berhubungan langsung dengan
strukturatomnya, mencakup jari-jari atom, energi ionisasi,
afinitaselektron, dan keelektronegatifan.
Sifat – sifat unsur berkaitan dengan konfigurasi elektron
Unsur yang memiliki konfigurasi sama memiliki kemiripan
sifat
Dalam satu periode , sifat atom dipelajari dari kiri ke
kanan
Dalam satu golongan sifat atom dipelajari dari atas ke
bawah
Pertanyaan :
Bagaimana kecenderungan sifat unsur periodik dalam satu
golongan dan dalam satu periode
Setelah kalian memahami materi sifat
periodik unsur, ayo berlatih mengerjakan
tugas berikut !
No Sifat Periodik Unsur Definisi Aturan dalam Periode (dari kiri ke kanan) Golongan ( dari atas ke bawah)
5.
Sifat Logam6.
Titik didih dan titik leleh1. Diketahui unsur-unsur : 3Li , 4Be , 5B , 9F.
Tentukan :
a.
Unsur yang mempunyai jari-jari atom terbesar !b.
Unsur yang mempunyai jari-jari atom terkecil ! 2. Diketahui unsur-unsur : 11Na , 19K , 37Rb , 55Cs.Tentukan :
a.
Unsur yang mempunyai jari-jari atom terbesar !b.
Unsur yang mempunyai jari-jari atom terkecil !3. Sebutkan faktor – faktor yang mempengaruhi besarnya jari – jari atom !
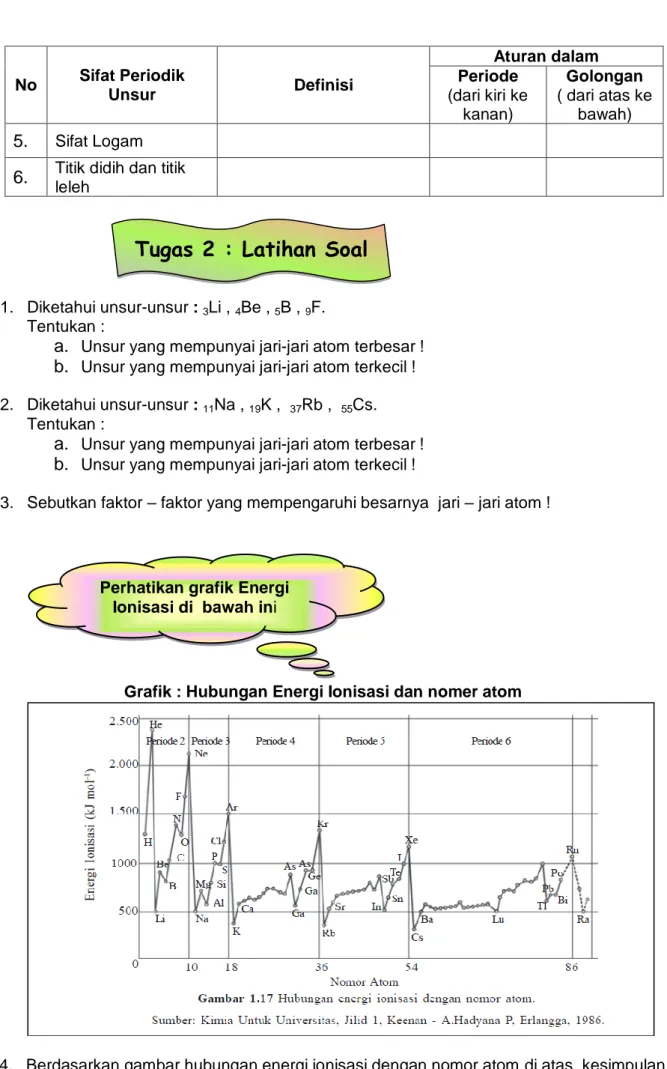
Grafik : Hubungan Energi Ionisasi dan nomer atom
4. Berdasarkan gambar hubungan energi ionisasi dengan nomor atom di atas, kesimpulan apakah yang dapat Anda peroleh tentang energi ionisasi unsur-unsur dalam satu periode ?
Tugas 2 : Latihan Soal
Perhatikan grafik Energi Ionisasi di bawah ini
Tabel : Harga Keelektronegtifitas Unsur-Unsur
5. Berdasarkan tabel harga keelektronegtifitas unsur-unsur, Bagaimana kecenderungan keelektronegatifan unsur-unsur dalam:
a.
satu golongan (dari atas ke bawah)b.
satu periode (dari kiri ke kanan)c.
jelaskan mengapa demikian?6. Diketahui unsur-unsur: 19K, 20Ca, 31Ga, 36Kr. Manakah yang memiliki:
a.
keeletronegatifan terbesar?b.
keelektronegatifan terkecil?c.
Jelaskan apa yang menyebabkan kecenderungan seperti itu? 7. Diketahui unsur-unsur: 9F, 17Cl, 35Br, 53I. Manakah yang memiliki:a.
keelektronegatifan terbesar ?b.
keelektronegatifan terkecil ?c.
Jelaskan mengapa demikian!Tabel: Afinitas Elektron Unsur-unsur
8. Diketahui unsur 11Na dan 17Cl. Unsur manakah yang mempunyai afinitas elektron
terbesar ? Jelaskan mengapa demikian !
Perhatikan tabel afinitas elektron di bawah ini Perhatikan tabel Harga
Unsur Titik Leleh Titik Didih Energi Ionisasi Konfigurasi Elektron P –200 °C 167 °C 1.600 kJ/mol 2, 7 Q –230 °C –233 °C 2.000 kJ/mol 2,8 R 97 °C 890 °C 450 kJ/mol 2,8,1
9. Berdasarkan tabel unsur P, Q, dan R di atas :
a.
Bagaimana wujud P, Q, dan R pada suhu kamar?b.
Pada golongan dan periode berapa unsur P, Q, dan R terletak pada sistem periodik unsur modern? Kerjakan Soal Pilihan Ganda Berikut ini !
---PERKEMBANGAN SPU
1. Pernyataan dibawah ini yang merupakan tujuan penyusunan unsur-unsur dalam sebuah tabel ialah … .
A. Agar unsur - unsur tersusun secara teratur berdasarkan kenaikan massa atomnya.
B. Unsur yang ada akan tersusun dengan sifat yang sama.
C. Untuk mempermudah dalam
mempelajari sifat-sifat unsur yang ada.
D. Agar diperoleh sistem periodik unsur modern.
E. Agar dapat diramalkan unsur-unsur yang pada saat itu belum ditemukan. 2. Pengelompkan unsur-unsur tiap kelompok
terdiri atas 3 unsur dengan dengan sifat kimia yang mirip dilakukan oleh... A. Newlands D. Thomson B. Dobereiner E. Lavoisier C. Mendeleyev
Perhatikan Titik Didih dan Titik Leleh di bawah ini
Apabila kalian telah mampu memahami
materi pada kegiatan belajar 2 di atas,
maka kalian bisa melanjutkan pada
kegiatan belajar 3 berikut.
KEGIATAN BELAJAR
3
Anda telah mempelajari dengan baik tentang perkembangan tabel perodik dan kepriodikan sifat-sifat unsur yang dapat dibaca dari tabel periodik. Untuk memantapkan pemahaman kalian kerjkan soal-soal berikut ini.
3. Hukum Oktaf mengelompokkan unsur-unsur berdasarkan … A. Massa atom B. Energi ionisasi C. Titik didih D. Keelekrtonegatifan E. Jari-jari atom
4. Susunan Berkala unsur-unsur Mendeleyev disusun berdasarkan ....
A. Sifat kimia unsur
B. Susunan elektron unsur-unsur C. Kenaikan nomor atom
D. Kenaikan nomor massa unsur-unsur E. Sifat logam dan non logam
5. Unsur–unsur dalam sistem periodik modern disusun berdasarkan....
A. Kenaikan massa atom dan kemiripan sifat
B. Kenaikan nomor atom dan kemiripan sifat
C. Kenaikan jumlah proton dan neutron D. Kenaikan titik didih dan titik leleh E. Sifat kimia dan sifat fisika
6. Perbedaan SPU modern dengan SPU sebelumnya adalah...
A.
Perbedaan menempatkan unsur dalam satu periodeB.
Perbedaan menempatkan unsur dalam satu golonganC.
SPU modern disusun berdasarkan kenaikan nomor atomD.
SPU modern disusun menjadi 18 golonganE.
SPU modern disebut spu panjang 7. Kelemahan pengelompokan unsur olehNewlans adalah...
A. Unsur yang sifatnya sama lebih dari 3 B. Terlalu umum
C. Tersedia tempat yang kosong D. Sulit dipelajari
E. Terdapat beberapa unsur yang tidak sesuai dengan oktaf
8. Kelemahan dari SPU Mendeleyev adalah …
A. Sifat hidrogen yang khusus sehingga tidak ada tempat.
B. Tidak dapat menunjang pemisahan unsur logam dengan non logam. C. Terdapat unsur-unsur yang terbalik
penempatannya.
D. Hanya cocok untuk unsur-unsur yang massa atomnya kecil.
E. Hanya cocok untuk unsur-unsur yang massa atomnya besar.
9. Pada SPU Modern, unsur dalam satu golongan jika semakin ke bawah maka ….. A. Jumlah kulit yang dimiliki semakin
banyak.
B. Jumlah kulit yang dimiliki berkurang. C. Jumlah kulit yang dimiliki tetap. D. Keelektronegatifan bertambah. E. Keelektronegatifan tetap. 10. Hukum Periodiknya dari SPU yang
sekarang digunakan adalah…
A. Unsur-unsur disusun menurut kenaikan massa atom relatifnya.
B. Jika unsur-unsur disusun menurut kenaikan massa atom relatifnya,maka sifat unsur akan berulang secara periodik.
C. Sifat-sifat unsur merupakan fungsi periodik dari massa atom relatifnya. D. Sifat-sifat unsur merupakan fungsi
periodik dari nomor atomnya. E. Jika unsur-unsur disusun tiga-tiga
menurut kenaikan massa atom relatifnya,maka massa atom relatif unsur yang tengah sama dengan separo dari jumlah Ar unsur yang pinggir.
SIFAT PERIODIK UNSUR
A. sama
11. Sifat periodik yang benar dalam satu golongan dari atas ke bawah adalah… A. Jari-jari atom makin kecil
B. Energi ionisasinya makin besar C. Titik didih logam makin bertambah D. Kelektronegatifannya makin kecil E. Kereaktifan logam makin berkurang 12. Unsur P dan Q mempunyai konfigurasi
elektron sebagai berikut:
P : 2), 8), 1) Q : 2), 8), 7) Pernyataan berikut yang tidak benar
tentang kedua unsur tersebut adalah ... . A. unsur P dan Q terletak dalam satu
periode
B. jari-jari atom unsur P lebih besar daripada unsur Q
C. unsur P mempunyai energi ionisasi lebih besar daripada unsur Q
D. unsur P lebih mudah membentuk ion positif daripada unsur Q
E. unsur Q lebih mudah membentuk ion negatif daripada unsur P
13. Diketahui unsur-unsur dengan notasi :
11Na ; 12Mg ; 17Cl ; 19K ; dan 20Ca
Perhatikan pernyataan berikut :
1) Jari-jari atomnya terpanjang = Kalium. 2) Energi ionisasinya paling kecil =
Kalium.
3) Affinitas elektronnya terbesar= unsur Klor.
4) keelektronegatifannya paling besar= klor.
Pernyataan yang paling tepat adalah … A. 1, 2, dan 3 D. 1, 2, 3, dan 4 B. 1 dan 3 E. 4 saja C. 2 dan 4
14. Dalam SPU, unsur-unsur yang seperioda dari kiri ke kanan, jari-jari atomnya semakin kecil. Hal ini disebabkan karena ...
A. Muatan inti bertambah, sedangkan jumlah kulit yang terisi elektron tetap. B. Energi ionisasinya semakin besar. C. Ukuran atom bertambah besar. D. Nomor atom maupun nomor massanya
semakin besar, sehingga tarikan inti atom terhadap elektron semakin lemah. E. Unsur-unsurnya semakin bersifat non
logam
15. Perhatikan cuplikan SPU berikut ini:
Na Mg S Cl
K Br
Rb I
Jari-jari atom terbesar adalah….
A. Na C. I E Br
B. Rb D. Cl
16. Unsur yang jari-jari atomnya paling pendek adalah ....
A. 5B C. 12Mg E. 16S
B. 8O D. 15P
17. Jari-jari atom unsur berikut : 3Li, 11Na, 19K, 4Be, dan 5B secara acak dalam satuan
angstrom adalah 2,03; 1,23; 1,57; 0,80; dan 0,89; maka jari-jari atom Lithium sama dengan …
A. 0,80 C. 1,23 E. 2,03 B. 0,89 D. 1,57
18. Besarnya energi yang dibebaskan pada saat atom suatu unsur dalam keadaan gas menerima elektron adalah...
A. Keelektronegatifan C. Jari-jari atom B. Energi ionisasi D. Afinitas
elektron
C. Massa atom relative
19. Atom dengan energi ionisasi tinggi selalu mempunyai….
A. Afinitas elektron rendah
B. Kecenderungan membentuk ion negatif C. Jari-jari atom besar
D. elektron-elektron valensi yang terikat kuat
E. Jumlah proton sedikit
20. Di antara unsur-unsur 4Be, 12Mg, 20Ca, 38Sr, 56Ba; yang memiliki potensial
ionsisasi paling kecil adalah ....
A.
4Be C. 20Ca E. 56BaB.
12Mg D. 38Sr21. Energi ionisasi unsur dalam satu golongan dari tiga unsur yaitu P =1142 kkal/mol, Q = 1655 kal/mol, dan R = 1281 kkal/mol. D Dari atas ke bawah unsur itu adalah ....
A.
P, Q, R C. P, R, Q E. Q, R, PB.
R, Q, P D. Q, P, R22. Diketahui unsur:
4M, 7P, 9Q, 11R, 12S, 19U, 20V
Unsur yang disusun berdasarkan kenaikan potensial ionisasinya adalah ....
A.
R, S, U C. U, R, S E. V, S UB.
Q, R, M D. S, R, V23. Energi ionisasi unsur-unsur segolongan berkurang dari atas ke bawah. Faktor utama yg menyebabkan penurunan tsb adalah...
A.
pertambahan jari-jari atomB.
pertambahan massa atomC.
pertambahan muatan intiD.
pertambahan titik didihE.
pertambahan nomor atom24. Kecenderungan unsur melepas elektronnya membentuk ion positif dicerminkan oleh . . . .
A. jari-jari atom D. titik didih B. energi ionisasi E.
keelektronegatifan C. afinitas elektron
25. Unsur yang afinitas elektronnya paling besar adalah ....
a. 13Al C. 35Br E. 31Ge
26. Diketahui beberapa unsur dgn konfigurasi elektron sbb:
P : 2), 8), 8),1) S : 2), 8), 4), Q : 2), 8) T : 2), 7), R : 2), 8), 2)
Unsur yang mempunyai aktifitas elektron terkecil adalah:
A.
P C. R E. TB.
Q D. S27. Unsur A dan B mempunyai afinitas elektron berturut-turut 240 kJ.mol─1 dan -328 kJ.mol─1 . Berarti ...
A. unsur A─ lebih mudah menyerap elektron daripada unsur B
B. ion B─ lebih stabil daripada atom B C. ion Alebih stabil daripada atom A D. unsur A lebih bersifat non-logam
daripada B
E. unsur A lebih sukar melepas elektron daripada unsur B
28. Keelektronegatifan suatu unsur adalah sifat yang menyatakan . . . .
A. besarnya energi yang diperlukan untuk melepas 1 elektron pada pembentukan ion positif
B. besarnya energi yang diperlukan untuk menyerap 1 elektron pada
pembentukan ion negatif
C. besarnya energi yang dibebaskan pada penyerapan 1 elektron membentuk ion negatif
D. besarnya tendensi (kecenderungan) menarik elektron pada suatu ikatan E. besarnya tendensi (kecenderungan)
menarik elektron membentuk ion negatif
29. Data elektronegatifitas unsur-unsur sebagai berikut:
K L M N O P
1,0 1,5 0,9 3,0 1,2 1,5 Urutan unsur-unsur tersebut dari kiri ke kanan dalam satu periode adalah.... A. K, L, N, O D. N, P, O, M B. O, P, N, L E. M, O, P, N C. L, N, O, P
30. Data keelektronegatifan beberapa unsure sbb
P = 1,2 R = 3,0 T = 4,0 Q = 2,5 S = 3,5
Unsur yang paling mudah menarik electron adalah ....
A. P C. R E. T
B. Q D. S
--- Periksakan hasil pekerjaan anda kepada guru.
Bagaimana…?
BAGUS….. ANDA MAKIN BISA
Setelah kalian belajar bertahap dan berlanjut melalui kegiatan belajar 1, 2, dan 3, berikut untuk mengukur diri kalian terhadap materi yang sudah kalian pelajari.
Jawablah sejujurnya terkait dengan penguasaan materi pada UKBM ini di Tabel berikut.
Tabel Refleksi Diri Pemahaman Materi
No Pertanyaan Ya Tidak
1. Apakah kalian dapat menjelaskan perkembangan system periodik unsur?
2. Apakah kalian dapat menentukan letak unsur dalam system periodik berdasarkan konfigurasi electron? 3. Bisakah kalian menemukan kecenderungan sifat
periodik dalam satu golongan dan satu periode? 4. Menganalisis sifat periodik unsur berdasarkan
kecenderungan sifat periodik?
Keterangan :
1. Jika menjawab “TIDAK” pada salah satu pertanyaan di atas, maka pelajarilah kembali materi tersebut dalam Buku Teks Pelajaran (BTP) dan pelajari ulang UKBM ini dengan bimbingan Guru atau teman sejawat.
Jangan putus asa untuk mengulang lagi!.
2. Dan apabila kalian menjawab “YA” pada semua pertanyaan, maka kalian boleh sendiri atau mengajak teman lain yang sudah siap untuk mengikuti tes formatif
agar kalian dapat belajar ke UKBM berikutnya... Oke.?