Sistem Periodik Unsur T er d ir i atas Unsur golongan utama Unsur golongan transisi
Perkembangan Sistem Periodik Unsur J. W. Dobereiner John Newland Dimitri Mendeleev Sistem Periodik Modern Jari-jari atom Energi ionisasi Afinitas elektron Keelektronegatifan
PETA KONSEP
Logam Kovalen Van der Waals Sistem 18 golonganTitik leleh, titik didih, Keberadaan di alam,
reaksi dengan air, dengan oksigen, dengan
Sistem Periodik Unsur
Apa itu Sistem
Periodik Unsur?
Sistem periodik adalah suatu tabel berisi identitas unsur-unsur yang dikemas secara berkala dalam bentuk periode dan golongan berdasarkan kemiripan sifat-sifat unsurnya.
Perkembangan Sistem Periodik Unsur
Johan W. Dobereiner
John Newland
Dimitri Mendeleev dan Lothar Meyer
Henry G. Moseley
1. Triad Dobereiner
Pada tahun 1829, Johann Wolfgang
Dobereiner mengelompokkan
unsur-unsur berdasarkan kemiripan
sifat-sifatnya
Dalam satu triad massa atom unsur
yang terletak di tengah merupakan
harga rata-rata massa unsur pertama
dan unsur yang ke tiga, penemuan
Dobereiner menyimpulkan bahwa
unsur-unsur dapat di kelompokan ke
dalam kelompok-kelompok tiga unsur
yang di sebut triade
TRIADE Ar Rata-rata Ar unsur pertama
Kelemahan dari teori triade:
Sistem ini kurang efisien karena
ternyata ada beberapa unsur lain
yang tidak termasuk dalam satu
Kelebihan dari teori triade:
adanya keteraturan massa atom
unsur yang terletak di tengah
merupakan
harga
rata-rata
2. Hukum Oktaf Newlands
Pada tahun 1865, John Newlands
mengelompokkan unsur-unsur
berdasarkan kenaikan massa atom
relatifnya.
Mempunyai sifat unsur yang akan
terulang pada tiap unsur ke delapan.
Demikian pula sifat unsur ke-9 mirip
dengan sifat unsur ke-2. Oleh karena
terjadi pengulangan sifat setelah 8
Kelebihan hukum Oktaf
Newlands:
dibandingkan dengan triade
Kelemahan hukum Oktaf
Newlands:
3. Sistem Periodik Meyer
Tahun 1864, Lothar Meyer melakukan
pengamatan
hubungan
antara
kenaikan massa atom dengan sifat
unsur.
Dari kurva tersebut, ia melihat adanya
keteraturan dari unsur-unsur dengan
sifat yang mirip. Sebagai contoh,
Di tahun 1868, Meyer menyusun
unsur-unsur tersebut ke dalam suatu
tabel berdasarkan kenaikan massa
atom dan pengulangan atau
4
.
Sistem Periodik Mendeleev
Pada tahun 1869 Dimitry Mendeleev
dari Rusia mengelompokkan unsur
–
unsur berdasarkan kenaikan massa
atom dan sifat kimianya.
Apabila unsur disusun menurut
Kelebihan Sistem Periodik
Mendeleev:
Dapat meramalkan tempat kosong untuk
unsur yang belum ditemukan
Contoh : unsur Ge berada di antara Si dan
Sn
Periode 4 dan 5 mirip dengan Sistem
Periodik Modern
Contoh : K dan Cu sama-sama berada di
periode 4 golongan I. Dalam Sistem
Kelemahan Sistem Periodik
Mendeleev:
Panjang periodenya tidak sama
Adanya penempatan unsur yang tidak
sesuai dengan kenaikan massa atom.
Contoh:
127I dan
128Te. Karena sifatnya,
Mendeleev terpaksa menempatkan Te
lebih dulu daripada I. Dalam Sistem
Periodik Modern disusun berdasarkan
kenaikan nomor atom
52Te lebih dulu dari
Triade besi (Fe, Co, Ni) dan triade yang
lain dimasukkan ke dalam golongan VIII,
padahal tidak mempunyai valensi tertinggi
8.
Adanya empat pasal anomali, yaitu
5. Sistem Periodik Modern (Henry
Moseley)
Tabel periodik mendeleev disebut tabel
periodik bentuk pendek.
Tabel tersebut kemudian disempurnakan
oleh Moseley, dengan cara menyusun
unsur-unsur menurut kenaikan nomor
atom, dan berdasarkan konfigurasi
Sistem periodik modern tersusun dari
baris-baris horizontal yang disebut
periode dan kolom-kolom vertikal
Golongan
Golongan utama (A), meliputi
Golongan IA : alkali
Golongan IIA : alkali tanah
Golongan III A : boron/alumunium Golongan IV A : karbon/silikon
Golongan V A : nitrogen/fosfor Golongan VI A : oksigen/sulfur Golongan VII A : halogen
Golongan transisi (B) meliputi
Golongan transisi (Gol B) Yaitu III B , IV B, V B, VI B, VII B, VIII B, I B, II B
Golongan transisi dalam, ada dua deret. Pada periode 6 golongan III B terdapat 14 unsur yang sangat mirip sifatnya, yaitu unsur-unsur Lantanida.
Demikian juga pada periode 7 yaitu unsur-unsur Aktinida. Supaya tabel tidak terlalu panjang,
Periode
Periode adalah susunan unsur-unsur dalam SPU arah mendatar atau horizontal yang disusun
berdasarkan kenaikan nomor atom. Periode dibagi 2 yaitu :
Periode pendek, meliputi:
Periode panjang, meliputi:
Jari-jari atom didefinisikan sebagai setengah jarak antara dua inti atom yang berikatan dalam wujud padat.
Jari-jari bola basket d
Kecenderungan Jari-jari atom di
periode 2 dan 3
Jari-Jari Atom
Bertambahnya jari-jari atom dari atas ke bawah dalam golongan yang sama disebabkan bertambahnya orbit (lintasan) elektron. Dengan bertambahnya orbit menyebabkan volume atom mengembang, sehingga jari-jari atom meningkat.
Bertambahnya jumlah proton
Kecenderungan Jari-jari Atom Golongan
Transisi
Jari-jari Ion
Ion Postitif
Ion positif lebih kecil dari asalnya. Natrium = 2,8,1
Na+ = 2,8
10 elektron ditarik dengan gaya tarik 11 proton
Ion Negatif
Lebih besar dari asalnya. Klorin = 2,8,7
Cl- = 2,8,8
KEELEKTRONEGATIFAN
Keelektronegatifan didefinisikan sebagai
kecenderungan suatu atom untuk menarik
pasangan elektron
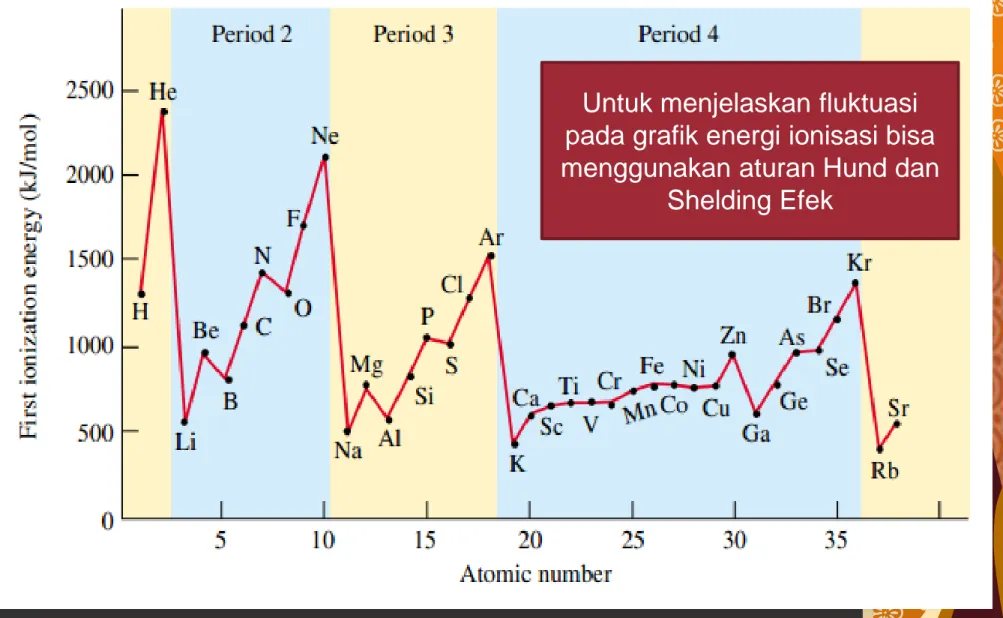
Energi Ionisasi
Energi
ionisasi
adalah
energi
yang
diperlukan
untuk
melepaskan
satu
elektron terluar dari suatu atom dalam
keadaan gas.
Dalam satu golongan (dari atas ke
Grafik energi ionisasi pertama unsur-unsur golongan utama
ENERGI IONISASI PERTAMA
Untuk menjelaskan fluktuasi pada grafik energi ionisasi bisa menggunakan aturan Hund dan
ENERGI IONISASI KEDUA
Pertama Kedua Ketiga Keempat Kelima Keenam Ketujuh
Afinitas Elektron
Afinitas adalah perubahan energi atom ketika
elektron ditambahkan kepada atom itu pada keadaan
gas.
Jika satu elektron ditambahkan kepada atom yang
stabil dan sejumlah energi diserap, maka afinitas
elektronnya berharga positif. Jika dilepaskan energi,
afinitas elektronnya berharga negatif.
Afinitas elektron
IA IIA IIIA IVA VA VIA VIIA VIIIA
H = 73 Li = 60 Na = 53 K = 48 Rb = 47 Be = 240 Mg = 230 Ca = 156 Sr = 168 Ba = 52 B = 83 Al = 50 Ga = 36 In = 34 Tl = 50 C = 123 Si = 120 Ge= 116 Sn= 121 Pb= 101 N = 0,0 P = 74 As = 77 Sb= 101 Bi = 101 O = 141 S = 200 Se= 195 Te= 183 Po= 270 F = 322 Cl = 349 Br = 325 I = 295 At = 270 He = 21 Ne = 29 Ar = 35 Kr = 39 Xe = 41
Referensi
Harnanto,Ari. 2009. Kimia Untuk SMA Kelas X. Jakarta: Pusat Perbukuan Departemen
Pendidikan Nasional.
Johari. 2004. Kimia SMA untuk Kelas X.Jakarta: Esis.
Purba, Michael. 2006. Kimia SMA untuk Kelas X. Jakarta: Erlangga.
Sudarmo, Unggul. 2006. Kimia SMA untuk Kelas