PENGHALUS WAJAH
TESIS
AZRI RAHMADI 197006001
PROGRAM STUDI PASCASARJANA KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN
2021
PEMANFAATAN EKSTRAK DAUN KEMUNING (Murraya paniculata L.) PADA PEMBUATAN MASKER SHEET SEBAGAI
PENGHALUS WAJAH
TESIS
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Magister Sains
AZRI RAHMADI 197006001
PROGRAM STUDI PASCASARJANA KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN
2021
i
PERNYATAAN ORISINALITAS
PEMANFAATAN EKSTRAK DAUN KEMUNING (Murraya paniculata L.) PADA PEMBUATAN MASKER SHEET SEBAGAI PENGHALUS WAJAH
TESIS
Saya menyatakan bahwa tesis ini adalah hasil karya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Agustus 2021
` Azri Rahmadi
NIM. 197006001
ii
PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Sebagai sivitas akademika Universitas Sumatera Utara, saya yang bertanda tangan di bawah ini :
Nama : Azri Rahmadi
NIM : 197006001
Program Studi : Magister Ilmu Kimia Jenis Karya Ilmiah : Tesis
Demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan kepada Universitas Sumatera Utara Hak Bebas Royalti Non-Ekslusif (Non-Exlusive Royalty Free Right) atas tesis saya yang berjudul :
Pemanfaatan Ekstrak Daun Kemuning (Murraya Paniculata L.) pada Pembuatan Masker Sheet sebagai Penghalus Wajah
Beserta perangkat yang ada (jika diperlukan), dengan Hak Bebas Royalti Non Eksklusif ini, Universitas Sumatera Utara berhak menyimpan, mengalih media, memformat, mengelola dalam bentuk data-base, merawat dan mempublikasikan tesis saya tanpa meminta izin dari saya selama mencantumkan nama saya sebagai penulis dan sebagai pemegang dan atau sebagai penulis dan sebagai pemilik hak cipta.
Demikian pernyataan ini dibuat dengan sebenarnya.
Medan, Agustus 2021
Azri Rahmadi NIM. 197006001
iii
LEMBAR PENGESAHAN TESIS
Judul Tesis : Pemanfaatan Ekstrak Daun Kemuning
(Murraya paniculata L.) pada Pembuatan Masker Sheet sebagai Penghalus Wajah
Kategori : PTesis
Nama : Azri Rahmadi
Nomor Induk Mahasiswa : 197006001
Program Studi : Magister Ilmu Kimia
Fakultas : MIPA - Universitas Sumatera Utara
Disetujui di Medan, Agustus 2021 Komisi Pembimbing
Ketua Anggota
Dr. Emma Zaidar Nasution, M.Si Dr. Amir Hamzah Siregar, M.Si NIP. 195512181987012001 NIP. 196106141991031002
Ketua Program Studi Dekan
Prof. Dr. Tamrin, M.Sc Dr. Nursahara Pasaribu, M.Sc NIP.196007041989031003 NIP. 196301231990032001
iv Telah diuji pada
Tanggal: Agustus 2021
PANITIA PENGUJI TESIS Ketua :
Anggota : 1.
2.
3.
4.
v
PEMANFAATAN EKSTRAK DAUN KEMUNING (Murraya paniculata L.) PADA PEMBUATAN MASKER SHEET SEBAGAI
PENGHALUS WAJAH
ABSTRAK
Pemanfaatan Ekstrak Daun Kemuning (Murraya Paniculata L.) pada Pembuatan Masker Sheet Sebagai Penghalus Wajah. Tujuan penelitian ini adalah untuk menentukan sifat toksisitas dan senyawa aktif dari ekstrak, menentukan sifat antibakteri, antioksidan, senyawa aktif dari sediaan masker, dan menentukan karakterisasi dari masker sheet ekstrak meliputi pH, bobot jenis, dan organoleptik.
Masker sheet disintesis menggunakan daun kemuning dari Kabupaten Batu Bara sebagai bahan aktif serta menggunakan pati, gliserin, kitosan, dan PVA sebagai bahan baku utama. Analisis ekstrak dengan menggunakan uji fitokimia, uji BSLT, dan GC-MS. Analisis sediaan masker dilakukan dengan uji antibakteri, uji antioksidan, organoleptik, FT-IR, SEM, pH, GC-MS, uji kuat tarik dan bobot jenis.
Uji Fitokimia pada ekstrak mengandung senyawa alkaloid, flavonoid, tanin dan saponin dimana yang paling banyak terkandung pada ekstrak adalah flavonoid. Uji toksisitas pada ekstrak diperoleh nilai LC50 yaitu 369, 828 ppm termasuk pada tingkat toksisitas sedang. Data GC-MS menunjukkan ekstrak dan sediaan masker mengandung senyawa aktif tekoferol dan flavonoid yang dapat berfungsi sebagai zat antioksidan. Uji antibakteri dan uji antioksidan menunjukkan hasil bahwa bahan aktif yang diaplikasikan dalam sediaan masker wajah mampu menghambat pertumbuhan bakteri Stapylococcus aureus (zona hambat >20 mm) dan mampu menghambat reaksi oksidasi melalui reaksi radical scavenging (IC50<50 mg/L). Hasil karakterisasi sediaan masker diperoleh pH dan bobot jenis menunjukkan hasil yang sudah sesuai dengan SNI 16-6070-1999 (pH berkisar 4,5 – 8,0) dan SNI 16-4399-1966 (bobot jenis berkisar 0,95-1,05 g/mL).
Kata kunci: Antibakteri, Antioksidan, Daun kemuning, Masker sheet
vi
THE UTILIZATION OF KEMUNING (Murraya paniculata L.) LEAF EXTRACT IN THE MANUFACTURING OF SHEET MASK AS A
FACIAL SMOOTHER
ABSTRACT
The Utilization of Kemuning Leaf Extract (Murraya Paniculata L.) in Making Sheet Masks as Facial Smoothing. The purpose of this study was to determine the toxicity and active compounds of the extract, to determine the antibacterial, antioxidant, and active compounds of the mask preparation, and to determine the characterization of the extract sheet mask including pH, specific gravity, and organoleptic. Sheet masks were synthesized using yellow leaves from Batu Bara Regency as the active ingredient and using starch, glycerin, chitosan, and PVA as the main raw materials.
Extract analysis using phytochemical test, BSLT test, and GC-MS. The analysis of the mask preparation was carried out by means of antibacterial test, antioxidant test, organoleptic, FT-IR, SEM, pH, GC-MS, tensile strength test and specific gravity.
Phytochemical tests on extracts contain compounds of alkaloids, flavonoids, tannins and saponins where the most contained in the extract are flavonoids. Toxicity test on extract obtained LC50 value of 369, 828 ppm including moderate toxicity level. GC- MS data shows that extracts and mask preparations contain active compounds tecopherol and flavonoids that can function as antioxidants. Antibacterial tests and antioxidant tests showed that the active ingredients applied in face masks were able to inhibit the growth of Stapylococcus aureus bacteria (inhibition zone >20 mm) and were able to inhibit oxidation reactions through radical scavenging reactions (IC50<50 mg/L). The results of the characterization of mask preparations obtained that pH and specific gravity showed results that were in accordance with SNI 16- 6070-1999 (pH ranged from 4.5 to 8.0) and SNI 16-4399-1966 (specific gravity ranged from 0.95-1.05 g/mL).
Keywords: Antibacterial, Antioxidant, Kemuning leaf, Sheet mask
vii
PRAKATA
Segala puji dan syukur kepada Tuhan Yang Maha Esa atas kasih dan karuniaNya, penulis dapat menyelesaikan penelitian dan penulisan tesis dengan baik.
Tesis dengan judul: Pemanfaatan Ekstrak Daun Kemuning (Murraya Paniculata L.) Pada Pembuatan Masker Sheet Sebagai Penghalus Wajah merupakan salah satu syarat untuk memperoleh gelar Magister Sains pada Program Pascasarjana Ilmu Kimia FMIPA Universitas Sumatera Utara.
Keberhasilan penelitian dan penulisan tesis ini tidak terlepas dari bantuan dan dukungan dari berbagai pihak yang terlibat secara langsung maupun tidak langsung.
Untuk itu, pada kesempatan ini penulis ingin mengucapkan terima kasih kepada:
1. Rektor Universitas Sumatera Utara, Prof. Dr. Runtung Sitepu, S.H., M.Hum.
(Periode 2016–2021) dan Dr. Muryanto Amin, S.Sos., M.Si (Periode 2021– 2026), serta Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara, Prof. Dr. Kerista Sebayang, MS. (Periode 2016– 2021) dan Dr. Nursahara Pasaribu, M.Sc (Periode 2021–sekarang), atas kesempatan yang diberikan kepada penulis untuk mengikuti dan menyelesaikan pendidikan Program Magister Kimia Fakultas MIPA Universitas Sumatera Utara.
2. Ketua Program Magister S2 Kimia, Prof. Dr. Tamrin, M.Sc dan Sekretaris Program Studi Magister S2 Kimia Dr. Andriayani, M.Si, untuk Bapak/Ibu Staf Pengajar Program Studi Magister S2 Kimia FMIPA Universitas Sumatera Utara dan kak Inggi Prawita selaku staf di Pascasarjana S2 Kimia FMIPA USU atas kesempatan, ilmu, fasilitas dan bantuan yang diberikan kepada penulis selama mengikuti pendidikan Magister S2 Kimia FMIPA Universitas Sumatera Utara.
3. Dr. Emma Zaidar Nasution, M.Si selaku Komisi Pembimbing yang senantiasa dengan sabar memberikan arahan, bimbingan serta dukungan kepada penulis hingga penelitian dan tesis ini dapat terselesaikan dengan baik.
4. Dr. Amir Hamzah Siregar, M.Si selaku Dosen Penguji yang telah memberikan saran dan masukan yang membangun kepada penulis demi perbaikan dalam penulisan tesis ini.
viii
5. Kepala, laboran, dan asisten Laboratorium Biokimia/KBM FMIPA Universitas Sumatera Utara yang sudah mengizinkan dan memberikan fasilitas kepada penulis untuk melakukan penelitian.
6. Orangtua dan keluarga Ayahanda H. Ahmad Azizi, S.Pd dan Ibunda Dra. Hj.
Ratni dan juga untuk abang dan kakak Muhammad Aznil Fakhri, ST dan Azizatur Rahmah, S.Ei, ME yang tak henti memberi dukungan berupa moril dan materil hingga akhirnya penulis dapat menyelesaikan pendidikan Magister ini.
7. Rekan-Rekan Mahasiswa Magister Kimia FMIPA Universitas Sumatera Utara Stambuk 2019 : Fajar Hutagalung, S.Si; Rima Anggeraini, S.Si; Ayu Syufiatun br. Tarigan, S.Si; Daniel Silalahi, S.Si; Rufina Pramudita, S.Si; Liver Iman Putra Zai, S.Si; Rizky Kurniawan, S.Si dan abangda Hendri Ginting, S.Si yang bersama-sama berjuang dalam menyelesaikan perkuliahan, penelitian dan penulisan tesis selama 2 tahun di Program Studi Magister S2 Kimia FMIPA USU.
8. Seluruh pihak dan sahabat yang banyak membantu dan mendukung penulis.
Penulis menyadari bahwa tesis ini masih terdapat kekurangan. Oleh karena itu, penulis mengharapkan kritik dan saran yang membangun demi kesempurnaan tesis ini. Akhir kata, penulis berharap semoga tesis ini dapat bermanfaat bagi penelitian dan kemajuan ilmu pengetahuan di masa yang akan datang.
Medan, Agustus 2021
Azri Rahmadi
ix DAFTAR ISI
PERNYATAAN ORINALITAS i
PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ii
LEMBAR PENGESAHAN TESIS iii
ABSTRAK v
PRAKATA vii
DAFTAR ISI ix
DAFTAR TABEL xii
DAFTAR GAMBAR xiii
DAFTAR TAMPILAN xiv
DAFTAR SINGKATAN xv
BAB 1 PENDAHULUAN
1.1 Latar Belakang 1
1.2 Perumusan Masalah 4
1.3 Pembatasan Masalah 4
1.4 Tujuan Penelitian 4
1.5 Manfaat Penelitian 4
1.6 Metodologi Penelitian 5
BAB 2 TINJAUAN PUSTAKA
2.1 Tanaman Kemuning (Murraya paniculata L.) 6 2.2 Kandungan Kimia Kemuning (Murraya paniculata L.) 7
2.3 Kulit 9
2.4 Jenis-jenis Kuit 11
2.5 Masker 12
2.6 Masker Sheet 13
2.7 Essence 14
2.8 Ekstraksi 16
2.9 Skrinning Fitokimia 16
2.10 Toksisitas dengan metode BSLT (Brine Shrimp Lethality Test) 18
2.11 Antibakteri 18
2.12 Antioksidan 20
2.13 FTIR (Fourier Transformn Infra Red (FTIR) 20 2.14 Scanning Electron Microscopy (SEM) 22
2.15 Uji Kuat Tarik (Tensile Strength) 22 BAB 3 METODE PENELITIAN
3.1 Waktu dan Tempat 23
3.2 Alat dan Bahan 23
3.2.1 Alat-alat 23
3.2.2 Bahan-bahan 23
3.3 Prosedur Percobaan 23
3.3.1 Penyediaan Sampel 23
3.3.1.1 Pengambilan Sampel 23
3.3.1.2 Preparasi Serbuk Daun Kemuning 24
x
3.3.2 Ekstraksi Sampel 24
3.3.2.1 Skrining Fitokimia 24
3.3.2.1.1 Alkaloid 24
3.3.2.1.2 Flavonoid 24
3.3.2.1.3 Tanin 24
3.3.2.1.4 Saponin 25
3.3.2.1.5 Steroid dan Terpenoid 25
3.3.2.2 Pengujian Toksisitas 25
3.3.2.2.1 Persiapan Larva Udang 25
3.3.2.2.2 Persiapan Larutan Pekat 25
3.3.2.2.3 Pengujian Toksisitas 26
3.3.2.2.4 Perhitungan LC50 26
3.3.2.3 Pengujian Aktivitas Antioksidan dengan Metode
Peredaman Radikal Bebas Menggunakan DPPH 26
3.3.2.3.1 Pembuatan Larutan DPPH 0,4 M 26
3.3.2.3.2 Pembuatan Larutan Blanko 26
3.3.2.3.3 Pembuatan Larutan Uji 27
3.3.2.3.4 Pembuatan Larutan Vitamin C Standar 27 3.3.2.3.5 Pengukuran Serapan Peredaman Radikal Bebas
DPPH 27
3.3.2.3.6 Perhitungan Nilai IC50 27
3.3.2.4 Pengujian Aktivitas Bakteri 28
3.3.2.4.1 Pembuatan Media MHA 28
3.3.2.4.2 Pembuatan Media NA 28
3.3.2.4.3 Uji Aktivitas Bakteri 28
3.3.3 Pembuatan Sediaan Masker Sheet 28
3.3.3.1 Pembuatan Masker Sheet 28
3.3.3.2 Pembuatan Sediaan Ekstrak Kemuning 29
3.3.3.3 Karakterisasi Masker 30
3.3.3.3.1 Pengukuran pH 30
3.3.3.3.2 Bobot Jenis 30
3.3.3.3.3 Pengujian Organoleptik 30
3.3.3.3.4 Pengujian Kuat Tarik 31
3.3.4 Bagan Penelitian 33
3.3.4.1 Pembuatan Ekstrak Daun Kemuning 33
3.3.4.2 Pembuatan Masker Sheet 34
3.3.4.3 Pembuatan Sediaan Ekstrak Daun Kemuning 35 BAB 4 HASIL DAN PEMBAHASAN
4.1 Uji Fitokimia ekstrak daun kemuning 36
4.2 Uji Toksisitas 37
4.3 Uji GC-MS 38
4.4 Pembuatan Sediaan Masker 39
4.5 Pengujian Sediaan Masker 40
4.5.1 Uji pH 40
4.5.2 Uji FT-IR 41
4.5.3 Uji Antibakteri 41
4.5.4 Uji Antioksidan 42
xi
4.5.5 Uji CG-MS Sediaan Masker 44
4.6 Pembuatan Masker Sheet 44
4.7 Pembuatan Masker Sheet Dengan Penambahan Sediaan Masker 45
4.8 Pengujian Masker Sheet Dengan Sediaan 46
4.8.1 Uji Kuat Tarik 46
4.8.2 Uji Morfologi Permukaan Menggunakan SEM 47
4.8.3 Uji FTIR 49
4.8.4 Uji Organoleptik 50
4.8.4.1 Hasil Uji Organoleptik Masker Sheet 50
4.8.4.2 Tekstur 51
4.8.4.3 Warna 51
4.8.4.4 Aroma 52
4.8.4.5 Homogenitas 53
4.8.4.6 Kesukaan Umum 54
4.8.5 Bobot Jenis 55
BAB 5 KESIMPULAN DAN SARAN
5.1 Kesimpulan 56
5.2 Saran 56
DAFTAR PUSTAKA 57
LAMPIRAN 64
xii
DAFTAR TABEL
Nomor
Tabel Judul Halaman
2.1 Jenis-jenis Essence 15
3.1 Formulasi sediaan ekstrak daun kemuning masker sheet 29
3.2 Skala penilaian uji organoleptik 30
4.1 Uji Fitokimia ekstrak daun kemuning 35
4.2 Hasil Pengujian BSLT 36
4.3 Komponen senyawa pada ekstrak daun kemuning 37
4.4 Pengujian pH pada masker sheet 39
4.5 Hail uji antibakteri 40
4.6 Hasil uji antioksidan DPPH 41
4.7 Tingkat kekuatan antioksidan 42
4.8 Komponen senyawa masker sheet ekstrak daun kemuning 43
4.9 Hasil uji kuat tarik 45
4.10 Tingkat kesukaan tekstur 50
4.11 Tingkat kesukaan warna 50
4.12 Tingkat kesukaan Aroma 52
4.13 Tingkat kesukaan Homogenitas 52
4.14 Tingkat kesukaan Kesukaan umum 53
4.15 Nilai bobot jenis masker 54
xiii
DAFTAR GAMBAR
Nomor
Gambar Judul Halaman
2.1 Kemuning (Murraya paniculata L.) 6
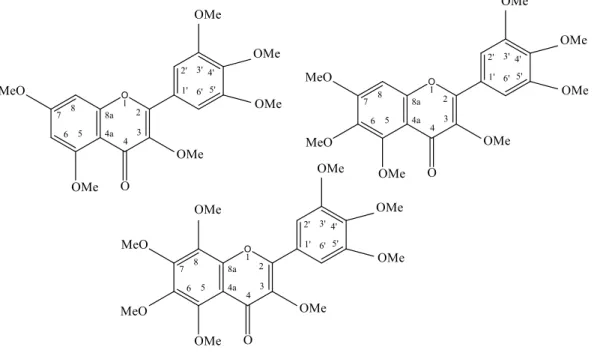
2.2 Struktur kimia senyawa flavonoid diisolasi dari Murraya paniculata L., 3,3’,4’,5,5’,7–heksametoksiflavon (a), 3,3’,4’,5,5’,6,7-heptametoksiflavon (b), dan
3,3’,4’,5,5’,6,7,8-oktametoksiflavon (c).
8
2.3 Struktur anatomi kulit 11
4.1 Kromatogram senyawa pada ekstrak daun kemuning 37
4.2 Sediaan masker 39
4.3 Hasil FT-IR sediaan masker daun kemuning 40
4.4 Zona bening sediaan ekstrak daun kemuning 41
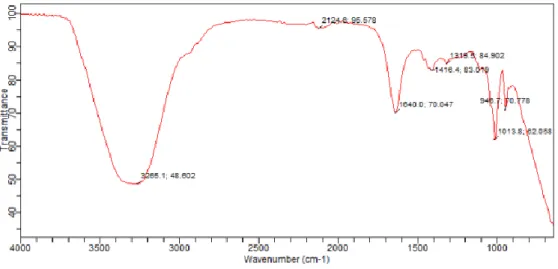
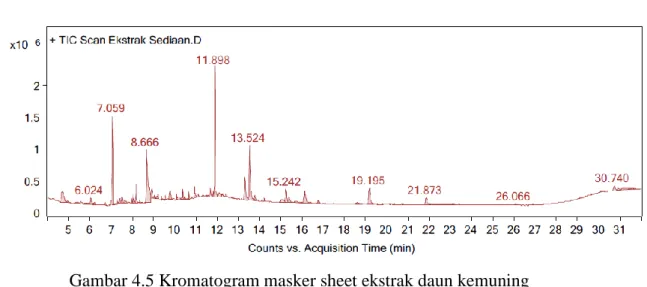
4.5 Kromatogram masker sheet ekstrak daun kemuning 43
4.6 Masker sheet 44
4.7 Hasil spektrum campuran masker 44
4.8 Masker sheet denga sediaan ekstrak daun kemuning 45 4.9 Uji morfologi permukaan sediaan masker tanpa ekstrak daun
kemuning
47 4.10 Uji morfologi permukaan sediaan masker dengan ekstrak
daun kemuning
48 4.11 Hasil spektrum FT-IR masker sheet dengan ekstrak daun
kemuning
49
xiv
DAFTAR LAMPIRAN
Nomor
Lampiran Judul Halaman
1 Nilai probit kematian 64
2 Perhitungan nilai LC50 64
3 Perhitungan nilai IC50 65
4 Perhitungan uji kuat tarik 65
5 Hasil uji antibakteri 69
6 Senyawa hasil uji GC-MS ekstrak kasar 70
7 Senyawa hasil uji GC-MS ekstrak sediaan 73
8 Hasil rekapitulasi uji organoleptik masker sheet 75
9 Perhitungan bobot jenis 80
xv
DAFTAR SINGKATAN
SEM = Scanning Electron Microscpe FT-IR = Fourier Transform Infra Red
GC-MS = Gas Chromatography-Mass Spectrometry PEG = Polietilena glikol
HCO = Hydrogenated Castor Oil DM = Dimineralisasi
SNI = Standart Nasional Indonesia BSLT = Brine Shrimp Lethality Test
BAB I PENDAHULUAN
1.1 Latar Belakang
Daun kemuning (Murraya paniculata L), yang biasa dikenal sebagai melati jeruk atau semak madu (Kamini dalam bahasa Hindi) merupakan suku keluarga tumbuhan Rutaceae. Tanaman ini tersebar ke seluruh India, Bangladesh, Srilanka, Myanmar, Cina Selatan, Taiwan, Thailand, Malaysia, Kaledonia hingga timur laut Australia dan juga Indonesia (Gautam et al., 2012). Tanaman ini sering dijadikan sebagai tanaman hias tetapi sebenarnya memiliki banyak khasiat seperti anti-tiroid, penghalus kulit, sebagai obat, antioksidan, antibakteri dan antirematik (Sukohar et al., 2017).
Penelitian mengenai daun kemuning banyak dilakukan dan telah dilaporkan karya ilmiahnya dimana memiliki aktivitas biologis yang digunakan sebagai obat penurun panas (antipiretik) dan juga antibakteri terhadap bakteri Staphylococcus aureus (Putri, 2015). Senyawa-senyawa metabolik sekunder banyak yang memiliki efek pengobatan jika dikonsumsi manusia, salah satunya dalah flavonoid yang memiliki kemapuan sebagai antioksidan untuk mengurangi tekanan radikal bebas yang dapat menginduksi penyakit degeneratif dalam tubuh manusia (Akinmoladun, 2016)(Sembiring, 2015).
Daun kemuning juga diketahui memiliki aktivitas antibiotik terhadap Mycococcus pyogenes dan Escherichia coli. Selanjutnya, daun dan akar tanaman ini digunakan dalam pengobatan tradisional untuk mengobati sakit perut, sakit gigi, asam urat, diare, disentri, rematik, batuk dan histeria. Daun ini juga dilaporkan memiliki anti-diabetes (Gautam et al., 2012), antinociceptive dan anti- inflamasi (Wu et al., 2010), anti-diare, sifat oksitosik, anti-kesuburan dan antioksidan in-vitroserta ekstrak hidro-alkohol M. paniculata tidak memiliki toksisitas pada hewan pengerat (Gautam et al., 2012). Penggunaan daun kemuning juga direkomendasikan untuk pengobatan luka, perawatan kulit, nyeri sendi, dan nyeri tubuh. (Zhu et al., 2015).
Serbuk daun dapat digunakan untuk luka dan meningkatkan penyembuhan. Rebusan daun ini juga dapat digunakan untuk mengobati penyakit
gembur-gembur. Di antara Paudi Bhuinya di Orissa utara, daun ini dijadikan dalam bentuk pasta yang berguna untuk penyembuhan tulang yang patah dengan mengoleskan pada bagian luar kulit untuk meredakan sendi yang meradang.
Penjelesan khasiat dari daun kemuning sehingga memiliki potensi menjadi bahan kosmetik yang dapat berguna untuk bagian luar tubuh (Gautam et al., 2012).
Kosmetik merupakan produk yang diaplikasikan pada tubuh atau wajah untuk meningkatkan penampilan yaitu dengan cara membersihkan, mempercantik, meningkatkan daya tarik dan mengubah penampilan tubuh (Okereke, 2015).
Kosmetik digunakan untuk memelihara kecantikan yang semakin berkembang seiring dengan perkembangan bioteknologi (Muchtardi, 2017). Pembuatan kosmetik dari bahan alami lebih baik dari pada bahan sintesis, bahan sintesis dapat merusak bentuk alami dari kulit sedangkan bahan alami lebih aman dalam penggunaan (Grace et al., 2015). Salah satu produk dari kosmetik adalah masker wajah atau facial mask yang merupakan produk untuk perawatan kulit wajah.
Masker wajah sangat bagus dan juga sebagai alternatif yang efektif untuk membantu perawatan kulit rutin karena konsumen dapat memiliki dan menggunakannya di rumah (Afonso et al., 2019). Produk perawatan kulit dengan daya tarik anti-penuaan telah menjadi yang terbaik sering menjadi perhatian dermatologis. Penambahan ekstrak yang bersifat alami meningkatkan daya anti- penuaan secara natural. Salah satu ekstrak yang bersifat alami tersebut yaitu ekstrak kemuning. Adanya penambahan pada ekstrak daun kemuning tersebut akan mampu meningkatkan kemampuan masker sebagai anti-penuaan pada kulit (Muchtardi, 2017).
Kulit merupakan lapisan tubuh sebagai pelindung dari paparan polusi dari lingkungan, terutama kulit wajah yang sering terpapar sinar UV yang akibatnya dapat menimbulkan masalah pada kulit seperti keriput, jerawat, penuaan dan pori kulit membesar. Sehingga merupakan sesuatu yang penting untuk merawat kulit (Grace et al. 2015).
Masker biopolimer adalah masker yang material polimernya yang berasal dari alam dan bersifat biodegradable. Masker biopolimer yang mengandung bioaktif dapat melepaskan senyawa bioaktif di bagian kulit yang tepat, pada waktu yang tepat, dan dengan dosis yang tepat (Morganti et al., 2016). Proses penuaan
kulit melibatkan degradasi matriks ekstraseluler di epidermis dan lapisan dermal, menunjukkan tanda-tanda yang terlihat pada permukaan kulit (Afonso et al., 2019).
Tipe-tipe masker wajah adalah masker lembaran atau popular dengan nama sheet mask, masker bilas, masker pell-off, dan masker hidrogel. Bahan yang digunakan dalam sheet mask dapat bervariasi tergantung merek dan juga bentuk sheet mask. Sheet mask yang diaplikasikan akan melembabkan kulit dengan baik dan mendalam, menghilangkan sebum (kelenjar minyak), dan meremajakan kulit atau mencegah hiperpigmentasi (Nilforoushzadeh et al., 2018).
Masker sheet adalah salah satu tren terbaru dan yang populer di Asia.
Dibandingkan masker dengan bentuk lain, masker sheet memiliki mekanisme Occasional Dressing Treatment (ODT) yang membuat profil penyerapan dan penetrasi yang baik, pengemasan yang efisien dan higienis (sekali pakai), dan tidak perlu dibersihkan setelah pemakaian (Reveny et al., 2016). Pembuatan masker sheet dengan menggunakan bahan baku seperti pati, kitosan dan gliserin yang dapat digunakan sebagai sebagai bahan tambah untuk perawatan wajah (Hariati, 2019).
Gautam et al., 2012 telah meneliti bahwa ekstrak daun kemuning memiliki sifat antibakteri diuji dengan bakteri E. coil, K. pneumoniae, S. typhi, E. faecalis, P. aeruginosa, S. flexinerrii, S. aureus, S. sonneii, di dapatkan zona hambat paling besar yaitu 14 mm. Tresia et al., 2016 telah meneliti sifat toksisitas ekstrak daun kemuning dan didapatkan persen mortalitas paling besar yaitu 95%. Hapsari, 2019 telah membuat sediaan masker yang memiliki aktivitas antioksidan dan antibakteri dengan menggunakan ekstrak daun kelor.
Berdasarkan uraian diatas, peneliti tertarik untuk membuat sediaan masker dari ekstrak kemuning karena daun kemuning banyak memiliki khasiat baik di dalam maupun luar tubuh serta diekplorasi senyawa yang terkandung dalam sediaan masker dari ekstrak kemuning tersebut. Kemudian sediaan masker diaplikasikan ke dalam masker sheet yang akan digunakan sebagai pembersih dan penghalus wajah.
1.2 Perumusan Masalah
1. Untuk menentukan sifat toksisitas dan senyawa aktif dari ekstrak daun kemuning.
2. Untuk menentukan sifat antibakteri, antioksidan dan senyawa aktif dari sediaan masker daun kemuning.
3. Untuk menentukan karakterisasi dari masker sheet ekstrak daun kemuning meliputi pH, Bobot jenis, Organoleptik.
1.3 Pembatasan Masalah
1. Sampel yang digunakan pada penelitian adalah daun kemuning di daerah batu bara
2. Analisis pada sediaan masker sheet dilakukan uji pengamatan,
antibakteri, antioksidan, organoleptik, FT-IR, SEM, pH, kuat tarik, dan BSLT.
3. Pembuatan masker menggunakan pati, gliserin, kitosan, PVA sebagai bahan baku utama
1.4 Tujuan Penelitian
1. Untuk menentukan sifat toksisitas dan senyawa aktif dari ekstrak daun kemuning.
2. Untuk menentukan sifat antibakteri, antioksidan dan senyawa aktif dari sediaan masker daun kemuning.
3. Untuk menentukan karakterisasi dari masker sheet ekstrak daun kemuning meliputi pH, Bobot jenis, Organoleptik.
1.5 Manfaat Penelitian
Hasil dari penelitian ini diharapkan dapat menjadi sarana informasi dan ilmu pengetahuan dibidang kecantikan tentang pembuatan masker sheet dari pati tapioka dan juga penggunaan daun kemuning sebagai ekstrak yang sangat bermanfaat untuk kulit wajah.
1.6 Metodologi Penelitian
Penelitian ini terdiri dari beberapa tahap yaitu persiapan bahan baku, pembuatan ekstrak daun kemuning, pembuatan masker sheet, karakterisasi hasil masker sheet dengan malakukan Analisis SEM, FT-IR, GC-MS, pH, BSLT, kuat tarik, organoleptik, antibakteri dan antioksidan.
Pembuatan masker wajah dengan mencampurkan tepung tapioka kedalam ekstrak daun kemuning, kemudian sambil dipanaskan sampai homogen, kemudian ditambahkan kitosan dan gliserin diaduk hingga mengental, lalu ditambahkan larutan Polivinil Alkohol (PVA) diaduk dan dipanaskan hingga suhu 80 oC, dicetak diatas plat akrilik, kemudian dikeringkan kedalam oven dengan suhu 40 – 50 oC selama 2 hari.
Setelah itu dibuat sediaan ekstrak daun kemuning dengan melarutkan xanthan gum dengan aqua dimineralisasi, ditambahkan dengan butilan glikol dan gliserin lalu digerus hingga homogen (camputan I). Dilarutkan nipagin dan nipasol didalam air panas (campuran II). Dilarutkan ekstrak daun kemuning dengan PEG-40 Hydrogenated castor oil dengan sebagian aqua dimineralisasi (campuran III). Lalu dicampurkan campuran II sedikit demi sedikit kedalam campuran I hingga homogen. Kemudian dicampurkan dengan campuran III dan digerus hingga campuran homogen.
BAB II
TINJAUAN PUSTAKA
2.1 Tanaman Kemuning (Murraya paniculata L.)
Tanaman Kemuning (Murraya paniculata L.) merupakan pohon perdu, tumbuh liar di semak belukar ataupun di hutan, dan secara luas tumbuh di negara India, Asia Tenggara, China bagian selatan, Taiwan dan kepulauan Okinawa (Kinoshita et al., 1989). Tumbuhan ini termasuk dalam familia Rutaceae.
Murraya. paniculata merupakan tumbuhan yang digunakan sebagai obat tradisional misalnya sebagai pemati rasa (anastesi), sedatif, anti-inflamasi, anti- rematik, penghilang bengkak dan anti-tiroid. Di China, Murraya paniculata dan Murraya exotica digunakan secara tradisional untuk pengobatan sakit kepala, sakit gigi, nyeri perut, influenza, reumatik, luka traumatik, dan luka gigitan serangga. Bagian tanaman yang digunakan adalah daun, kulit batang maupun buahnya (Kong et al., 1986).
Gambar 2.1 Kemuning (Murraya paniculata L.)
Kemuning biasanya tumbuh disemak belukar, tepi hutan, atau tanaman sebagai tanaman hias dan tanaman pagar. Kemuning juga termasuk tanaman semak atau pohon kecil. Pohon kemuning bercabang dan beranting banyak.
Tinggi tanaman kemuning ini sekitar 3-8 m. Batang kemuning keras, beralur, dan tidak berduri. Daunnya majemuk bersirip ganjil dengan jumlah anak daun antara
3-9 helai dan letaknya berseling. Helaian daun bertangkai berbentuk telur, sungsang, ujung pangkal runcing, serta tepi rata atau sedikit bergerigi. Panjang daun sekitar 2-7 cm dan lebar antara 1-3 cm Permukaan daun licin, mengkilap, dan berwarna hijau. Bunga kemuning bersifat majemuk dan berbentuk tandan yang terdiri dari 1-8 bunga Warnanya putih dan berbau harum. Bunga-bunga kemuning keluar dari ketiak daun atau ujung ranting. Buah kemuning berbentuk bulat telur atau bulat memanjang dengan panjang 8-12 mm. Ketika masih muda, buah berwarma hijau dan setelah tua menjadi merah mengkilap (Dalimartha, 1999).
Klasifikasi tanaman kemuning adalah : Kingdom: Plantae ( plants)
Divisi : Spermatophyta Subdivisi : Angiospermae Kelas : Dicotyledonae Ordo : Sapindales Famili : Rutaceae Genus : Murraya
Spesies : Murraya paniculata (L.) Jack.
2.2 Kandungan Kimia Kemuning (Murraya paniculata L.)
Kemuning (Murraya paniculata L.) mempunyai banyak kandungan senyawa kimia antara lain : yuehchukene, sibiricin, mexoticin, 5,7-dimetoksi-8- (3-metil-2-okso-butil) kumarin, murrangatin, murrangatin ester, murralongin, scopoletin, edulitin, metil N-metil anthranilat, 3’,4’,5’,5,7-pentametoksiflavon, 3’,4’,5,5’,7,8-heksametoksi-flavon (Kong et al., 1986; Imai et al., 1989). Ferracin et al. (1998) melaporkan sembilan senyawa flavonoid yang diisolasi dari buah segar M. paniculata. Kesembilan senyawa tersebut adalah : 5-Hidroksi-3,3, 4’,5’,7,8,-heksametoksiflavon, 8-hidroksi-3,3’,4’,5,5’,7-heksametoksiflavon, 3, 3’,4’,5,7,8-heksametoksiflavon,a3’,4’,5,5’,7-pentametoksiflavon,a3’,4’,5,5’,6,7 he ksametoksi flavon, 3,3’,4’, 5,5’,6,7-heptametoksiflavon, 3’,4’5,5’,7,8 – heksa - metoksiflavon, 3,3’4’5,5’,7,8,-heptametoksiflavonadana5-hydroxy-3,a3’,4’-7 pen tametoksiflavon.
Penemuan ini juga didukung temuan ilmiah oleh Riyanto (2003). Kulit batang M. paniculata mempunyai kandungan kimia senyawa flavonoid yaitu senyawa flavon termetilasi. Senyawa tersebut yaitu 3,3’,4’,5,5’,6,7,8- oktametoksiflavon; 3,3’,4’,5,5’,6,7-heptametoksiflavon; dan 3,3’,4’,5,5’, 7–
heksametoksiflavon. Sedangkan daun Murraya paniculata mempunyai kandungan kimia : 3,3’,4’,5,5’,7–heksametoksiflavon dan 3’,4’,5,5’,7-pentametoksiflavon.
Dari informasi ilmiah di atas, salah satu aktivitas farmakologi tanaman Murraya paniculata L. adalah anti-inflamasi. Reaksi inflamasi melibatkan peran mediator inflamasi yaitu histamin, prostaglandin, tromboksan. Pada penelitian, senyawa flavonoid dari tanaman Murraya paniculata diuji pengaruhnya terhadap pelepasan histamin dari kultur sel RBL-2H3. Apabila senyawa tersebut menghambat pelepasan histamin maka tanaman tersebut berpotensi dikembangkan sebagai obat antialergi. Namun, jika memodulasi pelepasan histamin dari sel mast maka tanaman tersebut berpotensi sebagai alergen.
Gambar 2.2 . Struktur kimia senyawa flavonoid diisolasi dari Murraya paniculata L., 3,3’,4’,5,5’,7–heksametoksiflavon (a), 3,3’,4’,5,5’,6,7-heptametoksiflavon (b), dan 3,3’,4’,5,5’,6,7,8-oktametoksiflavon (c).
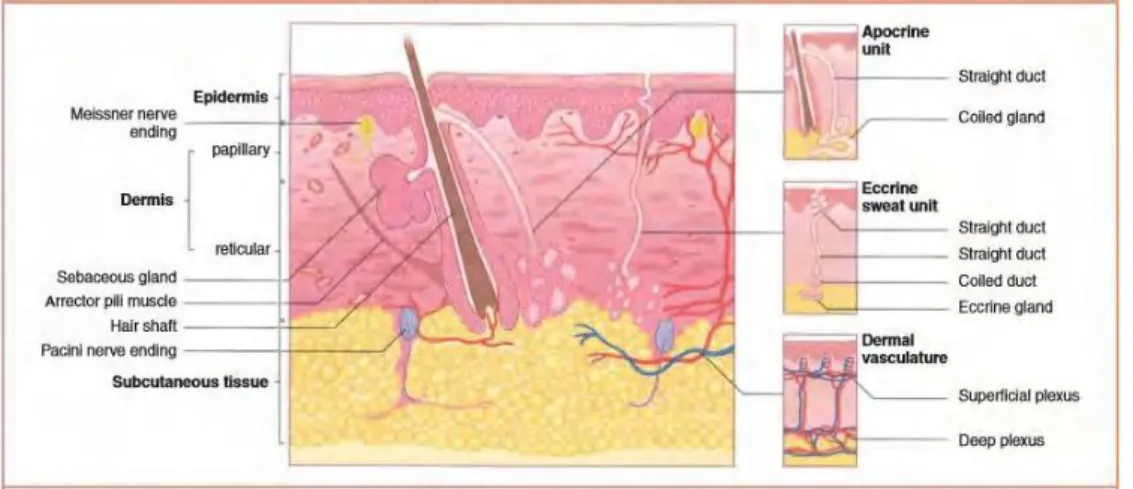
2.3 Kulit
Kulit merupakan bagian yang paling luar dari tubuh dan merupakan organ yang terluas, yaitu antara 1,5 - 2 m dengan berat kurang lebih 20 kg, sedangkan bagian kulit yang terlihat dari luar disebut epidermis beratnya 0,05-0,5 kg. Kulit juga bersifat sebagai pembungkus elastis yang terletak paling luar yang dapat melindungi tubuh dari pengaruh lingkungan hidup manusia (Putro, 1997). Kulit juga sangat kompleks, sensitif dan elastis serta bervariasi pada keadaan iklim, lokasi tubuh, ras, umur, dan jenis kelamin (Wasitaatmadja, 1997). Ketebalan kulit berbeda-beda sesuai dengan fungsinya. Kulit ditelapak kaki merupakan kulit yang tebal, sedangkan di bibir, dada, dan paha kulit tampak tipis (Dwikarya, 2002).
Secara histopatologis kulit tersusun atas 3 lapisan utama yaitu lapisan epidermis, lapisan dermis dan lapisan hypodermis (Wasitaatmadja, 1997).
a. Lapisan Epidermis
Lapisan epidermis tersusun atas epitel berlapis gepeng berkeratin. Pada lapisan ini terdapat empat jenis sel utama, yaitu keratinosit, melanosit, sel Langerhans, dan sel Merkel. Menurut Anderson (1996), lapisan epidermis tersusun dari 5 lapisan, yaitu:
1. Lapisan tanduk (stratum korneum), stratum korneum merupakan lapisan paling luar yang tersusun dari sel mati berkreatin dan memiliki sawar kulitpokok terhadap kehilangan air. Apabila kandungan air pada lapisan ini berkurang, maka kulit akan menjadi kering dan bersisik.
2. Lapisan lusidum (stratum lusidum), lapisan ini tersusun dari beberapa lapisan transparan dan di atasnya terdapat lapisan tandk dan bertindak juga sebagai sawar pada umumnya terdapat pada telapak tangan dan kaki.
3. Lapisan granulosum (stratum granulosum), lapisan ini terdiri dari 2 Sampai lapisan Sel dan terletak di atas lapisan stratum spinosum dan berfungsi untuk mengnasi protein dan ikatan kimia stratum korneum.
4. Lapisan spinosum (stratum spinosum), lapisan spinosum merupakan lapisan paling tebal dari epidermis. Sel diferensiasi utama stratum spinosum adalah keratinosit yang membentuk keratin.
5. Lapisan basal (stratum basale), lapisan basal merupakan bagian yang paling dalam dari epidermis dan tempat pembentukan lapisan baru yang menyusun
epidermis. Lapisan ini terus membelah dan sel hasil pembelahan ini bergerak ke atas membentuk lapisan spinosum. Melanosit yang membentuk melanin untuk pigmentasi kulit terdapat dalam lapisan ini.
b. Lapisan Dermis
Lapisan Dermis merupakan lapisan yang berada di bawah lapisan epidermis. Lapisan ini terdiri dari beberapa jaringan ikat yang memiliki dua lapisan yaitu :
1. Pars papilaris, terdiri atas sel fibroblast yang memproduksi kolagen.
2. Retikularis, yaitu lapisan yang memiliki banyak pembuluh darah, tempat akar rambut, kelenjar keringat, dan kelenjar sebaseus (Putro, 1997).
c. Lapisan Hypodermis (Subkutan)
Lapisan hypodermis (subkutan) adalah lapisan yang terletak di bawah dermis dan mengandung sel-sel lemak yang dapat melindungi bagian dalam organ dari trauma mekanik dan juga sebagai pelindung tubuh terhadap udara dingin, serta sebagai pengaturan suhu tubuh (Prianto, 2014). Lapisan subkutan terdiri atas jaringan ikat longgar berisi sel-sel lemak di dalamnya. Sel lemak merupakan sel bulat, besar, dengan inti terdesak kepinggir karena sitoplasma lemak yang bertambah. Sel-sel ini membentuk kelompok yang dipisahkan satu dengan yang lainnya oleh trabekula yang fibrosa. Lapisan sel lemak disebut panikulus adiposus, berfungsi sebagai cadangan makanan. Dilapisan ini terdapat ujung- ujung sarat tepi, pembuluh darah, dan saluran getah bening. Tebal jaringan lemak tidak sama bergantung pada lokasi, di abdomen 3 cm, sedangkan di daerah kelopak mata dan penis sangat tipis. Lapis lemak ini juga berfungsi sebagai bantalan (Wasitaatmadja, 1997). Lapisan ini terdiri atas jaringan konektif, pembuluh darah dan sel-sel penyimpanan lemak yang memisahkan dermis dengan otot, tulang dan struktur lain. Jumlah lemak dalam lapisan ini akan meningkat bila makan berlebihan, sebaliknva bila tubuh memerlukan energi yang banyak maka lapisan ini akan memberikan energi dengan cara memecah simpanan lemaknya (Putro, 1997).
Gambar 2.3 Struktur anatomi kulit (James, et al., 2006)
2.4 Jenis-jenis Kulit
Jenis-jeis kulit ditinjau dari sudut pandang kesehatan, kulit terbagi atas lima jenis (Noormindhawati, 2013) yaitu:
a. Kulit normal
Merupakan kulit ideal yang sehat, memiliki pH normal, kadar air dan kadar minyak seimbang, tekstur kulit kenyal, halus dan lembut, pori-pori kulit kecil.
b. Kulit berminyak
Merupakan kulit yang memiliki kadar minyak berlebihan di permukaan kulitsehingga tampak mengkilap, memiliki pori-pori besar, mudah berjerawat.
c. Kulit kering
Merupakan kulit yang tampak kasar, kusam, kulit mudah bersisik, terasa kaku, tidak elastis, dan mudah berkeriput
d. Kulit kombinasi
Merupakan jenis kulit kombinasi yaitu antara kulit wajah kering dan berminyak Pada area T cenderung berminyak, sedangkan pada derah pipi berkulit kering
e. Kulit sensitif
Merupakan kulit yang memberikan respons secara berlebihan terhadap kondisi tertentu, misalnya suhu, cuaca, bahan kosmetik atau bahan kimia lainnya yang menyebabkan timbulnya gangguan kulit seperti kulit mudah menjadi iritasi, kulit menjadi lebih tipis dan sangat sensitif.
2.5 Masker
Masker adalah produk kosmetik yang menerapkan prinsip Occlusive Dressing Treatment (ODT) pada ilmu dermatologi yaitu teknologi absorpsi perkutan dengan menempelkan suatu selaput atau membran pada kulit sehingga membentuk ruang semi-tertutup antara masker dan kulit untuk membantu penyerapan obat (Lu, 2010)(Lee, 2013).
Masker yang diaplikasikan pada wajah menyebabkan suhu kulit wajah meningkat (±1°C) sehingga peredaran darah kulit juga meningkat, mempercepat pembuangan sisa metabolisnme kulit, meningkatkan kadar oksigen pada pori-pori secara perlahan membuka dan membantu penetrasi zat aktif ke dalam kulit 5 hingga 50 kali dibanding sediaan lain (Lu,2010; Lee, 2013).
Menurut Mitsui (1997) terdapat beberapa jenis masker yang sering dipergunakan adalah sebagai berikut:
1. Tipe peel off
Prinsip pada masker peel-of adalah dengan memanfaatkan filming agent yang melekat pada kulit sehingga saat masker kering akan terbentuk lapisan film tipis. Ketika dilepaskan, sel-sel kulit mati dan kotoran pada pori akan ikut terlepas bersama dengan lapisan film tersebut. Keuntungan dari tipe ini adalah dapat mengangkat sel kulit mati, kotoran kulit, komedo, rambut wajah yang tak diinginkan dan memperbaiki warna tekstur kulit.
2. Tipe wash off
Tipe wash off ini adalah masker yang tidak akan membentuk film pada kulit, masker wash off ini terbagi menjadi 4 jenis yaitu:
a. Tipe mud pack
Kegunaan utama tipe ini adalah membersihkan dan melembapkan.
Bahanyang digunakan adalah kaolin, bentonit, lumpur alami, serbuk kacang- kacangan, dan sebagainya. Keuntungan dari tipe ini yakni masker tersebut mengandung surfaktan dan air sehingga mampu melunakkan dan membersihkan sebum kulit yang telah mengeras. Kerugian dari tipe ini mampu terkontaminasi bakteri sehingga perlu penambahan pengawet yang banyak dan sulit untuk dibersihkan.
b. Tipe krim
Merupakan tipe krim emulsi minyak dalam air, Kegunaan utamanya adalah untuk melembabkan kulit karena kandungan minyak tumbuhan serta mampu melunakkan sel kulit mati dan komedo. Keuntungan dari tipe ini dapat digunakan pada semua bagian kulit dan cocok digunakan untuk kulit yang berkeriput. Kerugian dari tipe ini penggunaan kurang praktis, periu dicuci, dan penggunaan yang kurang tepat dapat menimbulkan masalah jerawat.
c. Tipe gel
Merupakan gel transparan atau semi transparan yang dibuat menggunakan polimer larut air, sering ditambahkan humektan seperti gliserin. Keuntungan dari tipe ini yakni cocok untuk kulit sensitif. Kekurangan dari tipe ini penggunaan kurang praktis, perlu dicuci dengan air.
d. Tipe sheet
Umumnya menggunakan bahan non woven yang diresapi dengan losion atau essence yang kemudian didiamkan pada kulit wajah hingga meresap pada kulit. Keuntungannya yaitu memberikan efek dingin, nyaman digunakan serta pemakaiannya praktis.
2.6 Masker Sheet
Masker Sheet adalah masker wajah yang berbentuk lembaran yang biasanya teruat dari kertas atau pulp kelapa. Masker sheet ini telah banyak digunakan khususnya di Asia bagian timur, lembaran masker umumnya terbuat dari kain non woven, serat kertas, bioselulosa dan sebagainya. Masker ini juga dapat meningkatkan efek melembabkan, memutihkan dan anti-aging, tetapi kurang mampu membersihkan dan mengangkat sel kulit mati ( Lee, 2013).
Masker sheet ini pula memiliki beberapa jenis lembaran masker menurut Lee, 2013 yaitu sebagai berikut :
a. Tipe non woven
Tipe non woven adalaha tipe dengan menggunakan bahan tekstil seperti polypopilen dan viscose rayon. Keuntungannya lebih fleksibel, tidak mudah robek, bersifat hidrofil sehingga mampu meresap essence, dan tidak meninggalkan sisa essence di dalam kemasan. Kerugiannya pada penggunaan yag terlalu lama dapat menyebabkan kulit kering.
b. Tipe serat kertas (pulp)
Tipe serat kertas (pulp) ini pada dasarnya serat kertas merupakan bahan dasar pembuatan masker sheet, tetapi saata ini telah digantikan dengan bahan non wove. Keuntungannya lebih tipis dan mampu melekat baik dengan kulit.
Kerugiannya tingkat resapan essence terbatas dan mudah robek disebabkan permukaan masker lebih tipis.
c. Tipe bioselulosa
Tipe bioselulosa ini merupakan teknologi terbaru pembuatan masker sheet, menggunakan selulosa alami dari hasil fermentasi mikroorganisme.
Keuntungannya pada tipe ini sangat mampu melekat pada kulit sehingga tidak mudah terlepas dan tidak mengiritasi kulit. Kerugiannya pada biaya pembuatan relatif lebih mahal.
d. Tipe jeli
Tipe jeli ini dibuat dengan mencampurkan essence dan gelling agent, kemudian dicetak dengan cetakan masker menghasilkan jeli yang transparan.
Keuntugannya pada penggunaannya lebih praktis dibanding tipe masker lainnya.
Kerugiannya memiliki kemampuan penetrasi essence ke dalam kulit lebih bagus dibandingkan jenis masker sheet lainnya.
2.7 Essence
Essence adalah produk dengan konsentrat bahan aktif yang cukup tinggi, tetapi tidak setinggi serum. Tekstrunya lebih cair dari pada serum sehingga pada umumnya orang menyebutnya serum ringan. Essence ini sagat cocok untuk ditempatkan pada penyelesaian masalah pada kulit tertentu.
Essence merupakan tipe sediaan kosmetik yang sudah lama diperkenalkan.
Alasan yang membuat essence laku di pasaran adalah perubahan gaya hidup konsumen, sebagai contoh masyarakat ingin mempersingkat rutinitas kosmetik harian mereka untuk menghemat waktu, gambaran bahwa konsentrat berarti produk tersebut memiliki efek yang lebih baik, serta juga nyaman digunakan karena pengembangan formula dan desain wadah (Mitsui, 1997).
Essence juga dibuat untuk menimbulkan kekurangan produk perawatan kulit konvensional dalam efek, kesan penggunaan maupun sebagaiannya. Essence
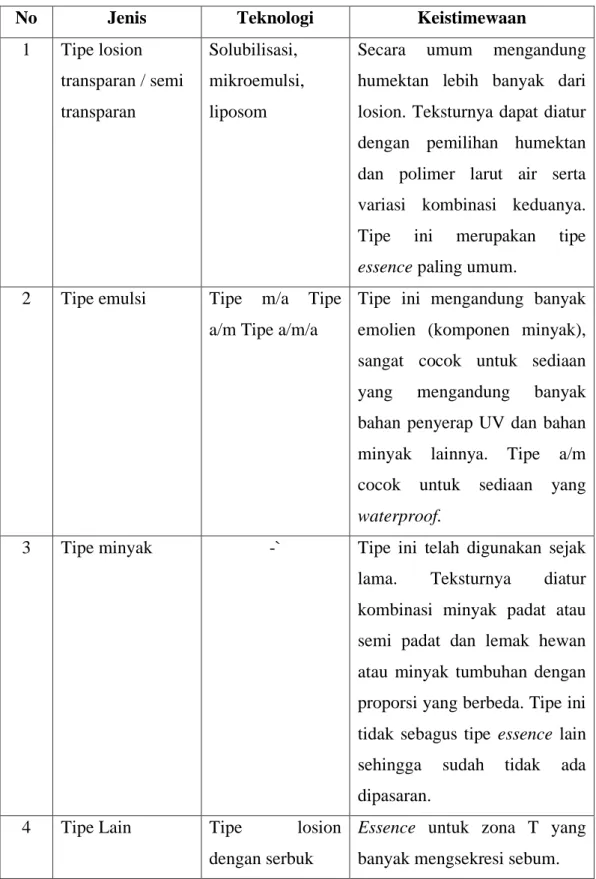
tersedia dalam beberapa tipe seperti losion, krim, emulsi dan minyak dengan teknologi pembuatan dan keistimewaan masing-masing tipe essence dapat dilihat pada tabel 2.1 berikut ini :
Tabel 2.1 Jenis-jenis Essence (Mitsui, 1997)
No Jenis Teknologi Keistimewaan
1 Tipe losion transparan / semi transparan
Solubilisasi, mikroemulsi, liposom
Secara umum mengandung humektan lebih banyak dari losion. Teksturnya dapat diatur dengan pemilihan humektan dan polimer larut air serta variasi kombinasi keduanya.
Tipe ini merupakan tipe essence paling umum.
2 Tipe emulsi Tipe m/a Tipe a/m Tipe a/m/a
Tipe ini mengandung banyak emolien (komponen minyak), sangat cocok untuk sediaan yang mengandung banyak bahan penyerap UV dan bahan minyak lainnya. Tipe a/m cocok untuk sediaan yang waterproof.
3 Tipe minyak -` Tipe ini telah digunakan sejak lama. Teksturnya diatur kombinasi minyak padat atau semi padat dan lemak hewan atau minyak tumbuhan dengan proporsi yang berbeda. Tipe ini tidak sebagus tipe essence lain sehingga sudah tidak ada dipasaran.
4 Tipe Lain Tipe losion
dengan serbuk
Essence untuk zona T yang banyak mengsekresi sebum.
Tipe alkohol Mengandung serbuk penyerap sebum agar hiasan wajah tahan lebih lama. Essence yang mempunyai efek germisida untuk sediaan jerawat.
2.8 Ekstraksi
Ekstraksi merupakan suatu proses pemisahan suatu zat dengan menggunakan perlarut yang sesuai. Metode ektraksi yang paling sederhana adalah maserasi (perendaman), yakni merendam suatu material ke dalam pelarut dengan beberapa kali penggoncangan yang bertujuan untuk memisahkan suatu zat yang tidak dapat terpisah tanpa bantuan pelarut. Maserasi memiliki dua mekasnisme yaitu difusi (terpisahnya senyawa dengan bantuan pelarut) dan disolusi (perendaman).
Ekstraksi pada bahan alam banyak digunakan sebagai bahan aditif alami yang digunakan untuk industri makanan, industri kosmetik (seperti sabun, sampo, pewarna rambut, pasta gigi, make-up, deodoran dan tabir surya), industri tekstil, wangi-wangian dan farmasi (Obat-obatan, vitamin dan suplemen). Ekstraksi alami bersumber dari tumbuhan seperti daun, bunga, buah, kulit, biji dan akar (Hardiyanti, 2019).
2.9 Skrinning Fitokimia
Skrining fitokimia (penapisan kimia) adalah tahapan awal untuk mengidentifikasi senyawa kimia yang terkandung dalam tumbuhan. Pada tahap ini, dapat diketahui golongan senyawa kimia yang terkandung pada tumbuhan.
Skrining fitokimia yang dilakukan adalah : 1. Uji senyawa golongan alkaloid
Ekstrak dilarutkan dengan asam klorida (HCI) dan kemudian disaring.
Filtrat diuji kandungan senyawa alkaloidnya dengan beberapa pengujian yaitu:
a. Uji Mayer
Filtrat diuji dengan reagen mayer, Kalium Merkuri lodida (K2HgI4) akan terbentuk presipitat berwarna kuning mengindikasikan adanya kandungan senyawa golongan alkaloid.
b. Uji Wagner
Filtrat diuji dengan reagen wagner, Iodin dalam Kalium Iodida (I2 + KI) akan terbentuk presipitat warna coklat/merah bata mengindikasikan adanya senyawa golongan alkaloid.
c. Uji Dragondroff:
Filtrat diuji dengan reagen Dragondroff (larutan Kalium Bismut Iodida) akan terbentuk presipitat warna merah mengindikasikan adanya senyawa golongan alkaloid.
d. Uji Hager
Filtrat diuji dengan reagen Hager, larutan asam pikrat jenuh akan terbentuk presipitat warna kuning mengindikasikan adanya senyawa golongan alkaloid.
2. Uji Senyawa Flavonoid a. Uji Reagen Alkalin
Ekstrak ditambahkan beberapa tetes larutan NaOH terbentuk warna kuning. Penambahan larutan asam menyebabkan hilangnya warna kuning. Hal ini mengindikasikan adanya senyawa flavonoid.
b. Uji Pb-asetat
Ekstrak ditambahkan beberapa tetes larutan Pb-asetat. Terbentuknya presipitat berwarna kuning mengindikasikan adanya senyawa flavonoid.
3. Uji Saponin a. Uji Froth
Ekstrak dilarutkan dengan air destilat sampai 20 ml dan diguncang.
Pembentukan lapisan sabun mengindikasikan adanya senyawa saponin.
b. Uji Sabun
Sebanyak 0,5 g ekstrak diguncang dengan 2 ml air. Jika sabun terbentuk setelah lebih kurang 10 menit, mengindikasikan adanya senyawa saponin.
4. Uji Senyawa Fenol dengan uji FeCl3
Ekstrak cair ditetesi 3-4 tetes larutan FeCl3. Terbentuknya warna hitam kebiru-biruan menunjukkan adanya senyawa fenol.
5. Uji Senyawa Tanin dengna uji Gelatin
Ekstrak ditambahkan 1% larutan gelatin yang mengandung NaCl.
Terbentuknya presipitat berwarna putih mengindikasikan adanya senyawa tanin.
2.10 Toksisitas dengan metode BSLT (Brine Shrimp Lethality Test)
Toksisitas adalah tingkat merusaknya suatu zat jika dipaparkan terhadap organisme. Toksisitas dapat mengacu pada dampak terhadap seluruh organisme, seperti hewan, bakteri, atau tumbuhan, dan efek terhadap substruktur organisme.
seperti sel (sitotoksisitas) atau organ tubuh seperti hati (hepatotoksisitas).
Metode Brine Shrimp Letality Test (BSLT) Salah satu metode yang digunakan untuk menentukan toksisitas adalah metode Brine Shrimp Lethality Test (BSLT), dengan menggunakan cara Meyer. Metode dilakukan dengan mengamati tingkat mortalitas larva udang Artemia salina Leach yang disebabkan oleh ekstrak uji. Hasil yang diperoleh dihitung sebagai nilai LC50 (Lethal Concentration) ekstrak uji, yaitu jumlah dosis atau konsentrasi ekstrak yang dapat menyebabkan kematian larva udang sejumlah 50% setelah masa inkubasi 24 jam.
2.11 Antibakteri
Antibakteri adalah senyawa yang digunakan untuk mengendalikan pertumbuhan bakteri yang bersifat merugikan. Pengendalian pertumbuhan mikroorganisme bertujuan untuk mencegah penyebaran penyakit dan infeksi, membasmi mikroorganisme pada inang yang terinfeksi, dan mencegah pembusukan serta perusakan bahan oleh mikroorganisme (Sulistyo, 1971).
Menurut Madigan, et al (2000), berdasarkan sifat toksisitas selektifnya, senyawa antimikrobia mempunyai 3 macam efek terhadap pertumbuhan mikrobia yaitu:
1. Bakteriostatik memberikan efek dengan cara menghambat pertumbuhan tetapi tidak membunuh. Senyawa bakterostatik seringkali menghambat sintesis protein atau mengikat ribosom. Hal ini ditunjukkan dengan
penambahan antimikrobia pada kultur mikrobia yang berada pada fase logaritmik. Setelah penambahan zat antimikrobia pada fase logaritmik didapatkan jumlah sel total maupun jumlah sel hidup adalah tetap.
2. Bakteriosidal memberikan efek dengan cara membunuh sel tetapi tidak terjadi lisis sel atau pecah sel. Hal ini ditunjukkan dengan penambahan antimikrobia pada kultur mikrobia yang berada pada fase logaritmik.
Setelah penambahan zat antimikrobia pada fase logaritmik didapatkan jumlah sel total tetap sedangkan jumlah sel hidup menurun.
3. Bakteriolitik menyebabkan sel menjadi lisis atau pecah sel sehingga jumlah sel berkurang atau terjadi kekeruhan setelah penambahan antimikrobia. Hal ini ditunjukkan dengan penambahan antimikrobia pada kultur mikrobia yang berada pada fase logaritmik. Setelah penambahan zat antimikrobia pada fase logaritmik, jumlah sel total maupun jumlah sel hidup menurun. Mekanisme penghambatan antibakteri dapat dikelompokkan menjadi lima, Sata menghambat sintesis dinding sel mikrobia, merusak keutuhan dinding sel
Mikrobia, menghambat sintesis protein sel mikrobia, menghambat sintesis asam nukleat, dan merusak asam nukleat sel mikrobia (Sulistyo, 1971).
Uji aktivitas antibakteri dapat dilakukan dengan metode difusi dan metode pengenceran. Disc diffusion test atau uji difusi disk dilakukan dengan mengukur diameter zona bening (clear zone) yang merupakan petunjuk adanya respon penghambatan pertumbuhan bakteri oleh suatu senyawa antibakteri dalam ekstrak.
Syarat jumlah bakteri untuk uji kepekaan/sensitivitas yaitu 105-108 CFU/ml.
Daya antimikrobia diukur secara in vitro agar dapat ditentukan kemampuan suatu zat antimikrobia. Adanya fenomena ketahanan tumbuhan secara alami terhadap mikrobia menyebabkan pengembangan sejumlah senyawa yang berasal dari tanaman yang mempunyai kandungan antibakteri dan antifungi (Jawetz, 2001).
Metode difusi merupakan salah satu metode yang sering digunakan.
Metode difusi dapat dilakukan dengan 3 cara yaitu metode silinder, metode lubang/sumuran dan metode cakram kertas. Metode lubang/sumuran yaitu membuat lubang pada agar padat yang telah diinokulasi dengan bakteri. Jumlah
dan letak lubang disesuaikan dengan tujuan penelitian, kemudian lubang diinjeksikan dengan ekstrak yang akan diuji. Setelah dilakukan inkubasi, pertumbuhan bakteri diamati untuk melihat ada tidaknya daerah hambatan di sekeliling lubang.
2.12 Antioksidan
Antioksidan merupakan molekul penting pada suatu senyawa yang berfungsi untuk meredam efek radikal bebas yang dapat menyebabkan munculnya penyakit degenerative di dalam tubuh. Reaksi radikal bebas dapat dihambat oleh senyawaan yang mengandung antioksidan dan perlu dilakukan pengujian aktivitasnya dalam menghambat radikal bebas.
Metode yang paling sering digunakan pada antioksidan adalah metode DPPH (2,2-diphenil 1-pichrylhidrazyl) yang bertujuan untuk mengetahui efek aktivitas antioksidan sebesar 50% atau biasa disebut IC50. Menurut Prakash (2001) metode DPPH merupakan metode yang mudah, cepat dan sensitive untuk pengujian aktivitas antioksidan senyawa atau ekstrak tanaman. Radikal bebas dapat terbentuk dari sebuah proses yang tak terelakkan dan berkesinambungan, yang dihasilkan dari metabolisme normal.
2.13 FTIR (Fourier Transformn Infra Red (FTIR)
Alasan suatu senyawa atau molekul diuji menggunakan FT-IR adalah karena senyawa atau molekul tersebut mampu menyerap radiasi inframerah yaitu yang terletak padapanjang gelombang 10-6- 10-4 nm. Spectrum serapan inframerah suatu material mempunyai pola khas, sehingga berguna untuk identifikasi material dan identifikasi keberadaan gugus-gugus fungsi yang ada.
Pengukuran pada spektrum inframerah dilakukan pada daerah cahaya inframerah tengah (mid-infrared) yaitu pada panjang gelombang 2,5-50 m atau bilangan gelombang 4000 - 200 cm-1 (Sagala, 2013).
Komponen dasar spektrofotometer IR sama dengan UV tampak, tetapi sumber detektor dan komponen optiknya sedikit berbeda. Mula-mula sinar infra marah di lewatkan melaui sampel dan larutan pambanding kemudian di laewatkan
pada monokromator untuk menghilangkan sinar yang tidak diinginkan. Berkas ini kemudian dididspersikan melalui prisma.
Alat IR biasanya dapat merekam sendiri absorbansinya. Temperatur dan kelembaban juga harus di atur yaitu maksimum 50% dan apabial melebihi batas tersebut maka menbuat permukaan prisma dan sel alkali halida menjadi suram.
Sumber radiasi yang sering digunakan adalah Nernest atau lampu Glower yang di buat dari oksida-oksida zirkonium dan natrium, berupa batang berongga dengan diameter 2 mm dan panjang 30 mm. Batang ini di panaskan sampai suhu 1500- 2000 °C dan akan memberikan radiasi diatas 7000 cm. Sumber Glower juga di gunkan dalam instrumen dengan absorbansi sekitar 5200 cm.
Monokromator yang di gunakkan dalam infra merah terbuat dari berbagai macam bahan antara lain gelas, lelehan silika, LiF, CaF2, BaF2,NaCl, AgCl, KBr, Csl. Tetapi pada ummnya prisma NaCl di gunakan untuk daerah 4000-6000cm”
dan prisma Kbr untuk 400 cm. Untuk detektor dalam infra merah digunakan detektor termal. Di antara detektor termal, termokopellah yang banyak di gunakan. Bolometer memberikan sinyal listrik sebagai hasil perubahan dalam tahanan konduktor metal dengan temperatur.
Untuk intrumen yang di gunakan umumnya ada 2 macam intrumen yaitu untuk analisis kuantitatif dan untuk analisis kualitatif. Karena kompleksnya spektrum IR maka di gunakan recorder. Umunya alat IR digunaka berkas ganda yang di rancang lebih sederhana drai pada berkas tunggal. Dalam semua instrumen selalu ada chopper frekuensi rendah untuk menyesuaikan output sumber. Rancangan optisnya mirip denga spektrofotometer UV-tampak kecuali tempat sampel dan pembandingan di tempatkan di antara sumber dan monokromator untuk menghamburkan sinar yang berasal dari sampel dan untuk mencegah terjadinya penguraian secara fotokimia. Sumber sinar dibagi menjadi dua berkas, satu dilewatkan pada sampel dan yang satu melewati pembanding, kemudain secara berturt-turut melewati attenuator dan chopper. Setelah melalui prisma, berkas jatuh pad detektor dan di ubah menjadi sinyal listrik yang di rekam oleh recorder. Kadang-kadang diperlukan amplifier bila sinyal lemah. Pada pengukuran kuantitatif model berkas ganda kurang begitu memuaskan karena
banyak ganguan dari sirkuit elektronik dan pengaturan titik nol besar sehinngga menyebabkan kesalahan.
2.14 Scanning Electron Microscopy (SEM)
Scanning Electron Microscope (SEM) merupakan sejenis mikroskop yang menggunakan elektron sebagai pengganti cahaya untuk melihat benda dengan resolusi tinggi. Analisa SEM bermanfaat untuk mengetahui mikro struktur (temasuk porositas dan bentuk retakan) benda padat. Berkas sinar elektron dihasilkan dari filamen yang dipanaskan, disebut elektron gun.
Cara kerja SEM adalah gelombang elektron yang dipancarkan elektron gun terkondensasi dilensa kondensor dan terfokus sebagai titikyang jelas oleh lensa objektif. Scanning coil yang diberi energi menyediakan medan magnetik bagi sinar elektron. Berkas sinar elektron yang mengenai cuplikan menghasilkan elektron sekunder dan kemudian dikumpulkan oleh detektor sekunde ratau detektor backscatter. Gambar yang dihasilkan terdiri dari ribuan titik berbagai intensitas dipermukaan Cathoda Ray Tube (CRT) sebagai topografi gambar. Pada sistem ini berkas elektron dikonsentrasikan pada spesimen, bayangannya diperbesar dengan lensa objektif dan diproyeksikan pada layar (Gunawan,2010).
2.15 Uji Kuat Tarik (Tensile Strength)
Kekuatan tarik adalah salah satu sifat dasar dari bahan polimer yang terpenting dan sering digunakan untuk karakteristik suatu bahan polimer.
Kekuatan tarik suatu bahan didefenisikan sebagai besarnya beban maksimum (E maks) yang digunakan untuk memutuskan specimen bahan dibagi dengan luas penampang awal
(Ao). Bila suatu bahan dikenakan beban tarik yang disebut tegangan (gaya persatuan luas). Tegangan terhadap regangan merupakan gambar karakteristik dari sifat mekanik suat bahan uji (wirjosentono, 1996). Kecepatan tarik 100 mm/menit dan beban maksimum 100 kg. Sampel yang sudah berbentuk dumbbell dijepitkan pada alat uji tarik, kemudian alatdijalankan dan didata yang dihasilkan diamati pada monitor.
BAB III
METODOLOGI PERCOBAAN
3.1. Lokasi dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Biokimia program studi Kimia FMIPA Universitas Sumatera Utara. Tes uji aktivitas bakteri dilakukan di Laboratorium Mikrobiologi FMIPA USU. Uji FT-IR dan SEM dilakukan di Laboratorium FMIPA UNILA. Uji GC-MS dilakukan di Laboratorium BEA CUKAI Belawan. Penelitian ini dikerjakan selama ± 3 bulan.
3.2. Alat dan Bahan 3.2.1. Alat
Alat yang digunakan pada saat penelitian ini adalah neraca analitis, labu takar, gelas ukur, gelas beaker, blender, saringan 100 mesh, erlenmeyer, alat BSLT, rotarievaporator, waterbath, oven, pH meter, Spektrofotometer FT-IR, alat SEM, alat GC-MS, inkubaor, cawan petri, alat destilasi, botol vial, kertas saring whattman no.42, cetakan masker wajah, jarum ose, alu dan lumpang dan corong kaca.
3.2.2. Bahan-bahan
Adapun bahan yang digunakan pada penelitian ini adalah ekstrak daun kemuning, kitosan, tepung tapioka, gliserin, CH3COOHglasial, aquadest, etanol,
larutan PVA, aqua DM, FeCl3 5%, NaOH 10%, H2SO4 pekat, HCl 2N, CeSO4 1%
dalam H2SO4 10%, kloroform, pereaksi bouchardart, pereaksi dragendroff, pereaksi maeyer, pereaksi salkowsky, propilen glikol, nipagin, nipasol, PEG-40 HCO, Xanthan Gum, ammonium sulfat, glukosa, DMSO, dan chlorampenicol.
3.3. Prosedur Percobaan 3.3.1. Penyediaan Sampel 3.3.1.1. Pengambilan Sampel
Sampel yang diteliti adalah daun kemuning yang diperoleh dari tanaman yang banyak tumbuh di Desa Bandar Sono Kecamatan Nibung Hangus Kabupaten Batu Bara.
3.3.1.2. Preparasi Serbuk Daun Kemuning
Sampel daun kemuning yang masih segar dikeringkan pada suhu ruang tanpa terkena sinar matahari langsung lebih kurang 1 minggu sampai daun kering dan dapat diremah ini berarti kadar air sudah berkurang dan dihaluskan dengan menggunakan blender hingga sampel berbentuk serbuk.
3.3.2. Ekstraksi Sampel
Serbuk daun kemunig sebanyak 300 g diekstraksi menggunakan pelarut etanol sebanyak 3 L selama 3 x 24 jam. Setalah itu ekstrak diuapkan menggunakan rotary evaporator dengan suhu 90 °C dan kecepatan 105 rpm.
Penguapan disempurnakan dengan menguapkan pelarut dengan menggunakan waterbath 95 %. Dilakukan Uji skrining fitokimia alkaloid, flavonoid, saponin, tanin, steroid tan terpenoid. Selanjutnya dilakukan uji fitokimia, uji BSLT, uji antioksidan dan uji antibakteri pada ekstrak daun kemuning. (Lyrawaty et al., 2013).
3.3.2.1. Skrining Fitokimia 3.3.2.1.1. Alkaloid
Sebanyak 15 mg ekstrak kental dilarutkan kedalam 6 MI HCI 1% diatas waterbath, setelah sampel dingin ditambahkan 0,5 g NaCl dan disaring. Filtrat dibagi menjadi 2 dan dimasukkan kedalam tabung. Tabung pertama diberi beberapa tetes reagen mayer. Pembentukan pengendapan warna kuning mengidentifikasikan adanya alkaloid. Tabung kedua diberi beberapa tetes Dragendroff. Pembentukan warna merah menunjukkan adanya alkaloid (Tiwari et al., 2011).
3.3.2.1.2. Flavonoid
Sebanyak 5 mg ekstrak kental dilarutkan air dan ditambahkan FeCls 5%
Produk akan menghasilkan Koloid warna hitam.
3.3.2.1.3. Tanin
Sebanyak 10 mg ekstrak kental dlarutkan dalam 15 mL metanol teknis kemudian dibagi ke dalam 3 bagian yaitu tabung A, tabung B, tabung C. Tabung A digunakan sebagai blanko, tabung B direaksikan dengan larutan FeCl; 10
%.Apabila terbentuk endapan pada tabung C maka larutan ekstrak mengandung tanin (Marliana, 2005).
3.3.2.1.4. Saponin
Sebanyak 10 mL larutan ekstrak uji dalam tabung reaksi dikocok vertikal selama 10 detik kemudian dibiarkan selama 10 detik. Pembentukan busa tertinggi 1-10 cm menunjukkan adanya saponin kemudian ditetesi tetes HCI 2 N busa tidak hilang (Depkes RI, 1995).
3.3.2.1.5. Steroid dan Terpenoid
Sebanyak 100 mg ekstrak dilarutkan dengan 2 ml. kloroform lalu dikocok setelan itu ditambahkan 2 mL asam sulfat p.a pembentukan cincin berwarna coklat diantara lapisan yang terbentuk. Pada lapisan atas membentuk warna hijau menunjukkan adanya steroid dan pada lapisan atas membentuk warna merah pekat akan menunjukkan adanya terpenoid (Joshi et al., 2013).
3.3.2.2. Pengujian Toksisitas
Uji toksisitas dilakukan dengan metode Brine Shrimp Lethality Test (BSLT) menggunakan Larva udang Artemia salina Leach.
3.3.2.2.1. Persiapan Larva Udang
Sebanyak 38 g garam dapur dilarutkan dalam 1 L aquadest untuk membuat air laut buatan sebagai media biakan telur udang. Dimasukkan sebanyak 20 mg telur Artemia salina ke dalam wadah yang berisi air laut buatan dan diberi cahaya cahaya. Telur-telur Artemia salina akan menetas menjadi larva dalam waktu 24- 48 jam (Imran et al., 2015; Jegathambigai et al., 2014; Asaduzzaman et al., 2015).
3.3.2.2.2. Persiapan larutan pekat
Uji Total 100 mg ekstrak metanol dari ekstrak sampel ditetesi dengan 3 tetes dimetilsulfoksida (DMSO) untuk melarutkan ekstrak yang sudah pekat, kemudian ditambahkan dengan air laut buatan sampai volume 10 ml. Diperoleh konsentrasi larutan induk 10.000 mg/l (10.000 ppm). Larutan induk diencerkan menjadi 1.000 ppm, 100 ppm dan 10 ppm. larutan dengan konsentrasi 1.000 ppm dibuat dengan mengambil larutan induk sebanyak 2,5 ml yang dimasukkan ke dalam Jobu takar volume 25 ml dan ditambahkan dengan air laut buatan sampai tanda batas larutan dengan konsentrasi 100 ppm dengan mengambil larutan induk
sebanyak 0,1 ml yang dimasukkan ke dalam labu takar volume 10 ml dan ditambahkan dengan air laut buatan sampai tanda batas. larutan dengan konsentrasi 10 ppm dibuat Ppm dengan mengambil larutan induk sebanyak 0,01 ml yang dimasukkan ke dalam labu takar volume 10 ml dan ditambahkan dengan air laut buatan sampai tanda batas.
3.3.2.2.3. Pengujian Toksisitas
Larutan uji 1.000 ppm, 100 ppm dan 10 ppm dimasukkan masing-masing ke dalam 3 botol vial. larutan air laut buatan ke dalam 3 botol vial sebagai kontrol negatif. Larutan air laut yang ditambahkan 3 tetes DMSO dimasukkan ke dalam 3 botol vial sebagai kontrol positif. Ada 5 jenis larutan uji yang dibuat masing- masing 3 kali pengamatan. Ke dalam masing-masing larutan uji dalam botol vial dimasukkan 10 ekor larva udang. Setelah 24 jam, diamati jumlah larva yang mati dalam botol yang berisi larutan uji (Kahn et al., 2015).
3.3.2.2.4. Cara Perhitungan Nilai LC50
Nilai LC50 dihitung dengan menggunakan analisis probit (Talukdar et al., 2016; Reddy et al., 2016) menggunakan tabel probit (Finney, 1982). Dibuat grafik sumbu x sebagai nilai log konsentrasi dan sumbu y sebagai nilai probit % mortalitas. Dari grafik, diperoleh persamaan garis linier. Nilai LC50 diperoleh dari hasil perhitungan nilai x dengan mensubstitusikan nilai y=5 (nilai probit dari mortalitas 50% = 5 pada tabel probit). Nilai LC50 nilai antilog x dari hasil perhitungan..
3.3.2.3.Pengujian Aktivitas Antioksidan dengan Metode Peredaman Radikal Bebas Menggunakan DPPH
3.3.2.3.1. Pembuatan larutan DPPH (1,1-Di Phenil-2-Picryl Hidrazil) 0,4 mM Sebanyak 7,9 mg DPPH (BM 394.32) ditimbang, kemudian dilarutkan dengan metanol pro analisis hingga 50 ml dan ditempatkan dalam botol gelap.
3.3.2.3.2. Pembuatan Larutan Blanko
Sebanyak 1 ml larutan DPPH 0,4 mM dipipet ke dalam tabung yang telah ditara 5 ml, kemudian ditambahkan metanol pro analisis hingga tanda dan dihomogenkan. Mulut tabung ditutup dengan aluminium foil.
3.3.2.3.3. Pembuatan Larutan Uji
Sebanyak 5 mg sampel ditimbang kemudian dilarutkan ke dalam 10 ml metanol pro analisis (500 ppm), larutan ini merupakan larutan induk. Sebanyak 50, 100, 150, 200 dan 250 ul larutan induk dipipet ke dalam tabung reaksi yang telah ditara 5 ml untuk mendapatkan konsentrasi 5, 10, 15, 20 dan 25 ppm. Ke dalam masing-masing tabung ditambahkan 1 ml larutan DPPH 1 mM dan ditambahkan dengan metanol pro analisis sampai 5 ml, kemudian dihomogenkan.
Mulut tabung ditutup dengan aluminium foil.
3.3.2.3.4. Pembuatan Larutan Vitamin C (Asam Askorbat) sebagai standar Sebanyak 5 mg vitamin C ditimbang kemudian dilarutkan ke dalam 10 ml metanol pro analisis (500 ppm = 500 µg/ml), larutan ini merupakan larutan induk.
%3D Sebanyak 50, 100, 150, 200 dan 250 µl larutan induk dipipet ke dalam tabung reaksi yang telah ditara 5 ml untuk mendapatkan konsentrasi 5, 10, 15, 20 dan 25 ppm. Ke dalam masing-masing tabung ditambahkan 1 ml larutan DPPH l mM dan ditambahkan dengan metanol pro analisis sampai 5 ml, kemudian dihomogenkan. Mulut tabung ditutup dengan aluminium foil.
3.3.2.3.5. Pengukuran Serapan Peredaman Radikal Bebas DPPH
Larutan uji dengan beberapa konsentrasi diinkubasi dalam penangas udara 37 °C selama 30 menit. Serapan solusi tampak pada panjang gelombang serapan maksimum 515 nm menggunakan spektrofotometer cahaya tampak.
3.3.2.3.6. Cara Perhitungan Nilai IC50
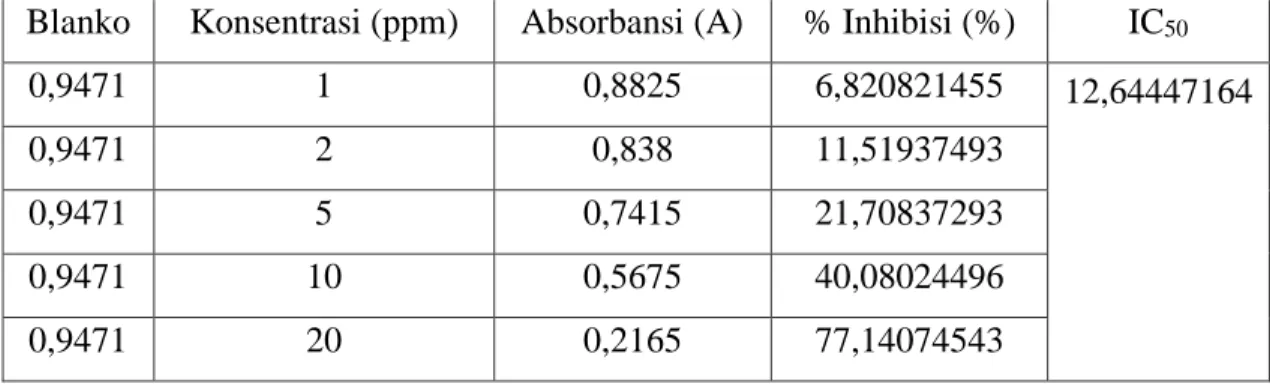
Persentase inhibisi dihitung denga rumus sebagai berikut :
% 𝑖𝑛ℎ𝑖𝑏𝑖𝑠𝑖 = 𝑆𝑒𝑟𝑎𝑝𝑎𝑛 𝑏𝑙𝑎𝑛𝑘𝑜 − 𝑆𝑒𝑟𝑎𝑝𝑎𝑛 𝑠𝑎𝑚𝑝𝑒𝑙
𝑆𝑒𝑟𝑎𝑝𝑎𝑛 𝐵𝑙𝑎𝑛𝑘𝑜 𝑥 100%
Nilai IC50 (Inhibition Concentration 50) adalah konsentrasi antioksidan (µg/ml) yang mampu menghambat 50 % radikal bebas. Nilai IC50 diperoleh dari potongan garis antara 50% daya hambatan dengan sumbu konsentrasi, kemudian imasukkan nilai y=50 ke persamaan linier y = ax+b. Nilai x menunjukkan nilai IC50. Sampel dinyatakan aktif bila nilai IC50 < 100 µg/ml