BAB 2
TINJAUAN PUSTAKA
2.1. Daun Zodia (Euodia hortensis J.R & G.Forst)
Berdasarkan taksonomi tanaman, klasifikasi daun zodia identifikasi tumbuhan di Laboratorium Herbarium Medanense (MEDA) Universitas Sumatera Utara adalah sebagai berikut :
Kerajaan : Plantae
Divisi : Spermatophyta Kelas : Dicotyledonae Bangsa : Rutales Familia : Rutaceae Genus : Euodia
Spesies : Euodia hortensis J.R & G.Forst
Gambar 2.1. Foto daun zodia
berkisar antara 2–30 cm. Tanaman zodia dapat mencapai ukuran 2 meter bila tumbuh di daerah bebas. Tanaman ini sangat mudah diperbanyak, yaitu melalui biji dan stek ranting (Jatmiko, 2014).
2.1.1. Manfaat Daun Zodia
Zodia adalah salah satu tanaman yang berfungsi sebagai insektisida khususnya nyamuk. Selain itu, lengan yang digigit nyamuk akan cepat sembuh (bentol dan gatal) apabila digosok dengan daun zodia. Selain itu zodia juga berfungsi untuk peredah malaria dengan cara merebus kulit batang zodia serta tanaman ini juga banyak digunakan sebagai obat herbal yang mampu membunuh sel kanker (Kardinan, 2004). Di daerah sentani di Irian Jaya, zodia digunakan sebagai penghilang bau badan. Tanaman zodia tersebut dioleskan pada tubuh, pada saat akan pesta. Aroma tubuh yang kurang sedap menjadi harum wangi zodia.
2.2. Minyak Atsiri
Minyak atsiri adalah minyak terbang atau disebut juga volatil oil atau essential oil merupakan campuran dari senyawa yang berwujud cairan atau padatan yang memiliki komposisi maupun titik didih yang berbeda (Sastrohamidjojo, 2004). Minyak atsiri bersifat mudah menguap pada suhu kamar, mempunyai rasa getir, serta berbau wangi sesuai dengan bau tanaman penghasilnya (Sudaryanti dan Sugiharti, 1990).
Minyak atsiri dapat dibagi menjadi dua kelompok. Pertama, minyak atsiri yang dengan mudah dapat dipisahkan menjadi komponen-komponen atau penyusunan murninya. Biasanya komponen utama yang terdapat dalam minyak atsiri tersebut dipisahkan atau diisolasi dengan penyulingan bertingkat atau dengan proses kimia yang sederhana. (Sastrohamidjojo, 2004). Minyak atsiri beberapa tanaman telah diketahui memiliki aktivitas antibakteri. Aktivitas antibakteri minyak atsiri disebabkan karena minyak atsiri mengandung senyawa yang dapat menghambat atau membunuh pertumbuhan bakteri (Inouye et al., 2001).
bergantung pada komponen kimia penyusun minyak tersebut (Agusta 2000). Aktivitas kerja minyak atsiri dalam menghambat pertumbuhan atau mematikan bakteri yaitu dengan cara mengganggu proses terbentuknya membran atau dinding sel, tidak terbentuk atau terbentuk secara tidak sempurna (Ajizah, 2004).
2.2.1. Komponen Kimia Minyak Atsiri
Pada umumnya perbedaan komposisi minyak atsiri disebabkan perbedaan jenis tanaman penghasil, kondisi iklim, tanah tempat tumbuh, umur panenan, metode ekstraksi yang digunakan dan cara penyimpanan minyak.
Minyak atsiri biasanya terdiri dari berbagai campuran persenyawaan kimia yang terbentuk dari unsur karbon (C), Hidrogen (H) dan oksigen (O). pada umumnya komponen kimia minyak atsiri dibagi menjadi dua golongan, yaitu:
1. Hidrokarbon yang terutama terdiri dari persenyawaan terpen
Persenyawaan yang termasuk golongan ini terbentuk dari unsur karbon (C), dan hidrogen (H). Jenis hidrokarbon yang terdapat dalam alam dan minyak atsiri sebagian besar terdiri dari monoterpen (2 unit isoprene) sesquiterpen (3 unit isoprene), diterpen (4 unit isoprene), Sesterpen (5 unit isopren), Triterpen (6 unit isopren), Tetraterpen (8 unit isopren).
2. Hidrokarbon teroksigenasi
Komponen kimia dari golongan ini terbentuk dari unsur karbon (C), Hidrogen (H) dan oksigen (O). persenyawaan yang termasuk dari golongan ini adalah persenyawaan alkohol, aldehid, ester, fenol. Ikatan karbon yang terdapat dalam molekulnya dapat terdiri dari ikatan tunggal, dan ikatan rangkap dua dan ikatan rangkap tiga (Ketaren, 1985)
2.2.2. Biosintesis minyak atsiri
Gambar 2.2 Biosintesisa Terpenoid (Achmad, 1985) ATP
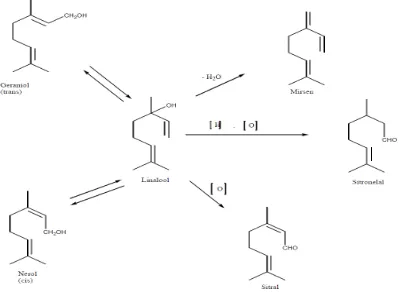
Untuk menjelaskan dapat diambil beberapa contoh monoterpen. Dari segi biogenetik, perubahan geraniol, nerol dan linalool dari yang satu menjadi yang lain berlangsung sebagai akibat reaksi isomerisasi. Ketiga alkohol ini, yang berasal dari hidrolisa geranil pirofosfat (GPP) dapat menjalani reaksi-reaksi sekunder berikut, misalnya dehidrasi menghasilkan mirsena, oksidasi menjadi sitral dan oksidasi reduksi menghasilkan sitronelal. Berikut ini adalah contoh perubahan senyawa monoterpen, dapat dilihat pada gambar 2.3
Gambar 2.3. Perubahan Senyawa Monoterpen (Achmad, 1985)
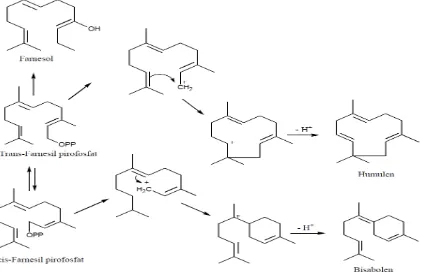
Gambar 2.4. Reaksi Biogenetik Beberapa Seskuiterpena (Achmad, 1985)
2.3. Isolasi Minyak Atsiri dengan Destilasi
Dalam tanaman minyak atsiri, biasanya proses difusi berlangsung sangat lambat, maka untuk mempercepat proses difusi sebelum melakukan penyulingan terlebih dahulu bahan tanaman harus diperkecil dengan cara dipotong - potong atau digerus. Peristiwa terpenting yang terjadi dalam proses penyulingan dengan metode hidrodestilasi ini adalah terjadinya difusi minyak atsiri dan air panas melalui membran bahan yang disuling, terjadinya hidrolisa terhadap beberapa komponen minyak atsiri dan terjadinya dekomposisi yang disebabkan oleh panas (Guenther, 1987). Penyulingan suatu campuran yang berwujud cairan yang tidak saling bercampur, hingga membentuk dua fase atau dua lapisan. Keadaan ini terjadi pada pemisahaan minyak atsiri dengan uap air. Penyulingan dengan uap air sering disebut steam destilasi. Pengertian umum ini memberikan gambaran bahwa penyulingan merupakan pemisahan komponen-komponen suatu campuran dari dua jenis cairan atau lebih berdasarkan perbedaan tekanan uap dari masing-masing zat tersebut (Sastrohamidjojo, 2004).
didalamnya karena perajangan ini menyebabkan kelenjar minyak dapat selebar mungkin (Lutony, 1994).
Dalam industri minyak atsiri dikenal 3 macam metode penyulingan, yaitu: 1. Penyulingan air (Hidrodestilasi)
Pada metode ini bahan yang akan disuling kontak langsung dengan air mendidih. Bahan tersebut mengapung di atas air atau terendam secara sempurna tergantung dari bobot jenis dan jumlah bahan yang disuling. Air yang dipanaskan dengan metode pemanasan yang bisa dilakukan yaitu dengan panas langsung, mantel uap, pipa uap melingkar tertutup. Ciri khas metode ini ialah kontak langsung antara bahan dan air mendidih. Oleh sebab itu sering disebut dengan penyulingan langsung (Sastrohamidjojo, 2004).
2. Penyulingan dengan air dan uap (Water and Steam distillation)
Pada metode penyulingan ini bahan diletakkan di atas rak-rak atau saringan berlubang. Ketel suling diisi dengan air sampai permukaan air berada tidak jauh dibawah saringan. Air dapat dipanaskan dengan berbagai cara yaitu dengan uap jenuh yang basah dan bertekanan rendah. Ciri khas metode ini adalah uap selalu dalam keadaan basah, jenuh dan tidak terlalu panas, bahan yang disuling hanya berhubungan dengan uap dan tidak dengan air panas. Untuk itu ukuran bahan harus seragam, pengisian dan kepadatan bahan harus merata didalam ketel sehingga uap dapat menembus bahan tersebut secara merata dan menyeluruh (Lutony,1994).
3. Penyulingan uap (Steam destilasi)
2.4. Analisis Komponen Kimia Minyak Atsiri dengan GC-MS
Minyak atsiri yang memiliki komponen tunggal dengan porsi yang sangat besar, kebanyakan mengandung campuran senyawa dengan berbagai tipe. Karena itu analisis dan karakterisasi komponen minyak atsiri merupakan masalah yang cukup rumit, ditambah dengan sifatnya yang mudah menguap pada suhu kamar. Jadi, untuk menganalisa minyak atsiri perlu diseleksi metode yang akan diterapkan. Sejak ditemukan kromatografi gas (GC), kendala dalam analisis komponen minyak atsiri ini mulai dapat diatasi. Pada penggunaan GC efek penguapan dapat dihindari bahkan dihilangkan sama sekali. Perkembangan teknologi instrumentasi yang sangat pesat akhirnya dapat melahirkan suatu alat yang merupakan gabungan dua sistem dengan prinsip dasar yang berbeda satu sama lain tetapi dapat saling menguntungkan atau saling melengkapi, yaitu gabungan antara kromatografi gas dan spektrometri massa (GC-MS). Kromatografi gas berfungsi sebagai alat pemisah berbagai komponen campuran dalam sampel, sedangkan spektrometri massa berfungsi untuk mendeteksi masing-masing molekul komponen yang telah dipisahkan pada sistem kromatografi gas (Agusta, 2000).
2.4.1. Analisis Kromatograf Gas
Kromatografi gas digunakan untuk memisahkan komponen campuran kimia dalam suatu bahan berdasarkan perbedaan polaritas campuran. Fase gerak akan membawa campuran sampel menuju kolom. Campuran dalam fase gerak akan berinteraksi dengan kecepatan yang berbeda dimana interaksi komponen dengan fase diam dengan waktu yang paling akhir (Eaton, 1989). Pemisahan tercapai dengan partisi sampel antara fase gas bergerak dan fase diam berupa cairan dengan titik didih tinggi (tidak mudah menguap) yang terikat pada zat padat penunjangnya. Komponen utama dalam Kromatografi Gas yaitu : Gas pembawa, Sistem Injeksi, Kolom, Fase diam, Suhu, Detektor.
2.4.1.1. Gas pembawa
sering dipakai sebagai gas pembawa karena tidak reaktif serta dapat dibeli dalam keadaan murni dan kering dalam kemasan tangki bervolume besar dan bertekanan tinggi. Hal yang menentukan ialah bahwa kita harus memakai gas paling murni (Gritter, 1991)
2.4.1.2. Sistem injeksi
Lubang injeksi didesain untuk memasukkan sampel secara cepat dan efesien. Pada dasarnya, ada 4 jenis injektor pada kromatografi gas, yaitu :
1. Injeksi langsung (direct injection), yang mana sampel yang diinjeksikan akan diuapkan dalam injektor yang panas dan 100% masuk menuju kolom.
2. Injeksi terpecah (split injection), yang mana sampel yang diinjeksikan diuapkan dalam injektor yang panas dan selanjutnya dilakukan pemecahan.
3. Injeksi tanpa pemecahan (splitness injection), yang mana hampir semua sampel diuapkan dalam injektor yang panas dan dibawa ke dalam kolom karena katup pemecah ditutup.
4. Injeksi langsung ke kolom (on coloum injection), yang mana ujung semprit dimasukkan langsung ke dalam kolom.
Teknik injeksi langsung ke dalam kolom digunakan untuk senyawa-senyawa yang mudah menguap, karena kalau penyuntikkannya melalui lubang suntik, dikwatirkan akan terjadi peruraian senyawa tersebut karena suhu yang tinggi (Rohman, 2009).
2.4.1.3. Kolom
Kolom merupakan tempat terjadinya proses pemisahaan karena didalamnya terdapat fase diam. Oleh karena itu, kolom merupakan komponen sentral pada kromatografi gas (Rohman, 2009). Kolom dapat terbuat dari tembaga, baja tahan karet, aluminium atau gelas. Kolom dapat berbentuk lurus, melengkung, atau gulungan spiral sehingga lebih menghemat ruang.
2.4.1.4. Fase diam
analisis minyak atsiri digunakan kolom yang lebih polar, sejumlah puncak yang dihasilkan menjadi lebar (lebih tajam) dan sebagai puncak tersebut juga membentuk ekor. Begitu juga dengan garis dasarnya tidak rata dan terlihat bergelombang. Bahkan kemungkinan besar komponen yang bersifat non polar tidak akan terdeteksi sama sekali (Agusta, 2000).
2.4.1.5. Suhu
Suhu merupakan salah satu faktor utama yang menentukan hasil analisis Kromatografi Gas dan Spektrometri Massa. Umumnya yang sangat menentukan adalah pengaturan suhu injektor dan kolom (Agusta, 2000).
2.4.1.6. Detektor
Detektor pada kromatografi gas adalah suatu sensor elektronik yang berfungsi mengubah sinyal gas pembawa komponen-komponen di dalamnya menjadi sinyal elektronik. Sinyal elektronik detektor akan sangat berguna untuk analisis kualitatif maupun kuantitatif terhadap komponen-komponen yang terpisah di antara fase diam dan fase gerak (Rohman, 2009).
2.4.2. Analisis Spektrometri Massa
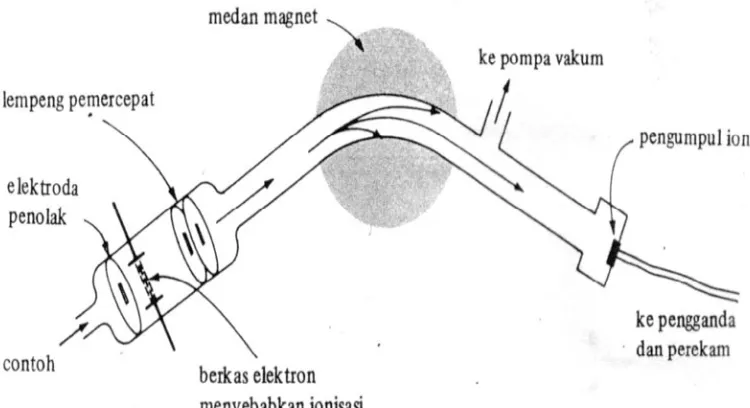
Spektrometer massa adalah suatu alat berfungsi untuk mendeteksi masing-masing molekul komponen yang telah dipisahkan pada sistem kromatografi gas yang terdiri dari sistem analisis dan sistem ionisasi dan sistem molekul. Prinsip spektrometri massa (MS) ialah senyawa organik (sampel) ditembak dengan berkas elektron dan menghasilkan ion bermuatan positif yang mempunyai energi yang tinggi karena lepasnya elektron dari molekul yang dapat pecah menjadi ion positif yang lebih kecil (ion fragmen). Spektrum massa merupakan grafik antara limpahan relatif lawan perbandingan massa/muatan (m/z). Terpisah fragmen ion positif didasarkan pada massanya. Kejadian tersederhana adalah tercampaknya satu elektron dari molekul dalam fasa gas oleh sebuah elektron dalam berkas elektron dan membentuk suatu kation radikal (M•+ )
Satu proses yang disebabkan oleh tabrakan elektron pada kamar pengion spektrometer massa adalah ionisasi dari molekul yang berupa uap dengan kehilangan satu elektron dan terbentuk ion molekul bermuatan positif, karena molekul senyawa organik mempunyai elektron berjumlah genap maka proses pelepasan satu elektron menghasilkan ion radikal yang mengandung satu elektron tidak berpasangan.
M M•+
Proses lain molekul yang berupa uap tersebut menangkap sebuah elektron membentuk ion radikal bermuatan negatif dengan kemudian terjadi jauh lebih kecil
(10-2) dari pada ion radikal bermuatan positif (Sudjadi, 1983).
Gambar 2.5. Skema alat Spektroskopi Massa
Pada sistem GC-MS ini, yang berfungsi sebagai detektor adalah spektrometer massa itu sendiri yang terdiri dari sistem analisis dan sistem ionisasi, dimana Electron Impact ionization (EI) adalah metode ionisasi yang umum digunakan (Agusta, 2000).
Spektrometer massa pada umumnya digunakan untuk : 1. Menentukan massa suatu molekul
2. Menentukan rumus molekul dengan menggunakan Spektrum Massa Beresolusi Tinggi (High Resolution Mass Spectra)
3. Mengetahui informasi dari struktur dengan melihat pola fragmentasinya 2.5. Bakteri
yang khas, seperti bola, batang atau spiral. Umumnya bakteri berdiameter antara 0,5 – 1,0 µm dan panjang hingga 10 mikron (1 mikron - 103 mm). Untuk melihat bakteri dengan jelas, tubuhnya perlu diisi dengan zat warna, pewarna ini disebut pengecatan bakteri(Pelzcar dan Chan, 1986).
Bakteri secara tradisional dibagi dalam dua golongan besar: patogen, menunjukkan pada bakteri penyebab penyakit dan nonpatogen menunjukkan pada mereka yang tidak menyebabkan penyakit. Patogen secara klasik diduga memiliki sifat-sifat tertentu yang memperkuat kemampuan mereka menimbulkan penyakit (Shulman et al., 1994). Kelompok mikroorganisme yang paling penting dan beraneka ragam, yang berhubungan dengan makanan dan manusia adalah bakteri. Adanya bakteri dalam bahan pangan dapat mengakibatkan pembusukan yang tidak diinginkan atau menimbulkan penyakit yang ditularkan melalui makanan. Bakteri adalah mikroorganisme bersel tunggal yang tidak terlihat oleh mata (Buckle, 2009).
2.5.1. Bakteri Gram Positif
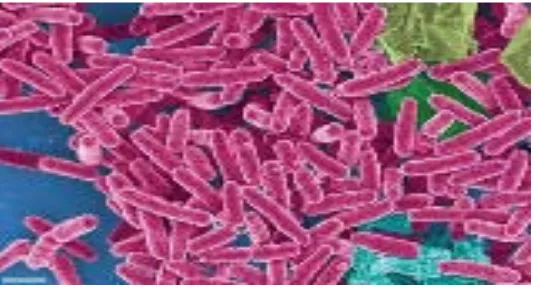
Bakteri gram positif yaitu memiliki struktur dinding sel yang tebal (15-80µm) dan berlapis tunggal dengan komposisi dinding sel terdiri atas lipid, peptidoglikan dan asam teikoat. Kandungan lipid pada bakteri gram positif antara 1-4%. Dinding sel terdiri dari lapisan tunggal peptidoglikan yang mencapai lebih dari 50% berat kering sel bakteri. Bakteri gram positif rentan terhadap gangguan fisik (Pelzcar & Chan, 1986). Jenis bakteri gram positif yang digunakan dalam penelitian ini adalah baccillus cereus dan Staphylococcus aureus.
2.5.1.1. Bacillus cereus
Sistematika bakteri baccillus cereus adalah sebagai berikut : Divisi : Bacteria
Kelas : Bacilli Bangsa : Baccilales Suku : Baccilaceae Marga : Baccillus
Jenis : Baccillus cereus (Anonim,2012)
Gambar 2.6. Bacillus cereus
Dalam penelitian salah satu bakteri yang digunakan adalah Bacillus cereus. Bacillus cereus telah dikenali sebagai salah satu penyebab keracunan pada makanan sejak
tahun 1955, sejak saat itu mikroorganisme ini telah menarik banyak perhatian dan menjadi salah satu penyebab keracunan pada pangan yang termasuk sering ditemukan. Keracunan akan timbul jika seseorang menelan makanan atau minuman yang mengandung bakteri atau bentuk sporanya, kemudian bakteri bereproduksi dan menghasilkan toksin di dalam usus, atau seseorang mengkonsumsi pangan yang telah
mengandung toksin tersebut
2.5.1.2. Staphylococcus aureus
Sistematika bakteri Staphylococcus aureus adalah sebagai berikut : Divisi : Eubacteria
Kelas : Bacilli Bangsa : Baccillales
Suku : Staphylococcaceae Marga : Staphylococcus
Jenis : Staphylococcus aureus
Gambar. 2.7. Bakteri Stphylococcus aureus
Staphylococcu aureus adala
bersifat aerob fakultatif, tidak menghasilkan berpasangan maupun berkelompok, dengan diameter sekitar 0,8-1,0 µm. Bakteri tumbuh cepat pada suhu 37oC dengan waktu pembelahan 0,47 jam. Bakteri ini terdapat pada kulit, selaput lendir, bisul dan luka(Pelzcar & Chan, 1986).
2.5.2. Bakteri Gram Negatif Bakteri gram negatif yaitu memiliki struktur dinding sel berlapis tiga dengan ketebalan 10-15µm). Komposisi dinding sel terdiri atas lipid dan peptidoglikan yang berada dalam lapisan sebelah dalam dengan jumlah sekitar 10% berat kering. Kandungan lipid pada bakteri gram negatif cukup tinggi yaitu 11-22%. Bakteri ini umumnya kurang rentan terhadap penisilin dan gangguan fisik. Selain itu, dinding sel bakteri gram negatif lebih tipis dari pada bakteri gram positif. Jenis bakteri gram negatif yang digunakan dalam penelitian ini adalah Pseudomonas aeruginosa dan shigella dysentriae.
2.5.2.1. Pseudomonas aeruginosa
Sistematika bakteri Pseudomonas aeruginosa adalah sebagai berikut : Divisi : Protophyta
Kelas : Schizomycetes Bangsa : Pseudomonadales Suku : Pseudomonadaceae Marga : Pseudomonas
Gambar bakteri Pseudomonas aeruginosa dapat dilihat pada gambar 2.9
Gambar 2.9. Pseudomonas aeruginosa
Pseudomonas aeruginosa mempunyai habitat normal ditanah maupun air dan berperan
dalam proses dekomposisi bahan-bahan organik. Pseudomonas aeruginosa bergerak aktif dengan flagella polar dan mempunyai ukuran lebar 0,5 - 1µm dan panjang 3 - 4 µm, dan bersifat aerob. Organisme ini juga dapat menimbulkan infeksi apabila secara mekanis ditempatkan dalam saluran kencing sewaktu penusukan lumbar (bagian pinggang) (Volk & Wheeler, 1989). Pseudomonas aeruginosa kadang-kadang kedapatan didalam luka pada hewan atau manusia. Bakteri ini menyebabkan timbulnya nanah yang kebiruan (Irianto, 2006).
2.5.2.2. Shigella dysentriae
Sistematika bakteri shigella dysentriae adalah sebagai berikut : Divisi : Bacteriophyta
Kelas : Bacteria Bangsa : Eubacteriales Suku : Bacteriaceae Marga : Shigella
Gambar 2.9. Bakteri Shigella dysenteriae
Shigella dysenteriae merupakan bakteri gram negatif berbentuk batang yang tidak
bergerak, tidak membeetuk spora. Bakteri ini dapat menyebabkan disentri basiler. Disentri adalah salah satu berbagai gangguan pencernaan yang ditandai dengan peradangan usus terutama kolon, disertai nyeri perut dan buang air besar yang sering mengandung darah dan lendir (Pelzcar & Chan, 1986).
2.6. Antibakteri
Antibakteri adalah obat yang digunakan sebagai pembasmi bakteri, khususnya bakteri yang bersifat merugikan manusia atau pathogen. Berdasarkan aktivitasnya, zat antibakteri dibedakan menjadi dua yaitu antibakteri yang memiliki aktivitas bakteriostatik (menghambat pertumbuhan bakteri) dan aktivitas bakterisidal (membunuh bakteri). Aktivitas bakteriostatik bekerja dengan cara menghambat perbanyakan populasi bakteri dan tidak mematikan. Pada kadar yang tinggi, antibakteriostatik juga dapat bertindak sebagai bakterisidal (Schunack et al. 1990). Zat antibakteri menyebabkan membran sel berada dalam lingkungan yang hipertonik. Suatu keadaan hipertonik dapat menyebabkan penghambatan pembentukan dinding sel sehingga sel hanya dibatasi oleh membran sel yang tipis (Jawetz dkk, 2005). Beberapa faktor dapat mempengaruhi aktivitas penghambatan atau pembunuhan bakteri oleh suatu zat yaitu konsentrasi zat, jumlah mikroorganisme, suhu, spesies mikroorganisme, adanya bahan organik dan pH (Pelzcar & Chan, 1986).
2.7. Pengujian aktivitas antibakteri
2.7.1. Metode Difusi
Merupakan metode yang paling sering digunakan yaitu dilakukan dengan cara menginokulasikan bakteri dimana sebuah cawan petri yang berisi media agar yang telah dimasukkan bakteri yang sesuai standar diatas permukaannya. Kemudian kertas cakram dibasahi atau dibubuhi dengan zat antimikroba yang telah diketahui konsentrasinya diletakkan diatas permukaan agar yang sudah memadat. Selama inkubasi, zat antimikroba akan berdifusi dari cakram ke media agar. Apabila zat antimikroba efektif maka zona hambat akan terbentuk di sekitar kertas cakram setelah inkubasi (Tortora, dkk., 2004).