BAB II
TINJAUAN UMUM INDUSTRI PT. PRADJA PHARIN (PRAFA)
2.1. Sejarah dan Perkembangan Perusahaan
PT. Prafa merupakan salah satu perusahaan farmasi Indonesia yang mengalami perkembangan pesat. Sejak didirikan oleh Bapak Tjipto Pusposuharto pada tahun 1960, PT. Prafa telah berkembang dari sebuah industri rumah tangga menjadi perusahaan farmasi besar yang memproduksi lebih dari 100 jenis sediaan obat.
PT. Prafa mulai beroperasi sebagai perusahaan dagang berbagai obat industri rumah tangga dengan 20 karyawan di areal berukuran 325 m2 . Pada tahun 1968 PT. Prafa ditunjuk sebagai importir dan penyalur tunggal sah di Indonesia bagi Meiji Seika Jepang. Pada tahun 1971, PT. Prafa menjadi perusahaan Penanaman Modal Dalam Negeri (PMDN) dengan tujuan untuk meningkatkan fasilitas produksi yang lebih besar. Sejak saat itu dimulai pembangunan pabrik di areal seluas 2300 m2 di Jalan Bandengan Selatan 58 A Jakarta Utara. Sejak saat itu PT. Prafa mulai memproduksi berbagai jenis sediaan yang jumlahnya semakin besar.
Mulai tahun 1988 PT. Prafa telah tumbuh menjadi suatu industri farmasi dengan ± 1000 karyawan, 200 jenis sediaan obat berkualitas dengan penanaman modal total mencapai lebih dari 10 miliar rupiah. Pada tahun itu pula dimulai pengembangan pabrik modern diatas areal seluas ± 12 hektar, dengan luas bangunan 32.208,52 m 2 yang terletak di daerah Citeureup-Bogor.
Pembangunan pabrik baru ini dapat diselesaikan pada tahun 1990 dengan luas areal 1500 m2. Pabrik dirancang dan dibangun sesuai dengan aspek Cara Pembuatan Obat yang Baik (CPOB) serta efisien dalam sistem produksi. Semua fasilitas dibangun dengan teknologi mutakhir dalam produksi steril, pembuatan
soft capsule dan lain sebagainya.
Pada tahun 1995 PT. Prafa bergabung dalam Darya Varia Group bersama tiga perusahaan lainnya yaitu PT. Darya Varia Laboratoria, PT. Kenrose Indonesia dan PT. Dupa dengan distributor PT. Wigo Distributor Farmasi. Tahun 1998 PT. Dupa dan PT. Kenrose ditutup. Mulai tanggal 21 Desember 2001 hingga sekarang Darya Varia Group diambil alih oleh United Laboratory, Manila-Philippines. Selain Darya Varia Group, yang tergabung dalam United Laboratory, Manila adalah PT. Medifarma Laboratories.
Pada tahun 2003, PT. Prafa diaudit oleh P&G, QAC (Quality Assurance Capability) yang didapat saat itu adalah 44%. Kemudian dilakukan audit kembali oleh P&G tahun 2004, QAC yang didapat bertambah menjadi 72%. Dengan perjuangan dan komitmen yang tinggi, akhirnya hanya dalam waktu satu tahun kemudian, PT. Prafa yang diaudit kembali oleh P&G berhasil menaikkan QACnya menjadi 92%. Sejak tahun 2004, PT. Prafa telah dipercaya oleh perusahaan P&G untuk melakukan toll manufacturing hingga kini, yaitu memproduksi Vicks Formula 44, Vicks Vaporub dan Vicks Inhaler. Pada tahun 2008, P&G memberikan QAC 100% untuk audit yang dilakukan pada PT. Prafa. Untuk selanjutnya audit P&G dilakukan setiap dua tahun.
Pada tahun 2005, PT. Prafa memperoleh Sertifikat Industri Farmasi Kelas A dari hasil mapping Badan POM dalam menilai kesiapan industri farmasi menghadapi harmonisasi pasar ASEAN. Berdasarkan hasil tersebut, PT Prafa dapat melakukan produksi di fasilitas sendiri dan menerima toll dari industri farmasi lain. Hingga kini PT. Prafa senantiasa berusaha untuk meningkatkan kualitas sarana dan SDMnya, terutama mengikuti standar PIC/s dan FDA
Regulation.
PT. Prafa juga melakukan kerja sama dalam proses produksi (Toll
Manufacture Agreement) dengan perusahaan lain (prinsipal) baik perusahaan
multinasional maupun lokal. Prinsipal multinasional antara lain P&G, Actavis dan Novartis. Prinsipal lokal antara lain PT. Novell, PT. Pharos, PT. Lapi, PT. Pyridam, PT. Mahakam Beta Farma, PT. Guardian Pharmatama, PT. Nufarindo, dan PT. Kalbe Farma.
Pada tahun 2008 PT.Prafa mendapatkan QAC 100% dan sudah mempertahankannya selama dua periode bertrut-berturut. Pada tahun 2009, Darya Varia Group melakukan project spesialization. PT. Medifarma Laboratories dikhususkan pada produksi high volume solid order dan OTC. PT. Darya Varia Laboratories dikhususkan pada produksi soft gelatin capsul, sediaan liquid dan
semisolid. Sedangkan PT. Prafa dikhususkan pada produksi low volume solid order, produk ethical (solid dan injeksi), antibiotik betalaktam dan cephalosporin
(solid dan injeksi), serta produk toll manufacturing. Banyak prinsipal lokal dan multinasional yang melakukan toll manufacturing sehingga PT. Prafa dispesialisasikan sebagai Centre of Excellent Toll Manufacturing. PT. Prafa terus
mengusahakan kualitas kerja demi kualitas produk sebagai salah satu bagian dari komponen pelayanan kesehatan. Diantaranya membuat Standard Operating
Procedures (SOP) untuk setiap aktivitas kerja. Sampai saat ini lebih dari 1000
SOP yang digunakan sebagai prosedur operasional pelaksanaan kerja.
Motivasi dan dedikasi yang tinggi merupakan falsafah perusahaan sebagaimana dinyatakan dalam logo perusahaan dengan inisial yang berbentuk segitiga yang memiliki sisi yang sama panjang dan tajam seperti gambar di bawah ini.
Gambar 1. Logo PT. Pradja Pharin
Segitiga tersebut diimplikasikan ke lambang-lambang huruf awal nama perusahaan. Bentuk segitiga itu sendiri melambangkan kemajuan dan budaya perusahaan yang modern. Pertemuan antar segitiga pada logo tersebut melambangkan kerjasama, kebersamaan dan komitmen. Sisi sama panjang mencerminkan bahwa Prafa terdiri dari elemen yang memiliki kepentingan bersama serta saling menunjang dan mendukung sehingga tidak ada yang dapat berdiri sendiri tanpa dukungan kekuatan elemen yang lain. Warna biru pada logo Prafa melambangkan semangat, rasa aman, bersih dan kepercayaan melalui
produk-produk yang dihasilkannya akan memberikan kesan yang berlangsung lama di hati para konsumennya.
2.2 Struktur Organisasi
PT. Prafa dipimpin oleh seorang Plant Manager yang membawahi enam departemen. Masing-masing departemen dipimpin oleh seorang manager yang dibantu oleh beberapa supervisor. Bagan struktur organisasi PT. Prafa dapat dilihat pada Lampiran (1).
2.3 Visi dan Misi
Visi dan Misi PT. Prafa dituangkan dalam Motto: “We Commit to Speed,
Quality, Cost and Safety”. Dengan motto ini PT. Prafa selalu berusaha
menghasilkan produk bermutu tinggi dan terjangkau oleh masyarakat dengan mengutamakan keselamatan kerja. Untuk dapat menembus pangsa pasar internasional, PT. Prafa berusaha untuk meningkatkan kualitas sarana dan SDMnya dengan mengikuti standar PIC/s dan FDA Regulation. Hal ini tertuang pada Motto: “We Commit to PIC/s and FDA Regulation and make cGMP as Way
of Life”.
2.4 Lokasi dan Sarana Produksi
Kantor pusat PT. Prafa berada di Talavera Office Park, 8th-10th Floor, Jl. Letjen Simatupang No. 22-26 Jakarta. Sedangkan lokasi pabrik berada di Desa Karang Asem Barat, Kecamatan Citeureup, Kabupaten Bogor, Jawa Barat. Pabrik tersebut menempati areal seluas 12 hektar dengan bangunan produksi seluas
17.208 m2 yang relatif terpisah dari lokasi pemukiman penduduk. Denah pabrik PT. Prafa dapat dilihat di Lampiran (2).
Sarana produksi yang dimiliki PT. Prafa antara lain:
1. Bangunan utama terdiri dari tiga gedung besar, yaitu:
a. Gedung pertama digunakan untuk ruang kantor, ruang produksi non betalaktam, ruang produksi dan kemas P&G, ruang Product Development
Department (PDD), ruang pengemasan sentral, Masjid dan kantin.
b. Gedung kedua digunakan untuk ruang Quality Assurance (QA) / Quality
Control (QC) Departemen, ruang Material Management (MM)
Department, gudang bahan baku dan bahan kemas.
c. Gedung ketiga digunakan untuk ruang produksi betalaktam dan
cephalosporin.
2. Bangunan penunjang lain meliputi gedung Technical Service, instalasi listrik, Air Handling Unit (AHU), steam unit, compress air unit, waste water
unit, water system unit, area parkir, pos satpam, dan unit laundry.
3. Bangunan gudang obat jadi dan gudang bahan mudah terbakar.
Peralatan produksi yang dimiliki adalah:
1. Peralatan produksi non betalaktam meliputi peralatan produksi tablet, tablet salut selaput, tablet salut gula, kapsul, dan injeksi.
2. Peralatan produksi betalaktam dan sefalosforin meliputi peralatan tablet, tablet salut selaput, kapsul, injeksi kering, dan sirup kering.
2.5 Jenis Produksi
Pada tahun 2009, Darya Varia Group melakukan project spesialization dan PT. Prafa dikhususkan pada produksi low volume solid order, produk ethical, antibiotik Betalaktam dan Sefalosporin, serta produk toll manufacturing. Banyak prinsipal lokal dan multinasional yang melakukan toll manufacturing sehingga PT. Prafa dispesialisasikan sebagai Centre of Excellent Toll Manufacturing. Pada saat ini PT. Prafa hanya memproduksi sediaan tablet dan kapsul skala kecil, infus 100 ml, suspension ready for injection, dry injection, solution ready for injection, dan dry syrup.
PT. Prafa memproduksi 2 macam produk. Yang pertama adalah produk. Prafa sendiri yang biasa disebut Original Product dan yang kedua adalah produk
Toll Manufacturing, yaitu memproduksi produk untuk perusahaan farmasi lain
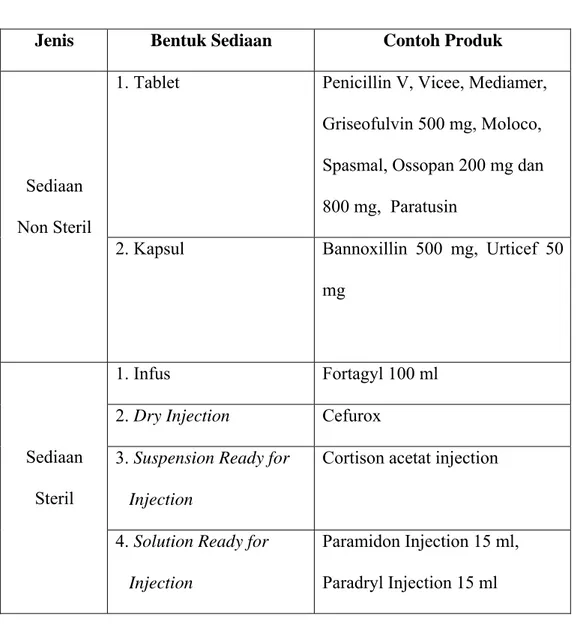
(Principal) yang bekerja sama dengan PT. Prafa. Contoh Original Product Prafa dapat dilihat pada tabel 1.
Tabel 1. Daftar Contoh Original Product PT. Prafa
Jenis Bentuk Sediaan Contoh Produk
1. Tablet Penicillin V, Vicee, Mediamer, Griseofulvin 500 mg, Moloco, Spasmal, Ossopan 200 mg dan 800 mg, Paratusin
Sediaan Non Steril
2. Kapsul Bannoxillin 500 mg, Urticef 50 mg
1. Infus Fortagyl 100 ml
2. Dry Injection Cefurox 3. Suspension Ready for
Injection
Cortison acetat injection Sediaan
Steril
4. Solution Ready for
Injection
Paramidon Injection 15 ml, Paradryl Injection 15 ml
PT. Prafa juga melakukan kerjasama dalam proses produksi (Toll
Manufacturing) dengan perusahaan atau prinsipal lainnya, antara lain : P&G, PT.
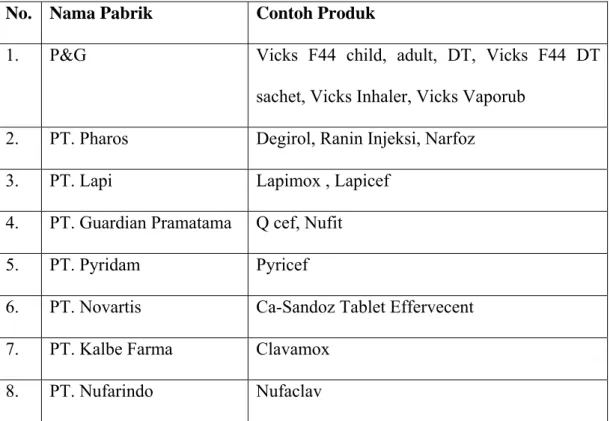
Pyridam, PT, Lapi, PT. Guardian Pramatama, PT. Novartis, PT. Pharos, PT. Novell, PT. Mahakam Beta Farma, PT. Nufarindo, dan PT. Kalbe Farma. Contoh produk perusahaan farmasi yang melakukan Toll Manufacturing dengan PT. Prafa dapat dilihat pada tabel 2 di bawah ini
Tabel 2. Daftar Contoh Produk Perusahaan Farmasi yang Melakukan Toll
Manufacturing dengan PT. Prafa
No. Nama Pabrik Contoh Produk
1. P&G Vicks F44 child, adult, DT, Vicks F44 DT sachet, Vicks Inhaler, Vicks Vaporub
2. PT. Pharos Degirol, Ranin Injeksi, Narfoz 3. PT. Lapi Lapimox , Lapicef
4. PT. Guardian Pramatama Q cef, Nufit 5. PT. Pyridam Pyricef
6. PT. Novartis Ca-Sandoz Tablet Effervecent 7. PT. Kalbe Farma Clavamox
8. PT. Nufarindo Nufaclav
2.6 Cara Pembuatan Obat yang Baik (CPOB)
CPOB adalah pedoman untuk pembuatan obat yang dapat memastikan bahwa obat dibuat dan dikendalikan secara konsisten untuk mencapai standar mutu yang sesuai dengan tujuan penggunaan dan dipersyaratkan dalam izin edar dan spesifikasi produk. CPOB mencakup seluruh aspek produksi dan pengawasan mutu. Cara Pembuatan Obat yang Baik bertujuan menjamin bahwa obat dibuat secara konsisten, memenuhi persyaratan yang ditetapkan dan sesuai dengan tujuan penggunaanya.
Dalam Pedoman CPOB cetakan 2006, terdapat dua belas aspek yang harus dipenuhi dalam penerapan CPOB, yaitu:
2.6.1. Manajemen Mutu
Menurut Petunjuk Operasional Penerapan CPOB cetakan 2009, prinsip: menjamin mutu suatu obat jadi tidak hanya mengandalkan pelulusan dari serangkaian pengujian tetapi:
• Mutu obat hendaklah dibangun sejak awal ke dalam produk tersebut. Mutu obat tergantung dari bahan awal, proses pembuatan dan pengawasan mutu, bangunan dan peralatan yang dipakai serta semua personil yang terlibat. • Semua obat hendaklah dibuat dalam kondisi yang dikendalikan dan
dipantau dengan cermat agar obat yang dihasilkan dapat selalu memenuhi persyaratan.
Aspek manajemen mutu yang saling terkait meliputi pemastian mutu, CPOB dan pengawasan mutu. Manajemen mutu memberikan arahan kebijakan mutu. Untuk melaksanakan kebijakan mutu diperlukan pemastian mutu untuk menetapkan sistem mutu, meliputi totalitas semua pengaturan yang dibuat dengan tujuan untuk memastikan bahwa obat yang dihasilkan sesuai dengan tujuan penggunaanya. Sistem mutu ditetapkan berdasarkan CPOB untuk meminimalkan resiko yang tidak dapat dideteksi melalui serangkaian tes, misalnya kontaminasi dan tercampurnya produk. CPOB meliputi aspek produksi dan pengawasan mutu. Pengawasan mutu merupakan bagian CPOB yang fokus pada pelaksanaan pengujian Kebijakan mutu hendaklah disosialisasikan kepada semua karyawan dengan cara yang efektif; caranya tidak cukup dengan membagikan fotokopinya dan/atau menempelkan pada dinding.
Manajemen mutu menentukan dan mengimplementasikan kebijakan mutu. Kebijakan mutu adalah pernyataan formal dari manajemen puncak industri farmasi yang menyatakan arahan dan komitmen dalam mutu produknya. Untuk melaksanakan Kebijakan Mutu dibutuhkan 2 unsur dasar:
• Sistem mutu yang mengatur struktur organisasi, tanggung jawab dan kewajiban, semua sumber daya yang diperlukan, semua prosedur yang mengatur proses yang ada.
• Tindakan sistematis untuk melaksanakan sistem mutu, yang disebut pemastian mutu atau quality assurance.
2.6.2 Personalia
Sumber daya manusia sangat penting dalam pembentukan dan penerapan sistem pemastian mutu yang memuaskan dan pembuatan obat yang benar. Oleh sebab itu industri farmasi bertanggung-jawab untuk menyediakan personil yang terkualifikasi dalam jumlah yang memadai untuk melaksanakan semua tugas. Tiap personil hendaklah memahami tanggung jawab masing-masing dan dicatat. Seluruh personil hendaklah memahami prinsip CPOB dan memperoleh pelatihan awal dan berkesinambungan, termasuk instruksi mengenai higiene yang berkaitan dengan pekerjaan.
Personil kunci mencakup kepala bagian produksi, kepala bagian pengawasan mutu dan kepala bagian manajemen mutu (pemastian mutu). Kepala produksi dan manajeman mutu hendaklah seorang apoteker yang terdaftar dan terkualifikasi dan memiliki pengalaman praktis. Kepala bagian pengawasan mutu hendaklah diutamakan seorang terkualifikasi dan lebih diutamakan seorang
apoteker. Dalam CPOB 2006 dijelaskan bahwa dalam struktur organisasi industri farmasi bagian produksi, manajemen mutu atau pengawasan mutu dipimpin oleh orang berbeda serta tidak saling bertanggung jawab satu terhadap yang lain.
Industri farmasi hendaklah memberikan pelatihan bagi seluruh personil yang karena tugasnya harus berada di dalam area produksi, gudang penyimpanan atau laboratorium (termasuk personil teknik, perawatan, dan petugas kebersihan) dan personil lain yang kegiatannya akan berdampak pada mutu produk. Pelatihan diberikan secara berkesinambungan dan efektif penerapannya serta dinilai secara berkala.
2.6.3 Bangunan dan fasilitas
CPOB menjelaskan ketentuan-ketentuan bangunan dan fasilitas pada area penimbangan, area produksi, area penyimpanan, area pengawasan mutu, serta sarana pendukung (ruang istirahat, kantin, mengganti pakaian kerja, toilet, bengkel perbaikan dan perawatan peralatan). Bangunan dan fasilitas untuk pembuatan obat hendaklah memiliki desain, konstruksi dan letak yang memadai, serta disesuaikan kondisinya dan dirawat dengan baik untuk memudahkan pelaksanaan operasi yang benar. Tata letak dan desain ruangan harus dibuat sedemikian rupa untuk memperkecil resiko terjadinya kekeliruan, pencemaran silang, penumpukan debu atau kotoran, dan dampak lain yang dapat menurunkan mutu obat. Serta memudahkan pembersihan, sanitasi dan perawatan yang efektif untuk menghindari pencemaran silang.
2.6.4 Peralatan
Peralatan untuk pembuatan obat hendaklah memiliki desain dan konstruksi yang tepat, ukuran yang memadai serta ditempatkan dan dikualifikasi dengan tepat, agar mutu obat terjamin sesuai desain serta seragam dari bets ke bets dan untuk memudahkan pembersihan serta perawatan. Peralatan yang bersentuhan dengan bahan awal, produk antara atau produk jadi tidak boleh menimbulkan reaksi, adisi, absorbsi yang dapat mempengaruhi identitas, mutu atau kemurnian. Penempatan alat disesuaikan dengan alur produksi, mempunyai jadwal preventive
maintenance dan mempunyai sistem cleaning yang telah tervalidasi untuk
mencegah kontaminasi silang. Peralatan satu sama lain ditempatkan pada jarak yang cukup untuk menghindari kesesakan serta memastikan tidak terjadi kekeliruan dan campu-baur produk. Peralatan dirawat sesuai jadwal untuk mencegah malfungsi atau pen
2.6.5 Sanitasi dan Higiene
Tingkat sanitasi dan higiene yang tinggi hendaklah diterapkan dalam setiap aspek pembuatan obat. Ruang lingkup sanitasi dan higiene meliputi personalia, bangunan, peralatan, perlengkapan, bahan produksi, wadahnya dan segala sesuatu yang dapat merupakan sumber pencemaran poduk. Sumber pencemaran potensial hendaklah dihilangkan melalui suatu program cleaning dan sanitasi serta higiene yang menyeluruh dan terpadu.
Untuk menjamin perlindungan produk dari pencemaran dan untuk keamanan personil, personil mengenakan pakaian pelindung yang bersih dan sesuai dengan tugasnya. Tersedia dalam jumlah cukup, sarana toilet dengan
ventilasi yang baik dan sarana memadai untuk penyimpanan pakaian personil (loker)
2.6.6 Produksi
Produksi hendaklah dilaksanakan dengan mengikuti prosedur yang telah ditetapkan, dan memenuhi ketentuan CPOB yang menjamin senantiasa menghasilkan produk yang memenuhi persyaratan mutu serta memenuhi ketentuan izin pembuatan dan izin edar (registrasi). Produksi hendaklah dilakukan dan diawasi oleh personil yang kompeten, yaitu yang sudah ditraining dan terkualifikasi.
Aspek produksi mencakup: perlakuan terhadap bahan awal, validasi proses, pencegahan pencemaran silang, sistem penomoran bets atau lot, penimbangan dan penyerahan serta pengembalian, pengolahan bahan dan produk kering, bahan pengemas, kegiatan pengemasan, pengawasan selama proses, bahan dan produk yang ditolak, dipulihkan dan dikembalikan, karantina dan penyerahan produk jadi, penyimpanan bahan awal, bahan pengemas, produk antara, produk ruahan dan produk jadi, pengiriman dan pengangkutan.
Ketentuan pada bahan awal antara lain pengadaan bahan awal hendaknya dari pemasok yang telah disetujui dan memenuhi spesifikasi yang diinginkan. Semua penerimaan, pengeluaran dan jumlah bahan tersisa hendaklah dicatat. Catatan tersebut meliputi keterangan mengenai persediaan, nomor bets atau lot, tanggal penerimaan dan pengeluaran, tanggal diluluskan dan tanggal daluawarsa. Setiap bahan awal, sebelum dinyatakan lulus untuk digunakan hendaknya memenuhi spesifikasi bahan awal yang sudah ditetapkan dan diberi label dengan
nama yang dinyatakan dalam spesifikasi. Pada saat penerimaan terhadap setiap kiriman dilakukan proses sampling oleh QC untuk mengetahui bahwa bahan tersebut sesuai dengan spesifikasi yang diinginkan. Bahan awal yang diterima hendaklah dikarantina sampai disetujui dan diluluskan untuk pemakaian.
Pada validasi proses, prosedur produksi hendaknya divalidasi dengan tepat. Validasi hendaknya dilaksanakan menurut prosedur yang telah ditentukan dan catatan hasilnya disimpan. Luas serta tingkat validasi yang dilakukan tergantung dari sifat dan kerumitan produk dan proses yang bersangkutan. Perubahan yang berarti dalam proses, peralatan, atau bahan hendaknya disertai dengan tindakan ulang, untuk menjamin bahwa perubahan tersebut akan tetap menghasilkan produk yang memenuhi spesifikasi yang telah ditetapkan.
Tiap tahap proses, produk dan bahan hendaklah dilindungi terhadap pencemaran mikroba dan pencemaran lain. Perhatian khusus diberikan pada masalah pencemaran silang. Pencemaran silang dihindari dengan tindakan teknis atau pengaturan yang tepat, misalnya dengan tersedianya ruang penyangga udara dan penghisap udara.
Sistem yang menjabarkan penomoran bets dan lot secara rinci diperlukan untuk memastikan bahwa produk antara, produk ruahan atau produk jadi suatu bets atau lot dapat dikenali dengan nomor bets dan lots tertentu. Penomoran bets dan lot yang digunakan pada tingkat pengolahan dan pengemasan selanjutnya hendaknya saling berkaitan. Pemberian nomor bets atau lot yang dialokasikan segera di catat dalam suatu buku catatan harian.
Penimbangan dan penyerahan bahan baku, bahan pengemas, produk antara dan produk ruahan dianggap suatu bagian dari siklus produksi dan memerlukan dokumentasi dan rekonsiliasi yang lengkap. Sebelum melakukan penimbangan dilakukan pemeriksaan kebenaran penandaan bahan baku termasuk label pelulusan. Kapasitas, ketepatan dan ketelitian alat timbangan dan alat ukur yang digunakan harus sesuai dengan jumlah bahan yang ditimbang.
Kondisi daerah pengolahan dipantau dan dikendalikan sampai tingkat yang disyaratkan. Sebelum pengolahan dimulai ditempuh langkah yang menjamin bahwa daerah pengolahan dan peralatan bebas dari bahan, produk yang tidak diperlukan. Menurut CPOB cetakan 2006 mengenai kesiapan jalur (line
clearance), segera sebelum menempatkan bahan pengemas dan bahan cetak lain
pada jalur pengemasan, personil penanggung jawab yang ditunjuk dari bagian pengemasan hendaklah melakukan pemeriksaan kesiapan jalur sesuai dengan prosedur tertulis yang disetujui oleh kepala bagian Manajemen Mutu (Pemastian Mutu), untuk:
a) Memastikan bahwa ssemua bahan dan produk yang sudah dikemas dar kegiatan pengemasan sebelumnya telah benar disingkirkan dari jalur pengemasan dan area sekitarnya;
b) Memeriksa kebersihan jalur dan area sekitarnya dan
2.6.7 Pengawasan Mutu
Pengawasan mutu merupakan bagian yang esensial dari CPOB untuk memberikan kepastian mutu bahwa produk secara konsisten mempunyai mutu yang sesuai dengan tujuan pemakaiannya. Keterlibatan dan komitmen semua pihak yang berkepentingan pada setiap tahap merupakan keharusan untuk mencapai sasaran mutu mulai dari awal pembuatan sampai kepada distribusi produk jadi. Pengawasan mutu tidak terbatas pada kegiatan laboratorium, tapi juga harus terlibat dalam semua keputusan yang terkait dengan mutu produk. Ketidaktergantungan pengawasan mutu dari produksi dianggap hal yang fundamental agar pengawasan mutu dapat melakukan kegiatan yang memuaskan.
Pengawasan mutu mencakup semua kegiatan analitis yang dilakukan di laboratorium (pengambilan sampel, pemeriksaan dan pengujian bahan awal, produk antara, produk ruahan dan produk jadi), uji stabilitas, penanganan sampel pertinggal, menyusun dan memperbaharui spesifikasi bahan dan produk serta metode pengujiannya.
2.6.8 Inspeksi Diri dan Audit Mutu
Tujuan inspeksi diri adalah untuk mengevaluasi apakah semua aspek produksi dan pengawasan mutu industri farmasi memenuhi kriteria Cara Pembuatan Obat yang Baik (CPOB). Program inspeksi diri hendaklah dirancang untuk mendeteksi kelemahan dalam pelaksanaan CPOB dan untuk menetapkan tindakan perbaikan yang diperlukan. Tim inspeksi ditunjuk oleh manajemen perusahaan terdiri dari sekurang-kurangnya 3 orang yang ahli dibidang pekerjaannya dan paham mengenai CPOB. Inspeksi diri hendaklah dilakukan
secara independen dan rinci oleh petugas yang kompeten dari perusahaan. Inspeksi diri hendaklah dilakukan secara rutin, di samping itu, pada situasi khusus, misalnya dalam hal terjadi penarikan kembali obat jadi atau terjadi penolakan yang berulang. Semua saran untuk tindakan perbaikan supaya dilaksanakan. Prosedur dan catatan inspeksi diri hendaklah didokumentasikan dan dibuat program tindak lanjut yang efektif.
Penyelenggaraan audit mutu berguna sebagai pelengkap inspeksi diri. Audit mutu meliputi pemeriksaan dan penilaian semua atau sebagian dari sistem manajemen mutu dengan tujuan spesifik untuk meningkatkan mutu. Audit mutu umumnya dilaksanakan oleh spesialis dari luar atau independen atau tim yang dibentuk khusus untuk hal ini oleh manajemen perusahaan. Audit mutu juga dapat diperluas terhadap pemasok dan penerima kontrak.
2.6.9 Penanganan Keluhan terhadap Obat, Penarikan Kembali Obat dan Obat Kembalian
Semua keluhan dan informasi lain yang berkaitan dengan kemungkinan terjadi kerusakan obat hendaklah dikaji dengan teliti sesuai dengan prosedur tertulis. Untuk menangani semua kasus yang mendesak, hendaklah disusun suatu sistem, bila perlu mencakup penarikan kembali produk yang diketahui atau diduga cacat dari peredaran secara cepat dan efektif. Produk kembalian adalah obat jadi yang telah beredar, yang kemudian dikembalikan ke industri farmasi karena keluhan mengenai kerusakan, daluarsa, atau alasan lain misalnya kondisi wadah atau kemasan yang menimbulkan keraguan akan identitas, mutu, jumlah dan keamanan obat yang bersangkutan. Penarikan kembali produk adalah suatu proses
penarikan kembali dari satu atau beberapa bets atau seluruh bets produk tertentu dari peredaran dilakukan. Penarikan kembali produk dilakukan apabila ditemukan produk yang cacat mutu atau bila ada laporan mengenai reaksi yang merugikan yang serius serta beresiko terhadap kesehatan. Penarikan kembali produk dari peredaran dan dapat mengakibatkan penundaan atau penghentian pembuatan obat tersebut.
Keluhan terhadap obat mencakup keluhan terhadap mutu keadaan fisik, kimia dan biologi, reaksi yang merugikan atau masalah efek terapetik (tidak berkhasiat). Semua keluhan dan laporan keluhan hendaklah diteliti dan dievaluasi dengan cermat, kemudian diambil tindak lanjut yang sesuai (diproses kembali atau dimusnahkan) dan dibuatkan laporan sesuai prosedur yang terdapat pada petunjuk operasional CPOB cetakan 2009.
2.6.10 Dokumentasi
Dokumentasi adalah bagian dari sistem informasi manajemen dan dokumentasi yang baik merupakan bagian yang esensial dari pemastian mutu. Dokumentasi yang jelas adalah fundamental untuk memastikan bahwa tiap personil menerima uraian tugas yang relevan secara jelas dan rinci sehingga memperkecil resiko terjadi salah tafsir dan kekeliruan yang biasanya timbul karena hanya mengandalkan komunikasi lisan. Spesifikasi, dokumen produksi induk/formula pembuatan, prosedur, metode dan instruksi, laporan dan catatan harus bebas dari kekeliruan dan tersedia secara tertulis. Bentuk penulisan dokumen dan isi yang jelas serta tegas adalah sangat penting.
2.6.11 Pembuatan dan Analisis Berdasarkan Kontrak
Pembuatan dan analisis berdasarkan kontrak harus dibuat secara benar, disetujui dan dikendalikan untuk menghindari kesalahpahaman yang dapat menyebabkan produk atau pekerjaan dengan mutu yang tidak memuaskan. Kontrak tertulis antara pemberi kontrak dan penerima kontrak harus dibuat secara jelas menentukan tanggung jawab dan kewajiban masing-masing pihak. Kontrak harus menyatakan secara jelas prosedur pelulusan setiap bets produk untuk diedarkan yang menjadi tanggung jawab penuh kepala bagian manajemen mutu (pemastian mutu). Pada bab ini meliputi tanggung jawab industri farmasi terhadap Otoritas Pengawasan Obat (OPO) dalam hal pemberian izin edar dan pembuatan obat.
2.6.12 Kualifikasi dan Validasi
Pada bab ini menguraikan prinsip kualifikasi dan validasi yang dilakukan di industri farmasi. CPOB mensyaratkan industri farmasi untuk mengidentifikasi validasi yang perlu dilakukan sebagai bukti pengendalian terhadap aspek kritis dan kegiatan yang dilakukan. Perubahan signifikan terhadap fasilitas, peralatan, dan proses yang dapat mempengaruhi mutu produk hendaklah divalidasi. Pendekatan dengan kajian resiko hendaklah digunakan untuk menentukan ruang lingkup dan cakupan validasi.
Seluruh kegiatan validasi hendaklah direncanakan. Unsur utama program validasi hendaklah dirinci dengan jelas dan didokumentasi di dalam Rencana Induk Validasi (RIV) atau dokumen setara.
Kualifikasi mencakup kualifikasi desain, kualifikasi instalasi, kualifikasi operasional dan kualifikasi kinerja pada peralatan/mesin. Pada validasi mencakup validasi metode analisis, validasi proses (validasi prospektif, validasi konkuren, validasi retrospektif), validasi pengemasan, validasi pembersihan, dan validasi sistem komputerisasi.