E-book ini hanya untuk kalangan sendiri
tidak untuk dijualbelikan
1
Larutan asam dan basa banyak kita jumpai dalam kehidupan sehari-hari. Senyawa asam yang cukup kita kenal diantaranya asam cuka yang berguna sebagai bumbu makanan dan asam sulfat yang berguna sebagai larutan pengisi sel akumulator(aki). Senyawa basa yang cukup kita kenal adalah sabun yang berguna untuk mandi dan mencuci.
A. TEORI ASAM-BASA
terdapat tiga teori yang dapat digunakan untuk memahami pengertian asam-basa. 1. Teori Asam-Basa Arrhenius
Teori asam-basa menurut Arrhenius adalah sebagai berikut.
a. Asam adalah zat yang didalam air terionisasi menghasilkan ion H+.
Contoh: HCl(aq) H+(aq) + Cl-(aq)
b. Basa adalah zat yang didalam air menghasilkan OH-.
Contoh: NaOH(aq) Na+(aq) + OH-(aq)
2. Teori Asam-Basa Br∅nsted-Lowry
Asam dan basa menurut Br∅nsted-Lowry didefiniskan sebagai berikut.
a. Asam adalah zat yang dapat memberikan proton (H+) kepada zat lain sehingga disebut juga donor
proton
b. Basa adalah zat yang dapat menerima proton (H+) dari zat lain sehingga disebut juga akseptor
proton Contoh 1:
Keterangan:
• NH4+ bersifat asam karena mampu memberikan ion H+ kepada H2O.
• H2O bersifat basa karena mampu menerima ion H+ dari NH4+.
• NH4+ dan NH3 adalah pasangan asam basa konjungasi.
• H2O dan H3O+ adalah pasangan basa asam konjugasi
Contoh 2:
Jika diperhatikan pada reaksi contoh 1 air (H2O) bersifat basa, sedangkan pada reaksi contoh 2 bersifat
asam.Sifat seperti ini disebut amfiprotik, artinya zat tersebut dapat bersifat asamatau basa tergantung suasana/lingkungannya.
2
E-book ini hanya untuk kalangan sendiri tidak untuk dijualbelikan 3. Teori Asam-Basa Lewisteori asam basa menurut Lewis adalah sebagai berikut.
a. Asam adalah zat yang dapat menerima pasangan elektron bebas. Dengan demikian, asam disebut akseptor elektron.
b. Basa adalah zat yang dapat memberikan pasangan elektron bebas. Dengan demikian, basa disebut donor elektron.
Contoh:
NH3 bersifat basa karena memiliki sepasang elektron bebas dan dapat memberikan pasangan elektron
bebasnya kepada BF3 yang memiliki orbital kosong. Karena BF3 mampu menerima pasangan elektron,
dapat dinyatakan bahwa BF3 bersifat asam.
B. DERAJAT KEASAMAN LARUTAN (pH)
Air murni memiliki derajat ionisasi yang sangat kecil sehingga konsentrasi air dianggap tetap. Berdasarkan reaksi ionisasi air:H2O ⇋ H+ + OH-,tetapan kesetimbangan aor dapat dinyataka sebagai berikut :
𝐾w = [H+][OH-]
Derajat keasaman dan kebebasan suatu larutan dinyatakan dengan pH dan pOH. Nilai pH suatu asam adalah pH < 7 dan nilai pH suatu basa adalah pH > 7. pH = 7 adalah pH netral, yaitu pH garam.
pH = −log[H+]
pOH = −[OH-]
pKw = pH + pOH
Karena pada suhu 25℃, Kw = 1 × 10−14, penurunan rumus dapat dilanjutkan sebagai berikut.
pH + pOH = -log Kw
Kemudian nilai Kw dapat disubtitusikan sehingga
pH + pOH = -log 1 × 10−14 pH + pOH = 14
pH = 14—pOH
C. INDIKATOR ASAM-BASA
Cara untuk mengenal larutan asam dan basa yaitu dengan menggunakan suatu zat yang disebut indikator asam-basa. Indikator asam-basa adalah zat yang dalam larutan asam dan basa memiliki warna yang berbeda. Dengan adanya perbedaan warna tersebut, kita dapat membedakan larutan asam dan. Beberapa jenis indikator yang biasa digunakan adalah sebagai berikut. Namun, sebelum itu berikut ini adalah tabel berisi beberapa sifat umum dari asam dan basa
Tabel 5.1 Sifat-sifat larutan asam dan basa
Sifat larutan asam
Sifat larutan basa
• Rasanya masam
• Bersifat korosif
• Memerahkan kertas lakmus biru
• Mengahtrarkan arus listrik
• Bereaksi dengan basa membentuk garam
• Rasanya pahit
• Terasa licin di kulit
• Membirukan kertas lakmus merah
• Menghatarkan arus listrik
• Bereaksi dengan asam membentuk
garam
Untuk menentukan pH larutan
E-book ini hanya untuk kalangan sendiri
tidak untuk dijualbelikan
3
1. Indikator Lakmus
Indikator lakmus terdiri dari lakmus merah dan biru. Perubahan warna yang terjadi pada kertas lakmus saat dicelupkan pada larutan asam atau basa adalah sebagai berikut.
a. Lakmus biru akan berubah menjadi merah dalam larutan asam. b. Lakmus merah akan berubah menjadi biru dalam larutan basa c. Lakmus merah dan biru tidak berubah (tetap) dalam larutan netral 2. Indikator Universal
Indikator universal digunakan untuk menentukan derajat keasaman (pH) suatu larutan asam atau basa. Mengukur pH dengan menggunakan indikator universal merupakan cara yang lebih akurat jika dibandingkan dengan indikator lainnya, selain pH meter.
3. Indikator Bahan Kimia
Indikator bahan kimia sering juga disebut sebagai indikator sintetis. Indukator ini mengalamai perubahan warna seiring dengan perubahan pH. Batas batas ketika indikator mengalami perubahan warna disebut trayek pH indikator
Tabel 5.2 Trayek perubahan warna beberapa indikator
Nama
Indikator
Trayek perubahan warna
(Trayek pH)
Perubahan warna
Metil hijau
0,2 – 1,8
Kuning – Biru
Timol hijau
1,2 – 2,8
Kuning – biru
Metil jingga
3,4 – 4,4
Merah – kuning
Metil Merah(MM)
4,2 – 6,3
Tak berwarna- merah
Metil ungu
4,8 – 5,4
Ungu – hijau
Bromokesol ungu
5,2 – 6,8
Kuning – ungu
Bromtimol biru(BTB)
6,0 – 7,6
Kuning – biru
Lakmus
4,7 – 8,3
Merah – biru
Kresol merah
7,0 – 8,8
Kuning – merah
Timol biru
8,0 – 9,6
Kuning – biru
Fenolftalein(PP)
8,3 – 10
Tak berwarna – merah
Timolftalein
9,4 – 10,6
Tak berwarna – biru
Alizarin kuning
10,3 – 12,0
Kuning – merah
Klayton kuning
12,2 – 13,2
Kuning - kuning
4. Indikator bahan Alam
Selain indikator-indikator di atas dapat juga digunakan indikator-indikator bahan alam. bahan alam yang umunya digunakan adalah kunyit, kembang sepatu, dan daun kulit manggis bahan-bahan ini diambil ekstraknya kemudian ditambahkan beberapa zat sehingga kemudian dapat menguji larutan asam dan basa
D. KEKUATAN ASAM-BASA
Asam dan basa dapat dikelompokan ke dalam golongan kuat dan lemah. Adpun perbedananya adalah sebagai berikut.
1. Asam Kuat dan Asam Lemah
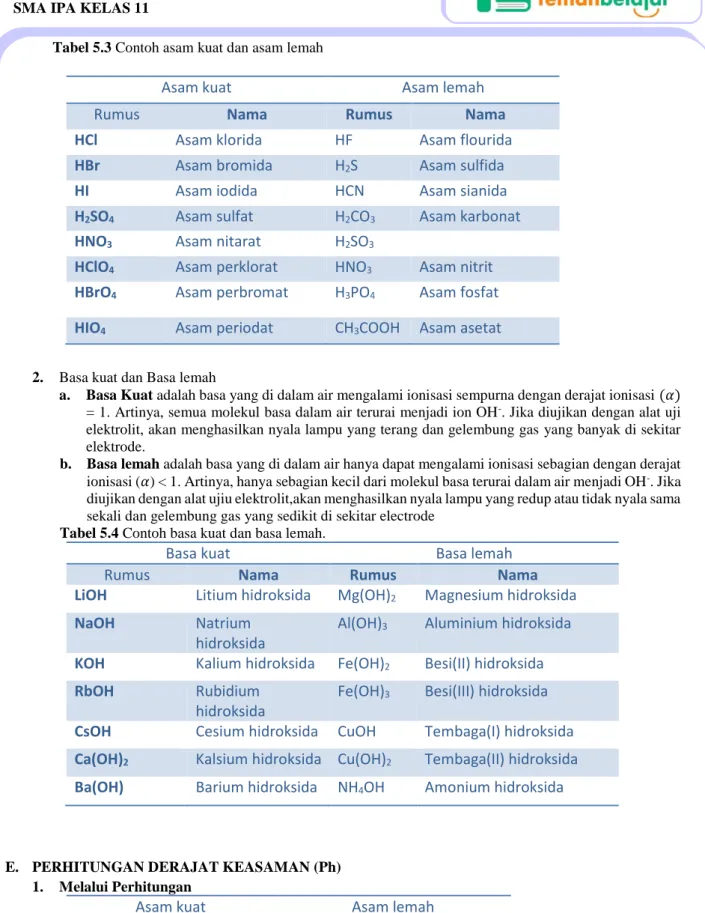
a. Asam kuat adalah asam yang di didalam air mengalami ionisasi sempurna dengan derajat ionisasi (𝛼) = 1. Artinya, semua molekul asam dalam air terurai menjadi io H+. Jika diujikan dengan alat uji
elektrolit,akan menghasilkan nyala lampu yang terang dan gelembung gas yang banyak disekitar elektrode.
b. Asam Lemah adalah asam yang didalam air hanya dapat mengalami ionisasi sebagian dengan derajat ionisasi (𝛼)< 1. Artinya, hanya sebagian kecil dari molekul asam terurai dalam air menjadi ion H+. Jika diujikan denga alat uji lelktrolit, akan menghasilkan nyala lampu yang redup atau tidak
4
E-book ini hanya untuk kalangan sendiri tidak untuk dijualbelikan Tabel 5.3 Contoh asam kuat dan asam lemah2. Basa kuat dan Basa lemah
a. Basa Kuat adalah basa yang di dalam air mengalami ionisasi sempurna dengan derajat ionisasi (𝛼) = 1. Artinya, semua molekul basa dalam air terurai menjadi ion OH-. Jika diujikan dengan alat uji
elektrolit, akan menghasilkan nyala lampu yang terang dan gelembung gas yang banyak di sekitar elektrode.
b. Basa lemah adalah basa yang di dalam air hanya dapat mengalami ionisasi sebagian dengan derajat ionisasi (𝛼) < 1. Artinya, hanya sebagian kecil dari molekul basa terurai dalam air menjadi OH-. Jika
diujikan dengan alat ujiu elektrolit,akan menghasilkan nyala lampu yang redup atau tidak nyala sama sekali dan gelembung gas yang sedikit di sekitar electrode
Tabel 5.4 Contoh basa kuat dan basa lemah.
Basa kuat
Basa lemah
Rumus
Nama
Rumus
Nama
LiOH
Litium hidroksida
Mg(OH)
2Magnesium hidroksida
NaOH
Natrium
hidroksida
Al(OH)
3Aluminium hidroksida
KOH
Kalium hidroksida
Fe(OH)
2Besi(II) hidroksida
RbOH
Rubidium
hidroksida
Fe(OH)
3Besi(III) hidroksida
CsOH
Cesium hidroksida CuOH
Tembaga(I) hidroksida
Ca(OH)2
Kalsium hidroksida Cu(OH)
2Tembaga(II) hidroksida
Ba(OH)
Barium hidroksida
NH
4OH
Amonium hidroksida
E. PERHITUNGAN DERAJAT KEASAMAN (Ph) 1. Melalui Perhitungan
Asam kuat
Asam lemah
[H
+] = a x M
pH = - log [H
+]
a = jumlah ion H
+M = molaritas larutan asam
[H
+] =√𝐾
𝑎
× 𝑀𝑎
[H
+] = 𝛼 × 𝑀𝑎
K
a= tetapan kesetimbangan
asam
Ma = molaritas asam lemah
𝛼 = derajat ionisasi asam lemah
Asam kuat
Asam lemah
Rumus
Nama
Rumus
Nama
HCl
Asam klorida
HF
Asam flourida
HBr
Asam bromida
H
2S
Asam sulfida
HI
Asam iodida
HCN
Asam sianida
H2SO4
Asam sulfat
H
2CO
3Asam karbonat
HNO3
Asam nitarat
H
2SO
3HClO4
Asam perklorat
HNO
3Asam nitrit
HBrO4
Asam perbromat
H
3PO
4Asam fosfat
E-book ini hanya untuk kalangan sendiri
tidak untuk dijualbelikan
5
Basa kuat
Basa lemah
[OH
-]= 𝒃 × M
pH = -log[OH
-]
pH = 14 – pOH
b = jumlah ion OH
-M = molaritas larutan basa
[OH
-] =√𝐾
𝑏
× 𝑀𝑏
[OH
-] = 𝛼 × 𝑀𝑏
K
b= tetapan kesetimbangan
Mb = molaritas basa lemah
𝛼 = derajat ionisasi basa
2. Melalui Indikator (kisaran pH) Contoh:
Suatu larutan berwarna biru jika ditetesi dengan indikator bromitol biru(6,0 – 7,6) dan tidak berwarna dengan indikator fenolftalein (8,3 – 10,0). Berapakah pH larutan tersebut?
Jawab:
Ingat kembali trayek pH pada Tabel 5.2
Jika dengan bromtimol biru larutan menjadi berwarna biru, artinya pH>7,6 Jika dengan fenolftalein tidak berwarna, artinya pH< 8,3
Pilihlah satu jawaban yang paling tepat ! 1. Di bawah ini adalah pernyataan tentang asam
menurut bebrapa teori asam-basa. I. Asam adalah zat pemberi proton. II. Asam adalah zat yang dalam air
melepaaskan ion H+.
III. Asam adalah zat penerima pasangan electron
Pernyataan I, II, dan III berturut-tururt, didasarkan pada teori . . . .
A. Arrhenius, Br∅nsted-Lowry, dan Lewis B. Arrhenius, Lewis, dan Br∅nsted-Lowry C. Lewis, Arrhenius, dan Br∅nsted-Lowry D. Bronsted-Lowry,Lewis, dan Arrhenius E. Bronsted-Lowry, Arrhenius, dan Lewis 2. Menurut Arrhenius,basa adalah senyawa yang
jika dilarutkan dalam air menghasilkan . . . . A. Proton
B. Elektron C. Neutron D. ion OH-
E. ion H+
3. Perhatikan reaksi-reaksi di bawah ini. 1) C6H5OH C6H5O- + H+
2) Fe(OH)2 Fe2+ + 2OH
-3) NH4OH NH4+ + OH-
4) HCN H+ + CN-
Berdasarkan reaksi di atas, senyawa yang
termasuk asam menurut Arrhenius adalah . . . . A. C6H5OH dan Fe(OH)2
B. C6H5OH dan NH4OH
C. Fe(OH)2 dan NH4OH
D. C6H5OH dan HCN
E. NH4OH dan HCN
4. Air aki (H2SO4) digunakan uutk mengisi sel aki
sebagai elektrolit. Menurut Arrhenius, air aki bersifat asam karena . . .
A. air aki mengandung atom hidrogen B. air aki mudah larut dalam air
C. air aki terurai dalam air melepaskan ion H+
D. air aki dapat menghantarkan listrik E. air aki dapat memberikan proton 5. Perhatikan reaksi-reaksi dibawah ini. 1. H2O + H2SO4 ⇋ H3O+ + HSO4
-2. H2O + HCO3 ⇋ H2CO3 + OH-
3. H2O + NH3 ⇋ NH4+ + OH
-4. H2O + HSO4- ⇋ H3O+ + SO4
-menurut Br∅nsted-Lowry,H2O yang bertindak
sebagai basa terdapat pada reaksi . . . . A. 1 dan 2
B. 1 dan 3 C. 1 dan 4 D. 2 dan 3 E. 3 dan 4
6
E-book ini hanya untuk kalangan sendiri tidak untuk dijualbelikan 6. Diketahui beberapa senyawa asam berikut.1. HNO3 3. CH3COOH
2. H2SO4 4. H3PO4
Senyawa asam tersebut yang memiliki valensi 1 dan 3 berturut-turut adalah. . .
A. 1 dan 2 B. 1 dan 3 C. 2 dan 3 D. 2 dan 4 E. 3 dan 4
7. Pasangan basa di bawah ini yang bervalensi 1 dan 2 adalah . . . .
A. NaOH dan KOH B. KOH dan Ca(OH)2
C. Fe(OH)2 dan Ca(OH)2
D. Cu(OH)2 dan Ba(OH)2
E. NaOH dan Al(OH)3
8. Menurut teori asam-basa Lewis, asam adalah. . . .
A. zat pemberi pasangan elektron B. zat penerima proton
C. zat penerima pasangan elektron D. zat pemberi proton
E. zat pemberi OH
-9. Diketahui reaksi berikut.
CH3COOH + HCl ⇋ CH3COOH2+ + Cl
-pasangan spesu ytang bersifat asam menurut teori Br∅nsted-Lowry adalah. . . .
A. CH3COOH2+ dan Cl
-B. HCl dan Cl
-C. HCl dan CH3COOH2+
D. CH3COOH dan Cl
-E. CH3COOH dan CH3COOH2+
10. Diketahui reaksi berikut. CO32- + H2O ⇋ HCO3- + OH
-Pasangan spesi yang bersifat basa menurut teori Br∅nsted-Lowry adalah . . . . A. CO32- dan H2O B. CO32- dan -C. CO32- dan OH -D. H2O dan OH- E. H2O dan HCO3
11. Diketahui persamaan reaksi berikut. C2H4O2 + H2O ⇋ H3O+ + C2H3O2
-Spesi yang termasuk pasangan asam-basa konjugasi menurut Br∅nsted-Lowry adalah A. C2H4O2 dan H2O
B. H3O+ dan C2H3O2
-C. C2H4O2 dan H3O+
D. C2H4O2 dan C2H3O2-
E. H2O dan C2H3O2
-12. Perhatikan reaksi berikut. 1. HCl + H2O ⇋ Cl- + H3O+
2. NH3 + H2O ⇋ OH- + NH4+
Spesi yang bersifat amfoter adalah . . . . A. HCl
B. H2O
C. NH3
D. NH+
E. H3O+
13. Zat berikut ini yang merupakan asam konjungsi dari PO43- adalah . . . . A. HPO42- B. H2PO4- C. H2SO4 -D. HPO4- E. SO4
-14. Zat berikut ini yang merupakan basa konjugasi dari H2SO4 adalah . . . . A. SO4 2-B. HSO4- C. H2SO4- D. HSO4- E. SO4
-15. Diketahui persamaan reaksi berikut. 1. HF + H2O F- + H3O+
2. NH3 + H2O NH4+ + OH
-3. HCN + H2O CN- + H3O+
4. CO32- + H2O HCO3- + OH
-Berdasarkan reaksi di atas. H2O yang berperan
sebagai asam dan basa secara berurutan terdapat pada reaksi. . . . A. 1 dan 2 B. 1 dan 3 C. 2 dan 3 D. 2 dan 4 E. 3 dan 4
16. Diketahui reaksi: H2SO4 + H2O ⇋ HSO4- + H3O+
Pernyataan yang benar tentang reaksi di atas adalah . . . .
A. HSO4- sebagai asam konjugasi dari H2SO4
B. H2SO4 bersifat asam karena menerima
proton
C. H2SO4 dan H3O+ sebagai pasangan asam
basa konjugasi
D. H3O+ sebagai basa konjugasi dari H2O
E. H2O bersifat basa karena menerima proton
17. Perhatikan rumus titik elektron dari senyawa-senyawa berikut.
Berdasarkan struktur Lewis di atas, senyawa yang bersifat asam adalah . . . .
A. 1 dan 2 B. 1 dan 3 C. 2 dan 3 D. 2 dan 4 E. 3 dan 4
18. Perhatikan reaksi berikut. BF3 + NH3 NH3BF3
Berdasarkan reaksi di atas, menurut Lewis NH3
berperan sebagai basa karena . . . . A. NH3 menerima proton dari BF3
B. NH3 menerima pasangan elektron dari BF3
E-book ini hanya untuk kalangan sendiri
tidak untuk dijualbelikan
7
D. NH3 memberi pasangan elektron kepada
BF3
E. NH3 memberi ion OH- dalam pelarut air
19. Perhatikan contoh larutan berikut. 1. Sabun 3. Cuka 2. Air jeruk 4. Kapur
larutan yang mengandung ion H+ adalah. . . .
A. 1 dan 2 B. 1 dan 3 C. 2 dan 3 D. 2 dan 4 E. 3 dan 4
20. Diketahui bahan makanan berikut. 1. Buah belimbing 3. Buah tomat 2. Daun pepaya 4. Bauh pare Berdasarkan data di atas, buah /daun yang mengandung zat basa adalah. . . .
A. 1 dan 2 B. 1 dan 3 C. 2 dan 3 D. 2 dan 4 E. 3 dan 4
21. Zat asam yang terkandung dalam buah jeruk adalah. . . . A. asam asetat B. asam sitrat C. asam malat D. asam tartrat E. asam sulfat
22. Di dalam laboratorium terdapat bebagai larutan yang memiliki sifat - sifat berikut.
1. Korosif terhadap logam 2. Rasanya pahit
3. Memerahkan lakmus biru 4. Memerahkan larutan PP 5. Bersifat elektrolit
Sifat –sifat yang dimiliki oleh larutan asam adalah . . . . A. 1, 2, dan 3 B. 1, 3, dan 5 C. 2, 3, dan 4 D. 2, 4 dan 5 E. 3, 4 dan 5
23. Di dalam laboratorium terdapat berbagai larutan dengan sifat-sifat berikut.
1. Rasanya masam 2. Terasa licin di kulit 3. Memerahkan lakmus biru 4. Membirukan lakmus merah
Sifat-sifat yang dimiliki oleh larutan basa adalah . . . . A. 1 dan 2 B. 1 dan 3 C. 1 dan 4 D. 2 dan 3 E. 2 dan 4
24. Pernyataan berikut yang kurang tepat tentang asam adalah . . . .
A. memiliki rasa masam B. memiliki ph kurang dari 7
C. dapat memerahkan lakmus biru D. semua asam bersifat elektrolit kuat E. dapat menetralkan basa
25. Perhatikan reaksi ionisasi zat-zaz yang dilarutkan dalam air berikut.
1. NH4OH(aq) NH4+(aq) + OH-(aq)
2. HCl(aq) H+(aq) + Cl-(aq)
3. NaCl(aq) Na+(aq) + Cl-(aq)
4. H2CO3(aq) 2H+(aq) + CO32-(aq)
Larutan yang bersifa asam dan basa berturut-turut adalah . . . . A. NH4OH dan HCl B. HCl dan NaCl C. NH4OH dan NaCl D. HCl dan H2CO3 E. H2CO3 dan NH4OH
26. Perhatikan reaksi ionisasi zat-zat yang dilarutkan dalam air berikut.
1. KOH(aq) K+(aq) + OH-(aq)
2. CaCl2(aq) Ca+(aq) + 2Cl-(aq)
3. Cu(OH)2(aq) Cu2+(aq) + 2OH-(aq)
4. CH3COOH(aq) CH3COO-(aq) + H+(aq)
5. NaNO3(aq) Na+(aq) + NO3-(aq)
larutan yang dapat mmerahkan lakmus biru adalah. . . . A. KOH B. CaCl2 C. Cu(OH)2 D. CH3COOH E. NaNO3
27. Perhatikan reaksi ionisasi zat-zat yang dilarutkan dalam air berikut.
1. NaOH(aq) Na+(aq) + OH-(aq)
2. CaCl2(aq) Ca2+(aq) + 2Cl-(aq)
3. Ca(OH)2(aq) Ca2+(aq) + 2OH-(aq)
4. HCOOH(aq) HCOO-(aq) + H+(aq)
Berdasarkan reaksi di atas, larutan yang dapat memerahkan PP adalah. . . .
A. NaOH dan CaCl2
B. CaCl2 dan Ca(OH)2
C. Ca(OH)2 dan NaOH
D. NaOH dan HCOOH E. Ca(OH)2 dan HCOOH
28. Air sabun dapat membirukan kertas lakmus merah, tetapi tidak mengubah kertas lakmus biru. Warna larutan yang terjadi jika air sabun di uji dengan indikator PP adalah . . .
A. Merah B. kuning C. biru. D. jingga E. tak berwarna
29. Air aki dapat memerahkan kertas lakmus biru, tetapi tidak mengubah warna kertas lakmus merah. Ai soda dapat membirukan kertas lakmus merah, tetapi tidak mengubah warna kertas lakmus biru. Berdasarkan informasi tersebut air aki dan air soda berturut turut memiliki sifat . . . .
8
E-book ini hanya untuk kalangan sendiri tidak untuk dijualbelikan A. asam dan basaB. basa dan asam C. asam dan netral D. basa dan netral E. netral dan asam
30. Indikator lakmus merah berubah menjadi biru dalam air kapur. Indikator ii akan memberikan warna biru juga dalam . . .
A. air sabun B. air jeruk C. air aki D. air garam E. air liur
31. Suatu larutan tak berwarna jika ditetesi dengan indikator fenolftalein(PP) berubah menjadi merah. Perubahan warna tersebut dikarenakan dalam larutan tersebut terkandung . . . . A. ion hidroksida
B. ion hidrogen C. atom hydrogen D. atom oksigen E. molekul air
32. Asam sulfat dalam air terionisasi sempurna dengan persamaan reaksi . . .
A. H2SO4(aq) H+(aq) + SO4-(aq)
B. H2SO4(aq) 2H+(aq) + 2SO4-(aq)
C. H2SO4(aq) H2+(aq) + SO42-(aq)
D. H2SO4(aq) 2H2+(aq) + SO42-(aq)
E. H2SO4(aq) 2H+(aq) + SO42-(aq)
33. Perhatikan reaksi ionisasi zat-zat yang dilarutkan 1. CaCl2(aq) Ca2+(aq) + 2Cl-(aq)
2. KOH(aq) K+(aq) + OH-(aq)
3. CH3COOH(aq) ⇋ CH3COO-(aq) + H+(aq)
4. Ca(OH)2(aq) Ca2+(aq) + 2OH-(aq)
zat yang tergolong basa ditunjukan oleh nomor. . A. 1 dan 2
B. 1 dan 3 C. 1 dan 4 D. 2 dan 4 E. 3 dan 4
34. Senyawa di bawah ini yang dalam air tidak dapat menghasilkan ion H+ adalah . . . .
A. NH4OH
B. HNO3
C. HCN D. CH3COOH
E. HBr
35. Larutan A dapat memerahkan lakmus biru, sedangkan larutan B tidak dapat merubah lakmus merah maupun biru. Berdasarkan hasil pengujian tersebut, larutan A dan B secara berturut turut bersifat. . . .
A. asam dan basa B. basa dan netral C. asam dan netral D. basa dan asam E. netral dan asam
36. Berikut ini adalah hasil pengujian beberapa larutan dengan indikator lakmus
Larutan
Perubahan warna
Lakmus merah Lakmus biru
Sari buah jeruk
Merah
Merah
Sabun
Biru
Biru
Garam
Merah
Biru
Gamping
Biru
Biru
Tawas
Merah
Merah
Berdasarkan data tersebut, larutan yang bersifat asam adalah. . . .
A. sari buah jeruk dan sabun B. sari buah jeruk dan garam C. sari buah jeruk dan tawas D. sabun dan garam
E. sabun dan tawas
37. Perhatikan tabel hasil pengujian beberapa larutan dengan menggunakan lakmus berikut.
Larutan
Perubahan warna
Lakmus merah Lakmus biru
Garam Inggris
Merah
Merah
Pasta gigi
Biru
Biru
Garam dapur
Merah
Biru
Obat maag
Biru
Biru
Air aki
Merah
Merah
Berdasarkan tabel diatas, larutan yang bersifat basa adalah . . .
A. garam inggris dan pasta gigi B. garam inggris dan garam dapur C. pasta gigi dan obat mag D. pasta gigi dan air aki E. obat mag dan air aki
38. Dari pengujian beberapa larutan dengan kertas lakmus diperoleh data sebagai berikut.
Larutan
Perubahan warna
Lakmus merah
Lakmus
biru
P
Q
R
S
Merah
Merah
Biru
Merah
Biru
Merah
Biru
Merah
Berdasarkan data di atas, larutan yang mengandung ion H+ adalah . . . .
A. P dan Q B. P dan R C. Q dan R D. Q dan S E. R dan S
39. Larutan CH3COOH dapat memerahkan kertas
lakmus biru, namun kertas lakmus merah tetap. Di antara larutan berikut yang menunjukan hasil pengujian yang sama dengan larutan CH3COOH
E-book ini hanya untuk kalangan sendiri
tidak untuk dijualbelikan
9
A. NaOH B. C2H5OH
C. NH4OH
D. H2C2O4
E. Ca(OH)2
40. Perhatikan data hasil pengujian beberapa larutan dengan menggunakan kertas lakmus berikut. Berdasarkan data di atas, larutan yang bersifat netral adalah. . . . A. HCl B. NaOH C C2H5OH D. NH4OH E. H2SO4
41. Air kelapa jika diuji dengan alat uji elektrolit tidak memunjukan gejala lampu menyala tetapi muncul sedikit gelembung gas di sekitar elektrode. Jika diuji dengan indikator lakmus dapat membirukan lakmus merah. Berdasarkan hasil pengujian, dapat disimpulkan air kelapa bersifat . . . . A. asam lemah B. asam kuat C. netral D. basa lemah E. basa kuat
42. Air aki jika diuji dengan alat uji elektrolit muncul gejala lampu menyala dan banyak gelembung gas di sekitar elektrode. Jika diuji dengan indikator lakmus dapat memerahkan lakmus biru. Berdasarkan hasil pengujian, dapat disimpulkan air kelapa bersifat . . . .
A. asam lemah B. asam kuat C. netral D. basa lemah E. basa kuat
43. Perhatikan data hasil pengujian daya hantar listrik beberapa larutan asam berikut.
No
.
Larutan
Pengamatan
Nyala
lampu
Elektrode
1.
H
2SO
4Nyala
terang
Ada banyak
gelembung
2.
HCN
Tidak nyala
Ada sedikit
gelembung
3.
HNO
3Nyala
terang
Ada banyak
gelembung
4.
HF
Nyala
redup
Ada sedikit
gelembung
Berdasarkan data di atas, senyawa yang termasuk asam lemah adalah . . . . A. 1 dan 2
B. 1 dan 3 C. 2 dan 3 D. 2 dan 4 E. 3 dan 4
44. Perhatikan data hasil pengamatan pH beberapa larutan asam dengan menggunakan indikator unversal berikut.
1. Larutan A memiliki pH = 1 2. Larutan B memiliki pH = 5 3, Larutan C memiliki pH = 3
Perbedaan tingkat keaasaman dari larutan A, B,
dan C yang benar adalah . . . . A. Larutan A < B
B. Larutan A < C C. Larutan A > B D. Larutan B > C E. Larutan C < B
45. Perhatikan data hasil pengujian daya hantar listrik beberapa larutan basa berikut.
No. Larutan
Pengamatan
Nyala
lampu
Elektrode
1.
KOH
Nyala
terang
Ada banyak
gelembung
2.
NH3
Nyala
redup
Ada sedikit
gelembung
3.
Fe(OH)
3Nyala
redup
Ada sedikit
gelembung
4.
NaOH
Nyala
terang
Ada banyak
gelembung
Berdasarkan data di atas, senyawa basa yang termasuk basa kuat adalah . . . .
A. KOH dan NH3
B. KOH dan Fe(OH)3
C. KOH dan NaOH D. NH3 dan Fe(OH)3
E. NH3 dan NaOH
46. Perhatikan hasil pengukuran pH beberapa larutan dengan indikator universal berikut.
Larutan uji
pH
X
2
Y
11
Z
7
Berdasarkan hasil pengamatan tersebut, sifat larutan X, Y, dan Z beturut-turut adlah . . . . A. asam, netral dan basa
B. asam, basa, dan netral C. basa, asam, netral D. basa, netral dan asam E. Netral, basa, dan asam
Larutan
Perubahan warna
Lakmus merah
Lakmus biru
HCl
Merah
Merah
NaOH
Biru
Biru
C2H5OH
Merah
Biru
NH4OH
Biru
Biru
10
E-book ini hanya untuk kalangan sendiri tidak untuk dijualbelikan 47. Perhatikan data hasil pengujian pH berikut.Larutan uji
pH
Air jahe
8,2
Air kelapa
9,1
Air hujan
6,5
Air tanah
5,9
Bahan yang bersifat basa adalah . . . . A. air jahe dan air kelapa
B. air jahe dan air hujan C. air kelapa dan air hujan D. air kelapa dan air tanah E. air hujan dan air tanah
48. Perhatikan hasil pengujian pH berbagai bahan berikut.
Larutan uji
pH
kapur
8,5
sabun
11
soda api
12
urine
6,0
susu
7,0
Urutan bahan-bahan tersebut dimulai dari yang paling basa hingga yang paling asam adalah . . . . A. kapur – sabun – soda api – urine – susu B. urine – susu – kapur – sabun - -soda api C. urien – susu – sabun – soda api – kapur D. soda api – sabun – kapur – susu – urine E. soda api – sabun – susu – kapur - urine 49. Data hasil pengujian pH dari bebagai bahan
disajikan dalam tabel berikut.
Larutan uji
pH
Getah lambung
2
darah
7,4
Jus jeruk
4,0
Pasta gigi
9,9
Urutan bahan-bahan tersebut dimulai dari yang paling asam hingga paling basa adalah . . . . A. pasta gigi – darah – jus jeruk – getah
lambung
B. getah lambung- -jus jeruk - -darah – pasta gigi
C. kus keruk - -getah lambung – darah - - pasta gigi
D. jus jeruk – pasta gigi – getah lambung – darah
E. jus jeruk - getah lambung – pasta gigi – darah
50. Perhatikan tabel Ka dari beberaoa asam berikut
Asam
HX
HY
HZ
K
a6,2 x 10
-81,8 x 10
-59,2 x
1-
-7 Berdasarkan tabel di atas, urutan kekuatan asam yang benar adalah . . .A. HX> HY > HZ B. HX > HZ > HY C. HY > HX > HZ D. HY > HZ > HX
E. HZ > HY > HX
51. Diberikan tabel milai Ka beberapa senyawa asam
berikut.
No.
Senyawa
K
a1.
HCOOH
1,77 x 10
-42.
CH
3COOH
1,75 x 10
-53.
C
6H
5OH
6,30 x 10
-54.
HF
6,50 x 10
-45.
HCN
4,90 x 10
-10Berdasrkan data diatas, asam yang paling lemah adalah. . . . A. HCOOH B. CH3COOH C. C6H5OH D. HF E. HCN
52. Perhatikan tabel Kb dari beberapa basa berikut.
Basa Metil amina
Amonia
Etil amina
K
B3,7 x 10
-41,8 x 10
-54,3 x 10
-4 Berdasarkan tabel dia atas, urutan kekuatan basa tang benar adalah . . . .A. metil amina > amonia > etil amina B. metil amina > etil amina > amonia C. etil amina > amonia > metil amina D. etil amina > metil amina > amonia E. amonia > metil amena > etil amina
53. Diketahu beberapa contoh larutan asam berikut. 1. HCl 4. CH3COOH
2. H2SN 5. HCn
3. HNO3
Larutan asam lemah ditunjukan oleh nomor . . . . A. 1 dan 3
B. 1 dan 5 C. 2 dan 4 D. 3 dan 4 E. 4 dan 5
54. Seorang siswa melakukan pengujian terhadap larutan A,B,C, dan D menggunakan indikaor PP.. hasil yang diperoleh adalah larutan A berubah warna menjadi merah, larutan B tidak berwwarna, larutan C berubah menjadi merah mua, dan larutan D. tidak berwarna
A. A dan B B. A dan C C. B dan C D. B dan C E. C dan D
55. Perhatikan hasil uji sampel berikut.
Indikator
Trayek
pH
Perubahan
Warna
Sampel
MM
4,2 – 6,3
Merah -
kuning
Kuning
BTB
6,0 – 76
Kuning -
biru
Biru
PP
8,3 – 10
Merah
E-book ini hanya untuk kalangan sendiri
tidak untuk dijualbelikan
11
nilai pH unutk sampel tersebut adalah . . . . A. pH ≤ 4,2
B. 6,3 ≥pH ≤ 8,3 C. 7,6 ≥pH≤ 8,3 D. pH≥ 8,3 E. pH≥ 10
56. Perhatikan perubahan warna dan trayek pH beberapa indikator berikut.
Indikator
Trayek pH
Trayek Warna
MM
4,2 – 6,3
Merah – Kuning
BTB
6,0 – 7,6
Kuning – biru
PP
8,3 – 10,0
Tidak berwarna -
merah
Seorang siswa melakukan uji dengan larutan pH ≤ 4,2 menggunakan indikator-indikator tersebut.Perubahan warna yang terjadi pada setiap indikator adalah . . . .
MM
BTB
PP
A.
Merah
Kuning
Tidak berwarna
B.
Kuning
Biru
Tidak berwarna
C.
Kuning
Biru
merah
D.
Kuning
Kuning
Tidak berwarna
E.
Merah
Kuning
merah
57. Peralatan rumah tangga berikut yang mudah rusak apabila terkena larutan asam adalah . . . . A. ember plastik
B. cobek batu C. galon air D. gergaji E. rak kayu
58. Perhatikan tabel hasil pengamatan perubahan warna larutan asam, cuka,garam dan air sabun dalam ekstak bahan indikator bahan alam berikut.
Bahan Indikator Bahan Alam Maw ar Kembang sepatu Kunyit Kulit manggis Wort el Mula-mula
Ungu Merah Kuning Cokelat jingga
+Garam Ungu Merah Kuning Kuning jingga +cuka mera
h
Merah Kuning jingga jingga
+sabun hijau hijau Cokela t
Hijau tua jingga
Berdasarkan hasil pengamatan di atas indikato asam-basa adalah ekstrak bahan . . . .
A. mawar
B. kembang sepatu C. kunyit
D. kulit manggis E. wortel
59. Diketahui ekstrak kunyit akan berwarna kuning terhadap larutan asam dan berwarna cokelat terhadap larutan basa. Hasil ekstrak kunyit terhadap tahu putih dan mi adalah kuning, sedangkan terhadap bakso dan kerupuk karak adalah coklat. Jika diketahui boraks bersifat
basa, bahan yang mengandung boraks adalah . . . A. tahu putih dan bakso
B. tahu puti dan mi telor C. bakso dan kerupuk karak D. bakso dan mi telor
E. mi telor dan kerupukl karak 60. Apabila ekstrak kembang sepatu merah
digunakan sebagai indikator asam-basa, warna yang terjadi dalam larutan asam dan basa berturut – turut adalah. . . .
A. Merah dan hijau B. Hijau dan merah C. Ungu dan merah D. Merah dan ungu E. Merah dan kunig
61. Hujan asam terjadi karena pencemaran udara oleh oksida belerang dan oksida nitrogen. Oksida belerang SO3 akan bereaksi dengan air
hujan menghasilkan asam kuat yaitu . . . . A. Asam sulfit
B. Asam sulfida C. Asam sulfat D. Asam nitrit E. Asam nitrat
62. Berikut ini yabg bukan merupakan akibat adanya hujan asam adalah . . . .
A. Rusaknya gedung-gedung B. Rusaknya hutan
C. Matinya biota air D. Rusaknya logam-logam E. Suburnya tanah
63. asam karbonat dalam air terionisasi sebagian. Persamaan reasksinya adalah . . . .
A. H2CO3 ⇋ H+(aq) + CO3-(aq)
B. H2CO3 ⇋ 2H2(aq) + CO32- (aq)
C. H2CO3 ⇋ H+(aq) + CO32-(aq)
D. H2CO3 ⇋ 2H+(aq) + CO32-(aq)
E. H2CO3 ⇋ 2H+(aq) + 2CO32-(aq)
64. Larutan A jika ditetesi dengan indikatro PP berubah menjadi merah dan jika diuji dengan alat uji elektrolit menyebabkan lampu menyala terang dan muncul gelembung gas di sekitar elektrode. Berdasrkan hasil pengujian tersebut, dapat disimpulkan bahwa larutan A bersifat . . . . A. basa kuat
B. asam kuat C. netral D. basa lemah E. asam lemah
65. Larutan yang merupakan basa kuat adalah . . . . A. AgOH
B. Al(OH)3
C. Zn(OH)2
D. NH4OH
E. Ba(OH)2
66. Larutan asam kuat dan asam lemah berturut turut adalah . . . .
A. NaOH dan NH4OH
B. HCOOH dan HCl C. CH3COOH dan HCN
12
E-book ini hanya untuk kalangan sendiri tidak untuk dijualbelikan D. NH4OHE. H2SO4 dan H2S
67. Diketahui beberapa larutan asam dan basa berikut.
1. HNO2 4.NH3
2. HNO3 5.KOH
3. HF
Larutan asam kuat ditunjukan oleh nomor . . . . A. 1
B. 2 C. 3 D. 4 E. 5
68. Di antara kelompok asam berikut yang tergolong asam lemah adalah . . . .
A. asam nitrat, asam sulfit, dan asam sulfida B. asam sulfat, asam iodida, dan asam klorida C. asam klorida, asam asetat, dan asam karbonat
D. asam nitrit, asam flourida, dan asam sianida E. asam format, asam bromida, dan asam pospat
69. Diketahui beberapa larutan basa berikut. 1. NaOH 3.NH3
2. Cu(OH)2 4.KOH
Larutan basa yang dapat menyebabkan bola la,pu pada alat uji elektrolit menyala teran dan muncul banyak gelembung gas adalah. . . . A. 1 dan 2
B. 1 dan 3 C. 1 dan 4 D. 2 dan 3 E. 2 dan 4
70. Terdapat bebrapa larutan asam berikut. 1. Asm klorida 4.Asam sulfat 2. Asam iodida 5.Asam flourida 3. Asam nitrat
Larutan asam yang menunjukan gejala lampu redup dan timbul sedikit gelembung gas di sekitar elektrode adalah . . . .
A. 1 B. 2 C. 3 D. 4 E. 5
71. Nilai pH larutan bersifat asam adalah . . . . A. pH = 7
B. pH < 7 C. pH > 7 D. pH≤ 7 E. pH ≥ 7
72. Air aki dapat memerahkan kertas lakmus biru, namun tidak merubah warna kertas lakmus merah. Berdasarkan hal tersebut, pernyataan berikut yang tidak tepat adalah . . . .
A. air aki besifat asam B. air aki memiliki pH = 7 C. air aki termasuk elektrolit D. air aki mengandung ion H+
E. air aki memiliki pH < 7
73. Diketahui beberapa larutan berikut. 1. Larutan sabun 3. Larutan kaporit 2. Larutan cuka 4. Larutan urea
Larutan yang memiliki harga pH > 7 adalah . . . . A. 1 dan 2
B. 1 dan 3 C. 1 dan 4 D. 2 dan 3 E. 3 dan 4
74. larutan berikut ini yang dapat memerahkan lakmus biru adalah . . . .
A.CH3COOH B.NH4OH
C.Ba(OH)2
D.C2H5OH
E.CH3OH
75. diberikan beberapa contoh larutan berikut. 1. HCl 4. HCN
2. NaOH 5. NH3
3. NaCl
larutan yang memiliki pH = 7 adalah . . . . A. 1
B. 2 C. 3 D. 4 E. 5
76. Pasangan senyawa berikut ini yang termasuk asam dan basa lemah adalah . . . .
A. HCl dan KOH B. HNO2 dan NaOH
C. H2CO3 danCa(OH)2
D. HCN dan NH3
E. CH3COOH dan Ba(OH)2
77. zat berikut ini yang tidak tergolong asam kuat adalah . . . . A. asam cuka B. asam klorifa C. asam sulfat D. asam nitrat E. asam iodida
78. Diketahui beberapa senyawa asam berikut. 1. HI 4. HF
2. HBr 5. H2SO4
3. HCl
Senyawa asam yang dalam air terionisasi hanya sebagian adalah . . . . A. 1 B. 2 C. 3 D. 4 E. 5
79. Diketahui beberapa larutan asam berikut. 1. HCl 0,1 M 4. H3PO4 0,1 M
2. H2SO4 0,1 M 5. HF 0,1 M
3. CH3COOH 0,1 M
Larutan yang menganfung ion H+ paling banyak
E-book ini hanya untuk kalangan sendiri
tidak untuk dijualbelikan
13
A. 1 B. 2 C. 3 D. 4 E. 5
80. Kelompok senyawa berikut ini yang larutannya memiliki pH > 7 adalah . . . .
A. NaOH, Ca(OH)2 dan HCOOH
B. KOH, NH3 dan Zn(OH)2
C. NH3, CH3COOH, dan Ba(OH)2
D. Fe(OH)3,C2H5Ohm dan C6H5OH
E. Cu(OH)2, NaOH, dan C2H5OH
81. Sebanyak 100mL larutan HCl 0,001 M mempunyai pH . . . . A. 1 B. 2 C. 3 D. 12 E. 13
82. Sebanyak 10 mL larutan KOH 0,01 M mempunyai pH . . . . A. 1 B. 2 C. 3 D. 4 E. 5
83. Apabila 0,005 mol H2SO4 dilarutkan dalam air
hingga volume larutan menjadi 100mL, pH larutan H2SO4 adalah . . . . A. 1 B. 2 C. 3 D. 4 E. 5
84. Jika Ka CH3COOH adalah 10-5, pH larutan
CH3COOH 0,01 M adalah . . . . A. 2 B. 2,5 C. 3 D. 3,5 E. 5 85. Larutan amonia 0,1 M (Kb = 1 X 10-5) mempunyai pH . . . . A. 1 B. 3 C. 6 D. 11 E. 13
86. sebanyak 300 mL larutan Ba(OH)2 ) 0,005 M
mempunyai pH . . . . A. 2 B. 3 – log 5 C. 11 D. 11 + log 5 E. 12
87. Jika pada 10 mL larutan HCl 0,1 M ditambahkan 90 mL air. Nilai pH larutan akan menjadi . . . . A. 1
B. 2 C. 3
D. 4 E. 5
88. Suatu basa lemah MOH mempunyai pH = 11 log 2, Kb MOH = 2 x 10-5. Konsentrasi basa tersebut
adalah . . . . A. 0,1 M B. 0,2 M C. 0,3 M D. 0,4 M E. 0,5 M
89. Sebanyak 2 gram NaOH (Mr = 40) dilarutkan
dalam air hingga volume larutan menjadi 500 mL, pH larutan NaOH tersebut adalah . . . . A. 1
B. 3 C. 6 D. 11 E. 13
90. Sebanyak 100 mL larutan NaOH 0,1 M ditambah air hingga volume larutan menjadi 1.000 mL. Perubahan pH larutan NaOH setelah diencerkan adalah dari . . . .
A. 11 menjadi 12 B. 12 menjadi 11 C. 12 menjadi 13 D. 13 menjadi 14 E. 13 menjadi 12
91. Sebanyak 0,74 gram Ca(OH)2 (Mr = 74)
dilarutkan dalam air hingga volume 2 L,pH larutan tersebut adalah . . . .
A. 11 B. 12 – log 5 C. 12 D. 12 + log 5 E. 13 92. Dalam larutan NH4OH 0,1 M (Kb NH4OH = 10 -5), besarnya konsentrasi [OH-] larutan tersebut
adalah . . . . A. 10-1 M B. 10-3 M C. 10-5 M D. 10-6 M E. 10-11 M
93. Diberikan tabel data harga Ka asam sebagai
berikut.
No.
Senyawa
K
a1.
HA
1,8 x 10
-42.
HB
1,8 x 10
-53.
HC
6,7 x 10
-54.
HD
3,4 x 10
-65.
HE
7,2 x 10
-8Dari data tersebut, asam yang paling kuat adalah . . . . A. HA B. HB C. HC D. HD E. HE
14
E-book ini hanya untuk kalangan sendiri tidak untuk dijualbelikan 94. Larutan asam klorida dengan pH = 1 akanberubah menjadi pH = 2 jika diencerkan sebanyak . . . . A. 1 kali B. 2 kali C. 5 kali D. 10 kali E. 20 kali
95. Larutan Ch3COOh 0,01 M yang terionisasi
dengan derajat ionisasi 𝛼 = 0,01 memilik pH sebesar . . . . A. 1 B. 2 C. 3 D. 4 E. 5
96. Sebanyak 3,4 gram NH3 (Mr = 17) dilarutkan
dalam air hingga volumenya 400 mL. Jika Kb
NH4OH = 1,8 x 10-5, pH larutan tersebut adalah .
. . . A. 3 – log 3 B. 3 + log 3 C. 11 – log 3 D. 11 E. 11 + log 3
97. Jika 100 mL larutan HCl 0,1 M diutambah sebanyak 400 mL , perubahan pH larutan setelah diencerkan adalah dari . .
A. 1 menjadi 2-log 2
B. 1 menjadi 2 C. 1 menjadi 2 + log 2 D. 2 menjadi 2 + log 2 E. 2 menjadi 3
98. Molaritas larutan asam sulfat yang memiliki pH = 2 adalah . . . . A. 0,001 M B. 0,005 M C. 0,05 M D. 0,01 M E. 0,5 M
99. Larutan HA 0,1 M terionisasi sebesar 1%, nilai tetapan ionisasi asam HA adalah . . . .
A. 1 X 10-6
B. 1 X 10-5
C. 2 X 10-5
D. 1 X 10-4
E. 2 X 10-4
100. konsentrasi ion H+ yang terdapat dalam 100 mL
larutan HCOOH 0,05 M dengan Ka = 2 x 10 -5
adalah. . . . A. 1 X 10-6 M B. 1 X 10-5 M C. 1 X 10-4 M D. 1 X 10-3 M E. 1 X 10-2 M