PERCOBAAN II
Judul : TITRASI ASAM BASA CARA POTENSIOMETRI
Tujuan : 1. Menstandarisasi larutan NaOH 2. Menggambarkan kurva titrasi
3. Menentukan tetapan kesetimbangan asam lemah.
Hari/ Tanggal : Sabtu/ 25 Oktober dan 1 November 2008
Tempat : Laboratorium Kimia FKIP UNLAM Banjarmasin
I. DASAR TEORI
a. Titrasi Asam-Basa Menggunakan Indikator
Titrasi ini berdasarkan reaksi netralisasi asam dengan basa, pada titik ekivalen (sama tepat/sesuai) dengan jumlah basa yang dipakai. Untuk mementukan titik ekivalen ini biasanya suatu indikator asam basa, yaitu suatu zat yang mempunyai warna tertentu pada pH tertentu. Jenis indikator yang kita pilih harus sedemikian sehingga pH pada titik ekivalen titrasi terdapat pada daerah perubahan warna, maka titik akhir telah tercapai.
Jadi, titik akhir titrasi adalah dimana saat timbul perubahan warna indikator yang dipakai. Titik akhir tidak selalu berimpit dengan titik ekivalen dan selisihnya disebut kurva titasi.
Pada umumnya indikator yang sering digunakan adalah indikator fenolfthalien (pp), bromhmol biru (BTB), dan lakmus.
b. Titrasi Asam-Basa Menggunakan pH meter
Titrasi adalah analisis dengan mengukur jumlah larutan yang diperlukan untuk bereaksi tepat sama dengan larutan lain. Titrasi ini digunakan pada reaksi netralisasi asam dengan basa pada titik ekivalen (sama tepat atau sesuai).
Cara titrasi yaitu dengan menambahkan setetes demi setetes larutan basa kepada larutan asam. Setiap basa yang diteteskan bereaksi dengan asam dan penetesan dihentikan pada saat jumlah mol H+ setara dengan jumlah mol OH-.
Pada saat itulah, larutan bersifat netral dan disebut titik ekivalen.
Larutan basa yang akan diteteskan (titran) dimasukkan ke dalam buret (pipa panjang berskala) dan jumlah yang terpakai dapat diketahui dari tinggi sebelum dan sesudah titrasi. Larutan asam yang akan dititrasi dimasukkan dalam erlenmeyer dengan mengukur volumenya terlebih dahulu. Untuk mengamati titik ekivalen digunakan indikator yang perubahan warnanya disekitar titik ekivalen. Saat terjadi perubahan warna itu disebut titik akhir titrasi.
Larutan yang digunakan pada titrasi ini adalah asam klorida (HCl) atau asam asetatat (CH3COOH) dengan indikator untuk menitrasi asam-basa
ditentukan dari kurva titrasi yang menunjukkan hubungan antara pH larutan dengan volume titran. Kurva ini dapat dibuat secara teoritis dengan menghitung pH larutan asam pada :
1. Titik awal sebelum penambahan
2. Titik-titik setelah ditambahkan basa sehingga larutan mengandung garam yang terbentuk dan kelebihan asam
3. Titik ekivalen, yaitu saat larutan mengandung garam tanpa ada kelebihan asam atau basa
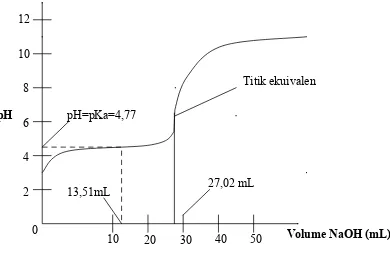
Berikut ini adalah contoh kurva titrasi asam asetat dengan larutan NaOH 0,101 M tertera pada sebagai berikut :
Gambar 1. kurva titrasi asam-basa antara larutan asam asetat dengan larutan NaOH 0,101 M. Titik ekivalen tercapai setelah penambahan 27,02 mL NaOH.
Titik ekivalen tercapai setelah penambahan NaOH 27,2 mL. Dari kurva titrasi didapat data untuk menghitung tetapan ionisasi asam asetat melalui persamaan Henderson-Hasselbalch.
pH = pKa + log [[asambasa]]
Persamaan ini digunakan untuk menghitung harga pH dari larutan buffer. Cara ini dapat digunakan untuk menghitung pH pada setiap titik dari kurva titrasi.
Harga pH pada kurva terlihat dari mulai harga pH sebelum penambahan NaOH sampai pada lewat titik ekuivalen. Dengan menggunakan persamaan di atas kita bisa menghitung harga Ka. Selama titrasi, konsentrasi asam akan menurun karena asam lemah bereaksi dengan NaOH yang ditambahkan. Kualitas asam dan basa akan sama pada titik tertentu; keasaman juga akan terjadi pada ½ titik ekuivalen. Pada titik pertengahan, jumlah ½ NaOH yang diperlukan bereaksi
12
10
8
6
4
2
0
10 20 30 40 50 Volume NaOH (mL)
pH
Titik ekuivalen
pH=pKa=4,77
sempurna dengan ½ jumlah asam lemah. Kuantitas NaOH pada titik pertengahan adalah : 27,02/ 2 = 13,51 mL. Pada saat ini konsentrasi asam sama dengan konsentrasi basa sesuai dengan persamaan berikut :
[asam] = [basa]
asam log1 0 basa
log
Menurut persamaan Henderson-Hasselbalch. pH = pKa, maka pKa dapat ditentukan.
II. ALAT DAN BAHAN Alat yang digunakan :
1. Gelas kimia : 2 buah
2. Pengaduk : 1 buah
3. Labu pengenceran 50 ml :1 buah
4. pH meter :1 buah
5. Gelas ukur 10 ml dan 50 ml : 3 buah
6. Termolyn : 1 buah
7. Erlenmeyer : 1 buah
8. Corong :1 buah
9. Pipet tetes : 4 buah
10. Botol zat gelap : 1 buah
11. Stirer : 1 buah
12. Buret 50 mL : 1 buah
13. Statif + klem : 1 buah
Bahan yang digunakan :
1. Kalium hidrogen ftalat 0,5 M 2. NaOH standar 0,1 M
5. Akuades melarutkan dengan air suling dan mengencerkan dalam labu ukur 250 mL sampai tanda tera. Memipet cairan ini sebanyak 50 mL dan memasukkan kedalam botol zat.
3. Membuat larutan NaOH yang akan distandarisasi (sekitar 0,1 M) dan memasukkan ke dalam buret
4. Menitrasi asam asetat 0,1 M dengan NaOH standar. Mencatat pH yang terbaca pada skala pH sebelum penambahan NaOH dan setelah penambahan larutan NaOH sebanyak 10, 20, 30, 35, 40, 45, 46, 47, 48, 49, 50, 51, 52, 55 dan 60 mL.
5. Membuat kurva titrasi, yakni plot antara pH dengan mL NaOH yang ditambahkan.
6. Menentukan harga Ka dari asam asetat yang dianalisis 7. Mengulangi percobaan sekali lagi, mulai dari no. 2.
IV. DATA PENGAMATAN
50 mL CH3COOH dititrasi dengan
NaOH + indikator PP
50 mL KHP 0,1 M
3. sampai volum 50 mL dalam labu pengenceran
10.
Pada perlakuan pertama yaitu melakukan pengenceran terhadap 10 mL KHP 0,5 M menjadi 50 mL KHP 0,1 M dengan menambahkan akuades sebanyak 40 mL. Reaksinya :
KHC8H4O4(aq) + H2O(l) → KHC8H4O4(aq)
KHC8H4O4 (disingkat KHP) adalah standar utama yang bagus sekali untuk larutan
basa. Jadi, apabila ingin membuat suatu larutan asam ataupun basa dengan konsentrasi yang diinginkan, maka untuk mengetahui konsentrasi yang sebenarnya, dilakukan standarisasi larutan dengan standar utama, contohnya KHP. Senyawa ini stabil saat pengeringan, non-higroskopis, dan mempunyai berat ekivalen yang tinggi (204,2 g/eq) sehingga dapat meminimalkan kesalahan saat penimbangan. Dari titrasi ini, diperoleh konsentrasi NaOH sebenarnya yaiu sebesar 0,25 M. Reaksinya :
KHC8H4O4(aq) + NaOH(aq) → KNaC8H4O4(aq) + HsO(l)
Tidak sesuainya harga konsentrasi NaOH dengan yang tertera pada label (0,1 M), mungkin disebabkan larutan natrium hidroksida (NaOH) selalu terkontaminasi oleh sejumlah kecil pengotor contohnya natrium karbonat. Ketika CO2 diserap oleh larutan NaOH dengan reaksi :
CO2 + 2OH- → CO32- + H2O
Ion karbonat adalah basa, tetapi ion ini bergabung dengan ion hidrogen dalam dua tahap
CO32- + H3O+ → HCO3- + H2O
HCO3- + H3O+ → H2CO3 + H2O
Jika fenolftalein digunakan sebagai indikator, perubahan warna terjadi bila reaksi sempurna yakni ion karbonat telah bereaksi dengan satu ion H3O+. ini
mengakibatkan galat, karena dua ion OH- digunakan dalam pembentukan satu
CO32-.
Kemudian menitrasi 50 mL CH3COOH 0,1 M dengan larutan standar
NaOH yang telah diketahui konsentrasinya hasil titrasi dengan standar utama KHP yaitu sebesar 0,25 M. Dari hasil percobaan titik akhir titrasi terjadi pada saat penambahan NaOH sebanyak 44,1 mL dan 45,4 mL, sehingga didapat volum NaOH rata-rata yang diperlukan dalam titrasi ini adalah sebesar 44,75 mL. melalui perhitungan diperoleh bahwa konsentrasi asam asetat sebesar 0,224 M. pada titrasi ini, terjadi reaksi :
Penambahan indikator fenolftalein (PP) dalam larutan asam asetat sebelum ditambahkan NaOH berfungsi untuk mengetahui titik akhir titrasi yang mana ditandai dengan terjadinya perubahan warna yakni dari larutan yang awalnya bening berubah menjadi warna merah muda.
Ketidaksesuaian konsentrasi CH3COOH hasil perhitungan dengan yang
tertera pada label mungkin disebabkan terjadinya kesalahan sewaktu menitrasi, yakni kekurangcermatan dalam melakukan titrasi ataupun kekurangcermatan dalam mengamati skala pada buret ataupun terjadi kesalahan dalam pembuatan asam asetat dengan konsentrasi 0,1 M.
Pada tahap berikutnya menitrasi 50 mL HCl 0,1 M dengan larutan NaOH 0,25 M. Dari percobaan, terjadinya perubahan warna pada larutan yang menandakan bahwa titik akhir titrasi telah tercapai yaitu pada saat volum NaOH yang digunakan sebesar 50 mL dan 49,2 mL, sehingga dapat ditentukan konsentrasi HCl sebenarnya yaitu sebesar 0,248 M. Adapun reaksi yang terjadi adalah sebagai berikut :
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)
Terjadinya perbedaan harga M HCl hasil perhitungan yang lebih besar daripada yang tercantum pada label yakni 0,1 M, mungkin dikarenakan terjadinya galat yakni terkontaminasinya zat yang digunakan oleh pengotor, terjadinya galat pada indikator, kesalahan sewaktu menitrasi ataupun kesalahan ketika proses pembuatan larutan HCl 0,1 M.
Berikutnya menitrasi asam asetat 0,224 M dengan NaOH 0,25 M dan mengukur pH-nya dengan menggunakan pH-meter. Selain itu, sebagai pembandingnya, dicari harga pH hasil titrasi CH3COOH dengan NaOH melalui
Kurva Titrasi Asam Asetat dan NaOH dengan pH meter
2.91
11.32
0 2 4 6 8 10 12
0 10 20 30 40 50 60 70
V NaOH (mL)
p
H
Kurva Titrasi Asam Asetat dengan NaOH Hasil Perhitungan
12.51
2.69
0 2 4 6 8 10 12 14
0 10 20 30 40 50 60 70
V NaOH (mL)
p
H
Berikut kurva titrasi CH3COOH dan NaOH dengan pH meter :
Sedangkan kurva titrasi CH3COOH dan NaOH hasil perhitungan adalah:
Dari kurva titrasi tersebut, terdapat harga pH awal CH3COOH yang tidak
Lalu dilakukan penambahan NaOH dan mengaduk larutan dengan menggunakan alat stirrer. Pengadukan ini berfungsi agar larutan basa yang ditambahkan dalam larutan asam dapat bercampur seluruhnya dengan sempurna sehingga seluruh partikel zat akan bereaksi dengan sempurna.
Sedangkan reaksi ion asam asetat mula-mula adalah : CH3COOH(aq) + H2O(aq) CH3COO-(aq) + H3O+(l)
Adapun persamaan reaksinya :
CH3COOH(aq) + NaOH(aq) → CH3COONa(aq) + H2O(l)
Pada penambahan NaOH selanjutnya harga pH yang dihasilkan melalui perhitungan maupun pHmeter tidak terlalu jauh berbeda. Namun, dari hasil perhitungan pada saat penambahan NaOH 4,5 mL, pH sudah meningkat secara tajam (10,72). Ini berbeda dengan pH yang ditunjukkan melalui pHmeter, dimana ketika penambahan NaOH sebanyak 55 mL, baru pH-nya meningkat secara tajam (10,5). Meningkatnya pH secara tajam menunjkkan bahwa larutan asam asetat yang bersifat asam lemah telah habis bereaksi dengan NaOH yang merupakan basa kuat, dan karena mol NaOH yang tersisa maka larutan pun akan bersifat basa sehingga harga pH-nya tinggi. Hal ini menyatakan bahwa lartan telah lewat titik ekivalen.
Pada awal-awal penambahan NaOH sebelum titik ekivalen, perubahan harga pH tidak terlalu berbeda secara signifikan. Hal ini dikarenakan terbentuknya larutan penyangga (buffer) sebab dengan penambahan mol NaOH yang lebih sedikit daripada CH3COOH sehingga NaOH akan habis bereaksi dan yang tersisa
adalah CH3COOH dan garamnya yakni CH3COONa sehingga akan menghasilkan
suatu larutan buffer.
Saat titik ekivalen, mol CH3COOH dan mol NaOH tepat habis bereaksi
sehingga yang tersisa adalah garamnya (CH3COONa) dan air. Karena garam ini
terbentuk dari asam lemah (CH3COOH) dengan basa kuat (NaOH) maka garam
Kurva Titrasi HCl dan NaOH dengan pH meter
1.2
12.03
0 2 4 6 8 10 12 14
0 10 20 30 40 50 60 70
V NaOH (mL)
p
H
7, karena sifat asam asetat yang lemah keasamannya dan NaOH yang tergolong basa kuat sehingga akan menghasilkan larutan yang bersifat basa.
Larutan yang dititrasi dengan NaOH berikutnya adalah HCl dan juga diukur pH-nya dengan menggunakan pHmeter. Dari hasil percobaan dengan menggunakan pHmeter, pH awal HCl adalah 1,20, sedangkan melalui perhitungan pH-nya sebesar 0,665, dengan persamaan reaksi ion :
HCl(aq) + H2O(l) H3O+ + Cl-(aq)
Kurva Titrasi HCl dengan NaOH Hasil Perhitungan
13.015
0.605 0 2 4 6 8 10 12 14
0 10 20 30 40 50 60 70
V NaOH (mL)
p
H
Kurva titrasi HCl dan NaOH hasil perhitungan, yaitu:
Terjadinya perbedaan harga pH awal HCl yang didapat melalui perhitungan dengan pHmeter mungkin disebabkan adanya kontaminasi pada zat yang digunakan oleh pengotor sehingga terjadi galat sewaktu pengukuran.
Pada penambahan NaOH sebelum titik ekivalen, pH HCl hasil perhitungan lebih rendah daripada pH HCl melalui pHmeter. Hal ini mungkin disebabkan adalanya pengotor dalam zat sehingga mempengaruhi hasil pengukuran dan menimbulkan galat.
Ketika titrasi mencapai titik ekivalen, dimana jumlah mol HCl tepat habis bereaksi dengan mol NaOH, yaitu pada saat volum NaOH yang ditambahkan adalah sebesar 24,8 mL dengan pH = 7. Ketika mol HCl yang merupakan asam kuat dan mol NaOH (basa kuat) tepat habis bereaksi maka akan mmbentuk garam NaCL dan air. Namun, karena garam ini berasal dari campuran asam kuat (HCl) dengan basa kuat (NaOH) maka garam ini tidak mengalami hidrolisis sehingga pH-nya akan sama dengan air yakni 7. Adapun persamaan reaksi yang terjadi adalah sebagai berikut :
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(aq)
menunjukkan bahwa adanya kemiripan antara konsentrasi HCl nyata dengan konsentrasi HCl hasil perhitungan.
Secara garis besar, dapat dikatakan bahwa harga pH hasil perhitungan maupun harga pH yang didapat melalui pengukuran dengan menggunakan pHmeter tidak terlalu jauh berbeda. Hanya saja, nilai pH hasil perhitungan biasanya lebih besar sedikit daripada hasil pengukuran pHmeter. Dan hal ini menunjukkan bahwa penentuan harga pH melalui metode potensiometri dengan menggunakan pHmeter memiliki keakuratan yang cukup tinggi karena harga pH tidak terlalu berbeda dengan perhitungan.
VI. KESIMPULAN
1. Dari hasil percobaan dan dihitung didapat bahwa harga konsentrasi CH3COOH adalah sebesar 0,224 M, M HCl = 0,248 M dan M NaOH
= 0,25 M.
2. Penambahan indikator fenolftalein (PP) digunakan untuk mengetahui titik akhir titrasi yang ditandai dengan terjadinya perubahan warna pada larutan yang berwarna bening pada mulanya menjadi berwarna merah muda.
3. Beberapa cara untuk mengetahui harga pH hasil titrasi bisa melalui perhitangan maupun dengan penggukuran menggunakan pHmeter. 4. Untuk mengetahui konsentrasi suatu larutan bisa dengan cara titrasi
menggunakan larutan standar misalnya KHP ataupun NaOH.
5. Baik dari hasil perhitungan maupun pengukuran dengan pHmeter, kurva titrasi HCl dan NaOH tidak terlalu jauh berbeda, sedangkan kurva titrasi CH3COOH dan NaOH terdapat sedikit perbedaan yaitu
VII. DAFTAR PUSTAKA
Achmad, Hiskia. 1996. Kimia Larutan. Citra Aditya Bakti, Bandung. Achmad, Hiskia. 1993. Penuntun Dasar – Dasar Praktikum Kimia.
Bandung : Depdikbud
Anshori, Irfan dan Hiskia Achmad. 1997. Kimia SMU 1. Erlangga, Jakarta. Day, R. A dan A. L. Underwood. 2002. Analisis Kimia Kuantitatif Edisi
Keenam. Penerjemah Iis Sopyan. Erlangga, Jakarta.
Rivai, Harrizul. 1994. Asas Pemeriksaan Kimia. UI-Press, Jakarta. Sholahuddin, Arif, Bambang Suharto dan Abdul Hamid. 2007. Panduan
Praktikum Kimia Analisis. FKIP UNLAM, Banjarmasin.
LAMPIRAN
Perhitungan :
1. Menentukan Konsentrasi NaOH Diketahui : Massa KHP = 0,1 M
Volume KHP = 50 mL = 0,05 L V NaOH 1 = 19 ml
V NaOH 2 = 20,7 ml
Ditanya : V NaOH rata – rata = …? M NaOH = ...?
Penyelesaian :
V NaOH rata – rata = 2
V V1 2
=
2 ml ) 7 , 20 19
(
= 39,72ml
= 19,85 ml M NaOH
(m.V) KHP = (M.V) NaOH
0,1 M. 50 ml = M NaOH . 19,85 ml M NaOH = 0,25 M
2. Menentukan Konsentrasi asam asetat Diketahui : M NaOH = 0,25 M
V CH3COOH = 50 mL
M HCl
(m.V) HCl = (M.V) HCl
M HCl. 50 ml = 0,25 M . 49,6 ml M HCl H = 0,248 M
Titrasi CH3COOH dengan NaOH - pH CH3COOH mula – mula
M CH3COOH = 0,224 M
Ka CH3COOH = 1,8 x 10-5
[H+] = Ka.M = 1,8.105.0,224 = 4,032.106 = 2,008.10-3 M
pH = - log [H+] = -log [2,008.10-3] = 2,69
- pH setelah penambahan 10 ml NaOH 0,25 M n CH3COOH = 50 ml. 0,224 M = 11,2 mmol
- pH setelah penambahan 20 ml NaOH 0,25 M n CH3COOH = 20 ml. 0,25 M = 11,2 mmol
n NaOH = 10 ml. 0,25 M = 2,5 mmol
Awal : 11,2 mmol 5 mmol -
-- pH setelah penambahan 30 ml NaOH 0,25 M n CH3COOH = 20 ml. 0,25 M = 11,2 mmol
V tot = V CH3COOH + V NaOH = (50 + 35)ml = 85 ml
- pH setelah penambahan 40 ml NaOH 0,25 M n CH3COOH = 20 ml. 0,25 M = 11,2 mmol
V tot = V CH3COOH + V NaOH = (50 + 44,8)ml = 94,8 ml
- pH setelah penambahan 45ml NaOH 0,25 M n CH3COOH = 20 ml. 0,25 M = 11,2 mmol
[OH-]=
ml 96
mmol 3 , 0
= 3,125. 10-3 M
pOH = -log [OH-] = - log [3,125. 10-3] = 2,5
pH = pKw =pOH = 14 – 2,5 = 11,5
- pH setelah penambahan 47 ml NaOH 0,25 M n CH3COOH = 20 ml. 0,25 M = 11,2 mmol
n NaOH = 47 ml. 0,25 M =11,75 mmol
CH3COOH + NaOH → CH3COONa + H2O
Awal : 11,2 mmol 11,75mmol -
-Reaksi : 11,2 mmol 11,2 mmol 11,75 mmol 11,75 mmol Akhir : - 0,55 mmol 11,75 mmol 11,75 mmol V tot = V CH3COOH + V NaOH = (50 + 47)ml = 97 ml
[OH-]=
ml 97
mmol 55 , 0
= 5,67. 10-3 M
pOH = -log [OH-] = - log [5,67. 10-3] = 2,25
pH = pKw =pOH = 14 – 2,25 = 11,75
- pH setelah penambahan 48 ml NaOH 0,25 M n CH3COOH = 20 ml. 0,25 M = 11,2 mmol
n NaOH = 48 ml. 0,25 M =12 mmol
CH3COOH + NaOH → CH3COONa + H2O
Awal : 11,2 mmol 12 mmol - -Reaksi : 11,2mmol 11,2mmol 12 mmol 12 mmol Akhir : - 0,8 mmol 12 mmol 12 mmol
[OH-]=
ml 98
mmol 8 , 0
= 8,16. 10-3 M
pOH = -log [OH-] = - log [8,16. 10-3] = 2,088
pH = pKw =pOH = 14 – 2,088 = 11,912
- pH setelah penambahan 49 ml NaOH 0,25 M n CH3COOH = 20 ml. 0,25 M = 11,2 mmol
n NaOH = 49 ml. 0,25 M =12,25 mmol
CH3COOH + NaOH → CH3COONa + H2O
Awal : 11,2 mmol 12,25mmol - -Reaksi : 11,2 mmol 11,2 mmol 12,25 mmol 12,25 mmol Akhir : - 1,05 mmol 12,25 mmol 12,25 mmol
V tot = V CH3COOH + V NaOH = (50 + 49)ml = 99 ml
[OH-]=
ml 99
mmol 05
, 1
= 1,06. 10-2 M
pOH = -log [OH-] = - log [1,06. 10-2] = 1,97
pH = pKw =pOH = 14 – 2,088 = 12,03
- pH setelah penambahan 50 ml NaOH 0,25 M n CH3COOH = 20 ml. 0,25 M = 11,2 mmol
n NaOH = 50 ml. 0,25 M =12,5 mmol
CH3COOH + NaOH → CH3COONa + H2O
Awal : 11,2 mmol 12,5 mmol - -Reaksi : 11,2mmol 11,2mmol 12,5 mmol 12,5 mmol Akhir : - 1,3 mmol 12,5 mmol 12,5 mmol
[OH-]=
ml 100
mmol 3 , 1
= 0,013 M
pOH = -log [OH-] = - log [0,013] = 1,886
pH = pKw =pOH = 14 – 1,886 = 12,114
- pH setelah penambahan 51 ml NaOH 0,25 M M CH3COOH = 0,224 M
n CH3COOH = 51 ml. 0,224 M =11,424 mmol
n NaOH = 51 ml. 0,25 M = 12,75 mmol
CH3COOH + NaOH → CH3COONa + H2O
Awal : 11,424 mmol 12,75 mmol -
-Reaksi : 11,424 mmol 11,424mmol 11,424 mmol 11,424 mmol Akhir : - 1,326 mmol 11,424 mmol 11,424 mmol
V tot = V CH3COOH + V NaOH = (51 + 51)ml = 102 ml
[OH-]=
ml 102
mmol 326
, 1
= 0,013 M
pOH = -log [OH-] = - log [0,013] = 1,886
pH = pKw =pOH = 14 – 1,886 = 12,114
- pH setelah penambahan 52 ml NaOH 0,25 M n CH3COOH = 11,424 mmol
n NaOH = 52 ml. 0,25 M = 13 mmol
CH3COOH + NaOH → CH3COONa + H2O
Awal : 11,424 mmol 13 mmol -
-Reaksi : 11,424 mmol 11,424 mmol 11,424 mmol 11,424 mmol Akhir : - 1,576 mmol 11,424 mmol 11,424 mmol
[OH-]=
ml 103
mmol 576
, 1
= 0,0153 M
pOH = -log [OH-] = - log [0,0153] = 1,8
pH = pKw =pOH = 14 – 1,8 = 12,2
- pH setelah penambahan 55 ml NaOH 0,25 M n CH3COOH = 11,424 mmol
n NaOH = 55 ml. 0,25 M = 13,75 mmol
CH3COOH + NaOH → CH3COONa + H2O
Awal : 11,424 mmol 13,75 mmol -
-Reaksi : 11,424 mmol 11,424mmol 11,424 mmol 11,424 mmol Akhir : - 2,326 mmol 11,424 mmol 11,424 5mmol
V tot = V CH3COOH + V NaOH = (51 + 55)ml = 106 ml
[OH-]=
ml 106
mmol 326 , 2
= 0,0219M
pOH = -log [OH-] = - log [0,0219] = 1,66
pH = pKw =pOH = 14 – 1,66 = 12,34
- pH setelah penambahan 60 ml NaOH 0,25 M n CH3COOH = 11,424 mmol
n NaOH =60 ml. 0,25 M = 15 mmol
CH3COOH + NaOH → CH3COONa + H2O
Awal : 11,424 mmol 15 mmol -
-Reaksi : 11,424 mmol 11,424mmol 11,424 mmol 11,424 mmol Akhir : - 3,576 mmol 11,424 mmol 11,424 mmol
Kurva Titrasi Asam Asetat dengan NaOH Hasil Perhitungan
Kurva Titrasi Asam Asetat dan NaOH dengan pH meter
2.91
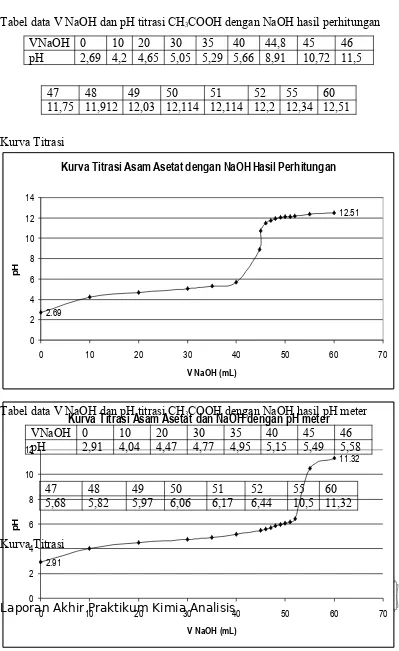
Tabel data V NaOH dan pH titrasi CH3COOH dengan NaOH hasil perhitungan
VNaOH 0 10 20 30 35 40 44,8 45 46
pH 2,69 4,2 4,65 5,05 5,29 5,66 8,91 10,72 11,5
47 48 49 50 51 52 55 60
11,75 11,912 12,03 12,114 12,114 12,2 12,34 12,51
Kurva Titrasi
Tabel data V NaOH dan pH titrasi CH3COOH dengan NaOH hasil pH meter
VNaOH 0 10 20 30 35 40 45 46
pH 2,91 4,04 4,47 4,77 4,95 5,15 5,49 5,58
Kurva Titrasi
47 48 49 50 51 52 55 60
Titrasi HCl dan NaOH
- pH HCl sebelum penambahan NaOH M HCl = 0,248 M
pH = - log [H+] = - log (0,248) = 0,605
- pH setelah penambahan 10 ml NaOH 0,25 M n HCl = 25 ml . 0,248 M = 6,2 mmol
n NaOH = 10 ml . 0,25 M = 2,5 mmol
HCl + NaOH → NaCl + H2O
Awal : 6,2 mmol 2,5 mmol -
-Reaksi : 2,5 mmol 2,5 mmol 2,5 mmol 2,5 mmol Akhir : 3,7 mmol - 2,5 mmol 2,5mmol
V tot = V HCl + V NaOH = (25 + 10)ml = 35 ml
[H+]=
ml 35
mmol 7 , 3
pH = -log [H+] = - log [0,1057] = 0,97
- pH setelah penambahan 10 ml NaOH 0,25 M n HCl = 25 ml . 0,248 M = 6,2 mmol
n NaOH = 20 ml . 0,25 M = 5 mmol
HCl + NaOH → NaCl + H2O
Awal : 6,2 mmol 5 mmol -
-Reaksi : 5 mmol 5 mmol 5 mmol 5 mmol Akhir : 1,2 mmol - 5 mmol 5 mmol
V tot = V HCl + V NaOH = (25 + 20)ml = 45 ml
[H+]=
ml 45
mmol 2
. 1
= 0,026 M
pH = -log [H+] = - log [0,026] = 1,574
- pH setelah penambahan 24,8 ml NaOH 0,25 M n HCl = 25 ml . 0,248 M = 6,2 mmol
n NaOH = 24,8ml . 0,25 M = 6,2 mmol
HCl + NaOH → NaCl + H2O
Awal : 6,2 mmol 6,2 mmol -
-Reaksi : 6,2 mmol 6,2 mmol 6,2 mmol 6,2 mmol Akhir : - - 6,2 mmol 6,2 mmol
- pH setelah penambahan 30 ml NaOH 0,25 M n HCl = 25 ml . 0,248 M = 6,2 mmol
n NaOH = 30 ml . 0,25 M = 7,5 mmol
HCl + NaOH → NaCl + H2O
Awal : 6,2 mmol 7,5 mmol -
-Reaksi : 6,2 mmol 6,2 mmol 6,2 mmol 6,2 mmol Akhir : - 1,3 mmol 6,2 mmol 6,2 mmol
V tot = V HCl + V NaOH = (25 + 30)ml = 55 ml
[OH-]=
ml 55
mmol 3
. 1
= 0,0236 M
pOH = -log [OH-] = - log [0,0236] = 1,63
pH = pKw – pOH = 14 – 1,63 = 12,37
- pH setelah penambahan 35 ml NaOH 0,25 M n HCl = 25 ml . 0,248 M = 6,2 mmol
n NaOH = 35 ml . 0,25 M = 8,75 mmol
HCl + NaOH → NaCl + H2O
Awal : 6,2 mmol 8,75 mmol -
-Reaksi : 6,2 mmol 6,2 mmol 6,2 mmol 6,2 mmol Akhir : - 2,25 mmol 6,2 mmol 6,2 mmol V tot = V HCl + V NaOH = (25 + 35)ml = 60 ml
[OH-]=
ml 60
mmol 25 , 2
= 0,0425 M
pOH = -log [OH-] = - log [0,0425] = 1,37
pH = pKw – pOH = 14 – 1,37 = 12,63
- pH setelah penambahan 40 ml NaOH 0,25 M n HCl = 25 ml . 0,248 M = 6,2 mmol
HCl + NaOH → NaCl + H2O
Awal : 6,2 mmol 10 mmol -
-Reaksi : 6,2 mmol 6,2 mmol 6,2 mmol 6,2 mmol Akhir : - 3,8 mmol 6,2 mmol 6,2 mmol
V tot = V HCl + V NaOH = (25 + 40)ml = 65 ml
[OH-]=
ml 65
mmol 8 , 3
= 0,058 M
pOH = -log [OH-] = - log [0,058] = 1,23
pH = pKw – pOH = 14 – 1,23 = 12,77
- pH setelah penambahan 45 ml NaOH 0,25 M n HCl = 25 ml . 0,248 M = 6,2 mmol
n NaOH = 45 ml . 0,25 M = 11,25 mmol
HCl + NaOH → NaCl + H2O
Awal : 6,2 mmol 11,25 mmol -
-Reaksi : 6,2 mmol 6,2 mmol 6,2 mmol 6,2 mmol Akhir : - 5,05 mmol 6,2 mmol 6,2 mmol
V tot = V HCl + V NaOH = (25 + 45)ml = 70 ml
[OH-]=
ml 70
mmol 05
, 5
= 0,072 M
pOH = -log [OH-] = - log [0,072] = 1,14
pH = pKw – pOH = 14 – 1,14 = 12,86
- pH setelah penambahan 46 ml NaOH 0,25 M n HCl = 25 ml . 0,248 M = 6,2 mmol
HCl + NaOH → NaCl + H2O
- pH setelah penambahan 47 ml NaOH 0,25 M n HCl = 25 ml . 0,248 M = 6,2 mmol
- pH setelah penambahan 48 ml NaOH 0,25 M n HCl = 25 ml . 0,248 M = 6,2 mmol
n NaOH = 48 ml . 0,25 M = 12 mmol
HCl + NaOH → NaCl + H2O
Awal : 6,2 mmol 12 mmol -
Akhir : - 5,8 mmol 6,2 mmol 6,2 mmol
V tot = V HCl + V NaOH = (25 + 48)ml = 73 ml
[OH-]=
ml 73
mmol 8
, 5
= 0,079 M
pOH = -log [OH-] = - log [0,079] = 1,09
pH = pKw – pOH = 14 – 1,09 = 12,91
- pH setelah penambahan 49 ml NaOH 0,25 M n HCl = 25 ml . 0,248 M = 6,2 mmol
n NaOH = 49 ml . 0,25 M = 12,25 mmol
HCl + NaOH → NaCl + H2O
Awal : 6,2 mmol 12,25 mmol -
-Reaksi : 6,2 mmol 6,2 mmol 6,2 mmol 6,2 mmol Akhir : - 6,05 mmol 6,2 mmol 6,2 mmol
V tot = V HCl + V NaOH = (25 + 49)ml = 74 ml
[OH-]=
ml 74
mmol 05
, 6
= 0,0817 M
pOH = -log [OH-] = - log [0,0817] = 1,087
pH = pKw – pOH = 14 – 1,087 = 12,913
- pH setelah penambahan 50 ml NaOH 0,25 M n HCl = 25 ml . 0,248 M = 6,2 mmol
n NaOH = 50 ml . 0,25 M = 12,5 mmol
HCl + NaOH → NaCl + H2O
Awal : 6,2 mmol 12,5 mmol -
V tot = V HCl + V NaOH = (25 + 50)ml = 75 ml
[OH-]=
ml 75
mmol 3 , 6
= 0,084 M
pOH = -log [OH-] = - log [0,084] = 1,075
pH = pKw – pOH = 14 – 1,075 = 12,925
- pH setelah penambahan 51 ml NaOH 0,25 M n HCl = 25 ml . 0,248 M = 6,2 mmol
n NaOH = 51 ml . 0,25 M = 12,75 mmol
HCl + NaOH → NaCl + H2O
Awal : 6,2 mmol 12,75 mmol -
-Reaksi : 6,2 mmol 6,2 mmol 6,2 mmol 6,2 mmol Akhir : - 6,55 mmol 6,2 mmol 6,2 mmol
V tot = V HCl + V NaOH = (25 + 51)ml = 76 ml
[OH-]=
ml 76
mmol 55 , 6
= 0,086 M
pOH = -log [OH-] = - log [0,086] = 1,064
pH = pKw – pOH = 14 – 1,064 = 12,94
- pH setelah penambahan 52 ml NaOH 0,25 M n HCl = 25 ml . 0,248 M = 6,2 mmol
n NaOH = 52 ml . 0,25 M = 13 mmol
HCl + NaOH → NaCl + H2O
Awal : 6,2 mmol 13 mmol -
-Reaksi : 6,2 mmol 6,2 mmol 6,2 mmol 6,2 mmol Akhir : - 6,8 mmol 6,2 mmol 6,2 mmol
[OH-]=
- pH setelah penambahan 55 ml NaOH 0,25 M n HCl = 25 ml . 0,248 M = 6,2 mmol
Kurva Titrasi HCl dengan NaOH Hasil Perhitungan
13.015
0.605 0 2 4 6 8 10 12 14
0 10 20 30 40 50 60 70
V NaOH (mL)
p
H
pH = pKw – pOH = 14 – 0,984 = 13,015
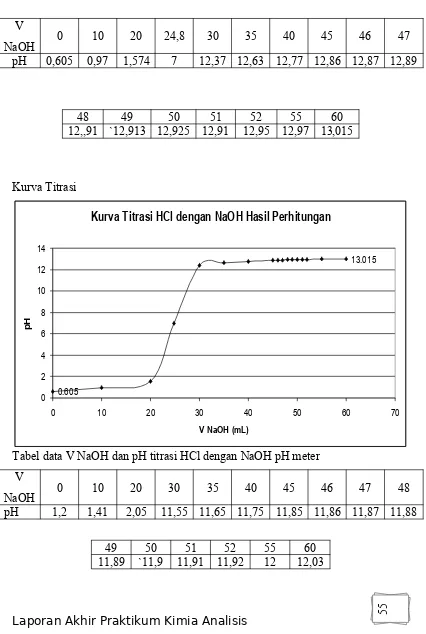
Tabel data V NaOH dan pH titrasi HCl dengan NaOH hasl perhitungan
V
NaOH 0 10 20 24,8 30 35 40 45 46 47
pH 0,605 0,97 1,574 7 12,37 12,63 12,77 12,86 12,87 12,89
48 49 50 51 52 55 60
12,,91 `12,913 12,925 12,91 12,95 12,97 13,015
Kurva Titrasi
Tabel data V NaOH dan pH titrasi HCl dengan NaOH pH meter V
NaOH 0 10 20 30 35 40 45 46 47 48
pH 1,2 1,41 2,05 11,55 11,65 11,75 11,85 11,86 11,87 11,88
49 50 51 52 55 60
Kurva Titrasi HCl dan NaOH dengan pH meter
1.2
12.03
0 2 4 6 8 10 12 14
0 10 20 30 40 50 60 70
V NaOH (mL)
p
H
Kurva Titrasi
Pertanyaan:
1. Jelaskan :
a. Larutan standar primer, larutan standar sekunder dan contohnya! b. Apa syarat zat dapat menjadi zat standar primer?
2. Pada titrasi netralisasi secara potensiometri perlukah menggunakan indikator, misalnya fenolftalein.
Jawaban Pertanyaan:
1. a. Larutan standar primer adalah larutan yang mempunyai konsentrasi yang mantap (tidak mudah berubah). Larutan standar primer dapat juga berarti larutan yang bersifat tidak higroskopik merupakan asam atau basa monoprotik lemah ataupun monoprotik kuat.
Contoh:
1. Senyawa Kalium hidrogen
ftalat (KHP), KHC8H4O4 untuk larutan basa, karena stabil terhadap
pemanasan, tidak higroskopik dan mempunyai bobot ekivalen yang tinggi 204,2 g/eq. Zat ini merupakan asam monoprotik lemah, namun karena larutan basa sering kali digunakan untuk menetapkan asam lemah, hal ini tidak merugikan. Dalam titrasi digunakan indikator PP dan larutan basa itu harus bebas karbonat.
2. Asam sulfamat, HSO3 NH3
merupakan asam monoprotik kuat dan baik indikator PP atau metil merah dapat digunakan dalam titrasi dengan basa kuat. Mudah diperoleh, tidak mahal dan mudah dimurnikan dengan pengkristalan ulang dari dalam air. Merupakan zat padat kristalin putih, tidak higroskopis dan stabil sampai temperatur 130oC. Bobot ekivalennya hanya 79,09 cukup lebih kecil
daripada KHP. Asam sulfamat mudah larut dalam air, dan kebanyakan garamnya mudah larut.
3. Senyawa kalium hidrogen
iodat, KH (SO3)2 merupakan monoprotik yang kuat yang digunakan
4. Asam sulfosalisilat, KHSa. K2Sa dengan Sa melambangkan anion bermuatan rangkap dan mempunyai
bobot molekul 550,655 dan pKa = 2,85. struktur molekulnya :
OH
COOH
SO3H
5. Natrium karbonat, Na2CO3 untuk larutan asam kuat. Bersifat agak
higroskopis, dapat dititrasi menjadi natrium bikarbonat NaHCO3 dengan
menggunakan indikator PP, bobot ekivalennya 106,0 g/ eq.
6. Basa organik tris (hidroksil metil) amino metana (CH2OH)3 CNH2, TRIS
atau THAM untuk larutan asam. Kemurniannya 99,95%. Bereaksi dengan asam korida, reaksinya adalah :
(CH2OH)3CNH2 + H2O (CH3OH)3CNH3 + H2O
Basa organik tris ini mempunyai bobot ekivalen 121,06 g/ eq.
- Larutan standar sekunder adalah suatu larutan asam dan basa ari konsentrasi yang kira – kira diinginkan dan kemudian menstandarisasikan salah satunyadengan sebuah standar primer. Larutan yang telah di standarisasikan dapat digunakan sebagai standar sekunder untuk mendapatkan konsentrasi dari larutan lainnya.
Contoh :
Zat yang digunakan untuk membuat larutan standar HCl (asam hidroklorida) adalah asam hidroklorida pekat yang mengandung kira – kira 36% blu HCl. Asam hidroklorida pekat ini bukanlah zat baku utama, karena itu mula – mula dibuat larutan standar asam hidroklorida dengan kepekatan kira – kira, kemudian dibakukan dengan zat baku utama, misalnya Na2CO3
b. Syarat menjadi zat standar primer
suatu tingkat kemurnian yang diketahui, pada suatu tingkat biaya yang logis. Zat – zat yang mempunyai kemurnian rendah (99,9%) sering digunakan sebagai zat baku dan disebut juga sebagai zat baku utama, tap ini sebenarnya istilah yang salah. Zat – zat baku yang mempunyai kemurnian rendah seperti itu disebut zat baku kerja. Secara umum, jumlah total dari pengotor tidak bolehlebih 0,01 sampai 0,02% dan terus dilakukan tes untuk mendeteksi kuantitas pengotor tersebut melalui tes kualitatif dengan sensitivitas yang diketahui.
2. Substansi harus stabil. Harus mudah dikeringkan dan tidak terlalu higrostopis sehingga tidak banyak menyerap air selama penimbangan. Substansi tersebut seharusnya tidak kehilangan berat bila ... udara... hidrat biasanya tidak dipergunakan sebagai standar primer.
3. Yang diinginkan adalah standar primer tersebut mempunyai berat ekivalen yang cukup tinggi agar dapat meminimalisasi konsekuensi galat pada saat penimbangan.
4. Zat itu harus bereaksi dengan zat yang ditentukan secara stoikiometri , tepat dan terukur.
c. Perbedaan titik akhir titrasi dan titik ekivalen
- Titik akhir titrasi adalah titik dimana pH pada saat indikator berubah warna.
- Titik ekivalen adalah titik dimana terjadi perubahan warna dan jumlah mol asam dengan jumlah mol basa adalah sama.
FLOWCHART
Larutan NaOH
Larutan NaOH 0,1 M
Membuat larutan standar NaOH sekitar 0,1 M Memasukkan ke dalam buret
5,1 g kalium hidrogen ftalat (KHP)
Menimbang dengan teliti
5,1 g (KHP) + H2O(l)*
Melarutkan dengan air suling dan mengencerkan dalam labu ukur 250 mL sampai tanda tera
Memipet cairan ini sebanyak 50 mL Memasukkan ke dalam gelas kimia
50 mL larutan KHP
Menambahkan indikator fenolftalein
Menitrasi dengan larutan standar NaOH 0,1 M
NB :
- sebelum prosedur tadi dilakukan, menyiapkan seperangkat alat pH meter yang telah dikalibrasi dengan buffer ber-pH 5
- mengulangi percobaan sekali lagi
* Reaksi yang terjadi adalah reaksi pelarutan : KHC8H4O4(s) + H2O(l) → KHC8H4O4(aq)
NB :
* Persamaan reaksi titrasi asam basa adalah:
CH3COOH(aq) + NaOH(aq) → CH3COONa(aq) + H2O(l)
- mengulangi percobaan sekali lagi dengan menggunakan HCl sebagai ganti CH3COOH
Asam asetat 0,1 M
Campuran *
Mencatat pH yang terbaca pada skala pH Menambahkan indikator PP
Menitrasi dengan NaOH standar
pH larutan
Mencatat pH yang terbaca pada skala pH setelah penambahan larutan NaOH 0,1 M sebanyak 10, 20, 30, 35, 40, 45, 46, 47, 48, 49, 50, 51, 52, 55, dan 60 mL.
Kurva Titrasi Asam Asetat dengan NaOH Hasil Perhitungan
12.51
2.69 2 4 6 8 10 12 14
p
H
Saran-Saran dari Asisten:
1. Berhati-hatilah dalam menuangkan asam atau basa, jangan sampai tertukar.
2. Pikirkanlah teknis praktikum, khususnya dalam menggunakan pH meter (hanya ada 1), sehingga semua peserta praktikum semuanya bisa mengoperasikan alat tersebut
Pertanyaan dan Jawaban Dalam Presentasi Final Praktikum
1. Penanya : Siti Armiyanti (Kelompok 2) Pertanyaan :
Kenapa harga Ka CH3COOH yang didapat sewaktu praktikum yaitu 1,73 x
10-9 berbeda dengan harga Ka CH
3COOH dari literatur yaitu 1 x 10-5? Jawaban :
Harga Ka CH3COOH yang didapat dari praktikum tidak menggunakan
Dari kurva tersebut dapat dicari Ka-nya dengan cara : menentukan volum NaOH yang digunakan ketika konsentrasi H+ tepat habis bereaksi dengan
konsentrasi OH- yaitu pada saat volum NaOH sebesar 44,8 mL. Selanjutnya
hitung ½ dari volum tersebut yaitu 22,4 mL. Lalu dari kurva titrasi dapat ditarik garis dari volum NaOH tadi (22,4 mL) dan kemudian ditarik garis melalui kurva untuk mendapatkan harga pH-nya, sehingga didapat harga pH sekitar 5. Dari pH tersebut, dapat ditentukan harga Ka-nya dengan cara menggunakan rumus :
pH = pKa sehingga harga pKa = 5 dan harga Ka-nya dapat dihitung yaitu pKa = -log Ka
5 = - log Ka Ka = 10-5
Dan harga ini sesuai dengan literatur, tetapi juga dalam perhitungan Ka harus diperhatikan faktor suhu ruangan ketika melakukan pengukuran karena harga Ka sangat dipengaruhi oleh suhu. Harga Ka dari literatur tersebut merupakan Ka CH3COOH yang diukur pada suhu ruangan 25oC. Jadi bisa
saja harga Ka CH3COOH yang didapat ketika praktikum berbeda dengan
literatur sebab sewaktu praktikum suhu ruangan tidak tepat 25oC.
Apa saja fungsi kurva titrasi, selain untuk menentukan harga Ka? Dalam menentuan harga pH lebih akurat mana antara melalui perhitungan dengan menggunakan pHmeter?
Jawaban :
Kurva titrasi selain digunakan untuk menentukan harga Ka juga memiliki banyak fungsi lain diantaranya untuk menunjukkan hubungan antara pH larutan dengan volume titran, menunjukkan titik awal sebelum penambahan, titik-titik setelah ditambahkan basa sehingga larutan mengandung garam yang terbentuk dan kelebihan asam, menunjukkan titik ekivalen yaitu saat larutan mengandung garam tanpa ada kelebihan asam atau basa, dan memperlihatkan daerah lewat ekivalen yaitu larutan mengandung garam dan kelebihan basa.