HASIL DAN PEMBAHASAN
Penumbuhan sel D. radiodurans dan Ekstraksi SOD
Bakteri D. radiodurans ditumbuhkan dalam media LB cair selama 48
jam dengan suhu 300
Rendemen yang dihasilkan lebih besar dibandingkan dengan hasil yang didapatkan oleh Trivadila (2011) dimana rendemen yang didapatkan adalah sebesar 0,07% dalam media yang sama. Tapi hasil yang didapat lebih kecil
dibandingkan dengan Mn-SOD yang dihasilkan dari udang Macrobrachium
nipponerse dimana ekstrak kasar yang dihasilkan adalah sebanyak 17100 mg (Yao et al. 2004). Seatovics et al. (2004) mendapatkan ekstrak kasar Mn-SOD
dari bakteri Thermotherix sp sebanyak 53 mg/17,5 mL. Dalam penelitian ini
bakteri Thermotherix sp diisolasi dari pemandian air hangat di Serbia kemudian dibiakkan dalam media nutrien broth (pepton 1,5%, meat extract 0,5%, NaCl 0,5 %, dan K
C. Setelah 48 jam bakteri dapat dipanen untuk mengambil enzim SOD. Sel bakteri dipecah untuk mengekstrak protein sitoplasma yang
mengandung enzim SOD dengan menggunakan ultrasonic homogenizer. Protein
yang terkestrak memiliki konsentrasi sebesar 3100 µg/ml. Rendemen ekstrak protein adalah 2,41% dari bobot basah (lampiran 2).
2HPO4 pH 7,2). Kecilnya rendemen ekstrak yang dihasilkan
dibandingkan dengan yang lain diduga karena D. radiodurans memiliki dinding sel yang lebih tebal dibandingkan dengan bakteri yang lain, selain itu bentuknya
yang tetrad dan besar menyebabkan sulit untuk memecah dinding sel D.
radiodurans dan mengekstrak sitoplasmanya (Trivadila 2011).
Pembuatan Elektroda
Elektroda rujukan adalah elektroda yang diketahui kestabilannya dan potensial setengah selnya, dan tidak sensitif terhadap analat yang diukur. Ada beberapa elektroda yang biasa digunakan sebagi elektroda rujukan yaitu Elektroda Hidrogen Standar (SHE), Elektroda Kalomel Jenuh (SCE), Elekroda Merkuri/Merkuri Sulfat dan Elektroda Ag/AgCl. Elektroda Ag/AgCl adalah elektroda yang terdiri dari logam perak yang dilapisi dengan perak klorida dalam larutan KCl jenuh. Elektroda Ag/AgCl dibuat dengan cara melakukan elektrolisis
terhadap kawat perak (Ag) dalam larutan NaCl 3M (Hattu 2009). Reaksi elektrokimia elektroda Ag/AgCl adalah sebagai berikut:
AgCl (s) + e- Ag(s) + Cl- ; E0
Pengukuran arus puncak K
= +0.222 V (3)
3
(4) [Fe(CN)6] dalam larutan elektrolit pendukung KCl 0,1 M menggunakan teknik voltametrik siklik yang dicantumkan dalam Lampiran 3 memperlihatkan bahwa arus puncak anodik pada potensial 315 dan arus puncak katodik diperoleh pada potensial 249 mV untuk elektroda komersil sedangkan untuk elektroda buatan adalah 320 dan 244 mV. Berdasarkan nilai potensial puncak anodik dan katodik, jumlah elektron (n) yang terlibat dalam reaksi dapat ditentukan dengan persamaan Nerst sebagai berikut:
dimana ΔEp = |Epa- Epa
Dari persamaan diatas maka jumlah elektron yang terlibat untuk elektroda komersil adalah :
| (5)
(6)
Jumlah elektron yang terlibat untuk elektroda buatan sendiri adalah
(7)
n yang didapat adalah 1 hal ini sesuai dengan nilai n pada reaksi oksidasi reduksi [Fe(CN)6]
3-Reaksi reduksi [Fe(CN)
yang hanya melibatkan satu elektron, seperti reaksi dibawah ini:
6]3- + e- [Fe(CN)6]
4-Reaksi Oksidasi [Fe(CN)
(8)
6]4- [Fe(CN)6]3- + e-
Berdasarkan perbandingan arus puncak anodik dan katodik yang diperoleh maka dapat juga ditentukan elektron yang terlibat
(9)
(10)
Dari hasil perhitungan nilai n untuk elektroda komersial dan buatan berturut-turut adalah 1.11 dan 1.27 ini mengidentifikasikan jika jumlah elektron yang terlibat bersesuain dengan nilai n pada oksidasi reduksi [Fe(CN)6]
3-Kualifikasi kinerja elektroda pembanding menggunakan sistem voltametri dengan menggunakan sistem elektrokimia yang sudah diketahui. Sistem
elektrokimia untuk (Fe(CN)6]3-/[Fe(CN)6]
4-[Fe(CN)
yang sudah diketahui adalah sebagai berikut: 6]3- + e- [Fe(CN)6]4- E0= 0,3610 Vvs E0ENH Maka nilai E (11) 0’ (12) adalah (13) vs Ag/AgCl (14)
Jika [KCl]= 3M dan E0Ag/AgCl = 0,222 V vs E0ENH maka E0’ untuk [Fe(CN)6]
3-/[Fe(CN)6]4- adalah 0,5014 V vs E0ENH maka E0
(15)
hasil percobaan adalah:
Dalam menentukan kekuatan ion, spesi yang memberikan sumbangan besar
adalah dan KCl. Sementara dianggap memberikan
sumbangan yang kecil, sehingga ≅ maka E0 ≅
(0,5014 V).
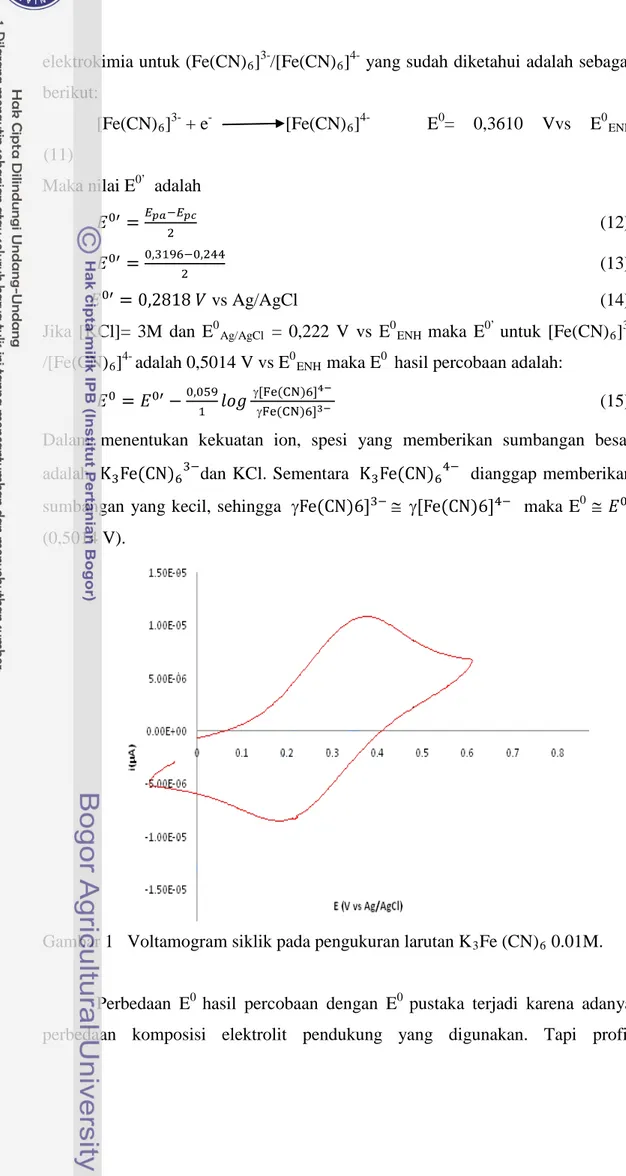
Gambar 1 Voltamogram siklik pada pengukuran larutan K3Fe (CN)6 0.01M.
Perbedaan E0 hasil percobaan dengan E0 pustaka terjadi karena adanya perbedaan komposisi elektrolit pendukung yang digunakan. Tapi profil
voltamogram yang ditunjukkan oleh Gambar 1, (Fe(CN)6]3-/[Fe(CN)6]4- dalam
KCl 0,1 M) menunjukkan hasil yang didapatkan tidak berbeda jauh dengan yang dihasilkan oleh Hattu (2009) dimana elektron yang terlibat adalah 0,9187 dan ∆Ep sebesar 59 mV dengan sistem Fe(CN)6]3-/[Fe(CN)6]4- dalam NaClO4 0,1 M.
Perbedaan yang dihasilkan kemungkinan disebabkan oleh adanya perbedaan komposisi elektrolit pendukung yang digunakan. Selain itu, hasil yang didapatkan juga tidak jauh berbeda dibandingkan dengan elektroda pembanding komersil dimana n yang terlibat 1,11 dan ∆E p sebesar 66 mV. Jumlah elektron yang
terlibat dalam penelitian ini adalah 1,27 ∆E p sebesar 75,6 mV berdasarkan hasil
yang diperoleh maka dapat dikatakan bahwa elektroda yang dibuat memiliki kriteria yang baik dan dapat digunakan untuk pengukuran selanjutnya.
Imobilisasi Enzim
Enzim memiliki selektivitas dan sensitivitas yang tinggi jika dalam kondisi normal, tapi sangat sensitive terdenaturasi oleh pH dan suhu yang ekstrem, pelarut organik dan deterjen (Takahashi et al. 2001). Untuk menjaga fungsi katalitik enzim pada kondisi ekstrem maka dilakukan imobilisasi pada permukaan material penyangga padat seperti nanokomposit zeolit.
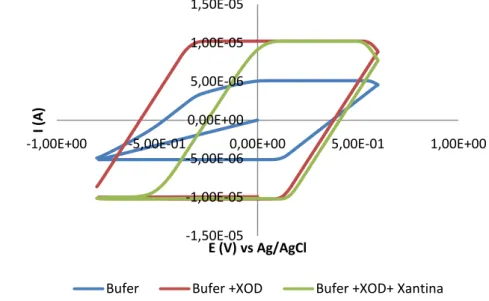
Selektivitas dan stabilitas suatu enzim terimobilisasi selain dipengaruhi oleh substrat juga dipengaruhi oleh metode immbolisasi dan material penyangga yang digunakan (Zhao et al. 2008). Oleh karena itu perlu dilakukan pemilihan metode imobilisasi yang tepat agar menghasilkan respon arus yang tinggi. Modifikasi metode imobilisasi yang dilakukan terdiri dari 4 jenis. yaitu SOD di imobilisasi dengan zeolit, kemudian diteteskan pada permukaan pasta karbon termodifikasi ferosena (SOD/Zeolit/PCf), SOD di imobilisasi pada permukaan pasta karbon termodifikasi ferosena (SOD/PCf), zeolit di imobilisasi pada permukaan pasta karbon termodifikasi ferosena (Zeolit/PCf) dan terakhir SOD di imobilisasi pada permukaan zeolit (SOD/Zeolit). Tabel 4 menunjukkan puncak arus dan potensial dari 4 modifikasi metode imobilisasi. Tabel 4 memperlihatkan bahwa SOD/Zeolit/PCf memiliki puncak arus anodik yang lebih tinggi dibandingkan dengan SOD/PCf, Zeolit/PCf dan SOD/Zeolit, dengan nilai berturut-berturut adalah 1,02, 0,054, 0,002 dan 0,0012 μA.
-4,00E-06 -3,00E-06 -2,00E-06 -1,00E-06 0,00E+00 1,00E-06 2,00E-06 3,00E-06 4,00E-06
-4,00E-01-2,00E-010,00E+00 2,00E-01 4,00E-01 6,00E-01 8,00E-01 1,00E+00I(
A)
E (V) vs Ag/AgCl
SZPf SPf SZ
Tabel 4 Puncak arus dan potensial modifikasi metode imobilisasi
Modifikasi Arus Puncak I(μA) E (mV) Vs Ag/AgCl) (mV)
Ipa Ipc Epa Epc
SOD/Zeolit/PCf 1.020 1.71 426 290
SOD/PCf 0.054 0.01 465 330
Zeolit/PCf 0.002 0.01 416 330
SOD/Zeolit 0.0012 0.00 -100 115
Gambar 2 menampilkan voltamogram siklik SOD/Zeolit/PCf, SOD/PCf dan SOD/Zeolit. Voltamogram siklik tersebut memperlihatkan puncak anode dan katode yang terbentuk karena proses reaksi oksidasi. Puncak anode yang dihasilkan untuk SOD/Zeolit/PCf pada potensial +426 mV dengan arus 1,02 mA dan puncak katode pada potensial +290 mV dengan besar arus 1,71 mA. Arus yang dihasilkan lebih tinggi dibandingkan dengan SOD/PCf dimana potensial anodik dan katodik berturut-turut adalah +465 dan +330V dengan puncak arus 0.054 dan 0.01mA. Sedangkan nilai untuk SOD/Zeolit lebih rendah dari keduanya. Nilai puncak arus anodik dan katodik SOD/Zeolit adalah 0,0012 dan 0,00 mA dengan potensial anodik -100 mV dan katodik 115 mV.
Gambar 2 Puncak arus anode dan katode SOD di imobilisasi dengan zeolit, kemudian diteteskan pada permukaan pasta karbon termodifikasi ferosena (SOD/Zeolit/PCf), SOD di imobilisasi pada permukaan
pasta karbon termodifikasi ferosena (SOD/PCf), dan SOD di imobilisasi pada permukaan zeolit (SOD/Zeolit)
Gambar 3 Puncak arus anode dan katode SOD zeolit di imobilisasi pada permukaan pasta karbon termodifikasi ferosena (ZPf)
Gambar 3 memperlihatkan modifikasi imobilisasi SOD dalam permukaan zeolit tanpa menggunakan pasta karbon termodifikasi ferosena menghasilkan voltamogram yang tidak simetrik sehingga sulit menentukan puncak arus anodik dan katodiknya. Dari data Puncak arus dan potensial modifikasi metode imobilisasi dan voltamogram siklik yang dihasilkan maka dapat disimpulkan SOD di imobilisasi dengan zeolit, kemudian diteteskan pada permukaan pasta karbon termodifikasi ferosena (SOD/Zeolit/PCf) lebih baik dibandingakan dengan yang lain.
Puncak anodik dan katodik SOD/Zeolit/PCf yang lebih tinggi dibandingkan dengan yang lain, menunjukkan bahwa terjadi proses transfer elektron dari reaksi enzimatis dismutase superoksida oleh SOD dalam nanokomposit zeolit permukaan elektroda pasta karbon termodifikasi ferosena (Gambar 4).
Kemampuan zeolit untuk meningkatkan puncak arus yang dihasilkan telah diperlihatkan oleh penelitian yang dilakukan oleh Dai et al. (2004) di mana enzim yang digunakan adalah sitokrom c dan NaY zeolit yang digunakan untuk mendeteksi H2O2. Penggunaan Fe (III) yang ditambahkan ke dalam zeolit
-1,50E-05 -1,00E-05 -5,00E-06 0,00E+00 5,00E-06 1,00E-05 1,50E-05
-1,00E+00I ( -5,00E-01 0,00E+00 5,00E-01 1,00E+00
A
)
E (V) vs Ag/AgCl
sebagai mediator pada pasta karbon dapat meningkatkan puncak oksidasi dan reduksi untuk mendeteksi dopamin dan triptopan (Balal et al. 2009).
Gambar 4 Proses transfer dari reaksi enzimatis SOD terimobilisasi dalam
nankomposit zeolit kepermukaan elektroda pasta karbon yang
dimediasi oleh ferosena
Elektroda pasta karbon telah digunakan secara luas untuk biosensor, karena beberapa keunggulan yang dimilikinya seperti memungkinkan untuk mengimobilisasi berbagai jenis substansi (enzim, ligan, mediator redoks, dan jaringan biologi), dapat diaplikasikan dengan rentang potensial yang lebar,
mudah dimodifikasi, aman, dan murah (Luo et al. 2006). Pasta karbon
termodifikasi zeolit menghasilkan arus yang lebih tinggi dibandingkan dengan
menggunakan elektroda glassy carbon electrode (GCE) termodifikasi
mikroperoksidase-11 (MP-11) dalam nanokomposit 1-oktil-3-metillimidazolium
hexafluorophosphate (OMIMPF6) yang digunakan untuk mendeteksi H2O2 di
mana puncak arus oksidasi yang dihasilkan adalah 0,1 mA pada potensial -0.260 and -0.235 V (Wan et al. 2009). Puncak arus juga menunjukkan hasil yang lebih besar dibandingkan dengan SOD terimobilisasi langsung pada elektroda emas dengan perbandingan arus puncak katodik dan anodik adalah 0,7 (Ipc/Ipa = 0.7 pada 100mV) dengan beda potensial antara katodik dan anodik adalah 0.15 V (Ep = Epa − Epc = 0.15V) (Di at al. 2004). Arus yang dihasilkan juga lebih tinggi dibandingkan dengan penelitian yang dilakukan oleh Trivadila (2011), SOD terimobilisasi pada elektroda pasta karbon tanpa zeolit menghasilkan puncak arus anodik sebesar 0,1mA.
Kemampuan zeolit dalam meningkatkan puncak arus ini bisa disebabkan karena sifatnya yang hidrofilik karena adanya gugus –OH disekitar pori sehingga sangat cocok untuk imobilisasi enzim (Valdes et al. 2006). Selain itu, karena karakteristiknya yang unik diantaranya stabil pada temperatur tinggi, tahan terhadap pelarut organik dan sifatnya yang keras sehingga lebih stabil terhadap tekanan mekanik yang tinggi akan menyebabkan enzim yang terjerab akan lebih stabil. Sedangkan rangka dan pori dari struktur zeolit yang seragam menyebabkan selektivitas dan reprodusibilitasnya yang dihasilkan tinggi (Valdes et al. 2006). Disamping itu, zeolit selain dapat digunakan sebagai material penyangga, keunikan yang dimiiliki zeolit adalah memiliki kemampuan katalitik yang dapat membantu mempercepat reaksi (Dai et al. 2004).
Optimasi aktivitas SOD terimobilisasi
Pengoptimuman Aktivitas SOD murni
Parameter–paramater yang dioptimumkan pada aktivitas SOD D.
radiodurans dilakukan dengan menggunakan rancangan percobaan metode permukaan respon seperti terlihat dalam Lampiran 4. Parameter-parameter yang
dioptimumkan adalah pH (7-11), suhu (20-400C), massa zeolit (25-250mg) dan
konsentrasi SOD (1-5 unit/ml).
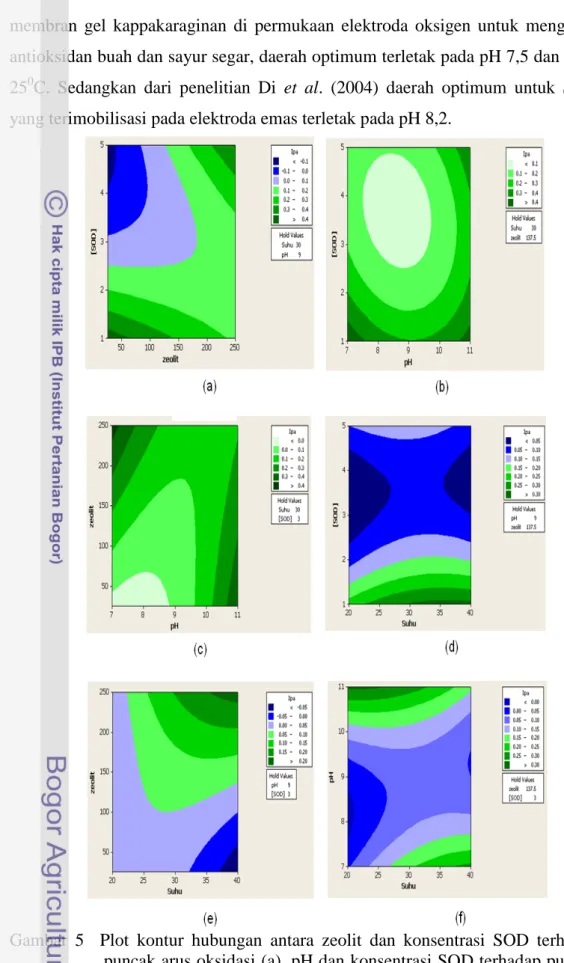
Gambar 5 memperlihatkan plot kontur hubungan antara zeolit dan konsentrasi SOD terhadap puncak arus oksidasi (a), pH dan konsentrasi SOD terhadap puncak arus oksidasi (b), pH dan zeolit terhadap puncak arus oksidasi (c), suhu dan konsentrasi SOD terhadap puncak arus oksidasi (d), suhu dan zeolit terhadap puncak arus oksidasi (e), suhu dan pH terhadap puncak arus oksidasi (f). Berdasarkan hasil pengoptimuman ini, maka kondisi optimum bagi aktivitas SOD
murni adalah pada pH 9, suhu 300C, zeolit 137,5 mg dan konsentrasi SOD 3
unit/ml.
Hasil ini sedikit berbeda dengan hasil yang telah dilakukan oleh peneliti-peneliti sebelumnya. Trivadila (2011) mengimobilisasi enzim SOD pada elektroda pasta karbon dengan mediator ferosen, aktivitas optimum SOD pada suhu 200C dan pH 11. Campanella etal. (2001) telah mengimobilisasi SOD pada
membran gel kappakaraginan di permukaan elektroda oksigen untuk mengukur antioksidan buah dan sayur segar, daerah optimum terletak pada pH 7,5 dan suhu 250C. Sedangkan dari penelitian Di et al. (2004) daerah optimum untuk SOD yang terimobilisasi pada elektroda emas terletak pada pH 8,2.
Gambar 5 Plot kontur hubungan antara zeolit dan konsentrasi SOD terhadap puncak arus oksidasi (a), pH dan konsentrasi SOD terhadap puncak arus oksidasi (b), pH dan zeolit terhadap puncak arus oksidasi (c), suhu dan konsentrasi SOD terhadap puncak arus oksidasi (d), Suhu
dan zeolit terhadap puncak arus oksidasi (e), suhu dan pH terhadap puncak arus oksidasi (f) aktivitas enzim murni.
Dari hasil ini dapat disimpulkan bahwa puncak arus optimum yang dihasilkan sangat dipengaruhi oleh proses imobilisasi yang dilakukan. Parameter-parameter yang sangat berpengaruh adalah pH dan suhu. Pergeseran pH terjadi karena enzim diimobilisasi pada matrik yang memiliki perbedaan muatan, sedangkan pergeseran suhu disebabkan oleh ketidakhomogenan karena imobilisasi enzim (Trivadila 2011).
Pengoptimuman Aktivitas Ekstrak SOD dan Bakteri D. radiodurans
Parameter-parameter yang dioptimumkan pada ekstrak SOD dari D.
radiodurans sama dengan optimasi yang dilakukan pada enzim murni tapi berbeda konsentrasi SOD (1000-2000µg/ml) (Lampiran 5). Gambar 12 menampilkan plot kontur hubungan antara pH dan konsentrasi SOD terhadap puncak arus oksidasi (a), pH dan zeolit terhadap puncak arus oksidasi (b), suhu dan konsentrasi SOD terhadap puncak arus oksidasi (c), suhu dan zeolit terhadap puncak arus oksidasi (d), Suhu dan pH terhadap puncak arus oksidasi (e), zeolit dan konsentrasi SOD terhadap puncak arus oksidasi (f).
Dari plot kontur kita dapat melihat bahwa daerah optimum dari SOD D.
radiodurans tidak berbeda dengan daerah optimum dari enzim SOD murni yaitu pH 9, suhu 300C, zeolit 137,5 mg. Disini yang berbeda adalah konsentrasi SOD yaitu 1500µg/ml, hal ini disebabkan karena ekstrak enzim SOD masih memiliki jenis protein lain selain protein enzim SOD. Hasil ini hampir sama dengan penelitian yang telah dilakukan oleh Trivadila (2011), dimana daerah optimum ekstrak enzim SOD adalah pH 9, suhu 27,50C.
Kondisi optimum pH, suhu dan jumlah zeolit antara SOD murni dan ekstrak adalah sama, sedangkan jumlah enzim yang berbeda, hal ini disebabkan karena kemurnian ekstrak SOD masih sangat rendah, masih terdapat protein lain selain protein SOD. Penelitian Trivadila (2011) menghasilkan kondisi optimum yang berbeda antara SOD murni dan ekstrak. Aktivitas optimum SOD pada suhu
200C dan pH 11, dan daerah optimum ekstrak enzim SOD adalah pH 9, suhu
kekuatan ionik dan nilai pI bersihnya, sehingga menggeser nilai pH optimumnya. Sehingga dapat diambil kesimpulan bahwa dengan adanya zeolit, keberadaan protein-protein lain dalam ekstrak diduga tidak mempengaruhi kekuatan ionik dan nilai pI bersihnya sehingga tidak menggeser nilai pH optimumnya. pH optimum yang didapatkan bersesuain dengan kondisi pH optimum untuk Cu/Zn-SOD berkisar 5-10 sedangkan untuk Mn-Cu/Zn-SOD pH diatas 8 akan menurunkan aktivitasnya (Donnely et al. 1989).
Gambar 6 Plot kontur hubungan antara pH dan konsentrasi SOD terhadap puncak arus oksidasi (a), pH dan zeolit terhadap puncak arus oksidasi (b), suhu dan konsentrasi SOD terhadap puncak arus oksidasi (c), suhu dan zeolit terhadap puncak arus oksidasi (d), Suhu dan pH terhadap puncak arus oksidasi (e), zeolit dan konsentrasi SOD terhadap puncak arus oksidasi (f) aktivitas ekstrak SOD
D.radiodurans.
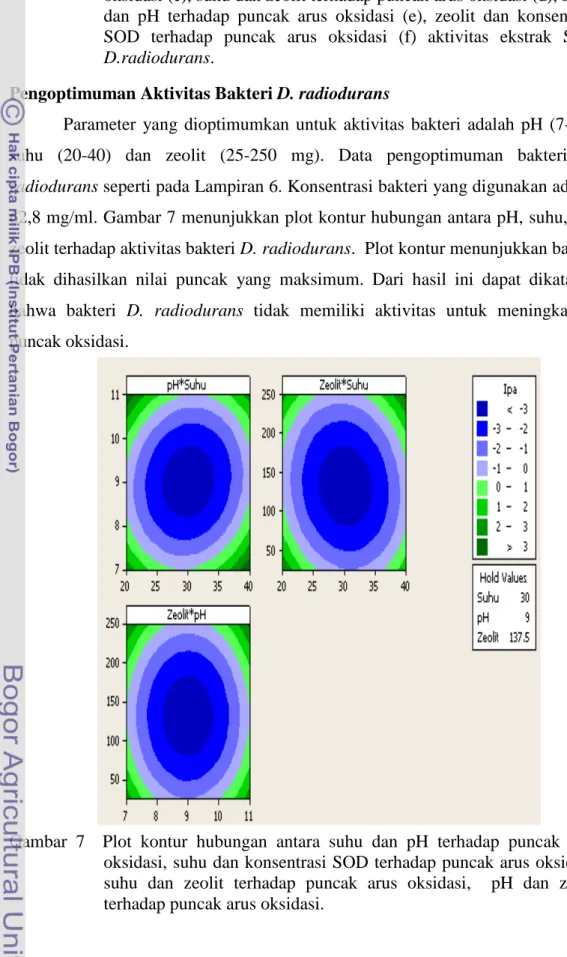
Pengoptimuman Aktivitas Bakteri D. radiodurans
Parameter yang dioptimumkan untuk aktivitas bakteri adalah pH (7-11),
suhu (20-40) dan zeolit (25-250 mg). Data pengoptimuman bakteri D.
radiodurans seperti pada Lampiran 6. Konsentrasi bakteri yang digunakan adalah 62,8 mg/ml. Gambar 7 menunjukkan plot kontur hubungan antara pH, suhu, dan zeolit terhadap aktivitas bakteri D. radiodurans. Plot kontur menunjukkan bahwa tidak dihasilkan nilai puncak yang maksimum. Dari hasil ini dapat dikatakan
bahwa bakteri D. radiodurans tidak memiliki aktivitas untuk meningkatkan
puncak oksidasi.
Gambar 7 Plot kontur hubungan antara suhu dan pH terhadap puncak arus oksidasi, suhu dan konsentrasi SOD terhadap puncak arus oksidasi, suhu dan zeolit terhadap puncak arus oksidasi, pH dan zeolit terhadap puncak arus oksidasi.
0 0,05 0,1 0,15 0,2 0,25 0,3 0,35 0,4 0 0,2 0,4 0,6 0,8 1 1,2 ak ti vi tas S O D (∆ Ip a) (μ A -1) Xantina](mM)
SOD Murni (µA) Ekstrak SOD (µA)
Deinococcus radiodurans merupakan bakteri Gram positif dengan diameter 1,5- 3,5 berkembang dan tidak menimbulkan penyakit. Koloninya halus, cembung, dan
berwarna pink kemerahan. Superoksida dismutase merupakan antioksidan
enzimatik intrasel atau juga dikenal dengan istilah antioksidan endogen (Sunarno
2009). Karena D. radiodurans memiliki dinding sel yang tebal dan juga
strukturnya yang tetrad kemungkinan ekskresi SOD tidak terjadi, karena tidak adanya SOD yang bereaksi dengan radikal superoksida tidak ada transfer elekron yang terjadi oleh sebab itulah arus tidak dihasilkan. Sehingga dapat disimpulan sel bakteri D. radiodurans utuh sebagai komponen pengenal hayati biosensor antioksidan kurang berpotensi.
Kinetika Enzim Superoksida Dismutase Imobilisasi
Untuk melihat kespesifikan suatu enzim maka dilakukan penentuan parameter kinetika enzim yaitu konstanta Michaelis-Menten nyata (KMapp) dan
laju reaksi nyata (Vmaks app) yang dianalogikan dengan arus maksimum nyata
(Imaks app). Parameter kinetika enzim ini dilakukan pengukuran aktivitas SOD
dengan variasi konsentrasi substrat xanitna 0,1-1,00 mM pada kondisi optimum masing-masing enzim. Data pengukuran aktivitas enzim SOD terlihat pada Lampiran 7. Gambar 8 dan 9 menunjukkan hubungan antara konsentrasi substrat xantina dengan aktivitas SOD murni dan SOD D.radiodurans.
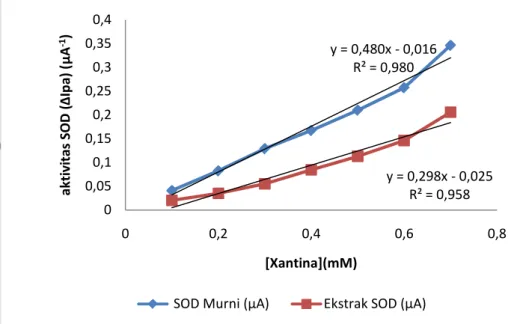
Gambar 8 Hubungan konsentrasi xantina dan aktivitas SOD.
Gambar 9 Linearitas konsentrasi xantina dan aktivitas SOD.
Gambar 8 menunjukkan hubungan konsentrasi substrat dan aktivitas
enzim SOD murni dan SOD D. radiodurans, identik dengan kurva
Michaelis-Manten. Dari kurva terlihat bahwa reaksi yang dikatalisasi oleh enzim terjadi dalam dua tahap, dimana tahap pertama pada kisaran konsentrasi 0,1 – 0,8 mM reaksi berada pada fase pertama dimana tidak semua sisi aktif SOD mengikat radikal superoksida. Fase kedua terjadi pada kisaran 0.8-0,10 mM, disini sisi aktif SOD telah mengikat radikal superoksida, disini dengan penambahan konsentrasi xantina yang lebih tinggi tidak mempengaruhi aktivitas SOD.
Gambar 9 menunjukkan lineritas dari hubungan antara xantina dan aktivitas enzim SOD. SOD murni memiliki kisaran lineritas yang lebih tinggi dari
pada ekstrak SOD, tapi nilai R2 dari keduanya tidak jauh berbeda. Hal ini
menunjukkan bahwa ekstrak SOD D. radiodurans yang terimobilisasi dalam
zeolit pada permukaan elektroda pasta karbon berpotensi untuk digunakan sebagai pengenal.
Menentukan parameter-parameter kinetika enzim yaitu (KMapp) dan (Imaks
app) dapat dilakukan dengan menggunakan metode Lineweaver-Burk. Gambar 10
menunjukkan kurva Lineweaver-Burk yaitu 1/ ∆Ipa dan 1/[xantina]. y = 0,480x - 0,016 R² = 0,980 y = 0,298x - 0,025 R² = 0,958 0 0,05 0,1 0,15 0,2 0,25 0,3 0,35 0,4 0 0,2 0,4 0,6 0,8 ak tiv it as S O D (∆ Ip a) (μ A -1) [Xantina](mM)
Gambar 10 Plot Lineweaver-Burk enzim SOD imobilisasi.
Nilai Imaks app dan KMapp yang ditampilkan pada pada Tabel 10
memperlihatkan bahwa nilai KMapp enzim murni lebih kecil dibandingkan
dengan nilai KMapp ekstrak SOD. Nilai Imaks app dan KMapp
Tabel 5 Nilai parameter kinetika enzim SOD imobilisasi
yang kecil menunjukkan bahwa laju reaksi katalitik dari dismutasi radikal superoksida
yang dikatalis SOD D. radiodurans lebih lambat dibandingkan dengan enzim
SOD.
Metode SOD Murni SOD D.radiodurans
Imaks app (µA) KMapp(mM) Imaks app (µA) KMapp(mM)
Lineweaver
-Burk 0.989 1.096 0.878 2.978
Perbedaan nilai Km yang dihasilkan disebabkan oleh perbedaan struktur
dari enzim SOD yang berasal dari eritrosit sapi dan SOD yang dihasilkan oleh D. radiodurans. SOD yang dihasilkan dari eritrosit sapi adalah tipe Cu-Zn SOD (Misra & Fredovich 1971; Kankofer 2002) sedangkan dari D. radiodurans adalah Mn-SOD. y = 1,927x + 1,011 R² = 0,983 y = 3,389x + 1,138 R² = 0,962 0,000 5,000 10,000 15,000 20,000 25,000 30,000 35,000 40,000 0,000 2,000 4,000 6,000 8,000 10,000 12,000 1/ Ip a (μ A -1) 1/[Xantina] (mM-1)
a b
Gambar 11 Struktur enzim Cu/Zn-SOD (Donnelly et al.1989) (a) dan Mn-SOD
(b).
Mekanisme katalisis SOD didasarkan pada reaksi redok dari ion logam (Cu/ Zn, Mn, Fe and Ni) dan ion radikal superoksida. Pada Cu/Zn –SOD, Cu2+ bertindak sebagai katalis sedangkan Zn adalah menjaga keseimbangan struktur
(Donnelly et al. 1989). Cu bertindak sebagai pembawa dua elektron radikal
superoksida melalui dua tahap reaksi.
E-Cu2+ + O2.- E-Cu+ + O2
E-Cu+ + O
(16)
2.- + 2H+ E-Cu2+ + H2O2
Mekanisme katalis pada MnSOD bereaksi dengan mengukuti fase ledakan dan fase orde nol, dimana Mn-SOD yang tereduksi akan bereaksi dengan radikal superoksida melalui dua jalur (Trivadila 2011)
(17)
Mn+3SOD (OH-) + O2.- (+H+) Mn+2SOD (H2O) + O2
Mn+2SOD (H (18) 2O) + O2.- (+H+) Mn+3SOD (OH-) +H2O2 Mn+2SOD (H (19) 2O) + O2.- Mn+3SOD (H2O) + O2 Mn+3SOD (H 2- (20) 2O) + O22-(+H+) Mn+3SOD (OH-) +H2O K (21)
m enzim murni dan ekstrak SOD yang diperoleh lebih besar
dibandingkan dengan yang dihasilkan Trivadila (2011), dimana Km untuk SOD
pada penelitian ini lebih besar dibandingkan dengan arus yang dihasilkan oleh penelitian Trivadila (2011), dengan puncak arus anodik yaitu 0,08 untuk SOD murni dan 0,1 untuk ekstrak SOD. Sehingga jika dibandingkan maka nilai Km
dari penelitian ini lebih kecil dibandingkan dengan Trivadila (2011). Nilai Km merupakan ukuran kuat dan rendahnya enzim mengikat substrat, jika Km kecil
enzim mengikat kuat substrat sehingga dengan substrat yang rendah cukup untuk
menjenuhkan enzim. Dan sebaliknya jika Km besar maka enzim tidak terlalu
mengikat kuat substrat sehingga substrat yang dibutuhkan untuk menjenuhkan enzim lebih banyak. Dari Hasil ini dapat disimpulkan bahwa, keberadaan zeolit dapat meningkatkan puncak arus anodik sehingga memiliki potensi sebagai material pendukung untuk biosensor antioksidan berbasis SOD.
Pengukuran Aktivitas Antioksidan
Metode pertama untuk mengukur kapasitas antioksidan adalah dengan menggunakan biosensor SOD. Kapasitas antioksidan dinyatakan sebagai relative antioxidant capacity (RAC). Nilai (RAC) merupakan perbandingan dua slope dari kurva dengan dan tanpa penambahan sampel antioksidan. Jika sampel memiliki kandungan antioksidan maka arus yang dihasilkan akan lebih rendah dibandingan dengan larutan yang hanya mengandung radikal superoksida. Dengan membandingakan dua slope ini maka dapat ditentukan kapasitas
antioksidan dari sampel (Campanella et al. 2004). Data RAC dari beberapa
konsentrasi vitamin C terdapat pada Lampiran 8.
Hasil pengukuran dengan biosensor ditunjukkan pada Gambar 12. Dari gambar dapat kita lihat bahwa, penambahan vitamin C akan menyebabkan penurunan puncak arus yang dihasilkan. Tinggi dan rendahnya puncak arus yang dihasilkan signifikan dengan perbedaan konsentrasi vitamin C yang ditambahkan. Pengukuran dengan biosensor menunjukkan bahwa vitamin C dapat mereduksi radikal superoksida lebih dari 50%. Hal ini dikarenakan vitamin C bertindak sebagai antioksidan yang dapat meredam terbentuknya radikal superoksida yang dihasilkan dari reaksi xantina oksidase dengan xantina.
y = 2,674x + 0,629 R² = 0,984 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 0 0,01 0,02 0,03 0,04 0,05 0,06 RA C Vitamin C (M)
Gambar 12 Puncak arus dengan tanpa (blanko) dan penambahan vitamin C.
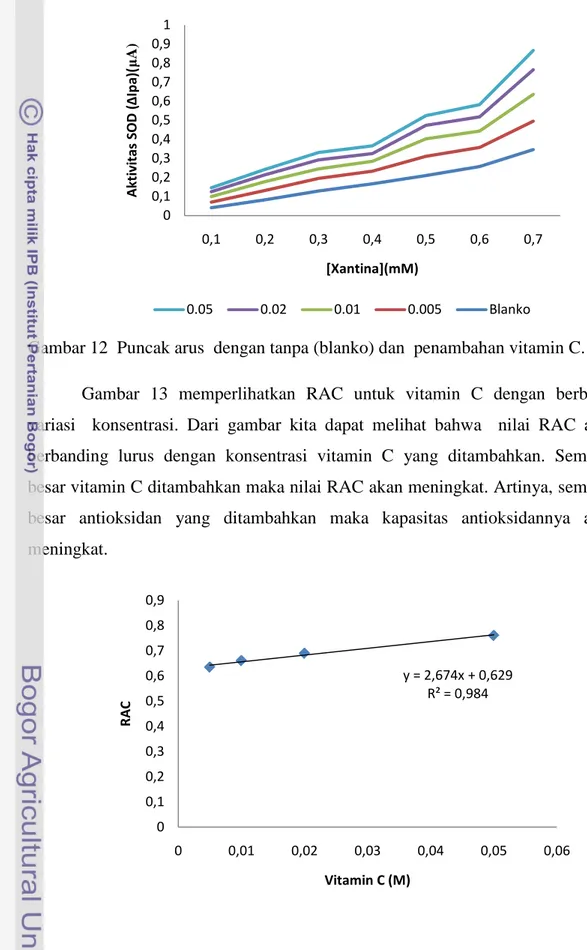
Gambar 13 memperlihatkan RAC untuk vitamin C dengan berbagai variasi konsentrasi. Dari gambar kita dapat melihat bahwa nilai RAC akan berbanding lurus dengan konsentrasi vitamin C yang ditambahkan. Semakin besar vitamin C ditambahkan maka nilai RAC akan meningkat. Artinya, semakin besar antioksidan yang ditambahkan maka kapasitas antioksidannya akan meningkat. 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1 0,1 0,2 0,3 0,4 0,5 0,6 0,7 A kt ivi ta s SO D (∆ Ip a) ( μ A) [Xantina](mM) 0.05 0.02 0.01 0.005 Blanko
Gambar 13 Nilai RAC Vitamin C dengan berbagai konsentrasi.
Vitamin C merupakan antioksidan yang sangat kuat. Hal ini dapat dilihat dari nilai RAC yang lebih besar dibandingkan dengan RAC berbagai buah seperti apel, nanas, anggur, Chery, pisang, melon , apricot (Campanella et al. 2003b). RAC vitamin C yang dihasilkan lebih tinggi dibandingkan dengan RAC minuman anggur putih dan anggur merah yang memiliki nilai RAC berturut-turut adalah 0,358 dan 0,534 (Campanella et al. 2004). Kapasitas antioksidan vitamin C yang didapatkan juga lebih besar dibandingkan dengan menggunakan biosensor amperometri berbasis SOD yang mendeteksi H2O2
Range konsentrasi vitamin C yang terukur adalah 0,005-0.05 M. Range konsentrasi yang digunakan pada penelitian ini lebih besar dibandingkan dengan biosensor berbasis silika yang dicampur dalam elektroda pasta karbon untuk mendeteksi asam askorbat, asam urat dan xantina, dimana range konsentrasinya adalah 2.0×10−4 - 1.0×10−3 M (Sun et al. 2009). Tapi masih lebih kecil dibandingkan dengan biosensor berbasis SOD untuk mengukur kapasitas antioksidan vitamin C pada minuman anggur merah dan anggur putih
(Campanella et al. 2004) dan biosensor berbasis tirosinase untuk mengukur
polifenol teh dengan mengukur katekin sebagai standar pada range konsentrasi 10-100 mM (Abhijeth et al. 2007)
, dimana vitamin C dalam minuman anggur putih dengan konsentrasi 21,5 mgL-1 memiliki kapasitas antioksidan sebesar 0,058 (Campanella et al. 2004).
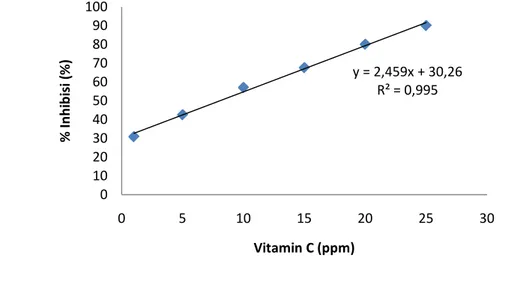
Metode kedua untuk menentukan kapasitas antioksidan dari vitamin C adalah menggunakan metode penangkapan radikal bebas DPPH menggunakan spektrofotometri. Vitamin C ditentukan kapasitas antioksidannya dengan cara membuat kurva deret standar dengan konsentrasi vitamin C 1, 5, 10, 15 dan 20 dan 25 ppm (Lampiran 8). Gambar 14 merupakan kurva kalibrasi yang memplot hubungan antara konsentrasi vitamin C dengan % Inhibisi terhadap DPPH. Konsentrasi yang menyebabkan DPPH awal turun sebanyak 50% yang digunakan
sebagai parameter nilai antioksidan suatu sampel dan disebut dengan IC50.
Gambar 14 % inhibisi vitamin C terhadap DPPH.
Dari kedua metode yang digunakan kita dapat melihat bahwa, konsentrasi vitamin C yang dapat diukur biosensor jauh lebih besar dibandingkan dengan metode spektrofotometri. Jika menggunakan metode spektrofotometri pada konsentrasi 30 ppm absorbansinya sudah mencapai 1 (Rahman et al. 2007), hal ini disebabkan karena spektrofotometeri sangat dipengaruhi oleh kekeruhan larutan. Hal ini berbeda dengan biosensor yang tidak dipengaruhi oleh kekeruhan larutan. Sehingga tidak diperlukan pengenceran berkali-kali yang dapat menyebabkan berkurangnya ketelitian. Selain itu, ketika vitamin C direaksikan DPPH dilakukan inkubasi selama 30 menit. Tapi dengan menggunakan biosensor tidak diperlukan inkubasi karena super radikal adalah senyawa yang tidak stabil sehingga harus segera diukur. Dari sini dapat disimpulkan bahwa penggunaan biosensor lebih cepat, akurat dan sensitif dibandingkan dengan spektrofotometri.
y = 2,459x + 30,26 R² = 0,995 0 10 20 30 40 50 60 70 80 90 100 0 5 10 15 20 25 30 % I nh ib is i ( %) Vitamin C (ppm)