AKTIVITAS DAN STABILITAS SUPEROKSIDA DISMUTASE
DARI EKSTRAK
Escherichia coli
DIIMOBILISASI PADA
ZEOLIT ALAM SEBAGAI BIOSENSOR ANTIOKSIDAN
LIYONAWATI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
ABSTRAK
LIYONAWATI. Aktivitas dan Stabilitas Superoksida Dismutase dari Ekstrak Escherichia coli Diimobilisasi pada Zeolit Alam sebagai Biosensor Antioksidan. Dibimbing oleh DYAH ISWANTINI PRADONO, NOVIK NURHIDAYAT, dan TRIVADILA.
Biosensor antioksidan berbasis superoksida dismutase (SOD) murni memiliki kekurangan antara lain harga yang mahal dan kestabilannya yang rendah. Solusi dari kekurangan tersebut adalah penggunaan bakteri yang
menghasilkan SOD sebagai sensor. Escherichia coli telah diketahui menghasilkan
SOD jenis Cu/Zn-SOD dan Mn-SOD. Kondisi optimum aktivitas antioksidan
SOD yang diperoleh berdasarkan Response Optimizer pada Minitab adalah suhu
37 °C, pH 7, dan zeolit 30 mg untuk ekstrak E. coli dan suhu 40 °C, pH 7, dan
zeolit 240 mg untuk sel E. coli. Nilai KM app dan Imaks app SOD dari ekstrak E. coli
ditentukan dengan metode Lineweaver-Burk. Nilai KM app dan Imaks app sebesar
1.1376 mM dan 2.3770 µA (diimobilisasi pada zeolit) dan 2.4039 mM dan 2.5012 µA (tanpa imobilisasi). Stabilitas elektrode menggunakan zeolit sebagai matriks imobilisasi relatif stabil hingga 4 jam, aktivitas antioksidan yang tersisa sebesar 88.91%, sedangkan stabilitas elektrode tanpa zeolit terus menurun, aktivitas antioksidan yang tersisa hingga 12 jam sebesar 11.67%.
Kata kunci: biosensor antioksidan, E. coli, superoksida dismutase, zeolit alam.
ABSTRACT
LIYONAWATI. Superoxide Dismutase Activity and Stability from Escherichia
coli Extract Immobilized on Natural Zeolites as Antioxidant Biosensor.
Supervised by DYAH ISWANTINI PRADONO, NOVIK NURHIDAYAT, and TRIVADILA.
Antioxidant biosensor based on pure superoxide dismutase (SOD) has drawbacks, such as high price and low stability. The solution of those
shortcomings was using of bacteria that produced SOD as a sensor. Escherichia
coli has been known to produce SOD, type Cu/Zn-SOD and Mn-SOD. The
optimum conditions SOD antioxidant activity obtained by Response Optimizer in
Minitab were 37 °C, pH 7, and 30 mg zeolites for E. coli extract and 40 °C, pH 7,
and 240 mg zeolites for E. coli cells. KM app and Imax app values of SOD from E. coli
extract were determined by Lineweaver-Burk method. The KM app and Imax app
values were 1.1376 mM and 2.3770 µA (immobilized on zeolites) and 2.4039 mM and 2.5012 µ A (without immobilization), respectively. The electrodes of zeolites as immobilization matrix was relatively stable until 4 hours, the remaining antioxidant activity was 88.91%, whereas the stability of electrodes without zeolites gradually fall, the remaining antioxidant activity until 12 hours was 11.67%.
AKTIVITAS DAN STABILITAS SUPEROKSIDA DISMUTASE
DARI EKSTRAK
Escherichia coli
DIIMOBILISASI PADA
ZEOLIT ALAM SEBAGAI BIOSENSOR ANTIOKSIDAN
LIYONAWATI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul : Aktivitas dan Stabilitas Superoksida Dismutase dari Ekstrak Escherichia coli Diimobilisasi pada Zeolit Alam sebagai Biosensor Antioksidan
Nama : Liyonawati NIM : G44080091
Disetujui, Pembimbing I
Prof Dr Dyah Iswantini Pradono, MSc Agr NIP 19670730 199103 2 001
Pembimbing II Pembimbing III
Dr Novik Nurhidayat Trivadila, SSi, MSi
NIP 19771029 200502 2 001
Diketahui,
Ketua Departemen Kimia
Prof Dr Ir Tun Tedja Irawadi, MS NIP 19501227 197603 2 002
PRAKATA
Penulis memanjatkan puji dan syukur kepada Allah SWT, karena atas rahmat dan karunia-Nya, penulis dapat menyelesaikan karya ilmiah yang berjudul
“Aktivitas dan Stabilitas Superoksida Dismutase dari Ekstrak Escherichia coli
Diimobilisasi pada Zeolit Alam sebagai Biosensor Antioksidan.” Penelitian
dilaksanakan dari Mei hingga November 2012 di Laboratorium Kimia Fisik, Laboratorium Bersama Kimia, Departemen Kimia, IPB, dan Laboratorium Genetika Mikrobiologi, Pusat Penelitian Biologi LIPI Cibinong.
Penulis menyampaikan terima kasih kepada ibu Prof Dr Dyah Iswantini Pradono, MScAgr, bapak Dr Novik Nurhidayat, dan ibu Trivadila, SSi, MSi selaku pembimbing yang selalu memberikan bimbingan dan saran selama penelitian dan dalam penyusunan karya ilmiah ini. Penulis juga mengucapkan terima kasih kepada Mbak Ratih, Pak Acun, Mas Eko, Pak Wawan, Pak Mail, dan Bu Ai yang telah membimbing dan membantu penulis selama penelitian. Ungkapan terima kasih juga ditujukan kepada Pemerintah Daerah Belitung Timur yang telah memberikan beasiswa kepada penulis selama mengikuti perkuliahan di IPB.
Penulis juga menyampaikan ungkapan terima kasih kepada Ayah, Ibu, Bang Eddy, Kak Sari, Kak Desi, Nurul, Dinie, Kak Yuanita, Lukman, Okik, Pak Muammar, Risma, Suci, Ima, Ami, Fadli, dan teman-teman Kimia 45 lainnya yang selalu memberikan bimbingan, semangat, dan doa.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2013
DAFTAR ISI
Superoksida Dismutase (SOD) dan Escherichia coli 4
Imobilisasi Enzim pada Zeolit Alam 5
BAHAN DAN METODE 7
Alat dan Bahan 7
Penumbuhan Sel Bakteri E. coli dan Ekstraksi Protein Sitoplasma E. coli 7
Pembuatan Elektrode Pasta Karbon Termodifikasi Ferosena 8
Aktivasi Zeolit 8
Imobilisasi Ekstrak E. coli dan Sel E. coli 8
Optimasi Aktivitas Antioksidan Ekstrak E. coli dan Sel E. coli 8
Pengukuran Aktivitas Antioksidan Ekstrak E. coli 9
Penentuan Stabilitas Biosensor Antioksidan Berbasis SOD dari Ekstrak
E. coli 9
Stabilitas Biosensor Antioksidan Berbasis SOD dari Ekstrak E. coli 17
SIMPULAN DAN SARAN 18
Simpulan 18
Saran 19
DAFTAR PUSTAKA 19
xii
DAFTAR GAMBAR
1 Skema alat biosensor antioksidan 3
2 Mekanisme pengukuran biosensor antioksidan 3
3 Struktur Cu/Zn-SOD dan Mn-SOD 4
4 Morfologi Escherichia coli 5
5 Metode imobilisasi enzim 6
6 Struktur zeolit 6
7 Zeolit alam jenis klinoptilolit 6
8 Voltammogram siklik 11
9 Alur kontur hubungan antara suhu, pH, dan zeolit terhadap aktivitas
antioksidan ekstrak E. coli 13
10 Alur kontur hubungan antara suhu, pH, dan zeolit terhadap aktivitas
antioksidan sel E. coli. 14
11 Hubungan konsentrasi xantina dengan aktivitas antioksidan ekstrak E. coli
12 Rentang linier antara xantina dengan aktivitas antioksidan ekstrak E. coli 16
13 Alur Lineweaver-Burk ekstrak E. coli 16
14 Kurva stabilitas biosensor antioksidan berbasis SOD dari ekstrak E. coli 18
DAFTAR LAMPIRAN
1 Bagan alir penelitian 22
2 Kombinasi faktor-faktor peubah bebas untuk optimasi aktivitas antioksidan
ekstrak E. coli dan sel E. coli terimobilisasi 23
3 Hasil optimasi aktivitas antioksidan ekstrak E. coli dan sel E. coli
terimobilisasi 24
4 Hasil pengukuran aktivitas antioksidan ekstrak E. coli terimobilisasi dan tanpa
imobilisasi pada rentang konsentrasi substrat xantina 0.1–1.0 mM 25
5 Analisis kinetika SOD dalam ekstrak E. coli terimobilisasi dengan metode
Lineweaver-Burk 26
6 Analisis kinetika SOD dalam ekstrak E. coli tanpa imobilisasi dengan metode
Lineweaver-Burk 28
7 Stabilitas biosensor antioksidan berbasis SOD dari ekstrak E. coli pada suhu
1
PENDAHULUAN
Aktivitas sehari-hari sering membuat tubuh terpapar radikal bebas yang dihasilkan dari pencemaran udara, makanan yang mengandung pengawet, stres, infeksi virus, dan bakteri hasil metabolisme tubuh. Radikal bebas adalah atom, molekul atau senyawa yang dapat berdiri sendiri, mempunyai satu atau lebih elektron tidak berpasangan pada orbital paling luar. Radikal bebas sangat berbahaya karena bersifat reaktif dalam mencari pasangan elektron, bereaksi cepat pada biomolekul melalui berbagai jenis reaksi antara lain penangkapan hidrogen, donor elektron, dan penggunaan elektron bersama. Radikal bebas akan melepaskan elektron pada molekul sekitarnya untuk menghasilkan pasangan elektron sehingga menjadi molekul yang stabil. Reaksi ini berlangsung terus-menerus dalam tubuh dan apabila tidak dihentikan akan menimbulkan berbagai penyakit seperti kanker, penuaan dini, serta penyakit degeneratif lainnya
(Pourmorad et al. 2006). Oleh karena itu, tubuh memerlukan antioksidan untuk
menetralisir dan mencegah kerusakan yang ditimbulkan oleh radikal bebas tersebut.
Sifat-sifat antioksidan seperti kapasitas dan aktivitas antioksidan dapat ditentukan dengan metode spektrofotometri, fluoresensi, kromatografi gas atau cair, dan sebagainya (Budnikov & Ziyatdinova 2005). Metode-metode tersebut memiliki beberapa kelemahan, khususnya metode spektrofotometri yakni biaya mahal, waktu preparasi sampel lama, dan kurang sensitif terutama dalam menguji sampel berwarna dan sangat dipengaruhi oleh kekeruhan atau turbiditas. Oleh karena itu, dibutuhkan metode yang lebih tepat, cepat, dan sensitif untuk mengukur sifat-sifat antioksidan.
Biosensor antioksidan merupakan metode alternatif yang dikembangkan untuk mengukur sifat-sifat antioksidan. Metode ini sangat menjanjikan karena waktu analisis cepat, membutuhkan instrumen yang tidak mahal, dan protokol operasi yang sederhana, yaitu biosensor amperometri untuk menguji kapasitas
antioksidan berdasarkan aktivitas penangkapan radikal bebas berbasis sitokrom c,
DNA, dan superoksida dismutase (SOD) (Prieto-Simon et al. 2008). Biosensor
antioksidan pada penelitian ini berbasis SOD, akan tetapi penggunaan SOD murni memiliki kekurangan, yaitu harga yang mahal dan kestabilan enzim yang rendah. Solusi dari kekurangan tersebut adalah penggunaan bakteri yang menghasilkan SOD sebagai sensor.
Enzim yang diekstraksi dari bakteri pada umumnya memiliki aktivitas dan stabilitas yang rendah. Modifikasi enzim pada biosensor dengan teknik imobilisasi bertujuan meningkatkan aktivitas, stabilitas, dan efisiensi penggunaan enzim tersebut. Selain itu, aktivitas katalitik molekul enzim yang terikat pada permukaan matriks imobilisasi mampu dipertahankan dalam jangka waktu tertentu. Bahan yang dapat digunakan sebagai matriks imobilisasi enzim antara lain biopolimer seperti kitosan, alginat, selulosa, karagenan, dan kitin (Nazaruddin 2007), serta polimer sintetik seperti nilon, polianilin, polistirena, dan poliakrilamida. Akan tetapi, penggunaan polimer sebagai matriks imobilisasi memiliki kelemahan utama, yaitu stabilitas kimia dan mekanik yang masih rendah (Park 2000).
Bahan anorganik seperti tanah liat, alumina berpori, silika (Bhatia et al.
2
salah satu bahan yang banyak terdapat di Indonesia dan berpotensi sebagai matriks imobilisasi SOD. Zeolit alam merupakan senyawa alumina silikat terhidrasi yang secara fisik dan kimia mempunyai kemampuan sebagai penjerap, penukar kation, dan sebagai katalis. Zeolit memiliki karakteristik unik, yaitu memiliki kemampuan katalitik yang dapat membantu mempercepat reaksi, stabil pada suhu tinggi, tahan terhadap pelarut organik, dan sifatnya yang keras sehingga lebih stabil terhadap tekanan mekanik yang tinggi, sehingga enzim yang terjerap lebih stabil. Rangka dan pori dari struktur zeolit yang seragam menyebabkan
selektivitas dan reprodusibilitas yang dihasilkan tinggi (Valdes et al. 2006).
Penggunaan zeolit sebagai matriks imobilisasi enzim pada biosensor telah
dilakukan oleh Goriushkina et al. (2010) untuk imobilisasi glukosa oksidase dan
Kirdeciler et al. (2011), untuk imobilisasi urease dan menghasilkan stabilitas kerja
biosensor yang baik. Selain itu, Balal et al. (2009) juga menggunakan zeolit untuk
modifikasi elektrode pasta karbon yang digunakan untuk mengukur kadar dopamin dan triptofan. Hasil tersebut juga menunjukkan bahwa arus yang dihasilkan lebih tinggi, memiliki stabilitas yang baik dalam percobaan berulang-ulang, dan membuat pengukuran menjadi lebih selektif dan sensitif. Selain itu, Weniarti (2011) juga melaporkan bahwa penggunaan zeolit alam sebagai matriks
imobilisasi SOD dari ekstrak Deinococcus radiodurans dapat meningkatkan
aktivitasnya dalam biosensor antioksidan. Bakteri D. radiodurans merupakan
bakteri Gram positif, berbentuk tetrad dan besar serta memiliki dinding sel lebih tebal dibandingkan dengan bakteri lain yang menyebabkan sulit untuk memecahkan dinding sel dan mengekstraksi protein sitoplasmanya (Trivadila
2011). Selain itu, D. radiodurans membutuhkan media yang kompleks untuk
membentuk koloni yang berwarna merah jambu (Battista 2003).
Oleh karena itu, dalam penelitian ini dicoba menggunakan bakteri lain, yaitu Escherichia coli sebagai sumber SOD. Alasan pemilihan E. coli sebagai sumber
SOD pada penelitian ini karena E. coli memiliki dinding sel yang tipis,
pertumbuhannya sangat cepat, dan mudah dalam penanganannya. Penelitian ini bertujuan menentukan aktivitas dan stabilitas SOD dari ekstrak protein sitoplasma E. coli ATCC25922 yang diimobilisasi pada zeolit alam sebagai biosensor antioksidan.
TINJAUAN PUSTAKA
Biosensor Antioksidan
Antioksidan merupakan substansi yang diperlukan tubuh untuk menetralisir dan mencegah kerusakan yang ditimbulkan oleh radikal bebas. Antioksidan adalah senyawa yang secara nyata dapat memperlambat oksidasi, walaupun dengan konsentrasi yang lebih rendah dibandingkan dengan substrat yang dapat dioksidasi. Antioksidan dapat menangkap berbagai jenis oksigen yang secara biologis bersifat reaktif (O2-, H2O2, -OH, -HOCl, dan sebagainya), dengan cara
3
Biosensor adalah suatu piranti yang memanfaatkan interaksi hayati untuk
mendeteksi analit target (Hartati et al. 2005). Biosensor mengombinasikan
komponen pengenal hayati dengan tranduser yang sesuai untuk mendeteksi adanya zat kimia target. Biosensor terdiri atas dua bagian utama, yaitu komponen pengenal hayati dan tranduser (Gambar 1). Komponen pengenal hayati sebuah biosensor berinteraksi secara selektif terhadap analit target, memastikan selektivitas dari sensor, sedangkan tranduser menentukan kepekaan biosensor dan mengubah respons hayati yang dihasilkan dari interaksi dengan analit target menjadi sinyal yang dapat diukur. Biosensor dapat diklasifikasikan berdasarkan jenis transdusernya, yaitu biosensor elektrokimia, optik, akustik, termal, dan piezoelektrik (Scoot 1998).
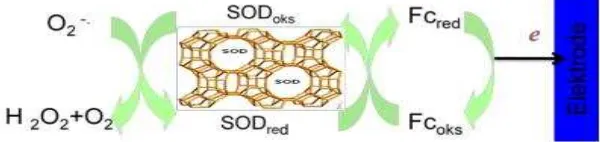
Gambar 1 Skema alat biosensor antioksidan.
Mekanisme pengukuran kapasitas antioksidan pada biosensor antioksidan (Gambar 2) melalui reaksi redoks, yaitu SOD akan mengoksidasi radikal superoksida (O2-) yang berasal dari substrat xantina menjadi O2 dan H2O2.
Perubahan oksidasi yang dihasilkan dari reaksi tersebut dapat dideteksi oleh elektrode pada transduser elektrokimia sebagai sinyal listrik, dan hasil yang keluar berupa grafik arus listrik yang menunjukkan terjadinya reaksi oksidasi dan reduksi pada proses tersebut.
Gambar 2 Mekanisme pengukuran biosensor antioksidan.
Biosensor elektrokimia berdasarkan pada reaksi katalisis enzimatik yang menghasilkan atau mengkonsumsi elektron (enzimnya dinamakan enzim redoks). Substrat sensor biasanya berisi tiga elektrode, yaitu elektrode pembanding, elektrode kerja, dan elektrode pembantu. Analit target yang terlibat dalam reaksi yang terjadi pada permukaan elektrode kerja, dan ion yang dihasilkan untuk memberikan sinyal. Pengukuran konsentrasi analit dapat dilakukan pada potensial tetap atau potensial nol (Martin 2011). Biosensor elektrokimia untuk mendeteksi radikal superoksida terbagi menjadi dua, yaitu biosensor berbasis sitokrom c dan SOD.
Biosensor antioksidan berbasis SOD terbukti dapat mengukur kapasitas
antioksidan berbagai jenis sampel, misalnya teh, produk herbal (Campanella et al.
2003), anggur merah, dan anggur putih (Campanella et al. 2004). Biosensor
4
Superoksida Dismutase (SOD) dan Escherichia coli
Superoksida dismutase (SOD) merupakan enzim yang diproduksi secara alami oleh organisme yang mengkonsumsi oksigen, berperan sebagai salah satu mekanisme pertahanan terhadap spesi oksigen reaktif yang diproduksi sebagai efek samping metabolisme dan respirasi. Enzim ini merupakan metaloenzim yang mengatalisis dismutasi dari radikal superoksida (O2.- + O2.- + 2H+→ O2 + H2O2)
dan telah diproduksi secara komersil dari eritrosit sapi yang mengandung hemocuprein (Mc Cord & Fridovich 1969).
Enzim SOD dapat dikelompokkan berdasarkan kofaktor logam utamanya, yaitu Cu/Zn-SOD dan Mn-SOD (Gambar 3). Pemanfaatan SOD untuk biosensor antioksidan telah banyak dilakukan, karena enzim ini memiliki kelebihan, yaitu bersifat spesifik dalam mengatalisis radikal superoksida menjadi oksigen dan peroksida dan memiliki ketahanan terhadap panas, misalnya SOD dari susu sapi dapat bertahan pada 63 °C dan SOD dari ekstrak kol bertahan pada 45 °C
(Donnelly et al. 1989). Mikroorganisme yang menghasilkan SOD antara lain
Deinococcus radiodurans, Escherichia coli, Bacillus subtilis, Saccharomyces cerevisiae, Aspergillus niger, dan sebagainya (Benov et al. 1996).
(a) (b)
Gambar 3 Struktur Cu/Zn-SOD (a) dan Mn-SOD (b) (Donnelly et al. 1989).
Bakteri E. coli (Gambar 4) termasuk dalam keluarga Enterobacteriaceae,
merupakan kelompok bakteri Gram negatif heterogen, habitat alaminya di saluran intestinal manusia dan hewan. Bakteri ini berbentuk batang, panjang 1-3µ m,
diameter 0.5 µm, volume sel 0.6–0.7 µm3, dan umumnya hidup pada 20–40 °C
dengan suhu optimum 37 °C. Sebagian besar spesies bakteri ini tidak berbahaya, menguntungkan manusia dengan memproduksi vitamin K, dan dapat mencegah
pertumbuhan bakteri lain di usus. Selain itu, E. coli banyak digunakan dalam
teknologi rekayasa genetika, yaitu sebagai vektor untuk menyisipkan gen-gen tertentu yang ingin dikembangkan.
Dinding sel E. coli tersusun atas membran luar, peptidoglikan, dan membran
5
Gambar 4 Morfologi Escherichia coli (Marler 2011).
Jenis SOD yang dihasilkan E. coli, yaitu Mn-SOD dan Cu/Zn-SOD. Enzim
Mn-SOD termasuk jenis homotetramer yang terdiri dari satu atom mangan pada setiap sub unit. Enzim Cu/Zn-SOD memiliki dua sub unit yang identik, berperan
dalam melindungi sel dari radikal superoksida, dan dapat ditemukan pada E. coli
dalam konsentrasi tinggi (Mates et al. 1999). Enzim SOD pada E. coli terdapat
dalam membran sel, tepatnya di bagian periplasma untuk Cu/Zn-SOD dan
Mn-SOD di membran sitoplasma (Gort et al. 1999). Oleh karena itu, penelitian ini
menggunakan E. coli sebagai sumber SOD untuk biosensor antioksidan.
Penggunaan sel bakteri E. coli dalam pengembangan biosensor telah banyak
dilakukan. Hal tersebut dilakukan karena batas deteksi sebanding dengan nanotube karbon biosensor glukosa yang menunjukkan bahwa penggunaan sel mikrob sebagai biosensor glukosa memiliki kemampuan yang sama dibandingkan dengan enzim murni. Metode ini dapat dikatakan lebih murah karena enzim aktif
tidak perlu diisolasi dan dimurnikan (Iswantini et al. 2011). Klasifikasi bakteri E.
coli, yaitu kingdom Bacteria, filum Proteobacteria, ordo Enterobacteriales, famili
Enterobacteriaceae, genus Escherichia, dan spesies E. coli (Holt et al. 1994).
Imobilisasi Enzim pada Zeolit Alam
Enzim terimobilisasi (immobilized enzymes) didefinisikan sebagai enzim
yang ditahan atau dilokalisasikan secara fisik dengan menahan aktivitas katalitiknya sehingga dapat digunakan berulang-ulang dan berkesinambungan. Beberapa hal penting yang harus diperhatikan pada proses imobilisasi enzim, yaitu sifat dari enzim bebas, jenis materi pendukung yang digunakan, metode aktivasi pendukung, dan perekatan enzim. Imobilisasi enzim memiliki beberapa keuntungan, yaitu jumlah total enzim yang dibutuhkan lebih sedikit dan dapat digunakan lagi, proses dapat dioperasikan secara terus menerus dan dapat dikontrol, produk mudah dipisahkan, aktivitas dan stabilitas enzim dapat diubah,
dan kegagalan dalam reaksi materi diperkecil (Grieshaber et al. 2008).
Sifat enzim terimobilisasi berbeda dari enzim bebas dikarenakan adanya pengaruh dari material penyangga, matriks imobilisasi, perubahan konformasi enzim yang berasal dari interaksi enzim dengan material penyangga, dan modifikasi kovalen dari residu asam amino. Sifat yang diamati selama proses imobilisasi enzim, yaitu aktivitas spesifik, pH optimum, Konstanta Michaelis-Menten (KM app), selektivitas, dan stabilitas. Aktivitas spesifik enzim pada saat
imobilisasi hampir menurun dan nilai laju kecepatan maksimum substrat menjadi
produk (Vmaks app) menjadi turun sedangkan nilai KM app meningkat (Weniarti
6
Metode imobilisasi enzim (Gambar 5) secara umum terbagi menjadi lima
metode, yaitu adsorpsi fisik (physical adsorption), ikatan kovalen (covalent
binding), enkapsulasi (encapsulation), penjebakan (entrapment), dan taut-silang (cross-linking). Penelitian ini menggunakan metode adsorpsi enzim, berdasarkan adsorpsi fisik protein enzim secara langsung pada permukaan matriks zeolit alam. Metode ini dipilih karena sederhana, murah, dapat digunakan pada kondisi
tertentu, dan tidak memengaruhi aktivitas enzim (Arya et al. 2007).
Gambar 5 Metode imobilisasi enzim (Vastarella 2001).
Zeolit alam merupakan mineral alam berbentuk kristal, terbentuk dari bahan vulkanik, dan mempunyai struktur pori dalam ukuran nano. Struktur pori pada zeolit terbentuk karena adanya silikon tetrahedral yang terhubung satu sama lain
dengan atom oksigen (Hadiyawarman et al. 2008). Zeolit (Gambar 6) memiliki
karakteristik unik, yaitu memiliki kemampuan katalitik yang dapat membantu mempercepat reaksi, stabil pada suhu tinggi, tahan terhadap pelarut organik, dan sifatnya yang keras sehingga lebih stabil terhadap tekanan mekanik yang tinggi sehingga akan menyebabkan enzim yang terjerap lebih stabil. Rangka dan pori dari struktur zeolit yang seragam menyebabkan selektivitas dan reprodusibilitas
yang dihasilkan tinggi (Valdes et al. 2006). Zeolit yang digunakan pada penelitian
ini berasal dari Bayah dan termasuk ke dalam jenis klinoptilolit. Zeolit klinoptilotit (Gambar 7) memiliki rumus molekul (Na4K4)(Al8Si40O96)
.
24H2Odengan kerangka Al dari zeolit tersebut tidak stabil terhadap panas dan asam (Ginting 2007).
Gambar 6 Struktur zeolit (Bell 2001).
7
Penggunaan zeolit untuk modifikasi elektrode pasta karbon telah dilakukan
oleh Nezamzadeh et al. (2007), yaitu untuk mengukur kadar asam askorbat.
Goriushkina et al. (2010) menggunakan zeolit untuk imobilisasi glukosa oksidase,
dan Balal et al. (2009) menggunakan zeolit untuk modifikasi elektrode pasta
karbon yang digunakan untuk mengukur kadar dopamin dan triptofan. Hasil tersebut juga menunjukkan bahwa elektrode pasta karbon termodifikasi zeolit, akan menghasilkan arus yang lebih tinggi dan memiliki stabilitas yang baik dalam percobaan berulang-ulang dan membuat pengukuran menjadi lebih sensitif dan selektif.
BAHAN DAN METODE
Alat dan Bahan
Alat-alat yang digunakan antara lain potentiostat-galvanostat eDAQ yang
dilengkapi dengan perangkat lunak Echem v2.1.0 dan Minitab, laminar air flow,
inkubator, High Speed Refrigerated Centrifuge KUBOTA 6500, Centrifuge 5415
R, autoklaf, Ultrasonic Homogenizer UH-150, spektrofotometer
ultraviolet-tampak (berkas ganda), pipet mikro, pinset, batang gelas, sel elektrokimia, neraca analitik, pH meter, oven, tanur, dan peralatan gelas lainnya. Bahan-bahan yang
digunakan antara lain sel E. coli ATCC25922, zeolit alam Bayah, media LB untuk
pertumbuhan E. coli, grafit, ferosena, parafin cair, xantina oksidase (XO), xantina,
dimetil sulfoksida (DMSO), bufer fosfat, HCl 3 M, AgNO3, membran dialisis,
jaring nilon, dan parafilm. Bagan alir penelitian secara umum dijelaskan pada Lampiran 1.
Penumbuhan Sel Bakteri E. coli dan Ekstraksi Protein Sitoplasma E. coli
Bakteri E. coli ditumbuhkan dalam media LB agar miring, kemudian
diinkubasi selama 24 jam, 37 oC. Bakteri yang tumbuh selanjutnya ditanam ke
dalam 5 mL media LB cair sebagai starter, diinkubasi sampai mencapai nilai
OD610=0.5 kemudian diinokulasi ke dalam 50 mL media LB cair dan diinkubasi
kembali selama 24 jam, 37 oC. Sel bakteri dipanen dengan cara disentrifugasi
pada kecepatan 10 000 rpm selama 20 menit. Pelet dipisahkan dari supernatan lalu dicuci dengan air destilata steril dan diresuspensikan dalam bufer fosfat pH 7.5.
Suspensi biomassa sel bakteri kemudian disonikasi dengan Ultrasonic
8
Pembuatan Elektrode Pasta Karbon Termodifikasi Ferosena
Sebanyak 3 mg ferosena dilarutkan dalam 1 mL DMSO, lalu ditambahkan 100 mg grafit. Campuran didiamkan selama 2 jam dan pelarut kemudian diuapkan dengan pengering vakum untuk mendapatkan grafit termodifikasi mediator
ferosena. Grafit termodifikasi ferosena tersebut dicampur dengan 35 L parafin
cair, kemudian digerus dengan mortar hingga membentuk pasta. Pasta karbon kemudian dimasukkan ke dalam badan elektrode gelas hingga padat sampai permukaan. Permukaan elektrode dihaluskan dan dibersihkan dengan amplas dan kertas minyak (Trivadila 2011).
Aktivasi Zeolit
Sebanyak 50 gram zeolit Bayah dicuci dengan akuades sampai pH netral,
disaring, dan dikeringkan dalam oven pada 105 oC. Zeolit yang telah dikeringkan,
diaktivasi dengan menambahkan 250 mL HCl 3 M ke dalam gelas piala dan diaduk selama 1 jam. Zeolit yang telah diaktivasi disaring, kemudian dicuci dengan akuades sampai pH netral. Larutan hasil saringan diuji kandungan klorin
dengan AgNO3 dan dicuci kembali dengan akuades sampai tidak mengandung
klorin. Setelah pH netral dan bebas klorin, zeolit dikeringkan pada suhu 300 oC
selama 3 jam. Zeolit yang telah diaktivasi kemudian dihaluskan dan diayak dengan ayakan 100 mesh (Arif 2011).
Imobilisasi Ekstrak E. coli dan Sel E. coli
Sebanyak 30 mg zeolit Bayah dicampurkan dengan 10 mL akuades,
sehingga membentuk suspensi 3 mg/mL. Sebanyak 20 L ekstrak E. coli dalam
bufer fosfat pH 7.5 dicampur dengan 10 L suspensi zeolit, didiamkan 10 menit,
dan diteteskan sebanyak 10 µL pada permukaan elektrode, didiamkan hingga pelarutnya menguap, dilapisi dengan membran dialisis, ditutup dengan jaring nilon, dan diikat dengan parafilm. Elektrode dapat langsung digunakan untuk
pengukuran aktivitas antioksidan ekstrak E. coli dengan metode voltammetri
siklik. Elektrode direndam dalam bufer fosfat pH 7.5 pada suhu 4 ºC ketika tidak digunakan untuk memberikan keadaan yang sama dengan lingkungan sebenarnya.
Prosedur yang sama dilakukan untuk imobilisasi sel E. coli (Dai et al. 2004, Ikeda
et al. 1998).
Optimasi Aktivitas Antioksidan Ekstrak E. coli dan Sel E. coli
Seperangkat alat potensiostat/galvanostat eDAQ, komputer, dan perangkat lunak pengolah data Echem V2.1.0 disiapkan untuk pengukuran dengan metode
voltammetri siklik. Elektrode yang digunakan, yaitu elektrode Ag/AgCl komersial
sebagai elektrode rujukan, elektrode platina sebagai elektrode bantu, dan elektrode pasta karbon termodifikasi ferosena sebagai elektrode kerja. Parameter
9
E: -400 mV, Rate: 250 mV/s, Step W: 20 ms, Upper E: 600 mV, Lower E: -400
mV, dan Range: 100 µV.
Radikal superoksida dihasilkan melalui reaksi enzimatis xantina dengan
xantina oksidase (XO). Radikal tersebut akan didismutasi menghasilkan O2 dan
H2O2 dengan katalis SOD. Sebanyak 1.9 mL larutan bufer fosfat, 100 µL larutan
ferosena, dan 100 µL larutan XO 0.1 U/mL ditambahkan ke dalam sel pengukuran dan puncak arus anode yang terbentuk diamati sebagai puncak blanko. Sebanyak 1 mL substrat xantina 2.1 mM ditambahkan dan diukur kembali perubahan atau kenaikan puncak arus anode yang terjadi (Trivadila 2011).
Optimasi aktivitas antioksidan ekstrak E. coli yang dilakukan berdasarkan
prosedur pengukuran di atas, meliputi optimasi suhu 20–40 °C, pH 7–11, dan
zeolit 30–240 mg. Metode yang digunakan untuk optimasi aktivitas SOD E. coli
dan sel E. coli terimobilisasi, yaitu Response Surface Method (RSM). Metode ini
dilakukan dengan memasukkan kombinasi faktor-faktor peubah bebas pada perangkat lunak statistika Minitab. Selanjutnya, percobaan dilakukan sesuai kombinasi yang dihasilkan untuk mendapatkan kondisi optimumnya. Kombinasi faktor-faktor peubah bebas untuk optimasi aktivitas antioksidan ekstrak SOD E. coli dan sel E. coli terimobilisasi dilampirkan pada Lampiran 2.
Pengukuran Aktivitas Antioksidan Ekstrak E. coli
Uji aktivitas dilakukan dengan variasi rentang konsentrasi substrat xantina
0.1–1.0 mM (interval 0.1 mM), kemudian dibuat kurva hubungan antara
konsentrasi substrat xantina dengan aktivitas antioksidan ekstrak E. coli. Sebagai
parameter adanya hubungan linier digunakan koefisien determinasi (R2) pada
analisis regresi linier y = a + bx.
Penentuan Stabilitas Biosensor Antioksidan Berbasis SOD dari Ekstrak E. coli
Penentuan stabilitas biosensor antioksidan berdasarkan pengukuran aktivitas
antioksidan SOD dari ekstrak E. coli setelah didapatkan kondisi optimum aktivitas
antioksidannya secara langsung melalui pengukuran arus yang didapat. Proses
pengukuran sama seperti pada tahap optimasi aktivitas antioksidan ekstrak E. coli.
Nilai aktivitas yang diperoleh pada pengukuran awal dianggap 100%. Aktivitas diukur ulang pada tiap 2 jam sekali hingga 12 jam. Bagan alir penelitian secara umum dilampirkan pada Lampiran 1.
Aktivitas Antioksidan Relatif (%) = I saat jam ke-(A)
I saat awal (A)
×
100%10
HASIL DAN PEMBAHASAN
Penumbuhan Sel E. coli dan Ekstraksi Protein Sitoplasma E. coli
Pertumbuhan bakteri didefinisikan sebagai pertambahan jumlah sel bakteri. Konsentrasi sel bakteri ditentukan dengan menghitung kekeruhan (turbiditas) kultur. Kekeruhan kultur berbanding lurus dengan jumlah sel bakteri. Prinsip dasar metode turbidimetri, yaitu jika cahaya mengenai sel, maka sebagian cahaya diserap dan sebagian cahaya diteruskan. Jumlah cahaya yang diserap sebanding dengan jumlah sel bakteri dan semakin banyak jumlah sel, semakin sedikit cahaya yang diteruskan (Purwoko 2007). Media pertumbuhan untuk bakteri mengandung nutrisi untuk memenuhi kebutuhan energi, sebagai bahan pembangun sel, untuk sintesis protoplasma, dan bagian-bagian sel lainnya. Media pertumbuhan yang
digunakan pada penelitian, yaitu media LB (Luria Bertani). Media ini
mengandung campuran zat-zat makanan (nutrisi) berupa tripton, NaCl, dan
ekstrak khamir yang diperlukan bagi pertumbuhan E. coli. Penambahan tripton
dan ekstrak khamir pada media LB berfungsi sebagai sumber asam amino dan vitamin.
Dinding sel E. coli dipecah menggunakan Ultrasonic Homogenizer untuk
mengekstraksi protein sitoplasma yang mengandung SOD. Konsentrasi ekstrak protein sitoplasma yang diperoleh sebesar 10680.60 µg/mL. Ekstrak protein sitoplasma yang diperoleh tersebut diduga mengandung SOD jenis Mn-SOD dan
Cu/Zn-SOD. Enzim SOD pada E. coli terdapat dalam membran sel, tepatnya di
bagian periplasma untuk Cu/Zn-SOD dan Mn-SOD di membran sitoplasma (Gort et al. 1999). Penelitian Yuan et al. (2002) menyebutkan SOD yang terkandung
dalam ekstrak sitoplasma sel E. coli sebesar 26% dan aktivitas spesifiknya sebesar
920 U/mg (setelah dimurnikan). Aktivitas ini lebih besar dibandingkan aktivitas
spesifik SOD dari Macrobrachium nipponerse sebesar 96.29 U/mg (Yao et al.
2004).
Optimasi Aktivitas Antioksidan Ekstrak E. coli dan Sel E. coli
Aktivitas antioksidan ekstrak E. coli ditentukan menggunakan metode
11
penambahan substrat xantina, terjadi reaksi enzimatis xantina dengan xantin oksidase (XO) yang menghasilkan radikal superoksida menurut reaksi:
xantina + H2O + O2 asam urat + 2H+ + 2O2•-
Selanjutnya, radikal yang dihasilkan akan didismutasi membentuk O2 dengan
katalis SOD melalui reaksi:
2H+ + 2O2•- O2 + H2O2
Reaksi yang terjadi pada permukaan elektrode pasta karbon ini akan menghasilkan arus puncak oksidasi yang lebih tinggi dibandingkan arus blanko (bufer fosfat) pada voltammogram siklik (Gambar 8). Oleh karena itu, dapat
disimpulkan bahwa ekstrak E. coli yang diimobilisasi pada permukaan pasta
karbon termodifikasi ferosena menghasilkan aktivitas yang dapat diukur menggunakan metode voltammetri siklik.
Gambar 8 Voltammogram siklik, bufer fosfat, bufer fosfat + ferosena,
bufer fosfat + ferosena + XO + xantina.
Optimasi aktivitas antioksidan ekstrak E. coli terimobilisasi meliputi suhu
20–40 °C, pH 7–11, dan zeolit 30–240 mg. Hasil optimasi tersebut (Lampiran 3)
kemudian dianalisis menggunakan Response Surface Methods (RSM) pada
perangkat lunak Minitab. Metode ini merupakan suatu teknik matematika dan statistika yang berguna untuk memodelkan dan menganalisis respons yang diteliti dipengaruhi oleh beberapa variabel dan bertujuan mengoptimumkan respons (Montgomery 2001). Respons yang diperoleh digambarkan dalam bentuk alur kontur yang merepresentasikan garis-garis yang menunjukkan nilai ekspektasi respons aktivitas berupa arus dari minimum hingga maksimum. Gambar 9 menampilkan alur kontur hubungan antara suhu-pH, suhu-zeolit, dan pH-zeolit
terhadap aktivitas antioksidan ekstrak E. coli. Alur kontur tersebut menampilkan
12
Kondisi optimum aktivitas antioksidan SOD dari ekstrak E. coli berdasarkan
Response Optimizer pada Minitab, yaitu suhu 37 °C, pH 7, dan zeolit 30 mg. Hasil
ini hampir sama dengan hasil yang diperoleh Endo et al. (2002) yang
mengimobilisasi SOD dengan mediator ferosena–karboksialdehida bertaut silang
dengan glutaraldehida pada permukaan elektrode Pt, memiliki aktivitas optimum pada suhu 37 °C dan pH 7.4. Proses imobilisasi yang berbeda akan memengaruhi pH dan suhu optimum yang diperoleh. Enzim terimobilisasi menunjukkan perubahan kebergantungan pada keadaan pH, suhu, matriks imobilisasi, dan kekuatan ionik, khususnya jika parameter-parameter tersebut diubah oleh reaksi
enzim itu sendiri (Bisswanger 2008). Aktivitas optimum ekstrak D. radiodurans,
yaitu pada suhu 30 °C, pH 9, dan zeolit 137.5 mg (Weniarti 2011). Perbedaan kondisi optimum tersebut dapat disebabkan oleh perbedaan bakteri yang digunakan sebagai sumber SOD, jenis SOD, konsentrasi SOD, dan proses imobilisasi yang digunakan. Selain itu, penelitian ini menggunakan matriks imobilisasi zeolit yang telah diaktivasi terlebih dahulu sehingga memungkinkan tidak terdapat pengotor-pengotor yang memengaruhi aktivitas optimum SOD
dalam ekstrak E. coli. Gambar 9 menampilkan alur kontur hubungan antara
suhu-pH, suhu-zeolit, dan pH-zeolit terhadap aktivitas antioksidan ekstrak E. coli.
(a)
13
(c)
Gambar 9 Alur kontur hubungan antara suhu dan zeolit (a), suhu dan pH (b), dan
pH dan zeolit (c) terhadap aktivitas antioksidan ekstrak E. coli.
Optimasi aktivitas antioksidan sel E. coli terimobilisasi meliputi suhu 20–40
°C, pH 7–11, dan zeolit 30–240 mg. Hasil optimasi tersebut (Lampiran 3)
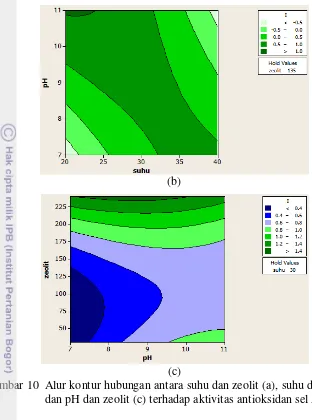
kemudian dianalisis menggunakan RSM pada perangkat lunak Minitab. Gambar 10 menampilkan alur kontur hubungan antara suhu-pH, suhu-zeolit, dan pH-zeolit terhadap aktivitas antioksidan sel E. coli. Kondisi optimum aktivitas sel E. coli
yang diperoleh berdasarkan Response Optimizer, yaitu suhu 40 °C, pH 7, dan
zeolit 240 mg. Hasil optimasi menunjukkan bahwa aktivitas maksimum sel E. coli
sebesar 1.972 µA lebih kecil daripada aktivitas maksimum ekstrak E. coli sebesar
2.885 µA. Hasil tersebut disebabkan karena jumlah enzim SOD yang terdapat
dalam sitoplasma E. coli lebih banyak, sehingga dinding selnya harus dipecah
terlebih dahulu untuk mendapatkan ekstrak protein sitoplasma yang mengandung
SOD. Berdasarkan hal tersebut dapat disimpulkan sel E. coli utuh kurang
berpotensi untuk digunakan sebagai komponen pengenal hayati pada biosensor antioksidan.
14
(b)
(c)
Gambar 10 Alur kontur hubungan antara suhu dan zeolit (a), suhu dan pH (b), dan pH dan zeolit (c) terhadap aktivitas antioksidan sel E. coli.
Aktivitas Antioksidan Ekstrak E. coli
Pengaruh substrat xantina terhadap aktivitas antioksidan ekstrak E. coli
yang diimobilisasi pada zeolit alam dilakukan pada rentang konsentrasi 0.1–1.0
mM (interval 0.1 mM), pH 7, zeolit 30 mg, dan suhu 28 °C. Pemilihan 28 °C (suhu ruang) ini memudahkan dalam aplikasi biosensor antioksidan yang lebih praktis sehingga dapat langsung digunakan pada suhu ruang. Hasil pengukuran
aktivitas antioksidan ekstrak E. coli pada rentang konsentrasi substrat xantina 0.1
– 1.0 mM dijelaskan pada Lampiran 4.
Gambar 11 menunjukkan hubungan antara konsentrasi substrat xantina
dengan aktivitas antioksidan ekstrak E. coli terimobilisasi dan tanpa imobilisasi
yang hampir identik dengan persamaan Michaelis-Menten. Kurva tersebut
menjelaskan bahwa reaksi yang dikatalisis oleh ekstrak E. coli yang mengandung
SOD terjadi dalam dua tahap. Tahap pertama terjadi pada rentang 0.1–0.8 mM,
yaitu reaksi berada pada fase pertama, tidak semua sisi aktif enzim mengikat radikal superoksida. Ketika konsentrasi xantina mencapai 0.9 mM, aktivitas
15
(terimobilisasi) dan 1.025 µA (tanpa imobilisasi), dan kondisi ini menunjukkan bahwa reaksi berada pada fase kedua, artinya enzim telah bekerja pada kapasitas penuh, semua sisi aktif enzim telah mengikat radikal superoksida. Penambahan substrat xantina dengan konsentrasi lebih tinggi berpengaruh pada penurunan
aktivitas antioksidan ekstrak E. coli, hal ini ditunjukkan pada saat penambahan
konsentrasi xantina 1.0 mM, aktivitasnya turun menjadi 1.818 µA (terimobilisasi) dan 0.637 µA (tanpa imobilisasi).
Arus puncak oksidasi ekstrak E. coli diimobilisasi pada permukaan zeolit
yang lebih tinggi menunjukkan bahwa telah terjadi proses transfer elektron dari reaksi enzimatis dismutasi superoksida oleh SOD dalam zeolit pada permukaan elektrode pasta karbon. Penggunaan zeolit alam sebagai matriks imobilisasi
ekstrak E. coli diduga memengaruhi arus puncak oksidasi yang dihasilkan.
Kemampuan zeolit dalam meningkatkan arus puncak oksidasi disebabkan oleh
sifatnya yang hidrofilik karena adanya gugus –OH di sekitar pori yang sangat
sesuai untuk imobilisasi enzim (Valdes et al. 2006). Kemampuan zeolit dalam
meningkatkan puncak arus oksidasi yang dihasilkan juga diperlihatkan pada
penelitian Dai et al. (2004). Penelitian tersebut menggunakan zeolit NaY sebagai
matriks imobilisasi sitokrom c untuk mendeteksi H2O2.
Gambar 11 Hubungan konsentrasi xantina dengan aktivitas antioksidan ekstrak E. coli, + zeolit, tanpa zeolit.
Penentuan rentang linier pengukuran bertujuan untuk mengetahui daerah kerja maksimum dari elektrode yang digunakan. Gambar 12 menunjukkan rentang linier antara konsentrasi substrat xantina dengan aktivitas antioksidan ekstrak E. coli terimobilisasi dan tanpa imobilisasi. Berdasarkan gambar tersebut, rentang
linier diperoleh pada rentang konsentrasi xantina 0.1–0.9 mM. Persamaan regresi
yang diperoleh, y = 3.9772x–0.1610 dengan R2 = 98.63% (menggunakan zeolit
sebagai matriks imobilisasi) dan y = 1.0752x –0.0616 dengan R2 = 96.09% (tanpa
matriks zeolit). Rentang linier ekstrak E. coli yang diperoleh lebih lebar daripada
penelitian Trivadila (2011), yaitu 0.1–0.7 mM untuk SOD murni dan 0.1–0.6 mM
16
Gambar 12 Rentang linier antara xantina dengan aktivitas antioksidan ekstrak E. coli, + zeolit, tanpa zeolit.
Penentuan parameter kinetika SOD dalam ekstrak E. coli bertujuan untuk
melihat kespesifikannya ketika diimobilisasi pada zeolit alam. Parameter kinetika
yang digunakan, yaitu konstanta Michaelis-Menten nyata (KM app) dan laju reaksi
maksimum nyata (Vmaks app), dianalogikan sebagai arus maksimum nyata (Imaks app).
Kedua parameter kinetika tersebut ditentukan dengan metode Lineweaver-Burk, Hanes-Woolf, dan Eadie-Hofstee. Berdasarkan Lampiran 5, koefisien determinasi
(R2) yang diperoleh dengan metode Lineweaver-Burk lebih besar dibandingkan
metode Hanes-Woolf dan Eadie-Hofstee, sehingga dapat disimpulkan kinetika
reaksi enzimatis SOD dalam ekstrak E. coli terimobilisasi dan tanpa imobilisasi
mengikuti kinetika Lineweaver-Burk.
Gambar 13 Alur Lineweaver-Burk ekstrak E. coli, + zeolit, tanpa zeolit.
Nilai KM app merupakan suatu ukuran kuat atau lemahnya enzim mengikat
substrat. Nilai KM app kecil maka enzim mengikat kuat substrat sehingga untuk
17
jika nilai KM app besar maka enzim tidak terlalu kuat mengikat substrat sehingga
substrat yang dibutuhkan untuk menjenuhkan enzim lebih banyak. Nilai Imaks app
merupakan indikator aktivitas enzim. Semakin besar Imaks app, semakin tinggi
aktivitas enzim dan sebaliknya. Nilai KM app SOD dari ekstrak E. coli, yaitu 1.1376
mM (terimobilisasi) dan 2.4039 mM (tanpa imobilisasi). Nilai Imaks app ekstrak
E. coli, yaitu 2.3770 µA (terimobilisasi) dan 2.5012 µA (tanpa imobilisasi).
Analisis kinetika ekstrak E. coli terimobilisasi dan tanpa imobilisasi dengan
metode Lineweaver-Burk dijelaskan pada Lampiran 5 dan 6.
Nilai KM app SOD dari ekstrak E. coli terimobilisasi pada penelitian ini
hampir sama dengan nilai KM app SOD murni yang diperoleh pada penelitian
Weniarti (2011), yaitu 1.096 mM, sedangkan nilai KM app SOD murni standar
(Sigma-Aldrich) sebesar 0.355 mM (Sigma-Aldrich 2011). Perbedaan nilai Imaks
app dan KM app yang diperoleh berhubungan dengan perbedaan tingkat kemurnian
enzim dan penggunaan zeolit sebagai matriks imobilisasi enzim. Enzim yang murni dan terjerap di permukaan zeolit memungkinkan sisi-sisi aktifnya lebih terlindungi, bereaksi lebih baik terhadap substrat, dan aktivitasnya meningkat
sehingga berdampak pada penurunan nilai KM app. Selain itu, enzim yang
diekstraksi dari sumber bakteri yang berbeda akan memiliki sifat-sifat yang berbeda terutama responsnya terhadap kondisi lingkungan seperti suhu, pH, dan konsentrasi substrat.
Stabilitas Biosensor Antioksidan Berbasis SOD dari Ekstrak E. coli
Kinerja metode voltammetri sangat dipengaruhi oleh material elektrode kerja. Elektrode kerja yang sering digunakan antara lain elektrode raksa, elektrode emas, elektrode platina, dan elektrode karbon. Penggunaan elektrode raksa untuk analisis sampel memerlukan penanganan khusus karena sifatnya yang beracun. Elektrode raksa juga memiliki keterbatasan rentang potensial anode, sehingga tidak dapat digunakan untuk pengukuran senyawa yang mudah teroksidasi. Elektrode alternatif yang biasa digunakan adalah elektrode padat yang dimodifikasi dengan senyawa pengompleks. Elektrode padat memiliki rentang potensial anode yang lebih luas. Elektrode padat yang sering digunakan sebagai elektrode kerja, yaitu elektrode berbasis karbon. Elektrode ini memiliki keunggulan, yaitu rentang potensial yang luas, arus latar yang rendah, inert, dan sesuai untuk berbagai macam sensor (Wang 1994).
Elektrode pasta karbon merupakan elektrode murah, permukaannya berpori, dapat diperbaharui, dan dapat dibuat dalam bentuk kecil. Elektrode pasta karbon pada penelitian ini dimodifikasi dengan penambahan mediator ferosena untuk meningkatkan kinerjanya dalam mendeteksi sampel. Parafin cair pada pembuatan elektrode pasta karbon digunakan sebagai pengikat karena dalam pengukuran
tidak ikut bereaksi (inert) dan stabil dalam campuran (Svancara et al. 2002).
Stabilitas elektrode merupakan faktor penting dalam biosensor antioksidan.
Stabilitas biosensor antioksidan berbasis ekstrak E. coli terimobilisasi dan tanpa
imobilisasi ditentukan dari pengukuran aktivitasnya setelah didapatkan kondisi optimum secara langsung melalui pengukuran arus yang didapat selama 12 jam. Stabilitas biosensor digambarkan sebagai hubungan waktu (jam) dengan aktivitas
18
Gambar 14 Kurva stabilitas biosensor antioksidan berbasis SOD dari ekstrak E. coli, + zeolit, tanpa zeolit.
Penggunaan zeolit sebagai matriks imobilisasi ekstrak E. coli memengaruhi
stabilitas elektrode. Enzim yang terimobilisasi pada permukaan zeolit, sisi aktifnya akan lebih terlindungi sehingga pengaruh suhu dan pH ekstrim terhadap enzim tersebut dapat diminimalkan. Stabilitas elektrode menggunakan zeolit sebagai matriks imobilisasi lebih baik dibandingkan dengan tanpa menggunakan zeolit. Stabilitas elektrode yang menggunakan zeolit sebagai matriks imobilisasi SOD, relatif stabil hingga 4 jam, aktivitas antioksidan yang tersisa sebesar 88.91%, sedangkan stabilitas elektrode tanpa zeolit cenderung turun hingga 12 jam, aktivitas yang tersisa sebesar 11.67%. Berdasarkan hasil tersebut dapat disimpulkan penggunaan zeolit alam Bayah sebagai matriks imobilisasi dapat
meningkatkan stabilitas ekstrak E. coli pada biosensor antioksidan.
SIMPULAN DAN SARAN
Simpulan
Superoksida dismutase dari ekstrak E. coli ATCC25922 yang diimobilisasi
pada zeolit alam memiliki aktivitas lebih tinggi dibandingkan tanpa diimobilisasi pada zeolit. Penggunaan zeolit alam sebagai matriks imobilisasi ini menghasilkan
aktivitas antioksidan ekstrak E. coli relatif stabil hingga 4 jam. Nilai KM app SOD
dalam ekstrak E. coli terimobilisasi lebih kecil dibandingkan tanpa imobilisasi.
Hal tersebut menunjukkan afinitas SOD dalam ekstrak E. coli terimobilisasi lebih
19
Saran
Penelitian lanjutan menggunakan material lain selain zeolit alam sebagai matriks imobilisasi perlu dilakukan agar didapatkan aktivitas dan stabilitas biosensor antioksidan yang lebih baik. Selain itu, perlu dilakukan uji keterulangan, ketepatan, limit deteksi, dan pembuatan alat biosensor antioksidan
berbasis SOD dari ekstrak E. coli untuk pengembangan ke arah aplikatif.
DAFTAR PUSTAKA
Arif Z. 2011. Karakterisasi dan modifikasi zeolit alam sebagai bahan media pendeteksi studi kasus: kromium heksavalen [Tesis]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Arya SK, Datta M, Malhotra BD. 2007. Recent advances in cholesterol biosensor. Biosens Bioelect 23: 1083-1100.
Balal K, Mohammad H, Bahareh, Ali B, Maryam H, Mozhgan Z. 2009. Zeolite nanoparticle modified carbon paste elektrode as a biosensor for simultaneous
determination of dopamine and tryptophan. J Chin Chem 56: 789-796.
Battista JR. 2003. The structure of Deinococcus radiodurans. Science 302:
567-568.
Bell RG. 2001. What are Zeolites?. [terhubung berkala].
http://www.bza.org/zeolites.html. [14 Feb 2012].
Benov LT, Beyer Jr WF, Stevens RD, Fridovich I. 1996. Purification and
characterization of the Cu,Zn SOD from Escherichia coli. Free Rad Bio Med
21 (1): 117-121.
Bhatia R, Gupta AK, Anup KS, Brinker CJ. 2000. Aqueous sol-gel process for
protein encapsulation. Chem Mater 12: 2434-2441.
Bisswanger H. 2008. Enzyme Kinetics Principles and Methods. Weinheim:
Wiley-VCH Verlag GmbH & Co. KGaA.
Budnikov GK, Ziyatdinova. 2005. Antioxidants as analytes in analytical
chemistry. J Anal Chem 60: 600-613. wines: comparison with other spectrophotometric and fluorimetric methods. Biosens Bioelect. 19: 641–651.
Dai Z, Liu S, Ju H. 2004. Direct electron transfer of cytochrome c immobilized on
a NaY zeolit matrix and its application in biosensing. Electro Acta 49:
2139-2144.
Donnelly JK, McLellan KM, Walker JL, Robinson DS. 1989. Superoxide
20
Endo K et al. 2002. Development of superoxide sensor by immobilization of
superoxide dismutase. Sens. Actuators B 83: 30-34.
Ginting A, Anggraini D, Indrayati S, Kriswarini R. 2007. Karakteristik komposisi kimia, luas pori, dan sifat termal zeolit dari daerah Bayah, Tasikmalaya, dan
Lampung. J Tek Bhn Nukl 3: 1-48.
Goriushkina TB, Kurç BA, Sacco A, Dzyadevych SV. 2010. Application of
zeolites for glucose oxidase in amperometric biosensors. Sens Elect &
Microsys Tech 1: 36-42.
Gort AS, Ferber DM, Imlay JA. 1999. The regulation and role the periplasmic
copper, zinc superoxide dismutase of Escherichia coli. Mol Microbiol 32 (1)
179-191.
Grieshaber D, Mackenzie R, Janos V, Erik R. 2008. Electrochemical
biosensor-sensor principles and architectures. Sensor 8: 1400-1458.
Hadiyawarman, Rijal A, Nuryadin BW, Abdullah M, Khairurrijal. 2008. Fabrikasi material nanokomposit superkuat, ringan, dan transparan menggunakan
metode simple mixing. J Nanotek 1: 14-21.
Hartati YW, Rochani S, Bahti HH, & Agma M. 2005. Biosensor elektrokimia untuk deteksi urutan DNA tanpa indikator hibridisasi. [Seminar]. Bandung: Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Padjadjaran.
Holt et al. 1994. Determinative Bacteriology. NSA: Lippincot William & Wilkins.
Ikeda T, Matsubara H, Kato H, Iswantini D. 1998. Electrochemical monitoring of
in vivo reconstitution of glucose dehydrogenase in Escherichia coli cells with
externally added pyrroloquinoline quinone. J Electroanal Chem 449(1-2):
219-224.
Iswantini D, Nurhidayat N, Trivadila. 2011. Glucose biosensor using selected
Indonesian bacteria. Microbiol 5 (1) 9-14.
Kirdeciler SK, Soy E, Ozturk S, Kucherenko I, Soldatkin O, Dzyadevych S, Akata B. 2011. A novel urea conductometric biosensor based on zeolite
immobilized urease. Talanta 85: 1435–1441.
Marler B. 2011. Everything you wanted to know about E. coli – But really didn’t.
[terhubung berkala].
http://www.foodpoisonjournal.com/food-poisoning- information/everything-you-wanted-to-know-about-e-coli-but-really-didnt/#.UPeODTVs3kE [17 Jan 2013].
Martin C. 2011. Prinsip biosensor.[terhubung berkala]. http://www.
newsmedical.net/health/Biosensor-Principle-(Indonesian).aspx.[4 Feb 2012]. Mates JM, Gomez CP, Castro IN. 1999. Antioxidant enzymes and human
diseases. Clin Biochem 32(8): 595-603.
McCord JM, Fridovich I. 1969. Superoxide dismutase An enzyme for
eryrhrocuprein (hemocuprein). J Biochem 224 (22): 6049–6055.
Montgomery DC. 2001. Design and Analysis Of Experiments 5th Edition. Canada:
John Wiley & Sons Inc.
Nazaruddin. 2007. Biosensor Urea Berbasis Biopolimer Kitin sebagai Matriks Imobilisasi. J Rek Kim & Lingk 6: 41-44.
Nezamzadeh A, Amini MK, Faghihian H. 2007. Square-wave voltammetric determination of ascorbic acid based on its electrocatalytic oxidation at
21
Park JK, Chang HN. 2000. Microencapsulation of microbial cells. Biotechnol.
Adv 18: 303-319.
Pietta PG. 2000. Flavonoids as antioxidants. J Nat Prod 63: 1035-1042.
Pourmorad F, Hosseinimehr SJ, Shahabimajd N. 2006. Antioxidant activity,
phenols, flavanoid contents of selected Iranian medicinal plants. S. Afr. J
Biotechnol 5: 1142-1145.
Prieto-Simon B, Cortina M, Campas M, Calas-Blanchard C. 2008.
Electrochemical biosensor as a tool for antioxidant capacity assessment. Sens
Actuators B 129: 459–466.
Purwoko T. 2007. Fisiologi Mikroba. Jakarta: Bumi Aksara.
Scott AO. 1998. Biosensors for Food Analysis. UK : The Royal Society of
Chemistry.
Sigma-Aldrich. 2011. Product information. [terhubung berkala].
http://www.sigmaaldrich.com/etc/medialib/docs/Sigma/Datasheet/2/s8160dat. Par.0001.File.tmp/s8160dat.pdf. [2 Des 2012].
Svancara I, Ogorevc B, Hocevar SB, Vytras K. 2002. Perspectives of carbon paste
electrode in stripping voltametry. Anal Sci Vol 18: 95-100.
Trivadila. 2011. Biosensor antioksidan menggunakan superoksida dismutase Deinococcus radiodurans yang diimobilisasi pada permukaan elektrode pasta karbon dan parameter kinetikanya. [Tesis]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Valdes MG, Perez-Cordoves AI, Diaz-Garcia ME. 2006. Zeolites and zeolite
based materials in analytical chemistry. J Trends Anal Chem 25: 24-30.
Vastarella W. 2001. Enzyme modified elektrodes in amperometric biosensors. [Tesis]. Bari: University of Degli Studi di Bari.
Wang J. 1994. Analytical Electrochemistry. New York: VCH.
Weniarti. 2011. Biosensor antioksidan berbasis superoksida dismutase Deinococcus radiodurans diimobilisasi pada nanokomposit zeolit alam Indonesia. [Tesis]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Yao C, Way AL, Wang WN, Sun RY. 2004. Purification and partial characterization of Mn-SOD from niusele tissue of shrimp Macrobrachium nipponerse. Aquacult 24: 621-631.
22
LAMPIRAN
Lampiran 1 Bagan alir penelitian
Penumbuhan dan Peremajaan Mikrob
Panen Mikrob
Ekstraksi Protein Sitoplasma Escherichia coli
Aktivasi Zeolit
Uji Aktivitas Antioksidan Ekstrak E. coli Terimobilisasi Optimasi Aktivitas
Antioksidan Ekstrak E. coli dan Sel E. coli Terimobilisasi
Penentuan Stabilitas Elektrode Pembuatan Elektrode Pasta
Karbon Termodifikasi
Imobilisasi Ekstrak E. coli dan Sel E. coli
23
24
Lampiran 3 Hasil optimasi aktivitas antioksidan ekstrak E. coli dan sel E. coli
25
Lampiran 4 Hasil pengukuran aktivitas antioksidan ekstrak E. coli terimobilisasi
dan tanpa imobilisasi pada rentang konsentrasi substrat xantina 0.1 –
1.0 mM
[Xantina] (mM)
Aktivitas antioksidan ekstrak E. coli (µA)
+ zeolit Tanpa zeolit
0.1 0.213 0.107
0.2 0.745 0.160
0.3 1.158 0.215
0.4 1.225 0.362
0.5 1.642 0.470
0.6 2.277 0.582
0.7 2.775 0.620
0.8 2.988 0.743
0.9 3.425 1.025
26
Lampiran 5 Analisis kinetika SOD dalam ekstrak E. coli terimobilisasi dengan
metode Lineweaver-Burk
Metode Lineweaver & Burk
27
Metode Eadie-Hofstee
Kinetika SOD dalam ekstrak E. coli terimobilisasi mengikuti alur
28
Lampiran 6 Analisis kinetika SOD dalam ekstrak E. coli tanpa imobilisasi dengan
metode Lineweaver-Burk
Metode Lineweaver & Burk
29
Metode Eadie-Hofstee
Kinetika SOD dalam ekstrak E. coli tanpa imobilisasi mengikuti alur
30
Lampiran 7 Stabilitas biosensor antioksidan berbasis SOD dari ekstrak E. coli
pada suhu ruang (28 °C)
Waktu (jam)
Aktivitas Antioksidan Ekstrak E. coli
+ Zeolit Tanpa Zeolit
I (µA) (%) I (µA) (%)
0 1.037 100.00 0.840 100.00
2 0.948 91.42 0.635 75.59
4 0.922 88.91 0.492 58.57
6 0.602 58.05 0.358 42.62
10 0.588 56.70 0.178 21.19
31
RIWAYAT HIDUP
Penulis dilahirkan di Kelapa Kampit, Belitung Timur pada 28 Juli 1990 dari Ayah Rusli Derasad dan Ibu Haironi. Penulis merupakan anak keempat dari lima bersaudara.
Tahun 2008 penulis lulus dari SMA Negeri 1 Kelapa Kampit, Belitung Timur dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Beasiswa Utusan Daerah (BUD). Penulis memilih Program Studi Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, IPB.
Selama mengikuti perkuliahan, penulis pernah menjadi asisten praktikum Kimia Organik Layanan ITP 2010/2011 dan Kimia Lingkungan 2011/2012 dan 2012/2013. Penulis pernah melaksanakan praktik lapangan dari Juli hingga Agustus 2011 di Laboratorium Biorekayasa Lingkungan, Bioproses, Pusat
Penelitian Bioteknologi LIPI Cibinong dengan judul “Ekstraksi dan Karakterisasi