PROFIL PERTUMBUHAN DAN KANDUNGAN GLIKOSIDA JANTUNG KALUS DAUN KAMBOJA JEPANG (Adenium obesum (Forssk.) Roem. &
Schult.) DALAM WOODY PLANT MEDIUM DENGAN VARIASI KONSENTRASI ASAM 2,4-DIKLOROFENOKSIASETAT DAN
6-FURFURYLAMINOPURINE
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh :
Lukas Eko Widyasmoro NIM : 028114024
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
PROFIL PERTUMBUHAN DAN KANDUNGAN GLIKOSIDA JANTUNG KALUS DAUN KAMBOJA JEPANG (Adenium obesum (Forssk.) Roem. &
Schult.) DALAM WOODY PLANT MEDIUM DENGAN VARIASI KONSENTRASI ASAM 2,4-DIKLOROFENOKSIASETAT DAN
6-FURFURYLAMINOPURINE
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh :
Lukas Eko Widyasmoro NIM : 028114024
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
2007
HALAMAN PERSEMBAHAN
“O Marie, conçue sans pêche priez pour nous qui avons
recours avous”
(“O Mary, conceived without sin, pray for us who have recourse to thee”)
Karyaku ini kupersembahkan ‘tuk:
My Shepherd Jesus & My Mother Mary;
Keluargaku;
My folks;
dan Almamaterku.
KATA PENGANTAR
Syukur kepada Tuhan Yang Maha Esa yang telah melimpahkan rahmat
dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul
“Profil Pertumbuhan dan Kandungan Glikosida Jantung Kalus Daun Kamboja Jepang (Adenium obesum (Forssk.) Roem. & Schult.) dalam Woody Plant Medium dengan Variasi Konsentrasi Asam 2,4-diklorofenoksiasetat dan 6-furfurylaminopurine” dengan baik. Deo Gracias.
Penyusunan skripsi ini dimaksudkan untuk memenuhi salah satu syarat
memperoleh gelar Sarjana Farmasi (S.Farm.) di Fakultas Farmasi Universitas
Sanata Dharma Yogyakarta.
Penulis menyadari bahwa penulisan skripsi ini bukanlah hal yang
mudah. Penulis banyak mendapatkan bantuan dan dukungan dari berbagai pihak
sehingga penulis mampu menyelesaikan skripsi ini. Oleh karena itu, penulis ingin
mengucapkan terima kasih kepada:
1. Kedua orang tuaku, atas pengorbanan, doa, kesabaran, dan dukungan yang
telah diberikan.
2. Ibu Rita Suhadi, M.Si., Apt., selaku Dekan Fakultas Farmasi Universitas
Sanata Dharma Yogyakarta.
3. Bapak Ign. Y. Kristio Budiasmoro, M.Si., selaku dosen pembimbing utama
yang telah meluangkan waktu dan tenaga untuk membimbing dan memotivasi
serta memberikan kritik dan saran dalam penyusunan skripsi ini.
4. Ibu Erna Tri Wulandari, M.Si., Apt., selaku dosen penguji yang telah
memberikan kritik dan saran dalam penyusunan skripsi ini.
5. Bapak Yohanes Dwiatmaka, M.Si., selaku dosen penguji yang telah
memberikan kritik dan saran dalam penyusunan skripsi ini.
6. Romo Drs. P. Sunu Hardiyanta, S.Si., S.J., yang telah memberikan doa dan
dukungan kepada penulis selama penyusunan skripsi.
7. Seluruh dosen Fakultas Farmasi yang telah memberikan dukungan kepada
penulis baik selama kuliah maupun selama penyusunan skripsi ini.
8. Laboran Fakultas Farmasi, khususnya laboran Laboratorium Biologi di lantai
3: Mas Sigit, Mas Wagiran, Mas Andri, dan Mas Sarwanto yang telah
membantu penulis selama mengerjakan skripsi di laboratorium.
9. Teman-teman Fakultas Farmasi angkatan 2002 terutama kelas A, terima kasih
atas semua persahabatan dan kenangannya....
10.Teman-teman Fakultas Farmasi angkatan 2002 kelompok praktikum A, terima
kasih atas semua kerjasama dan kekompakannya.
11.Para pendahulu di Laboratorium Kultur Jaringan: Ratna, Mina, Christin, dan
Vero, terima kasih atas semua bantuan dan wejangannya ya.... Untuk Ratna,
terima kasih atas pinjaman skripsi dan bukunya ya.
12.Kompatriotku di Laboratorium Kultur Jaringan: Melissa, Donny, dan Vicky,
terima kasih atas bantuan dan kerjasamanya selama nge-lab. Thank U very
much, folks!
13.Teman-teman 2003: Ratih, Vian, Rosa, Vera, Irwan. Terima kasih atas
perhatian, dukungan, dan semangatnya! Untuk Ratih, terima kasih sudah jadi
sie konsumsiku saat ujian.
14.Sisa-sisa 2002: Theodorus ‘Gopa’, ‘MasDanu’ Kusuma, Benediktus ‘Suprex’,
‘Kobo’ Hendra, ‘Ancol’. Mari kita susul yang lain!
15.Eks-de Britto 2002: Yusuf ‘Kirmanta’, Yuda ‘TG’, ‘Adhit’ Nugraha Arisadha,
‘BenBen’ Sugientoro, ‘Koh Pingping’ Mahardika, Adhistyawan ‘Kobo’. Viva
‘Man for others’!
16.Teman-teman di kos ‘exGriffindor’: Adrianus ‘Nawamiri’, Vincencius
‘Anno’, Heribertus ‘Kumal’, Adhistyawan ‘Kobo’, Theodorus ‘Gopa’. Terima
kasih atas semua kebersamaan, bantuan (tempat, komputer, printer, dan
tenaga), dan dorongan semangatnya. Thanks bro!!
17.Keluarga besar Squadra Viola, terima kasih atas perhatian dan semangatnya.
18.Semua pihak yang tidak dapat penulis sebutkan satu per satu.
Akhirnya, penulis menyadari bahwa tidak ada yang sempurna di dunia
ini. Skripsi ini pun masih belum sempurna karena adanya keterbatasan waktu,
tenaga, dan pikiran. Oleh karena itu, penulis sangat mengharapkan saran dan
kritik agar skripsi ini makin sempurna dan berguna bagi ilmu pengetahuan.
Yogyakarta, 22 Desember 2007
Penulis
INTISARI
Tanaman kamboja jepang (Adenium obesum (Forssk.) Roem. & Schult.) selama ini hanya dikenal sebagai tanaman hias, namun berbagai penelitian menunjukkan bahwa tanaman ini mengandung glikosida jantung. Di berbagai negara, kamboja jepang sudah digunakan dalam pengobatan tradisional. Teknik kultur jaringan dapat digunakan untuk mendapatkan glikosida yang optimum dari tanaman. Penelitian ini bertujuan untuk memperoleh informasi mengenai pola pertumbuhan kalus daun kamboja jepang serta membandingkan profil kromatografi lapis tipis (KLT) ekstrak kalus daun kamboja jepang dengan ekstrak daun kamboja jepang dan standar digitoksin.
Penelitian ini merupakan penelitian eksperimental murni dengan menggunakan rancangan acak lengkap pola searah. Daun tanaman kamboja jepang ditanam pada Woody Plant Medium (WPM) dengan variasi konsentrasi zat pengatur tumbuh asam 2,4-diklorofenoksiasetat (2,4-D) dan
6-furfurylaminopurine (FAP). Penelitian dilakukan dengan mengamati waktu
inisiasi kalus, pertambahan bobot kalus basah, susut pengeringan, dan membandingkan profil KLT kalus daun kamboja jepang dengan ekstrak daun kamboja jepang dan standar digitoksin.
Hasil penelitian menunjukkan bahwa waktu inisiasi kalus tercepat adalah pada medium WPM 3, yaitu medium WPM dengan konsentrasi 2,4-D sebesar 2 ppm dan FAP sebesar 1 ppm. Pertumbuhan kalus yang optimum juga terjadi pada medium WPM 3. Fase lag terjadi pada hari ke-4 sampai hari ke-20, fase eksponensial terjadi pada hari ke-20 sampai hari ke-28, dan fase stasioner terjadi setelah hari ke-28. Kalus daun kamboja jepang menunjukkan profil KLT yang mirip dengan ekstrak daun kamboja jepang dan standar digitoksin.
Kata kunci: daun kamboja jepang, glikosida jantung, 2,4-D, FAP, WPM
ABSTRACT
So far desert rose (Adenium obesum (Forssk.) Roem. & Schult.) is known as an ornamental plant, but many research shows that this plant contains cardiac glycoside. In many countries, desert rose has been used in traditional medications. Tissue culture technique can be used to obtain optimum glycoside from the plant. This research is intended to find out the information about the growth profile of the callus of desert rose’s leaf and to compare the thin layer chromatography (TLC) profile of the extract of callus of desert rose’s leaf with the extract of desert rose’s leaf and digitoxin standard.
This research is a pure experimental research which uses a complete device of one-way pattern. Desert rose’s leaf was planted in a Woody Plant Medium (WPM) with the variations of plant growth substance 2,4-dichlorophenoxyacetic acid (2,4-D) and 6-furfurylaminopurine (FAP). This research was carried out by observing the callus initiation time, the callus’ wet weight increase, the callus’ dry weight decrease, and comparing the TLC profile of extract of callus of desert rose’s leaf with the extract of desert rose’s leaf and digitoxin standard.
The results of this research show that the fastest callus initiation time was in WPM 3 medium, which contain 2 ppm 2,4-D and 1 ppm FAP. The optimum callus growth also occurs in WPM 3 medium. Lag phase occurs from day 4 until day 20, exponential phase occurs from day 20 until day 28, and stationary phase occurs after day 28. The callus of kamboja jepang’s leaf has the similar TLC profile as the extract of desert rose’s leaf and digitoxin standard.
Key words: desert rose’s leaf, cardiac glycoside, 2,4-D, FAP, WPM
DAFTAR ISI
Halaman
HALAMAN JUDUL ...
HALAMAN PERSETUJUAN PEMBIMBING ...
HALAMAN PENGESAHAN ...
HALAMAN PERSEMBAHAN ...
KATA PENGANTAR ...
PERNYATAAN KEASLIAN KARYA ...
INTISARI ...
1. Rumusan permasalahan ...
2. Keaslian penelitian ...
3. Manfaat penelitian ...
B. Tujuan Penelitian ...
BAB II. PENELAAHAN PUSTAKA ... A. Uraian Tanaman Kamboja Jepang ...
2. Nama ilmiah ...
3. Morfologi ...
4. Khasiat ...
5. Kandungan Kimia ...
B. Kultur Jaringan Tanaman ...
1. Pengertian ...
2. Media kultur ...
3. Eksplan ...
4. Kalus ...
5. Sterilisasi ...
6. Penanaman eksplan ...
7. Subkultur ...
8. Pertumbuhan kalus ...
C. Glikosida Jantung ...
D. Kromatografi Lapis Tipis ...
E. Landasan Teori ...
F. Hipotesis ...
BAB III. METODOLOGI PENELITIAN ... A. Jenis dan Rancangan Penelitian ...
B. Variabel Penelitian dan Definisi Operasional ...
1. Variabel utama ...
2. Variabel pengacau terkendali ...
3. Variabel pengacau tidak terkendali ...
4. Definisi operasional ...
C. Alat dan Bahan Penelitian ...
1. Alat penelitian ...
2. Bahan penelitian ...
D. Tata Cara Penelitian ...
1. Determinasi tanaman ...
2. Pembuatan stok ...
3. Pembuatan media ...
4. Sterilisasi alat dan ruangan ...
5. Sterilisasi dan penanaman eksplan ...
6. Pengamatan waktu inisiasi kalus ...
7. Subkultur ...
8. Pemanenan ...
9. Analisis pertumbuhan kalus ...
10.Pengeringan dan pembuatan serbuk daun kamboja jepang ...
11.Uji tabung ...
12.Pembuatan ekstrak kalus daun kamboja jepang ...
13.Pembuatan ekstrak kalus daun kamboja jepang yang dihidrolisis
14.Pembuatan ekstrak daun kamboja jepang ...
15.Pembuatan standar digitoksin ...
16.Uji KLT ekstrak kalus, ekstrak daun kamboja jepang dan
larutan standar digitoksin ...
1. Analisis menggunakan grafik pertumbuhan kalus berdasarkan
data penimbangan bobot kalus basah dengan umur kalus ...
2. Analisis menggunakan grafik pertumbuhan kalus berdasarkan
data biomassanya ...
BAB IV. HASIL DAN PEMBAHASAN ... A. Determinasi Tanaman Kamboja Jepang ...
B. Pemilihan dan Penanaman Eksplan ...
C. Waktu Inisiasi Kalus ...
D. Subkultur dan Panen ...
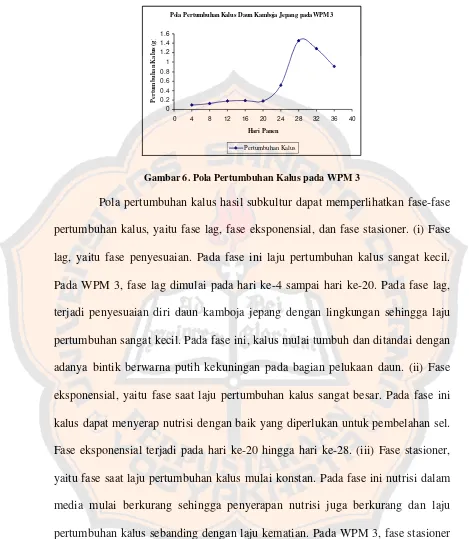
E. Profil Pertumbuhan Kalus ...
F. Susut Pengeringan Kalus ...
G. Analisis Kandungan Kimia Kalus ...
BAB V. KESIMPULAN DAN SARAN ... A. Kesimpulan ...
B. Saran ...
DAFTAR PUSTAKA ...
LAMPIRAN ...
BIOGRAFI PENULIS ...
DAFTAR TABEL
Waktu inisiasi kalus pada WPM 2 ...
Waktu inisiasi kalus pada WPM 3 ...
Hasil pengamatan KLT dengan fase diam silika gel GF254
dan fase gerak etil asetat-metanol-air (81 : 11 : 8 v/v ) ...
Hasil pengamatan KLT ekstrak kalus WPM 2 dan WPM 3
Hasil penimbangan bobot kalus dengan pemanenan pada
WPM 2 ...
Penentuan susut pengeringan pada WPM 2 ...
Hasil penimbangan bobot kalus dengan pemanenan pada
WPM 3 ...
DAFTAR GAMBAR
Struktur dasar bufadienolida dan kardenolida ...
Eksplan dalam bentuk irisan melintang daun ...
Inisiasi kalus ...
Kalus daun kamboja jepang hasil subkultur ...
Pola Pertumbuhan Kalus pada WPM 2 ...
Pola Pertumbuhan Kalus pada WPM 3 ...
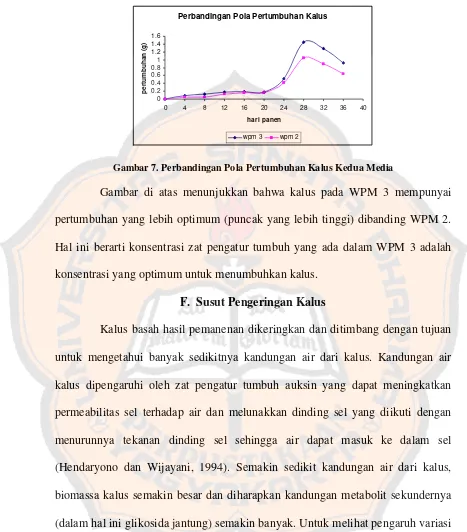
Perbandingan Pola Pertumbuhan Kalus Kedua Media ...
Perbandingan susut pengeringan kalus pada kedua media .
Kromatogram glikosida jantung kalus daun kamboja
jepang, ekstrak daun kamboja jepang tanaman asal dan
standar digitoksin setelah disemprot dengan pereaksi
Kedde ...
Kromatogram glikosida jantung kalus daun kamboja
jepang, ekstrak daun kamboja jepang tanaman asal dan
standar digitoksin setelah disemprot dengan pereaksi
SbCl3 ...
Kromatogram ekstrak kalus daun kamboja jepang WPM 2
Kromatogram ekstrak kalus daun kamboja jepang WPM 3
Foto tanaman kamboja jepang (Adenium obesum (Forssk.)
Roem. & Schult.) ...
Gambar 15
Foto KLT dengan fase diam silika gel GF254, fase gerak
etil asetat-metanol-air (81 : 11 : 8 v/v), pada pengamatan
dengan sinar tampak ...
Foto KLT dengan fase diam silika gel GF254, fase gerak
etil asetat-metanol-air (81 : 11 : 8 v/v), pada pengamatan
dengan sinar UV 254 nm ...
Foto KLT dengan fase diam silika gel GF254, fase gerak
etil asetat-metanol-air (81 : 11 : 8 v/v), pada pengamatan
dengan sinar UV 365 nm ...
Foto KLT dengan fase diam silika gel GF254, fase gerak
etil asetat-metanol-air (81 : 11 : 8 v/v), deteksi penampak
bercak penyemprot pereaksi Kedde ...
Foto KLT dengan fase diam silika gel GF254, fase gerak
etil asetat-metanol-air (81 : 11 : 8 v/v); deteksi penampak
bercak penyemprot antimon-triklorida (SbCl3), 100˚C
selama 6 menit ...
Foto KLT WPM 2 dengan fase diam silika gel GF254,
fase gerak etil asetat-metanol-air (81 : 11 : 8 v/v), pada
pengamatan dengan sinar UV 254 nm ...
Foto KLT WPM 3 dengan fase diam silika gel GF254, fase
gerak etil asetat-metanol-air (81 : 11 : 8 v/v), pada
DAFTAR LAMPIRAN
Halaman
Lampiran 1
Lampiran 2
Lampiran 3
Lampiran 4
Surat Keterangan Determinasi ...
Foto-foto Hasil Penelitian ...
Data-data Penelitian ...
Komposisi Woody Plant Medium ... 78
79
87
91
BAB I PENGANTAR
A. Latar Belakang
Kamboja jepang (Adenium obesum (Forssk.) Roem. & Schult.)
merupakan jenis tanaman sukulen atau tanaman yang mengandung banyak air
dengan ciri utama adalah batang tanaman digunakan untuk menyimpan air.
Adenium obesum, termasuk suku Apocynaceae, juga dikenal sebagai mawar gurun
(desert rose) (Beikram dan Andoko, 2003; Ranger, 1996). Selama ini kamboja
jepang digunakan sebagai tanaman hias dan secara tradisional digunakan untuk
membantu proses kelahiran. Penduduk asli Afrika bagian timur menggunakan
tanaman ini sebagai racun ikan dan anak panah (Ranger, 1996) serta digunakan
untuk pengobatan gonorrhoea (Nakamura et al, 2000).
Dalam penelitiannya, Nakamura et al (2000) telah berhasil mengisolasi
dan mengidentifikasi 4 senyawa dari daun Adenium yang diduga berperan dalam
aktivitas sitotoksisnya. Atawodi (2005) dan Freiburghaus et al (1996) telah
meneliti ekstrak akar dan kulit batang kamboja jepang yang ternyata berpotensi
sebagai agen terapeutik untuk pengobatan trypanosomiasis. Penelitian yang
dilakukan oleh Yamauchi dan Abe (1990) menunjukkan bahwa Adenium obesum
mengandung oleandrigenin beta-gentiobiosyl-beta-D-thevetoside sebagai
glikosida yang utama. Selain itu, kamboja jepang juga memiliki kandungan
senyawa glikosida yang mirip digitalis/digitoksin (Melero et al, 2000). Di Afrika
dan Asia banyak ditemukan terjadinya kasus cardiac toxicity yang disebabkan
oleh kandungan racun panah yang mengandung latex dari tumbuhan
Apocynaceae, yang dikombinasikan dengan iritator untuk memfasilitasi difusi
racun ke dalam jaringan (Brunetton, 1999).
Produk-produk metabolit sekunder kebanyakan diperoleh secara
komersial dengan cara diisolasi dari tanaman, dan ini menimbulkan permasalahan
dengan terbatasnya sumber-sumber bahan baku untuk diisolasi. Oleh karena itu
diperlukan alternatif dalam usaha penyediaan metabolit sekunder tanaman. Salah
satu alternatif tersebut adalah melalui teknik kultur jaringan tanaman. Metode
kultur jaringan dapat dipakai untuk produksi metabolit sekunder yang selanjutnya
dapat disintesis menjadi senyawa murni dalam bidang industri obat (Suryowinoto,
1992).
Penelitian ini merupakan rangkaian dari penelitian yang dilakukan oleh
Wijaya (2007) dan Chandra (2007). Wijaya (2007) telah berhasil menumbuhkan
kalus yang berasal dari daun kamboja jepang dalam medium tumbuh
Murashige-Skoog (MS) dengan penambahan zat pengatur tumbuh (ZPT) 2,4-D sebanyak 4
ppm. Pada penelitian tersebut diperoleh 2 senyawa pada ekstrak kalus daun
kamboja jepang yang mirip dengan senyawa yang terkandung di dalam ekstrak
daun kamboja jepang dan ekstrak daun Nerium olender L. yang diduga sebagai
glikosida jantung. Chandra (2007) juga berhasil menumbuhkan kalus yang berasal
dari daun kamboja jepang meskipun dengan medium tumbuh yang berbeda, yaitu
medium Gamborg, dan dengan penambahan 2 variasi konsentrasi 2,4-D dan FAP.
Pada penelitian tersebut diperoleh 1 senyawa pada ekstrak kalus daun kamboja
kamboja jepang dan standar digitoksin yang diduga sebagai glikosida jantung.
Oleh karena itu, penelitian ini diharapkan dapat menumbuhkan kalus yang berasal
dari daun kamboja jepang dan dari kalus yang dihasilkan diperoleh senyawa
glikosida jantung seperti pada tanaman asalnya. Media tumbuh yang digunakan
dalam penelitian ini adalah Woody Plant Medium (WPM) karena menurut
Hendaryono dan Wijayani (1994) media WPM cocok sebagai media kultur untuk
membudidayakan tanaman berkayu. Penelitian ini menggunakan 2 variasi
konsentrasi 2,4-D dan FAP untuk membandingkan pertumbuhan kultur kalus dan
susut pengeringan kalus yang dihasilkan.
Penelitian ini bertujuan untuk mengkulturkan tanaman kamboja jepang
dari bagian daun serta mengidentifikasi metabolit sekunder glikosida jantung yang
dihasilkan oleh kalus yang dibentuk dari hasil budidaya in vitro.
1. Rumusan Permasalahan
Berdasarkan latar belakang yang telah disebutkan di atas, dapat
dirumuskan permasalahan sebagai berikut :
a. Apakah eksplan yang berasal dari daun kamboja jepang dapat
menghasilkan kalus jika dikembangkan secara in vitro dalam media
tumbuh Woody Plant Medium (WPM)?
b. Bagaimana profil pertumbuhan kalus daun kamboja jepang yang
dikulturkan?
c. Apakah kalus daun kamboja jepang hasil budidaya in vitro dapat
2. Keaslian Penelitian
Sejauh penelusuran pustaka yang dilakukan penulis, penelitian tentang
profil pertumbuhan dan kandungan glikosida jantung kalus daun kamboja jepang
(Adenium obesum (Forssk.) Roem. & Schult.) dalam Woody Plant Medium
dengan variasi konsentrasi asam 2,4-diklorofenoksiasetat dan
6-furfurylaminopurine belum pernah diteliti.
Penelitian ilmiah menggunakan tanaman kamboja jepang yang pernah
dilakukan antara lain :
a. Wijaya (2007) telah melakukan penelitian tentang profil pertumbuhan dan
kandungan glikosida jantung dari kalus daun kamboja jepang (Adenium
obesum (Forssk.) Roem. & Schult.) dalam media tumbuh Murashige-Skoog.
b. Chandra (2007) telah melakukan penelitian tentang profil pertumbuhan dan
analisis kualitatif glikosida jantung kalus daun kamboja jepang (Adenium
obesum (Forssk.) Roem. & Schult.) dalam media tumbuh Gamborg dengan
variasi konsentrasi asam 2,4-diklorofenoksiasetat dan 6-furfurylaminopurine.
3. Manfaat Penelitian
a. Manfaat teoritis
Penelitian ini diharapkan dapat bermanfaat dalam mengembangkan ilmu
kefarmasian terutama dalam hal teknik penghasilan glikosida jantung dari
tanaman, khususnya tanaman kamboja jepang, secara in vitro menggunakan
b. Manfaat praktis
Penelitian ini sebagai penelitian awal tentang produksi glikosida jantung
dari tanaman dengan teknik kultur jaringan sehingga mempunyai kemungkinan
untuk digunakan sebagai alternatif penyediaan obat jantung.
B. Tujuan Penelitian
Tujuan penelitian ini adalah :
a. Menumbuhkan kalus dari eksplan daun kamboja jepang.
b. Mengetahui profil pertumbuhan kalus daun kamboja jepang.
c. Membuktikan bahwa ekstrak kalus daun kamboja jepang hasil budidaya in
BAB II
PENELAAHAN PUSTAKA A. Uraian Tanaman Kamboja Jepang 1. Nama Daerah/Nama Lain
Kamboja jepang, semboja jepang, desert rose, Mock azalea, Pink
Begonia, Sabi Star, Kudu (Anonim, 2006a).
2. Nama Ilmiah
Tanaman kamboja jepang (Adenium obesum (Forssk.) Roem. &
Schult.) termasuk famili Apocynaceae. Sinonim tanaman kamboja jepang ini
adalah Plumeria rubra L.cv. acutifolia (Anonim, 2006b).
3. Morfologi
Kamboja jepang (Adenium obesum (Forssk.) Roem. & Schult.)
merupakan jenis tanaman sukulen atau tanaman yang mengandung banyak air
dengan ciri utama adalah batang tanaman digunakan untuk menyimpan air.
Adenium merupakan tumbuhan asli Afrika dan biasanya ditemukan di gurun
pasir Afrika dan Jazirah Arab, namun juga ditemukan di kawasan Asia
(Ranger, 1996).
Secara morfologis tanaman kamboja jepang (Adenium obesum (Forssk.)
Roem. & Schult. ) memiliki akar yang mampu membesar seperti umbi dan
diselimuti oleh rambut-rambut akar yang sangat banyak; daunnya berbentuk
lanset dengan ujung membulat, tebal dan berserat, berwarna hijau, tampak
mengkilap dan licin; bunganya berwarna merah muda sampai merah tua,
memiliki 5 helai mahkota bunga yang bagian tengahnya berwarna putih;
buahnya tumbuh secara berpasangan, terletak di ujung tunas, berbentuk pipih
panjang, berwarna hijau waktu masih muda dan kemudian berangsur-angsur
berubah menjadi cokelat; bijinya berada dalam buah, berwarna cokelat.
Tanaman ini dapat tumbuh hingga dua meter(Soenanto, 2005).
4. Khasiat
Selama ini kamboja jepang digunakan sebagai tanaman hias dan secara
tradisional digunakan untuk membantu proses kelahiran. Penduduk asli Afrika
bagian timur menggunakan tanaman ini sebagai racun ikan dan anak panah
(Ranger, 1996) serta digunakan untuk pengobatan gonorrhoea (Nakamura et
al, 2000). Ekstrak kulit batang Adenium obesum berpotensi sebagai acaricidal
(Mgbojikwe dan Okoye, 2001). Ekstrak dari tanaman ini juga menunjukkan
sifat sitotoksis (Nakamura et al, 2000). Atawodi (2005) dan Freiburghaus et al
(1996) telah meneliti ekstrak akar dan kulit batang kamboja jepang yang
ternyata berpotensi sebagai agen terapeutik untuk pengobatan
trypanosomiasis.
5. Kandungan Kimia
Tanaman kamboja jepang mengandung glikosida jantung dengan
kandungan utama berupa oleandrigenin, beta-gentiobiosyl-beta-D-thevetoside,
neridienone A dan 16,17-dihydroneridienone A (Yamauchi dan Abe, 1990).
Kamboja jepang juga memiliki kandungan senyawa glikosida yang mirip
digitalis (Melero et al, 2000), ekugin, kardenolida, honghelosida A,
16-asetilstrospesida, asam dihidroifflaionik, flavonol, 3-O-metil kaemferol,
B. Kultur Jaringan Tanaman 1. Pengertian
Kultur jaringan adalah teknik budidaya tanaman dengan menggunakan
potongan kecil sel, jaringan atau organ yang dipelihara dalam satu medium
dan dalam kondisi aseptik atau bebas mikroorganisme (Katuuk, 1989; Santoso
dan Nursandi, 2002). Usaha pengembangan tanaman dengan teknik kultur
jaringan merupakan usaha perbanyakan tanaman secara vegetatif. Di bidang
farmasi, teknik kultur jaringan sangat menguntungkan karena dapat
menghasilkan metabolit sekunder untuk keperluan obat-obatan dalam jumlah
yang besar dan dalam waktu yang singkat (Hendaryono dan Wijayani, 1994).
Ide memperbanyak tanaman dengan cara mengulturkan bagian kecil
jaringan atau organ ini berdasarkan teori sel yang dikemukakan oleh Schleiden
dan Schwann, yaitu bahwa sel merupakan satuan struktur, fungsional, dan
hereditas terkecil dari makhluk hidup sehingga dapat tumbuh dan berkembang
menjadi suatu individu yang normal. Sel juga mempunyai kemampuan
totipotensi, yaitu kemampuan setiap sel, dari mana saja sel tersebut diambil,
yang apabila ditumbuhkan pada lingkungan yang sesuai akan tumbuh dan
berkembang menjadi tanaman lengkap yang baru (Hendaryono dan Wijayani,
1994; Santoso dan Nursandi, 2002).
Ada beberapa keuntungan dari teknik kultur jaringan, antara lain:
a. Kandungan–kandungan zat yang berguna dapat diproduksi di bawah kondisi
yang terkontrol, terbebas dari perubahan iklim dan keadaan tanah.
c. Sel-sel kebanyakan tumbuhan mudah untuk berkembangbiak dalam
menghasilkan metabolit-metabolit yang spesifik.
d. Kontrol automatis dari pertumbuhan sel dan proses pengaturan metabolit yang
rasional dalam bioreaktor akan mengurangi biaya tenaga kerja dan
meningkatkan produktivitas.
e. Substansi organik dapat diekstrak dari kultur kalus. (Dicosmo dan Misawa,
1995)
Teknik kultur jaringan dapat berhasil dengan baik apabila syarat-syarat
yang diperlukan terpenuhi, yaitu meliputi pemilihan eksplan sebagai bahan
dasar untuk pembentukan kalus, penggunaan medium yang cocok, keadaan
yang aseptik, dan pengaturan udara yang baik terutama untuk kultur cair.
Kultur kalus adalah teknik budidaya kalus tanaman dalam suatu
lingkungan terkendali dan dalam keadaan aseptik atau bebas mikroorganisme.
Kultur kalus ini bertujuan untuk memperoleh kalus dari eksplan yang diisolasi
dan ditumbuhkan dalam lingkungan terkendali (Santoso dan Nursandi, 2002).
2. Media kultur
Media kultur merupakan salah satu faktor penentu keberhasilan
perbanyakan tanaman secara kultur jaringan. Berbagai komposisi media kultur
telah diformulasikan untuk mengoptimalkan pertumbuhan dan perkembangan
tanaman yang dikulturkan. Murashige dan Skoog memublikasikan formulasi
media MS (singkatan dari Murashige dan Skoog) yang sampai sekarang
terbukti cocok untuk kultur jaringan banyak tanaman dan banyak digunakan di
Media kultur dapat berbentuk cair atau padat. Media cair merupakan
campuran komponen-komponen zat kimia dengan air suling (Hendaryono dan
Wijayani, 1994), sedangkan media berbentuk padat merupakan media cair
dengan penambahan pemadat media seperti agar-agar (Yusnita, 2003).
Jaringan yang dikulturkan memerlukan unsur hara makro dan unsur
hara mikro dari dalam media tumbuh. Media kultur juga harus mengandung
bahan-bahan lain yang berguna untuk merangsang pertumbuhan serta
perkembangan sel jaringan yang dikulturkan. Pemisahan eksplan dari tanaman
induk menyebabkan perubahan biosintesis di dalam eksplan tersebut, sehingga
perlu diberikan unsur hara ke dalam media kultur untuk membantu eksplan
supaya dapat tumbuh dan berkembang. Bahan-bahan itu adalah bahan-bahan
organik yang meliputi karbohidrat, vitamin, asam amino, serta zat pengatur
pertumbuhan (Katuuk, 1989).
a. Air
Air memegang peranan yang sangat penting dalam proses pengulturan
karena 95% dari media kultur terdiri dari air. Air yang digunakan adalah air
distilata (akuades) atau air distilata ganda (akuabides). Air ledeng atau air
sumur sebaiknya tidak digunakan karena mengandung sejumlah kontaminan
(substansi atau mikroorganisme) yang dapat merusak proses perkembangan
kultur eksplan. Air suling disimpan dalam kondisi steril dengan tidak memberi
peluang pada bakteri untuk hidup dan berkembang (Katuuk, 1989; Yusnita,
b. Garam-garam anorganik
Kebutuhan nutrisi mineral untuk tanaman yang dikulturkan secara in
vitro pada dasarnya sama dengan kebutuhan nutrisi tanaman yang
ditumbuhkan di tanah. Kebutuhan nutrisi yang berupa unsur makro dan mikro
diberikan melalui akar, yaitu dengan menambahkan unsur-unsur tersebut pada
medium agar. Unsur makro adalah unsur yang dibutuhkan tanaman dalam
jumlah banyak, sedangkan unsur mikro dibutuhkan tanaman dalam jumlah
sedikit. Fungsi dari unsur-unsur mikro belum diketahui secara pasti, namun
ketidakhadiran unsur mikro dapat menyebabkan kelainan pertumbuhan
(Katuuk, 1989).
Unsur-unsur yang termasuk unsur makro antara lain:
1) Nitrogen (N)
Kegunaan nitrogen pada tanaman adalah untuk meningkatkan daya
tumbuh tanaman karena unsur N dapat membentuk protein, lemak,
klorofil, alkaloid, hormon tanaman, dan asam amino. Kekurangan N akan
menyebabkan daun berwarna kuning dan pertumbuhan terganggu.
Sebaliknya, terlalu banyak N akan mengakibatkan perkembangan vegetatif
lebih besar daripada perkembangan buah (Katuuk, 1989; Hendaryono dan
Wijayani, 1994).
2) Fosfor (P)
Fosfor dibutuhkan tanaman untuk pembentukan karbohidrat dengan
cara mengikat fosfat. Terlalu banyak fosfor dalam media akan
unsur lainnya seperti seng, besi, dan tembaga (Katuuk, 1989; Hendaryono
dan Wijayani, 1994; Santoso dan Nursandi, 2002).
3) Kalium (K)
Kalium berfungsi memperkuat tubuh tanaman karena kalium dapat
menguatkan serabut-serabut akar sehingga daun, bunga, dan buah tidak
mudah gugur. Di samping itu, kalium juga berfungsi dalam pembelahan
sel, memperlancar metabolisme, dan mempengaruhi penyerapan makanan
(Hendaryono dan Wijayani, 1994).
4) Kalsium (Ca)
Kalsium terdapat dalam batang dan daun tanaman. Kalsium bertugas
dalam merangsang pembentukan bulu-bulu akar, mengeraskan batang, dan
merangsang pembentukan biji karena kalsium bersama-sama dengan
magnesium akan memproduksi cadangan makanan (Hendaryono dan
Wijayani, 1994).
5) Magnesium (Mg)
Magnesium merupakan elemen utama dalam molekul klorofil.
Penambahan magnesium dalam tanaman akan meningkatkan kandungan
fosfat dalam tanaman. Fosfat digunakan sebagai bahan mentah dalam
pembentukan sejumlah protein yang akan menyempurnakan pertumbuhan
daun dan membentuk karbohidrat, lemak, serta minyak-minyak
6) Sulfur (S)
Sulfur merupakan unsur yang penting untuk pembentukan beberapa
jenis protein, seperti asam amino dan vitamin B1. Sulfur juga berperan
dalam pembentukan bintil-bintil akar dan membantu pembentukan anakan
sehingga pertumbuhan dan ketahanan tanaman terjamin (Hendaryono dan
Wijayani, 1994).
Unsur-unsur yang termasuk unsur mikro antara lain:
1) Besi (Fe)
Besi dibutuhkan lebih banyak daripada unsur mikro lainnya. Dalam
media kultur, besi diberikan dalam bentuk FeSO4 dan dicampurkan
terlebih dahulu dengan garam ethylene diamine tetraasetic acid (EDTA).
Besi tidak boleh dicampurkan langsung ke dalam media karena besi
bersifat tidak larut dalam air sehingga dapat menimbulkan endapan yang
menyebabkan besi tidak dapat digunakan oleh jaringan atau kultur. Cara
untuk mengatasi hal ini adalah dengan menambahkan chelating agent yang
akan membungkus ion Fe sehingga dapat bercampur rata dengan larutan
(Katuuk, 1989; Hendaryono dan Wijayani, 1994).
Pemberian besi dalam media kultur jaringan adalah sebagai
penyangga kestabilan pH media selama digunakan untuk menumbuhkan
jaringan tanaman. Pada tanaman, besi berfungsi dalam pernafasan dan
2) Tembaga (Cu)
Tembaga berperan sebagai bagian dari enzim, ikut ambil bagian
dalam proses fotosintesis dan pembentukan klorofil, ikut pula dalam
aktivitas reduksi nitrit (Santoso dan Nursandi, 2002).
3) Mangan (Mn)
Mangan berperan sebagai aktivator enzim dengan bertindak sebagai
perantara, pembentuk klorofil, dan aktif dalam fotosintesis, metabolisme
protein serta pembentukan vitamin C (Santoso dan Nursandi, 2002).
4) Seng (Zn)
Seng adalah unsur yang berperan penting dalam pembentukan
protoplas. Tanaman yang cukup seng mampu memproduksi auksin IAA
(indole asetic acid) endogenus, sehingga tidak memerlukan penambahan
auksin sintetik dalam media (Katuuk, 1989).
5) Boron (B)
Boron berperan dalam metabolisme karbohidrat. Kekurangan boron
pada tanaman tertentu akan mengakibatkan kerusakan jaringan, sebaliknya
terlalu banyak boron akan mengakibatkan tanaman mati. Media kultur
yang kekurangan boron akan menyebabkan sintesis sitokinin dalam media
terganggu (Katuuk, 1989; Santoso dan Nursandi, 2002).
6) Molibdenum (Mo)
Molibdenum berguna dalam proses pengikatan nitrogen dari
atmosfer menjadi nitrat dengan bantuan bakteri pengikat nitrogen. Selain
diberikan berlebihan dapat menyebabkan kerusakan jaringan tanaman
(Katuuk, 1989).
7) Kobalt (Co)
Kobalt berguna untuk mengikat nitrogen. Dalam kultur jaringan,
kobalt digunakan untuk pembentukan asam inti (Katuuk, 1989).
8) Iodium (I)
Iodium ditambahkan dalam media sebagai KI. Unsur iodium tidak
terlalu diperlukan dalam media namun sering juga digunakan. Beberapa
asam amino juga mengandung iodium (Katuuk, 1989).
Unsur-unsur makro dan mikro diberikan dalam bentuk garamnya
supaya lebih mudah larut dalam air (Yusnita, 2003). Unsur-unsur makro
biasanya diberikan dalam bentuk NH4NO3, KNO3, CaCl2.2H20, MgSO4.7H2O
dan KH2PO4. Sedangkan unsur-unsur mikro biasa diberikan dalam bentuk
MnSO4.4H2O, ZnSO4.4H2O, H3BO3, KI, NaMo4.2H2O, CuSO4.5H2O dan
CoCl2.6H2O (Hendaryono dan Wijayani, 1994).
Media tumbuh pada kultur jaringan sangat besar pengaruhnya terhadap
pertumbuhan dan perkembangan eksplan serta bibit yang dihasilkannya.
Macam-macam media kultur jaringan telah ditemukan sehingga jumlahnya
cukup banyak. Media tumbuh untuk eksplan berisi kualitatif komponen bahan
media yang hampir sama, hanya agak berbeda dalam besarnya kadar untuk
tiap-tiap senyawa. Medium yang biasa digunakan untuk budidaya tanaman
berkayu adalah medium standar WPM (Woody Plant Medium). Kesulitan yang
‘phenolic compound’ sehingga kalus atau eksplan menjadi berwarna coklat
yang akhirnya tidak tumbuh. Hal ini disebut ‘browning’ (Hendaryono dan
Wijayani, 1994).
c. Vitamin dan Myo-inositol
Vitamin merupakan komponen media yang berpengaruh terhadap
pertumbuhan kalus. Vitamin yang sering digunakan dari kelompok vitamin B,
yaitu tiamin-HCl (vitamin B1), piridoksin-HCl (vitamin B6), asam nikotinat,
dan riboflavin (vitamin B2). Tiamin adalah vitamin yang terpenting untuk
hampir semua kultur jaringan tanaman. Tiamin berfungsi untuk mempercepat
pembelahan sel pada meristem akar, juga berperan sebagai koenzim dalam
reaksi yang menghasilkan energi dari karbohidrat dan memindahkan energi.
Fungsi dari vitamin B6 adalah sebagai ko-enzim yang membantu reaksi kimia
dalam proses metabolisme (Katuuk, 1989). Asam nikotinat juga penting dalam
reaksi-reaksi enzimatik, di samping berperan sebagai prekursor dari beberapa
alkaloid. Vitamin C, seperti asam sitrat dan asam askorbat, kadang-kadang
digunakan sebagai antioksidan untuk mencegah atau mengurangi pencoklatan
atau penghitaman pada permukaan irisan jaringan eksplan (Hendaryono dan
Wijayani, 1994; Yusnita, 2003). Vitamin E berperan untuk memperkuat
pembentukan sel-sel kalus pada tanaman tertentu (Katuuk, 1989).
Myo-inositol merupakan heksitol dan sering digunakan sebagai salah
satu komponen media yang penting karena terbukti merangsang pertumbuhan
jaringan yang dikulturkan dan membantu proses diferensiasi. Bila
mendorong pertumbuhan jaringan kalus (Hendaryono dan Wijayani, 1994;
Yusnita, 2003).
d. Asam amino
Asam-asam amino berperanan penting untuk pertumbuhan dan
diferensiasi kalus. Kebutuhan asam amino untuk setiap tanaman berbeda-beda.
Asparagin dan Glutamin berperan dalam metabolisme asam amino, karena
dapat menjadi pembawa dan sumber amonia untuk sintesis asam-asam amino
baru dalam jaringan (Hendaryono dan Wijayani, 1994).
e. Sumber energi
Pada umumnya, tidak semua sel tanaman yang terisolasi dalam kultur
in vitro bersifat autotrof sehingga tidak dapat menyediakan energi untuk
proses fotosintesis. Kebutuhan akan energi menyebabkan perlunya
penambahan karbohidrat sebagai sumber energi dalam media kultur (Yusnita,
2003). Karbohidrat adalah kimia karbon yang meliputi gula, pati, dan selulosa.
Ada banyak jenis karbohidrat yang dipakai dalam kultur jaringan, namun yang
paling banyak digunakan adalah sukrosa atau D-glukosa (Katuuk, 1989).
f. Zat pengatur tumbuh
Keberadaan hormon dan zat pengatur tumbuh dalam kegiatan kultur
jaringan adalah mutlak karena kegiatan kultur jaringan umumnya
menggunakan bahan tanam yang tidak lazim (sel, jaringan, atau organ) dan
budidayanya adalah budidaya terkendali (Santoso dan Nursandi, 2002).
Hormon adalah zat yang diproduksi dalam tumbuhan itu sendiri dan aktif
kultur jaringan, telah dibuat hormon tumbuhan buatan secara sintetik maupun
melalui fermentasi. Hormon atau zat tersebut dinamakan zat pengatur tumbuh
(Katuuk, 1989). Zat pengatur tumbuh (ZPT) pada tanaman adalah senyawa
organik bukan hara, yang dalam jumlah sedikit dapat mendukung,
menghambat dan dapat mengubah proses fisiologi tumbuhan. ZPT diperlukan
sebagai komponen medium bagi pertumbuhan dan diferensiasi. Tanpa
penambahan ZPT dalam medium, pertumbuhan akan terhambat atau mungkin
tidak tumbuh sama sekali (Hendaryono dan Wijayani, 1994).
Penentuan macam dan konsentrasi hormon dan zat pengatur tumbuh
untuk tujuan kultur tertentu tidak mudah. Diperlukan pengetahuan yang lebih
luas tentang kedua zat tersebut, dan melihat serta mempelajari contoh-contoh
penggunaannya (Santoso dan Nursandi, 2002). Zat pengatur tumbuh yang
sudah dikenal antara lain auksin, sitokinin, adenin, giberelin, etilen, dan
abscicin. Dari semua jenis ZPT tersebut, auksin dan sitokinin adalah yang
paling banyak digunakan (Katuuk, 1989).
1) Auksin
Auksin adalah hormon tanaman yang diproduksi secara alamiah
dalam tubuh tanaman dan juga dapat secara sintesis. Dalam media, auksin
berfungsi untuk merangsang pertumbuhan kalus, perbesaran sel,
pertumbuhan akar, dan mengatur morfogenesis (Katuuk, 1989).
Auksin alamiah yang paling banyak dikenal adalah IAA
(3-indoleasetic acid). Selain IAA dikenal juga auksin sintetik, yaitu NAA (a
(3-indole butyric acid), dan PCPA (P-chlorophenoxy asetic acid) (Katuuk,
1989).
Pengaruh rangsangan auksin terhadap jaringan berbeda-beda. Pada
kadar yang tinggi, auksin lebih bersifat menghambat daripada merangsang
pertumbuhan dan menyebabkan diferensiasi kalus cenderung ke arah
pembentukan primordia akar. Pengaruh auksin terhadap perkembangan sel
menunjukan adanya indikasi bahwa auksin dapat menaikkan tekanan
osmotik, meningkatkan sintesa protein, meningkatkan permeabilitas sel
terhadap air, dan melunakkan dinding sel yang diikuti menurunnya
tekanan dinding sel sehingga air dapat masuk ke dalam sel yang disertai
dengan kenaikan volume sel (Hendaryono dan Wijayani, 1994).
2) Sitokinin
Dalam kultur jaringan, sitokinin berfungsi untuk mengatur
pertumbuhan serta morfogenesis. Sitokinin juga merupakan hormon yang
diproduksi secara alamiah (endogenus), dan juga dapat dibuat secara
sintesis (Katuuk, 1989).
Sitokinin alami ditemukan lebih dari 30 jenis dan terdapat dalam
bentuk sitokinin bebas, maupun sebagai glukosa atau ribosa. Dua sitokinin
alami yang paling banyak digunakan dalam kultur jaringan adalah zeatin
(4-hydroxy-3-methyl-trans-2-butenylaminopurine) dan 2-iP
(N6-(2-ispentyl)adenin). Sitokinin sintetik yang digunakan dalam kultur jaringan
antara lain kinetin atau FAP (6-furfurylaminopurine), BAP atau BA
)-N’-phenylurea), PBA (SD 8339) ((6-benzylamino
)-9-(2-tetrahydropyranyl)-9H-purine), thidiazuron (N-phenyl
-N’-1,2,3-thiadiazol-5-phenylurea), dan 2,6Cl-4PU (N-(2,6-dichloro-4-pyridyl
)-N’-phenylurea) (Santoso dan Nursandi, 2002).
Dalam pertumbuhan jaringan, sitokinin berpengaruh pada
pembelahan sel. Sitokinin bersama-sama dengan auksin mempengaruhi
diferensiasi jaringan. Pemberian sitokinin yang relatif tinggi akan
menyebabkan kalus ke arah pembentukan primordia batang atau tunas
(Hendaryono dan Wijayani, 1994).
3. Eksplan
Eksplan adalah bagian kecil jaringan atau organ yang dikeluarkan atau
dipisahkan dari tanaman induk kemudian dikulturkan (Katuuk, 1989). Pada
pemilihan eksplan, sebaiknya dipilih bagian atau jaringan tanaman yang masih
muda dan mudah tumbuh, yaitu jaringan meristem. Jaringan meristem terdiri
dari sel-sel yang selalu membelah, berdinding tipis, belum mempunyai
penebelan zat pektin, plasmanya penuh, dan vakuolanya kecil-kecil.
Penggunaan jaringan meristem dalam kultur jaringan dikarenakan jaringan
meristem selalu membelah, sehingga diperkirakan mempunyai hormon yang
mengatur pertumbuhan (Hendaryono dan Wijayani, 1994).
Berhasil tidaknya pengulturan eksplan tergantung pada faktor yang
dimiliki oleh eksplan itu sendiri. Faktor-faktor tersebut meliputi ukuran, umur
fisiologi, sumber, serta genotip eksplan (Katuuk, 1989).
Ukuran eksplan sangat menentukan proses pengkulturan. Bagian
tanaman yang dipotong masih mengandung suplai makanan serta hormon
untuk potongan itu sendiri, sehingga makin besar potongan, makin besar
kemampuan potongan ini untuk dirangsang tumbuh dan beregenerasi.
Namun, semakin besar eksplan maka semakin besar kemungkinan
mendapatkan jaringan yang terkontaminasi. Eksplan yang kecil mempunyai
daya tahan yang kurang. Ukuran eksplan yang paling baik adalah 0,5 sampai
1,0 cm, namun ukuran ini dapat bervariasi, tergantung pada material
tanaman yang dipakai serta jenis tanaman (Katuuk, 1989).
b.Umur eksplan.
Umur eksplan sangat mempengaruhi tipe serta daya morfogenesis.
Jaringan yang masih muda serta belum banyak berdiferensiasi terdapat pada
bagian meristematik. Bagian inilah yang paling banyak berhasil dari semua
jenis tanaman. Sel atau jaringan yang masih muda (juvenile) akan tetap
muda dalam pengkulturan sehingga daya untuk beregenerasi tetap ada,
sedangkan sel-sel tua (mature), kesanggupan untuk beregenarasi sudah
berkurang. Selain dari kandungan jaringan meristematik yang berkurang,
jaringan yang sudah tua kemungkinan sudah mengandung patogen (Katuuk,
1989).
c.Sumber eksplan.
Sumber eksplan adalah tanaman induk tempat eksplan diambil.
Tanaman yang dijadikan sumber eksplan hendaknya dari tanaman yang
musim, serta kelembaban terhadap tanaman induk sangat mempengaruhi
perkembangan eksplan. Tanaman induk dituntut untuk berkecukupan zat
hara, lama penyinaran, intensitas cahaya serta hormon tumbuh. Dengan kata
lain, pertumbuhannya harus optimum (Katuuk, 1989).
Kemampuan bagian tanaman dalam pengulturan juga dipengaruhi oleh
jenis tanaman. Secara umum tanaman berkayu lebih sulit untuk
ditumbuhkankan dibanding herbaseus, monokotil lebih mudah dari dikotil.
Kesulitan membentuk kalus tidak hanya berdasarkan hal-hal tersebut, tetapi
lebih berdasar pada aspek fisiologi dan biokimia bahan tanam (Santoso dan
Nursandi, 2002).
d.Genotip eksplan.
Genotip adalah faktor endogen yang paling utama mempengaruhi
perkembangan jaringan eksplan, dibandingkan faktor-faktor lain. Perbedaan
kemampuan untuk beregenerasi disebabkan oleh genotip jelas dapat dilihat
pada tanaman monokotil, dikotil dan gymnospermae. Dari ketiga kelompok
ini, kemampuan untuk beregenerasi yang paling rendah adalah tanaman
gymnospermae, kemudian diikuti oleh tanaman monokotil, dan terakhir oleh
tanaman dikotil. Selanjutnya dikatakan bahwa apabila satu jenis tanaman
dengan mudah beregenerasi in vivo maka sifat ini berlaku juga pada in vitro
(Katuuk, 1989).
4. Kalus
Jika suatu eksplan ditanam pada medium padat atau dalam medium
terbentuk massa kalus (Yuwono, 2006). Kalus adalah jaringan yang tak
berbentuk dan tak terorganisasi. Jaringan ini merupakan hasil pembelahan sel
yang berpotensi tinggi untuk terus-menerus membelah diri. Kalus adalah satu
fase yang harus dilalui selama pengulturan organ, jaringan, maupun
pengulturan sel-sel yang mendahului (Katuuk, 1989). Wetherell (1982)
mendefinisikan kalus sebagai pertumbuhan sel yang belum berdiferensiasi,
membentuk tumor sebagai akibat dari pengaruh auksin dan sitokinin yang
tinggi.
Secara alami, tanaman juga dapat membentuk kalus sebagai upaya
perlindungan tanaman karena tanaman mengalami perlukaan (infeksi bakteri,
gigitan serangga atau nematoda) dan juga karena tanaman mengalami stress
(Santoso dan Nursandi, 2002). Dalam kultur jaringan, kalus terbentuk karena
luka/irisan pada eksplan sebagai respon terhadap hormon baik eksogenus
maupun endogenus. Adanya rangsangan ini menyebabkan sel berubah dari
bentuk inaktif menjadi aktif (Katuuk, 1989).
Sel-sel penyusun kalus adalah sel-sel parenkim yang mempunyai
ikatan yang renggang dengan sel-sel lainnya (Santoso dan Nursandi, 2002).
Pembelahan sel tidak terjadi pada seluruh permukaan eksplan, tetapi hanya
pada bagian meristematik, yaitu lapisan yang terletak pada bagian luar sel
perifer. Lapisan bagian dalam merupakan jaringan yang sudah tua dan tidak
membelah lagi. Setelah pembelahan sel bagian luar berkurang, kalus akan
terlihat membulat atau kompak, dan selanjutnya akan berlangsung proses
5. Sterilisasi
Menciptakan dan memelihara kondisi aseptik merupakan pekerjaan
yang paling berat dalam kultur jaringan. Spora dari bakteri dan jamur yang ada
di sekitar kita dapat jatuh atau terbawa sampai pada eksplan karena adanya
pergerakan udara. Akhirnya spora dan jamur akan tumbuh dan berkembang,
dan dalam beberapa hari akan tumbuh menjadi koloni mikrobial sehingga
objek kultur dikatakan terkontaminasi (Katuuk, 1989).
Media kultur jaringan merupakan sumber makanan yang baik untuk
bakteri dan fungi, dan semua prosedur in vitro harus memuat pencegahan
terhadap kontaminasi mikroba (Wetherell, 1982). Ada beberapa teknik
sterilisasi yang biasa digunakan dalam kultur jaringan tanaman, yaitu:
a. Sterilisasi panas basah
Cara sterilisasi panas basah adalah dengan menggunakan uap air. Alat
yang digunakan untuk sterilisasi ini adalah autoklaf. Hampir semua
mikroba akan mati setelah diberi uap air dengan suhu 121˚C selama 10-15
menit. Cara sterilisasi ini dapat digunakan untuk mensterilkan media
kultur, air, alat/instrumen, peralatan gelas serta peralatan plastik yang
tahan akan suhu panas. Lama sterilisasi ada aturannya, untuk mensterilkan
media 20-75 ml dibutuhkan waktu 15-20 menit, media 75-500 ml
dibutuhkan waktu 20-25 menit, media 500-5000 ml dibutuhkan waktu
25-35 menit, yang semuanya dilakukan pada suhu 121˚C; sedangkan untuk
mensterilkan peralatan gelas dibutuhkan waktu 30 menit dengan suhu
b. Sterilisasi panas kering
Cara sterilisasi panas kering adalah dengan menggunakan suhu tinggi
dan dalam kondisi kering. Alat yang digunakan untuk sterilisasi ini adalah
oven. Oven digunakan untuk mensterilkan alat-alat yang tidak mudah
terbakar, antara lain: alat-alat gelas dan alat-alat dari logam. Namun dalam
keadaan tertentu dimana suhu tidak terlalu panas, alat dapat dibungkus
dengan kertas kemudian disterilkan. Namun bukan berarti semua alat dari
bahan logam harus disterilkan dengan cara ini. Alat-alat seperti pisau serta
scalpel tidak dapat disterilkan dengan cara ini sebab dapat merusak
ketajaman pisau /alat (Katuuk, 1989).
Lama pemanasan tergantung pada suhu. Biasanya sterilisasi untuk
suhu 160˚C, memerlukan waktu 45 menit; 170˚C selama 18 menit; 180˚C
selama 7,5 menit, dan 190˚C selama 1,5 menit. Suhu harus terus dikontrol,
sebab pada suhu 170˚C, kertas mulai hancur. Setelah selesai proses
sterilisasi, alat/instrumen dikeluarkan dan dibawa ke ruang transfer, dan
dapat disterilkan lagi dengan menggunakan sinar ultraviolet (Katuuk,
1989).
c. Sterilisasi dengan memakai nyala
Alat/instrumen yang sudah disterilkan dengan oven, dikeluarkan dari
bungkusnya, dicelupkan dalam etanol 70% dan dilewatkan pada nyala
lampu spiritus. Setiap beberapa saat instrument harus dicelupkan ke dalam
etanol kemudian dibakar. Perlakuan ini berjalan terus selama kegiatan
d. Sterilisasi dengan bahan kimia
Sterilisasi dengan bahan kimia merupakan pembasmian mikroba
dengan memakai bahan kimia. Biasanya bahan kimia dipakai untuk
mensterilkan permukaan saja, yang meliputi material tanaman dapat
disterilkan dengan menggunakan natrium hipoklorit, perak nitrat atau air
brom; sedangkan instrumen, tangan pekerja, serta ruang atau kotak transfer
dapat disterilkan dengan menggunakan alkohol 70% (Katuuk, 1989).
Banyak jenis bahan pencuci yang bisa digunakan untuk sterilisasi
material tanaman. Jenis dan lama sterilisasi tergantung pada kepekaan
material tanaman. Terlalu lamanya proses sterilisasi dengan konsentrasi
bahan pencuci yang tinggi, akan mematikan mikroba sekaligus merusak
jaringan tanaman yang disterilkan. Di samping itu, bahan pencuci
hendaknya bersifat lebih mudah larut. Bila tidak demikian, sisa zat pencuci
ini akan tetap pada material tanaman, yang dapat mengganggu
pertumbuhan eksplan (Katuuk, 1989).
e. Sterilisasi dengan cahaya
Ruang dan kotak transfer sulit disterilkan hanya dengan menggosok
dengan alkohol atau bahan kimia pada permukaan. Untuk itu digunakan
lampu germisidal dengan sinar ultraviolet. Ada laboratorium yang sudah
memasangnya di langit-langit atau pada tempat lain dengan tujuan semua
bagian terkena cahaya. Kelemahan menggunakan sinar ultraviolet adalah
terjadi. Selain itu, sinar ultraviolet hanya mampu mematikan bentuk
fertilisasi bakteri dan jamur, bukan bentuk spora (Katuuk, 1989).
6. Penanaman eksplan
Penanaman eksplan dilakukan di dalam laminar air flow (LAF)
dengan kondisi aseptis. Sebelum bekerja di dalam LAF, semua perhiasan
tangan harus dilepas dan tangan dibasuh dengan alkohol 70%. Saat menanam
eksplan, pekerja harus menggunakan masker penutup mulut dan hidung
(Hendaryono dan Wijayani, 1994).
Eksplan ditanam ke dalam media dengan sedikit ditekan agar eksplan
bersinggungan dengan media. Selanjutnya wadah ditutup dengan alumunium
foil atau parafin untuk mencegah penguapan. Media yang berisi eksplan
diinkubasikan dalam ruangan dengan suhu 25˚C (Dixon, 1985).
7. Subkultur
Subkultur adalah usaha untuk mengganti media tanam kultur jaringan
dengan media yang baru, sehingga kebutuhan nutrisi untuk pertumbuhan kalus
dapat terpenuhi (Hendaryono dan Wijayani, 1994).
Subkultur pada media padat dilakukan dengan meletakkan kalus yang
sudah terbentuk di atas cawan petri dan membelah-belahnya lagi menjadi
bagian-bagian kecil dengan menggunakan skalpel dan pinset.
Potongan-potongan kalus tersebut segera dimasukkan kembali ke dalam wadah yang
berisi media baru dengan komposisi media yang sama dengan media lama dan
diinkubasikan kembali. Seluruh proses ini dilakukan dalam kondisi aseptis
8. Pertumbuhan kalus
Ada 3 tahapan perkembangan dan pertumbuhan kalus, mulai dari
waktu subkultur atau penaburan inokulum, yaitu induksi pembelahan sel,
pembelahan sel aktif dan tahap pembelahan sel lambat atau sel berhenti
membelah. Laju pertumbuhan kalus umumnya ditetapkan secara kuantitatif
dengan parameter indeks pertumbuhan bobot kalus basah. Pertambahan bobot
kalus basah merupakan selisih antara bobot kalus basah pada periode tertentu
dikurangi bobot kalus mula-mula atau bobot inokulum. Selanjutnya dari kurva
pertumbuhan kalus yang menyatakan hubungan antara pertumbuhan bobot
kalus basah dengan umur dapat diketahui fase-fase pertumbuhan kalus antara
lain:
a. Fase lag, yaitu fase belum terjadinya pertumbuhan secara nyata, keadaan
ini terjadi selama beberapa waktu setelah kalus disubkultur, serta
merupakan waktu adaptasi kalus dengan media yang baru. Pada fase ini
pertambahan bobot kalus hanya sedikit dan terlihat hampir mendatar pada
kurva.
b. Fase eksponensial, yaitu fase mulai terjadinya pertumbuhan kalus.
Pertambahan bobot kalus mulai terlihat nyata dan diikuti fase linier
dimana pertumbuhan kalus terus menaik secara eksponensial seperti garis
lurus ke atas dan berhenti.
c. Fase stasioner, yaitu fase saat pertumbuhan kalus sama dengan kematian
sel-sel kalus. Pada fase ini, kalus tidak dapat bertahan hidup dalam waktu
nutrien telah habis digunakan, sehingga kematian sel menjadi lebih cepat
(George dan Sherrington, 1984).
C. Glikosida Jantung
Glikosida jantung banyak ditemukan dalam keluarga tumbuhan yang
tidak berkaitan satu sama lain seperti Apocynaceae, Liliaceae, Moraceae, dan
Ranunculaceae (Robinson, 1995); juga banyak ditemukan pada anggota suku
Scrophulariaceae, Digitalis, Nerium, Asclepiadaceae, dan Asclepis (Harborne,
1987). Tumbuhan yang mengandung senyawa ini biasanya digunakan sebagai
racun panah dan siksaan pada zaman prasejarah. Contoh glikosida yang
bermanfaat dalam pengobatan misalnya glisirizin, glikosida asam gliserisat,
yang terkandung dalam akar Glycyrrhiza glabra sebagai komponen aktif
utama (Robinson, 1995).
Sumber utama kardenolida ialah genus Digitalis dan Strophantus.
Digitalis mempunyai efek langsung pada jantung yaitu memberi kekuatan bila
jantung melemah. Glikosida jantung biasanya mempunyai sifat peluruh air
seni (diuretik) yang berakibat menurunkan tekanan darah dan mengobati
bengkak. Keberadaan senyawa ini dalam tumbuhan mungkin memberi
perlindungan kepada tumbuhan tersebut dari gangguan beberapa serangga
(Robinson, 1995).
Isolasi glikosida jantung murni dalam tanaman sulit dilakukan karena
glikosida jantung merupakan suatu glikosida yang memiliki kepolaran yang
menggunakan pelarut yang polar antara lain: etanol, etil asetat, campuran
etanol dan air serta campuran etanol dan kloroform (Samuelsson, 1999).
Glikosida jantung diklasifikasikan sebagai steroid (sterol), karena
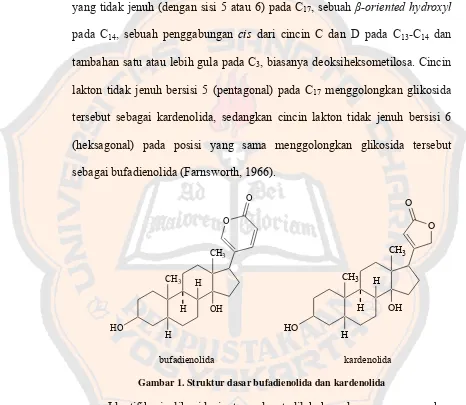
memiliki inti cyclopentanoperhydrophenanthrene, sebuah cincin lakton α-β
yang tidak jenuh (dengan sisi 5 atau 6) pada C17, sebuah β-oriented hydroxyl
pada C14, sebuah penggabungan cis dari cincin C dan D pada C13-C14 dan
tambahan satu atau lebih gula pada C3, biasanya deoksiheksometilosa. Cincin
lakton tidak jenuh bersisi 5 (pentagonal) pada C17 menggolongkan glikosida
tersebut sebagai kardenolida, sedangkan cincin lakton tidak jenuh bersisi 6
(heksagonal) pada posisi yang sama menggolongkan glikosida tersebut
sebagai bufadienolida (Farnsworth, 1966).
H
Gambar 1. Struktur dasar bufadienolida dan kardenolida
Identifikasi glikosida jantung dapat dilakukan dengan menggunakan
Kromatografi Lapis Tipis (KLT) secara kualitatif. Reaksi identifikasi terhadap
glikosida jantung dapat dilakukan menggunakan uji dengan pereaksi Baljet
(2,4,6-trinitrophenol), uji dengan pereaksi Kedde (3,5-dinitrobenzoic acid), uji
(sodium nitroprusside) dimana pereaksi tersebut akan bereaksi dengan grup
metilen aktif yang ditemukan dalam cincin lakton tidak jenuh. Pereaksi ini
akan memberikan warna oranye, ungu, biru, dan violet, yang menunjukkan
adanya glikosida jantung (Farnsworth, 1966).
D. Kromatografi Lapis Tipis
Kromatografi lapis tipis (KLT) merupakan metode pemisahan
fisikokimia (Stahl, 1969). Pada dasarnya semua kromatografi menggunakan
dua fase yaitu fase diam dan fase gerak. Pemisahan-pemisahan tergantung
pada gerakan relatif dari dua fase ini. Kromatografi dapat digolongkan
berdasarkan sifat-sifat fase diam, yang dapat berupa zat padat atau zat cair.
Apabila fase diam berupa zat padat maka cara tersebut dikenal sebagai
kromatografi serapan, sedangkan untuk fase diam yang berupa cairan dikenal
sebagai kromatografi partisi (Sastrohamidjojo, 2001).
Kromatografi lapis tipis termasuk ke dalam kromatografi serapan.
Prinsip dari kromatografi serapan adalah kecepatan bergerak dari suatu
komponen tergantung pada berapa besarnya komponen tersebut tertahan oleh
fase diam (Sastrohamidjojo, 2001).
Fase diam yang digunakan dalam kromatografi lapis tipis adalah bahan
penyerap atau adsorben (Stahl, 1969). Fase diam dapat berupa serbuk halus
yang berfungsi sebagai permukaan penjerap (kromatografi cair-padat) atau
berfungsi sebagai penyangga untuk lapisan zat cair (kromatografi cair-cair)
pemilihan bahan penyerap adalah ukuran partikel dan homogenitas partikel
penyerap. Kedua sifat ini sangat berpengaruh pada gaya adhesi. Besar partikel
yang biasa digunakan adalah 1-25 mikron. Fase diam yang umum dan paling
banyak digunakan adalah silika gel yang dicampur dengan CaSO4 untuk
menambah daya lengket partikel silika gel pada pendukung (pelat). Adsorben
lain yang juga biasa digunakan adalah alumina, kieselguhr, celite, serbuk
selulosa, serbuk poliamida, kanji dan sephadex (Mulja dan Suharman, 1995).
Fase diam yang digunakan untuk analisis secara kromatografi lapis tipis untuk
glikosida jantung adalah silika gel GF 254 (Wagner, 1984).
Fase gerak adalah medium angkut dan terdiri atas satu atau beberapa
pelarut. Fase ini bergerak dalam fase diam karena adanya gaya kapiler. Fase
gerak yang digunakan adalah pelarut bertingkat mutu analitik dan bila
diperlukan sistem pelarut multi-komponen harus berupa campuran
sesederhana mungkin terdiri atas maksimum tiga komponen (Stahl, 1969).
Ada beberapa macam pilihan fase gerak untuk glikosida jantung, yaitu etil
asetat-metanol-air (100:13,5:10 v/v); etil asetat-metanol-etanol-air (81:11:4:8
v
/v); metiletil keton-toluena-air-asam asetat glasial (40:5:3:2,5:1 v/v); dan
kloroform-metanol-air (65:35:10 v/v) (Wagner, 1984).
Campuran yang dipisahkan berupa larutan yang ditotolkan berupa
bercak. Setelah itu pelat atau lapisan dimasukkan ke dalam bejana tertutup
rapat yang berisi larutan pengembang yang cocok (fase gerak). Pemisahan
terjadi selama pengembangan. Selanjutnya senyawa yang tidak berwarna
Identifikasi dari senyawa yang terpisah (bercak/noda) pada lapisan
tipis dapat dilakukan dengan tanpa pereaksi kimia dan disemprot dengan
reagen. Identifikasi senyawa glikosida jantung dapat dilakukan dengan tanpa
pereaksi kimia yaitu dengan menggunakan sinar ultraviolet 254 dan 365 nm,
sedangkan reagen penyemprot yang digunakan untuk identifikasi senyawa
glikosida jantung adalah reagen Kedde, Legal, Baljet, Raymond, antimony
(III) chloride, chloramine-trichloroacetic acid/CTA, sulphuric acid (Wagner,
1984) dan vanillin-phosporic acid (Jork et al., 1990).
Jarak pengembangan senyawa pada kromatogram biasanya dinyatakan
dengan angka Rf atau hRf. Harga Rf didefinisikan sebagai perbandingan jarak
antara senyawa dari titik awal dengan jarak tepi muka pelarut dari awal.
Rf =
Harga Rf yang diperoleh pada KLT tidak tetap jika dibandingkan dengan
kromatografi kertas sehingga perlu dibuat kromatogram zat pembanding
kimia, lebih baik dengan kadar yang berbeda-beda. Perkiraan identifikasi
diperoleh dengan pengamatan dua bercak dengan harga Rf dan ukuran yang
hampir sama. Angka Rf berkisar antara 0,01 – 1,00 dan hanya dapat
ditentukan dengan dua desimal. hRf adalah angka Rf dikalikan faktor 100 (h),
menghasilkan nilai berkisar antara 0 – 100 (Harborne, 1984; Stahl, 1969).
E. Landasan Teori
Selama ini kamboja jepang digunakan sebagai tanaman hias dan secara
penelitian yang dilakukan Melero et al (2000), kamboja jepang mempunyai
kandungan senyawa glikosida yang mirip digitalis sehingga mempunyai
kemungkinan dapat digunakan sebagai obat jantung.
Pelaksanaan teknik kultur jaringan ini berdasarkan teori sel seperti
yang dikemukaan oleh Schleiden dan Schwann, yaitu bahwa sel merupakan
satuan struktural, fungsional, dan hereditas terkecil dari makhluk hidup
sehingga dapat tumbuh dan berkembang menjadi suatu individu yang normal.
Sel juga mempunyai kemampuan totipotensi, yaitu kemampuan setiap sel, dari
mana saja sel tersebut diambil, yang apabila ditumbuhkan pada lingkungan
yang sesuai akan tumbuh dan berkembang menjadi tanaman lengkap yang
baru yang mempunyai kandungan kimia yang sama dengan tanaman asalnya.
Media kultur merupakan salah satu faktor penentu keberhasilan
perbanyakan tanaman secara kultur jaringan. Apabila eksplan ditanam dalam
media cocok, pertumbuhannya pun akan optimum. Media tumbuh yang
digunakan dalam penelitian ini adalah Woody Plant Medium (WPM) karena
menurut Hendaryono dan Wijayani (1994) media WPM cocok sebagai media
kultur untuk membudidayakan tanaman berkayu.
Laju pertumbuhan kalus umumnya ditetapkan secara kuantitatif
dengan parameter indeks pertumbuhan bobot kalus basah. Kurva pertumbuhan
kalus dapat menunjukkan fase-fase pertumbuhan kalus, yaitu fase lag (fase
penyesuaian), fase eksponensial (fase pertumbuhan optimum), dan fase
Teknik kultur jaringan ini diharapkan dapat menghasilkan metabolit
sekunder, yaitu glikosida jantung, dari tanaman kamboja jepang yang
mempunyai profil KLT yang mirip dengan profil KLT pada tanaman induknya
dan kultur kalusnya memiliki profil pertumbuhan sigmoidal yang fase
stasionernya menghasilkan kandungan glikosida jantung yang optimum.
F. Hipotesis
1. Daun tanaman kamboja jepang dapat membentuk kalus dengan variasi
penambahan zat pengatur tumbuh asam 2,4-Diklorofenoksiasetat dan
6-furfurylaminopurine pada media WPM.
2. Kultur kalus yang dihasilkan melalui teknik kultur jaringan ini memiliki
pertumbuhan sigmoidal yang fase stasionernya menghasilkan kandungan
glikosida jantung yang optimum.
3. Ekstrak kalus daun tanaman kamboja jepang memiliki profil KLT yang
BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk jenis penelitian eksperimental murni dengan
rancangan acak lengkap pola searah.
B. Variabel Penelitian dan Definisi Operasional 1. Variabel utama
a. Variabel bebas : waktu pemanenan (hari ke-) dan variasi konsentrasi 2,4-D
dan FAP.
b. Variabel tergantung: profil pertumbuhan kultur kalus dan susut
pengeringan kalus (%).
2. Variabel pengacau terkendali
a. Subyek uji : daun yang digunakan sebagai eksplan adalah daun segar dan
sehat yang terletak pada nomor 3-5 dari ujung batang atau cabang dengan
ukuran eksplan 0,5 - 1,0 cm.
b. Bahan uji dan cara kerja penanaman berupa:
i. Media agar jenis WPM dengan sterilisasi tetap terjaga.
ii. Sterilitas, suhu, kelembaban dan intesitas cahaya dalam ruang
inkubator.
3. Variabel pengacau tidak terkendali
a. Keadaan patologis pada daun tanaman yang tidak tampak.
b. Kandungan senyawa kimia lain yang terkandung dalam kamboja jepang
yang dapat mempengaruhi hasil kromatogram.
4. Definisi Operasional
a. Daun yang digunakan sebagai eksplan dalam penelitian ini adalah daun
yang segar dan sehat, terletak pada nomor 3-5 dari ujung batang atau
cabang.
b. Waktu inisiasi adalah waktu yang dibutuhkan oleh eksplan untuk
membentuk kalus dihitung mulai dari saat penanaman eksplan sampai hari
pertama kalus mulai terbentuk berupa bintik putih dari tepi irisan daun
eksplan.
c. Subkultur adalah suatu kegiatan pemeliharaan kalus dengan memindahkan
kalus ke dalam media baru sehingga kalus tidak kekurangan nutrisi.
d. Bobot kalus basah awal adalah hasil pengurangan antara bobot botol +
media + kalus dengan bobot botol + media pada saat subkultur.
e. Bobot kalus basah akhir adalah bobot kalus yang ditimbang pada saat
pemanenan.
f. Bobot kalus kering adalah bobot kalus pada saat pemanenan dan sesudah
mengalami proses pengeringan dengan menggunakan oven pada suhu
40-500C, sampai diperoleh kalus dengan bobot konstan yaitu antara
penimbangan yang pertama dan berikutnya selama 1 jam tidak berbeda 0,5
g. Laju pertumbuhan kalus adalah laju pertumbuhan kalus yang ditandai
adanya pertambahan berat kalus dari waktu ke waktu dengan memanen
setiap 4 hari sekali sebanyak 3 botol selama 36 hari.
h. Profil pertumbuhan kalus adalah rasio antara pertumbuhan kalus (bobot
kalus basah akhir- bobot kalus basah awal) dengan waktu pemanenan serta
rasio antara bobot kalus kering dengan waktu pemanenan.
i. Persen susut pengeringan adalah rerata bobot kalus basah dikurangi
dengan rerata bobot kalus kering lalu dibagi dengan rerata bobot kalus
basah dikali dengan 100%.
j. Konsentrasi zat pengatur tumbuh, yaitu asam 2,4-Diklorofenoksiasetat
yang digunakan adalah 4 ppm dan 2 ppm yang terkandung dalam satu liter
media. Sedangkan konsentrasi 6-furfurylaminopurine yang digunakan
adalah 1 ppm.
C. Alat dan Bahan Penelitian 1. Alat penelitian
a. Alat yang digunakan dalam kultur jaringan tanaman:
1) Alat-alat gelas, Pyrex
2) Autoklaf, YX 400Z Shanghai Sanshen, Medical Inst, Co, LTD.
3) Oven, Marius Instrument, German.
4) Pemanas listrik, Ika Combimag, RCT, German.
5) Timbangan analitik, Scaltec.
7) Magnetic stirrer.
8) Pinset.
9) Skapel.
10)Kertas indikator pH.
11)Kertas saring.
12)Laminar air flow.
13)Lampu UV.
14)Inkubator, Heraeus Tamson, Holland.
15)Botol kultur.
16)Aluminium foil, Heavy-Duty, Diamond-Wrap.
17)Refrigerator, Sharp.
18)Sprayer.
19)Mortir & stamper.
b. Alat untuk penyarian : alat gelas (pyrex), kertas saring, dan waterbath
c. Alat untuk Kromatografi Lapis Tipis:
1) Bejana gelas.
2) Lempeng kaca.
3) Lemari asam.
4) Pipa kapiler.
5) Penyemprot bercak.
6) Lampu TL Day Light” 20 watt.