SIFAT-SIFAT INTRAMOLEKUL
SENYAWA ORGANIK
Setiap senyawa organik memiliki sifat-sifat fisik maupun sifat-sifat kimia, tetapi dalam pembahasan ini akan difokuskan pada sifat-sifat intramolekul. Sifat-sifat intramolekul tersebut meliputi panjang ikatan, energi ikatan, momen dipol, keasaman dan kebasaan suatu molekul organik.
Di dalam energi ikatan dijelaskan tentang pengukuran, perhitungan secara teori dan faktor-faktor yang menentukan panjang ikatan. Pada energi ikatan akan diuraikan tentang penentuan energi ikatan secara eksperimen dan secara teoritis. Pembahasan tentang momen dipol meliputi perhitungan momen dipol dalam berbagai macam senyawa organik. Pada uaraian tentang keasaman dan kebasaan dijelaskan tentang faktor-faktor yang menentukan keasaman dan kebasaan suatu senyawa organik.
PANJANG IKATAN
Panjang ikatan adalah jarak antara duah buah atom yang saling berikatan atau jarak rata-rata anatar dua buah inti yang berikatan kovalen.
rA = ½ d, rA = jari-jari kovalen A
Panjang ikatan (d)
Panjang ikatan dapat diukur melalui salah satu cara dari: a. Difraksi elektron
b. Difraksi sinar X
c. Studi dari spektra (spektrum) d. Gabungan dari ketiga cara diatas
e. Difraksi elektron (metode terbaru)
Faktor-faktor yang menentukan panjang ikatan adalah jari-jari kovalen, keelektronegatifan, energi ikatan dan orde ikatan.
1. Jari-Jari Kovalen (Radius Kovalen )
Jari-jari kovalen adalah setengah dari jarak antara dua inti atom homonuklear yang berikatan kovalen atau setengah dari jarak ikatan antara dua atom yang sama.
rA = ½ dA
Menurut Huggins dan Pauling hubungan antara jari-jari kovalen dan panjang ikatan adalah
Keterangan :
rA-B = panjang ikatan AB
rA = jari-jari kovalen atom A
rB = jari-jari kovalen atom B
contoh :
1. Panjang ikatan C-C merupakan jumlah jari-jari kovalen kedua atom C. Dengan demikian jika atom C mempunyai jari-jari kovalen 0,77 Ao, maka panjang ikatan C-C dapat diperoleh dengan cara berikut:
rC-C = r C + r C
= 0,77 + 0,77 = 1,54
2. Panjang ikatan H-H adalah total dari jari-jari kovalen kedua atom H dan jika jari-jari kovalen atom adalah 0,28 Ao, maka panjang ikatan H-H dapat dihitung dengan cara berikut:
rH-H = rH + rH
= 0,28 + 0,28 = 0,56
3. Panjang ikatan C-Cl adalah jumlah jari kovalen atom C dan atom Cl. Apabila jari-jari kovalen atom C dan Cl adalah berturut-turut 0,77 dan 0,99 Ao, maka panjang ikatan C-Cl adalah:
rC-Cl = rC + rCl
= 0,77 + 0,99 = 1,76
Dari data eksperimen memperlihatkan bahwa panjang ikatan C-Cl adalah 1,72 . Ini berarti bahwa data perhitungan lebih besar daripada data eksperimen. Dengan demikian persamaan di atas hanya berlaku untuk dua atom yang berikatan dengan perbedaan keelektronigatifan nol. Jadi, jari-jari kovalen meruapakan setengah dari jarak inti kedua atom yang berikatan.
Harga jari-jari kovalen beberapa unsur yang sering dijumpai dalam senyawa organik tertera dalam tabel 1.
Tabel 1. Jari-jari kovalen beberapa unsur
Unsur Jari-jari kovalen, r ( )
H 0,28 C 0,77 N 0,75 O 0,74 F 0,72 Si 1,17 P 1,10 S 1,04 Cl 0,99
2. Keelektronegatifan
Untuk ikatan yang dibentuk dari atom-atom yang memiliki perbedaan keelektronegatifa, rumus Pauling dan Huggins tidak dapat diterapkan. Kenyataan memberi petunjuk bahwa panjang ikatan seperti ini selalu lebih pendek daripada jumlah jari-jari atom pembentuknya. Hal ini terjadi karena adanya kontraksi akibat perbedaan keelektronegatifan polaritas.
Contoh :
Menurut rumus Pauling, panjang ikatan C-N dengan jari-jari kovalen C dan N berturut-turut 0,77 dan 0,75 Ao adalah sebagai berikut:
rC-N = rC + rN
=0,77 + 0,75 = 1,52
Data observasi menunjukkan rC-N = 1,47 . Artinya data observasi lebih pendek
daripad hasil perhitungan. Semakin besar perbedaan keelektronegatifan kedua unsur yang berikatan semakin besar pula kontraksi panjang ikatannya. Hal ini dapat dilihat pada panjang ikatan C-O dengan jari-jari kovalen atom C dan O adalah masing-masing 0,77 dan 0,74 .
rC-O = rC + rO
=0,77 + 0,74 = 1,51
Data pengamatan memperlihatkan rC-O = 1,24 . Jadi, nilai kontraksinya
merupakan selisih antara data observasi dengan hasil perhitungan, yakni 0.09 Å Koreksi terhadap kontraksi di atas dilakukan oleh Schumacher dan Stevenson dengan rumus:
Keterangan :
rA-B = panjang ikatan
rA = jari-jari kovalen A
rB = jari-jari kovalen B
XA - XB = Keelektronegatifan A dan B
Contoh :
Hitung panjang ikatan C-Cl dimana jari-jari kovalen atom C dan Cl adalah masing-masing 0,77 dan 0,99 dan keelektronegatifan C dan Cl adalah berturut-turut 2,5 dan 3,0. rC-Cl = rC + rCl – 0,0 9 XC – XCl rC-Cl = 0,77 + 0,99– 0,09 XC – XCl = 0,77 + 0,99– 0,09 2,5– 3,0 = 1,67 – 0,09 (0,5) = 1,715 1,72
Disamping itu, Huggins memperkenalkan hubungan antara energi ikatan dan panjang ikatan, yaitu:
r’A-B = rAB + 1/a In EAB
Keterangan :
r’A-B = panjang ikatan aktual, panjang ikatan pada energi tetap
rAB = Panjang ikatan A-B
E = energi ikatan AB
a = tetapan, jika E dinyatakan dengan kkal/g maka a= 4,6
E E E r’AB = r’A + r’B Dengan demikan, ’ ’ E
r’A dan r’B adalah jari-jari kovalen A dan B pada energi tetap.
Contoh
Hitung panjang C-Cl jik diketahui energi ikatan C-Cl = 77 kkal rC-Cl = r’C + r’Cl - 1/2 Iog EC-Cl
=1,22 +1,44 – ½ log 77 =1,72 Ao
3. Orde Ikatan
Orde ikatan menunjukkan jumlah ikatan.
Ikatan tunggal C-C ; rC-C = 1,54 A, artinya ikatan mempunyai orde ikatan = 1
Ikatan tunggal C=C ; rC-C = 1,54 A, yang berarti bahwa ikatan ini berorde ikatan
dua
Pada umumnya, ikatan rangkap lebih kecil dari pada ikatan tunggal, jika terjadi resonansi maka orde ikatan berada diantara 1 dan 2.
Contoh: Benzena
orde ikatan untuk a = ½ x 2 + ½ x1 = 3/2
b = ½ x1 + ½ X 2 =3/2 , dimana rA = r B
Pauling memberi hubungan antara orde ikatan dan panjang ikatan, yang menyatakan bahwa hubungan empiris antara orde ikatan dengan panjang ikatan ternyata tidak linier.
r’ = r1 -
2 1
1 3 1 2 y r r y keterangan : r’ = panjang ikatanr1, r2 = Panjang ikatan tunggal dan panjang ikatan rangkap
y = Orde ikatan contoh :
a b
Jumlah bentuk resonansi = 2
b a
ra = 1,54 -
1 2 3 . 2 33 , 1 54 , 1 1 2 3 3 = 1.54 -
2 21 , 0 2 1 3 = 1,54 –0,1575 = 1,3825 ÅPanjang ikatan hasil observasi adalah 1,39 Å, yang berarti bahwa hasil perhitungan sedikit lebih pendek. Perlu dicatat bahwa panjang ikatan keenam ikatan dalam benzen adalah sama.
Bagaimana dengann panjang ikatan naftalena?
Orde ikatan masing-masing ikatan dalam naftalena adalah sebagai berikut:
Orde ikatan
3 5 1 3 1 2 3 2 a b=
3 4 2 3 1 1 3 2 c=
3 4 2 3 1 1 3 2 d=
3 5 1 3 1 2 3 2 ra = 1,54 -
1 2 5 . 2 33 , 1 54 , 1 1 3 5 3 = 1,54 – 0,126 = 1,36 Å rb = 1,54 -
1 3 4 . 2 21 , 0 1 3 4 3 =1,54 – 0,126 = 1,414 ÅPanjang ikatan c sama dengan panjang ikatan b, sedangkan panjang ikatan d sama dengan panjang ikatan a.
Tugas !
Antrasena dan fenantren.
Perhatikan untuk senyawa sianogen, yang strukturnya dapat mengalami resonansi dan membentuk tiga macam struktur.
Yc-c =
Yc-c =
Dengan demikian, ada faktor lain yang mempengaruhi panjang ikatan yaitu berada diantara 2 dan 3 struktur.
4. Hiperkonjugasi
Hiperkonjugasi melibatkan pergeseran elektron ikatan , elektron bebas dan elektron ikatan . Berbeda dengan resonansi yang hanya melibatkan pergeseran elektron ikatan dan elektron bebas. Efek hiperkonjugasi lebih lemah dari pada resonansi. Contoh: H2C H C C H CH2 C C H H+
Energi Ikatan
Energi ikatan adalah energi yang dibutuhkan untuk memutuskan ikatan kovalen antara dua atom secara homolitik (dibagi rata) atau masing-masing membawa jumlah elektron yang sama.
Contoh :
H : H H : H
Lawan dari energi ikatan adalah energi disosiasi. Energi dissosiasi adalah energi yang dibebaskan pada saat ikatan terbentuk.
Ada dua cara dalam melakukan penentuan panjang ikatan : 1. Cara spektroskopi E = h → = 1 = C . C V
2. Cara penurunan persamaan Van’t Hoff
R H T d K In d 1 Keterangan : K = Tetapan kesetimbangan T = Suhu H = Kalor dissosiasi
R = Tetapan Gas (1,199 kal/o mol).
Energi ikatan dwiatom berkisar mulai 36 – 135 kkal/mol. Energi ikatan tertinggi (135 kkal/mol) yang dimiliki oleh molekul HF dan energi ikatan terendah (36 kkal/mol) yang dimiliki oleh molekul I2.
Untuk molekul poliatom, maka yang dihitung adalah (jumlah) ikatan yang ada dalam molekul, misalnya energi ikatan untuk S8 merupakan delapan kali ikatan
S-S. Begitupun juga energi ikatan P4 adalah empat kali ikatan P-P.
ES8 = 8 (S-S) E P4 = 4 (P-P)
Untuk ikatan kovalen heterogen A-B dapat dihitung dengan menggunakan persamaan rata-rata geometri seperti berikut:
EA-B = EAA x EBB Contoh : 1. EC-H = ECC x EHH = 1 / 21 , 91 104 80x kkal mol
Sementara hasil pengamatan 99 kkal/mol1
2. EC-O = ECC x EOO
= 80x 33 51,38kkal/mol1
Hasil pengamatan 81 1
/mol kkal
Jadi, rumus di atas tidak dapat digunakan untuk ikatan yang terdiri dari dua atom yang memiliki perbedaan kelektronegatifan. Semakin besar perbedaan keelektronegatifannya semakin besar energi ikatannya artinya ikatan tersebut tidak 100%
B B A A x E E | |
kovalen. Dengan demikian harus diperhitungkan faktor keelektronegatifan. Rumus di atas tidak berlaku karena tidak memperhatikan faktor keelektronegatifan dari unsur yang saling berikatan kovalen. Dengan demikian, rumus yang diperkenalkan lebih lanjut adalah:
E dalam ev, 1 eV = 23 kkal/mol
Contoh : Hitung EC-H = EAAxEBB + | C H |
= 80x104 + | |2 = 91,61
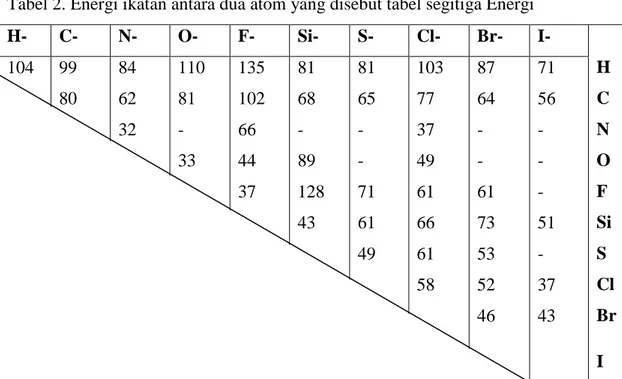
Tabel 2. Energi ikatan antara dua atom yang disebut tabel segitiga Energi
Energi ikatan rangkap dapat dilihat sebagai berikut: C=C : 142 kkal/mol H- C- N- O- F- Si- S- Cl- Br- I- H C N O F Si S Cl Br I 104 99 80 84 62 32 110 81 - 33 135 102 66 44 37 81 68 - 89 128 43 81 65 - - 71 61 49 103 77 37 49 61 66 61 58 87 64 - - 61 73 53 52 46 71 56 - - - 51 - 37 43
C≡C : 186 kkal/mol C=N : 121 kkal/mol C≡N : 191 kkal/mol
Contoh Soal
Hitung perbedaan keelektronegatifan C-H dengan menggunakan table segitiga energy EC-H = 99 kkal/mol EC-C = 80 kkal/mol EH-H = 104 kkal/mol EC-H = Eccx EBB + | C H| 99 = 80x104 + | C H | 99 = 91 + | C H| | C H | = 8/23 ev = 0,34 XC – XH = √ = 0,59 XC = 2,5 = 0,4 XH = 2,1
Energi ikatan dapat dicari dari energi pembentukannya
Contoh : 1. H2O O H H 2H + O H-O-H E O-H =1/2 (E pembentukan H2O) 2H2(g) + O2(g) 2H2O = - 116 kkal /mol
4H(g) 2H2(g) = -208 kkal / mol
2O (g) O2(g) = -118 kkal / mol
4 H (g) + 2O(g) 2H2O = -442 kkal / mol
Dimana Eo-H = -442/4 = -110,5 kkal/mol
2. NH3 = -11 kkal/mol
H2N-NH2= 104 kkal/mol
E N=N = 170 kkal/mol a) Berapa E N-H…..? b) Berapa E N-N…..?
c) Hitung kalor reaksi H2N-NH2 + 2H2O 4H2O + N2
Penyelesaian:
a. N2(g) + 3H2(g) 2NH3(g) = - 22 kkal /mol
3[H-H(g) 2H] = 312 kkal / mol
2 [N+3H NH3 ] = -2a kkal / mol
N=N 2N = 170 kkal / mol N2(g) + 3H2(g) 2NH3 = 482-2a -22 = 482-2a a = 252 kkal/mol EI N-H = 252/3 = 84 kkal/mol b. 2N2(g) + N2(g) H2N-NH2 = 10 kkal /mol N=N 2N = 170 kkal / mol 2 [H-H 2H ] = 208 kkal / mol 4H = 2N H2N-NH2 = 4(-8) - b kkal / mol N2(g) + 2H2(g) H2N-NH2 = 378-336-b B=32 kkal/mol c. =
EI pemutusan
EI pembentukan= 824 -1050 = --176 kkal
Momen Dipol
Molekul yang mempunyai momen dipol (µ) adalah molekul yang mempunyai kutub–kutub positif dan negatif.
Contoh:
Besarnya momen dipol/derajat kepolaran (µ) dapat dihitung melalui persamaan:
µ = momen dipol (debeye/D) diaca debi 1D = ~ 10-10 Å esu d = jarak antara dua muatan (Å) 1Å = 10-8 cm
z = muatan (esu) esu = 10-10 µ H2O = 1,84D
Penentuan Kedudukan (+) dan (-) dalam Molekul Contoh :
CO2 tdk polar
Dalam molekul dikenal pula momen ikatan. Momen ikatan adalah momen yang ditimbulkan oleh adanya perbedaan keelektronegatifan antara dua atom yang berikatan.
∑
Bentuk geometri (struktur rantai) mempengaruhi momen dipol = jumlah momen ikatan
Pengaruh struktur suatu seny.terhadap momen dipol Contoh : H2O = = → = Rumus umum : µ2 = p2 + q2 = (µ1 – q)2 + (µ22 + q2) = µ12 - 2 µ1q + q2 + µ22 - q2 = µ12 + µ22 - 2 µ1q = µ12 + µ22 + 2 µ1 µ2 cos α µ2 = µ12 + µ22 + 2 µ1 µ2 cos q = µ2 cos β = µ2 cos (180 – ) = -µ2 cos
Contoh : H2O
CH3OH
Data µ (momen ikatan) hasil pengukuran
Tabel 3. Harga beberapa momen ikatan N - H 1,3 D C - Br 1,8 D O - H 1,5 D O - H 1,5 D S - H 0,7 D C = O 2,7 D C - N 1.0 D C - Cl 1.9 D C - O 1,2 D
Momen gugus adalah jumlah momen ikatan yang ada pada gugus itu. Momen gugus dipengaruhi posisi pengikatannya (berbeda jika terikat pada senyawa siklik dan pada alifatik).
Contoh : µ gugus NO2 alifatik : 3,68D ; aromatik : 4,21D
Tampak bahwa µ gugus NO2 aromatik lebih besar dari µ gugus NO2 alifatik karena
pada senyawa aromatik terjadi resonansi.
µ2H2O = µOH2 + µOH2 + 2 µOH µOH cos (1040)
(1,84D)2 = 2 µOH2 + (- 0,4838 µOH2) 3,3656 = 1,5162 µOH2
µOH = 99 3D 5 D
√( ) ( )
µ2CH3OH = µCO2 + µOH2 + 2 µCO µOH cos
(1100) (1,69)2 = µCO2 + (1,50D)2 + 2 µCO (1,50D) (- 0,342) 2,8561 = µCO2 + 2,25 + µCO (- 1,026) µCO2 = µCO (- 1,026) – 0,6151 = 0 µCO2 + 1,026 µCO – 0,6151 = 0 = 1,445 D
µ = √( )
=√( ⁄ ) ( √ ) = 3,67 D
Tabel 4. Daftar momen gugus hasil pengukuran
Gugus µ gugus (D) Alkil Aril OCH3 1,22 1,33 NH2 1,20 1,43 Br 2,10 1,73 Cl 2,05 1,70 OH 1,69 1,40 COOH 1,68 1,73 CHO 2,73 2,76 COCH3 2,78 3,50 NO2 3,68 4,21 C ≡ N 4,00 4,39
Pada Br, Cl, OH µ gugus alkil > µ gugus aril karena efek induksi, I(-)
sedangkan mesomerinya, M+
Jika lebih dari satu gugus maka µ gugus total sering cocok dengan µ molekul dan ada
penyimpangan bila ada pengaruh sterik.
Contoh :
Atau
µ2 = µNO22 + µBr2 + 2 µNO2 µBr cos (1200)
Harga µ nitro bromo benzena (eksperimen) = 3,40 D (dalam larutan benzena)Arah berlawanan dikurangkan, searah di jumlahkan.
µ = √ ( ) = √( ) ( ) ( )
= √ = 2,73D
Momen Dipol Senyawa Hidrokarbon
Untuk senyawa alkana (parafin) umumnya momen dipolnya (µ) µ C – CH3 µ C – H
µ C – CH3 µ H
Untuk senyawa aromatik
µ = 0,4 D
dalam toluena ada momen dwikutub + dan - yang ditimbulkan dari pengaruh resonansi dan hiperkonjugasi sehingga mengakibatkan µ(momen dipol) tidak sama dengan nol.
µ (non polar)
µ alifatik
CH3
Alifatik tak jenuh Senyawa Azulena Senyawa duren 1,2,4,5-tetramethylbenzene H3C CH3 CH3 H3C Momen dipolnya (µ) (
Momen Dipol Turunan haloge
Tabel. Momen dipol senyawa turunan klor
Senyawa µ (D) CH3Cl 1,87 C2H5Cl 2,05 n C3H7Cl 2,10 n C5H11Cl 2,12 CH2 = CHCl 1,44 CH ≡ CCl 0,44
Dari tabel terlihat bahwa µ C2H5Cl > µ CH2
= CHCl. Ini disebabkan karena pada CH2 = CHCl terjadi delokalisasi sehingga
ikatannya menjadi lebih pendek (momen dipol menjadi lebih kecil).
Sifat–sifat Keasaman dan Kebasaan Reaktivitas Senyawa Organik
Reaktivitas suatu senyawa organik ditentukan dari gugus fungsinya. Gugus fungsi ada yang bersifat :
1) Induksi (I)
a) Mendorong elektron (+ I) b) Menarik elektron (- I)
2) Mesomeri (M) meliputi resonansi dan hiperkonjugasi a) Meninggalkan gugus fungsi (+ M)
b) Menghampiri gugus fungsi (- M)
Contoh :
-M (masuk ke gugus fungsi) +M (keluar gugus fungsi) dan -I (O menarik elektron) +I (mendorong elektron)
+M (keluar dari gugus) +M (keluar dari
gugus)
C6H5Cl 1,70
-I (menarik elektron) -I (menarik elektron) Faktor yang mempengaruhi keasaman dan kebasaan suatu zat :
1. Efek induksi 2. Efek mesomeri 3. Efek ikatan hidrogen 4. Efek sterik
5. Efek dielektrikum 1. Efek Induksi
a. Suatu asam dengan gugus penarik (-I) akan memperbesar keasamannya. Contoh:
CH3COOH FCH2COOH
pKa : 4,8 pKa : 2,66
b. Semakin besar keelektronegatifan gugus –I tersebut makin kuat asam tersebut. Contoh :
FCH2COOH (lebih asam dari) ClCH2COOH
pKa : 2,66 pKa 2,86
c. Semakin banyak gugus –I (penarik elektron) semakin kuat asam yang bersangkutan. Contoh:
Cl3CCOOH > Cl2CHCOOH > ClCH2COOH pKa : 0,65 pKa : 1,30 pKa : 2,86
Akan tetapi, jika letak gugus –I jauh, maka pengaruhnya hanya sedikit. Contoh :
ClCH2CH2COOH < ClCH2COOH pKa : 4,00 pKa : 2,86
d. Apabila suatu asam mempunyai gugus +I (pendorong elektron), maka asam tersebut akan berkurang keasamannya. Contoh :
HCOOH > CH3COOH pKa : 3,77 pKa : 4,8
Makin kuat gugus +I tersebut makin kecil keasamannya. Contoh :
-OOCCH2COOH < CH3CH2 COOH pKa : 5,69 pKa : 4,85
Suatu basa akan bertambah kuat jika memiliki gugus +I. Contoh : NH3 < CH3NH3 < (CH3)2NH
pKb : 4,75 pKb : 3,34 pKb : 3,29
2. Efek Mesomeri
Pengaruh mesomeri lebih besar dari pada pengaruh induksi terhadap sifat keasaman dan kebasaan. Contoh :
Ditinjau dari efek induksi –I, mestinya asam p-hidroksi benzoat lebih kuat dari pada asam benzoat, namun kenyataannya tidak demikian. Ini disebabkan oleh efek mesomeri +M.
Pada atom O asam p-hidroksi benzoat terjadi muatan (-) yang cenderung berantaraksi dengan atom H sehingga atom H sukar lepas (kurang besifat asam). Hal serupa terjadi pada p-nitro fenol dan m-nitro fenol
OH OH N+ O -O OH N+ O- O
Ditinjau dari suduk efek induksi, seharusnya m-nitro fenol lebih asam dari p-nitro fenol karena jarak ikatan nitro – fenol lebih dekat. Tetapi yang terjadi sebaliknya. Ini disebabkan oleh faktor mesomeri –M.
Kenyataan juga menunjukkan kebasaan anilin lebih besar dari benzil amina.
CH2NH2 NH2
aniline 1 - phenylm et hanam ine
9,37 50.000 kali lebih kecil kebasaannya
3. Efek Ikatan Hidrogen
Ikatan hidrogen adalah antraksi antara atom H yang terikat pada unsur elektronegatif (N, O, F) dengan atom lain yang keelektronegatifannya besar. Ikatan hidrogen bisa terjadi intramolekul dan antarmolekul. Efek elektrostatif yang ditimbulkan adalah jarak pendek (2Å).
COOH
OCH
3COOH
OH
COOH
O
H
OH
COOH
pKa: 4,2 2,98 4,1 1.000 kali lebih asam dari
asam benzoat
Pada saat membentuk ikatan hidrogen dapat memperbesar keasaman seny. syaratnya akan dibentuk cincin khelat 5 atau 6 .
150 kali
300 kali Berbeda dengan ikatan hidrogen pada orto fenol, ikatan hidrogen tidak dapat membentuk anion/basa konjugasi yaitu o-nitro phinolat. Akibatnya keasaman fenol ini hampir sama para-nya
4. Efek Dielektrikum dan Sterik
Hubungan antara dielektrikum dengan keasaman adalah sebagai berikut : RT ln
ΔG0
= Keterangan :
N = Bilangan Avogadro (6,022 x 1023 mol-1) e = muatan elektron D = Bilangan dielektrikum K1/K2 HCO2 – CH2 COOH 734 (asam malonat) HCOO2 – C(C2H5)2 – COOH 121.000 HCO2 – CH2 – CH2 – COOH 19,2 (asam siksinat) HCOO2 – C(CH3)2 C(CH3)2 – COOH 6130
Asam-asam teralkilasi mempunyai rongga yang tetapan dielektrikumnya rendah sehingga K1/K2 besar. Semakin tersubstitusi, semakin kecil bilangan
dielektrikumnya.
Efek sterik menghalangi perputaran gugus untuk berpindah akibatnya antaraksi gugus semakin besar.
STEREOKIMIA
Stereokimia adalah study bagaimana atom dalam suatu molekul tertata dalam ruangan. Stereoisomer atau isomer ruang adalah dua senyawa yang mempunyai rumus struktur yang sama tetapi berbeda penataan ruangnya. Stereoisomer terbagi atas isomer geometri dan isomer optik.
1. Isomer Geometri
Isomer geometri dapat dijumpai pada senyawa alkena atau olevin den senyawa siklik. Untuk membedakan antara 2 struktur yang sama perlu diberi konfigurasi. Konfigurasi tersebut dapat berupa istilah cis – trans dan E – Z.
Sistem cis - trans
Cis = sejajar Trans = bersebrangan
CH3 C H3 H H H3C H CH3 H
Untuk siklik biasanya :
CH3 H H CH3 CH3 H CH3 H
Trans 1,2-dimetil siklopentana cis 1,2-dimetil siklopentana Untuk konformasi :
C
H3 CH3
Trans 1,4-dimetil sikloheksena System E-Z
E = Entgegen = berlawanan Z = Zesammen = Bersama-sama
Br
H C2H5
CH3 Br
H CH3
C2H5
- Aturan Penentuan berdasarkan urutan prioritas sistem E-Z (Aturan Chan-Ingold-Prelog):
1. Atom dengan nomor atom tertinggi mempunyai prioritas utama.
2. Jika unsur sama maka nomor atom berikutnya digunakan untuk memberikan prioritas.
3. Jika atom-atom isotop satu sama lain, maka isotop dengan nomor massa tertinggi memiliki prioritas utama.
4. Jika ikatan yang ada rengkap maka diekivalenkan dengan ikatan tunggal Contoh : CH2-CH2-CH2Cl CH2-CH2-CH2-CH3 H C H3 H2CO CH2OH C H3 H O 6-kloro-3-pentil-2(Z) heksena
2. Isomer optic (ENANTIOMER)
Untuk membedakan dapat ditinjau salah satu dari dua aspek yaitu kiralitas dan unsur-unsur simetris. Pada isomer optik dikenal enantiomer atau rumus molekul dan rumus struktur sama tetapi berbeda sudut putarnya. Suatu senyawa dikatakn optis aktif jika dapat memutar bidang sinar terpolarisasi. Sinar terpolarisasi adalah sinar monokromatis yang memiliki tertentu. Alat untuk mengukur besar perputaran suatu senyawa optis aktif disebut polarimeter.
Sumber lensa prisma sampel prisma bayangan
Cahaya monokromatik mikol mikol
Kiralitas
Atom C dikatakan khiral apabila ke empat gugus yang terikat pada atom C tersebut tidak ada yang sama (atom C asimetris). Untuk membedakan atom C khiral ditentukan dengan konfigurasi. Konfigurasi adalah penyusunan atom-atom disekitar atom C khiral. Ada 2 jenis konfigurasi, yaitu :
- Sistem Absolut (R – S)
Sistem ini menggunakan aturan CHIP, dengan ketentuan :
1. Keempat gugus yang berada pada pusat khiral ditempatkan menurut prioritas.
2. Pusat khiral diamati oleh arah yang berlawanan dengan prioritas terendah. 3. Pilih gugus yang prioritas tertinggi dan tarik anak panah bengkok ke gugus
dengan prioritas tertinggi berikutnya.
4. Bila searah jarum jam diberi konfigurasi R dan bila berlawanan dengan arah jarum jam diberi konfigurasi S.
CH2OH OH H O H R COOH OH OH H H O H R
4-okso-(2-S-3-R) dihidroksi butanoat - Sistem Relatif
Sistem ini umumnya digunakan pada karbohidrat dan asam-asam amino. Menurut Fischer, jika gugus –OH pada atom C nomor 2 terakhir berada disebelah kanan disebut D dan jika berada disebelah kiri disebut L.
CH2OH OH H O H CH2OH CH3 O H O H D (+) gliseraldehid L (-) gliseraldehid - Unsur-Unsur Asimetris
Senyawa dengan satu atom C asimetris COOH OH H CH3 CH3 C H3 C H3 C H3
Proyeksi Fischer Proyeksi Bola dan Pasak
Jika senyawa yang dicerminkan menghasilkan bayangan yang tidak dapat dihimpitkan disebut senyawa optis aktif. Jika suatu senyawa terdiri dari 50% senyawa I dan 50% senyawa II disebut campuran rasemat dan senyawa ini memiliki titik leleh lebih rendah dari kedua zat penyusunnya tetapi memiliki kelarutan yang lebih besar.
Senyawa dengan dua atom asimetris
Senyawa ini memiliki 4 pasangan enantiomer/ stereoisomer. Pengecualian terhadap asam tartrat hanya memiliki tiga stereoisomer.
COOH
COOH
H
OH
H
OH
ICOOH
COOH
H
O
H
H
O
H
IICOOH
COOH
OH
H
H
O
H
IIICOOH
COOH
O
H
H
H
OH
IV IDENTIK ENATIOMERStruktur asam tartrat identik, artinya tidak optis aktif. Senyawa yang memiliki atom C khiral tetapi tidak optis aktif disebut senyawa meso. Misalnya pada senyawa I dan II. Sedangkan untuk senyawa I dan III merupakan senyawa optis aktif sebagian (pada atom C nomor 2) yang disebut epimer. Sedangkan senyawa optis aktif sebagian (bukan pada atom C nomor 2) disebut senyawa diastereoisomer.
1 n 3 epimer
Senyawa dengan tiga atom C asimetris
COOH COOH H OH H OH H OH COOH COOH OH H H O H H O H COOH COOH H OH O H H H OH COOH COOH O H H O H H H OH COOH COOH H O H H O H H O H COOH COOH O H H H OH H OH COOH COOH H O H OH H H O H COOH COOH OH H OH H H O H I II III IV V VI VII VIII Ket :
Senyawa (I & II), (V & VI), (III & VIII), (IV & VII) identik Jadi, hanya ada 4 enantiomer pada senyawa tersebut.
Terjadi pada senyawa monosakarida (misanya glukosa) CHO CH2OH H OH O H H H OH H OH CHO CH2OH O H H H OH O H H O H H D (+) glukosa D (+) Mannosa Karbohidrat
Karbohidrat terdiri dari gugus OH dan karbonil. Karbohidrat dapat membentuk hemiasetal secara intramolekuler.
R O H
+
R OH R OH H OR'+
R OH R OR' H OR' R OH H OR' (HEMIASETAL) (ASETAL) Contohnya :CH2OH H OH O H H H OH H OH O H CH2OH H OH O H H O H H H H O
+
CH2OH H OH O H H H OH H H O ANOMER -D-glukosa (t.l. 146 C) -D-glukosa (t.l. 150C) Bentuk howards : O CH2OH H H OH OH H OH H OH H OH O H OH H OH OH H H OH H O CH2OH H H OH OH OH H H OH H -D-glukopiranosa D (+) glukosa -D(+)-glukosa t.l 150C t.l. 146C Bentuk konformasi : O OH OH HOH2C O H O H OH O OH HOH2C O H O H O OH OH HOH2C O H O H 63 % 0.02 % 37 % Untuk Fruktosa Proyeksi Fischer CH2OH O H H H OH H OH O CH2OH CH2OH O H H H OH H CH2OH O H O
+
CH2OH O H H H OH CH2OH OH H OBentuk Howards dan konformasi yang stabil:
O
OH
CH
2OH
OH
H
H
OH
CH
2OH
OH
O CH2OH H H CH2OH OH H OH HUntuk sukrosa (-fruktopiranosil--D-glukopiranosida)
O H H H O H OH H OH H CH2OH O O HO H O H OH H CH2OH OH Bentuk konformasi O O H H OH H H H O H CH2OH O H CH2OH O H CH2OH OH H H OH Epimerisasi
Perubahan konfigurasi pada atom C nomor 2 disebut epimerasi. Sedangkan perubahan konfigurasi pada atom C selain nomor 2 disebut diastereoisomer.
D L O H EPIMERISASI D D O H L O H L DIASTEREOISOMERASI Unsur-Unsur Simetris
Suatu senyawa yang mempunyai unsur simetris biasanya tidak optis aktif. Unsur-unsur simetris meliputi :
- Bidang Simetris
Bidang simetris adalah bidang yang membelah dua bagian suatu molekul yang merupakan bayangan cermin satu sama lain.
Contoh : H Me Et Me Et H H Me Et Me Et H S R - Pusat Simetris
Pusat simetris adalah titik dimana jarak semua titik ke titik tersebut sama panjang.
Me H Et Me Et H 180O Me H Et Me Et H 180O
- Sumbu Simetri Sederhana
Sumbu simetris sederhana adalah bila suatu struktur melalui sumbu tersebut sebesar 2/n maka akan dihasilkan struktur yang identik. Jika suatu senyawa memiliki sumbu simetris sederhana maka dapat bersifat optis aktif dan dapat pula bersifat tidak optis aktif.
Contoh : Me H Et Me Et H 180O Me H Et Me Et H Me H Et Me Et H
Disimetris (optis aktif)
Me H Et Et Me H 180O Me H Et Et Me H Me H Et Et Me H IDENTIK
- Sumbu Simetris Bolak Balik
Sumbu simetris bolak balik adalah bila suatu struktur melalui sumbu tersebut sebesar 2/n lalu dicerminkan pada sumbu tersebut maka akan dihasilkan struktur yang identik.
Contoh : SB SB SB SB 180O SB SB SB SB SB SB SB SB
identik artinya tidak optis aktf
KONFORMASI
Konformasi adalah cara penyusunan gugus suatu molekul dalam ruang yang berbeda disebabkan oleh pemutaran pada ikatan sigma karbokation (konformasi bukan merupakan suatu isomer). Macam-macam konformasi antara lain :
1. Rumus Dimensional H H OH CH2Cl H HO
2. Rumus Bola dan pasak dengan rumus show horse
CH3 H BR CH3 H Br H H ClH2C OH H H
Rumus Bola dan Pasak
Rumus so horse 3. Fraksi Newman OH H H CH2Cl OH H 4.Proyeksi Fischer CH2Cl OH H H HO H
Adanya pemutaran ikatan sigma maka suatu molekul dapat memiliki beberapa konformasi. Tetapi, ada yang stabil dan tidak stabil. Konformasi yang stabil disebut konformer, tetapi konformer bukan isomer sebab dapat dipertukarkan.
Contoh :
CH3 - *CH Br - *CH Br – CH3
CH3 H Br CH3 H Br H Ch3 Br CH3 Br H Br H CH3 Ch3 Br H Br H CH3 Ch3 Br H Br Br H CH3 Br H
Konformasi fraksi newman :
(Fully eclips) Gauche eclips)
Eclips (staggered) H Ch3 Br CH3 Br H Br H CH3 Ch3 Br H Br H CH3 Ch3 Br H
Eclips Gauche eclips) (Fully eclips)
Dari keempat konformasi, staggered yang paling stabil sebab tidak ada interaksi antara gugus senama sehingga gaya tarik dan gaya tolak tidak ada. Semakin jauh maka energi makin rendah. Adapun profil energinya :
0 60 120 180 240 300 360 Sikloheksena :
Stuktur chair yang paling stabil sebab semua sudutnya tetrahedral (109) sehingga atom-atomnya dapat bebas bergerak. Bentuk chair berada dalam kesetimbangan :
I I I I I I
Dari I ke III disebut flip over, jika terjadi flip over maka yang dikedudukan equatorial menjadi aksial dan aksial menjadi equatorial.
Contoh : Cis 1,4-dimetil sikloheksana H3C CH 3 H H H H3C H H CH3 H ` H CH3 H H CH3 H
Senyawa ini tidak begitu stabil sebab ada antaraksi yang sama antara CH3
dan H.
Untuk Trans 1,4-dimetil sikloheksana :
H H3C H CH3 CH3 H CH3 H
Untuk kestabilan, gugus yang terbesar harus berada pada kedudukan equatorial.
H H
H H
H H Senyawa Bifenil
Kedua cincin seakan-akan planar, tetapi karena ikatannya tunggal dan terjadi rotasi maka senyawa ini dapat beresonansi melalui ikatan tunggal. Akan tetapi jika ada subtituen orto, meta, maka ada antaraksi subtituen yang cukup besar. Pada suhu rendah, kecepatan berotasi lambat (jika tidak ada gugus penghalang). Contoh : NO2 O2N NO2 NO2
No2 H H NO2 No2 H No2 H
Jika Diamati dari kanakan Jika Diamati dari Kiri
CH3 Cl H
Alena
Senyawa alena adalah senyawa yang memiliki dua atau lebih ikatan rangkap 2 yang terkomulasi atau senyawa yang memiliki ikatan rangkap yang bertetangga dengan lingkar.
H3C H3C (siklo heksadiena) Penentuan konfigurasi : C C A B A B A B B A B A B
Dari kanan Dari kiri
H C l
C l H
Kata Pengantar
Puji Syukur kami panjatkan kehadirat Allah S.W.T. atas hidayah dan izin-Nyalah, sehingga diktat ini dapat tersusun sesuai dengan rencana. Diktat ini dimaksudkan untuk membantu mahasiswa yang mengikuti kimia dasar lanjut belajar secara mandiri dan dapat memahami dengan baik konsep-konsep yang diuraikan pada mata kuliah kimia dasar lanjut.
Diktat ini diperutnukkan bagi mahasiswa semester genap mahasiswa FMIPA UNM yang terdiri dari beberapa pokok bahasan, yaitu Struktur Atom, Sistem Periodik, Ikatan Kimia, Kesetimbangan Kimia, Larutan Hidrolisis dan Larutan Penyangga, Kimia Karbon, dan Kimia Unsur.
Besar harapan kami semoga bermanfaat bagi mahasiswa yang mengikuti kuliah kimia dasar lanjut, terutama mahasiswa dalam lingkungan Fakultas Matematika dan Ilmu Pengetahuan Alam UNM Makassar.
Makassar, Januari 2009