PENUNTUN PRAKTIKUM BIOKIMIA DASAR
UNTUK MAHASISWA TEKNOLOGI LABORATORIUM MEDIS
DISUSUN OLEH : WIJIASTUTI, M.Si.
UNIT BIDANG ILMU BIOKIMIA JURUSAN ANALIS KESEHATAN FAKULTAS FARMASI DAN SAINS
UNIVERSITAS MUHAMMADIYAH PROF. DR. rHAMKA JAKARTA
2020
2
PENUNTUN PRAKTIKUM BIOKIMIA DASAR Nama Mahasiswa :
NPM :
Kelas/Kelompok : Hari Praktikum : Jam Praktikum :
Dosen : Wijiastuti, M.Si
UNIT BIDANG ILMU BIOKIMIA JURUSAN ANALIS KESEHATAN FAKULTAS FARMASI DAN SAINS
UNIVERSITAS MUHAMMADIYAH PROF.DR.HAMKA JAKARTA
2020
3
KATA PENGANTAR
Puji syukur kita panjatkan kehadirat Allah SWT, atas berkah dan rahmat hidayah-Nya, penuntun praktikum ini dipergunakan pada praktikum Biokimia Dasar bagi mahasiswa Teknologi Laboratorium Medis (Analis Kesehatan), Fakultas Farmasi dan Sains, Universiras Muhammadiyah Prof. DR. Hamka, Jakarta.
Dalam pelaksanaan praktikum, mahasiswa diwajibkan mengisi lembar kerja hasil praktikum yang telah disediakan. Diharapkan pula mahasiswa membaca literature yang berhubungan materi praktikum.
Kami sadari bahwa penuntun praktikum ini masih terdapat banyak kekurangan, walaupun demikian kami mengharapkan penuntun ini dapat memberikan sumbangan ilmu semua pihak.
Jakarta, Februari 2020 Penulis
4 DAFTAR ISI Kata
Pengantar……….……...
3
Daftar
Isi……….….………….
4
Tata Tertib Praktikum
……….….…………
5
BAB I. Uji Kualitatif Karbohidrat……….…….…….….. 7
BAB II. Lipida………;……….. 39
BAB III. Protein………..……… 59
Daftar Pustaka
………..
80
5
TATA TERTIB PRAKTIKUM
Mahasiswa yang diperkenankan melakukan praktikum adalah mereka yang terdaftar secara akademik, yang selanjutnya disebut sebagai Praktikan.
Tata tertib praktikum Biokimia Dasar adalah :
1. Praktikan wajib hadir 10 menit sebelum praktikum dimulai, keterlambatan lebih dari 10 menit sejak praktikum dimulai , praktikan dianggap tidak hadir.
2. Jika berhalangan hadir, praktikan harus dapat memberikan keterangan tertulis terkait dengan alasan ketidak hadirannya.
3. Jika akan mengganti hari wajib memberikan keterangan tertulis terlebih dahulu dari koordinator pengampu praktikum.
4. Praktikan memasuki ruang laboratorium dengan menggunakan jas laboratorium.
5. Praktikan memakai sepatu tertutup
6. Praktikan wajib membawa Modul (Penuntun Praktikum), laporan kerja praktikum, serbet, masker, tisu, dan alat-alat yang dibutuhkan pada saat praktikum.
7. Dilarang membawa peralatan yang tidak berhubungan dengan praktikum.
8. Dilarang keluar masuk laborratorium kecuali ada izin ke toilet.
9. Tidak diperbolehkan makan, minum,merokok
10. Dilarang berisik, bercanda, tertawa atau mengganggu teman pada saat praktikum berlangsung.
11. Praktikan bertanggung jawab atas peralatan yang dipinjamnya, kebersihan meja masing-masing serta lantai disekitarnya.
12. Bila terjadi kerusakan alat atau alat gelas yang pecah maka praktikan wajib menggantinya segera.
13. Setelah menggunakan reagen, praktikan wajib meletakkan kembali ke tempat semula
14. Dilarang menghamburkan reagen praktikum.
6
15. Apabila membuang reagen praktikum pada tempat yang telah disediakan.
16. Sewaktu waktu Dosen, asisten jaga dapat melakukan tes untuk materi yang akan atau telah dikerjakan.
17. Praktikan melakukan analisis sesuai dengan materi yang dipraktikumkan, mencatat hasilnya pada lembar kerja praktikum serta meminta ACC pada dosen/asisten.
7 BAB I
UJI KUALITATIF KARBOHIDRAT A. Pendahuluan
Karbohidrat adalah biomakromolekul yang tersusun atas unsur karbon (C), hidrogen (H), dan oksigen (O) penyusun sebagian besar senyawa organik di bumi dan berperan utama dalam proses kehidupan makhluk (BOUN, 2013). Istilah karbohidrat umumnya digunakan pada kelompok polihidroksi aldehida atau keton yang dikenal sebagai gula. Pada tanaman karbohidrat merupakan hasil dari proses fotosintesis dengan substratnya adalah karbondioksida, air dan sinar matahari. Karbohidrat adalah senyawa yang mudah dicerna oleh hewan, dimana dalam sistem biokimia tubuh akan dikonversi kembali menjadi karbon dioksida dan air, bersamaan reaksi tersebut terjadi pelepasan energi (ATP) (Yusuf, 2010).
Karbohidrat diklasifikasikan menjadi karbohidrat sederhana dan kompleks.
Karbohidrat sederhana biasanya dikenal dengan monosakarida atau gula sederhana, yang mengandung satu molekul sakarida dan tidak dapat dipecah lagi menjadi gugus karbohidrat yang lebih kecil. Sedangkan karbohidrat kompleks mengandung lebih dari satu gugus sakarida terdiri dari disakarida, oligosakarida dan polisakarida (Yusuf, 2010). Sedangkan menurut BOUN (2013), penggolongan karbohidrat berdasarkan kandungan gugus sakaridanya, karbohidrat (sakarida) dibagi menjadi empat kelompok: monosakarida, disakarida, oligosakarida dan polisakarida.
Monosakarida juga dapat diklasifikasikan sebagai ketosa dan aldosa. Ketosa adalah monosakarida yang mengandung gugus karbonil. Aldosa mengandung gugus aldehid. Ada istilah "aldohexose" untuk aldosa heksosa atau "ketohexose" untuk ketosa yang juga merupakan heksosa (Yusuf, 2010).
Bentuk disakarida dapat didegradasi menjadi dua unit monosakarida melalui proses hidrolisis dan pelepasan 1 molekul air. Oligosakarida dapat diurai menjadi 3-6 unit monosakarida dan melepaskan satu atau lebih gugus air, sedangkan polisakarida
nCO2 + n H2O + Energi (ATP) CnH2nOn + n O2
8
dapat diurai menjadi 7 atau lebih unit monosakarida dan melepaskan satu atau lebih gugus air (Yusuf, 2010).
Polisakarida berperan sebagai simpanan energi (misalnya, pati pada tanaman dan glikogen pada hewan) dan sebagai komponen struktural (misalnya, Selulosa pada tanaman dan kitin dalam artropoda). Polisakarida struktural sering ditemukan berkombinasi dengan protein (glikoprotein atau mucoprotein) atau lipid (lipopolisakarida). Bentuk 5-karbon monosakarida ribosa adalah komponen penting dari koenzim (misalnya, ATP, FAD dan NAD) dan tulang punggung molekul genetik yang dikenal sebagai RNA. Deoksiribosa terkait adalah komponen DNA. Sakarida dan turunannya berperan penting dalam berbagai sistem tubuh (BOUN, 2013).
B. Uji Molisch
Molisch adalah uji sensitifitas kimia terhadap kehadiran karbohidrat, berdasarkan dehidrasi karbohidrat oleh asam sulfat menjadi furfural atau hydroxymethylfurfural (aldehid) yang berkondensasi dengan dua molekul fenol (biasanya α-naftol, resorsinol, timol) menghasilkan warna merah atau ungu. Uji ini adalah uji umum terhadap semua golongan karbohidrat, dan beberapa senyawa gabungan yang mengandung karbohidrat. Semua karbohidrat mulai dari monosakarida, disakarida, sampai dengan polisakarida, asam nukleat dan glikoprotein akan memberikan reaksi positif (Awasthi et al, 2013; BOUN, 2013; Elzagheid, 2018).
Bentuk pentosa didehidrasi menjadi furfural, sedangkan heksosa didehidrasi menjadi 5-hidroksi metil furfural (Awasthi et al, 2013).
PRINSIP :
TUJUAN :
9
REAKSI :
ALAT DAN BAHAN :
a. Tabung Reaksi b. Rak Tabung c. Pipet tetes
d. α-Nafthol 5% dalam Alkohol 95%, e. H2SO4 Pekat
SAMPEL :
Berbagai Larutan Karbohidrat 1%.
CARA KERJA :
1. Masukkan 2 mL larutan sampel ke dalam tabung reaksi.
2. Kemudian tambahkan 2-3 tetes larutan α-Nafthol, kocok.
3. Tambahkan perlahan 1-2 mL H2SO4 Pekat, melalui dinding tabung. Sehingga terbentuk 2 lapisan. Hati-hati, jangan sampai tercampur.
4. Amati warna yang terbentuk diantara 2 lapisan tersebut.
5. Bandingkan hasil dengan larutan control dan blanko.
6. Hasil positif ditandai dengan cincin berwana ungu.
HASIL PERCOBAAN :
Bahan Tabung 1 Tabung 2 Tabung 3 Tabung 4 Tabung 5
10 Reagen Molisch
Kocok H2SO4
Hasil :
PEMBAHASAN :
Gambar 1. Uji Molisch (Elzagheid, 2018)
11
12
KESIMPULAN :
TTD Dosen / Asisten Dosen
13 C. Uji Iodium
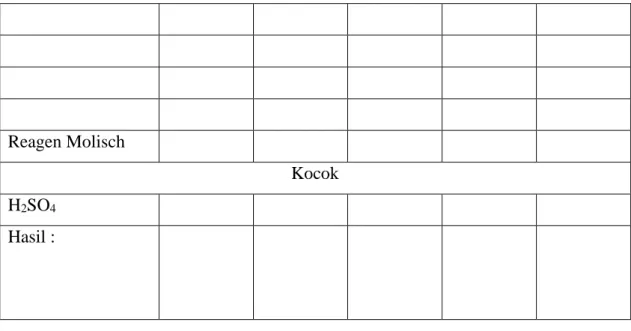
Uji Iodium digunakan untuk mendeteksi kehadiran pati (Amilum/starch). Larutan Iodium adalah campuran antara iodium dan potassium iodide. Reaksi larutan Iodium dengan pati menghasilkan warna ungu/biru kehitaman.
Uji Iodium adalah indikator untuk mendeteksi keberadaan pati dan dapat diaplikasikan untuk semua jenis polisakarida (BOUN, 2013). Iodium dengan polisakarida akan membentuk kompleks adsorpsi berwarna. Pati memberi warna biru dengan yodium, sedangkan glikogen memberikan kompleks berwarna coklat kemerahan. Oleh karena itu, metode ini bermanfaat dan mudah untuk mendeteksi amilase, amilopektin & glikogen (Awasthi et al., 2013).
PRINSIP :
TUJUAN :
REAKSI :
ALAT DAN BAHAN :
a. Tabung Reaksi
14 b. Rak Tabung
c. Pipet tetes
d. Larutan Iodium (Larutan iodium 0.005 N dalam potassium iodide 3% (w/v) e. Aquadestilata
SAMPEL :
Berbagai Larutan Gula 1%
CARA KERJA :
1. Disiapkan dua buah tabung reaksi.
2. Tabung pertama diisi dengan 1 mL sampel.
3. Tabung kedua diisi dengan 1 mL larutan aquadestilata.
4. Ke setiap tabung tambahkan dengan 1-2 tetes larutan iodium, kocok.
5. Amati perubahan warna yang terjadi.
6. Amati perubahan warna jika tabung dipanaskan dan didinginkan.
7. Positif polisakarida ditandai dengan terbentuknya kompleks warna ungu/biru kehitaman.
Gambar 2. Uji Iodium (Elzagheid, 2018)
15
HASIL PERCOBAAN :
Bahan Tabung 1 Tabung 2 Tabung 3 Tabung 4 Tabung 5
Larutan Iodium
Kocok Hasil :
PEMBAHASAN :
16
KESIMPULAN :
TTD Dosen / Asisten Dosen
17 D. Uji Barfoed
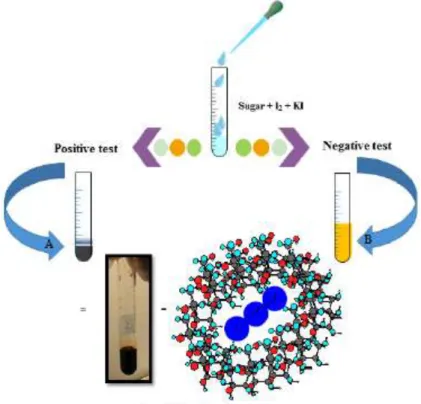
Uji Barfoed adalah uji untuk mendeteksi kehadiran monosakarida. Reagen Barfoed adalah campuran asam asetat dan Cu (II) asetat, larutan ini bersifat asam lemah, sehingga larutan Barfoed hanya dapat mereduksi golongan monosakarida.
Reaksi terjadi jika dikombinasikan larutan sampel dengan larutan Barfoed dalam air panas. Uji ini mirip dengaan reaksi pada uji Benedict (untuk uji aldehida). Pereaksi Barfoed dikombinasikan dengan larutan uji dan direbus akan terbentuk endapan tembaga oksida (II) berwarna merah jika terjadi reduksi gula. Reaksinya negatif terhadap gula disakarida (Awasthi et al, 2013; BOUN, 2013).
Aldehida adalah kelompok monosakarida yang biasanya membentuk siklik hemiasetal yang jika teroksidasi menjadi karboksilat. Monosakarida biasanya tereduksi dalam 1-2 menit, sedangkan disakarida membutuhkan waktu lebih lama antara 7-12 menit untuk dihidrolisis kemudian bereaksi dengan reagen (Awasthi et al, 2013).
PRINSIP :
TUJUAN :
REAKSI :
18
ALAT DAN BAHAN :
a. Tabung Reaksi b. Rak Tabung c. Penangas air d. Pipet tetes
e. Reagen Barfoed (larutan 13,3 g Cu Asetat dalam 200 mL air dan asam asetat glasial)
SAMPEL :
Berbagai Larutan Gula 1%
CARA KERJA :
1. Masukkan 1 mL sampel dan tambahkan dengan 2 mL pereaksi Barfoed, campurkan.
2. Rebus tabung yang sudah berisi campuran (sampel-pereaksi Barfoed) pada air mendidih selama 5 menit. Angkat. Amati larutan dan endapan yang terjadi.
Gambar 2. Uji Barfoed (Elzagheid, 2018)
19
HASIL PERCOBAAN :
Bahan Tabung 1 Tabung 2 Tabung 3 Tabung 4 Tabung 5
Larutan Barfoed
Kocok, Didihkan 5 Menit Hasil :
PEMBAHASAN :
20
KESIMPULAN :
TTD Dosen / Asisten Dosen
21 E. Uji Benedict
Uji Benedict adalah uji umum untuk alpha hidroksi aldehid dan keton. Dapat digunakan untuk mendeteksi keberadaan gula pereduksi dalam berbagai sampel (Elzagheid, 2018). Gula pereduksi akan mereduksi logam seperti tembaga (Cu), Ba, Hg (merkuri), Besi (Fe) & perak (Ag) dalam larutan alkalin, ketika biru alkali (tembaga oksida atau hidroksida) tersuspensi dalam larutan alkalis yang dipanaskan akan membentuk endapan biru oksida tembaga (CuO) (Awasthi et al, 2013).
Gula pereduksi berpotensi mereduksi ketika gugus aldehida atau ketonik bebas setelah dipanaskan, tembaga biru hidroksida dikonversi menjadi suspensi oksida tembaga merah (Cu2O) endapan merah kecoklatan dari logam. Reaksi ini digunakan dalam menguji reduksi logam yang diendapkan dalam larutan alkalis. Tes ini lebih sensitif dan pereaksi tidak rusak jika disimpan untuk waktu lebih lama (Tiwari, 2015).
Pada metode ini natrium sitrat berfungsi sebagai agen pengkelat membentuk ion kompleks yang larut dengan Cu++, mencegah pengendapan CuCO3 dalam larutan alkali. Kandungan gula akan ditunjukan dengan hasil endapan tembaga oksida merah.
Warna endapan yang terbentuk tergantung pada konsentrasi gula dari hijau hingga warna merah bata. Semua monosakarida bersifat pereduksi gula karena semuanya memiliki gugus karbonil reaktif bebas. Beberapa disakarida seperti maltosa memiliki sekelompok karbonil dapat juga mereduksi gula tetapi kurang reaktif dari pada monosakarida (Awasthi et al, 2013).
PRINSIP :
22
TUJUAN :
REAKSI :
ALAT DAN BAHAN :
a. Tabung Reaksi b. Rak Tabung c. Penangas air d. Pipet tetes
e. Reagen Benedict, komposisi nya :
- Reagen A: Larutkan 173 gram Sodium citrat dan 100 gram Na2CO3 anhidrat dalam 600 ml H2O panas. Encerkan menjadi 800 ml dengan panas.
- Reagen B: Larutkan 17.3 gram CuSO4.5H2O dalam 100 ml air panas dan dinginkan.
- Campurkan Reagen A dan B (dalam kondisi dingin) dan di encerkan sampai dengan 1 Liter.
SAMPEL :
Berbagai Larutan Gula 1%
CARA KERJA :
1. Masukkan 0.5-1 mL larutan sampel kedalam 5 ml reagen Benedict. Kocok.
2. Panaskan campuran sampel+reagen Benedict pada air mendidih selama 5 menit.
3. Dinginkan larutan pada air mengalir, amati perubahan warna yang terjadi dari biru menjadi hijau, kuning, jingga sampai merah bata, tergantung berapa banyak gula yang terkandung dalam sampel.
23
HASIL PERCOBAAN :
Bahan Tabung 1 Tabung 2 Tabung 3 Tabung 4 Tabung 5
Larutan Benedict
Kocok, Didihkan 5 Menit Hasil :
PEMBAHASAN :
24
KESIMPULAN :
TTD Dosen / Asisten Dosen
25 F. Uji Fehling
Uji Fehling digunakan untuk membedakan antara gula yang mereduksi dan tidak mereduksi (BOUN, 2013; Tiwari 2015). Karbohidrat memiliki gugus aldehida atau keton yang bebas atau berpotensi bebas dapat bertindak sebagai agen pereduksi.
Reagen Fehling berwarna biru tua dan terdiri dari tembaga sulfat yang dicampur dengan kalium natrium tartarate dan natrium hidroksida.
Pada sampel yang telah diblarutkan dengan pereaksi Fehling lalu dipanaskan, kompleks bistartarocuprate (II) akan mengoksidasi aldosa menjadi asam aldonat yang sesuai, dalam proses yang bersamaan kompleks ion tembaga (II) direduksi membentuk warna mulai menjadi warna kuning atau merah yang tidak larut (endapan ion tembaga (I) oksida (Cu2O)). Disisi lain, ketosa teroksidasi menjadi asam rantai pendek (Tiwari 2015).
Ion tartarate mencegah pembentukan Cu(OH)2 yang tidak dapat larut pada reaksi CuSO4.5H2O dan NaOH dalam pembentukkan kompleks larutan bistartaratocuprate (II). Kompleks ini melepaskan ion kupri secara perlahan untuk direduksi sehingga mencegah pembentukan oksida tembaga hitam. Jika solusi Fehling dipanaskan tanpa adanya reduksi gula maka akan terbentuk endapan hitam oksida tembaga (Tiwari 2015).
PRINSIP :
TUJUAN :
26
REAKSI :
ALAT DAN BAHAN :
a. Tabung Reaksi b. Rak Tabung c. Penangas air d. Pipet tetes
e. Pereaksi Fehling A (Larutkan 7.0 g CuSO4.7H2O dalam 100 ml H2O)
f. Pereaksi Fehling B (Larutkan 24.0 g KOH dan 34.6 g K Na tartarate dalam 100 ml H2O)
SAMPEL :
Berbagai Larutan Gula 1%
CARA KERJA :
1. Masukkan 1 mL larutan Fehling A (larutan CuSO4 encer) dan 1 mL larutan Fehling B (larutan potassium tartrate) ke dalam tabung reaksi.
2. Tambahkan 2 mL larutan gula, campur dengan baik dan didihkan selama 2-3 menit.
3. Amati terbentuknya presipitat kupri oksida berwarna merah yang terbentuk pada akhir reaksi.
HASIL PERCOBAAN :
Bahan Tabung 1 Tabung 2 Tabung 3 Tabung 4 Tabung 5
27 Larutan Fehling A
Larutan Fehling B
Kocok, Didihkan 2-3 Menit Hasil :
PEMBAHASAN :
28
KESIMPULAN :
TTD Dosen / Asisten Dosen
29 G. Uji Seliwanoff
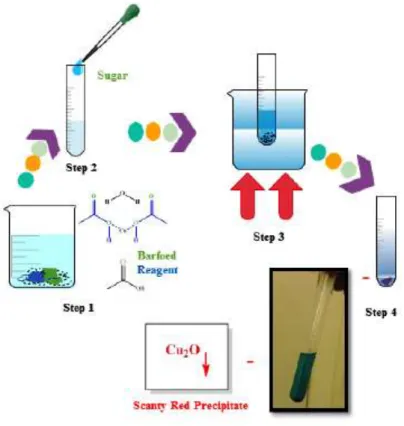
Uji Seliwanoff adalah reaksi uji khusus untuk mendeteksi gula dengan gugus ketosa. Gula dapat dibedakan aldosa dari ketosa berdasarkan pada kemampuan mereka untuk membentuk furfural. Ketika konsentrasi HCl ditambahkan, ketosa akan mengalami dehidrasi dan lebih cepat menghasilkan turunan furfural aldosa. Derivat ini akan membentuk kompleks dengan resorsinol dan menghasilkan warna merah tua (Awasthi et al, 2013; Elzagheid, 2018)). Jika gula mengandung gugus keton, maka gula tersebut adalah ketosa dan jika mengandung gugus aldehida, maka gula tersebut adalah aldosa (Elzagheid, 2018).
Gambar 1. Uji Seliwanoff (Elzagheid, 2018)
30
PRINSIP :
TUJUAN :
REAKSI :
ALAT DAN BAHAN :
a. Tabung Reaksi b. Rak Tabung c. Penangas air d. Pipet tetes
e. Pereaksi Seliwanoff
SAMPEL :
Berbagai Larutan Gula 1%
CARA KERJA :
1. Masukkan 1 mL larutan gula kedalam 2 mL pereaksi Seliwanoff, campur dengan baik dan didihkan selama 1-2 menit
31
2. Amati terbentuknya warna merah ceri yang terbentuk pada akhir reaksi.
HASIL PERCOBAAN :
Bahan Tabung 1 Tabung 2 Tabung 3 Tabung 4 Tabung 5
Larutan Seliwanoff
Kocok, Didihkan 1-2 Menit Hasil :
PEMBAHASAN :
32
KESIMPULAN :
TTD Dosen / Asisten Dosen
33 H. Uji Osazon (Phenylhydrazene’s Test)
Uji Osazon adalah uji mikroskopis terhadap senyawa bisphenyl hydrazones yang terbentuk ketika gula (monosakarida) direaksikan dengan senyawa fenilhidrazin.
Osazone adalah senyawa kristal yang diperoleh pada titik leleh yang halus/tajam. Gula pereduksi yang memiliki gugus aldehida atau gugus keton akan bereaksi dengan fenilhidrazin. Reaksi ini terdiri atas 3 langkah dan membutuhkan 3 mol fenilhidrazin (Ghafoor, 2016).
Saat reaksi fenilhidrazin dengan monosakarida, ada penambahan fenil hidrazin yang dikonsumsi untuk mengoksidasi gugus OH yang berdekatan menjadi gugus karbonil dan kemudian membentuk fenil hidrazon kedua. Hidrazon bisfenil inilah yang disebut osazon (Ghafoor, 2016).
PRINSIP :
TUJUAN :
REAKSI :
34
ALAT DAN BAHAN :
a. Tabung Reaksi b. Rak Tabung c. Penangas air d. Pipet tetes
e. Pereaksi Phenylhydrazene
SAMPEL :
Berbagai Larutan Gula 1%
CARA KERJA :
1. Masukkan 300 mg Campuran fenil hidrazin (2 bagian fenil hidrazin hidroklorida dicampur dengan 3 bagian natrium asetat) dan tambahkan 5 ml larutan yang diuji.
2. Kocok, dan panaskan di air mendidih selama 30 - 45 menit.
3. Biarkan tabung mendingin perlahan (bukan di bawah keran) dan periksa kristal secara mikroskopis.
Presipitasi pada uji Osazon (Yusuf, 2010)
35
Glukosazone (Yusuf, 2010)
Maltosazone (Yusuf, 2010)
36
HASIL DAN PEMBAHASAN :
Galaktosazone (Yusuf, 2010)
Laktosazone (Yusuf, 2010)
37
KESIMPULAN :
TTD Dosen / Asisten Dosen
38
DETERMINASI KARBOHIDRAT
Start
Uji Molisch Non - Karbohidrat (-)
Karbohidrat
Uji Iodium (+)
(+)
Uji Barfoed (-)
Uji Benedict (+) (-)
Uji Seliwanoff
(+)
Uji Osazon (+) (-)
39 BAB II
UJI KUALITATIF LIPID
A. PENDAHULUAN
Lipid adalah sekelompok senyawa kimia yang memiliki sifat khas tidak dapat larut dalam air. Fungsi biologis lipid beragam antara lain sebagai bentuk simpanan energi utama terbanyak dalam organisme, pembentuk struktur, dan masih banyak lagi peranannya dalam tubuh (Nelson and Cox, 2006).
Ester gliserol dan asam lemak dikenal sebagai gliserida. Lemak atau minyak adalah gliserida yang terbentuk secara alami, bentuknya yang padat atau cair tergantung pada bentuknya pada suhu kamar. Gliserol alkohol trihidrat dapat diesterifikasi dan menghasilkan mono, di-, dan trigliserida. Asam lemaknya mungkin sama atau berbeda. Pada saponifikasi, diperoleh: gliserol dan asam lemak bebas.
Lemak hewani sebagian besar terdiri dari trigliserida yang mengandung asam lemak jenuh penuh dengan rantai lurus dan sejumlah atom karbon (Mahmoud and Mohamed, 2015).
Lipid dikelompokan menjadi dua kelompok, yaitu lipid sederhana dan lipid kompleks. Lipid sederhana terdiri atas asam lemak, lipid netral (monoglyceride, diglycerde, dan triglyceride) dan lilin. Sedangkan lipid kompleks terdiri atas fosfolipid, glikolipid dan lipoprotein (Ghafoor, 2016).
B. UJI KELARUTAN LIPID
Lemak bersifat non-polar (hidrofobik), tetapi larut dalam pelarut organik seperti kloroform, benzena, dan alkohol mendidih. Lipid yang berbeda memiliki kemampuan larut dalam pelarut organik yang berbeda. Sifat ini memungkinkan kita untuk memisahkan campuran lemak dari satu dengan yang lain (Mahmoud and Mohamed, 2015).
40
PRINSIP :
TUJUAN :
REAKSI :
ALAT DAN BAHAN : a. Alkohol 96 % b. Kloroform c. Eter
d. Aquadestilata e. Na2CO3 0.5%
f. Kertas saring g. Tabung reaksi h. Pipet tetes i. Pipet skala
41 j. Rak tabung
k. Penjepit tabung
SAMPEL : Minyak kelapa
Mentega Margarin
CARA KERJA :
1. Siapkan 5 tabung reaksi yang bersih, beri label masing-masing tabung dengan aquadestilata, alcohol 96 %, eter, kloroform, dan Na2CO3 0.5%.
2. Masukkan masing-masing tabung dengan 1 mL zat tersebut.
3. Tambahkan ke setiap tabung 2 tetes sampel.
4. Kocok kuat-kuat tabung hingga larutan homogen. Kemudian siapkan kertas saring, dibuat lingkaran dan beri tanda sesuai dengan kode pada tabung.
5. Uji kelarutan minyak dengan meneteskan masing-masing dengan 1 tetes larutan.
6. Amati kelarutannya berdasarkan bercak yang terbentuk pada kertas saring.
HASIL PERCOBAAN :
Bahan Tabung 1 Tabung 2 Tabung 3 Tabung 4 Tabung 5 Aquadestilata
Alkohol 96%
Eter Kloroform Na2CO3 0.5%
Minyak Kelapa
Kocok tabung sampai homogen, biarkan beberapa saat.
Hasil :
PEMBAHASAN :
42
43
KESIMPULAN :
TTD Dosen / Asisten Dosen
44 C. UJI PEMBENTUKAN EMULSI
Lipid ketika dilarutkan dalam air akan bercampur sementara dan setelah beberapa menit air dan lipid akan terpisah sebagai dua lapisan yang dikenal dengan proses emulsifikasi, proses ini terjadi sementara (air dan lemak) dan dapat terjadi pencampuran permanen. Emulsifikasi adalah menstabilkan dispersi koloid lipid oleh agen pengemulsi. Proses difusi butiran harus diantara molekul-molekul air, terkadang meninggalkan campuran (minyak + air), membesar dan berbalik ke permukaan air sehingga emulsi hanya sementara. Tetapi proses tersebut dapat dirubah menjadi emulsifikasi permanen ketika kita menggunakan agen pengemulsi, dan agen pengemulsi terbaik adalah garam empedu dan lesitin. Agen pengemulsi memiliki kelompok (hidrofilik) dan non-polar (hidrofobik) (Ghafoor, 2016).
PRINSIP :
TUJUAN :
ALAT DAN BAHAN : a. Larutan sabun b. Protein 2 % c. Empedu encer d. Na2CO3 0.5%
45 e. Tabung reaksi
f. Pipet tetes g. Pipet skala h. Rak tabung
SAMPEL : Minyak
CARA KERJA :
1. Siapkan 5 tabung reaksi yang bersih, beri label masing-masing tabung.
2. Ke tabung 1, 2 dan 3, masukkan masing-masing tabung dengan 2 mL aquadestilata.
3. Ke tabung 2 masukkan 2 tetes Na2CO3 0.5%, tabung 3 masukkan 2 tetes larutan sabun, tabung 4 diisi dengan 2 mL protein dan tabung 5 diisi dengan 2 mL larutan empedu.
4. Kemudian ke semua tabung ditambahkan dengan 2 tetes minyak kelapa.
5. Kocok kuat-kuat tabung hingga larutan homogen beberapa saat.
6. Amati emulsi yang terbentuk pada setiap tabung.
HASIL PERCOBAAN
Bahan Tabung 1 Tabung 2 Tabung 3 Tabung 4 Tabung 5 Aquadestilata 2 mL 2 mL 2 mL
Na2CO3 0.5% 2 tetes
Larutan sabun 2 tetes
Larutan protein 2 mL
Larutan empedu 2 mL
Minyak Kelapa 2 tetes 2 tetes 2 tetes 2 tetes 2 tetes Kocok tabung sampai homogen, biarkan beberapa saat.
Hasil :
PEMBAHASAN :
46
47
KESIMPULAN :
TTD Dosen / Asisten Dosen
48 D. UJI KEASAMAN MINYAK
PRINSIP :
TUJUAN :
REAKSI :
ALAT DAN BAHAN : a. Kertas Lakmus merah atau biru b. Porcelain
c. Pipet tetes
SAMPEL : Minyak
Minyak tengik
CARA KERJA :
49
1. Teteskan sedikit minyak kelapa dan kelapa tengik pada lubang-lubang porcelain tetes
2. Letakkan kertas lakmus ke dalam minyak 3. Amati perubahan warna pada lakmus HASIL PERCOBAAN
Bahan Perubahan Warna Lakmus
Sifat asam/basa
Merah Biru
1.
2.
3.
PEMBAHASAN :
50
KESIMPULAN :
TTD Dosen / Asisten Dosen
51 E. UJI PENYABUNAN MINYAK
Penyabunan adalah proses hidrolisis Triasil gliserol yang menghasilkan komponen asam lemak dan alcohol (Mahmoud and Mohamed, 2015). Merupakan reaksi kimia yang terjadi ketika minyak nabati atau lemak hewani (trigliserida, ester) dicampur dengan alkali yang kuat (NaOH, KOH) (Mahmoud and Mohamed, 2015;
Ghafoor, 2016).
Produk dari safonifikasi adalah sabun (garam asam lemak) dan gliserol (alkohol bebas). Sabun yang dihasilkan dapat diendapkan dengan menambahkan larutan natrium klorida pekat. Pengunaan Sodium hydroxide (NaOH) akan menghasilkan
"sabun keras", sedangkan penggunaan Potassium hydroxide (KOH) menghasilkan sabun lembut atau sabun cair karena kelarutannya yang lebih besar (Ghafoor, 2016).
PRINSIP :
TUJUAN :
REAKSI :
52 ALAT DAN BAHAN :
a. Alkohol 95%
b. NaOH
c. Larutan deterjen
d. Na2CO3 0.5% asam asetat encer (5 M) e. Larutan CaCl2 5%
f. Larutan MgSO4 5%
g. Larutan Pb Asetat 5%
h. Erlenmeyer i. Tabung reaksi j. Alat pemanas k. Neraca analitis
SAMPEL : Minyak
CARA KERJA :
a. Hidrolisis Minyak Kelapa (Saponifikasi)
1. Masukkan 5 mL minyak ke dalam Erlenmeyer.
2. Tambahkan 1.5 gram NaOH dan 25 mL alcohol 95 %.
3. Panaskan sampai mendidih selama 15 menit.
4. Untuk mengetahui apakah reaksi telah sempurna, ambil 3 tetes larutan dan larutkan dalam air. Bila larut, maka reaksi telah sempurna.
5. Uapkan alcohol yang tersisa sampai habis.
6. Dinginkan, lalu tambahkan dengan 75 mL air dan panaskan sampai semua sabun larut.
b. Uji Sifat-Sifat Sabun (Kesadahan)
HASIL PERCOBAAN
Bahan Tabung 1 Tabung 2 Tabung 3 Tabung 4 Tabung 5
53 Aquadestilata
Na2CO3 0.5%
CaCl2 5%
MgSO4 5%
Pb Asetat 5%
Kocok tabung sampai homogen, biarkan beberapa saat.
Hasil :
PEMBAHASAN :
54
KESIMPULAN :
TTD Dosen / Asisten Dosen
55 F. UJI KOLESTEROL
Kehadiran ikatan rangkap dalam salah satu cincin kolesterol bertanggung jawab atas kemampuannya membentuk produk warna dengan asam anorganik pekat.
Pemberian asam sulfat pekat akan menghasilkan dehidrasi molekul kolesterol (uji Salkowski) dengan terbentuknnya disulfonat bicholestadien berwarna merah. Jika yang dihadirkan asam asetat anhidrida akan membentuk bicholestadien monosulphonate berwarna hijau (uji Lieberman-Burchard). Kehadiran sedikit air saja membuat reaksi ini tidak terjadi (Ghafoor, 2016).
Metoda Lieberman adalah uji untuk steroid tak jenuh (sebagai kolesterol), berdasarkan pada pembentukan serangkaian warna (seperti merah muda ke biru menjadi hijau) dengan asam asetat an-hidrida dengan adanya asam sulfat pekat disebut juga tes Liebermann-Burchard (Ghafoor, 2016).
Metoda Salkowski adalah uji untuk kolesterol; ketika asam sulfat pekat ditambahkan ke larutan kloroform kolesterol, lapisan kloroform menunjukkan warna merah ke biru dan lapisan asam menunjukkan fluoresensi hijau (Ghafoor, 2016).
PRINSIP :
TUJUAN :
REAKSI :
56 ALAT DAN BAHAN :
a. Klorofrm b. H2SO4
c. Pipet tetes d. Pipet skala e. Rak tabung f. Penjepit tabung
SAMPEL : Minyak
Mentega Margarine
Kolesterol 0.5 % dalam kloroform
CARA KERJA :
1. Tambahkan 2 mL H2SO4 pekat ke dalam 2 ml larutan kolesterol dalam kloroform 2. Amati cincin berwarna merah diantara 2 larutan yang berbeda.
HASIL PERCOBAAN
Bahan Tabung 1 Tabung 2 Tabung 3 Tabung 4 Tabung 5 Minyak
Mentega Margarine Kolesterol 0.5 % dalam kloroform Klorofrm
H2SO4
Jangan dikocok ! Hasil :
57
PEMBAHASAN :
58
KESIMPULAN :
TTD Dosen / Asisten Dosen
59 BAB III PROTEIN 1. PENDAHULUAN
Protein adalah komponen utama dalam sel organisme yang berperan pada banyak system proses biologis. Protein terdistribusi di seluruh struktur subseluler secara tidak seragam dalam jumlah tinggi terkandung di dalam resin/getah (hyaloplasm, cytosol). Tingkatan protein dalam organel ditentukan oleh ukuran dan jumlah organel dalam sel. Protein adalah senyawa organic yang mengandung nitrogen molekul tinggi dengan struktur organisasi yang kompleks, polimer yang terdiri dari asam amino yang dihubungkan menjadi rantai oleh ikatan peptida kovalen (Gavriliuc, 2011).
2. UJI NINHIDRIN
Reaksi antara gugus asam amino bebas dengan ninhidrin (triketohidrinden hidrat).
Ninhydrin adalah agen pengoksidasi kuat dan di hadapannya, asam amino teroksidasi dan membebaskan amonia, CO2, aldehida yang sesuai dan ninhidrin yang tereduksi.
Amonia yang terbentuk akan bereaksi dengan ninhidrin dan produk tereduksinya (hidridantin) menghasilkan substrat biru diketohidrin (ungu ruhemann). Pada asam amino prolin, produk yang dihasilkan berbeda membentuk warna kuning cerah.
Asparagine yang memiliki gugus amida bebas menghasilkan produk berwarna cokelat.
Uji ini juga dapat diberikan oleh protein dan peptida. (Awasthi et al, 2013).
PRINSIP :
TUJUAN :
60
REAKSI :
ALAT DAN BAHAN :
ALAT DAN BAHAN :
a. water bath b. tabung reaksi c. rak tabung d. penjepit tabung e. pipet tetes
f. larutan Ninhydrin 0.2 % dilarutkan dalam acetone.
SAMPEL : Larutan Asam Amino 0.5%
PROSEDUR :
1. Tambahkan 2-5 tetes larutan ninhydrin solution pada 1 ml larutan sampel.
2. Campur larutan dan didihkan selama 5 menit.
3. Amati warna yang terbentuk pink, ungu or warna violet-blue.
4. Asam amino acid seperti proline and hydroxyproline menghasilkan kompleks warna yellow.
HASIL PERCOBAAN
Bahan Tabung 1 Tabung 2 Tabung 3 Tabung 4 Tabung 5
61 Lar. Ninhidrin
0.2%
Campur dan didihkan selama 5 menit.
Hasil :
PEMBAHASAN :
62
KESIMPULAN :
TTD Dosen / Asisten Dosen
63 3. UJI BIURET
Uji biuret mendeteksi adanya residu asam amino dari peptida, kandungan dua atau lebih residu asam amino digunakan untuk menentukan ada atau tidaknya protein.
Tes ini bergantung pada fakta bahwa residu asam amino membentuk kompleks berwarna dengan ion Cu+2 dalam medium basa. Uji dilakukan terhadap zat-zat yang mengandung setidaknya dua gugus karbonil yang terikat langsung melalui satu atom karbon atau nitrogen. Dalam tes ini alkali CuSO4 akan bereaksi dengan senyawa yang mengandung dua atau lebih ikatan peptide dan memberikan kompleks berwarna ungu.
Semua protein harus menunjukkan hasil positif sedangkan asam amino sederhana harus memberikan hasil tes negative (Awasthi et al, 2013).
PRINSIP :
TUJUAN :
REAKSI :
ALAT DAN BAHAN :
64
ALAT DAN BAHAN :
a. water bath b. tabung reaksi c. rak tabung d. penjepit tabung e. pipet tetes
f. CuSO4.5H2O 1%
g. NaOH 40%
SAMPEL : Larutan protein 0.5% - bovine serum albumin &
casein dalam NaOH Larutan asam amino 0.5%
PROSEDUR :
1. Masukkan 1 ml larutan sampel ke dalam tabung dan tambahkan 0.5 mL NaOH, campur larutan.
2. Tambahkan 2-5 tetes larutan CuSO4
3. Amati warna yang ungu yang terbentuk dari peptide pada sampel
HASIL PERCOBAAN
Bahan Tabung 1 Tabung 2 Tabung 3 Tabung 4 Tabung 5
NaOH 40 % CuSO4.5H2O 1%
Campur dan amati Hasil :
65
PEMBAHASAN :
66
KESIMPULAN :
TTD Dosen / Asisten Dosen
67 4. UJI XANTOPROTEIN
Uji ini merespons asam amino aromatik, seperti phenyl alanine, tyrosine dan tryptophan. Adanya asam nitrat pekat, cincin fenil aromatik akan dinitrasi menghasilkan nitro-derivatif berwarna kuning. Pada pH basa warna berubah menjadi oranye karena ionisasi gugus fenolik. Protein yang mengandung asam amino aromatik juga memberikan respons positif terhadap tes ini (Awasthi et al, 2013).
PRINSIP :
TUJUAN :
REAKSI :
ALAT DAN BAHAN :
ALAT DAN BAHAN :
a. water bath b. tabung reaksi
68 c. rak tabung
d. penjepit tabung e. pipet tetes f. vortex g. HNO3 pekat h. NaOH 40% w/v
SAMPEL : Larutan asam amino 0.5% seperti tyrosine, glycine, tryptophan, phenylalanine, lysine dan lain lain.
PROSEDUR :
1. Masukkan 1 ml larutan sampel ke dalam tabung dan tambahkan beberapa tetes HNO3 pekat, campur larutan dengan vortex.
2. Didihkan tabung selama beberapa menit. Lalu dinginkan pada air mengalir 3. Tambahkan beberapa tetes NaOH, kocok. Amati warna yang terbentuk. Merah
orange menunjukkan adanya gugus aromatic pada sampel.
HASIL PERCOBAAN
Bahan Tabung 1 Tabung 2 Tabung 3 Tabung 4 Tabung 5
HNO3 pekat
Vortex, didihkan dengan waterbath NaOH 40 %
Campur dan amati Hasil :
69
PEMBAHASAN :
70
KESIMPULAN :
TTD Dosen / Asisten Dosen
71 5. UJI MILLON
Uji ini merespon asam amino fenolik seperti Tyrosine dan turunannya.
Senyawa dengan hidroksibenzena radikal bereaksi dengan pereaksi Millon membentuk kompleks berwarna merah. Pereaksi Millon adalah larutan sulfat merkuri dalam asam sulfat (Awasthi et al, 2013).
PRINSIP :
TUJUAN :
REAKSI :
ALAT DAN BAHAN :
ALAT DAN BAHAN :
a. water bath b. tabung reaksi
72 c. rak tabung
d. penjepit tabung e. pipet tetes f. vortex
g. Reagen Millon (15% W/V mercuric sulphate dalam asam sulfat 6 N) h. Sodium nitrite (5%W/V dalam air destilasi ( to be freshly prepared)
SAMPEL : Larutan asam amino
Larutan glycine, casein & bovine serum albumin 1mg/ml
PROSEDUR :
1. Masukkan 1 ml larutan sampel ke dalam tabung dan tambahkan beberapa tetes reagen Millon, campur larutan dengan vortex.
2. Didihkan tabung selama 3-5 menit. Lalu dinginkan pada air mengalir.
3. Tambahkan beberapa tetes sodium nitrite, kocok. Amati warna yang terbentuk.
Hasil positif reaction juga ditunjukkan pada sampel protein yang mengandung tyrosine.
HASIL PERCOBAAN
Bahan Tabung 1 Tabung 2 Tabung 3 Tabung 4 Tabung 5
reagen Millon
Vortex, didihkan dengan waterbath 3- 5 menit sodium nitrite
Campur dan amati Hasil :
73
PEMBAHASAN :
74
KESIMPULAN :
TTD Dosen / Asisten Dosen
75 6. UJI DENATURASI PROTEIN
Protein adalah polimer asam amino yang khas, karena dapat terdiri dari ratusan asam amino. Kelompok asam amino dapat berupa nonpolar, polar, bermuatan positif, atau bermuatan negatif. Struktur protein utama adalah untaian rantai asam amino, sedangkan struktur sekunder dan tersier protein ditentukan berdasarkan lipatan protein. Ini disebut konformasi asli dan biasanya keadaan di mana protein itu paling aktif dan fungsional. Protein disimpan dalam konformasi asli dengan kombinasi kekuatan: Ikatan hidrogen, interaksi ionik, jembatan disulfida, dan interaksi hidrofobik (Hobbs, 2013).
Mengubah konformasi protein baik sementara atau permanen dengan mengganggu kekuatan-kekuatan tersebut dikenal dengan denaturasi. Denaturasi menyebabkan hilangnya aktivitas protein. Karena konformasi asli biasanya adalah larut air, mengganggu struktur sekunder dan tersier menyebabkan perubahan kelarutan dan sering menghasilkan pembentukan padatan dalam larutan. Reagen atau kondisi yang dapat menyebabkan denaturasi disebut agen denaturasi; ini termasuk panas, perubahan pH, alkohol, dan garam logam berat (Hobbs, 2013). Uji yang dilakukan adalah Uji terhadap efek pemanasan, pH, ethanol 95%, lead(II) nitrate atau silver nitrate terhadap larutan albumin.
PRINSIP :
TUJUAN :
76
ALAT DAN BAHAN :
a. water bath b. tabung reaksi c. rak tabung d. penjepit tabung e. pipet tetes f. pH universal g. HCl 1 N h. NaOH 1 N i. Etanol 95%
j. timbal (II) nitrat 2% atau perak nitrat 2%
SAMPEL : Albumin adalah protein dengan simple globular. Dapat dilarutkan dengan air dan salt solutions seperti isotonic saline (NaCl 0.9%)
PROSEDUR :
1. Siapkan larutan stok albumin dengan menambahkan satu putih telur ke dalam 100 mL air suling. Aduk sampai albumin larut.
2. Tempatkan 5 mL larutan albumen ke masing-masing dari enam tabung reaksi.
Beri label tabung, A, B1, B2, C dan D.
3. Perlakukan keempat larutan sebagai berikut:
- Kontrol: Diamkan pada suhu kamar. Ukur suhunya. Tentukan pH dengan kertas pH.
- Pengaruh panas : Panaskan Tabung A dalam water bath selama beberapa menit.
- Pengaruh perubahan pH : Dalam tabung B1, tambahkan 2 mL HCl 1M. Cek pH menggunakan strip tes pH. Dalam tabung B2, tambahkan 2 mL NaOH 10%. Cek pH menggunakan strip tes pH.
- Efek etanol dan timbal (II) nitrat atau perak nitrat : Dalam tabung C,
tambahkan 1 mL etanol 95%. Dalam tabung D, tambahkan 5-10 tetes timbal (II) nitrat 2% atau perak nitrat 2%.
77
4. Bandingkan setiap solusi pengujian dengan kontrol. Catat pengamatan Anda.
HASIL PERCOBAAN Perlakuan/
Bahan
Tabung
A B1 B2 C D Kontrol
Albumin Panas pH HCL pH NaOH etanol 95%
timbal (II) nitrat / perak nitrat 2%
Hasil :
PEMBAHASAN :
78
79
KESIMPULAN :
TTD Dosen / Asisten Dosen
80
DAFTAR PUSTAKA
Awasthi G., Kumar S., Sanghi A., dan Singh SS. 2013. Biochemistry Laboratory Manual. International E – Publication, www.isca.me, www.isca.co.in. Diunduh pada tanggal 7 Februari 2019.
BOUN. 2013. Experiment 1- Qualitative Analysis Of Carbohydrates.
www.chem.boun.edu.tr/wp-content/uploads/2014/04/Chem-415-Experiment- 1.pdf. Diunduh pada tanggal 6 Februari 2019.
Elzagheid MI. 2018. Laboratory Activities to Introduce Carbohydrates Qualitative Analysis to College Students. World Journal of Chemical Education, vol. 6, no.
2 (2018): 82-86. doi: 10.12691/wjce-6-2-1, Science and Education Publishing, http://pubs.sciepub.com/wjce/6/2/1. Diunduh pada tanggal 7 Februari 2019.
Gavriliuc L,. 2011. Biochemistry. Biochemistry And Clinical Biochemistry Department, State University Of Medicine And Pharmacy Nicolae Testemitanu, CHISINAU. Diunduh pada tanggal 18 Februari 2019.
Ghafoor, DD,. 2016. Biochemistry Lab Manual. Departement of Medical Laboratory Science. Komar University of Science and Technology.
komar.edu.iq/english/wp-content/uploads/2018/09/Lab-manual-Biochemistry.
pdf . Diunduh pada tanggal 18 Februari 2019.
Hobbs D,. 2013. Experiment 14: Proteins and Denaturing Agents https://www.mrgscience.com/uploads/2/0/7/9/20796234/protein_denaturation_l ab.pdf. Diunduh pada tanggal 18 Februari 2019.
Mahmoud A and Mohamed H. 2015. Course Book Of Chemistry 2 (Practical Biochemistry). Department of Biochemistry.Benha University, Agriculture
81
College. http://bu.edu.eg/portal/uploads/Agriculture/Agricultural%20 Biochemistry/1117/crs13490/Practical%20Biochemistry.doc.pdf. Diunduh pada tanggal 8 Februari 2019.
Nelson DL. And Cox MM. 2006. Lehninger : Principles of Biochemistry. Fourth Edition, www.whfreeman.com/lehninger4e. Diunduh pada tanggal 15 Februari 2019.
Tiwari. 2015. Practical Biochemistry: A Student Companion. Lambert Academic Publishing. https://www.researchgate.net/publication/313745155. Diunduh pada tanggal 8 Februari 2019.
Yazid E, dan Nursanti L,. 2006. Penuntun Praktikum Biokimia untuk Mahasiswa Analis. Penerbit Andi, Yogyakarta.
Yusuf JMA. 2010. Quantitative Analysis of Carbohydrates.
http://jyousef.kau.edu.sa/GetFile.aspx?id=71548&fn=Quantitative%20analysis
%20of%20Carbohydrates.pdf