Hidrogenasi Elektrokimia Hidrokarbon Terpen
Rinaldy P. Santosa
1, Tedi Hudaya
1, dan Tatang Hernas Soerawidjaja
31 Laboratorium Rekayasa Reaksi Kimia dan Pemisaha, Jurusan Teknik Kimia Fakultas Teknologi Industri,
Universitas Katolik Parahyangan, Telp/Fax (022) 2032700
2,* Program Studi Teknik Kimia, Fakultas Teknologi Industri, Institut Teknologi Bandung,
Email : tatanghs@che.itb.ac.id, hstatang@yahoo.com
Abstrak
Minyak terpentin adalah biohidrokarbon yang dapat ditingkatkan mutu pembakarannya menjadi seperti kerosin ataupun avtur. Penelitian ini bertujuan untuk meningkatkan titik asap dari minyak terpentin agar memenuhi syarat mutu kerosin maupun avtur melalui proses hidrogenasi elektrokimia di dalam suatu sel elektrokimia pada kondisi tegangan kerja tertentu yang telah ditentukan pada variasi konsentrasi larutan elektrolit (0,5;0,75;1M) serta waktu proses hidrogenasi (6 dan 12 jam). Dengan meningkatnya kandungan hidrogen dalam minyak terpentin maka titik asapnya akan makin naik dan mendekati titik asap kerosin. Analisis tingkat kejenuhan minyak terpentin dilakukan menggunakan uji brom (titrasi bromida-bromat). Analisis produk minyak yang dihasilkan dilakukan dengan uji nyala api menggunakan lampu cempor. Hasil penelitian menunjukkan bahwa proses hidrogenasi elektrokimia dengan menggunakan larutan elektrolit KCOOH dan asam formiat dapat mejenuhkan ikatan rangkap pada minyak terpentin. Konsentrasi larutan elektrolit paling optimal di dalam penelitian adalah 0,75 M dengan penurunan bilangan brom sebesar 24% dari 1,86 menjadi 1,41. Titik asap yang diperoleh pada konsentrasi 0,75 M adalah 18 mm sedangkan titik asap minyak tanah hasil percobaan adalah 25 mm. Penambahan asam formiat akan menurunkan pH larutan elektrolit sehingga penurunan bilangan brom semakin cepat.
Kata Kunci: bilangan brom, hidrogenasi elektrokimia, hidrokarbon, minyak terpentin, titik asap
Abstract
The oil of turpentine consists of biohydrocarbons (C10H16), the burning quality of which can be upgraded to
resemble those of kerosene or jet fuel. This research aims to increase the smoke point of turpentine oil to meet the requirements of kerosene or jet fuel via an electrochemical hydrogenation processthat was carried out using a certain optimum voltage by varying the concentration of the electrolyte solution (0,5 M; 0,75 M; 1M) and the time period of the hydrogenation process (6 and 12 hours). With the increasing of hydrogen content, the smoke point will also increase. Processed turpentine oil was analyzed using the bromide-bromate titration and the smoke point was determined from burning the oil using oil-lamp. In this research, the electrochemical hydrogenation process used potassium formate electrolyte solution and formic acid increased the saturation degree of turpentine oil. The best electrolyte solution concentration was 0,75 M with 24% decrease of bromine number from 1,86 to 1,41. The smoke point of processed oil at electrolyte solution concentration of 0,75 M is 18 mm while the smoke point of kerosene from experiment is 25mm. The added formic acid into the electrolyte solution caused the further reduction of bromine number.
Keywords: bromine number, electrochemical hydrogenation, hydrocarbon, smoke point, turpentine oil
Pendahuluan
Bahan bakar minyak saat ini telah menjadi salah satu kebutuhan pokok dalam kehidupan manusia, terutama sebagai bahan bakar kendaraan bermotor. Sumber utama bahan bakar yang digunakan saat ini berasal dari bahan bakar fosil yang tidak dapat diperbaharui, sementara jumlahnya semakin berkurang serta mengakibatkan dampak lingkungan serius. Hal ini mendorong dikembangkannya sumber bahan bakar nabati dari minyak tanaman. Salah satu sumber bahan baku yang dapat dimanfaatkan adalah minyak terpentin. Minyak terpentin memiliki viskositas serta
karakteristik pembakaran yang menyerupai minyak tanah dan avtur. Akan tetapi perlu dilakukan proses lebih lanjut terhadap minyak tersebut agar kualitasnya dapat menyerupai minyak tanah (biokerosin) atau bahkan avtur serta memenuhi syarat-syarat kelayakan dari minyak tanah atau avtur. Hal ini disebabkan kandungan hidrokarbon (C10H16) berupa monoterpen
yang terdapat di dalam minyak terpentin masih belum memenuhi syarat mutu titik asap yang ditentukan bagi kerosin dan avtur. Kerosin memiliki syarat titik asap minimal 18 mm sedangkan avtur memiliki titik asap minimal 25 mm. Titik asap tersebut dipengaruhi oleh
kandungan hidrogen yang terdapat di dalam kerosin atau avtur.
Salah satu proses yang dapat dilakukan untuk meningkatkan kualitas dan kelayakan tersebut adalah hidrogenasi elektrokimia terhadap minyak terpentin. Melalui proses ini, diharapkan kadar hidrogen dari minyak terpentin meningkat dan syarat titik asap yang telah ditentukan dapat terpenuhi, sehingga membuka jalan bagi sumber-sumber bahan bakar baru yang dapat diperbaharui dan lebih ramah lingkungan untuk dipakai sebagai bahan bakar terbarukan.
Tujuan dari penelitian yang dilakukan ini adalah mempelajari proses hidrogenasi elektrokimia terhadap hidrokarbon terpen (monoterpen) yang terkandung pada minyak terpentin serta mengkaji sampai sejauh mana kualitas produk hasil penjenuhan yang bisa didapatkan.
Ruang lingkup yang digunakan dalam penelitian ini adalah proses hidrogenasi elektrokimia dilakukan di dalam suatu sel elektrokimia dengan bahan baku minyak terpentin. Parameter yang divariasikan adalah konsentrasi larutan elektrolit serta variasi lamanya waktu hidrogenasi elektrokimia. Katoda yang digunakan berupa nikel.
Landasan Teori
Terpen merupakan suatu hidrokarbon yang dihasilkan oleh tumbuhan dengan rumus molekul (C5H8)n (Eggersdorfer, 2003). Salah satu sumber alam
yang banyak mengandung terpen adalah minyak terpentin. Minyak terpentin merupakan minyak mudah menguap yang didapatkan sebagai produk atas dari proses distilasi terhadap getah pohon pinus. Minyak terpentin merupakan campuran dari terpen dan minyak – minyak lainnya dengan kandungan utama adalah dua macam monoterpen yaitu α-pinen serta β-pinen.
Minyak terpentin memiliki viskositas serta karakteristik pembakaran yang menyerupai minyak tanah dan avtur Akan tetapi kandungan monoterpen dalam minyak terpentin masih belum memenuhi syarat mutu titik asap (tinggi maksimum dari nyala tanpa asap yang bisa dihasilkan oleh bahan bakar ketika digunakan dalam lampu minyak standar) yang ditentukan bagi kerosin dan avtur. Kerosin memiliki syarat titik asap minimal 18 mm dan sedangkan avtur memiliki titik asap minimal 25 mm. Kandungan hidrogen yang terkandung dalam monoterpen masih kurang sehingga titik asap yang dimiliki pun masih rendah dan tidak memenuhi persyaratan dari kerosin serta avtur. Meskipun begitu, monoterpen dapat ditingkatkan mutunya agar dapat memenuhi persyaratan dari kerosin maupun avtur.
Salah satu proses yang dapat dilakukan untuk meningkatkan kadar hidrogen sehingga kualitas dan kelayakan minyak terpentin naik adalah hidrogenasi yang merupakan suatu proses kimia di mana dilakukan adisi atom hidrogen ke dalam suatu molekul biasanya terjadi pada senyawa yang memiliki ikatan rangkap dua atau rangkap tiga sehingga terbentuk
molekul yang lebih jenuh. Reaksi hidrogenasi bersifat eksoterm dan membutuhkan energi pengaktifan yang tinggi (Fessenden, 1986).
Pada penelitian ini, proses hidrogenasi dilakukan secara elektrokimia di dalam suatu sel elektrokimia yang terdiri dari katoda dan anoda. Sumber hidrogen yang digunakan berasal dari reduksi air atau mediator yang berasal dari larutan elektrolit di permukaan katoda nikel yang digunakan. Proses hidrogenasi dilakukan secara batch di mana larutan elektrolit hanya dimasukkan sekali di awal proses.
Pada proses hidrogenasi terhadap monoterpen akan digunakan larutan elektrolit berupa asam format yang ditambah garam kalium format. Penggunaan ion format ini dikarenakan adanya siklus format yang terjadi Mekanisme siklus format yang terjadi adalah sebagai berikut (Mondal and Lalvani, 2003) :
HCOO- + oil + H2O oil-H2 + HCO3-
HCO3- + 2H+ + 2e- HCOO- + H2O
Pada saat awal ion format dan air akan mereduksi ikatan rangkap pada minyak. Dari proses ini akan dihasilkan minyak jenuh serta ion bikarbonat (merupakan CO2 yang terlarut dalam air). Ion
bikarbonat kemudian akan mengalami reduksi pada katoda sehingga dihasilkan kembali ion format dan air yang akan dapat bereaksi dengan minyak tak jenuh yang masih ada. Proses hidrogenasi elektrokimia ini dapat dilakukan di sekitar temperatur dan tekanan ruang.
Selain itu terdapat pula suatu reaksi samping pada katoda yang akan mengkonsumsi arus namun tidak mempengaruhi perolehan produk. Reaksi tersebut adalah reaksi pembentukan gas hidrogen dari kombinasi dua atom Hads sebagai berikut (Mondal dan Lalvani, 2003) :
2Hads→ H2(gas) (3)
Reaksi samping ini dapat terjadi dikarenakan sudah tidak ada lagi ruang kosong di permukaan katoda bagi atom H untuk teradsorp sehingga atom H yang terbentuk saling bereaksi satu sama lain dan membentuk gas H2 yang kemudian lepas ke udara.
Reaksi ini harus dihindari karena selain menyebabkan pemborosan energi, gas H2 yang terbentuk
meningkatkan resiko timbulnya bahaya ledakan dan kebakaran. Hal ini dapat dilakukan dengan mengatur besarnya potensial listrik yang digunakan.
Karena proses berlangsung di dalam suatu reaktor elektrokimia, selain di katoda terjadi pula reaksi di anoda. Untuk larutan elektrolit yang berbasis air maka pada anoda terjadi reaksi oksidasi sebagai berikut (Mondal dan Lalvani, 2003) :
1/2H2O → ¼ O2 + H+ + e- (4)
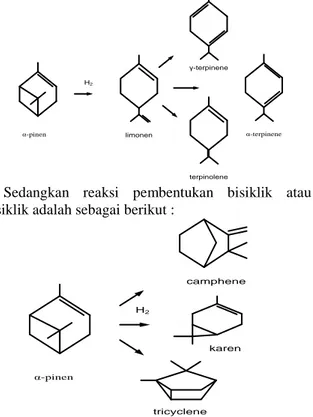
Proses hidrogenasi dilakukan dalam kondisi asam. Hal ini dikarenakan pada kondisi tersebut pinen akan mengalami reaksi isomerisasi menjadi dua macam produk utama yaitu produk bisiklik atau trisiklik contohnya camphen dan juga produk monosiklik
contohnya limonen. Reaksi pembentukan produk monosiklik adalah sebagai berikut :
α-pinen limonen
H2
α-terpinene
terpinolene γ-terpinene
Sedangkan reaksi pembentukan bisiklik atau trisiklik adalah sebagai berikut :
α-pinen
tricyclene H2
camphene
karen
Semakin besar konsentrasi asam maka selektivitas dari reaksi isomerisasi akan lebih mengarah ke produk monosiklik. Jadi penggunaan kondisi asam dalam proses hidrogenasi akan dapat mempercepat proses hidrogenasi itu sendiri karena kondisi asam akan membantu terbukanya ikatan bisiklik yang terdapat pada pinen sehingga reaksi hidrogenasi dapat berlangsung lebih cepat (Chimal-Valencia et al, 2004).
Metodologi
Pada proses hidrogenasi elektrokimia tegangan kerja untuk perlu ditentukan dahulu dengan cara menaikkan tegangan listrik hingga didapatkan nilai arus yang konstan. Tegangan listrik yang memberikan nilai arus yang konstan tersebut merupakan tegangan kerja optimum yang digunakan dalam proses hidrogenasi elektrokimia. Selain itu, digunakan pula indikator lain berupa pengamatan lepas atau tidaknya gelembung gas H2 yang terdapat pada katoda. Apabila
gelembung gas tersebut terlepas maka tegangan telah melebihi tegangan optimum. Hal ini juga menandakan perpindahan ion – ion dalam larutan elektrolit telah mencapai batas maksimum oleh karena itu pengunaan tegangan yang berlebihan selain memboroskan energi juga berbahaya karena dapat menimbulkan resiko ledakan dan kebakaran.
Proses hidrogenasi elektrokimia terhadap hidrokarbon terpen yang terkandung dalam minyak terpentin dilakukan dalam suatu sel elektrokimia dengan memberikan tegangan yang telah ditentukan sebelumnya. Skema alat penelitian yang dilakukan dapat dilihat pada Gambar 1. Dalam penelitian ini
dilakukan variasi konsentrasi larutan elektrolit (0,5 M; 0,75 M; 1 M) dan lama waktu proses hidrogenasi (6 dan 12 jam). Larutan elektrolit yang digunakan berupa garam kalium format yang ditambah asam formiat sebagai pengatur pH. Pengaruh asam formiat dilihat dari percobaan yang dilakukan tanpa memberikan tegangan ke dalam sel elektrokimia.
Kawat Listrik Anoda (+) Kawat Listrik Katoda
(-) Pompa Anoda (per stainless steel) Katoda nikel (packing) Kisi Berpori Gas O2
Gambar 1. Rangkaian Sel Elektrokimia
Peningkatan kadar hidrogen dari monoterpen dilihat dari tingkat kejenuhan minyak setelah proses hidrogenasi. Tingkat kejenuhan dianalisis dengan melakukan uji brom (titrasi bromida-bromat). Satu mol brom teradsorp akan setara satu ikatan rangkap yang belum terjenuhkan. Persamaan bilangan brom (B) yang digunakan adalah
(Johnson,1947)
Analisis produk minyak yang dihasilkan dilakukan dengan uji nyala api untuk mengetahui titik asap dari produk tersebut. Titik asap tersebut kemudian dibandingkan dengan titik asap kerosin untuk mengetahui sampai sejauh mana produk minyak yang telah dihasilkan.
Hasil dan Pembahasan
Analisis Awal Minyak Terpentin
Bahan baku minyak terpentin didapatkan dari PT. Perhutani. Analisis bilangan brom awal dilakukan secara triplo dan hasil analisis yang diperoleh disajikan pada Tabel 1.
Tabel 1. Hasil Analisis Bilangan Brom Minyak Terpentin
Dari hasil analisis diperoleh bilangan brom awal minyak terpentin rata-rata sebesar 1,87 mol Br2/ mol
sampel yang setara dengan 220 gr Br2 / 100 gr sampel.
Densitas dari minyak terpentin hasil pengukuran adalah sebesar 0,858 gr/ml. Nilai densitas ini berada pada rentang densitas minyak terpentin menurut literatur yaitu antara 0,855 – 0,872 gr/ml.
Penentuan Tegangan Optimum
Penentuan tegangan optimum dilakukan dengan cara mengalurkan kurva tegangan terhadap arus yang dihasilkan pada setiap percobaan yang dilakukan. Salah satu contoh penentuan tegangan optimum diperlihatkan pada Gambar 2.
Gambar 2. Kurva Penentuan Tegangan Optimum 0,75 M
Tegangan yang digunakan pada setiap variasi konsentrasi larutan elektrolit disajikan pada Tabel 2.
Tabel 2. Tegangan Optimum yang Dipakai pada Setiap Variasi Konsentrasi
Analisis Hasil
Proses hidrogenasi minyak terpentin dilakukan secara elektrokatalitik dengan menggunakan sel elektrokimia di mana larutan elektrolit yang digunakan adalah larutan KCOOH dan asam formiat yang ditambahkan untuk mengatur pH sampai diperoleh pH = 4. Variasi percobaan yang dilakukan adalah variasi konsentrasi dari larutan elektrolit KCOOH yaitu 0,5 M; 0,75 M; 1 M serta lamanya proses hidrogenasi elektrokimia yaitu 6 dan 12 jam. Penurunan bilangan brom yang diinginkan bergantung
dari apakah senyawa brom yang dihasilkan pada titrasi bromida-bromat mampu membuka gugus siklik yang ada. Bila senyawa brom mampu membuka gugus siklik maka diharapkan terjadi penurunan bilangan brom hingga bernilai 1 (dengan struktur monosiklik) sedangkan bila senyawa brom tidak mampu membuka gugus siklik maka diharapkan terjadi penurunan bilangan brom hingga bernilai 0 (dengan struktur rantai lurus). Hasil percobaan yang diperoleh disajikan pada Tabel 3.
Tabel 3. Hasil Percobaan Hidrogenasi Elektrokimia Minyak Terpentin
Pengaruh Konsentrasi KCOOH
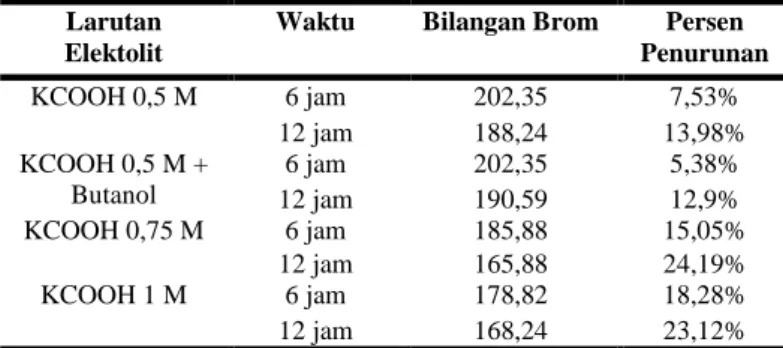
Dari Tabel 3. dapat disimpulkan bahwa konsentrasi dari larutan elektrolit yang digunakan mempengaruhi bilangan brom yang didapatkan. Peningkatan konsentrasi larutan elektolit KCOOH menyebabkan kemampuan perpindahan massa (ion) yang terjadi antara larutan elektrolit dengan minyak terpentin semakin besar sehingga reaksi hidrogenasi yang berlangsung semakin banyak terjadi yang dapat dilihat dengan semakin menurunnya angka brom yang didapatkan. Makin menurunnya bilangan brom yang diperoleh menunjukkan pula bahwa ikatan rangkap yang terhidrogenasi semakin banyak. Pada penelitian yang dilakukan ini konsentrasi optimum larutan elektrolit KCOOH yang diperoleh adalah 0,75 M karena pada konsentrasi tersebut diperoleh penurunan bilangan brom yang paling signifikan dari bilangan brom awal minyak terpentin yaitu sebesar 24% (dari 1,86 menjadi 1,41). Di dalam percobaan disimpulkan pula bahwa penambahan butanol ke dalam larutan elektrolit sebagai emulsifier tidak membantu proses hidrogenasi yang terjadi. Hal ini dilihat dari besarnya bilangan brom yang masih lebih besar daripada bilangan brom pada percobaan dengan larutan elektrolit yang tidak ditambah butanol.
Pengaruh Lama Waktu Hidrogenasi
Dari Tabel 3. dapat disimpulkan bahwa lama waktu dari proses hidrogenasi berpengaruh terhadap bilangan brom yang didapatkan di mana makin lama waktu proses hidrogenasi maka bilangan brom yang didapatkan makin menurun. Hal ini menunjukkan bahwa makin lama waktu hidrogenasi maka jumlah ikatan rangkap yang terhidrogenasi semakin banyak sehingga bilangan brom nya pun semakin menurun.
Hasil Pengujian Bilangan Brom
I 1,88 II 1,86 III 1,87 Konsentrasi Larutan Elektrolit Tegangan Kerja 0,5 M 8 V 0,75 M 13 V 1 M 11 V Larutan Elektolit
Waktu Bilangan Brom Persen
Penurunan KCOOH 0,5 M 6 jam 202,35 7,53% 12 jam 188,24 13,98% KCOOH 0,5 M + Butanol 6 jam 202,35 5,38% 12 jam 190,59 12,9% KCOOH 0,75 M 6 jam 185,88 15,05% 12 jam 165,88 24,19% KCOOH 1 M 6 jam 178,82 18,28% 12 jam 168,24 23,12%
Meskipun begitu pada selang waktu proses hidrogenasi antara 6 dengan 12 jam penurunan bilangan brom yang terjadi tidak sebesar pada selang waktu proses hidrogenasi antara 0 sampai 6 jam. Hal ini mungkin disebabkan karena keefektifitasan larutan elektrolit yang digunakan sudah menurun sehingga penurunan ikatan rangkap yang terjadi makin sedikit. Perlu dilakukan penelitian lebih lanjut apakah penambahan ulang larutan elektrolit setelah beberapa jam reaksi dapat mempercepat reaksi.
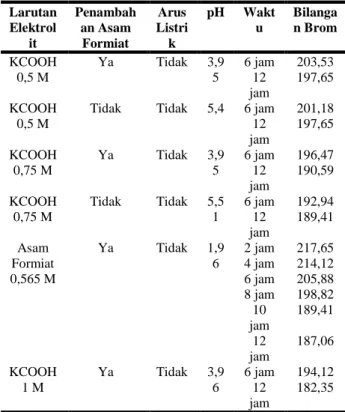
Pengaruh Penambahan Asam Formiat
Penggunaan asam formiat pada larutan elektrolit yang digunakan menyebabkan kondisi asam yang diharapkan dapat membantu terbukanya gugus siklik pada minyak terpentin agar proses hidrogenasi dapat berlangsung dengan lebih baik dan lebih cepat. Pengaruh dari kondisi asam yang digunakan ini dapat dilihat dari kenaikan bilangan brom yang diperoleh dibandingkan bilangan brom awal minyak terpentin. Hal ini dikarenakan dengan terbukanya gugus siklik maka jumlah ikatan rangkap yang didapatkan akan semakin banyak sehingga bilangan brom yang dihasilkan pun semakin besar. Perbandingan dari penambahan asam formiat disajikan pada Tabel 4.
Tabel 4. Pengaruh Penambahan Asam Formiat Larutan Elektrol it Penambah an Asam Formiat Arus Listri k pH Wakt u Bilanga n Brom KCOOH 0,5 M Ya Tidak 3,9 5 6 jam 203,53 12 jam 197,65 KCOOH 0,5 M
Tidak Tidak 5,4 6 jam 201,18
12 jam 197,65 KCOOH 0,75 M Ya Tidak 3,9 5 6 jam 196,47 12 jam 190,59 KCOOH 0,75 M Tidak Tidak 5,5 1 6 jam 192,94 12 jam 189,41 Asam Formiat 0,565 M Ya Tidak 1,9 6 2 jam 217,65 4 jam 214,12 6 jam 205,88 8 jam 198,82 10 jam 189,41 12 jam 187,06 KCOOH 1 M Ya Tidak 3,9 6 6 jam 194,12 12 jam 182,35
Tabel 4 tersebut memperlihatkan bahwa penambahan asam formiat tidak menyebabkan kenaikan dari bilangan brom minyak terpentin namun justru menyebabkan penurunan bilangan brom tersebut. Hal ini dapat disebabkan terjadinya reaksi adisi lain terhadap gugus siklik maupun ikatan
rangkap yang ada pada monoterpen yang terkandung pada minyak terpentin terutama oleh air (terjadi proses hidrasi) sehingga bilangan bromnya pun turun karena jumlah ikatan rangkap yang ada telah berkurang akibat terjadinya reaksi adisi tersebut.
Penurunan bilangan brom pada kondisi di mana dilakukan penambahan asam formiat lebih besar daripada kondisi tanpa penambahan asam formiat. Hal ini disebabkan karena pH dari larutan elektrolit lebih rendah sehingga kondisi asam semakin kuat dan menyebabkan reaksi adisi yang terjadi semakin cepat. Jadi dapat disimpulkan bahwa semakin asam kondisi pH dari larutan elektrolit maka penurunan bilangan brom yang didapatkan akan semakin besar.
Analisis Uji Nyala Api
Uji nyala api dilakukan untuk mengetahui titik asap dari minyak terpentin yang telah mengalami proses hidrogenasi. Titik asap tersebut merupakan ketinggian dari nyala api maksimum tanpa mengeluarkan asap yang dihasilkan ketika minyak tersebut dibakar dalam lampu minyak standar. Hasil uji nyala api yang diperoleh disajikan pada Tabel 5.
Tabel 5. Hasil Uji Nyala Api
Sampel Tinggi Nyala Api
(mm) Terpentin Murni ± 10 mm 0,5 M ± 12 mm 0,75 M ± 18 mm 1 M ± 18 mm Kerosin ± 25 mm
Dari Tabel 5. dapat disimpulkan bahwa secara garis besar makin besar penurunan angka brom maka titik asap yang didapatkan dari pembakaran minyak terpentin akan makin tinggi. Hal ini dikarenakan jumlah hidrogen yang terdapat dalam minyak semakin banyak sehingga titik asap pun akan makin tinggi. Akan tetapi titik asap kenaikan titik asap yang didapatkan tidak terlalu besar dan masih cukup jauh apabila dibandingkan dengan titik asap dari kerosin. Hal ini dikarenakan masih terdapat ikatan rangkap pada minyak terpentin sehingga kadar hidrogennya masih kurang yang berakibat titik asap yang didapatkan masih rendah.
Selain itu apabila titik asap kerosin yang diperoleh dari proses pengujian (±25 mm) dibandingkan dengan titik asap kerosin secara teoritis (min 18 mm) terdapat perbedaan yang cukup jauh. Hal ini disebabkan proses pengujian dilakukan dengan menggunakan lampu yang tidak standar yaitu lampu cempor sehingga hasil pengujian yang didapatkan pun tidak seakurat apabila kerosin dibakar dalam lampu minyak standar.
Kesimpulan
Proses hidrogenasi elektrokimia (secara elektrokatalitik) dengan menggunakan larutan
elektrolit KCOOH yang ditambah asam formiat sebagai pengatur pH dapat digunakan untuk menurunkan ikatan rangkap (menambah kandungan hidrogen) yang terdapat pada minyak terpentin. Konsentrasi larutan elektrolit KCOOH sebesar 0,75 M memberikan hasil yang terbaik pada proses hidrogenasi elektrokimia yang dilakukan dibandingkan dengan konsentrasi 0,5 M dan 1 M di mana terjadi penurunan bilangan brom sebesar 24% dari 1,86 menjadi 1,41. Sedangkan semakin asam kondisi pH larutan elektrolit maka penurunan bilangan brom akan semakin besar.
Makin lama waktu proses hidrogenasi yang dilakukan maka penurunan bilangan brom akan makin besar yang menunjukkan jumlah ikatan rangkap semakin berkurang. Makin berkurangnya ikatan rangkap tersebut membuat titik asap dari minyak terpentin akan naik.
Ucapan Terimakasih
Penulis mengucapkan terima kasih kepada Lembaga Pengembangan dan Pengabdian Masyarakat (LPPM) Universitas Katolik Parahyangan yang telah mendanai penelitian dalam hal penyedian minyak terpentin serta pembuatan peralatan penelitian yang digunakan.
Daftar Simbol
B = bilangan brom, mol Br2 / mol sampel
N KBr – KBrO3 = normalitas KBr – KBrO3 , N
V KBr – KBrO3 = volume KBr – KBrO3 , ml
N Na2S2O3 = normalitas Na2S2O3 , N
V Na2S2O3 = volume Na2S2O3, ml
Massa sampel = massa sampel, gr
Daftar Pustaka
Chimal-Valencia, O., Robau-Sanchez, A., Collins-Martinez, V., Aguilar-Elguezabal, A., (2004), Ion exchange resin as catalyst for the isomerization of α-pinene to camphene, Biosource Technology, 93, pp. 119-123.
Deliy, I.V. and Simakova, I.L., (2008). Catalytic activity of the VIII Group metals in the hydrogenation and isomerization of α- and β-pinenes, Russian
Chemical Bulletin International Edition, Vol. 57, No.
10, pp. 2056 – 2064.
Eggersdorfer, M., (2003), Terpenes, in Ullmann’s
Encyclopedia of Industrial Chemistry, 35, pp. 653 –
668.
Fessenden, R. J., dan Fessenden J.S., (1986), Kimia
Organik Jilid Dua, Erlangga, Jakarta.
Gscheidmeier, M. and Fleig, H., (1996), Turpentines, in Ullmann’s Encyclopedia of Industrial Chemistry, A 27, pp. 267 – 280.
Johnson, L.H. and Clark, R.A., (1947), Procedure for Determination of the Bromine Number of Olefinic Hydrocarbons, Ind.Eng.Chem.Anal, Vol.19, No.11, pp. 869 – 872.
Kirk-Othmer, (1997), Terpenoids, in Encyclopedia of
Chemical Technology, Volume 23, Fourth Edition,
John Wiley and Sons.Inc.
Lewis, J.B. and Bradstreet, R.B., (1940), Determination of Unsaturation in Aliphatic Hydrocarbon Mixtures by Bromine Absorption, Ind.
Eng. Chem. Anal. Ed. 12, pp. 387-390.
Mondal, K. and Lalvani, S.B., (2003), Electrochemical Hydrogenation of Canola Oil Using a Hydrogen Transfer Agent, JAOCS, Vol. 80, No.11, pp. 1135 – 1141.
Mondal, K. and Lalvani, S.B., (2008), Low Temperature soybean oil hydrogenation by an electrochemical process, Journal of Food
Engineering, 84, pp. 526 – 533.
Mondal, K. and Lalvani, S.B., (2003), Mediator-assisted electrochemical hydrogenation of soybean oil,
Chemical Engineering Science, 58, pp. 2643 – 2656.
Mulliken, S. and Wakeman,R., (1935), Estimation of Unsaturation in Aliphatic Hydrocarbons by Bromide-Bromate Titration, Ind. Eng. Chem. Anal. Ed. 7, pp. 59.
Soerawidjaja, Tatang H., Peran Kritikal Biomassa dalam Penyediaan Energi dan Tantangan – Tantangan Litbangnya, Seminar Teknik Kimia Universitas Katolik Parahyangan, Bandung, 23 April 2009.
Utami H., Budiman A., Sutijan, Roto, Sediawan, W.B., (2011), Heterogeneous Kinetics of Hydration of α-Pinene for α-Terpineol Production: Non – Ideal Approach, World Academy of Science, Engineering,
and Technology, pp. 864 – 867.
Yusem, G.J. and Pintauro, P.N., (1992), The Electrocatalytic Hydrogenation of Soybean Oil,