EFEKTIVITAS PENGGUNAAN KOMPOSISI ZEOLIT 20 GRAM/L DAN KARBON AKTIF 10 GRAM/L PADA PENGANGKUTAN SISTEM TERTUTUP IKAN
MAANVIS (Pterophyllum scalare) DENGAN KEPADATAN BERBEDA
WOLFI SANDY
SKRIPSI
PROGRAM STUDI TEKNOLOGI DAN MANAJEMEN PERIKANAN BUDIDAYA DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN INSTITUT PERTANIAN BOGOR
DAFTAR ISI
Halaman DAFTAR GAMBAR ... ix DAFTAR LAMPIRAN ... x I. PENDAHULUAN 1.1 Latar Belakang ... 1 1.2 Tujuan ... 2II. TINJAUAN PUSTAKA 2.1 Biologi Ikan Maanvis (Pterophyllum scalare) ... 3
2.2 Pengangkutan Ikan ... 4
2.2.1 Kemasan ... 6
2.2.2 Kepadatan Ikan ... 6
2.2.3 Kelangsungan Hidup ... 6
2.3 Persyaratan Media Pengangkutan ... 7
2.3.1 Oksigen Terlarut (DO) ... 7
2.3.2 Derajat Keasaman (pH) ... 8
2.3.3 Suhu ... 8
2.3.4 Amonia ... 8
2.4 Zeolit... 10
2.5 Karbon Aktif ... 11
III. BAHAN DAN METODE 3.1 Waktu dan Tempat ... 13
3.2 Prosedur Percobaan ... 13
3.3 Rancangan Penelitian ... 14
3.4 Analisis Data ... 14
IV. HASIL DAN PEMBAHASAN 4.1 Hasil ... 15
4.1.1 Total Amonia Nitrogen (TAN)... 15
4.1.2 Amonia Tak Terionisasi (NH3) ... 15
4.1.3 Suhu ... 16
4.1.4 Oksigen Terlarut (DO) ... 17
4.1.5 pH ... 17
4.1.6 Tingkat Kelangsungan Hidup... 18
4.2 Pembahasan ... 19
V. KESIMPULAN DAN SARAN 5.1 Kesimpulan ... 23
5.2 Saran ... 23
DAFTAR PUSTAKA ... 24
DAFTAR LAMPIRAN
Halaman 1. Tabel konsentrasi total ammonia nitrogen (mg/L) pada media air
pengangkutan ... 28
2. Tabel konsentrasi amonia tak terionisasi (mg/L) pada media air pengangkutan ... 29
3. Tabel suhu (ºC) pada media air pengangkutan ... 30
4. Tabel konsentrasi oksigen terlarut (mg/L) pada media air pengangkutan ... 31
5. Tabel pH pada media air pengangkutan ... 32
6. Tabel tingkat kelangsungan hidup (%) setiap perlakuan ... 33
7. Tabel kualitas air dan survival rate (SR) pada pengangkutan sistem tertutup ikan maanvis dengan kepadatan 20 ekor/L Jam ke- 120 ... 35
8. Tabel kualitas air dan survival rate (SR) pada pengangkutan sistem tertutup ikan maanvis dengan penambahan zeolit 20 gram/L dan karbon aktif 10 gram/L pada jam ke- 120………. 36
9. Tabel analisis biaya pengangkutan pada jam ke-120 ... 37
10. Gambar penelitian ... 38
11. Analisis ragam kepadatan terhadap konsentrasi TANpada jam ke- 0 ... 39
12. Analisis ragam kepadatan terhadap konsentrasi TANpada jam ke- 48 ... 40
13. Analisis ragam kepadatan terhadap konsentrasi TANpada jam ke- 96 ... 41
14. Analisis ragam kepadatan terhadap konsentrasi TANpada jam ke- 120 . 42 15. Analisis ragam kepadatan terhadap konsentrasi NH3 pada jam ke- 0 ... 43
16. Analisis ragam kepadatan terhadap konsentrasi NH3 pada jam ke- 48 .... 44
17. Analisis ragam kepadatan terhadap konsentrasi NH3 pada jam ke- 96 .... 45
18. Analisis ragam kepadatan terhadap konsentrasi NH3 pada jam ke- 120... 46
19. Analisis ragam kepadatan terhadap kelangsungan hidup ikan maanvis pada jam ke- 108 ... 47
20. Analisis ragam kepadatan terhadap kelangsungan hidup ikan maanvis pada jam ke- 114 ... 48
21. Analisis ragam kepadatan terhadap kelangsungan hidup ikan maanvis pada jam ke- 120 ... 49
I. PENDAHULUAN
1.1 Latar Belakang
Indonesia memiliki pangsa pasar ikan hias sebesar 7,5% pada perdagangan ikan hias global tahun 2008, sementara Singapura telah mencapai 22,8%. Dengan kondisi 90% kebutuhan ikan Singapura disuplai Indonesia (Poernomo 2008). Suatu peluang besar bagi Indonesia untuk meningkatkan nilai ekspor ikan hias, jika Indonesia mampu memanfaatkan 90% dari kebutuhan ikan untuk Singapura tersebut.
Beberapa spesies ikan hias air tawar ekspor Indonesia adalah maanvis, cupang, blackghost, neon tetra, dan Botia macracantha (Bachtiar 2004). Salah satu jenis ikan hias air tawar ekspor Indonesia yang banyak digemari masyarakat adalah ikan maanvis Pterophyllum scalare, yang dikenal juga sebagai ikan bidadari atau angelfish yang memiliki warna menarik dan gerakan yang anggun (Susanto 2000).
Kepadatan yang umum digunakan dalam pengangkutan sistem tertutup ikan maanvis ukuran 2 gram berkisar antara 10-12 ekor/L dalam waktu 24 jam (Riza 2007). Menurut Supendi (2006) pengiriman ikan hias ke luar negeri memerlukan waktu yang cukup lama yaitu hingga 96 jam. Permasalahan yang sering dihadapi oleh eksportir Indonesia dalam pengiriman ikan hias ke luar negeri adalah tingkat kelangsungan hidup yang rendah akibat kualitas air yang memburuk selama pengangkutan. Jhingran dan Pullin (1985) menyatakan bahwa kematian ikan pada sistem pengangkutan salah satunya disebabkan oleh akumulasi amonia. Akumulasi amonia dapat diatasi dengan beberapa cara diantaranya dengan menurunkan laju metabolisme ikan sehingga laju ekskresi amonia menurun, kemudian menyerap amonia yang telah diekskresikan ke dalam media pengangkutan. Penyerapan amonia dapat dilakukan dengan menggunakan bahan yang dapat menyerap dan melakukan penukaran ion, antara ion NH4
+
dengan ion-ion lainnya (Riza 2007). Bahan yang dapat digunakan untuk mengurangi konsentrasi amonia adalah dengan menggunakan zeolit dan karbon aktif.
Zeolit dan karbon aktif ini mampu mengadsorbsi sejumlah amonia dalam waktu tertentu (Supendi 2006).
Berdasarkan perhitungan jumlah ikan yang diangkut per volume air dalam kantong plastik dan lama pengangkutan tidak lebih dari 48 jam untuk ikan air tawar (Frose 1985), didapatkan hasil bahwa kepadatan ikan maanvis ukuran 2 gram dalam kantong plastik adalah 20 ekor/L. Menurut penelitian Riza (2007) penambahan zeolit dengan dosis 20 gram/L mampu mengadsorbsi sejumlah amonia dalam media pengepakan ikan maanvis Pterophyllum scalare dengan kepadatan 20 ekor per liter selama 120 jam dan menghasilkan tingkat kelangsungan hidup sebesar 100%. Dari hasil tersebut diduga kepadatan ikan maanvis dalam pengepakan dapat ditingkatkan lebih tinggi lagi. Pada sistem pengangkutan tertutup dengan penambahan zeolit, jumlah benih ikan yang akan diangkut dapat ditingkatkan 20-25% (Coger dan Turner, 1985 dalam Anwar 1989).
Padat penebaran yang lebih tinggi (sampai batas tertentu) dalam pengangkutan sangat diperlukan agar biaya pengangkutan semakin kecil. Perlu dilakukan penelitian lebih mendalam tentang efektifitas pemanfaatan zeolit dan karbon aktif pada sistem pengangkutan tertutup dengan menggunakan kepadatan ikan yang lebih tinggi.
Menurut Riza (2007) ikan maanvis tergolong salah satu jenis ikan yang lemah. Hasil dari penelitian ini diharapkan dapat diaplikasikan terhadap pengangkutan sistem tertutup pada jenis ikan lain yang memiliki sifat lebih kuat dibandingkan ikan maanvis.
1.2 Tujuan
Tujuan penelitian ini adalah untuk mengetahui perubahan kualitas air media yang masih layak untuk mendukung kelangsungan hidup yang maksimal sehingga dapat ditentukan kepadatan optimal diantara kepadatan 20, 25, 30 dan 40 ekor/liter pada sistem pengangkutan tertutup ikan maanvis (Pterophyllum scalare) selama 120 jam.
II. TINJAUAN PUSTAKA
2.1 Biologi Ikan Maanvis (Pterophyllum scalare)
Ikan maanvis terdiri dari tiga spesies yaitu, Pterophyllum altum,
Pterophyllum domerilii dan Pterophyllum scalare yang pada umumnya sering
dibudidayakan. Klasifikasi ikan maanvis Pterophyllum scalare adalah sebagai berikut: Filum : Chordata Kelas : Osteichthyes Ordo : Percomorphoidea Famili : Cichlidae Genus : Pterophyllum
Species : Pterophyllum scalare Lichenstein (Axelrod 1995)
Ikan maanvis atau dikenal juga dengan istilah ’angel fish’ berasal dari perairan Amazon, Amerika Selatan. Strain-strain ikan maanvis yaitu Marble,
Marble Slayer, Black, Black Slayer, White Slayer, Black-White Slayer, Tricolour dan Twocolour (Susanto 2000).
Salah satu strain ikan maanvis yang banyak digemari masyarakat adalah strain Tricolour. Bentuk tubuh ikan maanvis Tricolour (Gambar 1) pipih seperti anak panah atau kepingan disk, sirip punggung dan perutnya membentang lebar dan memanjang ke arah ekor sehingga nampak seperti busur (Mclnerny 1958). Panjang tubuh ikan maanvis Tricolour maksimal adalah 15 cm, dengan iris mata berwarna kuning, warna dasar tubuhnya silver dan corak hitam, terdapat 3-4 garis vertikal berwarna hitam pada sirip dan tubuhnya. Pada bagian kepalanya terdapat warna kuning yang menarik (Axelrod 1995).
Menurut Susanto (2000) suhu optimum maanvis berkisar antara 20-25 o C, pH optimum berkisar antara 6,5-7,5, air jernih, dan mudah menerima berbagai jenis pakan, baik pakan alami maupun pakan buatan.
Berdasarkan penelitian Riza (2007) ikan maanvis mampu bertahan hidup dalam keadaan puasa sampai 9 hari dengan tingkat konsumsi oksigen ikan maanvis ukuran 2 gram sebesar 0,21 ± 0,02 mg O2/gram/jam dan laju ekskresi TAN maanvis ukuran 2 gram adalah 0,004 mg/L/jam.
2.2 Pengangkutan Ikan
Sistem pengangkutan terdiri dari dua metode yaitu pengangkutan dengan menggunakan air sebagai media (sistem basah) dan pengangkutan tanpa menggunakan media air (sistem kering). Pengangkutan sistem basah terdiri dari dua cara yaitu terbuka dan tertutup. Pada pengangkutan jarak jauh dan lama (lebih dari 24 jam) biasanya digunakan sistem tertutup. Metode yang paling sederhana pada sistem tertutup ini adalah dengan menggunakan kantong plastik yang diisi air dan oksigen murni, dengan perbandingan antara air dan oksigen adalah 1:2, lalu diikat rapat (Jhingran dan Pullin 1985).
Pengangkutan ikan pada dasarnya adalah usaha menempatkan ikan pada lingkungan baru yang berbeda dengan lingkungan asalnya disertai dengan perubahan-perubahan sifat lingkungan yang relatif mendadak dan mengancam kehidupan ikan. Keberhasilan mengurangi pengaruh perubahan lingkungan yang mendadak akan memberi kemungkinan untuk mengurangi tingkat kematian, yang berarti tercapainya tujuan pengangkutan (Huet 1971).
Faktor penting pada sistem pengangkutan ikan adalah tersedianya oksigen terlarut yang memadai. Kemampuan ikan untuk mengkonsumsi oksigen dipengaruhi oleh toleransi terhadap stress, suhu air, pH, konsentrasi CO2, akumulasi amonia, ikan terlalu aktif, infeksi bakteri, dan luka fisik akibat penanganan yang kasar (Jhingran dan Pullin 1985).
Menurut (Nemoto 1957), hal penting yang harus diperhatikan dalam pengangkutan ikan adalah: (1) Meningkatkan supplay oksigen dengan cara mengganti udara dengan oksigen murni, meningkatkan tekanan oksigen pada wadah serta mengurangi konsumsi oksigen rata-rata. (2) Mengontrol metabolisme
dengan cara mengurangi laju buangan metabolit dan menetralisir atau menghilangkan hasil metabolisme.
Faktor utama yang mempengaruhi pengangkutan ikan hidup dengan mempertimbangkan persediaan oksigen dalam pengangkutan antara lain : (1) Spesies ikan. Kebutuhan ikan akan oksigen bervariasi sesuai dengan spesiesnya. (2) Umur dan ukuran ikan. Dalam jumlah berat total yang sama, kebutuhan oksigen untuk pernapasan bagi ikan yang kecil adalah lebih tinggi dibandingkan ikan yang lebih besar. (3) Ketahanan relatif ikan. Ikan yang diberi pakan alami lebih tahan dibandingkan dengan ikan yang diberi pakan buatan. Ikan dalam kondisi siap memijah daya tahan dalam pengangkutan rendah. (4) Suhu air. Pada suhu yang rendah mengakibatkan kadar oksigen dalam air lebih tinggi, karena kebutuhan untuk respirasi menurun. (5) Lama waktu angkut. Makin pendek lama waktu angkut makin tinggi kepadatan. (6) Cara angkut dan lama istirahat. Makin cepat dan prasarana pengangkutan yang baik serta waktu istirahat yang pendek, memungkinkan keberhasilan akan lebih besar. (7) Sifat alami alat pengangkut. Pengangkutan dengan kayu menyebabkan peningkatan suhu air lebih lambat dibanding dari logam, tetapi yang terakhir mengisolasi panas dalam wadah. (8) Kondisi klimatologik. Hal ini berpengaruh terhadap suhu air di dalam wadah maupun kandungan oksigen terlarutnya (Huet 1971).
Lesmana (2001) menyatakan bahwa untuk pengangkutan ikan perlu dilakukan seleksi ikan dan pemuasaan atau pemberokan ikan. Proses seleksi meliputi kualitas dan kesehatan, ukuran, jenis serta jumlah. Ukuran dan jenis ikan untuk satu kemasan sebaiknya seragam. Sedangkan jumlah ikan dalam satu kemasan sangat bergantung pada ukuran dan besarnya kemasan. Pengangkutan untuk ekspor, sebaiknya seleksi sudah dikerjakan minimal tiga hari sebelum ikan dikemas, setelah diseleksi ikan ditempatkan dalam akuarium khusus. Bila memungkinkan, jumlah ikan untuk akuarium khusus cukup 1-2 kemasan saja. Hal ini untuk memudahkan proses lebih lanjut saja. Selanjutnya ikan dipuasakan selama 40-60 jam. Tujuannya agar hasil metabolisme ikan seperti kotoran, CO2 hasil pernapasan, dan NH3 dari urine berkurang.
2.2.1 Kemasan
Kemasan yang baik dalam pengangkutan sistem tertutup adalah menggunakan plastik jenis poli etilen (PE) dengan ketebalan plastik 0,03 mm, karena ringan, mudah diperoleh dan murah serta dapat diamati selama proses pengangkutan (Liviawaty dan Afrianto 1990). Lebih lanjut dinyatakan, penggunaan kantong plastik pada pengangkutan jarak jauh sebaiknya diletakkan dalam kotak styrofoam untuk mengurangi kontak yang terjadi antara air di dalam kantong dengan temperatur lingkungan. Garbhards (1965) menyatakan bahwa penggunaan wadah plastik untuk pengemasan yang diletakkan pada kotak
styrofoam meningkatkan kelangsungan hidup sebesar 99,9%. 2.2.2 Kepadatan Ikan
Kepadatan ikan adalah bobot ikan yang berada dalam suatu wadah dalam waktu tertentu. Lesmana (2001) mengatakan bahwa semakin tinggi kepadatan ikan dalam kantung kemasan akan semakin besar kompetisi ikan dalam menggunakan ruang dan oksigen. Konsumsi oksigen tertinggi terjadi selama 15 menit pertama setelah pengemasan. Kepadatan ikan bergantung pada volume air, berat dan ukuran ikan, jarak dan lamanya pengangkutan, suplay oksigen dan suhu (Djadjadiredja 1958).
Kepadatan ikan maanvis dalam pengepakan umumnya 10-12, ekor per liter air untuk pengangkutan selama 24 jam (Riza 2007). Frose (1985) mengemukakan bahwa jumlah ikan yang diangkut selama 48 jam dirumuskan sebagai berikut :
Keterangan : Fq = bobot ikan per volume (g/L) W = bobot rata-rata (gram)
2.2.3 Kelangsungan Hidup
Kelangsungan hidup merupakan persentase organisme yang hidup pada akhir pemeliharaan dari jumlah seluruh organisme awal yang dipelihara dalam suatu wadah (Effendie 1985). Peningkatan kepadatan dapat mempengaruhi proses fisiologis dan tingkah laku ikan terhadap ruang gerak. Hal ini pada akhirnya dapat menurunkan kondisi kesehatan dan fisiologis ikan sehingga pemanfaatan pakan, pertumbuhan dan kelangsungan hidup mengalami penurunan (Handajani dan Hastuti 2002). Kepadatan yang tinggi dapat menyebabkan stres pada ikan. Respon
5 . 0
38 W
stres terjadi dalam 3 tahap yaitu stres, bertahan, dan kelelahan. Ketika ada stres dari luar, ikan mulai mengeluarkan energinya untuk bertahan dari stres. Selama proses bertahan ini pertumbuhan dapat menurun dan selanjutnya terjadi kematian (Wedemeyer 1996).
2.3 Persyaratan Media Pengangkutan
Dalam pengangkutan ikan diperlukan media air yang cukup layak kualitasnya untuk mendukung kelangsungan hidup ikan. Kualitas air yang paling berpengaruh terhadap kelangsungan hidup ikan antara lain: oksigen terlarut, suhu, pH air dan amonia (Effendi 2003).
2.3.1 Oksigen terlarut (DO)
Kebutuhan ikan akan oksigen berbeda-beda, bergantung pada spesies, ukuran, aktivitas, jenis kelamin, saat reproduksi, tingkat konsumsi pakan, suhu, dan konsentrsi oksigen terlarut (Boyd 1991). Peningkatan suhu akan meningkatkan laju metabolisme dan menyebabkan permintaan oksigen pada jaringan lebih tinggi (Spotte 1970).
Piper et al. (1986) menyatakan bahwa oksigen terlarut di dalam media pengangkutan harus lebih besar dari 7 ppm dan lebih kecil dari tingkat jenuh, sebab kebutuhan oksigen akan meningkat pada saat kadar CO2 tinggi dan stress penanganan sehingga untuk persiapan disediakan dua kali kebutuhan normal. Pescod (1973) menyatakan bahwa kandungan O2 terlarut yang baik untuk kehidupan ikan harus lebih dari 2 ppm. Jika kurang dari 2 ppm harus tidak terjadi lebih dari 8 jam dalam waktu 24 jam. Kadar oksigen terlarut terendah yang dapat ditolerir ikan dalam pengangkutan adalah 2-3 mg/L (Huet 1971). Hubungannya dengan suhu adalah, jika suhu air sampai 23-24o C akan berhasil mengurangi konsumsi oksigen di awal pengangkutan (Kuncoro 2004).
Oksigen masuk ke dalam air melalui difusi langsung antara permukaan udara dan air (Spotte 1970). Oksigen masuk ke dalam air melalui difusi pasif dari atmosfer, karena adanya perbedaan tekanan parsial oksigen di udara dan di air (Wedemeyer 1996).
Salah satu cara untuk mempertahankan tingkat kelarutan oksigen dalam air adalah dengan pengaerasian, yaitu penambahan oksigen atau udara berisi oksigen secara mekanik ke dalam air hingga konsentrasi kelarutannya meningkat. Pada pengepakan tertutup penambahan oksigen dengan cara menambahkan oksigen murni sebelum pengepakan (Kuncoro 2004).
2.3.2 Derajat Keasaman (pH)
Nilai pH (power of hidrogen) merupakan ukuran konsentrasi ion H+ di dalam air. Keasaman adalah kapasitas air untuk menetralkan ion-ion hidroksil (OHˉ). Nilai pH disebut asam bila kurang dari 7, pH 7 disebut pH netral dan pH di atas 7 disebut basa (Boyd 1990).
Jaringan insang merupakan target organ pertama akibat stress asam. Ketika ikan berada pada pH rendah, peningkatan lendir akan terlihat pada permukaan insang, begitu juga pada pH tinggi, dimana insang ikan sangat sensitif dan berbahaya bagi mata ikan (Boyd 1990). Kriteria pH yang ideal menurut Pescod (1973) adalah 6,5-8,5.
2.3.3 Suhu
Jhingran dan Pullin (1985) menyatakan kriteria temperatur yang ideal untuk pengangkutan ikan tropis adalah 20-24oC. Setiap spesies memiliki kisaran suhu yang berbeda, maka bila terjadi perubahan di luar kisaran suhu tersebut akan membuat ikan menjadi stress bahkan dapat mangakibatkan kematian. Peningkatan suhu akan menurunkan konsentrasi DO (dissolve oxygen), meningkatkan laju metabolisme dan konsumsi oksigen ikan. Penurunan suhu air akan menurunkan suhu tubuh, respon imun ikan, aktivitas makan dan pertumbuhan (Wedemeyer 1996).
2.3.4 Amonia
Sumber utama amonia di perairan adalah ekskresi langsung amonia oleh ikan atau hasil metabolisme ikan (Boyd 1990). Amonia yang dilepas oleh ikan menyebabkan keseimbangan sebagai berikut:
NH3 + H2O NH4+ + OH
-Di dalam perairan amonia terdapat dalam dua bentuk yaitu, amonium (NH4+) dan amonia yang tidak terionisasi (NH3). NH3 adalah bentuk amonia yang lebih beracun dibanding NH4+ bagi organisme perairan. NH3 sangat berbahaya
bagi ikan, namun NH4+ relatif lebih aman (Boyd 1990). Bentuk kandungan (NH3 dan NH4+) tergantung pada konsentrasi ion hidrogen pada air. Air dengan pH rendah memiliki ion hidrogen lebih banyak sehingga bentuk NH4+ lebih dominan. Jika pH meningkat diatas 7,2 maka jumlah ion hidrogen akan berkurang dan mengakibatkan bentuk NH3 lebih dominan. Peningkatan suhu air juga dapat menyebabkan meningkatnya NH3 yang bersifat toksik sehingga dapat membahayakan ikan (Effendi 2003).
Menurut Frose (1985) dalam wadah pengangkutan laju metabolisme ikan lebih cepat sampai tiga kali dari metabolisme rutin sehingga menyebabkan laju ekskresi hasil metabolisme selama proses pengangkutan meningkat pula. Sumber utama ammonia di perairan adalah ekskresi langsung ammonia oleh ikan atau hasil metabolisme ikan (Boyd 1990).
Seiring dengan peningkatan konsentrasi amonia, maka ekskresi amonia oleh organisme akuatik akan berkurang, hal ini menyebabkan konsentrasi amonia dalam darah dan jaringan lainnya meningkat. Hal ini dapat mengakibatkan perubahan pH dan menimbulkan efek pada reaksi katalisasi enzim dan stabilitas membran. Amonia dapat meningkatkan konsumsi oksigen oleh jaringan, menghancurkan insang, dan mengurangi kemampuan oksigen untuk mentransportasikan oksigen (Boyd 1991). Kadar amonia bebas yang tidak terionisasi (NH3) sebaiknya tidak lebih dari 0,02 mg/L. Peningkatan amonia diatas konsentrasi 0,2 ppm bersifat toksik bagi beberapa jenis ikan (Effendi 2003).
Presentase NH3 terhadap total amonia nitrogen tergantung pada suhu dan pH. Berikut disajikan dalam Tabel 1.
Tabel 1. Presentase Amonia Tak Terionisasi (NH3) pada pH dan Temperatur
yang Berbeda (Stickney, 1979)
Temperatur (oC) pH 6,5 7 7,5 8 8,5 16 0,1 0,3 0,9 2,9 8,5 18 0,1 0,3 1,1 3,3 9,8 20 0,1 0,4 1,2 3,8 11,2 22 0,1 0,5 1,4 4,4 12,7 24 0,2 0,5 1,7 5,0 14,4 26 0,2 0,6 1,9 5,8 16,2 28 0,2 0,7 2,2 6,6 18,2 30 0,3 0,8 2,5 7,3 20,3
Jumlah amonia yang diekskresikan tergantung pada beberapa faktor seperti spesies, ukuran, pakan, dan temperatur (Boyd 1990). Laju metabolisme hewan air yang berukuran lebih kecil akan lebih cepat dibandingkan hewan yang berukuran lebih besar pada spesies yang sama (Spotte 1970).
2.4 Zeolit
Zeolit berasal dari kata Yunani zein yang berarti membuih dan lithos yang berarti batu. Zeolit merupakan mineral hasil tambang yang bersifat lunak dan mudah kering. Warna dari zeolit adalah putih keabu-abuan, putih kehijau-hijauan, atau putih kekuning-kuningan. Ukuran kristal zeolit kebanyakan tidak lebih dari 10-15 mikron. Zeolit terbentuk dari abu vulkanik yang telah mengendap jutaan tahun silam. Sifat-sifat mineral zeolit sangat bervariasi tergantung dari jenis dan kadar mineral zeolit. Zeolit mempunyai struktur berongga biasanya rongga ini diisi oleh air serta kation yang bisa dipertukarkan dan memiliki ukuran pori tertentu. Oleh karena itu zeolit dapat dimanfaatkan sebagai penyaring molekuler, senyawa penukar ion, sebagai filter dan katalis (Mursi Sutarti, 1994). Berdasarkan penelitian Riza (2007) dalam waktu 1 jam, zeolit berukuran -40/+60 mesh dengan berat 10 gram mampu menurunkan kandungan TAN sampai 1,2 mg/L.
Menurut Srihapsari (2006) kegunaan zeolit adalah sebagai penukar ion, yaitu pertukaran ion-ion dari suatu larutan elektrolit dengan ion dari zeolit. Pertukaran hanya dapat terjadi diantara ion-ion yang sejenis dan berlangsung dalam waktu yang sangat singkat. Pertukaran kation berlangsung bila kation yang bergerak dan bermuatan positif terikat pada gugus yang bermuatan negatif saling bertukar dengan kation lain yang terdapat dalam larutan. Demikian sebaliknya dengan anion. Dalam pengangkutan ikan sistem tertutup kegunaan zeolit terutama adalah sebagai penukar ion NH4+ dengan Ca2+ atau Na+ atau ion-ion lainnya (Mumphton dan Fishman 1977 dalam Anwar 1989) sehingga dapat menetralkan racun hasil metabolisme. Pada sistem tertutup dengan penambahan zeolit, jumlah benih ikan yang diangkut dapat ditingkatkan 20-25% (Coger dan Turner 1985
Proses aktivasi zeolit alam dapat dilakukan dengan 2 cara, yang pertama yaitu secara fisika melalui pemanasan dengan tujuan untuk menguapkan air yang terperangkap di dalam pori-pori kristal zeolit, sehingga luas permukaannya bertambah. Proses pemanasan zeolit dikontrol, karena pemanasan yang berlebihan kemungkinan akan menyebabkan zeolit tersebut rusak. Yang kedua aktivasi zeolit secara kimia dengan tujuan untuk membersihkan permukaan pori, membuang senyawa pengotor dan mengatur kembali letak atom yang dapat dipertukarkan (Khairinal 2000). Urutan kerja aktivitasi zeolit (Anwar 1989).
1. Zeolit ditimbang sebanyak 100 gram di dalam gelas piala.
2. Ditambahkan 1000 ml larutan pengaktif (NaOH) dan diaduk dengan pengaduk dari plastik selama 4 jam.
3. Dicuci dengan air suling hingga bau NaOH hilang. 4. Zeolit dikeringkan pada temperatur 105o C.
2.5 Karbon Aktif
Karbon aktif merupakan suatu padatan berpori yang mengandung 85-95% karbon, dihasilkan dari bahan-bahan yang mengandung karbon dengan pemanasan pada suhu tinggi (Chand dan Meenakshi 2005 dalam Suherman dkk. 2009). Beberapa limbah hasil pertanian seperti jerami padi, jerami gandum, kulit kacang, bambu dan serabut kelapa dapat dimanfaatkam menjadi produk karbon aktif dan telah dikaji secara mendalam dengan berbagai prosedur yang berbeda (Lartey dan Francis 2002 dalam Suherman dkk. 2009). Karbon aktif mempunyai sifat adsorbtif terhadap suatu larutan, gas, atau uap sehingga bahan tersebut dapat digunakan sebagai penjernih larutan, penghisap gas atau racun dan penghilang warna (Culp et al. 1978 dalam Hadi 1988).
Pembuatan karbon aktif dibagi menjadi dua macam yaitu aktifasi kimia dan aktifasi fisika. Proses aktifasi fisika membutuhkan suhu tinggi 600-900°C. Jenis bahan kimia yang dapat digunakan sebagai aktifator adalah hidroksida logam alkali garam-garam karbonat, klorida, sulfat, fosfat dari logam alkali tanah dan khususnya ZnCl2, asam-asam anorganik seperti H2SO4 dan H4PO4, dan uap air pada suhu tinggi. Unsur-unsur mineral dari persenyawaan kimia yang ditambahkan tersebut akan meresap ke dalam arang dan membuka permukaan
yang semula tertutup oleh komponen kimia sehingga volume dan diameter pori bertambah besar. Jenis aktivator yang dipilih akan berpengaruh terhadap kualitas karbon aktif. Beberapa jenis senyawa kimia yang sering digunakan dalam industri pembuatan karbon aktif adalah ZnCl2, KOH, dan H2SO4. Masing-masing jenis aktifator akan memberikan efek/pengaruh yang berbeda-beda terhadap luas permukaan maupun volume pori-pori karbon aktif yang dihasilkan (Michael 1995
III. BAHAN DAN METODE
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan mulai bulan Juli sampai Agustus 2009, di Laboratorium Lingkungan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
3.2 Prosedur Percobaan
Alat yang digunakan yaitu kantung plastik poly etylen (PE) ukuran 15x45 cm sebanyak 12 lembar, 200 ikat karet gelang, 1 buah termometer, 1 unit pH meter, 1 unit DO-meter, data sheet dan spektrofotometer.
Bahan yang digunakan yaitu air bersih yang berasal dari tandon laboratorium Lingkungan BDP sebanyak 12 liter, 240 gram zeolit yang telah dikemas berukuran 22-36 mesh, 120 gram karbon aktif berukuran 13-44 mesh, reagent uji amonia (1 tetes KMnO4, chlorox 0,5 ml, phenate 0,6 mL) dan ikan ikan maanvis (Pterophyllum scalare) dengan berat rata-rata 2 gram sebanyak 345 ekor.
Prosedur yang dilakukan yaitu ikan uji dipuasakan selama 2 hari. Selanjutnya sampel air diambil untuk diukur pH, suhu, kadar oksigen terlarut, dan kadar amonia. Kemudian disiapkan 12 lembar kantung plastik dan karet pengikat, salah satu ujung plastik dipasang keran untuk mengambil sample air, sedangkan diujung lainnya diikat dengan karet untuk menghindari titik mati air. Selanjutnya kantung plastik diisi dengan air masing-masing 1 liter dan ikan uji dimasukkan ke dalam kantong plastik dengan kepadatan 20, 25, 30 dan 40 ekor per kantung. Zeolit dan karbon aktif yang telah dibungkus kain dimasukkan ke dalam kantung dengan dosis berturut-turut 20 gram/liter dan 10 gram/liter.
Masing-masing perlakuan terdiri dari 3 kali ulangan. Setiap kantung diisi air dan oksigen dengan perbandingan 1:2 dan diikat dengan karet gelang, kemudian dimasukkan ke dalam kotak styrofoam. Selanjutnya dimasukkan batu es ke dalam kotak styrofoam agar suhu stabil sekitar 20ºC, kemudian ditutup.
Pengamatan keadaan ikan dilakukan setiap 6 jam, dan pengambilan sampel air sebanyak 30 ml per kantung setiap 48 jam. Pengamatan dan pengambilan sampel dihentikan hingga 120 jam.
3.4 Rancangan Penelitian
Rancangan yang digunakan dalam penelitian ini adalah RAL (Rancangan Acak Lengkap), yaitu 4 jenis perlakuan masing-masing terdiri dari 3 kali ulangan, yaitu :
1) Perlakuan A dengan kepadatan 20 ekor/liter 2) Perlakuan B dengan kepadatan 25 ekor/liter 3) Perlakuan C dengan kepadatan 30 ekor/liter 4) Perlakuan D dengan kepadatan 40 ekor/liter
Model percobaan yang digunakan dalam percobaan ini adalah:
Keterangan :
Yij = ulangan ke- j akibat perlakuan ke-i µ = nilai tengah
τi = pengaruh perlakuan ke-i ∑ij = galat
Parameter yang digunakan dalam mengevaluasi percobaan adalah data tingkat kelangsungan hidup, konsentrasi total amonia nitrogen, konsentrasi amonia tak terionisasi, serta sebagai pendukung adalah data pH, suhu dan kadar oksigen terlarut.
3.5 Analisis Data
Data yang diperoleh kemudian dianalisis menggunakan analisis ragam (ANOVA) dengan uji F pada selang kepercayaan 95 % dan uji Tukey.
ij i yij
IV HASIL DAN PEMBAHASAN
4.1 Hasil
4.1.1 Total Amonia Nitrogen (TAN)
Konsentrasi total amonia nitrogen (TAN) diukur setiap 48 jam dari jam ke-0 hingga jam ke-120. Peningkatan konsentrasi TAN terjadi pada semua perlakuan, konsentrasi TAN tertinggi pada kepadatan 40 ekor yaitu 4,40±0,30 mg/l dan terendah pada kepadatan 20 ekor yaitu 4,10±0,19 mg/l. Sedangkan pada kepadatan 25 ekor dan 30 ekor sebesar 4,16±0,27 mg/l dan 4,12±0,26 mg/l (Lampiran 1).
Gambar 2. Total Amonia Nitrogen Rata-rata setiap Perlakuan pada Media Air Pengangkutan
Gambar 2 menjelaskan peningkatan konsentrasi TAN terhadap pertambahan waktu. Pola peningkatan konsentrasi TAN relatif sama pada semua perlakuan.
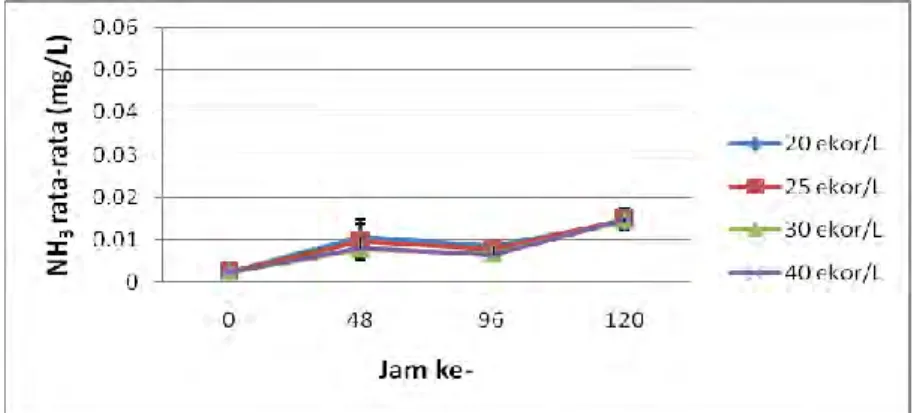
4.1.2 Amonia tak Terionisasi (NH3)
Konsentrasi NH3 media diukur setiap 48 jam dimulai jam ke-0 hingga jam ke-120. Konsentrasi NH3 tertinggi pada kepadatan 40 ekor 0,0148±0,0024 mg/l disusul kepadatan 25 ekor 0,0147±0,0028 mg/l, sedangkan terendah pada perlakuan 20 ekor/L sebesar 0,0140±0,0010 mg/l (Lampiran 2).
Gambar 3. Amonia tak terionisasi rata-rata setiap perlakuan pada media air pengangkutan
Amonia tak terionisasi (NH3) rata-rata pada keempat perlakuan memiliki pola yang relatif sama. Konsentrasi NH3 rata-rata berfluktuasi selama 120 jam (Gambar 3).
4.1.3 Suhu
Pengukuran suhu dilakukan setiap 48 jam selama 120 jam. Selama pengamatan, pada jam yang sama baik kepadatan 20, 25, 30 maupun 40 ekor memiliki suhu yang sama. Suhu tertinggi terjadi pada jam ke-0 sebesar 26,6 oC dan terendah 20 oC pada jam ke-120 (Lampiran 3).
Gambar 4. Suhu rata-rata setiap perlakuan pada media air pengangkutan
Suhu untuk semua perlakuan mengalami penurunan hingga jam ke-120. Penurunan drastis terjadi pada jam ke-48, selanjutnya stabil sampai jam ke- 96 dan terjadi penurunan kembali hingga jam ke- 120 (Gambar 4).
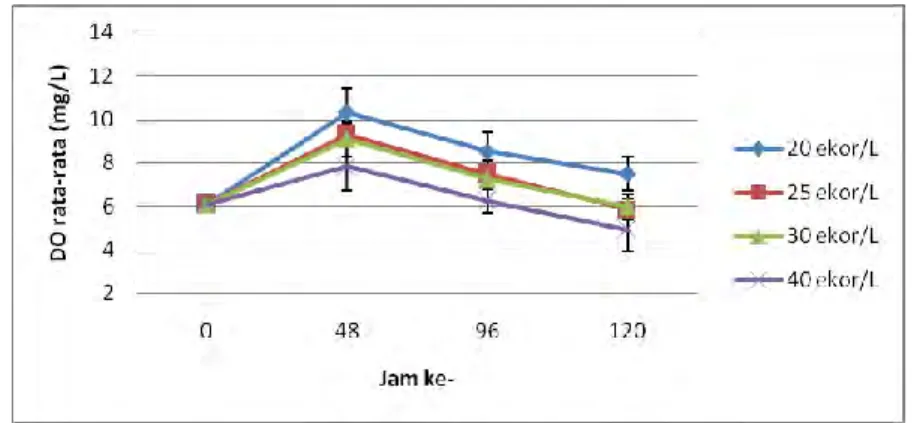
4.1.4 Oksigen Terlarut (DO)
Pengukuran DO dilakukan setiap 48 jam dari jam ke-0 hingga jam ke-120. Konsentrasi DO tertinggi adalah 7,48±0,79 mg/l pada perlakuan kepadatan 20 ekor/L dan terendah sebesar 4,90±0,96 mg/l pada perlakuan kepadatan 40 ekor/L (Lampiran 4).
Gambar 5. Oksigen terlarut rata-rata setiap perlakuan pada media air pengangkutan
Hubungan oksigen terlarut terhadap waktu disajikan pada Gambar 5. Pada awal perlakuan konsentrasi oksigen terlarut masing-masing perlakuan adalah sama yaitu 6,1 mg/L. Peningkatan konsentrasi oksigen terlarut terjadi pada jam ke-48 dan terjadi penurunan pada jam ke-96 dan 120.
4.1.5 pH
Pengukuran pH media pengepakan dilakukan setiap 48 jam selama 120 jam. Nilai pH media pengepakan pada setiap perlakuan berkisar antara 6,89±0,06 dan 7,35±0,00 (Lampiran 5).
Nilai pH rata-rata media pengepakan keempat perlakuan kepadatan mengalami penurunan pada jam ke- 0 sampai jam ke- 96, kemudian terjadi peningkatan pH sampai jam ke- 120. Pola hubungan pH terhadap pertambahan waktu memiliki kesamaan untuk semua pengangkutan (Gambar 6).
4.1.6 Tingkat Kelangsungan Hidup
Tingkat kelangsungan hidup ikan maanvis diamati setiap 6 jam selama 120 jam. Tingkat kelangsungan hidup tertinggi sebesar 100±0,00% pada perlakuan kepadatan 25 ekor sedangkan terendah pada perlakuan kepadatan 20 ekor sebesar 96,67±2,89% (Lampiran 6).
Gambar 7. Tingkat Kelangsungan Hidup (%) Rata-rata Setiap Perlakuan
Tingkat kelangsungan hidup untuk semua perlakuan disajikan dalam Gambar 7. Grafik tersebut diambil dari data tingkat kelangsungan hidup rata-rata setiap perlakuan pada (Lampiran 6). Pada jam ke-0 hingga jam ke-96, tingkat kelangsungan hidup dari masing-masing perlakuan menunjukkan hasil yang sama yaitu 100±0,00%. Kematian ikan uji mulai terjadi pada jam-ke 108.
4.2 Pembahasan
Konsentrasi TAN rata-rata (Gambar 2) meningkat seiring bertambahnya waktu. Konsentrasi TAN rata-rata setiap perlakuan pada jam ke-120 berkisar antara 4,10±0,19 – 4,40±0,30 mg/L (Lampiran 1). Menurut Riza (2007) laju ekskresi TAN maanvis ukuran 2 gram adalah 0,004 mg/L/jam, sehingga dapat diduga laju ekskresi TAN maanvis ukuran 2 gram selama 120 jam ± 0.48 mg/L dan laju ekskresi TAN maanvis ukuran 2 gram sebanyak 40 ekor adalah 19,2 mg/L. Rendahnya nilai TAN selama penelitian ini disebabkan oleh daya serap zeolit dan karbon aktif terhadap amonia. Menurut Supendi (2006) salah satu cara untuk mengurangi konsentrasi amonia adalah dengan menggunakan zeolit dan karbon aktif, dimana zeolit dan karbon aktif ini mampu mengadsorbsi sejumlah amonia dalam waktu tertentu.
Menurut Boyd (1990), di dalam perairan amonia terdapat dalam dua bentuk yaitu, amonium (NH4+) dan amonia yang tidak terionisasi (NH3). NH3 adalah bentuk amonia yang lebih beracun dibanding NH4+ bagi organisme perairan. NH3 sangat berbahaya bagi ikan, namun NH4+ relatif lebih aman. Dari grafik amonia rata-rata di atas dapat dilihat bahwa konsentrasi NH3 meningkat pada 48 jam pertama, kemudian menurun sampai jam ke- 96 dan naik kembali sampai jam ke- 120. Pola peningkatan NH3 tersebut berhubungan dengan konsentrasi TAN serta dipengaruhi oleh suhu dan pH air.
Konsentrasi NH3 setiap perlakuan pada jam ke 120 berkisar antara 0,0140±0,0010 - 0,0148±0,0024mg/L (Lampiran 2). Konsentrasi tersebut masih aman untuk kehidupan ikan. Menurut Efendi (2003) kadar NH3 pada perairan tawar sebaiknya tidak melebihi 0,02 mg/L. Konsentrasi NH3 pada penelitian ini lebih rendah jika dibandingkan dengan penelitian Riza (2007) sebelumnya. Berdasarkan penelitian sebelumnya pada jam ke 120 konsentrasi NH3 pada pengangkutan sistem tertutup ikan maanvis sebanyak 20 ekor/L dengan penambahan zeolit 20 gram/L adalah 0,0159±0,0051 mg/L (Lampiran 7). Hal ini disebabkan adanya perbedaan penambahan 10 gram/L karbon aktif pada penelitian ini.
Berdasarkan penelitian Riza (2007) konsentrasi NH3 untuk perlakuan kontrol tanpa penambahan zeolit ataupun karbon aktif adalah 0,0663±0,0021
mg/L (Lampiran 7). Jika dilihat dari konsentrasi NH3 perlakuan kontrol tanpa penambahan zeolit dan karbon aktif pada penelitian sebelumnya yang jauh lebih tinggi dibandingkan konsentrasi NH3 pada penelitian ini, penambahan zeolit sebanyak 20 gram/L dan karbon aktif 10 gram/L sangat efektif dalam menekan kenaikan konsentrasi NH3 sehingga nilainya masih dalam kisaran yang layak bagi kehidupan ikan maanvis pada pengepakan sistem tertutup sampai kepadatan 40 ekor/L selama 120 jam.
Rendahnya fraksi NH3 terhadap TAN pada penelitian ini disebabkan oleh rendahnya pH dan suhu pada media air pengepakan, yaitu suhu 20-21º C (Lampiran 3) dan pH 6,73-7,35 (Lampiran 5) serta daya serap zeolit dan karbon aktif. Menurut Effendi (2003) bentuk kandungan (NH3 dan NH4+) tergantung pada konsentrasi ion hidrogen pada air. Air dengan pH rendah memiliki ion hidrogen lebih banyak sehingga bentuk NH4+ lebih dominan. Jika pH meningkat diatas 7,2 maka jumlah ion hidrogen akan berkurang dan mengakibatkan bentuk NH3 lebih dominan. Peningkatan suhu air juga dapat menyebabkan meningkatnya NH3 yang bersifat toksik sehingga dapat membahayakan ikan.
Peningkatan suhu menyebabkan peningkatan laju metabolisme dan respirasi organisme air, dan selanjutnya mengakibatkan peningkatan konsumsi oksigen (Effendie 2003), untuk menghindari hal tersebut maka suhu dalam kemasan diturunkan (sampai batas tertentu) dengan penambahan batu es ke dalam kotak styrofoam. Penurunan suhu (sampai batas tertentu) juga menyebabkan peningkatkan kelarutan oksigen dalam air. Menurut Boyd (1990) kelarutan oksigen terlarut paling tinggi pada suhu 0º C dan turun dengan meningkatnya suhu. Suhu air media pengepakan pada umumnya berkisar antara 20-21 oC (Lampiran 3), suhu tersebut masih di dalam kisaran optimum kehidupan ikan maanvis. Menurut Susanto (2000) suhu optimum maanvis berkisar antara 20-25 o
C.
Grafik konsentrasi oksigen terlarut terhadap waktu di atas diambil dari data konsentrasi rata-rata oksigen terlarut tiap perlakuan. Pada awal perlakuan (jam ke- 0) konsentrasi oksigen terlarut masing-masing perlakuan adalah sama yaitu 6,1 mg/L. Hal ini disebabkan pada awal penelitian digunakan sumber air yang sama untuk masing-masing perlakuan. Peningkatan konsentrasi oksigen
terlarut terjadi sampai jam ke- 48, hal ini dikarenakan adanya penambahan oksigen murni pada awal pengepakan. Selanjutnya konsentrasi oksigen terlarut rata-rata setiap perlakuan menurun seiring bertambahnya waktu.
Konsentrasi oksigen terlarut rata-rata media air pengepakan menurun seiring dengan semakin tingginya kepadatan ikan. Konsentrasi oksigen terlarut terendah pada akhir perlakuan menunjukkan angka yang masih bisa ditolerir untuk kehidupan ikan yaitu 3,79 mg/L. Kadar oksigen terlarut terendah yang dapat ditolerir ikan dalam pengangkutan adalah 2-3 mg/L (Huet 1971).
Nilai pH media pengepakan berkisar antara 6,73-7,35 (Lampiran 6) sehingga masih dalam kisaran optimum kehidupan ikan maanvis yaitu berkisar antara 6,5-7,5 (Susanto 2000). Dari pembahasan kualitas air (NH3, suhu, DO, dan pH) dapat disimpulkan bahwa selama penelitian, kualitas air tersebut masih layak untuk kehidupan ikan maanvis. Hasil tersebut memungkinkan kelangsungan hidup ikan maanvis tetap tinggi.
Tingkat kelangsungan hidup ikan maanvis dapat dilihat pada Tabel 7. Berdasarkan analisa sidik ragam diketahui bahwa pada jam ke- 0 sampai jam ke- 120 tingkat kelangsungan hidup ikan maanvis pada setiap perlakuan tidak berbeda nyata (P<0,005). Tingkat kelangsungan hidup ikan maanvis mulai mengalami penurunan setelah jam ke- 96. Kematian yang terjadi pada setiap perlakuan diduga karena kelelahan yang dialami ikan selama penelitian. Proses pengangkutan dapat menimbulkan stress pada ikan. Menurut Wedemeyer (1996) respon stres terjadi dalam 3 tahap yaitu stres, bertahan, dan kelelahan. Ketika terdapat stres dari luar, ikan akan mengeluarkan energinya untuk bertahan. Proses bertahan menyebabkan pertumbuhan dapat menurun dan selanjutnya terjadi kematian. Kematian ikan maanvis mulai terjadi pada jam ke- 108. Pada saat itu ikan maanvis sudah dalam kondisi puasa selama 7 hari. Berdasarkan penelitian Riza (2007) ikan maanvis dengan bobot 2 gram hanya mampu bertahan hidup dalam keadaan puasa sampai 9 hari dalam lingkungan yang terkontrol. Kematian pada ikan uji terkait dengan laju metabolisme yang lebih tinggi selama pengangkutan sehingga energi yang dikeluarkan ikan akan lebih besar jika dibandingkan dengan kondisi metabolisme rutin, akibatnya ikan akan lebih cepat mengalami kematian akibat kehabisan energi untuk bertahan dari stres. Menurut Frose (1985) di dalam wadah
pengangkutan laju metabolisme ikan lebih cepat sampai tiga kali dari metabolisme rutin.
Perlakuan penambahan zeolit sebanyak 20 gram/L dan karbon aktif 10 gram/L dengan kepadatan 40 ekor/L pada penelitian menunjukkan efisiensi teknis dan ekonomis yang paling tinggi diantara perlakuan lainnya. Hal ini terlihat dari hasil akhir jumlah ikan yang masih hidup pada jam ke-120 lebih tinggi jika dibandingkan dengan perlakuan lainnya serta perhitungan biaya pengangkutan rata-rata/ekor pada jam ke-120 yang paling rendah (Lampiran 8).
Jumlah ikan yang masih hidup (jam ke-120) pada penelitian ini 2 kali lebih tinggi jika dibandingkan dengan penelitian sebelumnya (Riza 2007) dengan biaya pengangkutan yang lebih rendah 2 kali lipat (Lampiran 8), sedangkan jika dibandingkan dengan kepadatan yang umum digunakan dalam pengangkutan sistem tertutup ikan maanvis jumlah ikan yang masih hidup 4 kali lebih tinggi dengan biaya pengangkutan 3,5 kali lebih rendah (Lampiran 8).
BAB V. KESIMPULAN DAN SARAN
5.1 Kesimpulan
Penambahan zeolit sebanyak 20 gram/L dan karbon aktif 10 gram/L sangat efektif dalam menekan kenaikan konsentrasi NH3. Perlakuan penambahan zeolit sebanyak 20 gram/L dan karbon aktif 10 gram/L dengan kepadatan 40 ekor/L menunjukkan efisiensi teknis dan ekonomis yang paling tinggi diantara perlakuan lainnya.
Jika dibandingkan dengan penelitian sebelumnya (Riza 2007), jumlah ikan yang masih hidup (jam ke-120) pada penelitian ini 2 kali lebih tinggi dengan biaya pengangkutan yang lebih rendah 2 kali lipat, sedangkan jika dibandingkan dengan kepadatan yang umum digunakan dalam pengangkutan sistem tertutup ikan maanvis jumlah ikan yang masih hidup 4 kali lebih tinggi dengan biaya pengangkutan 3,5 kali lebih rendah.
5.2 Saran
Pengangkutan sistem tertutup ikan maanvis selama 120 jam dapat digunakan kepadatan 40 ekor/L dengan penambahan 20 gram/L zeolit dan 10 gram/L karbon aktif.
DAFTAR PUSTAKA
Anwar, R. 1989. Pengaruh Zeolit pada Pengangkutan Benih Ikan Gurame (Osphronemus gouramy). Karya Ilmiah. Program Sarjana. Institut Pertanian Bogor. Bogor
Axelrod, H.R. 1995. Mini Atlas of freshwater Aquarium fish. The United States to the Pet Trade. T.F.H Publication, Inc. Hlm 89-96.
Bachtiar, Y. 2004. Budidaya Ikan Hias Air Tawar Untuk Ekspor. Agromedia Pustaka. Depok.
Boyd, C.E. 1990. Water Quality Management in Ponds for Aquaculture. Birmingharm Publishing Co., Alabama
Boyd, C.E. 1991. Water Quality Management and Aeration in Shirmp Farming. Editor Alex Bocek Pedoman Teknis dari Proyek Penelitian dan Pengembangan Perikanan, Pusat Litbang Perikanan Indonesia
Daelani, D. A.S.2001. Usaha Pembenihan Ikan Hias Air Tawar. Penebar Swadaya, Jakarta.
Djadjadireja, R.R. 1958. Preliminary Report on Tranportation of Chanos Fingerling with Aerating System. Indo-Pasifik fish. Coor., 8 (II), hlm 1-8
Effendi, H. 2003. Telaah Kualitas Air bagi Pengolahan Sumberdaya dan
Lingkungan Perairan. Jurusan Sumberdaya Perairan, Fakultas
Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Effendi, I.M. 1985. Biologi Perikanan. Bagian I: Study Natural History. Bogor: Fakultas Perikanan, Institut Pertanian Bogor.
[FAO] Food and Drugs Administration. 1995. Quality and quality Changes in fresh fish. FAO Fish. Tech. hlm 348
Frose, R. 1985. Improved Fish Transport in Plastic Bag. ICLARM Newsletter 8 (4). Hlm 8-9.
Garbhards, V.S. 1965. Transport of Juvenile Trout in Sealed Containers. The Progressive Culturist 27 (1). Hlm 1-6
Hadi, A. 1988. Peran Arang Tempurung Kelapa dalam Perbaikan Mutu Air dan Kelangsungan Hidup Larva Udang Windu (Peneaus monodon). Karya Ilmiah. Program Sarjana. Institut Pertanian Bogor. Bogor
Huet, M. 1971. Text Book of Fish Culture. Breeding and Cultivation of Fish. Fishing News (Book) Ltd., London, Hlm 436
Jhingran, V.G., Pullin. 1985. Hatchery Manual of Common Carp, Chineese, and Indian Major Carps. ICLARM Studies and Reviews II. Asian Development Bank. hlm 74-80.
Junianto. 2003. Teknik Penanganan Ikan. Penebar Swadaya, Jakarta.
Khairinal, T.W. 2000. Dealuminasi Zeolit Alam Wonosari dengan Perlakuan
asam dan Proses Hidrotermal. Prosiding Seminar Nasional Kimia VIII.
Yogyakarta
Kuncoro, B. 2004. Kiat Memasarkan Ikan Hias. Penebar Swadaya, Jakarta. Lesmana, D. 2001. Budidaya Ikan Hias Populer. Penebar Swadaya, Jakarta. Liviawaty, E., Afrianto, E. 1990. Budidaya Ikan Mas Koki dan Pemasarannya.
Kanisius. Jogjakarta.
Mclnerny, D.G. Gerard. 1958. All About Tropical Fish. The Macmillan Company. NewYork. Hlm 418-421.
Mursi, S. 1994. Zeolit : Tinjauan Literatur. Jakarta
Nemoto, C.M. 1957. Experiments with Methods for Asia Transport of Live Fish. Progressive Fish Culturist 19 (4). Hlm 147-157
Pescod, M.P. 1973. Water Supply and Wastewater Disposal in Developing Countries. Asian Institute of Tecnology, Bangkok.
Piper, R.G, I.B. McElwain, L.E. Orme, J.P. McCaren, L.G. Fowler, J.R. Leonard. 1986. Fish Hatchery Management. United States Department of The Interior Fish and Wildlife Service. Washington DC. Hlm 348-371. Pranoto, S.H. 2007. Isolasi dan Seleksi Bakteri Nitrifikasi dan Denitrifikasi
sebagai Agen Bioremediasi pada Media Pemeliharaan Udang Vannamei. Skripsi. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor Poernomo, S. 2008. DKP dan LIPI Kembangkan Ikan Hias. http://
http://www.indonesia.go.id/id/index.php?option=com_content&task=vie w&id=8427&Itemid=696 [23 November 2009].
Riza, M.F. 2007. Pengaruh Penambahan Zeolit dan Karbon Aktif terhadap Tingkat Kelangsungan Hidup Ikan Maanvis (Pterophyllum scalare) pada Pengangkutan Sistem Tertutup. Skripsi. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor
Spotte, S. 1970. Fish and Invertebrate Culture. 2nd Ed. Jhon Willy and sons. New York.
Srihapsari, D. 2006. Penggunaan Zeolit Alam yang Telah Diaktivasi dengan Larutan Hcl untuk Menjerap Logam-Logam Penyebab Kesadahan Air. Skripsi. Fakultas Matematika dan Ilmu Pengetahuan Alam. Universitas Negri Semarang.
Stickney, R. 1979. Principles of Warmwater Aquaculture. Assosiate Proffesor Departemen of Wildlife and Fishers Sciences. A and M University. Texas
Suherman, Ikawati, Melati. 2009. Pembuatan Karbon Aktif dari Limbah Kulit Singkong UKM Tapioka Kabupaten Pati. Jurnal. Universitas Diponegoro. Semarang
Supendi, A. 2006. Pemanfaatan Zeolit dan Karbon Aktif pada Sistem Pengepakan Tertutup Ikan Corydoras (Corydoras aenus). Skripsi. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor
Susanto, H. 2000. Maanvis. Penebar Swadaya. Jakarta.
Syauqi, A. 2009. Kelangsungan Hidup Benih Bawal Air Tawar Colossoma
macropomum Cuvier. Pada Sistem Pengangkutan Tertutup dengan Padat
Penebaran 43, 86 dan 129 ekor/ Liter. Skripsi. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor
Wedemeyer, G.A. 1996. Physiology of Fish in Intensive Culture Systems. Chapman and hall. New York.
Lampiran 1. Tabel Konsentrasi Total Amonia Nitrogen (mg/L) pada Media Air Pengepakan
Kepadatan (ekor)
Ulangan Jam ke-
0 48 96 120 20 1 0,16 1,52 2,31 4,24 2 0,16 1,82 2,59 4,18 3 0,16 1,46 1,98 3,88 25 1 0,16 1,80 2,13 4,44 2 0,16 1,48 2,47 4,16 3 0,16 1,62 2,22 3,90 30 1 0,16 1,78 2,36 4,34 2 0,16 1,48 2,16 3,82 3 0,16 1,72 2,00 4,20 40 1 0,16 2,07 2,24 4,58 2 0,16 1,88 2,18 4,06 3 0,16 2,02 2,12 4,58
Keterangan : Huruf superscript di belakang nilai standar deviasi yang berbeda pada setiap baris menunjukkan pengaruh perlakuan yang berbeda nyata (P<0,05)
Jam ke- Kepadatan (ekor) 20 25 30 40 0 0,16±0,00 a 0,16±0,00 a 0,16±0,00 a 0,16±0,00 a 48 1,60±0.19 a 1,63±0,16 a 1,66±0,15 a 1,99±0,09 a 96 2,29±0,30 a 2,27±0,17 a 2,17±0,18 a 2,18±0,06 a 120 4,10±0,19 a 4,16±0,27 a 4,12±0,26 a 4,40±0,30 a
Lampiran 2. Tabel Konsentrasi Amonia tak Terionisasi (mg/L) pada Media Air Pengepakan Kepadatan (ekor) Ulangan Jam ke- 0 48 96 120 20 1 0,002416 0,015109 0,008616 0,013144 2 0,002416 0,010046 0,008392 0,015215 3 0,002416 0,006818 0,008633 0,01389 25 1 0,002416 0,014220 0,007498 0,017494 2 0,002416 0,006912 0,008867 0,011898 3 0,002416 0,007841 0,007193 0,014898 30 1 0,002416 0,010733 0,007316 0,015537 2 0,002416 0,006038 0,006696 0,014134 3 0,002416 0,006777 0,006060 0,013776 40 1 0,002416 0,010019 0,007101 0,017221 2 0,002416 0,007144 0,005690 0,012342 3 0,002416 0,006969 0,006572 0,015022 Jam ke- Kepadatan (ekor) 20 25 30 40 0 0,00241±0,00 a 0,00241±0,00 a 0,00241±0,00 a 0,00241±0,00 a 48 0,0106±0,0041 a 0,00965±0,0039 a 0,00784±0,0025 a 0,00804±0,0017 a 96 0,00854±0,00013 b 0,00785±0,00089 ab 0,00669±0,00062 a 0,00645±0,00071 a 120 0,0140±0,0010 a 0,0147±0,0028 a 0,0144±0,00093 a 0,0148±0,0024 a
Keterangan : Huruf superscript di belakang nilai standar deviasi yang berbeda pada setiap baris menunjukkan pengaruh perlakuan yang berbeda nyata (P<0,05)
Lampiran 3. Tabel Suhu (oC) pada Media Air Pengepakan Kepadatan (ekor) Ulangan Jam ke- 0 48 96 120 20 1 26,6 21 21 20 2 26,6 21 21 20 3 26,6 21 21 20 25 1 26,6 21 21 20 2 26,6 21 21 20 3 26,6 21 21 20 30 1 26,6 21 21 20 2 26,6 21 21 20 3 26,6 21 21 20 40 1 26,6 21 21 20 2 26,6 21 21 20 3 26,6 21 21 20 Jam ke- Kepadatan (ekor) 20 25 30 40 0 26,60±0,00 26,60±0,00 26,60±0,00 26,60±0,00 48 21,00±0,00 21,00±0,00 21,00±0,00 21,00±0,00 96 21,00±0,00 21,00±0,00 21,00±0,00 21,00±0,00 120 20,00±0,00 20,00±0,00 20,00±0,00 20,00±0,00
Lampiran 4. Tabel Konsentrasi Oksigen Terlarut (mg/l) pada Media Air Pengepakan Kepadatan (ekor) Ulangan Jam ke- 0 48 96 120 20 1 6,1 11,45 9,04 8,10 2 6,1 9,20 7,50 6,59 3 6,1 10,29 9,04 7,77 25 1 6,1 9,03 6,78 5,88 2 6,1 9,93 7,70 6,31 3 6,1 8,94 7,96 5,38 30 1 6,1 9,39 6,78 5,30 2 6,1 9,73 7,39 6,34 3 6,1 8,18 7,52 6,30 40 1 6,1 6,60 5,65 3,79 2 6,1 8,76 6,68 5,42 3 6,1 8,12 6,39 5,51 Jam ke- Kepadatan (ekor) 20 25 30 40 0 6,10±0,00 6,10±0,00 6,10±0,00 6,10±0,00 48 10,31±1,12 9,30±0,54 9,10±0,81 7,82±1,10 96 8,52±0,88 7,48±0,62 7,23±0,39 6,24±0,53 120 7,48±0,79 5,85±0,46 5,98±0,58 4,90±0,96
Lampiran 5. Tabel pH pada Media Air Pengepakan Kepadatan (ekor) Ulangan Jam ke 0 48 96 120 20 1 7,35 7,32 6,89 6,85 2 7,35 7,06 6,82 6,94 3 7,35 7,01 6,98 6,93 25 1 7,35 7,20 6,86 6,99 2 7,35 7,01 6,87 6,81 3 7,35 7,02 6,82 6,97 30 1 7,35 7,09 6,80 6,93 2 7,35 6,94 6,80 6,95 3 7,35 6,92 6,79 6,88 40 1 7,35 7,02 6,81 6,96 2 7,35 6,90 6,73 6,84 3 7,35 6,85 6,80 6,88 Jam ke- Kepadatan (ekor) 20 25 30 40 0 7,35±0,00 7,35±0,00 7,35±0,00 7,35±0,00 48 7,13±0.16 7,07±0.10 6,98±0.09 6,92±0,08 96 6,89±0,08 6,85±0,02 6,79±0,005 6,78±0,04 120 6,90±0,04 6,92±0,09 6,92±0,03 6,89±0,06
33
Lampiran 6. Tabel Tingkat Kelangsungan Hidup (%) setiap Perlakuan
Kepadatan (ekor) Ulangan jam ke- 0 6 12 18 24 30 36 42 48 54 60 66 72 78 84 90 96 102 108 114 120 20 1 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 95 95 95 2 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 95 95 95 3 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 25 1 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 2 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 3 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 30 1 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 2 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 96,7 96,7 3 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 40 1 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 2 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 97,5 97,5 97,5 3 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100
Lanjutan lampiran 6… Jam ke- Kepadatan (ekor) 20 25 30 40 102 100,00±0,00 a 100,00±0,00 a 100,00±0,00 a 100,00±0,00 a 108 96,67±2,89 a 100,00±0,00 a 100,00±0,00 a 99,17±1,44 a 114 96,67±2,89 a 100,00±0,00 a 98,89±1,92 a 99,17±1,44 a 120 96,67±2,89 a 100,00±0,00 a 98,89±1,44 a 99,17±1,44 a
35 Lampiran 7. Tabel Kualitas Air dan Survival Rate (SR) pada Pengangkutan Sistem Tertutup Ikan Maanvis dengan Kepadatan 20 Ekor/L Jam ke- 120
Perlakuan TAN (mg/L) NH3(mg/L) Suhu (°C) pH DO (mg/L) SR (%)
Kontrol tanpa zeolit
dan karbon aktif 13,258 ± 0,420 0,0663±0,0021
20
6,84±0,08 4,50±0,30 5
Zeolit 20 gram/L 3,179 ± 1,02 0,0159±0,0051 20 6,78±0,14 5,63 ±0,29 100
Zeolit 15 gram/L dan karbon aktif 5 gram/L
4,717±0,475 0,0236±0,003 20 6,69±0,10 5,53±0,23 100
Zeolit 10 gram/L dan karbon aktif 10 gram/L
6,408±0,605 0,0320±0,0030 20 6,76±0,05 5,43±0,31 91,70±2,89
Zeolit 5 gram/L dan karbon aktif 15 gram/L
10,642±0,535 0,0532±0,0027 20 6,77±0,05 5,50±0,17 75±10
Karbon aktif 20
gram/L 11,917±0,210 0,0596±0,0010 20 6,75±0,06 5,23±0,47 65±5 Sumber : Penelitian Riza (2007)
36 dan Karbon Aktif 10 Gram/L pada Jam ke- 120
Perlakuan TAN (mg/L) NH3(mg/L) Suhu (°C) pH DO (mg/L) SR (%)
Kepadatan 20 ekor/L 4,10±0,19 0,0140±0,0010 20 6,90±0,04 7,48±0,79 96,67±2,89 Kepadatan 25 ekor/L 4,16±0,27 0,0147±0,0028 20 6,92±0,09 5,85±0,46 100 Kepadatan 30 ekor/L 4,12±0,26 0,0144±0,00093 20 6,92±0,03 5,98±0,58 98,89±1,44 Kepadatan 40 ekor/L 4,40±0,30 0,0148±0,0024 20 6,89±0,06 4,90±0,96 99,17±1,44
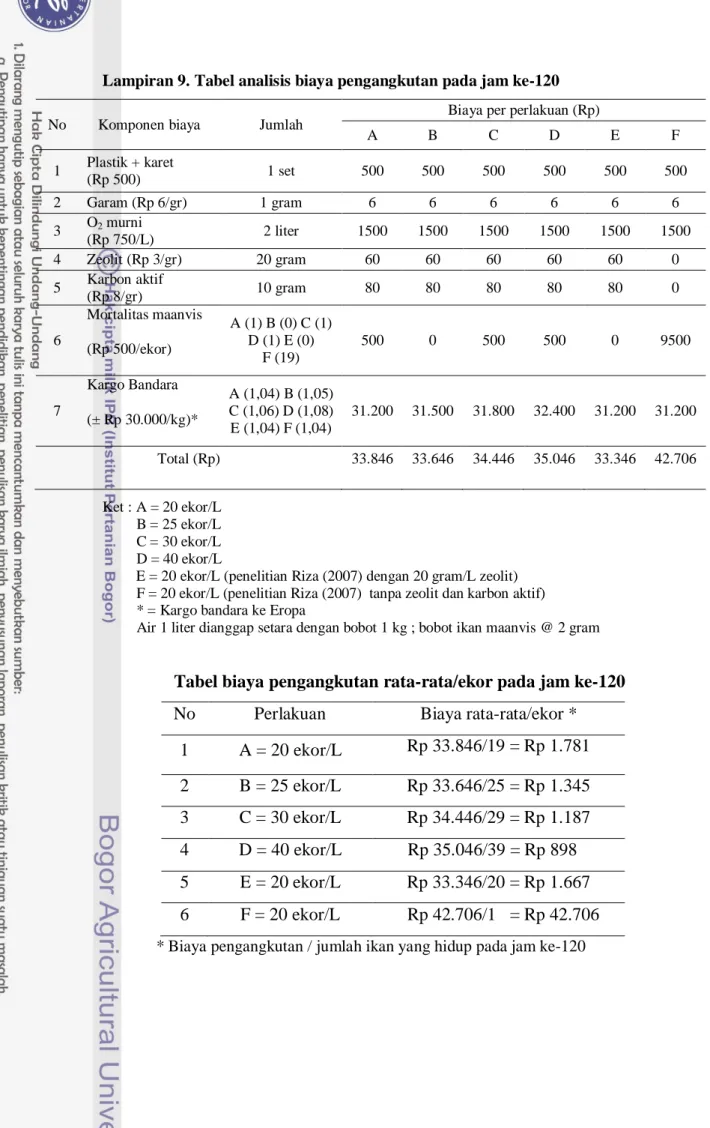
Lampiran 9. Tabel analisis biaya pengangkutan pada jam ke-120
No Komponen biaya Jumlah
Biaya per perlakuan (Rp)
A B C D E F 1 Plastik + karet (Rp 500) 1 set 500 500 500 500 500 500 2 Garam (Rp 6/gr) 1 gram 6 6 6 6 6 6 3 O2 murni (Rp 750/L) 2 liter 1500 1500 1500 1500 1500 1500 4 Zeolit (Rp 3/gr) 20 gram 60 60 60 60 60 0 5 Karbon aktif (Rp 8/gr) 10 gram 80 80 80 80 80 0 6 Mortalitas maanvis (Rp 500/ekor) A (1) B (0) C (1) D (1) E (0) F (19) 500 0 500 500 0 9500 7 Kargo Bandara (± Rp 30.000/kg)* A (1,04) B (1,05) C (1,06) D (1,08) E (1,04) F (1,04) 31.200 31.500 31.800 32.400 31.200 31.200 Total (Rp) 33.846 33.646 34.446 35.046 33.346 42.706 Ket : A = 20 ekor/L B = 25 ekor/L C = 30 ekor/L D = 40 ekor/L
E = 20 ekor/L (penelitian Riza (2007) dengan 20 gram/L zeolit) F = 20 ekor/L (penelitian Riza (2007) tanpa zeolit dan karbon aktif) * = Kargo bandara ke Eropa
Air 1 liter dianggap setara dengan bobot 1 kg ; bobot ikan maanvis @ 2 gram
Tabel biaya pengangkutan rata-rata/ekor pada jam ke-120
No Perlakuan Biaya rata-rata/ekor * 1 A = 20 ekor/L Rp 33.846/19 = Rp 1.781 2 B = 25 ekor/L Rp 33.646/25 = Rp 1.345 3 C = 30 ekor/L Rp 34.446/29 = Rp 1.187 4 D = 40 ekor/L Rp 35.046/39 = Rp 898 5 E = 20 ekor/L Rp 33.346/20 = Rp 1.667 6 F = 20 ekor/L Rp 42.706/1 = Rp 42.706
Lampiran 10. Gambar penelitian
Zeolit Karbon Aktif
Kemasan Zeolit dan Karbon Aktif Akuarium Pemeliharaan Ikan Maanvis
Lampiran 11. Analisis ragam kepadatan terhadap konsentrasi TAN pada jam ke- 0
ANOVA SPSS 16
Source of Variation Sum of Squares df Mean Square F Sig,
Between Groups ,000 3 ,000 , ,
Within Groups ,000 8 ,000
Total ,000 11
(tidak ada uji lanjut)
Pada selang kepercayaan 95% kepadatan tidak memberikan pengaruh nyata terhadap konsentrasi TAN.
Lampiran 12. Analisis ragam kepadatan terhadap konsentrasi TAN pada jam ke- 48
ANOVA SPSS 16
Source of Variation Sum of Squares df Mean Square F Sig,
Between Groups ,295 3 ,098 4,024 ,051 Within Groups ,196 8 ,024 Total ,491 11 UJI TUKEY SPSS 16 perlakuan N
Subset for alpha = 0,05 1 20 ekor/L 3 1,6000 25 ekor/L 3 1,6333 30 ekor/L 3 1,6600 40 ekor/L 3 1,9900 Sig, ,062
Pada selang kepercayaan 95% kepadatan tidak memberikan pengaruh nyata terhadap konsentrasi TAN.
Lampiran 13. Analisis ragam kepadatan terhadap konsentrasi TAN pada jam ke- 96
ANOVA SPSS 16
Source of Variation Sum of Squares df Mean Square F Sig,
Between Groups ,035 3 ,012 ,289 ,832 Within Groups ,321 8 ,040 Total ,356 11 UJI TUKEY SPSS 16 perlakuan N
Subset for alpha = 0,05 1 30 ekor/L 3 2,1733 40 ekor/L 3 2,1800 25 ekor/L 3 2,2733 20 ekor/L 3 2,2933 Sig, ,881
Pada selang kepercayaan 95% kepadatan tidak memberikan pengaruh nyata terhadap konsentrasi TAN.
Lampiran 14. Analisis ragam kepadatan terhadap konsentrasi TAN pada jam ke- 120
ANOVA SPSS 16
Source of Variation Sum of Squares df Mean Square F Sig,
Between Groups ,181 3 ,060 ,883 ,490 Within Groups ,545 8 ,068 Total ,726 11 UJI TUKEY SPSS 16 perlakuan N
Subset for alpha = 0,05 1 20 ekor/L 3 4,1000 30 ekor/L 3 4,1200 25 ekor/L 3 4,1667 40 ekor/L 3 4,4067 Sig, ,512
Pada selang kepercayaan 95% kepadatan tidak memberikan pengaruh nyata terhadap konsentrasi TAN.
Lampiran 15. Analisis ragam kepadatan terhadap konsentrasi NH3 pada jam
ke- 0
ANOVA SPSS 16
Source of Variation Sum of Squares df Mean Square F Sig,
Between Groups ,000 3 ,000 , ,
Within Groups ,000 8 ,000
Total ,000 11
(tidak ada uji lanjut)
Pada selang kepercayaan 95% kepadatan tidak memberikan pengaruh nyata terhadap konsentrasi NH3.
Lampiran 16. Analisis ragam kepadatan terhadap konsentrasi NH3 pada jam
ke- 48
ANOVA SPSS 16
Source of Variation Sum of Squares df Mean Square F Sig,
Between Groups ,000 3 ,000 ,508 ,688 Within Groups ,000 8 ,000 Total ,000 11 UJI TUKEY SPSS 16 Perlakuan N
Subset for alpha = 0,05 1 30 ekor/L 3 ,00784933 40 ekor/L 3 ,00804400 25 ekor/L 3 ,00965767 20 ekor/L 3 ,01065767 Sig, ,725
Pada selang kepercayaan 95% kepadatan tidak memberikan pengaruh nyata terhadap konsentrasi NH3.
Lampiran 17. Analisis ragam kepadatan terhadap konsentrasi NH3 pada jam
ke- 96
ANOVA SPSS 16
Source of Variation Sum of Squares df Mean Square F Sig,
Between Groups ,000 3 ,000 6,802 ,014 Within Groups ,000 8 ,000 Total ,000 11 UJI TUKEY SPSS 16 perlakuan N
Subset for alpha = 0,05 1 2 40 ekor/L 3 ,00645433 30 ekor/L 3 ,00669067 25 ekor/L 3 ,00785267 ,00785267 20 ekor/L 3 ,00854700 Sig, ,114 ,589
Pada selang kepercayaan 95% kepadatan tidak memberikan pengaruh nyata terhadap konsentrasi NH3.
Lampiran 18. Analisis ragam kepadatan terhadap konsentrasi NH3 pada jam
ke-120
Pada selang kepercayaan 95% kepadatan tidak memberikan pengaruh nyata terhadap konsentrasi NH3.
ANOVA SPSS 16
Source of Variation Sum of Squares df Mean Square F Sig,
Between Groups ,000 3 ,000 ,093 ,962 Within Groups ,000 8 ,000 Total ,000 11 UJI TUKEY SPSS 16 perlakuan N
Subset for alpha = 0,05 1 20 ekor/L 3 ,01408300 30 ekor/L 3 ,01448233 25 ekor/L 3 ,01476333 40 ekor/L 3 ,01486167 Sig, ,961
Lampiran 19. Analisis Ragam Kepadatan terhadap kelangsungan hidup ikan maanvis pada jam ke- 108
Pada selang kepercayaan 95% kepadatan tidak memberikan pengaruh nyata terhadap kelangsungan hidup ikan maanvis.
ANOVA SPSS 16
Source of Variation Sum of Squares df Mean Square F Sig,
Between Groups 22,396 3 7,465 2,867 ,104 Within Groups 20,833 8 2,604 Total 43,229 11 UJI TUKEY SPSS 16 Perlakuan N
Subset for alpha = 0,05 1 20 ekor/L 3 96,6667 40 ekor/L 3 99,1667 25 ekor/L 3 100,0000 30 ekor/L 3 100,0000 Sig, ,129
Lampiran 20. Analisis Ragam Kepadatan terhadap kelangsungan hidup ikan maanvis pada jam ke-114
Pada selang kepercayaan 95% kepadatan tidak memberikan pengaruh nyata terhadap kelangsungan hidup ikan maanvis.
ANOVA SPSS 16
Source of Variation Sum of Squares df Mean Square F Sig,
Between Groups 18,243 3 6,081 1,732 ,238 Within Groups 28,093 8 3,512 Total 46,337 11 UJI TUKEY SPSS 16 Perlakuan N
Subset for alpha = 0,05 1 20 ekor/L 3 96,6667 30 ekor/L 3 98,9000 40 ekor/L 3 99,1667 25 ekor/L 3 100,0000 Sig, ,209
Lampiran 21. Analisis Ragam Kepadatan terhadap kelangsungan hidup ikan maanvis pada jam ke- 120
Pada selang kepercayaan 95% kepadatan tidak memberikan pengaruh nyata terhadap kelangsungan hidup ikan maanvis.
ANOVA SPSS 16
Source of Variation Sum of Squares df Mean Square F Sig,
Between Groups 18,243 3 6,081 1,732 ,238 Within Groups 28,093 8 3,512 Total 46,337 11 UJI TUKEY SPSS 16 Perlakuan N
Subset for alpha = 0,05 1 20 ekor/L 3 96,6667 30 ekor/L 3 98,9000 40 ekor/L 3 99,1667 25 ekor/L 3 100,0000 Sig, ,209