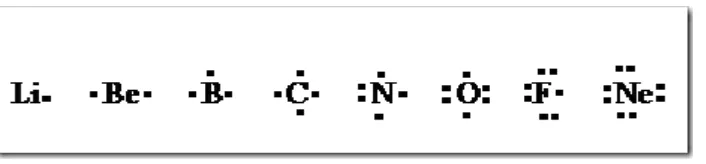RENCANA PELAKSANAAN PEMBELAJARAN
(RPP)
Satuan Pendidikan : SMA PGRI 2 KAJEN
Mata Pelajaran : Kimia
Kelas/semester : X/1
Materi Pokok : Perkembangan Teori Atom
Alokasi Waktu : 2 x 45 menit
Pertemuan : Ke-1
I. Standar Kompetensi
1. Menentukan struktur atom, sifat-sifat periodik unsur, dan ikatan kimia
II. Kompetensi Dasar
1.1 Memahami struktur atom berdasarkan teori atom Bohr, sifat-sifat unsur, massa atom relatif, dan sifat-sifat periodik unsur dalam tabel periodik serta menyadari keteraturannya melalui pemahaman konfigurasi elektron.
III. Indikator:
1.1.1 Menjelaskan perkembangan teori atom
1.1.2 Menggambarkan model teori atom Dalton, Thomson, Rutherford, Bohr dan mekanika kuantum.
IV. Tujuan Pembelajaran
1. Produk
a. Siswa dapat mejelaskan model atom menurut Dalton, Thomson, Rutherford, Bohr dan mekanika kuantum.
b. Siswa dapat menjelaskan menjelaskan kelebihan dan kelemahan teori atom Dalton, Thomson, Rutherford, Bohr dan mekanika kuantum.
2. Proses:
a. Rasa keingintahuan siswa dapat ditumbuhkan
b. Siswa menjadi rajin mencari sumber referensi tentang perkembangan teori atom
V. Materi Ajar Model Atom Dalton
1. Atom merupakan partikel zat atau materi terkecil yang tidak dapat dibagi lagi menjadi bagian yang lebih kecil.
2. Atom berbentuk/digambarkan seperti bola sederhana yang berukuran sangat kecil.
3. Suatu unsur tersusun dari atom-atom yang sama, sedangkan senyawa tersusun dari atom-atom yang berbeda sesuai unsur penyusunnya.
4. Atom-atom bergabung membentuk senyawa dengan perbandingan bilangan bulat dan sederhana.
5. Reaksi kimia merupakan pemisahan, penggabungan, atau penyusunan kembali atom-atom sehingga atom-atom tidak dapat diciptakan atau dimusnahkan.
2. Model Atom Thomson
J.J. Thomson menggambarkan model atomnya setelah dia menemukan sinar katode. Dia menyimpulkan bahwa atom adalah bola padat bermuatan positif dan di dalamnya tersebar elektron yang bermuatan negatif.
3. Model Atom Rutherford
Teori atom Rutherford muncul berdasarkan eksperimen hamburan sinar alfa dari uranium. Kesimpulannya adalah atom terdiri dari inti atom yang sangat kecil dan bermuatan positif, dikelilingi oleh elektron yang bermuatan negatif seperti tata surya.
Kelemahan dari model atom Rutherford adalah teori ini tidak dapat menjelaskan mengapa elektron tidak jatuh ke dalam inti atom.
4. Model Atom Bohr
5. Model Atom Modern
Model atom modern ditemukan oleh Schrodinger. Penjelasan model atom modern adalah elektron-elektron yang mengelilingi inti atom memiliki tingkat energi tertentu tetapi keberadaannya tidak dapat dipastikan. Elektron berada di dalam orbital-orbital yang merupakan fungsi gelombang tertentu dalam kulit atom yang disebut sebagai daerah dengan kebolehjadian paling besar untuk menemukan elektron. Model atom modern disebut juga model atom Schrodinger.
VI. Motode dan pendekatan pembelajaran
Model pembelajaran; kooperatif tipe STAD Metode pembelajaran:
a. Demonstrasi b. Diskusi c. Tanya Jawab
VII. Langkah-langkah Pembelajaran Kegiatan Pendahuluan :
a. Apersepsi Guru bertanya:
Apakah kalian pernah memperhatikan lempengan besi?
Apa penyusun dari lempengan besi? Kenapa berbeda dengan lempengan aluminium? Apa yang kalian ketahui tentang atom?
b. Motivasi
Siswa diminta mencari referensi tentang pegertian atom.
Kegiatan Inti:
a. Eksplorasi
Siswa mencari informasi tentang perkembangan teori atom yang berubah-ubah seiring dengan perkembangan zaman dan kemajuan teknologi.
Siswa menggali lebih lanjut beberapa ilmuan yang mengemukakan teori model atomnya.
Siswa menganalisis teori atom Dalton, Thomson, Rutherford, Bohr dan mekanika kuantum
Siswa membaca dan menganalisis informasi yang diapat.
Siswa merangkum teori atom dari Dalton, Thomson, Rutherford, Bohr dan mekanika kuantum secara urut dan lengkap dengan tahun serta menggambarkan model atomnya dalam bentuktabel.
Siswa percaya diri membacakan hasil rangkumannya. c. Konfirmasi
Guru memberikan umpan balik positif dan penguatan terhadap informasi-informasi yang didapat oleh siswa tentang perkembangan teori atom.
Siswa melakukan refleksi untuk memperoleh pengalaman belajar yang telah dilakukan.
Kegiatan Penutup
Guru beserta siswa menyimpulkan pelajaran
Guru menutup akhir pertemuan dengan mengingatkan siswa untuk mempelajari lagi materi yang baru saja dipelajari dan belajar untuk materi selanjutnya.
VIII. Media dan sumber belajar
Media : Papan tulis Sumber Belajar: a. LKS
b. Buku kimia SMA kelas X IPA semester 1 yang relevan c. Internet
IX. Penilaian
1. Penilaian Kognitif a. Jenis: Tertulis b. Bentuk : soal uraian
c. Instrumen: soal, kunci jawaban dan rubrik penilaian 2. Penilaian Psikomotorik
a. Prosedur : observangsi langsung b. Instrumen: Lembar Pengamatan 3. Penilaian afektif
a. Prosedur : observangsi langsung b. Instrumen: Lembar Pengamatan
X. Alat Evaluasi
Jawablah lengkapilah tabel berikut! No
.
Teori Atom Penjelasan Teori Atom
3. Rutherford 4. Bohr
5. Teori Mekanika Kuantum
RENCANA PELAKSANAAN PEMBELAJARAN
(RPP)
Satuan Pendidikan : SMA PGRI 2 KAJEN
Mata Pelajaran : Kimia
Materi Pokok : Struktur Atom
Alokasi Waktu : 2 x 45 menit
Pertemuan : Ke-2
I. Standar Kompetensi
1. Menentukan struktur atom, sifat-sifat periodik unsur, dan ikatan kimia
II. Kompetensi Dasar
1.1 Memahami struktur atom berdasarkan teori atom Bohr, sifat-sifat unsur, massa atom relatif, dan sifat-sifat periodik unsur dalam tabel periodik serta menyadari keteraturannya melalui pemahaman konfigurasi elektron.
III. Indikator:
1.1.1 Menjelaskan struktur atom berdasarkan teori Bohr
1.1.2 Menentukan notasi atom, jumlah elektron, jumlah proton, dan neutron dari suatu unsur secara teliti.
1.1.3 Menjelaskan isobar,isotop dan isoton.
IV. Tujuan Pembelajaran
1. Produk
a. Siswa dapat mejelaskan struktur atom berdasarkan teori Bohr
b. Siswa dapat menuliskan notasi atom.
c. Siswa dapat menentukan jumlah elektron, proton dan neutron.
d. Siswa dapat menjelaskan isotop, isobar dan isoton. 2. Proses:
a. Siswa dapat lebih teliti berhitung dalam menghitung jumlah elektron,proton dan neutron..
b. Siswa dapat belajar secara mandiri dengan mengamati lambang-lambang unsur dalam tabel sistem periodik unsur.
V. Materi Ajar
Nomor Atom dan Nomor Massa
Suatu atom memiliki sifat dan massa yang khas satu sama lain. Dengan penemuan partikel penyusun atom dikenal istilah nomor atom (Z) dan nomor massa (A)
Penulisan lombang atom unsur menyetarakan nomor atom dan nomor massa. Dimana :
A = nomor massa Z = nomor atom X = lambang unsur
Nomor Massa (A) = Jumlah proton + Jumlah Neutron Atau
Nomor Atom (Z) = Jumlah proton 1. Nomor Atom (Z)
Nomor atom (Z) menujukkan jumlah proton (muatan positif) atau jumlah elektron dalam atom tersebut. Nomor atom ini merupakan ciri khas suatu unsur. Oleh karena atom bersifat netral maka jumlah proton sama dengan jumlah elektronya, sehingga nomor atom juga menujukkan jumlah elektron. Elektron inilah yang nantinya paling menentukan sifat suatu unsur. Nomor atom ditulis agak ke bawah sebelum lambang unsur
2. Nomor Massa (A)
Massa elektron sangat kecil dan dianggap nol sehingga massa atom ditentukan oleh inti atom yaitu proton dan neutron. Nomor massa (A) menyatakan banyaknya proton dan neutron yang menyusun inti atom suatu unsur. Nomor massa ditulis agak ke atas sebelum lambang unsur.
E. Isotop, Isobar, dan Isoton suatu Unsur
1. Isotop
Isotop adalah atom yang mempunyai nomor sama tetapi memiliki nomor massa berbeda Setiap isotop satu unsur memiliki sifat kimia yang sama karena jumlah elektron valensinya sama.
Isotop-isotop unsur ini dapat digunakan untuk menetukan massa atom relatif (Ar) atom
tersebut berdasarkan kelimpahan isotop dan massa atom semua isotop 2. Isobar
Isobar adalah unsur-unsur yang memiliki nomor atom berbeda tetapi nomor massa sama. 3. Isoton
Atom-atom yang berbeda tetapi mempunyai jumlah neutron yang sama
VI. Motode dan pendekatan pembelajaran
Model pembelajaran; kooperatif tipe STAD Metode pembelajaran:
a. Demonstrasi b. Diskusi d. Tanya Jawab
VII. Langkah-langkah Pembelajaran Kegiatan Pendahuluan :
a. Apersepsi Guru bertanya:
Bagaimanakah teori atom menurut Bohr?
b. Motivasi
Siswa diajak mengenal unsur-unsur dan lambangnya yang sering dijumpai dalam kehidupan sehari-hari.
Kegiatan Inti:
a. Eksplorasi
Siswa mencari informasi tentang struktur atom berdasarkan teori Bohr.
Siswa menuliskan beberapa lambang unsur beserta namanya .
Siswa menghafalkan beberapa nama unsur dan lambangnya yang sering dijumpai dalam kehidupan sehari-hari.
Siswa menganalisis tentang rumus menentukan jumlah proton, elektron dan neutron suatu unsur.
Siswa menentukan jumlah proton, elektron dan neutron beberapa unsur.
Guru menegaskan kepada siswa tentang pangertian isotop, isoton dan isobar agar mudah diingat oleh siswa.
Siswa mencari contoh-contoh atom-atom yang berisotop, isoton dan isobar. b. Elaborasi
Guru memberi kesempatan kepada siswa untuk membaca dan menganalisis informasi yang diapat.
Siswa mencatat serta menggarisbawahi rumus penentuan jumlah proton, elektron dan neutron.
Siswa mengerjakan latihan soal untuk menentukan jumlah proton, elektron dan neutron
Guru meminta siswa untuk maju ke depan menuliskan hasil jawaban di depan hadapan teman-teman.
c. Konfirmasi
Guru memberikan umpan balik positif dan penguatan terhadap informasi-informasi yang didapat oleh siswa tentang cara menentukan jumlah proton, elektron dan
Siswa menyimpulkan pelajaran
Guru menutup akhir pertemuan dengan mengingatkan siswa untuk mempelajari lagi materi yang baru saja dipelajari dan belajar untuk materi selanjutnya.
VIII. Media dan sumber belajar
a. LKS
b. Buku kimia SMA kelas X IPA semester 1 yang relevan c. Internet
IX. Penilaian
1. Penilaian Kognitif a. Prosedur: Tertulis
b. Jenis tagihan : tugas dan soal evaluasi
c. Instrumen: lembar tes kognitif dalam bentuk isian singkat dan uraian 2. Penilaian hasil evaluasi.
a. Prosedur : observangsi langsung b. Instrumen: Lembar Pengamatan 3. Penilaian afektif
a. Prosedur : observangsi langsung b. nstrumen: Lembar Pengamatan
X. Alat Evaluasi
1. Sebutkan partikel penyusun atom
2. Tentukan jumlah proton, elektron dan isobar dari unsur berikut!
Na
11
23 dan 1123Na+¿
¿
RENCANA PELAKSANAAN PEMBELAJARAN
(RPP)
Satuan Pendidikan : SMA PGRI 2 KAJEN
Mata Pelajaran : Kimia
Kelas/semester : X/1
Materi Pokok : Konfigurasi Elektron
Alokasi Waktu : 2 x 45 menit
Pertemuan : Ke-3
I. Standar Kompetensi
1. Menentukan struktur atom, sifat-sifat periodik unsur, dan ikatan kimia
II. Kompetensi Dasar
1.1 Memahami struktur atom berdasarkan teori atom Bohr, sifat-sifat unsur, massa atom relatif, dan sifat-sifat periodik unsur dalam tabel periodik serta menyadari keteraturannya melalui pemahaman konfigurasi elektron.
III. Indikator:
1.1.4 Menentukan konfigurasi elektron bardasarkan kulit 1.1.5 Menentukan elektron valensi.
IV. Tujuan Pembelajaran
1. Produk
b. Siswa dapat menentukan jumlah elektron maksimum yang menempati setiap lintasan/kulit elektron.
c. Siswa dapat menentukan konfigurasi elektron atom netral maupun dalam bentuk ion.
d. Siswa dapatmenetukan elektron valensi suatu atom 2. Proses:
c. Siswa dapat lebih teliti menuliskan konfigurasi atom secara urut dan benar. d. Siswa dapat belajar secara mandiri mengkonfigurasikan atom.
V. Materi Ajar
Konfigurasi elektron berdasarkan kulit
Menurut model atom Bohr, elektron – elektron mengelilingi inti pada lintasan – lintasan tertentu yang disebut kulit elektron atau tingkatan energi. Tingkatan energi paling rendah adalah kulit elektron yang terletak paling dalam, semakin ke luar semakin besar nomor kulitnya dan semakin tinggi tingkat energinya. Kulit elektron diberi simbol, untuk kulit pertama ( paling dekat dengan inti) diberi lambang K, kulit kedua diberi lambang L, kulit ketiga M, dan seterusnya. Tiap – tiap kulit elektron hanya dapat ditempati elektron maksimum 2n2, dengan n adalah nomor kulit.
Contoh soal dan pembahasan
Konfigurasikan 3Li , 11Na
Konfigurasikan 20Ca ( 2, 8, 8, 2)
VI. Motode dan pendekatan pembelajaran
Model pembelajaran; kooperatif tipe STAD Metode pembelajaran:
a. Demonstrasi b. Diskusi Kelompok c. Tanya Jawab d. Penugasan
VII. Langkah-langkah Pembelajaran Kegiatan Pendahuluan :
a. Apersepsi Guru bertanya:
Bagaimana model atom yang digambarkan oleh Bohr?
Apa yang dimaksud dengan lintasan-lintasan elektron yang dimaksud dalam model atom Bohr?
b. Motivasi
Siswa diminta untuk mencermati ion-ion yang tertera pada bungkus minuman isotonik.
Kegiatan Inti:
a. Eksplorasi
Siswa mencari informasi tentang struktur atom berdasarkan teori Bohr.
Siswa mengenalkan tentang nama-nama kulit atom.
Siswa menentukan jumlah elektron maksimum yang mengisi setiap kulit atom dengan rumus 2(n)2.
Guru menjelaskan kepada siswa cara untuk mengkonfigurasikan atom secara benar.
Siswa untuk menentukan elaktron valensi suatu atom. b. Elaborasi
Siswa membaca dan menganalisis informasi yang diapat.
Siswa membuat tabel konfigurasi atom dari nomer atom 1 sampai 36 dengan menyebutkan nama kulitnya.
Guru meminta siswa untuk menggambarkan model atom lengkap beserta elektron – elektron yang mengelilinginya dalam orbit/lintasan elektron.
c. Konfirmasi
Guru memberikan umpan balik positif dan penguatan terhadap informasi-informasi yang didapat oleh siswa tentang konfigurasi atom.
Guru memfasilitasi siswa melakukan refleksi untuk memperoleh pengalaman belajar yang telah dilakukan.
Kegiatan Penutup
Guru beserta siswa menyimpulkan pelajaran
Guru menutup akhir pertemuan dengan mengingatkan siswa untuk mempelajari lagi materi yang baru saja dipelajari dan belajar untuk materi selanjutnya.
VIII. Media dan sumber belajar
Media : Papan tulis Sumber Belajar: a. LKS
b. Buku kimia SMA kelas X IPA semester 1 yang relevan c. Internet
XI. Penilaian
1. Penilaian Kognitif a. Prosedur: Tertulis
b. Jenis tagihan : tugas dan soal evaluasi
c. Instrumen: lembar tes kognitif dalam bentuk isian singkat dan uraian Penilaian hasil evaluasi.
2. Penilaian afektif
a. Prosedur : observangsi langsung b. Instrumen: Lembar Pengamatan
X. Alat evaluasi
RENCANA PELAKSANAAN PEMBELAJARAN
(RPP)
Satuan Pendidikan : SMA PGRI 2 KAJEN
Mata Pelajaran : Kimia
Kelas/semester : X/1
Materi Pokok : Perkembangan Sistem Periodik Unsur
Alokasi Waktu : 2 x 45 menit
Pertemuan : Ke-4
I. Standar Kompetensi
1. Menentukan struktur atom, sifat-sifat periodik unsur, dan ikatan kimia
II. Kompetensi Dasar
1.1 Memahami struktur atom berdasarkan teori atom Bohr, sifat-sifat unsur, massa atom relatif, dan sifat-sifat periodik unsur dalam tabel periodik serta menyadari keteraturannya melalui pemahaman konfigurasi elektron.
III. Indikator:
1.1.6 Menjelaskan perkembangan sistem periodik unsur 1.1.7 Menjelaskan golongan dan periode
IV. Tujuan Pembelajaran
1. Produk
a. Siswa dapat memahami perkembangan sistem periodik unsur.
b. Siswa dapat menganalisis dasar penyusunan sistem periodik menurut Johan W. Dobereiner, Newlands, Mendeleleev dan Moseley
c. Siswa dapat menjelakan dasar penyusunan unsur dalam sistem periodik modern.
d. Siswa dapat menunjukkan golongan dan periode. 2. Proses:
a. Siswa dapat menghafal unsur-unsur dalam suatu golongan secara kreatif V. Materi Ajar
(Terlampir dalam diktat bahan ajar) VI. Motode dan pendekatan pembelajaran
Model pembelajaran; kooperatif tipe STAD Metode pembelajaran:
d. Penugasan
VII. Langkah-langkah Pembelajaran Kegiatan Pendahuluan :
a. Apersepsi Guru bertanya:
Bagaimana model atom yang digambarkan oleh Bohr?
Apa yang dimaksud dengan lintasan-lintasan elektron yang dimaksud dalam model atom Bohr?
b. Motivasi
Siswa diminta untuk mencermati ion-ion yang tertera pada bungkus minuman isotonik.
Kegiatan Inti:
a. Eksplorasi
Siswa mencari informasi tentang perkembangan sistem periodik unsur.
Siswa menganalisis setiap perkembangan teori sistem periodik berdasarkan tahun, tokoh dan dasar penyusunan unsur-unsurnya .
b. Elaborasi
Siswa menggambarkan sistem periodik unsur secara kelompok.
Guru meminta siswa merangkum teori perkembangan sistem periodik unsur.
Guru meminta siswa untuk membacakan hasil rangkumannya. c. Konfirmasi
Guru memberikan umpan balik positif dan penguatan terhadap informasi-informasi yang didapat oleh siswa tentang perkembangan sistem periodik unsur.
Guru memfasilitasi siswa melakukan refleksi untuk memperoleh pengalaman belajar yang telah dilakukan.
Kegiatan Penutup
Guru beserta siswa menyimpulkan pelajaran
Guru menutup akhir pertemuan dengan mengingatkan siswa untuk mempelajari lagi materi yang baru saja dipelajari dan belajar untuk materi selanjutnya.
VII. Media dan sumber belajar
Media : Papan tulis Sumber Belajar: a. LKS
b. Buku kimia SMA kelas X IPA semester 1 yang relevan c. Internet
XI. Penilaian
1. Penilaian Kognitif a. Prosedur: Tertulis
b. Jenis tagihan : tugas dan soal evaluasi
c. Instrumen: lembar tes kognitif dalam bentuk isian singkat dan uraian 2. Penilaian afektif
b. Instrumen: Lembar Pengamatan
X. Evaluasi
Lengkapi tabel tentang perkembangan sistem periodik unsur berikut ini No. Tahu
n
Tokoh Dasar penyusunan unsur
1. 2. 3. 4.
RENCANA PELAKSANAAN PEMBELAJARAN
(RPP)
Satuan Pendidikan : SMA PGRI 2 KAJEN
Mata Pelajaran : Kimia
Kelas/semester : X/1
Materi Pokok : Sifat kepriodikan unsur
Alokasi Waktu : 2 x 45 menit
I. Standar Kompetensi
1. Menentukan struktur atom, sifat-sifat periodik unsur, dan ikatan kimia
II. Kompetensi Dasar
1.1 Memahami struktur atom berdasarkan teori atom Bohr, sifat-sifat unsur, massa atom relatif, dan sifat-sifat periodik unsur dalam tabel periodik serta menyadari keteraturannya melalui pemahaman konfigurasi elektron.
III. Indikator:
1.1.8 Menjelaskan sifat-sifat unsur.
1.1.9 Menentukan massa atom relatif suatu atom . 1.1.10 Menjelaskan sifat-sifat keperiodikan unsur.
IV. Tujuan Pembelajaran
1. Produk
a. Siswa dapat menjelaskan sifat unsur-unsur
b. Siswa dapat menentukan massa atom relatif suatu atom.
c. Siswa dapat menganalisis kecenderungan jari-jari atom dalam satu golongan maupun dalam suatu periode.
d. Siswa dapat menganalisis kecenderungan energi ionisasi atom dalam satu golongan maupun dalam suatu periode.
e. Siswa dapat menganalisis kecenderungan kelektronegatifan atom dalam satu golongan maupun dalam suatu periode.
f. Siswa dapat menganalisis kecenderungan afinitas elektron suatu atom dalam satu golongan maupun dalam suatu periode.
2. Proses:
a. Siswa dapat menghafal unsur-unsur dalam suatu golongan secara kreatif V. Materi Ajar
(Terlampir dalam diktat bahan ajar) VI. Motode dan pendekatan pembelajaran
Model pembelajaran; kooperatif tipe STAD Metode pembelajaran:
b. Motivasi
Siswa diminta untuk mencermati sistem periodik unsur modern.
Kegiatan Inti:
a. Eksplorasi
Siswa mencari informasi tentang macam-macam sifat kepriodikan unsur.
Siswa menjelaskan pengertian jari-jari atom dan menggambarkan jari-jari atom.
Siswa menganalisis kecenderungan jari-jari atom dalam satu golongan dan satu periode.
Siswa menjelaskan pengertian sifat keelektronegatifan unsur.
Siswa menganalisis kecenderungan kelektronegatifan unsur dalam satu golongan dan satu periode dalam sisitem periodik unsur.
Siswa menjelakan pengertian energi ionisasi unsur
Siswa menganalisis kecenderungan energi ionisasi dalam satu golongan dan satu periode.
Siswa menjelaskan pengertuan afinitas elektron
Siswa menganalisis kecenderungan afinitas elektron dalam satu golongan dan satu periode.
Siswa menjelaskan pengertian sifat logam unsur
Siswa menganalisis kecenderungan sifat logam dalam satu golongan dan satu periode.
b. Elaborasi
Guru memberi kesempatan kepada siswa untuk membaca dan menganalisis informasi yang diapat.
Guru meminta siswa merangkum kecenderungan sifat-sifat kepriodikan unsur dalam SPU..
Guru meminta siswa untuk membacakan hasil rangkumannya. c. Konfirmasi
Guru memberikan umpan balik positif dan penguatan terhadap informasi-informasi yang didapat oleh siswa tentang sifat keperiodikan unsur.
Siswa melakukan refleksi untuk memperoleh pengalaman belajar yang telah dilakukan.
Kegiatan Penutup
Siswa menyimpulkan pelajaran
Guru menutup akhir pertemuan dengan mengingatkan siswa untuk mempelajari lagi materi yang baru saja dipelajari dan belajar untuk materi selanjutnya.
VIII. Media dan sumber belajar
Media : Papan tulis Sumber Belajar: a. LKS
IX. Penilaian
1. Penilaian Kognitif a. Prosedur: Tertulis
b. Jenis tagihan : tugas dan soal evaluasi
c. Instrumen: lembar tes kognitif dalam bentuk isian singkat dan uraian 2. Penilaian afektif
a. Prosedur : observangsi langsung b. Instrumen: Lembar Pengamatan
X. Evaluasi
1. Sebutkan sifat-sifat kepriodikan unsur
2. bagaimana kecenderungan sifat kepriodikan unsur dalam sistem periodik unsur
RENCANA PELAKSANAAN PEMBELAJARAN
(RPP)
Satuan Pendidikan : SMA PGRI 2 KAJEN
Mata Pelajaran : Kimia
Kelas/semester : X/1
Materi Pokok : Kestabilan Unsur
Alokasi Waktu : 2 x 45 menit
Pertemuan : Ke-6
I. Standar Kompetensi
1. Menentukan struktur atom, sifat-sifat periodik unsur, dan ikatan kimia
II. Kompetensi Dasar
1.2 Membandingkan proses pembentukan ikatan ion, ikatan kovalen, ikatan koordinasi, dan ikatan logam serta hubungannya dengan sifat fisika senyawa yang terbentuk.
III. Indikator:
1.2.1 Menjelaskan kestabilan unsur melalui konfigurasi elektron gas mulia. 1.2.2 Menjelaskan kestrabilan unsur melalui kaidah oktet dan duplet. 1.2.3 Menggambarkan struktur lewis
1.2.4 Menjelaskan pengecualian teori oktet
IV. Tujuan Pembelajaran
1. Produk
a. Siswa dapat menjelaskan kestabilan unsur golongan utama melalui konfigurasi golongan mulia.
c. Siswa dapat menggambarkan model atom yang telah stabil seperti gas mulia dan menuliskan notasinya kembali setelah menangkap atau melepas elektron.
d. Siswa dapat menggambarkan struktur lewis pada unsur-unsur.
2. Proses:
a. Siswa dapat menggambarkan struktur lewis beberapa unsur dengan mandiri V. Materi Ajar
Peranan elektron pada pembentukan ikatan kimia ( kaidah duplet dan oktet)
Lewis mengemukakan bahwa jumlah elektron terluar dari dua atom yang berikatan, akan berubah sedemikian rupa sehingga susunan elektron kedua atom tersebut sama dengan susunan elektron gas mulia. Kecenderungan atom-atom untuk memiliki konfigurasi elektron seperti gas mulia disebut kaidah Oktet dan kaidah duplet. Kaidah oktet dipenuhi apabila atom memiliki 8 elektron pada kulit terluar sedangkan kaidah duplet dipenuhi apabila atom memiliki 2 elektron pada kulit terluar.Untuk atom-atom yang mempunyai nomor atom kecil dari hidrogen sampai dengan boron cenderung memiliki konfigurasi elektron seperti gas helium atau mengikuti kaidahDuplet, selebihnya mengikuti kaidah oktet.
Konfigurasi elektron dari gas mulia seperti yang tertera pada Tabel berikut:
Tabel konfigurasi gas mulia
Unsur-unsur dari golongan alkali dan alkali tanah, untuk mencapai kestabilan seperti gas mulia cenderung melepaskan elektron terluarnya sehingga membentuk ion positif. Unsur-unsur yang mempunyai kecenderungan membentuk ion positif termasuk Unsur-unsur elektropositif. Unsur-unsur dari golongan halogen dan khalkogen mempunyai kecenderungan menangkap elektron untuk mencapai kestabilan, sehingga membentuk ion negatif. Unsur-unsur yang demikian termasuk unsur elektronegatif.
Periode Unsur Nomor atom K L M N O P
1 He 2 2
2 Ne 10 2 8
3 Ar 18 2 8 8
4 Kr 36 2 8 18 8
Lambang Lewis
Lambang Lewis (Lewis symbol) atau lambang titik elektron Lewis (Lewis electron dot symbol) yaitu penggambaran suatu atom unsur yang dikelilingi oleh titik-titik yang menyatakan elektron valensi dari unsur terkait.Pada lambang Lewis elektron-elektron dalam tidak tidak digambarkan. Lambang lewis beberapa golongan utama diberikan pada gambar
Gambar Lambang Lewis beberapa unsur golongan utama
Lambang Lewis untuk gas mulia dikelilingi oleh 8 elektron, setiap elektron berpasangan sehingga lambang lewis pada gas mulia terdapat 4 pasang elektron kecuali helium yang memiliki satu pasang elektron berpasangan. Sedangkan lambang Lewis unsur dari golongan lain menunjukkan adanya elektron tunggal yang belum berpasangan.
VI. Motode dan pendekatan pembelajaran
Model pembelajaran; kooperatif tipe STAD Metode pembelajaran:
a. Demonstrasi b. Diskusi Kelompok c. Tanya Jawab d. Penugasan
VII. Langkah-langkah Pembelajaran Kegiatan Pendahuluan :
a. Apersepsi Guru bertanya:
Bagaimana cara menuliskan konfigurasi suatu unsur ? Bagaimana cara menentukan elektron valensi?
b. Motivasi
Siswa diminta untuk mencermati gambar molekul yang berikatan.
Kegiatan Inti:
a. Eksplorasi
Siswa menyebutkan unsur-unsur dalam golongan VIIIA.
Siswa untuk mengkonfigurasikan unsur-unsur gas mulia.
Siswa menjelakan kaidah oktet dan kaidah duplet
Siswa mencari contoh tentang kaidah oktet dan duplet b. Elaborasi
Guru memberi kesempatan kepada siswa untuk membaca dan menganalisis informasi yang diapat.
Siswa merangkum teori tentang kesetabilan unsur-unsur .
Siswa membacakan hasil rangkumannya. c. Konfirmasi
Guru memberikan umpan balik positif dan penguatan terhadap informasi-informasi yang didapat oleh siswa tentang .kestabilan unsur.
Siswa melakukan refleksi untuk memperoleh pengalaman belajar yang telah dilakukan.
Kegiatan Penutup
Guru beserta siswa menyimpulkan pelajaran.
Guru menutup akhir pertemuan dengan mengingatkan siswa untuk mempelajari lagi materi yang baru saja dipelajari dan belajar untuk materi selanjutnya.
VIII. Media dan sumber belajar
Media : Papan tulis Sumber Belajar: a. LKS
b. Buku kimia SMA kelas X IPA semester 1 yang relevan c. Internet
IX. Penilaian
a. Penilaian Kognitif Prosedur: Tertulis
Jenis tagihan : tugas dan soal evaluasi
Instrumen: lembar tes kognitif dalam bentuk isian singkat dan uraian b. Penilaian hasil evaluasi.
c. Penilaian afektif
Prosedur : observangsi langsung Instrumen: Lembar Pengamatan
X. Evaluasi
1. apa yang dimaksud dengan kaidah oktet dan duplet?
3. Bagaiaman konfigurasi gas mulia?
RENCANA PELAKSANAAN PEMBELAJARAN
(RPP)
Satuan Pendidikan : SMA PGRI 2 KAJEN
Mata Pelajaran : Kimia
Materi Pokok : Ikatan Ion
Alokasi Waktu : 2 x 45 menit
Pertemuan : Ke-7
I. Standar Kompetensi
1. Menentukan struktur atom, sifat-sifat periodik unsur, dan ikatan kimia
II. Kompetensi Dasar
1.2 Membandingkan proses pembentukan ikatan ion, ikatan kovalen, ikatan koordinasi, dan ikatan logam serta hubungannya dengan sifat fisika senyawa yang terbentuk
III. Indikator:
1.2.1 Menjelaskan pengertian ion.
1.2.2 Mengelompokkan unsur yang tergolong nonlogam dan logam. 1.2.3 Menjelakan terjadinya ikatan ion
1.2.4 Memprediksi unsur-unsur yang dapat membentuk senyawa ion
IV. Tujuan Pembelajaran
1. Produk
a. Siswa dapat menjelaskan pengertian ion.
b. Siswa dapat mengelompokkan unsur-unsur non logam dan menentukan elektron valensinya.
c. Siswa dapat menuliskan notasi ion suatu unsur yang telah mengalami pelepasan atau penenrimaan elektron.
d. Siswa dapat menjelaskan terjadinya ikatan ion antar unsur.
e. Siswa dapat memprediksi unsur golongan IA yang berikatan dengan golongan VI A, ataupun VIIA.
f. Siswa dapat memprediksi senyawa ion yang terbentuk akibat adanya ikatan ion antara unsur golongan IIA dengan golongan VI A, ataupun VIIA
2. Proses:
Siswa dapat membuat daftar tabel senyawa ion dengan kerjasama antar teman
V. Materi Ajar
Ikatan Ion
Ikatan ion adalah ikatan yang terbentuk akibat gaya tarik listrik (gaya Coulomb) antara ion yang berbeda. Ikatan ion juga dikenal sebagai ikatan elektrovalen.
Pembentukan Ikatan Ion
dengan reaktivitas tinggi karena mudah melepas elektron dengan energi ionisasi rendah sedangkan klorin merupakan nonlogam dengan afinitas atau daya penagkapan elektron yang tinggi. Apabila terjadi reaksi antara natrium dan klorin maka atom klorin akan menarik satu elektron natrium. Akibatnya natrium menjadi ion positif dan klorin menjadi ion negatif. Adanya ion positif dan negatif memungkinkan terjadinya gaya tarik antara atom sehingga terbentuk natrium klorida. Pembentukan natrium klorida dapat digambarkan menggunakan penulisan Lewis sebagai berikut:
Pembentukan NaCl
Pembentukan NaCl dengan lambang Lewis
Ikatan ion hanya dapat tebentuk apabila unsur-unsur yang bereaksi mempunyai perbedaan daya tarik electron (keeelektronegatifan) cukup besar. Perbedaan keelektronegati-fan yang besar ini memungkinkan terjadinya serah-terima elektron. Senyawa biner logam alkali dengan golongan halogen semuanya bersifat ionik. Senyawa logam alkali tanah juga bersifat ionik, kecuali untuk beberapa senyawa yang terbentuk dari berilium.
Aturan oktet menjelaskan bahwa dalam pembentukan natrium klorida, natrium akan melepas satu elektron sedangkan klorin akan menangkap satu elektron. Sehingga terlihat bahwa satu atom klorin membutuhkan satu atom natrium. Dalam struktur senyawa ion natrium klorida, ion positif natrium (Na+) tidak hanya
berikatan dengan satu ion negatif klorin (Cl-) tetapi satu ion Na+ dikelilingi oleh 6
ion Cl- demikian juga sebaliknya. Struktur tiga dimensi natrium klorida dapat
digunakan untuk menjelaskan susunan senyawa ion.
Struktur kristal kubus NaCl
VI. Motode dan pendekatan pembelajaran
Model pembelajaran; kooperatif tipe STAD Metode pembelajaran:
a. Demonstrasi b. Diskusi Kelompok c. Tanya Jawab d. Penugasan
VII. Langkah-langkah Pembelajaran Kegiatan Pendahuluan :
a. Apersepsi Guru bertanya:
Bagaimana cara menentukan elektron valensi?
Sebutkan unsur-unsur yang bersifat logam dan nonologam? b. Motivasi
Siswa diminta untuk mencermati kelompok unsur logam dan nonlogam.
Kegiatan Inti:
c. Eksplorasi
Siswa mencari unsur logam dan nonlogam.
Siswa mengkonfigurasikan contoh unsur logam golongan A dan unsur nonlogam.
Siswa menjelaskan kation dan anion.
Siswa menggambarkan struktur lewis senyawa yang berikatan ion d. Elaborasi
Guru memberi kesempatan kepada siswa untuk membaca dan menganalisis informasi yang diapat.
Siswa merangkum materi yang sudah dipelajari.
Guru meminta siswa untuk membacakan hasil rangkumannya. e. Konfirmasi
Guru memberikan umpan balik positif dan penguatan terhadap informasi-informasi yang didapat oleh siswa.
Siswa melakukan refleksi untuk memperoleh pengalaman belajar yang telah dilakukan.
Kegiatan Penutup
Guru beserta siswa menyimpulkan pelajaran yang telah dipelajari.
Guru menutup akhir pertemuan dengan mengingatkan siswa untuk mempelajari lagi materi yang baru saja dipelajari dan belajar untuk materi selanjutnya.
VIII. Media dan sumber belajar
Media : Papan tulis Sumber Belajar: d. LKS
e. Buku kimia SMA kelas X IPA semester 1 yang relevan f. Internet
IX. Penilaian
Penilaian Kognitif Prosedur: Tertulis
Jenis tagihan : tugas dan soal evaluasi
Instrumen: lembar tes kognitif dalam bentuk isian singkat dan uraian Penilaian hasil evaluasi.
Penilaian afektif
Prosedur : observangsi langsung Instrumen: Lembar Pengamatan
X. Penilaian
RENCANA PELAKSANAAN PEMBELAJARAN
(RPP)
Satuan Pendidikan : SMA PGRI 2 KAJEN
Mata Pelajaran : Kimia
Kelas/semester : X/1
Materi Pokok : Ikatan Kovalen
Alokasi Waktu : 2 x 45 menit
Pertemuan : Ke-8
I. Standar Kompetensi
1. Menentukan struktur atom, sifat-sifat periodik unsur, dan ikatan kimia
II. Kompetensi Dasar
1.2 Membandingkan proses pembentukan ikatan ion, ikatan kovalen, ikatan koordinasi, dan ikatan logam serta hubungannya dengan sifat fisika senyawa yang terbentuk
1.2.1 Menjelakan pengertian ikatan kovalen 1.2.2 Memberikan contoh ikatan kovalen
1.2.3 Menggambarkan struktur lewis ikatan kovalen.
IV. Tujuan Pembelajaran
1. Produk
a. Siswa dapat menyebutkan unsur nonlogam.
b. Siswa dapat menuliskan konfigurasi unsur nonlogam.
c. Siswa dapat menentukan elektron valensi unsur nonlogam.
d. Siswa dapat menggambarkan ikatan kovalen.
2. Proses:
Siswa dapat mencari contoh senyawa kovalen dengan mandiri V. Materi Ajar
(Terlampir dalam diktat bahan ajar) VI. Motode dan pendekatan pembelajaran
Model pembelajaran; kooperatif tipe STAD Metode pembelajaran:
Sebutkan unsur-unsur yang termasuk nonlogam? Jelaskan bagaimana cara menentukan elektron valensi? b. Motivasi
Siswa diminta untuk mencermati sistem periodik unsur.
Kegiatan Inti:
a. Eksplorasi
Siswa mendata unsur – unsur yang nonlogam.
Siswa mengkonfigurasikan unsur-unsur yang nonlogam.
Siswa menetukan elektron valensi nonlogam
Siswa menjelakan pengertian ikatan kovalen
Siswa menggabungkan unsur-unsur yang membentuk ikatan kovalen.
Siswa menggambarkan ikatan kovalen. b. Elaborasi
Siswa membaca dan menganalisis informasi yang diapat.
Guru meminta siswa untuk membacakan hasil rangkumannya. c. Konfirmasi
Guru memberikan umpan balik positif dan penguatan terhadap informasi-informasi yang didapat oleh siswa.
Siswa melakukan refleksi untuk memperoleh pengalaman belajar yang telah dilakukan.
Kegiatan Penutup
Guru beserta siswa menyimpulkan pelajaran
Guru menutup akhir pertemuan dengan mengingatkan siswa untuk mempelajari lagi materi yang baru saja dipelajari dan belajar untuk materi selanjutnya.
VIII. Media dan sumber belajar
Media : Papan tulis Sumber Belajar: a. LKS
b. Buku kimia SMA kelas X IPA semester 1 yang relevan c. Internet
IX. Penilaian
a. Penilaian Kognitif Prosedur: Tertulis
Jenis tagihan : tugas dan soal evaluasi
Instrumen: lembar tes kognitif dalam bentuk isian singkat dan uraian b. Penilaian afektif
RENCANA PELAKSANAAN PEMBELAJARAN
(RPP)
Satuan Pendidikan : SMA PGRI 2 KAJEN
Mata Pelajaran : Kimia
Kelas/semester : X/1
Materi Pokok : Kepolaran suatu senyawa
Alokasi Waktu : 2 x 45 menit
Pertemuan : Ke-9
I. Standar Kompetensi
1. Menentukan struktur atom, sifat-sifat periodik unsur, dan ikatan kimia
II. Kompetensi Dasar
1.2 Membandingkan proses pembentukan ikatan ion, ikatan kovalen, ikatan koordinasi, dan ikatan logam serta hubungannya dengan sifat fisika senyawa yang terbentuk
III. Indikator:
1.2.1 Menjelaskan pasangan elektron bebas. 1.2.2 Menjelaskan pasangan elektron ikatan. 1.2.3 Menjelaskan pengertian kepolaran senyawa.
IV. Tujuan Pembelajaran
1. Produk
a. Siswa dapat menjelaskan pasangan elektron bebas.
b. Siswa dapat menjelaskan pasangan elektron ikatan
c. Siswa dapat menjelaskan pengertian kepolaran suatu senyawa.
d. Siswa dapat membedakan senyawa kopalen yang polar dan kovalen nonpolar.
e. Siswa dapat memberikan contoh senyawa elektron polar.
Siswa dapat mencari contoh senyawa kovalen polar dengan mandiri V. Materi Ajar
(Terlampir dalam diktat bahan ajar) VI. Motode dan pendekatan pembelajaran
Model pembelajaran; kooperatif tipe STAD Metode pembelajaran:
Bagaimana cara menentukan bahwa itu ikatan kovalen? b. Motivasi
Siswa diminta untuk mencermati contoh-contoh ikatan kovalen.
Kegiatan Inti:
1. Eksplorasi
Siswa mencari informasi tentang ikatan kovalen
Siswa menggambarkan struktur lewis suatu senyawa kovalen .
Siswa menjelaskan kepolaran suatu senyawa.
Siswa menjelaskan tentang PEI
Siswa menentukan PEI dalam struktur lewis senyawa kovalen
Siswa menjelaskan PEB
Siswa menentukan PEB dalam struktur lewis senyawa kovalen
Siswa dapat membedakan senyawa kovalen polar dan nonpolar berdasarkan ada tidaknya suatu PEB.
2. Elaborasi
Guru memberi kesempatan kepada siswa untuk membaca dan menganalisis informasi yang diapat.
Siswa merangkum teori tentang kepolaran suatu senyawa.
Siswa membacakan hasil rangkumannya. 3. Konfirmasi
Guru memberikan umpan balik positif dan penguatan terhadap informasi-informasi yang didapat oleh siswa.
Siswa melakukan refleksi untuk memperoleh pengalaman belajar yang telah dilakukan.
Kegiatan Penutup
Guru menutup akhir pertemuan dengan mengingatkan siswa untuk mempelajari lagi materi yang baru saja dipelajari dan belajar untuk materi selanjutnya.
VIII. Media dan sumber belajar
Media : Papan tulis Sumber Belajar: A. LKS
B. Buku kimia SMA kelas X IPA semester 1 yang relevan C. Internet
IX. Penilaian
a. Penilaian Kognitif Prosedur: Tertulis
Jenis tagihan : tugas dan soal evaluasi
Instrumen: lembar tes kognitif dalam bentuk isian singkat dan uraian b. Penilaian afektif
Prosedur : observangsi langsung Instrumen: Lembar Pengamatan
X. Evaluasi
1. Apakah pengertian senyawa polar? 2. Berikan contoh senyawa kovalen polar!
(RPP)
Satuan Pendidikan : SMA PGRI 2 KAJEN
Mata Pelajaran : Kimia
Kelas/semester : X/1
Materi Pokok : Ikatan logam
Alokasi Waktu : 2 x 45 menit
Pertemuan : Ke-10
I. Standar Kompetensi
1. Menentukan struktur atom, sifat-sifat periodik unsur, dan ikatan kimia
II. Kompetensi Dasar
1.2 Membandingkan proses pembentukan ikatan ion, ikatan kovalen, ikatan koordinasi, dan ikatan logam serta hubungannya dengan sifat fisika senyawa yang terbentuk
III. Indikator:
1.2.1 Menjelaskan pengertian sifat logam .
1.2.2 Menjelaskan unsur-unsur yang bersifat logam. 1.2.3 Menjelaskan ikatan logam
1.2.4 Menjelaskan karakteristik senyawa logam
IV. Tujuan Pembelajaran
1. Produk
a. Siswa dapat menjelaskan pengertian sifat logam
b. Siswa dapat menyebutkan unsur-unsur yang bersifat logam.
c. Siswa dapat menjelaskan ikatan logam.
d. Siswa dapat menyebabkan karakteristik senyawa logam
2. Proses:
Siswa dapat mencari contoh senyawa logam dengan mandiri V. Materi Ajar
(Terlampir dalam diktat bahan ajar) VI. Motode dan pendekatan pembelajaran
a. Apersepsi Guru bertanya:
Jelaskan pengertian ikatan logam? b. Motivasi
Siswa diminta untuk mencermati logam-logam yang ada disekitar mereka.
Kegiatan Inti:
1. Eksplorasi
Siswa menjelaskan pengertian ikatan logam.
Siswa menjelaskan unsur-unsur yang berikatan logam.
Siswa menjelaskan terjadinya ikatan logam.
Siswa dapat menjelaskan karakteristik senyawa logam. 2. Elaborasi
Guru memberi kesempatan kepada siswa untuk membaca dan menganalisis informasi yang diapat.
Siswa merangkum materi yang baru saja dipelajari.
Siswa untuk membacakan hasil rangkumannya. 3. Konfirmasi
Guru memberikan umpan balik positif dan penguatan terhadap informasi-informasi yang didapat oleh siswa.
Siswa melakukan refleksi untuk memperoleh pengalaman belajar yang telah dilakukan.
Kegiatan Penutup
Guru beserta siswa menyimpulkan pelajaran
Guru menutup akhir pertemuan dengan mengingatkan siswa untuk mempelajari lagi materi yang baru saja dipelajari dan belajar untuk materi selanjutnya.
VIII. Media dan sumber belajar
Media : Papan tulis Sumber Belajar:
a. LKS
b. Buku kimia SMA kelas X IPA semester 1 yang relevan c. Internet
IX. Penilaian
a. Penilaian Kognitif Prosedur: Tertulis
Jenis tagihan : tugas dan soal evaluasi
Instrumen: lembar tes kognitif dalam bentuk isian singkat dan uraian Penilaian hasil evaluasi.
b. Penilaian afektif
X. Evalusi
1. Jelaskan pengertian sifat logam
2. Sebutkan senyawa yang berikatan logam
RENCANA PELAKSANAAN PEMBELAJARAN
(RPP)
Satuan Pendidikan : SMA PGRI 2 KAJEN
Mata Pelajaran : Kimia
Kelas/semester : X/1
Materi Pokok : Tata nama senyawa
Alokasi Waktu : 2 x 45 menit
Pertemuan : Ke-11
I. Standar Kompetensi
2. Memahami hukum-hukum dasar kimia dan penerapannya dalam perhitungan kimia.
2.1 Mendeskripsikan tata nama senyawa anorganik dan organik sederhana serta persamaan reaksinya.
III. Indikator:
1.2.1 Menjelaskan tata nama senyawa organik dan anorganik. 1.2.2 Menuliskan nama berdasarkan rumus kimianya
IV. Tujuan Pembelajaran
1. Produk
a. Siswa dapat menjelaskan atutan tata nama senyawa anorganik
b. Siswa dapat memahami tata nama senyawa organik.
2. Proses:
Siswa dapat mencari contoh senyawa organik dan anorganik beserta namanya dengan
mandiri
V. Materi Ajar
(Terlampir dalam diktat bahan ajar) VI. Motode dan pendekatan pembelajaran
Model pembelajaran; kooperatif tipe STAD Metode pembelajaran:
Apa nama dari senyawa yang memiliki rumus kimia CO2?
2. Motivasi
Siswa diminta untuk mencermati nama-nama senyawa di sekitar mereka.
Kegiatan Inti:
1. Eksplorasi
Siswa menyebutkan nama-nama unsur yang tertera pada sistem periduk unsur.
Siswa medata unsur-unsur yang bersifat logam dan bersifat nonlogam.
Siswa dapat menjelaskan aturan tata nama senyawa biner logam dengan nonlogam
Siswa dapat menjelaskan tata nama senyawa biner nonlogam dengan nonlogam.
Siswa dapat menjalaskan tata nama senyawa biner poliatomik.
Siswa dapat menjelaskan tata nama senyawa asam dan basa 2. Elaborasi
Siswa merangkum materi yang baru saja dipelajari.
Siswa untuk membacakan hasil rangkumannya. 3. Konfirmasi
Guru memberikan umpan balik positif dan penguatan terhadap informasi-informasi yang didapat oleh siswa.
Siswa melakukan refleksi untuk memperoleh pengalaman belajar yang telah dilakukan.
Kegiatan Penutup
Guru beserta siswa menyimpulkan pelajaran
Guru menutup akhir pertemuan dengan mengingatkan siswa untuk mempelajari lagi materi yang baru saja dipelajari dan belajar untuk materi selanjutnya.
VIII. Media dan sumber belajar
Media : Papan tulis Sumber Belajar:
a. LKS
b. Buku kimia SMA kelas X IPA semester 1 yang relevan c. Internet
IX. Penilaian
a. Penilaian Kognitif Prosedur: Tertulis
Jenis tagihan : tugas dan soal evaluasi
Instrumen: lembar tes kognitif dalam bentuk isian singkat dan uraian Penilaian hasil evaluasi.
b. Penilaian afektif
Prosedur : observangsi langsung Instrumen: Lembar Pengamatan
X. Evalusi
1. Apakah nama dari unsur a. NO
b. NO2
c. NaCl
2. Gambarkan rumus kimia dari: a. Asam klorida
RENCANA PELAKSANAAN PEMBELAJARAN
(RPP)
Satuan Pendidikan : SMA PGRI 2 KAJEN
Mata Pelajaran : Kimia
Kelas/semester : X/1
Materi Pokok : Penyetaraan Reaksi
Alokasi Waktu : 2 x 45 menit
Pertemuan : Ke-12
I. Standar Kompetensi
2. Memahami hukum-hukum dasar kimia dan penerapannya dalam perhitungan kimia.
II. Kompetensi Dasar
2.1 Mendeskripsikan tata nama senyawa anorganik dan organik sederhana serta persamaan reaksinya.
III. Indikator:
1.2.1 Memahami penyetaran reaksi kimia sederhana
IV. Tujuan Pembelajaran
1. Produk
a. Siswa dapat memahami pengertian persamaan reaksi
b. Siswa dapat menyetarakan reaksi dengan cara trial and error
c. Siswa dapat menyetarakan reaksi dengan cara matematika
2. Proses:
(Terlampir dalam diktat bahan ajar) VI. Motode dan pendekatan pembelajaran
Model pembelajaran; kooperatif tipe STAD Metode pembelajaran:
Apa yang kalian tahu tentang persamaan reaksi? 2. Motivasi
Siswa diminta untuk mencermati suatu reaksi.
Kegiatan Inti:
1. Eksplorasi
Siswa dapat menjelaskan pengertian persamaan reaksi.
Siswa mencermati jumlah atom sebelum reaksi dengan atom yang berada di sebelah kanan (sesudah reaksi).
Siswa dapat menyetarakan reaksi dengan cara trial and error.
Siswa menambahkan koefesien pada senyawa atau unsur yang bereaksi ataupun yang sudah berekasi.
2. Elaborasi
Guru memberi kesempatan kepada siswa untuk membaca dan menganalisis informasi yang diapat.
Siswa merangkum materi yang baru saja dipelajari.
Siswa untuk membacakan hasil rangkumannya. 3. Konfirmasi
Guru memberikan umpan balik positif dan penguatan terhadap informasi-informasi yang didapat oleh siswa.
Siswa melakukan refleksi untuk memperoleh pengalaman belajar yang telah dilakukan.
Kegiatan Penutup
Guru beserta siswa menyimpulkan pelajaran
Guru menutup akhir pertemuan dengan mengingatkan siswa untuk mempelajari lagi materi yang baru saja dipelajari dan belajar untuk materi selanjutnya.
VIII. Media dan sumber belajar
Sumber Belajar: a. LKS
b. Buku kimia SMA kelas X IPA semester 1 yang relevan c. Internet
IX. Penilaian
a. Penilaian Kognitif Prosedur: Tertulis
Jenis tagihan : tugas dan soal evaluasi
Instrumen: lembar tes kognitif dalam bentuk isian singkat dan uraian Penilaian hasil evaluasi.
b. Penilaian afektif
Prosedur : observangsi langsung Instrumen: Lembar Pengamatan
X. Evalusi
RENCANA PELAKSANAAN PEMBELAJARAN
(RPP)
Satuan Pendidikan : SMA PGRI 2 KAJEN
Mata Pelajaran : Kimia
Kelas/semester : X/1
Materi Pokok : Hukum Lavoisier dan Hukum Proust
Alokasi Waktu : 2 x 45 menit
Pertemuan : Ke-13
I. Standar Kompetensi
2. Memahami hukum-hukum dasar kimia dan penerapannya dalam perhitungan kimia.
II. Kompetensi Dasar
2.2 Membuktikan dan mengkomunikasikan berlakunya hukum-hukum dasar kimia melalui percobaan serta menerapkan konsep mol dalam menyelesaikan perhitungan kimia.
III. Indikator:
1.2.1 Menjelaskan dan membuktikan hukum kekekalan massa (hukum Lavoisier) melui percobaan.
1.2.2 Menjelaskan dan membuktikan hukum perbandingan tetap (hukum Proust) melaui percobaan.
IV. Tujuan Pembelajaran
1. Produk
a. Siswa dapat menjelaskan pengertian hukum kekekalan massa
b. Siswa dapat mendefinisikan pereaktan dan produk
c. Siswa dapat menghitung massa zat sebelum bereaksi dan massa zat sesudah berekasi.
d. Siswa dapat menjelaskan pengertian hukum perbandingan tetap.
2. Proses:
Siswa dapat mencari contoh hukum kekekalan massa dan perbandingan tetap dengan
mandiri
V. Materi Ajar
(Terlampir dalam diktat bahan ajar) VI. Motode dan pendekatan pembelajaran
a. Demonstrasi
Bagaimanakah cara menyetarakan reaksi? b. . Motivasi
Guru menampilkan gambar-gambar ilustrasi tentang hukum kekekalan dan hukum proust.
Kegiatan Inti:
1. Eksplorasi
Siswa mencari tahu tentang pengertian hukum kekekalan massa.
Siswa mencari tahu tentang definisi perekatan dan produk.
Siswa dapat membuktikan hukum kekekalan massa
Siswa dapat menghitung massa zat sesudah reaksi dan sebelum reaksi
Siswa dapat membuktikan hukum perbandingan tetap. 2. Elaborasi
Guru memberi kesempatan kepada siswa untuk membaca dan menganalisis informasi yang diapat.
Siswa merangkum materi yang baru saja dipelajari.
Siswa untuk membacakan hasil rangkumannya. 3. Konfirmasi
Guru memberikan umpan balik positif dan penguatan terhadap informasi-informasi yang didapat oleh siswa.
Siswa melakukan refleksi untuk memperoleh pengalaman belajar yang telah dilakukan.
Kegiatan Penutup
Guru beserta siswa menyimpulkan pelajaran
Guru menutup akhir pertemuan dengan mengingatkan siswa untuk mempelajari lagi materi yang baru saja dipelajari dan belajar untuk materi selanjutnya.
VIII. Media dan sumber belajar
Media : Papan tulis Sumber Belajar:
a. LKS
b. Buku kimia SMA kelas X IPA semester 1 yang relevan c. Internet
IX. Penilaian
Prosedur: Tertulis
Jenis tagihan : tugas dan soal evaluasi
Instrumen: lembar tes kognitif dalam bentuk isian singkat dan uraian Penilaian hasil evaluasi.
b. Penilaian afektif
Prosedur : observangsi langsung Instrumen: Lembar Pengamatan
RENCANA PELAKSANAAN PEMBELAJARAN
(RPP)
Satuan Pendidikan : SMA PGRI 2 KAJEN
Mata Pelajaran : Kimia
Kelas/semester : X/1
Alokasi Waktu : 2 x 45 menit
Pertemuan : Ke-14
I. Standar Kompetensi
2. Memahami hukum-hukum dasar kimia dan penerapannya dalam perhitungan kimia.
II. Kompetensi Dasar
2.2 Membuktikan dan mengkomunikasikan berlakunya hukum-hukum dasar kimia melalui percobaan serta menerapkan konsep mol dalam menyelesaikan perhitungan kimia.
III. Indikator:
1.2.1 Menjelaskan dan membuktikan hukum kelipatan perbandingan. 1.2.2 Menjelaskan hukum perbandingan volume (Hukum Gay Lussac).
IV. Tujuan Pembelajaran
1. Produk
a. Siswa dapat menjelaskan hukum kelipatan perbandingan
b. siswa dapat menjelaskan hukum perbandingan volume (Hukum Gay Lussac)
2. Proses:
Siswa dapat mencari contoh penerapan hukum perbandingan volume dengan
mandiri
V. Materi Ajar
(Terlampir dalam diktat bahan ajar) VI. Motode dan pendekatan pembelajaran
Model pembelajaran; kooperatif tipe STAD Metode pembelajaran:
Bagaimanakah bunyi hukum perbandingan tetap? b. . Motivasi
Guru menampilkan gambar-gambar ilustrasi tentang hukum perbandingan tetap.
Kegiatan Inti:
1. Eksplorasi
Siswa mencari tahu tentang pengertian hukum kelipatan perbandingan.
Siswa dapat membuktikan hukum kelipatan perbandingan melalui percobaan.
Siswa mengerjakan soal-soal yang berhubungan dengan hukum kelipatan perbandingan dan hukum perbandingan volume melalui kerja kelompok.
2. Elaborasi
Guru memberi kesempatan kepada siswa untuk membaca dan menganalisis informasi yang diapat.
Siswa merangkum materi yang baru saja dipelajari.
Siswa untuk membacakan hasil rangkumannya. 3. Konfirmasi
Guru memberikan umpan balik positif dan penguatan terhadap informasi-informasi yang didapat oleh siswa.
Siswa melakukan refleksi untuk memperoleh pengalaman belajar yang telah dilakukan.
Kegiatan Penutup
Guru beserta siswa menyimpulkan pelajaran
Guru menutup akhir pertemuan dengan mengingatkan siswa untuk mempelajari lagi materi yang baru saja dipelajari dan belajar untuk materi selanjutnya.
VIII. Media dan sumber belajar
Media : Papan tulis Sumber Belajar:
1. LKS
2. Buku kimia SMA kelas X IPA semester 1 yang relevan 3. Internet
IX. Penilaian
c. Penilaian Kognitif Prosedur: Tertulis
Jenis tagihan : tugas dan soal evaluasi
Instrumen: lembar tes kognitif dalam bentuk isian singkat dan uraian Penilaian hasil evaluasi.
d. Penilaian afektif
RENCANA PELAKSANAAN PEMBELAJARAN
(RPP)
Satuan Pendidikan : SMA PGRI 2 KAJEN
Mata Pelajaran : Kimia
Kelas/semester : X/1
Materi Pokok : Perhitungan Kimia (Bagian 1)
Alokasi Waktu : 2 x 45 menit
Pertemuan : Ke-15
I. Standar Kompetensi
2. Memahami hukum-hukum dasar kimia dan penerapannya dalam perhitungan kimia.
II. Kompetensi Dasar
2.2 Membuktikan dan mengkomunikasikan berlakunya hukum-hukum dasar kimia melalui percobaan serta menerapkan konsep mol dalam menyelesaikan perhitungan kimia.
1.2.1 Mengkonversikan jumlah mol dengan jumlah partikel, massa, dan volum zat. 1.2.2 Menentukan rumus empiris dan rumus molekul
1.2.3 Menentukan rumus air kristal
IV. Tujuan Pembelajaran
1. Produk
a. Siswa dapat menghitung jumlah mol b. Siswa dapat menghitung jumlah partikel c. Siswa dapat menghitung volum zat d. Siswa dapat menentukan rumus empiris e. Siswa dapat menentukan rumus molekul f. Siswa dapat menentukan rumus air kristal.
2. Proses:
Siswa dapat mencari contoh perhitungan kimia dalam kehidupan sehari-hari dengan
mandiri
V. Materi Ajar
(Terlampir dalam diktat bahan ajar) VI. Motode dan pendekatan pembelajaran
Model pembelajaran; kooperatif tipe STAD Metode pembelajaran:
Bagaimanakah bunyi hukum perbandingan tetap? b. Motivasi
Guru menampilkan gambar-gambar ilustrasi tentang perhitungan kimia.
Kegiatan Inti:
1. Eksplorasi
Siswa mencari tahu tentang pengertian perhitungan mol.
Siswa mencari tahu tentang cara menghitung jumlah partikel. .
Siswa mencari tahu tentang cara menghitung volume zat.
Siswa mengkolerasikan rumus perhitungan mol, jumlah partikel dan volume zat. 2. Elaborasi
Guru memberi kesempatan kepada siswa untuk membaca dan menganalisis informasi yang diapat.
Siswa merangkum materi yang baru saja dipelajari.
3. Konfirmasi
Guru memberikan umpan balik positif dan penguatan terhadap informasi-informasi yang didapat oleh siswa.
Siswa melakukan refleksi untuk memperoleh pengalaman belajar yang telah dilakukan.
Kegiatan Penutup
Guru beserta siswa menyimpulkan pelajaran
Guru menutup akhir pertemuan dengan mengingatkan siswa untuk mempelajari lagi materi yang baru saja dipelajari dan belajar untuk materi selanjutnya.
VIII. Media dan sumber belajar
Media : Papan tulis Sumber Belajar: 4. LKS
5. Buku kimia SMA kelas X IPA semester 1 yang relevan 6. Internet
IX. Penilaian
c. Penilaian Kognitif Prosedur: Tertulis
Jenis tagihan : tugas dan soal evaluasi
Instrumen: lembar tes kognitif dalam bentuk isian singkat dan uraian Penilaian hasil evaluasi.
d. Penilaian afektif
RENCANA PELAKSANAAN PEMBELAJARAN
(RPP)
Satuan Pendidikan : SMA PGRI 2 KAJEN
Mata Pelajaran : Kimia
Kelas/semester : X/1
Materi Pokok : Perhitungan kimia (bagian 2)
Alokasi Waktu : 2 x 45 menit
Pertemuan : Ke-16
I. Standar Kompetensi
2. Memahami hukum-hukum dasar kimia dan penerapannya dalam perhitungan kimia.
II. Kompetensi Dasar
2.2 Membuktikan dan mengkomunikasikan berlakunya hukum-hukum dasar kimia melalui percobaan serta menerapkan konsep mol dalam menyelesaikan perhitungan kimia.
III. Indikator:
2.2.1 Menentukan kadar zat dalam suatu senyawa. 2.2.2 Menentukan pereaksi pembatas dalam suatu reaksi 2.2.3 Menentukan banyak zat pereaksi atau hasil reaksi
IV. Tujuan Pembelajaran
1. Produk
a. Siswa dapat menghitung kadar zat dalam suatu senyawa b. siswa dapat menjelaskan pereaksi pembatas suatu reaksi
c. siswa dapat menghitung banyaknya zat pereaksi atau hasil reaksi.
2. Proses:
V. Materi Ajar
(Terlampir dalam diktat bahan ajar) VI. Motode dan pendekatan pembelajaran
Model pembelajaran; kooperatif tipe STAD Metode pembelajaran:
Bagaimanakah cara menyetarakan reaksi ? Bagaimanakah cara menghitung jumlah mol? b. . Motivasi
Guru menampilkan gambar-gambar ilustrasi tentang pereaksi pembatas.
Kegiatan Inti:
1. Eksplorasi
Siswa mencari tahu tentang menentukan kadar suatu zat.
Siswa mencari tahu tentang pereaksi pembatas dan hasil reaksi. .
Siswa dapat menjelaskan pereaksi pembatas.
Siswa dapat menghitung jumlah pereaksi pembatas
Siswa dapat menghitung massa zat hasil reaksi. 2. Elaborasi
Guru memberi kesempatan kepada siswa untuk membaca dan menganalisis informasi yang diapat.
Siswa merangkum materi yang baru saja dipelajari.
Siswa untuk membacakan hasil rangkumannya. 3. Konfirmasi
Guru memberikan umpan balik positif dan penguatan terhadap informasi-informasi yang didapat oleh siswa.
Siswa melakukan refleksi untuk memperoleh pengalaman belajar yang telah dilakukan.
Kegiatan Penutup
Guru beserta siswa menyimpulkan pelajaran
Guru menutup akhir pertemuan dengan mengingatkan siswa untuk mempelajari lagi materi yang baru saja dipelajari dan belajar untuk materi selanjutnya.
VIII. Media dan sumber belajar
a. LKS
b. Buku kimia SMA kelas X IPA semester 1 yang relevan c. Internet
IX. Penilaian
a. Penilaian Kognitif Prosedur: Tertulis
Jenis tagihan : tugas dan soal evaluasi
Instrumen: lembar tes kognitif dalam bentuk isian singkat dan uraian Penilaian hasil evaluasi.
b. Penilaian afektif
Prosedur : observangsi langsung Instrumen: Lembar Pengamatan
Kepala Sekolah
Achmad Jaenudin, S.Pd NIY 201877
Kajen, 29 Agustus 2015 Guru Mapel