KARAKTERISTIK MORFOLOGI DAN MOLEKULER LALAT BUAH Bactroceras pp. (DIPTERA: TEPHRITIDAE) PADA PERTANAMAN
JAMBU BIJI MERAH KABUPATEN DELI SERDANG
T E S I S
Oleh :
PUTRI MUSTIKA SARI 157001001/ MAET
PROGRAM STUDI MAGISTER AGROTEKNOLOGI FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA MEDAN
2018
KARAKTERISTIK MORFOLOGI DAN MOLEKULER LALAT BUAH Bactrocera spp. (DIPTERA: TEPHRITIDAE) PADA PERTANAMAN
JAMBU BIJI MERAH KABUPATEN DELI SERDANG
T E S I S
Diajukan Sebagai Salah Satu Syarat Untuk Mendapatkan Gelar Magister Dalam Program Magister Agroteknologi Pada Fakultas Pertanian
Universitas Sumatera Utara
Oleh :
PUTRI MUSTIKA SARI 157001001/ MAET
PROGRAM STUDI MAGISTER AGROTEKNOLOGI FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA MEDAN
2018
Judul Tesis : KarakteristikMorfologi Dan Molekuler Lalat Buah Bactrocera spp. (Diptera: Tephritidae) Pada Pertanaman Jambu Biji Merah Kabupaten Deli Serdang
Nama Mahasiswa : Putri Mustika Sari Nomor Induk Mahasiswa : 157001001
Program Studi : Magister Agroteknologi
Menyetujui Komisi Pembimbing
(Prof.Dr.Ir.Darma Bakti, M.S) (Prof.Dr.Dra. M. Cyccu Tobing, M.S)
Ketua Anggota
Ketua Program Studi, Dekan,
(Prof. Ir.Edison Purba, Ph.D) (Dr. Ir. Hasanuddin, M.S)
Tanggal lulus : 18 Januari 2018
Telah diuji pada
Tanggal : 18 Januari 2018
PANITIA PENGUJI TESIS
Ketua : Prof. Dr. Ir. Darma Bakti, M.S
Anggota : 1. Prof. Dr. Dra. M. Cyccu Tobing, M.S 2. Dr. Ir. Hasanuddin, M.S
3. Dr. Ir. Marheni, M.P
4. Prof. Ir. Edison Purba, Ph.D
PERNYATAAN
Judul Tesis
“KARAKTERISTIK MORFOLOGI DAN MOLEKULER LALAT BUAH Bactrocera spp. (DIPTERA:TEPHRITIDAE) PADA PERTANAMAN
JAMBU BIJI MERAH DI KABUPATEN DELI SERDANG”
Dengan ini penulis menyatakan bahwa tesis ini disusun sebagai syarat untuk memperoleh gelar Magister Agroteknologi pada Program Studi Magister Agroteknologi Fakultas Pertanian Universitas Sumatera Utara adalah benar merupakan hasil karya sendiri.
Adapun pengutipan-pengutipan yang penulis lakukan pada bagian-bagian tertentu dari hasil karya orang lain dalam penulisan Tesis ini, telah penulis cantumkan sumbernya secara jelas sesuai dengan norma, kaidah, dan etika penulis ilmiah.
Apabila dikemudian hari ternyata seluruh atau sebagian Tesis ini bukan hasil karya penulis sendiri atau adanya plagiat dalam bagian-bagian tertentu, penulis bersedia menerima sanksi pencabutan gelar akademik yang penulis sandang dan sanksi-sanksi lainnya sesuai dengan peraturan perundangan yang berlaku.
Medan, Januari 2018 Penulis
Putri Mustika Sari
ABSTRACT
Putri Mustika Sari, Morphologi and Molecular Characteristic of Bactrocera spp.
Fruit Flies (Diptera: Tephritidae) in Psidium guava Crop Deli Serdang. Guided by Prof. Dr. Ir. Darma Bakti, MS., and Prof. Dr. Dra. M. Cyccu Tobing, MS.
Eight species of fruit flies (Bactrocera spp.) was known by morphological identification at LIPI, only one species unknown by morphological identification.
This fruit fly is obtained from the trap installation with methyl eugenol, cocoa waste processing, and mixture of both, and the collection of fruits that are attacked in five locations of Psidium guava crop Deli Serdang. Dendrogram Neighbor Joining analysis results based on the RAPD marker of the DNA band characters, showing the nine species are divided into three groups. The first group consists of B. caudata (Kolam dan Namoriam) dan B. umbrosa (Kolam, Namoriam dan Sei Mencirim); the second group consisted of B. curcubitae (Sei Beras Sekata), B.
caudata (Sei Mencirim dan Sei Beras Sekata), B. umbrosa (Sei Beras Sekata), B.
carambolae (Sei Mencirim dan Sei Beras Sekata), dan B. papayae (Kolam, Namoriam, Sei Mencirim dan Sei Beras Sekata);and the third group consisted of B. kinabalu (Kolam), B. carambolae (Sawit Rejo, Kolam dan Namoriam), B. tau (Kolam), B. sp (Sawit Rejo), B. papayae (Sawit Rejo), B. curcubitae (Sawit Rejo, Kolam, Namoriam dan Sei Mencirim), B. caudata (Sawit Rejo), B.umbrosa (Sawit Rejo) dan B. albistrigata (Kolam).The DNA sequencing results (500 bp) showed from the species Bactrocera sp. has a homology rate of 89% with B.
carambolae, B. papayae, B. dorsalis, B. invadens from the Genbank collection.
The phylogenetic tree shows that Bactrocera sp. has an ancestor who came from China.
Keywords: Bactrocera spp., morphology, RAPD, sequencing
ABSTRAK
Putri Mustika Sari, Karakteristik Morfologi dan Molekuler Lalat Buah Bactrocera spp. (Diptera: Tephritidae) Pada Pertanaman Jambu Biji Merah Kabupaten Deli Serdang. Dibimbing oleh Prof. Dr. Ir. Darma Bakti, MS., dan Prof. Dr. Dra. M.
Cyccu Tobing, MS.
Delapan spesies lalat buah telah diketahui dari identifikasi morfologi lalat buah di LIPI, hanya satu spesies yang belum diketahui dari identifikasi morfologi.
Lalat buah ini didapatkan dari pemasangan perangkap dengan metil eugenol, olahan limbah kakao, dan campuran keduanya, serta pengumpulanbuah yang terserang di 5 lokasi pertanaman jambu biji merah Kabupaten Deli Serdang.
Dendrogramhasilanalisis Neighbor Joining berdasarkan marka RAPD dari karakter pita DNA menunjukkan hubungan kedekatan genetik kesembilan spesiesituterbagikedalam 3 kelompok. Kelompok 1 adalah B. caudata (Kolam dan Namoriam) dan B. umbrosa (Kolam, Namoriam dan Sei Mencirim); Kelompok 2 adalah B. curcubitae(Sei Beras Sekata), B. caudata (Sei Mencirim dan Sei Beras Sekata), B. umbrosa (Sei Beras Sekata), B. carambolae (Sei Mencirim dan Sei Beras Sekata), dan B. papayae (Kolam, Namoriam, Sei Mencirim dan Sei Beras Sekata); dan Kelompok 3 adalah B. kinabalu (Kolam), B. carambolae (Sawit Rejo, Kolam dan Namoriam), B. tau (Kolam), B. sp (Sawit Rejo), B. papayae (Sawit Rejo), B. curcubitae (Sawit Rejo, Kolam, Namoriam dan Sei Mencirim), B. caudata (Sawit Rejo), B.umbrosa (Sawit Rejo) dan B. albistrigata (Kolam).
Hasilsekuensing DNA (500 bp) menunjukkan dari spesies Bactrocera sp.
memiliki tingkat homologi sebesar 89% dengan B. carambolae, B. papayae, B.
dorsalis, B. invadens dari koleksi Genbank. Pohon filogenetik menunjukkan bahwa Bactrocera sp. dan B. Kinabalu memiliki hubungan genetik yang dekat dengan Bactrocera yang berasal dari China dan Thailand.
Kata Kunci : Bactrocera spp., morfologi, RAPD, sekuensing
RIWAYAT PENULIS
Penulis lahir pada tanggal 03 Februari 1990 di Medan, sebagaianak ke tiga dari tiga bersaudara, puteri dari Ayahanda Eka Indra Prayogi dan Ibunda Zuraini.
Pendidikan formal yang pernah ditempuh penulis yaitu :
- Tahun 2002 lulus dari Sekolah Dasar (SD) Negeri 068007 Medan.
- Tahun 2005 lulus dari Sekolah Lanjutan Tingkat Pertama (SLTP) Negeri 10 Medan.
- Tahun 2008 lulus dari Sekolah Menengah Atas (SMA) Negeri 17 Medan.
- Tahun 2013 lulus Sarjana Pertanian dari Departemen Hama dan Penyakit Tumbuhan Fakultas Pertanian Universitas Sumatera Utara melalui jalur SNMPTN.
- Tahun 2015 mengikuti Pendidikan Magister (S2) pada Sekolah Pascasarjana Universitas Sumatera Utara, Medan dengan biaya mandiri.
Tahun 2013 - 2014 pernah bekerja sebagai pegawai di Market Palangkaraya Fruit, Tahun 2014 - 2015 pernah bekerja sebagai pengajar di Bimbingan Belajar LP Surya JF dan pernah bekerja sebagai pengajar di Bimbingan Belajar Bima.
UCAPAN TERIMA KASIH
Penulis mengucapkan puji dan syukur kehadirat Allah SWT yang telah memberikan berkah-Nya kepada penulis sehingga dapat menyelesaikan penulisan tesis ini tepat waktu.
Pada kesempatan ini penulis menyampaikan ucapan terimakasih kepada Orangtua yang telah mendukung penulis dalam menyelesaikan tesis ini. Terima kasih kepada Komisi Pembimbing Prof. Dr. Ir. Darma Bakti, MS., selaku Ketua, dan Prof. Dr. Dra. M. Cyccu Tobing, MS., selaku Anggota, yang telah membimbing dan mengarahkan penulis dalam menyelesaikan penulisan tesis ini.
Terima kasih juga penulis tujukan kepada Oscar Effendy, M.Si. selaku Ahli di Laboratorium Entomologi LIPI serta Laboratorium Biologi dan Genetika Molekuler FMIPA USU yang telah membantu dalam penelitian.
Penulis menyadari tesisini masih jauh dari sempurna, oleh sebab itu penulis mengharapkan kritik dan saran yang bersifat membangun demi kesempurnaan tesis ini. Akhir kata penulis mengucapkan terima kasih.
Medan, Januari 2018
Penulis
DAFTAR ISI
ABSTRACT ...i
ABSTRAK ...ii
RIWAYAT PENULIS ... iii
KATA PENGANTAR ...iv
DAFTAR ISI ...v
DAFTAR TABEL ... vii
DAFTAR GAMBAR ...viii
DAFTAR LAMPIRAN ... ix
PENDAHULUAN LatarBelakang ... 1
Perumusan Masalah ... 4
TujuanPenelitian ... 4
HipotesisPenelitian ...5
KegunaanPenelitian ...5
TINJAUAN PUSTAKA MorfologiLalatBuah ...6
BiologiLalatBuah ...7
EkologiLalatBuah ...7
GejalaSeranganLalatBuah ...9
Parasitoid LalatBuah ...9
Karakteristik Molekuler (PCR-RAPD) ...10
SenyawaAtraktan ... 14
METODE PENELITIAN WaktudanTempatPenelitian ... 16
BahandanAlat ... 16
MetodePenelitian ... 17
PelaksanaanPenelitian ... 19
Penetuan Lokasi ... 19
PersiapanAtraktanOlahanLimbahKakao ... 19
Uji Kadar Protein danGlukosa OLK ...20
PengumpulanSampel Lalat buah Di Lapangan ... 21
PengambilanBuah Terserang ... 22
IdentifikasiMorfologi ... 22
Karakteristik Molekuler Imago Lalat Buah ... 23
SekuensingBactrocerakinabaludanB.sp ... 25
PeubahAmatan ... 25
HASIL DAN PEMBAHASAN Jumlah Populasi Lalat Buah Terperangkap ... 27
Lalat Buah Diidentifikasi Secara Morfologi ...30
Tingkat Parasitasi Parasitoid ... 33
Uji Kualitas DNA Hasil Ekstraksi Lalat Buah ... 34
Uji Kuantitas dan Konsentrasi DNA Lalat Buah ... 35
Profil Pita DNA Lalat Buah ... 37
Hasil Blast SekuenB. kinabalu dan B. Sp ... 46
KESIMPULAN DAN SARAN Kesimpulan ... 49
Saran ... 49 DAFTAR PUSTAKA
LAMPIRAN
DAFTAR TABEL
Halaman
1. LokasiPengambilanSampelLalatBuah ... 18
2. Populasi Jantan dan Betina yang Terperangkap ... 28
3. JenisLalatBuah yang Terperangkap ... 31
4. Tingkat Parasitasi Parasitoid ... 34
5. HasilUjiKuantitasdanKonsentrasi DNA lalatbuah ... 44
6. HasilAnalisis Blast Sekuens DNA Gen SitokromOksidase I ... 47
DAFTAR GAMBAR
Halaman
1. MorfologiLalatBuah ... 5
2. BentukPerangkapUntukPengambilanSampel ... 20
3. GrafikPopulasiLalatBuah yang Terperangkap ... 26
4. HasilUjiElektroforesis 29 Sampel DNA LalatBuah ... 33
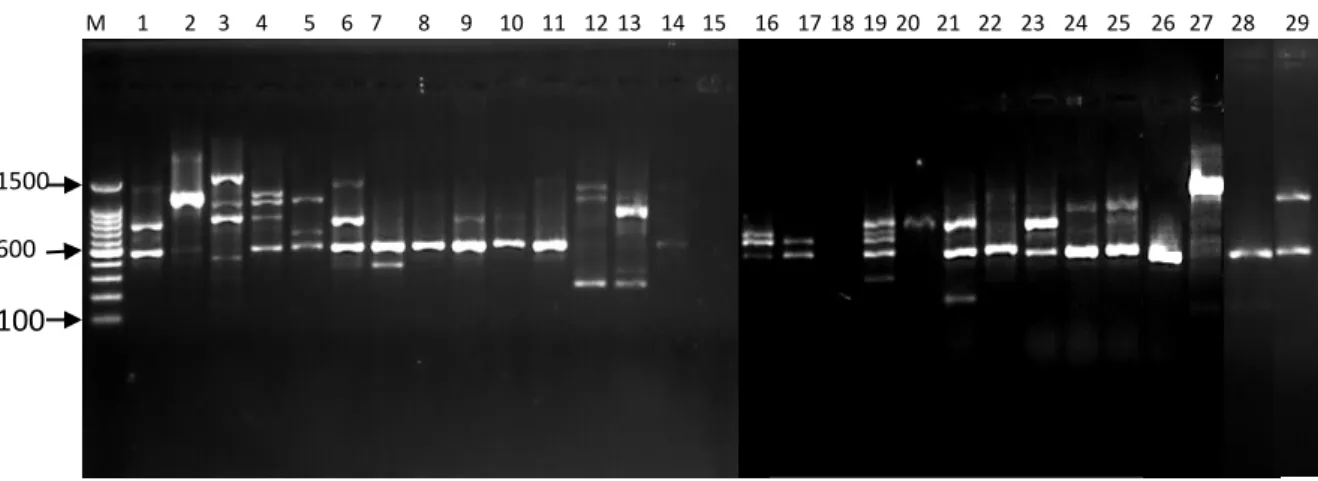
5. Profil PCR Primer OPC-01 ... 36
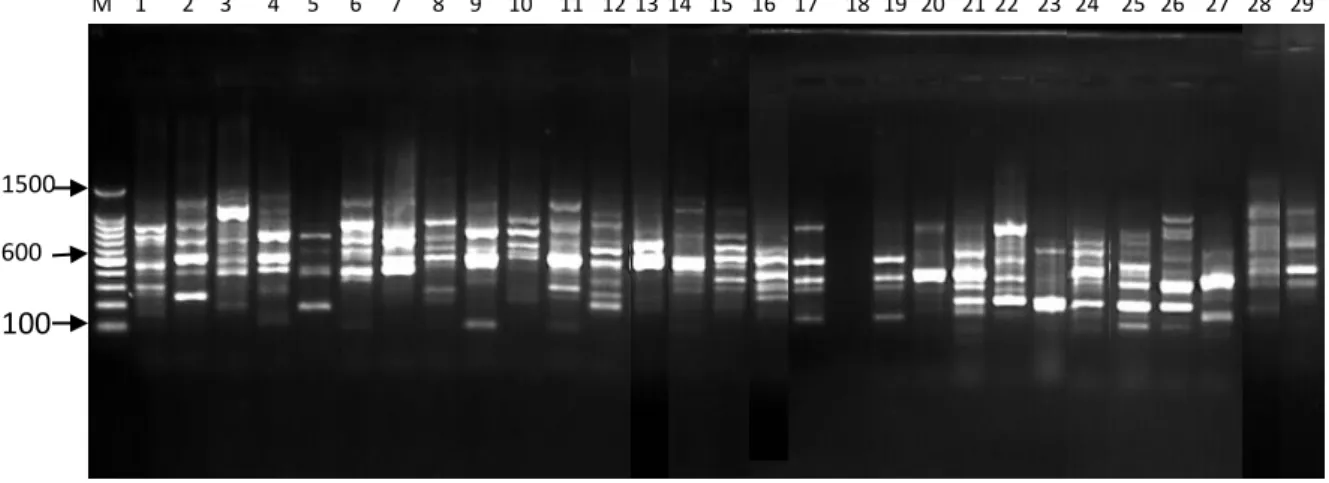
6. Profil PCR Primer OPL-07 ... 37
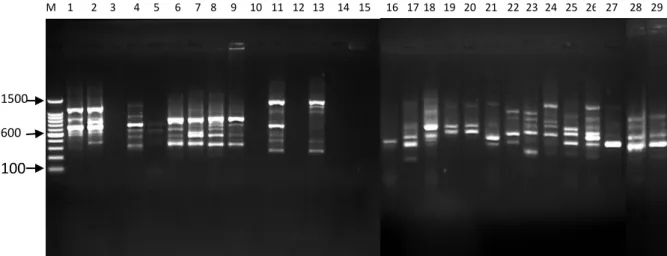
7. Profil PCR Primer OPL-08 ... 38
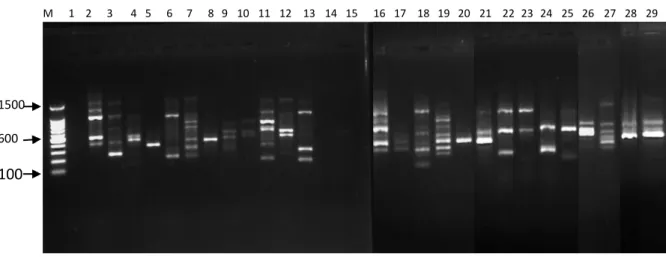
8. Profil PCR Primer OPL-16 ... 39
9. Profil PCR Primer OPI-17 ... 40
10. Dendogram 9Spesies Lalat BuahBerdasarkanMarka RAPD ... 42
11. DendrogramHubunganGenetikSekuen DNA ... 47
DAFTAR LAMPIRAN
Halaman
1. PetaPengambilanSampelLalatBuah ... 55
2. LetakPerangkap Di Lapangan ... 56
3. Proses PembuatanOlahanLimbahKakao ... 57
4. Uji Kadar Protein danGlukosaOlahanLimbahKakao ... 58
5. PengumpulanSampelLalatBuah, RearingdanIdentifikasi ... 60
6. Proses Ekstraksi DNA, ElektroforesisdanAmplifikasi PCR ... 63
7. Data JumlahLalatBuah yang Terperangkap ... 64
8. HasilPengukuranSuhudanKelembaban di Lapangan ... 72
9. IdentifikasiSampelLalatBuahdan Parasitoid ... 73
10. HasilKromatogramSekuenB. kinabaludanB. sp ... 79
11. JarakGenetikLalat Buah Berdasakan Marka RAPD ... 82
ix
PENDAHULUAN
Latar Belakang
Lalat buah (Diptera: Tephritidae) umumnya bersifat polifag dengan kisaran inang yang luas, meskipun beberapa diketahui bersifat oligofag dan monofag (Suputa et al., 2010). Dampak kerusakan yang ditimbulkan lalat buah menjadi perhatian dunia,di Indonesia pernah mengalami masalah pada komoditas buah- buahan yang menunjukkan gejala serangan lalat buah (Suputa et al., 2007). Selain menurunkan produksi juga menjadi faktor pembatas perdagangan antar negara karena adanya serangan dari hama lalat buah(Kardinan et al., 2009).
Berdasarkan hasil pengumpulan data yang dilakukan tercatat 266 jenis buah- buahan (mangga, durian, rambutan, manggis, salak, duku, jambu biji, jambu air, buah merah, matoa, pepaya, belimbing, nangka, jeruk, dsb) asli Indonesia telah ditemukan yang sebagian besar masih tumbuh liar di hutan-hutan dan hanya sebagian kecil yang telah dibudidayakan (Uji, 2007).Kabupaten Deli Serdang merupakan salah satu sentra tanaman buah jambu biji merah di Sumatera Utara, pernah mengalami penurunan produksipada tahun 2010. Produksi jambu biji merah sebesar 35.261 turun menjadi 33.477 ton pada tahun 2016(BPS, 2017).
Salah satu faktor penurunan produksi disebabkan oleh serangan Organisme Pengganggu Tanaman (OPT) di pertanaman jambu biji merah.
Siwi et al. (2006) melaporkan bahwa tanaman inang dari spesies B.
albistrigata adalah mangga, jambu biji, jambu air, nangka, dan tanaman famili Curcubitaceae. Tanaman inang dari spesies B. tau adalah melon, jambu biji, mentimun, dan tanaman famili Curcubitaceae. Tanaman inang dari spesies lalat
buah B. carambolae adalah tanaman belimbing, jambu air, jambu biji, tomat, cabai, nangka, cempedak, sukun, jeruk lemon, sawo, manggis, mangga, dan lain lain. Tanaman inang dari spesies B. papayae adalah pisang, pepaya, jambu biji, jambu bol, jeruk manis, sawo, belimbing, sirsak, manggis, rambutan, nangka, mangga, duku, rambai, cabai, terong, markisa dan lain lain (Sukarmin, 2011).
Drew dan Romig (2012) melaporkan lalat buah di Indonesia sebanyak 122 spesies. Tapi hanya 11 spesies yang diketahui berperan penting sebagai hama, yaitu B. albistrigata, B. carambolae, B. dorsalis, B.frauenfeldi, B.latifrons, B.
musae, B. occipitalis, B. umbrosa, B. caudata, B. cucurbitae, dan B. tau.
Berbagai upaya pengendalian lalat buah telah dilakukan diantaranya dengan cara pembungkusan, teknik serangga jantan mandul, sanitasi, pengendalian biologis, penyemprotan pestisida (Dhillon et al.,2005). Pengendalian secara biologis dengan memanfaatkan peran parasitoidyang berasal dari famili Branconidae (Hymenoptera), yaitu Fopius sp. dan Biosteres sp. yang mampu menekan populasi lalat buah di lapangan(Siwi et al., 2006).Pengendalian lalat buah lainnya yang efektif dan ramah lingkungan adalah penggunaan perangkap atraktan(Kardinan et al., 2009). Selain metil eugenol ada juga atraktan lain, yaitu protein hidrolisat yang berasal dari protein yang terhidrolisis. Protein hidrolisat merupakan makanan yang dibutuhkan oleh lalat buah betina untuk menghasilkan telur (Rahardjo et al., 2009).
Drew & Romig (2012) menyatakan bahwa identifikasi spesies lalat buah sangat penting, karena beberapa kelompok taksa lalat buah memiliki variasi karakter morfologi yang hampir sama. Contoh perbedaan mofologis yang sulit
dibedakan satu sama lain antara B. carambolae dan B. papayae karena kedekatan kekerabatannya sehingga dari ukuran tubuh dan sayap terlihat sama, tidak seperti spesies lain yang bisa dibedakan langsung dengan melihat pola gambar sayap dan abdomennya (Pramudi et al., 2013). Adanyapengaruh perubahan-perubahan lingkungan dan sering tidak menggambarkanhubungan genetik akibat adanya interaksi lingkungan, sehinggaperlu dilakukan karakterisasi molekuler untukmendapatkan hasil yang akurat dalam mengkarakterisasiperbedaan spesies (Smith etal., 2003; Pramudi et al., 2013).
Penanda genetik digunakan untuk menentukanvariasi genetik diantara spesies yangdiselidiki. Dengan menggunakan metoda PCR (Polymerase Chain Reaction) dan RAPD (Random Amplified Polymorphic DNA) dapat diidentifikasi polimorfisme DNA yang digunakan sebagai penanda genetik untukmengenal ciri khas populasi lalat buah yang telah dikumpulkan dari lokasi geografi yangberbeda (Jenkins et al., 2012). Analisis RAPD secara cepat dan efektif dapatmengidentifikasi penanda genetik untuk membedakanspesies-spesies yang berhubungan erat (Anggereini, 2008).
Perlu adanya informasi mengenai spesies lalat buah yang ada dengan spesies lalat buah yangbaru, sehingga dapat diketahui sumber asal datangnya hama tersebut, dan program pengendalian hama lalat buah dapat lebih ditekankan pada daerah sumber asal serangan lalat buah (Pramudi et al., 2013). Di Sumatera Utara, khususnya Kabupaten Deli Serdang informasi mengenai karakteristik molekuler lalat buah belum pernah dilakukan.
Perumusan Masalah
Provinsi Sumatra Utara memiliki potensi tanaman hortikultura yang melimpah dengan pintu-pintu pemasukan dan pengeluaran komoditas pertanian yang menghubungkan dengan daerah lain di dalam wilayah RI, maupun ke luar wilayah RI. Hal ini membuka peluang penyebaran lalat buah melalui media pembawa komoditas pertanian semakin meningkat, sehingga mempengaruhi status spesies lalat buah di suatu daerah. Selain itu informasi mengenai spesies lalat buah di Sumatra Utara khususnya Kabupaten Deli Serdang masih sangat terbatas, oleh karena itu perlu penelitian mengenai identifikasi spesies lalat buah baik secara morfologi maupun molekuler yang ditemukan di Kabupaten Deli Serdang.
Tujuan Penelitian
1. Mengetahui jenis dan populasi lalat buah yang tertangkap pada senyawa atraktan yang mengandung campuran metil eugenol dan olahan limbah kakao di pertanaman jambu biji merah.
2. Mempelajari karakteristik molekuler lalat buah dengan menggunakan metode RAPD (Random Amplified Polymorphic DNA) - PCR (Polymerase Chain Reaction).
3. Mengetahui jenisdan tingkat parasitasi parasitoid pada pertanaman jambu biji merah Kabupaten Deli Serdang.
Hipotesis Penelitian
1. Terdapat lebih dari 1 jenis lalat buah yang tertarik terhadap senyawa atraktan yang mengandung campuran metil eugenol dan olahan limbah kakao di pertanaman jambu biji merah.
2. Ada variasi genetik antar spesies lalat buah di 5 lokasi pertanaman jambu biji merah di Kabupaten Deli Serdang.
3. Terdapat parasitoid yang berasosiasi pada pertanaman jambu biji merah di Kabupaten Deli Serdang.
Kegunaan Penulisan
1. Untuk menambah informasi mengenai karakteristik morfologi dan molekulerlalat buah di Kabupaten Deli Serdang.
2. Sebagai salah satu syarat untuk mendapatkan gelar Magister di Program Studi Magister Agroteknologi Fakultas Pertanian Universitas Sumatera Utara.
TINJAUAN PUSTAKA
Morfologi Lalat Buah
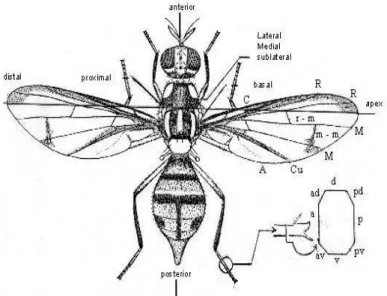
Bentuk morfologi Bactrocera secara umum dapat dilihat pada Gambar 1.
Gambar 1. Morfologi Lalat Buah Bactrocera Sumber: Siwi et al. (2006)
Puparium lalat buahberbentuk oval berwarna kuning kecoklatan dengan panjang ± 5 mm (DitlinHortikultura, 2006). Imago lalat buah umumnya memiliki ciri-ciri penting di kepala, toraks,sayap, dan abdomen.Kepala terdiri atas antena, mata, dan spot. Pada bagian toraks adalah ada tidaknya medial postsutural vittaedan lateral postsutural vittae (Siwi et al., 2006).Pada bagian sayap terdapat basal costal,costal, microtrichia, costal band, anal streak, danpola sayap. Pada bagian abdomenada tidaknya gambaran pola T padaterga, menyatu atau tidaknya
antar terga ke dua danseterusnya, serta pola warna pada bagian terga (Pramudi et al., 2013).
Biologi Lalat Buah
Siklus hidup lalat buah mengalami perkembangan sempurna atau perkembangan holometabola yang memiliki 4 fase metamorfosis yaitu telur, larva, pupa, dan imago (Vijaysegaran & Drew, 2006). Lalat betinameletakkan telurnya di dalam buah sedalam 2-4 mm melalui kulit buah. Lalat buah betina dapat meletakkan 10 sampai 12 telur setiap hari dan sekitar 200-250 telur selama hidupnya (Siwi et al., 2006).
Larva terdiri atas tiga instar dalam waktu antara 6 – 10 hari dan hidup di dalam jaringan buah (Putra & Suputa, 2013). Larva instar akhir keluar dari jaringan buah dan melentingkan tubuhnya ke tanah untuk berpupa, stadia pupa berkisar antara 8 – 12 hari (Handayani, 2015). Seekor imago betina dapat hidup berkisar antara 23 – 27 hari, sedangkan imago jantan berkisar antara 13 – 15 hari(Siwi et al., 2006).
Ekologi Lalat Buah
Aktivitas lalat buah dalam menentukan tanaman inang berdasarkan warna dan aroma buah (Suputa et al., 2007). Perilaku lalat buah dirangsang oleh bahan kimia yang dikenal sebagai semiochemicalssalah satunya adalah kairomones (metil eugenol berupa senyawa phenylpropanoid)(Tan et al., 2011). Lalatbuah dapat berkembang pada suhu 10-30oC dan dapat berkembang baik pada kelembaban 62- 90% (Ginting, 2009).Lalat buah mulai aktif pada pagi hari hingga siang hari dan menurun aktifitasnya pada sore hari(Suputa et al., 2007).
Keragaman lalat buah sangat dipengaruhi oleh ketersediaan tanaman inang dan preferensi lalat buah terhadap inangnya (Siwi et al., 2006). Dalam suatu
daerah lalat buah akan berpindah jika sumber pakan telah berkurang(Khaeruddin, 2015).Besarnya populasi lalat buah di lingkungandipengaruhi oleh suhu udara, sedangkan kelimpahan populasi lalat buah di daerah tropis dipengaruhi oleh curah hujan(Herlinda et al., 2007). Curah hujan berhubungan erat dengan kelembaban, terutama kelembaban tanah yang berkorelasi dengan peluang kemunculan imago lalat buah. Hal ini karena pada larva instar akhir akan keluar dari dalam jaringan inangnya, kemudian berpupa di dalam tanah (Putra & Suputa, 2013).
P. guajava (jambu biji merah) diketahui sebagai inang utama dari berbagai spesies lalat buah (Siwi et al., 2006; Suputa et al., 2010; Leblanc et al., 2013;
Drew, 2016). Inang yang hanya berasosiasi dengan satu spesies lalat buah adalah A. comorus, C. papaya, Musa sp., A. bunius, N. lappaceum, S. melongena, C.
annum, dan S. lycopersicum. Perbedaan kisaran inang yang dimiliki oleh spesies lalat buah dipengaruhi oleh spektrum warna, senyawa kimiawi volatil yang dikeluarkan oleh tanaman inang, preferensi serta persepsi lalat buah terhadap morfologi, nutrisi, persebaran, dan kuantitas tanaman inang serta interaksi terhadap organisme serta individu lain (Binyameen, 2013).
Syahfari & Mujiyanto (2013) melaporkan Bactrocera cucurbitae dan B.
papayae hanya menyerang buah pepaya saja, sedangkan lalat buah yang menyerang lebih dari satu buah yaitu B. carambolae menyerang buah mangga, belimbing, jambu biji, jambu air. B. albistrigata menyerang buah mangga, jambu biji, jambu air (Rahardjo et al., 2009).
Gejala Serangan Lalat Buah
Serangan lalat buah ini sering ditemukan pada buah yang hampir masak.
Gejala awal ditandai dengan terlihatnya noda-noda kecil berwarna hitam bekas tusukan ovipositornya (Suputa et al., 2007). Stadia larva tinggal di dalam buah dan mendapat nutrisi dari buah tersebut dengan cara merusak daging buah, sehingga buah menjadi busuk dan akhirnya gugur (Sarjan et al., 2010). Kerusakan yang dialami tanaman akibat dari serangan lalat buah hanya sebatas pada buahnya saja. Tanaman itu sendiri tidak terganggu, tetap normal, tumbuh sehat dan tetap bisa berbuah (Susanti, 2012).
Parasitoid Lalat Buah
Parasitoid lalat buah yang telah diidentifikasi di Indonesia ialah Opius sp., Diachasmimorpha sp., Tetrastichus sp., Spalangia sp., Asobara sp., dan Agasnaspis sp. (Suputa et al., 2010). Spesies parasitoid yang banyak ditemukan di Indonesia adalah Diachasmimorpha spp., Opius spp., dan Psytallia spp.(Putra &
Suputa, 2013). Menurut Artayasa et al. (2006) spesies parasitoid Biosteres vandenboschi terdapat pada buah belimbing dan jambu air; Opius makii dan parasitoid Chalcidoidea terdapat pada buah belimbing; Eurytomide ditemukan pada buah belimbing, jambu air dan mangga; sedangkan Diapriidae dan Eulophidae terdapat pada buah mangga.
Sunarno & Popoko (2013) menyatakan bahwa tanaman inang sebagai faktor pembatas populasi lalat buah dan populasi lalat buah sebagai faktor pembatas populasi parasitoid. Menurut Astriyani (2014), faktor-faktor yang mempengaruhi perkembangan parasitoid salah satunya adalah ketersediaan pakan yang sesuai,
dan tindakan penggunaan pestisida yang tidak bijak. Populasi parasitoid juga
dipengaruhi oleh umur tanaman dan ketersediaan inang di lapangan (Herlinda, 2007).
Vargas et al.(2012) melaporkan populasi Fopius arisanus danDiachasmimorpha longicaudata yang relatif rendah pada musim kering dan tinggi pada musim hujan yang dipengaruhi oleh intensitas curah hujan. Fopius sp.
merupakan parasitoid soliter telur-pupa sedangkan Diachasmimorpha sp.
merupakan parasitoid soliter larva-pupa. Kedua parasitoid ini merupakan
parasitoid utama dari lalat buah khususnya dari genus Bactrocera (Muhlison, 2016).
Karakteristik Molekuler (RAPD-PCR)
Sidik jari DNA (DNA fingerprinting) merupakan suatu teknologi DNA untuk melihatkeragaman individu, dapat untuk membedakan individu yang dekat kekerabatannya sekalipun. Metode sidik jari DNA dapat diterapkan padasemua makhluk hidup, baik prokariotik maupun eukariotik (Madigan et al., 2009).Berbagai teknik molekuler yang telahdikembangkan antara lain adalah RFLP (Restriction Fragment LengthPolymorphism), AP-PCR (Arbitrarily Primed PCR), DAF (DNA AmplifiedFingerprinting), RAPD (Random Amplified Polymorphic DNA), AFLP(Amplification Fragment Length Polymorphism) dan STMS (Sequence TaggedMicrosatellites) yang masing-masing mempunyai kelebihan dan kelemahan (Bangun, 2007).
Analisis sidik jari DNA dapat dilakukan dengan berbagai cara, salah satunya menggunakanmetode PCR. Sidik jari DNA dengan metode PCR lebih mudah
dilakukan karena tidakmemerlukan enzim restriksi, tidak memerlukan hibridisasi dengan suatu pelacak tertentu, tidakmemerlukan pemindahan fragmen-fragmen DNA dari gel ke suatu membran, dan dapat dilakukanterhadap sampel DNA dalam jumlah sedikit (Yuwono, 2006).
RAPD mengungkapkan pola keragaman genetik, tapi RAPD cenderung memberikan diagnostik populasi, ras atau spesies-spesifik penanda. Karakteristik ini dapat menjadi penting untuk studi populasi dan untuk menginformasikan keputusan tentang konservasi populasi (Jenkins et al., 2012). Elrod & Satansfield (2007) menjelaskan bahwa keragaman genetik muncul disebabkan oleh adanya mekanisme mutasi, perpasangan alel secara bebas dan adanya migrasi gen dari satu tempat ke tempat lain. Dasar dari analisis RAPD adalah penggunaan alat Polymerase Chain Reaction (PCR) yang merupakan suatu metode in vitro untuk memperbanyak sekuen DNA dan sangat berguna untuk identifikasi genotipik, analisa kekerabatan, filogenetik dan pemetaan genetik (Muladno, 2010).
Teknik RAPD ini digunakan untuk mengetahui asal geografi seranggga hama, pemetaan genom lokal dan global suatu spesies, mengetahui keanekaragaman genetik suatu organisme, konstruksi peta genetik suatu organisme (Singh et al., 2011). Spesies yang berbeda dapat menunjukkan tingkat polimorfisme yang berbeda, sebanding dengan variasi lokus RAPD dan jumlah lokus yang diamplifikasi (Jiang et al., 2014).
Konsentrasi cetakan DNA harus dioptimasi. Jika konsentrasinya terlalu rendah, maka primer tidak dapat menemukan target. Sebaliknya bila konsentrasi cetakan DNA terlalu tinggi akan meningkatkan kemungkinan salah target
(mispriming). Selain itu kemurnian cetakan DNA juga penting, karena dapat mempengaruhi hasil reaksi (Zein & Prawiradilaga, 2013). Hasil ekstraksi DNA dapat mengalami kontaminasi smear bisa merupakan sisa dari larutan-larutan yang terbawa selama proses isolasi atau juga dapat berupa DNA yang terdegradasi pada proses isolasi (Mulyani et al., 2011). Keberadaan senyawa tersebut dapat
menjadi faktor yang menghambat keberhasilan proses ekstraksi DNA (Maftuchah & Zainuddin, 2013).
Azizah (2009) menyatakan bahwa primer yang tidak spesifik atau sesuai dapat menyebabkan teramplifikasinya daerah lain dalam genom yang tidak dijadikan sasaran atau sebaliknya tidak ada daerah genom yang teramplifikasi.
Beberapa bukti percobaan menunjukkan bahwa perbedaan satu pasang basa saja sudah cukup menyebabkan ketidaksesuaian cetakan primer yang kemudian mencegah amplifikasi. Perbedaan intensitas pita DNA tersebut dipengaruhi oleh sebaran situs penempelan primer pada genom, kemurnian dan konsentrasi genom dalam reaksi (William et al., 1990; Asokan et al., 2007).
Menurut Zhang et al. (2010) bahwa B. dorsalis kompleks yang menduduki subgenus Bactrocera merupakan monofiletik. B. dorsalis kompleks mempunyai bentuk dan sifat yang berbeda akan tetapi mereka mempunyai common ancestor (nenek moyang) yang sama. Menurut Dharmayanti et al. (2010) bahwa analisis filogenetika digunakan untuk untuk menentukan bagaimana keluarga tersebut diturunkan selama proses evolusi. Spesies yang memiliki nilai jarak genetik semakin rendah, memiliki hubungan kekerabatan semakin dekat, dan sebaliknya.
Besarnya perbedaan jarak genetik dalam populasi dapat disebabkan oleh beberapa
faktor seperti faktor isolasi oleh jarak, geografi, ekologi, dan reproduksi. Apabila hal ini terjadi maka akan muncul jenis baru yang mampu beradaptasi pada
lingkungannya secara alami dalam waktu jangka panjang (Schmitt &Haubrich,2008). Lucic et al. (2011) menyatakan bahwakekerabatan
antar individu yang ditunjukkan olehdendogram berkorelasi dengan jarak genetik individu.Kekerabatan yang dekat menunjukkan jarak genetik yangrendah dan kekerabatan yang jauh menujukkan jarakgenetik yang tinggi.
Perbedaan DNA lebih banyak dipakai karena dianggap lebih stabil dalam perkembanganspesies dibandingkan dengan perbedaan morfologi. Adanya perubahan sekecil apapundalam reaksi dapat mengubah jumlah dan intensitasproduk amplifikasi sehingga keterulangan sulit untuk dipertahankan.
Banyaknya pita yang dihasilkan oleh setiap primer tergantung pada sebaran situs yang homolog pada genom (Pramudi et al., 2013). Muladno (2010) menambahkan bahwa RAPD tidak dapatmembedakan individu homozigot dan heterozigot karenabersifat sebagai penanda dominan serta sulit mendeteksiperubahan yang kecil pada struktur DNA.
Menurut Putra (2005) ada duahal dasar yang digunakan untuk identifikasi yaitumenggunakan karakter tubuh seperti morfologi, anatomi,perilaku dan fisiologi. Selain itu, dapat dilakukan denganmemanfaatkan untai basa DNA yang terdapat pada sel-selserangga sebagai pencirinya.Identifikasi DNA spesies dapat menjadi alat yang sangatberguna dalam entomologi meski tidak menggantikanidentifikasi spesies secara konvensional. Identifikasivisual dapat digunakan untuk membedakan antara duajenis karakteristik fisik dan perilaku
sangat mirip atauidentik. Sebuah identifikasi menyeluruh dari spesiesmelalui metode konvensional diperlukan sebelummengunakan analisis DNA (Anggereini, 2008).
Senyawa Atraktan Lalat Buah
Berbagai upaya pengendalian lalat buah telah dilakukan diantaranya dengan cara pembungkusan, teknik serangga jantan mandul, penyemprotan pestisida, sanitasi, dan pengendalian biologi (Dhillon et al.,2005). Pengendalian pestisida tidak hanya beracun bagi serangga hama sasaran tetapi juga berbahaya bagi komponen hidup lainnya (misalnya musuh alami), serangga hama dapat bersifat resisten, serta dalam jangka panjang pemakaian pestisida dapat mengalami peningkatan populasi hama sasaran (Untung, 2006). Sedangkan pengendalian lalat buah yang efektif dan ramah lingkungan adalah penggunaan perangkap atraktan (Kardinan et al., 2009).
Muryati et al. (2008) melaporkan bahwa B. albistrigata, B. cucurbitae, dan B. tau dapat tertangkap dengan atraktan cue-lure(4-(p-acetoxyphenil)-2- butanone)dan metil eugenol. Sementara itu B. carambolae dan B papayae hanya dapat tertangkap pada atraktan metil eugenol. Radius aroma atraktan dari metil eugenol ini mencapai 20 sampai dengan 100 m, tetapi jika dibantu angin jangkauannya dapat mencapai 3 km (Kardinan et al., 2009).
Menurut Indriyanti et al. (2012) limbah kakao cair yang diperoleh dari hasil fermentasi pulp kemudian diolah sehingga dapat digunakan sebagai food atractant atau umpan pakan bagi lalat buah. Olahan limbah kakao dapat menarik lalat buah betina karena mengandung protein hidrolisat yang cukup tinggi setelah diolah
dengan penambahan enzim papain. Protein hidrolisat merupakan senyawa hasil degradasi protein akibat penambahan enzim papain. Lalat buah betina membutuhkan protein dalam proses reproduksinya yaitu dalam hal tumbuh kembang telur, sehingga perangkap olahan limbah kakao ini dapat menarik lalat buah betina (Rahmawati, 2014). Leweniqila et al. (1997) menyatakan bahwa prinsi penyemprotan umpan protein adalah semua lalat buah betina yang belum matang membutuhkan protein agar matang secara seksual.
Untuk menarik lalat betina dapat digunakan protein hidrolisat yang merupakan sumber nutrisi lalat buah yang dikombinasi dengan perangkap warna kuning (Heath et al., 2007). Imago lalat buah betina tertarik pada warna kuning jika dibandingkan dengan warna lainnya. Untuk menambah keefektifan daya tarik lalat buah, digunakan perangkap warna kuning dengan atraktan untuk memerangkap lalat buah jantan dan betina (Sulistya, 2015).
BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini telah dilaksanakan pada bulan Aprilsampai November 2017.Pengumpulan sampel lalat buah dilakukan di 5 lokasi pertanaman jambu biji merah di Kabupaten Deli Serdang (Tabel 1) (peta pengumpulan sampel lalat buah Lampiran 1).Identifikasi morfologi lalat buah dilakukan di Laboratorium Hama Fakultas Pertanian Universitas Sumatera Utara, Medan, serta di Laboratorium Pusat Penelitian Biologi Lembaga Ilmu Pengetahuan Indonesia (LIPI) Cibinong.
Karakteristik molekuler lalat buah dilakukan di Laboratorium Genetika dan Biologi Molekuler FMIPA Universitas Sumatera Utara, Medan.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah atraktan (ME) metil eugenol sintetis dan (OLK) olahan limbah kakao, papain, natrium hidroksida, alkohol 70%, pasir, kapas, buah yang terserang, madu, wizard genomic DNA, go taq green master mix, agarose, 100bp DNA ladder, buffer TAE, ethidium bromide.
Alat yang digunakan dalam penelitian ini yaitu: mikroskop hirox, pinset, kuas, gunting, kamera, kawat tipis, wadah plastik, botol specimen, kain kasa, alat tulis, gelas ukur, pengaduk, pipet tetes, kertas label, pH meter, tube, micropipette, micropestle, incubator, sentrifuge, PCR, eletroforesis, UV Iluminator, GPS, thermohigrometer.
Metode Penelitian
Penelitian ini dilakukan sesuai metode Rahmawati (2014) dengan menggunakan RAK Faktorial dengan 2 faktor dan 3 ulangan, bagan penelitian terlampir pada Lampiran 2.
Faktor 1: Atraktan Lalat Buah
A1 = Methyl Eugenol sintetis 1 ml (Pembanding) A2 = Olahan limbah kakao 1 ml
A3 = Methyl Eugenol sintetis+ Olahan limbah kakao 1ml : 1 ml Faktor 2: Lokasi Pertanaman Jambu Biji Merah
L1 = Desa Kolam
L2 = Desa Sei Beras Sekata L3 = Desa Sawit Rejo L4 = Desa Sei Mencirim L5 = Desa Namoriam Kombinasi Perlakuan:
A1L1 A1L2 A1L3 A1L4 A1L5
A2L1 A2L2 A2L3 A2L4 A2L5
A3L1 A3L2 A3L3 A3L4 A3L5
Data ketertarikan lalat buah Bactrocera spp. dianalisis dengan uji lanjutDuncan untuk mengetahui interaksi perlakuan.Perhitungan analisis data ini menggunakan software SPSS 16.
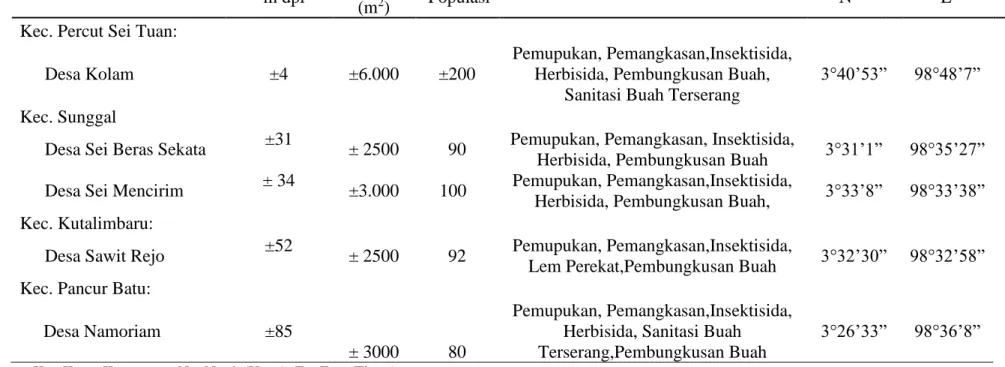
Tabel 1. Lokasi Pengambilan Sampel Lalat Buah Di Pertanaman Jambu Biji Merah Kabupaten Deli Serdang Lokasi
Ketinggian Luas Jumlah Pemeliharaan Ordinat
m dpl Lahan
(m2) Populasi N E
Kec. Percut Sei Tuan:
Desa Kolam ±4 ±6.000 ±200
Pemupukan, Pemangkasan,Insektisida, Herbisida, Pembungkusan Buah,
Sanitasi Buah Terserang
3°40’53” 98°48’7”
Kec. Sunggal
Desa Sei Beras Sekata ±31
± 2500 90 Pemupukan, Pemangkasan, Insektisida,
Herbisida, Pembungkusan Buah 3°31’1” 98°35’27”
Desa Sei Mencirim ± 34
±3.000 100 Pemupukan, Pemangkasan,Insektisida,
Herbisida, Pembungkusan Buah, 3°33’8” 98°33’38”
Kec. Kutalimbaru:
Desa Sawit Rejo ±52
± 2500 92 Pemupukan, Pemangkasan,Insektisida,
Lem Perekat,Pembungkusan Buah 3°32’30” 98°32’58”
Kec. Pancur Batu:
Desa Namoriam ±85
± 3000 80
Pemupukan, Pemangkasan,Insektisida, Herbisida, Sanitasi Buah Terserang,Pembungkusan Buah
3°26’33” 98°36’8”
Ket: Kec = Kecamatan; N = North (Utara); E = East (Timur)
Pelaksanaan Penelitian 1. Penentuan Lokasi
Metode penentuan daerah penelitian ditetapkan secara purposive sampling (sampling dengan maksud dan tujuan tertentu). Daerah lokasi pertanaman jambu biji merah di Desa Kolam, Sei Beras Sekata, Sawit Rejo, Sei Mencirim, dan Namoriam yang sebelumnya sudah dilakukan survei pendahuluan (Tabel 1). Desa – desa tersebut ditentukan secara sengaja dengan pertimbangan bahwa desa tersebut merupakan desa sentra pertanaman jambu biji merah di Kabupaten Deli Serdang. Setiap lokasi sampel memiliki bentuk dan luas lahan yang berbeda, maka ditetapkan untuk menyamakan semua ukuran luas lahan setiap lokasi sampel pengambilan lalat buah yakni 2500 m2.
2. Persiapan Atraktan Olahan Limbah Kakao
Pengolahan Limbah kakao cair mengacu pada metode Lloyd & Drew (1997) dan Indriyanti et al. (2014) yang dimodifikasi.Limbah kakao cair dikumpulkan dari Perkebunan Rakyat di Kecamatan Sibiru-biru. Limbah kakao cair berasal dari pulp buah kakaoyang meluruh akibat fermentasi alami.Limbah kakao cair diambil sebanyak 300 ml kemudian dipanaskan sambil diaduk hingga volume menjadi setengahnya.Limbah diukur pH-nya menggunakan pH meter, lalu dinetralkan dengan larutan natrium hidroksida (NaOH) sampai pH mendekati 6-7.
Ditambahkan 0.3% NaCl sebagai pengawet dan0.1%enzim papain untuk mendegradasi protein. Limbah diaduk hingga rata kemudian dipanaskan di dalam oven pada suhu 50°C selama 2 jam.
3. Uji Kadar Protein dan Glukosa Olahan Limbah Kakao
Limbah kakao yang telah diolah kemudian diuji kadar protein dan glukosa di Laboratorium Biokimia FMIPA USU (Lampiran 4), dengan metode Kjeldahl untuk pengujian protein, yaitu dimasukkan sampel ke dalam DigiTube, kemudian ditambahkan 15 ml H2SO4 98% dan 0.2 g selenium mixture. Didestruksi dengan DigiPREP HT selama 2 jam sampai diperoleh larutan bening. Didestilasi hasil destruksi dengan DigiPREP Distillation System.Dititrasi dengan HCL 0.1 N sampai diperoleh warna ungu. Titrasi blanko asam borat dengan HCL 0.1 N dilakukan sampai diperoleh warna ungu. Kemudian dicatat volume yang terpakai dan dihitung kadar protein dengan rumus:
% Protein =(V. titrasi − V. blanko) X NHCL X 14.008 X 6.25
massa sampel X 100%
MetodeLuff Schoorl untuk pengujian glukosa, yaitu ditimbang sampel sebanyak 2 gram.Lalu larutkan sampel dengan aquades dalam labu takar 50 ml.
Diambil 10 ml larutan dengan pipet volume kemudian masukkan dalam Erlenmeyer.Ditambahkan 25 ml reagent Luff Schoorl dan air suling, kemudian dipanaskan selama 3 menit dan dibiarkan selama 10 menit.Ditambahkan 15 ml KI 20% dan 25 ml H2SO4 25% perlahan, kemudian dititrasi dengan larutan Na2SO3
0.1 N sampai kuning pucat. Ditambahkan indikator amilum 0.5% dititrasi lagi sampai putih susu. Dicatat volume titrasi kemudian dihitung kadar glukosa dengan rumus:
% Glukosa =Angka Tabel X Faktor Pengenceran
massa sampel X 1000 X 100%
Kapas Atraktan 4. Pengumpulan Sampel Lalat Buah Di Lapangan
Pengumpulan sampel lalat buah dengan menggunakan perangkap Steiner yang dimodifikasi dan diberi atraktan.Perangkap dibuat dengan menggunakan wadah plastik (1 kg)dicat kuning, dan didalamnya diletakkan kapas untuk tempat atraktan.Pemberian atraktanpada kapas dengan jarum suntik sesuai masing- masing perlakuan danakan diulang setiap pengambilan sampel.Bentuk perangkap dapat dilihat pada Gambar 2.
(a) (b)
Gambar 2. (a). Bentuk perangkap yang terlihat dari sisi luar; (b) Bentuk perangkap yang terlihat dari sisi dalam.
Pemasangan perangkap dilakukan pada pukul 07.00 WIB.Perangkap dipasang dengan metode irisan diagonal zig zag yakni menentukan secara acak tempat perangkap lalat buahpada pertanaman jambu biji merah disetiap lokasi pengambilan sampel (Lampiran 5), jarak antar perangkap± 20 m disesuaikan dengan jarak tanam yang berbeda ditiap lokasi. Jumlah perangkap yang akan dipasang disetiap lokasi sampel sebanyak 9 buah dan total perangkap diseluruh lokasi sampel adalah 45 perangkap. Perangkapdigantungkan padacabangpohon yang ternaungi (kanopi) pada ketinggian ± 1 – 1.5 m di atas permukaan tanah.
Pengumpulan lalat buah dilakukan seminggu sekali sebanyak 8x.Lalat buah Kait
gantungan
Lubang Masuk
70%,serta diberi nomor sampel,perlakuan, lokasi, tanggal pengambilan.Kemudian sampel dibawa ke laboratorium untuk diidentifikasi.
5. PengambilanBuah yang Terserang
Diambil 5 buah yang terserang secara purposive random sampling sebanyak 4x dengan interval waktu 2 minggu pada setiap lokasi sampel.Buah yang telah dikumpulkan dimasukkan dalam kantung plastik, diberi label lokasi, tanggal pengambilan dan dibawa ke laboratorium.Buah yang terserang dimasukkan ke dalam wadah plastik dengan media pasir dan ditutup kain kasa.Buah diamati setelah 7 hari, untuk mendapatkan pupa lalat buah maka pasir diayaksetiap dua hari sekaliselama 14 hari. Pupa lalat buah yang terkumpul ditempatkan pada wadahplastik lain yang ditutup dengan kain kasa (Astriyani, 2014).
Imago lalat buah dan parasitoid yang muncul diberipakan berupa larutan madu sampai imagoberumur tiga hari.Kemudian dimatikan dengan dimasukkan dalam lemari pendingin, selama 5-10 menit.Kemudian dikoleksi dalam botol yang berisi alkohol 70% dan diidentifikasi.
6. Identifikasi Morfologi
Imago lalat buah dan parasitoid yang telah ditemukandiidentifikasi secara morfologi meliputi caput, toraks, sayap, dan abdomen, dengan menggunakan mikroskop dan dibantu dengan buku identifikasi lalat buah, yakni: The Australia Handbook For The Identification Of Fruit Flies(Drew, 2016); Taksonomi dan Bioekologi Lalat Buah Penting Bactrocera spp. di Indonesia(Siwi et al., 2006);
Tephritid Flies(White, 1988), Hymenoptera Of The World An Identification Guide To Families(Goulet & Huber, 1993), serta agar identifikasi ini lebih akurat maka
untuk konfirmasi dilakukan juga identifikasi di Laboratorium Pusat Penelitian Biologi Lembaga Ilmu Pengetahuan Indonesia (LIPI), Cibinong, Bogor.
7. Karakteristik Molekuler (PCR - RAPD) Imago Lalat Buah 7.1. Ekstraksi DNA
Untuk melihat karakteristik molekuler, pengambilan spesies lalat buah mengikuti penelitian sebelumnya oleh Pramudi et al. (2013) yakni diambil setiap spesies lalat buah sebanyak20 ekor secara acak dari setiap lokasi pertanaman sampel.Untukteknik ekstraksi DNA lalat buah berdasarkan metode yang tertera pada Wizard Genomic DNA (Lampiran 6), yakni: lalat buah digerus dalam Nuclei lysissolution dingin dengan menggunakan mortar sampai halus. Dimasukkan kedalam tube dan ditambahkan Nuclei Lysis Solution dan divortex 10 detik.Lalu diinkubasi pada suhu 650C selama 15-30 menit.Ditambahkan 3 μlRNase Solution kedalam nuclei lysate jaringan dan proteinase K 17.5 μl.Dicampurkan dengan membalik tabung 2-5 kali, kemudian diinkubasi pada suhu 370C selama 15-30 menit.Sampel dibiarkan dingin dalam suhu ruang.Protein Precipitation Solution 200 μl ditambahkan, divortex selama 20 detik.Lalu disentrifugasi selama 4 menit dengan kecepatan 14.000*g. Supernatan dibuang, pelet larutan dipindahkan kedalam tabung yang berisi 600 μl isopropanol suhu ruang.Larutan dicampurkan dengan perlahan.Kemudian disentrifugasi selama 3 menit dengan kecepatan 14.000*g.
Supernatan dibuang, ditambahkan 600 μl 70% ethanol pada suhu ruang dan campurkan perlahan.Selanjutnya disentrifugasi selama 1 menit dengan kecepatan 14.000*g. Ethanol dibuang dan pellet dikeringkan selama 15
menit.DNA rehydration solution 100 μl ditambahkan dan diinkubasi pada suhu 650C selama 1 jam, DNA disimpan pada suhu 40C.
7.2. Amplifikasi DNA
DNA hasil ekstraksi diamplifikasi dengan teknik PCR-RAPD, dengan menggunakan lima primerberdasarkan dari penelitian sebelumnya oleh Pramudi et al. (2013) yang berasal dari Macrogen, yaitu Primer OPC-01 (TTCGAGCCAG), OPI-17 (GGTGGTGATG), OPL-07 (AGGCGGGAAC), OPL-08 (AGCAGGTGGA), OPL-16 (AGGTTGCAGG). Campurkan 10 μl go taq green master mix, 2 μl primer, 2μl DNA lalat buah dan 6 μlnucleifreewaterke dalam PCR tube, kemudian dimasukkan ke dalam mesin PCR yang sudah diprogram untuk 45 siklus pada kondisi, yakni predenaturasi 940C selama 2 menit, denaturasi 940C selama 1 menit, annealing 370C selama 1 menit, extension 720C selama 1 menit, dan final extension 720C selama 5 menit.
7.3. Elektroforesis Gel Agarose
Sebanyak4 μl DNA lalat buah hasil PCR dicampur dengan 2 μlloading dye, kemudian dimasukkan juga 2 μl 100 bp DNA ladder kedalam gel agarose 1.5% yang diwarnai dengan etidium bromida dalam buffer TAE 1X.Selanjutnya dielektroforisispada 80 Volt selama 120 menit.Kemudian divisualisasi dalam UV-illuminator agar terlihat pita DNA yang dihasilkan.
7.4. Sekuensing
Spesies lalat buah yang masih ragu diidentifikasi secara morfologi, dilanjutkan dengan mengidentifikasi berdasarkan sekuen DNA.Sekuensing DNA dilakukan untuk mengetahui urutan nukleotida pada daerah cox1.Sekuensing dilakukan oleh Macrogendi Korea.
8. Peubah Amatan
8.1 Populasi Lalat Buah Dilapangan
Dihitung jumlah imago lalat buah yang terperangkap pada masing-masing perangkap di lima lokasi pertanaman jambu biji Kabupaten Deli Serdang.
8.2 Identifikasi Lalat Buah dan Parasitoid
Diidentifikasi imago lalat buah yang terperangkap, identifikasi dilakukan sampai tingkat spesies, menggunakan kunci identifikasi lalat buah yang dibantu dengan mikroskop.
8.3 Tingkat Parasitasi
Perhitungan tingkat parasitisasi setiap parasitoid yang berasosiasi dipertanaman jambu biji merah, menggunakan rumus (Herlianadewi, 2013).
TP = ∑ A
∑ B + Σ A X 100%
Keterangan : TP = Tingkat parasitisasi
A = Jumlah parasitoid yang muncul
B = Jumlah imago Lalat Buahyang muncul.
8.4 Analisis Secara Molekuler Lalat Buah
Data molekuler yang dianalisis diubah ke dalam bentuk data biner berdasarkan ada dan tidaknya pita hasil amplifikasi.Jika terdapat pita diberi nilai 1, sedangkan jika tidak ada diberi nilai 0.Matriks jarak atau ketidaksamaan genetik untuk semua kombinasi pasangan individu dapat dianalisis dengan Neighbour-Joining Tree (NJtree) untuk memperoleh gambaran dari kekerabatan diantara individu-individu.Perhitungan dan analisis deskriptif ini menggunakan software DARwin Softwere Versi 6 (Perreira dan Jacquemoud-Collet, 2014).
8.5 Analisis Sekuensing
Data hasil sekuensing berupa ABI file dari Bactrocera sp.dan B.kinabaludimasukkan dalam BLAST (Basic Local Alignment Search Tool) NCBI untuk melihat homologi dengan spesies koleksi GenBank.
8.6 Data Pendukung
Data survei lahan petani jambu biji merah di Kabupaten Deli Serdang.Data analisis kadar protein dan glukosa dalam olahan limbah kakao sebagai atraktan.
Data suhu dan kelembaban yang diambil menggunakan alat thermohigrometer di lima lokasi pertanaman jambu biji merah Kabupaten Deli Serdang. Data curah hujan dari BMKG untuk wilayah Kabupaten Deli Serdang.
Rataan Jumlah Lalat Buah (ekor)
HASIL DAN PEMBAHASAN
Hasil
1. Populasi Lalat Buah Di Lapangan
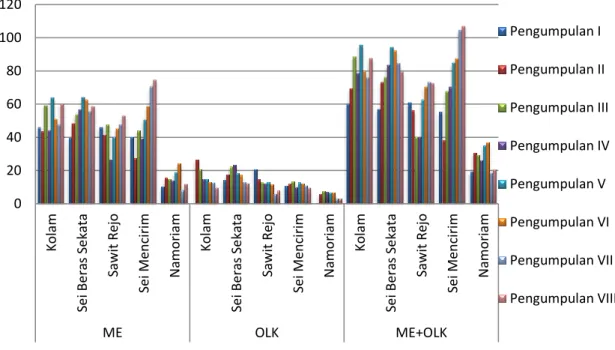
Hasil pengumpulan lalat buahdi 5 lokasi pertanaman jambu biji merah menunjukkan terdapat perbedaan jumlah lalat buah yang terperangkap dengan menggunakan beberapa senyawa atraktan.Perbedaan tersebut dapat dilihat pada Gambar 3.
Gambar 3.Grafik populasi lalat buah yang tertarik atraktan ME sintetis, OLK dan ME+OLK di 5 lokasi pertanaman jambu biji merah Kabupaten Deli Serdang.
Berdasarkan grafik data pada Gambar 3, menunjukkan bahwa jumlah rata- rata populasi lalat buah yang terperangkap pada perlakuan pencampuran kedua senyawa atraktan tersebut lebih banyak karena dapat menarik lalat buah jantan
0 20 40 60 80 100 120
Kolam Sei Beras Sekata Sawit Rejo Sei Mencirim Namoriam Kolam Sei Beras Sekata Sawit Rejo Sei Mencirim Namoriam Kolam Sei Beras Sekata Sawit Rejo Sei Mencirim Namoriam
ME OLK ME+OLK
Pengumpulan I Pengumpulan II Pengumpulan III Pengumpulan IV Pengumpulan V Pengumpulan VI Pengumpulan VII Pengumpulan VIII
lalat buah jantan membutuhkan ME untuk pembentukan feromon (Tan et al., 2011). Sedangkan Lalat buah betina tidak tertarik pada ME, tetapi tertarik pada protein hidrolisat yang terdapat pada OLK untuk proses perkembangan telur dan kematangan organ reproduksinya (Rahmawati, 2014). Lalat buah betina yang belum matang membutuhkan pakan protein agar matang secara seksual (Leweniqila et al., 1997). ME sintetis spesifik menarik lalat buah jantan, namun setelah dicampur dengan olahan limbah kakao (OLK) dapat menarik lalat buah betina (Indriyanti, 2012).
Olahan limbah kakao dapat menarik lalat buah betina karena mengandung protein hidrolisat setelah diolah dengan penambahan enzim papain.Hasil analisis protein yang terhidrolisis pada limbah kakao yang telah diolah sebesar8.75% dan sebesar 9.26% (Lampiran 4).Olahan limbah kakao dapat menarik lalat buah betina karena mengandung protein hidrolisat yang cukup tinggi.Protein hidrolisat merupakan senyawa hasil degradasi protein akibat penambahan enzim papain(Indriyanti, 2012).
Tabel 2. Populasi lalat buah jantan betina yang terperangkap atraktan
Atraktan Populasi Lalat Buah
Total (%) Jantan Betina
Metil Eugenol (ME) 4712 471 35.65
Olahan Limbah Kakao (OLK) 306 1224 10.52
ME+OLK 5218 2609 53.83
Total 10236 4303
Perangkap yang menggunakan atraktan metil eugenol memiliki persentase populasi hasil tangkapan yang lebih tinggi yakni sebesar 35.65% dibandingkan dengan perangkap yang menggunakan atraktan olahan limbah kakao yang mengandung protein hidrolisat memiliki persentase sebesar 10.52%. Jika
dicampurkan kedua atraktan tersebut memiliki persentase hasil tangkapan sebesar 53.83%. Menurut Rahayu (2011) hal ini diduga disebabkan protein hidrolisat mudah menguap dan terkena air hujan. Sifat ketahanan protein hidrolisat di lapangan tidak sama seperti metil eugenol. Lloyd & Drew (1997) menyatakan bahwa untuk meningkatkan efektifitas protein hidrolisat dapat dicapai dengan meneliti metode aplikasinya, formulasi yang digunakan dan mempertebal atau memberi bahan perekat protein hidrolisat sehingga dapat mengurangi kehilangan karena turunnya hujan. Menurut Vickers (1997) protein hidrolisat dalam keadaan tertentu tidak cukup berhasil mengendalikan lalat buah.Ketika populasi lalat buah tinggi, protein hidrolisat tidak cukup menarik lalat buah betina.Protein hidrolisat juga memiliki persistensi yang rendah di alam.
Hasil penangkapan pada campuran ME dan OLK menunjukkan bahwa daya tarik lalat buah tidak hanya dipengaruhi oleh campuran kedua senyawa atraktan, tetapi factor lingkungan juga mempengaruhi. Pada lokasi pertanaman di desa Sei Mencirim memiliki rataan populasi lalat buah terbanyakdibanding desa lainnya.
Hal tersebut terjadi karena adanya perbedaan dalam pemeliharaan pertanaman, pada lokasi pertanaman di desa Sei Mencirim dalam pemeliharaan masih kurang bijak dalam penggunaan pestisida (frekuensi penyemprotan pestisida bisa dilakukan 2x dalam seminggu) sebagai komponen utama dalam pengendalian OPT dan kurangnya dilakukan sanitasi buah terserang di lahan yang dapat menyebabkan tetap tersedianya larva lalat buah di lahan tersebut (narasumber petani, 2017). Diketahui pestisida tidak hanya beracun bagi serangga hama sasaran tetapi juga berbahaya bagi komponen hidup lainnya (misalnya musuh
alami), serangga hama dapat bersifat resisten, serta dalam jangka panjang pemakaian pestisida dapat mengalami peningkatan populasi hama sasaran (Untung, 2006).
Perilaku lalat buah juga dapat dipengaruhi oleh faktor abiotik baik suhu maupun kelembaban.Pada Lampiran 8, dapat dilihat bahwa Kabupaten Deli Serdang pada bulanMei s/d Juni memiliki temperatur rata-rata 26.7oC, curah hujan rata-rata 6.6 mm perbulan, dan kelembaban rata-rata 79.8%. Suhurata-rata dan kelembaban yang terdapat di Kabupaten Deli Serdang sangatberpotensi bagi perkembangan hidup lalat buah.Ginting (2009) mengatakan lalatbuah dapat berkembang pada suhu 10-30oC dan dapat berkembang baik pada kelembaban 62- 90%.Lalat buah mulai aktif pada pagi hari hingga siang hari dan menurun aktifitasnya pada sore hari (Suputa et al., 2007).
2. Lalat Buah yang Diidentifikasi Secara Morfologi
Pada 5 lokasi pertanaman jambu biji merah di Kabupaten Deli Serdang didapatkan 9 spesies lalat buah (Lampiran 9) yang berasosiasi dipertanaman tersebut, yakni B. carambolae, B. papayae, B. curcubitae, B. caudata, B.
umbrosa,B. albistrigata, B. kinabalu,Bactrocera sp.
Terdapat beberapa jenis tanaman buah-buahan di sekitar pertanaman jambu biji merah yang menjadi inang lalat buah yaitu jambu madu deli, jambu air thongsamsi, jambu kristal, pepaya, cabai, jeruk lemon, duku, nangka, jambu jamaika, kuini, dan belimbing (Tabel 3).Hal tersebut berpengaruh pada jumlah dan jenis lalat buah yang terperangkap,pada lokasi pertanaman yang beragam tentu jumlah populasi dan jenis lalat buah lebih banyak,sehingga
memungkinkanjumlah dan jenis lalat buah yang terperangkap pada desa Kolam lebih banyakdibanding pada desa lainnya.
Tabel 3. Jenis lalat buah yang diidentifikasi No. Lokasi Species Lalat Buah
Tanaman Buah Sekitar Pertanaman Jambu Biji
Merah
1. Sawit Rejo
Bactrocera carambolae
Jambu Kristal, Pepaya, Cabai
Bactrocera papayae Bactrocera umbrosa Bactrocera curcubitae Bactrocera caudata Bactrocera sp.
2. Sei Beras Sekata
Bactrocera carambolae
Jambu Kristal, Pepaya Bactrocera papaya
Bactrocera umbrosa Bactrocera curcubitae Bactrocera caudata
3. Namoriam
Bactrocera carambolae
Belimbing, Jambu Air Thongsamsi, Duku,
Pepaya Bactrocera papaya
Bactrocera umbrosa Bactrocera curcubitae Bactrocera caudata
4. Sei Mencirim
Bactrocera carambolae
Jambu Kristal, Jeruk Lemon Bactrocera papayae
Bactrocera umbrosa Bactrocera curcubitae Bactrocera caudata
5. Kolam
Bactrocera carambolae
Jambu Madu Deli, Jambu Jamaika, Jambu Air Thongsamsi, Nangka,
Kuini, semangka Bactrocera papayae
Bactrocera umbrosa Bactrocera curcubitae Bactrocera caudata Bactrocera albistrigata Bactrocera tau
Bactrocera kinabalu
Siwi et al. (2006) menyatakan bahwa keragaman lalat buah sangat dipengaruhi
Dalam suatu daerah lalat buah akan berpindah jika sumber makanan telah berkurang (Khaeruddin, 2015).
B. carambolae dan B. papayae merupakan spesies lalat buah yang populasinya paling banyak ditemukan di lokasi pengambilan sampel. Diketahui bahwa B. carambolae dan B. papayae merupakan hama yang bersifat polifag, yang berarti lalat buah tersebut dapat ditemukan dibanyak tanaman buah.
MenurutSiwi et al. (2006) tanaman inang dari spesies lalat buah B. carambolae adalahtanaman belimbing, jambu air, jambu biji, tomat, cabai, nangka, cempedak, sukun, jeruk lemon, sawo, manggis, mangga, dan lain lain. Tanaman inang dari spesies B. papayae adalah pisang, pepaya, jambu biji, jambu bol, jeruk manis, sawo, belimbing, sirsak, manggis, rambutan, nangka, mangga, duku, rambai, kolang-kaling, cabai, terong, markisa dan lain lain (Sukarmin, 2011). Kedua spesies tersebut merupakan hama penting karena menyebar luas dalam populasi yang sangat tinggi.
B. tau, B. albistrigata, B. kinabalu,dan Bactrocera sp. merupakan spesies dengan populasi rendah dan hanya ditemukan di satu lokasi penelitian. Diduga bahwa pada lokasi tersebut memiliki tanaman inang dan perkembangbiakan yang sesuai dengan spesies lalat buah tersebut. Menurut Ginting (2009) jenis spesies yang jarang tersebut dapat merupakan spesies yang menetap dan mencari makan di suatu habitat atau mungkin hanya merupakan penjelajah eksidental (tidak tetap) dari habitat yang berdekatan atau bahkan jenis migran. Tanaman inang dari spesies B. albistrigata adalah mangga, jambu biji, jambu air, nangka, dan tanaman
famili Curcubitaceae. Tanaman inang dari spesies B. tau adalah melon, jambu biji, mentimun, dan tanaman famili Curcubitaceae (Siwi et al., 2006).
P. guajava (jambu biji merah) diketahui sebagai inang utama dari berbagai spesies lalat buah (Siwi et al., 2006; Suputa et al., 2010; Leblanc et al., 2013;
Drew, 2016). Inang yang hanya berasosiasi dengan satu spesies lalat buah adalah A. comorus, C. papaya, Musa sp., A. bunius, N. lappaceum, S. melongena, C.
annum, dan S. lycopersicum. Perbedaan kisaran inang yang dimiliki oleh spesies lalat buah dipengaruhi oleh spektrum warna, senyawa kimiawi volatil yang dikeluarkan oleh tanaman inang, preferensi serta persepsi lalat buah terhadap morfologi, nutrisi, persebaran, dan kuantitas tanaman inang serta interaksi terhadap organisme serta individu lain (Binyameen, 2013).
3. Tingkat Parasitasi Parasitoid
Hasil rearinglalat buah dari buah yang terserang ditemukan 2 spesies parasitoid (Lampiran 9) yang menyerang lalat buah di pertanaman jambu biji merah yaitu Psyttalia sp. near walker danPsyttalia sp. near walkeri. Tingkat parasitasi parasitoid dapat terlihat pada Tabel 4.
Tabel 4. Tingkat parasitasi parasitoid No. Lokasi pengambilan
buah yang terserang
Jumlah buah
Jumlah lalat buah
Jumlah parasitoid
Persentase parasitasi
1. Desa Sawit Rejo 20 43 0 0
2. Desa Sei Beras Sekata 20 54 4 6.9%
3. Desa Namoriam 20 33 0 0
4. Desa Sei Mencirim 20 62 0 0
5. Desa Kolam 20 27 1 3.6%
Berdasarkan populasi parasitoid tersebut dapat ditunjukkan bahwa kemampuan musuh alami sangat rendah dalam mengatur keseimbangan populasi lalat buah di pertanaman jambu biji merah. Rendahnya tingkat parasitasi tersebut salah satunya diduga karena pengaruh buruk perlakuan insektisida di pertanaman.
Terlihat hanya pada dua lokasi ditemukan parasitoid hasil rearing lalat buah dari buah yang terserang, yakni pada desa Sei Beras Sekata memiliki tingkat parasitasi sebesar 6.9%, dan desa Kolam sebesar 3.6%. Hal tersebut dapat juga dikarenakan pada pertanaman jambu biji merah di desa Sei Beras Sekata berada di sebelah lahan pertanaman jagung, dimana diketahui bahwa serbuk sari tanaman jagung dapat menjadi sumber pakan tambahan bagi parasitoid.MenurutAstriyani (2014), faktor-faktor yang mempengaruhi perkembangan parasitoid salah satunya adalah ketersediaan pakan yang sesuai, dan tindakan penggunaan pestisida yang tidak bijak (Herlinda, 2007).
4. Analisis Molekuler Uji Kualitas DNA
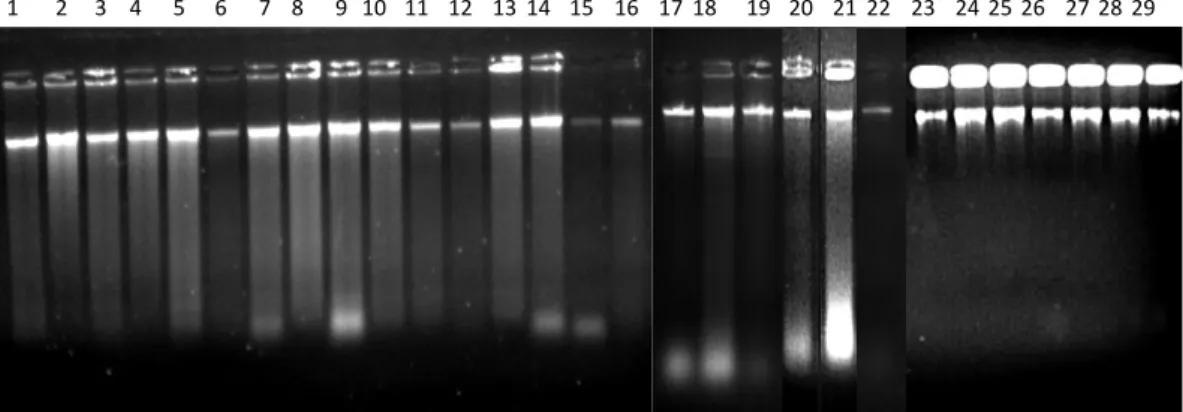
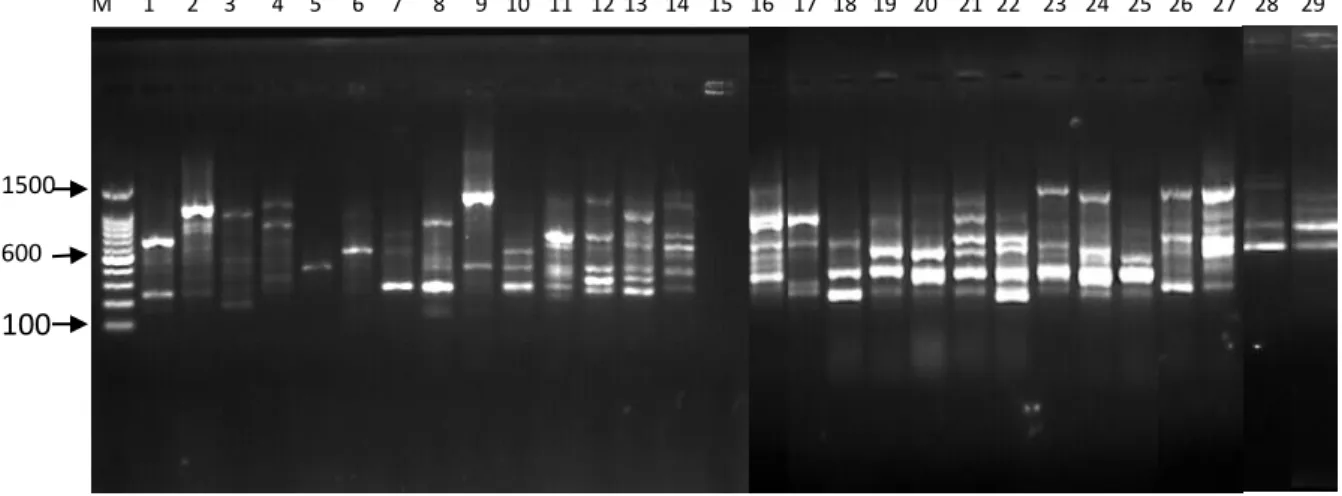
Uji kualitas DNA dilakukan untuk mengetahui tingkat keberhasilan ekstraksi DNA. Profil pita DNA untuk uji kualitas dapat dilihat pada Gambar 4.
Hasil pengamatan kualitas DNA memperlihatkan pola pita yang tebal yang menunjukkan bahwa pada pita tersebut terdapat DNA lalat buah sehingga dapat dianalisis dengan menggunakan PCR. Terlihat juga kondisi smear hasil ekstraksi yang ditunjukkan oleh beberapa pita, hal ini disebabkan oleh keberadaan kontaminan, proses ekstraksi yang belum maksimal, atau merupakansisa larutan- larutan yang terbawa selama isolasi. Mulyani et al. (2011) menyatakan bahwa
smear bisa merupakan sisa dari larutan-larutan yang terbawa selama proses isolasi atau juga dapat berupa DNA yang terdegradasi pada proses isolasi. Keberadaan senyawa tersebut dapat menjadi faktor yang menghambat keberhasilan proses ekstraksi DNA (Maftuchah & Zainuddin, 2013).
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29
Gambar 4. Hasil uji elektroforesis 29 sampel DNA lalat buah di lima lokasi pertanaman jambu biji merah
Ket: (1) B.umbrosa Sawit Rejo; (2) B. umbrosa Kolam; (3) B. umbrosa Namoriam; (4) B. umbrosa Sei Mencirim; (5) B. umbrosa Sei Beras Sekata; (6) B.curcubitae Sawit Rejo; (7) B.curcubitae Kolam; (8) B.curcubitae Namoriam; (9) B.curcubitae Sei Mencirim; (10) B.curcubitae Sei Beras Sekata; (11) B.caudata Sawit Rejo; (12) B.caudata Kolam; (13) B.caudata Namoriam; (14) B.caudata Sei Mencirim; (15) B.caudata Sei Beras Sekata; (16) B.carambolae Sawit Rejo; (17) B.carambolae Kolam;
(18) B.carambolae Namoriam; (19) B.carambolae Sei Mencirim; (20) B.carambolae Sei Beras Sekata;
(21) B.papayae Sawit Rejo; (22) B.papayae Kolam; (23) B.papayae Namoriam; (24) B.papayae Sei Mencirim; (25) B.papayae Sei Beras Sekata; (26) B.tau Kolam; (27) B.albistrigataKolam;
(28)B.KinabaluKolam; (29) B.sp.Sawit Rejo.
Uji Kuantitas DNA
Hasil uji kuantitas dengan menggunakan nanofotometer menunjukkan pendekatan terhadap konsentrasi DNA yang telah diekstraksi dari DNA sampel.
Hasil pengecekan kuantitas dengan nanofotometer yang terlihat pada Tabel 5 terdapat DNA sampel yang memiliki tingkat kemurnian yang tidak sesuai dengan rasio perbandingan Sambrook et al. (1989) yaitu 1.80 – 2.00. Hal tersebut menunjukkan bahwa tingkat kemurnian di luar batas rasio tersebut berarti masih terdapat kontaminan yang berupa fenolik, karbohidrat, protein dan RNA.Menurut
Zein & Prawiradilaga (2013) jika konsentrasinya terlalu rendah, maka primer tidak dapat menemukan target. Sebaliknya bila konsentrasi cetakan DNA terlalu tinggi akan meningkatkan kemungkinan salah target (mispriming). Selain itu kemurnian cetakan DNA juga penting, karena dapat mempengaruhi hasil reaksi.
Tabel 5. Hasil uji kuantitas dan konsentrasi DNA lalat buah populasi Kabupaten Deli Serdang dengan nanofotometer
No. Lokasi Sampel Kode λ 260/λ 280
(Kemurnian)
Konsentrasi (ng/µl)
1. Sawit Rejo Bactrocera Umbrosa U1 1.76 830
2. Kolam Bactrocera Umbrosa U2 1.95 1430
3. Namoriam Bactrocera Umbrosa U3 2.23 760
4. Sei Mencirim Bactrocera Umbrosa U4 2.00 100 5. Sei Beraskata Bactrocera Umbrosa U5 1.31 250 6. Sawit Rejo Bactrocera curcubitae Cu1 3.00 480
7. Kolam Bactrocera curcubitae Cu2 1.96 2160
8. Namoriam Bactrocera curcubitae Cu3 2.07 830 9. Sei Mencirim Bactrocera curcubitae Cu4 1.88 980 10. Sei Beraskata Bactrocera curcubitae Cu5 1.31 250 11. Sawit Rejo Bactrocera caudata Ca1 2.00 280
12. Kolam Bactrocera caudata Ca2 1.38 130
13. Namoriam Bactrocera caudata Ca3 1.80 180
14. Sei Mencirim Bactrocera caudata Ca4 1.91 110 15. Sei Beraskata Bactrocera caudata Ca5 1.92 250 16. Sawit Rejo Bactrocera carambolae Cb1 1.65 530
17. Kolam Bactrocera carambolae Cb2 1.66 800
18. Namoriam Bactrocera carambolae Cb3 1.59 670 19. Sei Mencirim Bactrocera carambolae Cb4 1.23 310 20. Sei Beraskata Bactrocera carambolae Cb5 1.33 240 21. Sawit Rejo Bactrocera papayae P1 2.50 1150
22. Kolam Bactrocera papayae P2 2.27 250
23. Namoriam Bactrocera papayae P3 1.46 190
24. Sei Mencirim Bactrocera papayae P4 1.69 1480 25. Sei Beraskata Bactrocera papayae P5 1.67 620
26. Sei Beraskata Bactrocera tau Bt 1.76 320
27. Kolam Bactrocera albistrigata Ba 1.66 800
28. Kolam Bactrocera kinabalu Bk 1.98 1070
29. Sawit Rejo Bactrocera sp. Bsp 1.26 190