i
VALIDASI METODE ANALISIS DELTAMETRIN DALAM AIR DAN APLIKASINYA PADA PENETAPAN LAJU DISIPASI DELTAMETRIN
MENGGUNAKAN MODEL LINGKUNGAN PERAIRAN
SKRIPSI
Diajukan Untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh:
Kristina Nety Indriati 098114034
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
vi
vii
PRAKATA
Puji Syukur kepada Tuhan Yesus Kristus atas kasih dan karunia-Nya sehingga penulis dapat menyelesaikan penelitian serta penyusunan skripsi yang berjudul “Validasi Metode Analisis Deltametrin dalam Air dan Aplikasinya pada Penetapan Laju Disipasi Deltametrin Menggunakan Model Lingkungan Perairan”. dengan baik dan lancar.
Dalam pelaksanaan penelitian hingga penyusunan skripsi ini, penulis banyak mendapatkan bantuan doa, bimbingan, arahan, saran dan kritik yang membangun dari banyak pihak. Maka dari itu, penulis ingin mengucapkan terima kasih kepada:
1. Ipang Djunarko, M.Sc., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
2. Prof. Dr. Sri Noegrohati Apt. selaku Dosen pembimbing utaman yang telah memberikan pengarahan, bantuan, tuntunan, kritik, dan saran sejak awal penelitian hingga akhir penyusunan skripsi ini.
3. Sanjayadi, M.Si. selaku Dosen pembimbing pendamping yang telah memberikan pengarahan, bantuan, tuntunan, kritik, dan saran sejak awal penelitian hingga akhir penyusunan skripsi ini.
4. Jefrry Julianus, M.Si. selaku dosen penguji atas segala masukan dan bimbingannya.
viii
6. Rini Dwiastuti, M.Sc. atas segala bantuan dalam perijinan penggunaan laboratorium.
7. Segenap dosen yang telah berkenan membagikan ilmu kepada penulis selama belajar di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
8. Darius Bardiyat dan Sumarni, orang tua yang selalu memahami dan memberikan motivasi dan doa sehingga penulis dapat menyelesaikan pendidikan sampai menjadi seorang sarjana dengan pribadi yang kuat dan tegar.
9. Yani Widayanti, Novita Dwi Hastuti, Agustinus Aharnoko, Dwi Anggoro, dan Ignatius Dwi yang selalu memberikan dorongan semangat dan doa terutam saat kejenuhan dan keputusasaan datang.
10.Dina Christin atas semua waktu, kesabaran, bantuan serta dukungan.
11.Margaretta Dyah, Diah Intan Sari, Eling Monika atas doa dan dukungan kepada penulis.
12.Teman seperjuangan skripsi Oei Johanes Darma H.S, kebersamaan dan suka dukanya.
13.Mas Bimo, Pak Parlan, Pak Kunto, Pak Kethul, Mas Wagiran, Pak Ottok dan seluruh staf laboratorium Fakultas Farmasi serta staf keamanan dan kebersihan Universitas Sanata Dharma Yogyakarta atas bantuan dan kerjasamanya. 14.Teman-teman FST A 2009 dan seluruh angkatan 2009 atas doa dan dukungan
yang diberikan kepada penulis.
ix
Penulis menyadari bahwa masih banyak kekurangan dalam penelitian dan penyusunan skripsi ini mengingat keterbatasan dan kemampuan penulis, sehingga sangat diharapkan adanya masukan dan saran yang membangun untuk penulis. Semoga skripsi ini dapat bermanfaat bagi pembaca dan berguna bagi dunia ilmu pengetahuan.
x
DAFTAR ISI
HALAMAN JUDUL ……….. i
HALAMAN PERSETUJUAN………... ii
HALAMAN PENGESAHAN………. iii
PERNYATAAN KEASLIAN KARYA... iv
LEMBAR PERSETUJUAN PUBLIKASI KARYA... v
HALAMAN PERSEMBAHAN ...………... vi
PRAKATA………... vii
DAFTAR ISI………... x
DAFTAR TABEL……….. xv
DAFTAR GAMBAR……….. xvi
DAFTAR LAMPIRAN………... xvii
INTISARI………... xviii
ABSTRACT……….. xix
BAB I. PENDAHULUAN... 1
A. Latar Belakang………. 1
1. Perumusan Masalah ……….. 3
2. Keaslian Penelitian ………. 3
3. Manfaat Penelitian ………... 4
B. Tujuan Penelitian ………... 4
BAB II. PENELAAHAN PUSTAKA... 5
xi 1.Definisi dan Instrumentasi………... 2.Validasi Metode Analisis ………..…...
B. Variabel Penelitian dan Definisi Operasional ………... 27
C.Bahan Penelitian………...………... 28
xii
E. Tata Cara Penelitian ………..
1. Optimasi dan Validasi Metode Analisis ………. a. Pembuatan Larutan Stok Deltametrin... b. Pembuatan Larutan Intermediet ... c. Pembuatan Kurva Baku... d. Presisi Kromatografi Gas... e. Optimasi SPE C18 ...
f. Optimasi Pembersihan Wadah... g. Penetapan % recovery, Akurasi, Presisi, Limit of Quantification dengan Prosedur Standar Adisi... 2. Penentuan Konsentasi Deltametrin Dalam Air yang Diaplikasikan
pada Laju Disipasi Deltametrin ………... 3. Penetapan Laju Disipasi Menggunakan Model Lingkungan
Perairan………... F. Tata Cara Evaluasi Hasil...
29
xiii
e. Laju Disipasi... G. Rancangan Penelitian...
33 34 BAB IV. HASIL DAN PEMBAHASAN
A. Metode Analisis Deltametrin dalam Air.………... 1. Uji Kesesuaian Sistem………... a. Optimasi Instrumen Kromatografi Gas... b. Sensitivitas Kromatografi Gas... c. Presisi Kromatografi Gas... d. Linearitas Kromatografi Gas... ...
2. Preparasi Sampel……….
a. Optimasi SPE C18...
b. Optimasi Pembersihan Wadah...
3. Validasi Metode Analisi ………
a. Akurasi ... b. Presisi... c. Limit of Quantification... d. Pengaruh Matriks terhadap Prosedur Analisis... B. Penentuan Konsentasi Deltametrin Dalam Air yang akan
Diaplikasikan Pada Laju Disipasi Deltametrin... C. Disipasi Deltametrin dalam Lingkungan Perairan... D. Karakterisasi Resiko Residu Pestisida Deltametrin Dalam Air... BAB V. KESIMPULAN DAN SARAN
xiv
B. Saran... 55
DAFTAR PUSTAKA ………. 56
LAMPIRAN ………... 59
xv
DAFTAR TABEL
Tabel I Kelarutan deltametrin... 8
Tabel II Perdedaan kolom kemasan dan kolom kapiler... 19
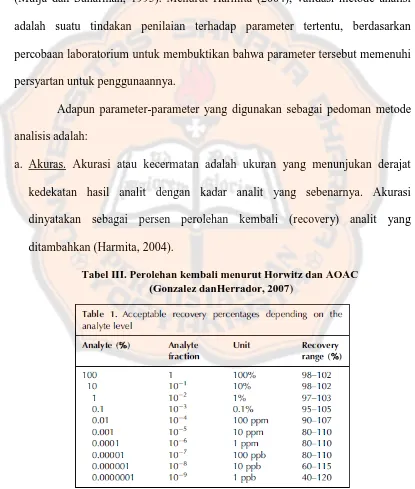
Tabel III Perolehan kembali menurut Horwitz dan AOAC... 23
Tabel IV Batas % RSD menurut Horwitz dan AOAC... 24
Tabel V Hasil optimasi kromatografi gas ………... 37
Tabel VI LOD kurva baku deltametrin... 38
Tabel VII % RSD waktu retensi dan luas puncak DCB ……….. 39
Tabel VIII % Recovery wadah yang dibilas dan tidak dibilas metanol... 44
Tabel IX Hasil % recovery.………... 45
Tabel X % CV dari standar adisi... 46
Tabel XI Uji F standar deviasi kurva daku dan adisi... 48
Tabel XII Uji signifikansi slope kurva baku dan kurva adisi……….... 48
Tabel XIII Rata-rata jumlah ikan yang mati hingga 96 jam……... 49
Tabel XIV Konsentrasi deltametrin yang terukur……… 50
xvi
DAFTAR GAMBAR
Gambar 1. Struktur deltametrin ………...……... 8
Gambar 2. Kanal sodium...………... 12
Gambar 3. Skematik prosedur SPE...……… 17
Gambar 4. Diagram sistem kromatografi gas………. 18
Gambar 5. Aquarium yang berisi 40 L air dan ikan nila... 34
Gambar 6. Kurva baku linearitas rentang bawah... 38
Gambar 7 Kromatogram DCB... 39
Gambar 8. Kurva baku deltametrin 1...……… 40
Gambar 9. Kurva baku deltametrin 2...……… 40
Gambar 10. Kromatogram deltametrin yang dielusi menggunakan metanol...…… 43
Gambar 11. Hubungan kurva baku dan kurva adisi replikasi I, II, dan III...……….. 47
Gambar 12. Hubungan antara hari vs kadar deltametrin...……….... 51
Gambar 13. Hubungan antara hari vs In kadar deltametrin ……... 52
xvii
DAFTAR LAMPIRAN
Lampiran 1. Data optimasi kromatografi gas... 60
Lampiran 2. Contoh kromatogram DCB dan deltametrin... 60
Lampiran 3. Data rasio luas puncak kurva baku deltametrin 1... 61
Lampiran 4. Kurva baku deltametrin 1... 61
Lampiran 5. Data rasio luas puncak kurva baku deltametrin 2... 61
Lampiran 6. Kurva baku detlametrin 2... 62
Lampiran 7. Kurva baku linieritas rentang bawah... 62
Lampiran 8. LOD kurva baku deltametrin... 62
Lampiran 9. % recovery wadah yang dibilas dan tidak dibilas metanol... 63
Lampiran 10. % recovery analisi deltametrin dalam air... 63
Lampiran 11. % CV analisi deltametrin dalam air... 63
Lampiran 12. LOQ... 64
Lampiran 13. Hubungan kurva baku dan kurva adisi replikasi I, II, III... 64
Lampiran 14. Hubungan kurva baku dan kurva adisi replikasi I, II, III…….. 66
Lampiran 15. Rata- rata konsentasi deltametrin yang terukur ... 66
Lampiran 16. Data kadar terukur... 67
xviii
Intisari
Deltametrin merupakan pestisida golongan piretoid. Dalam penggunaan yang tidak sesuai, residu deltametrin dapat masuk ke lingkungan perairan. Dalam lingkungan perairan deltametrin akan cepat hilang karena terjadi akumulasi di tanah dan terdegradasi oleh cahaya. Tujuan dari penelitian ini adalah menetapkan laju disipasi deltametrin dalam lingkungan perairan dan keamanan air yang tercemar pestisida deltametrin.
Pada umumnya kadar deltametrin dalam air pada kisaran parts per trillion (ppt) sehingga perlu pemekatan agar dapat dideteksi dengan kromatografi gas detektor penangkap elektron. Penelitian ini menggunakan metode pengayaan dengan SPC 18 dan instrumen yang digunakan adalah kromatografi gas detektor penangkap elektron. Metode ini perlu divalidasi sebelum digunakan untuk mengetahui laju disipasi deltametrin dalam air.
Metode penelitian ini memiliki validitas yang baik dari sisi linearitas, akurasi, dan presisi. Laju disipasi deltametrin dalam lingkungan perairan relatif cepat dan besarnya laju disipasi deltametrin 1,34 dan 2,45 μg/hari berturut-turut pada konsentrasi 0,17 dan 0,34 μg/L dan air yang tercemar pestisida deltametrin aman dikonsumsi oleh manusia.
xix
ABSTRACT
Deltamethrin is a class of pesticides pyrethroid. Inappropriate use of, deltamethrin residues can be through into the aquatic environment. In the aquatic environtment deltamethrin will quickly disappear due to the accumulation in soil and degrated by light. The purpose of this study was to establish the rate of dissipation deltamethrin in aquatic environments and security of contamination deltamethrin in the water.
Generally, the levels of deltamethrin in the water are on the range of ppt so it needs to be concentrated and detected by gas chromatography electron capture detector. This study used an enrichment method with SPC 18 and the instrument used the gas chromatography electron capture detector. This method needs to be validated before used to determine the rate of dissipation deltamethrin in the water.
The method of this study has a good validity in terms of linearity, accuracy, and precision. The rate of deltamethrin dissipation in the aquatic environments is 1,34 dan 2,45 μg/day for concentration 0,167 dan 0,34 μg/L, it’s relative quickly. It shows that water which is contaminated dy deltamethrin is safe for human consumption.
1
BAB I
PENDAHULUAN
A. Latar Belakang
Dimasa sekarang ini ilmu pengetahuan berkembang dengan sangat pesat, salah satunya bidang pertanian. Manusia berusaha mencari tanaman yang mampu berproduksi tinggi dan menguntungkan bagi kehidupannya. Selama proses produksi pangan terjadi gangguan hama, yang dapat menurunkan hasil. Penggunaan pestisida dalam pertanian merupakan salah satu cara yang digunakan untuk membasmi hama.
Penggunaan pestisida di Indonesia dari tahun ke tahun mengalami peningkatan. Di Kota Klaten, 306 petani rata-rata menggunakan pestisida 5 sampai 7 kali per musim tanam (Anonim f, 2011). Hal ini terjadi karena peredaran pestisida dan jumlah merek pestisida yang beredar makin banyak, serta kurangnya pengawasan pemerintah mengenai penggunaan pestisida yang berbahaya. Imidakloprin, profenolos dan deltametrin merupakan beberapa contoh pestisida yang digunakan petani (Nurhamida, 2005). Pestisida deltametrin merupakan pestisida yang banyak digunakan petani Indonesia karena mudah untuk diaplikasikan dan hasilnya dapat segera diketahui.
membunuh serangga berguna, dan menimbulkan resistensi. Dampak negatif penggunaan pestisida deltametrin bagi lingkungan antara lain mengurangi berbagai jenis biota tertentu, adanya residu pestisida di tanah, air, dan berbagai hasil pertanian yang dapat menyebabkan gangguan kesehatan. Residu deltametrin yang berada dalam sumber air, apabila terminum, dapat mengakibatkan gangguan kesehatan mulai dari gejala ringan seperti sakit perut, mual, mutah-mutah, diare, hingga gejala keracunan berat seperti kerusakan ginjal, kerusakan hati serta kerusakan paru-paru (World Health Organization, 1990).
Keberadaan residu pestisida dalam air dapat diketahui menggunakan
Berdasarkan latar belakang tersebut, maka dirumuskan permasalahan dan manfaat penelitian sebagai berikut:
1. Rumusan masalah
a. Bagaimana menetapkan laju disipasi deltametrin dalam lingkungan perairan?
b. Apakah air yang tercemar pestisida deltametrin apabila dikonsumsi manusia aman?
2. Keaslian Penelitian
Penelitian tentang pestisida deltametrin yang pernah dilakukan adalah validasi metode pestisida deltametrin dalam lingkungan budaya cabai merah menggunakan Gas Chromatography-Electron Capture Detector (GC-ECD) (Prabowo, 2010), penetapan laju degradasi pestisida deltametrin dalam air secara GC-ECD (Agus, 2002), dan validasi metode penetapak kadar deltametrin dalam kubis (Brassica oleracea var. capitata) menggunakan kromatografi gas dengan detektor ionisasi nyala (Moechtar, Darmawati, dan Vani, 2012)
3. Manfaat Penetitian
a. Manfaat metodologis. Penelitian ini dapat memberikan tambahan wawasan terhadap perkembangan analisis residu pestisida secara kromatografi gas menggunakan detektor penangkan elektron pada sampel air.
b. Manfaat praktis. Penelitian ini dapat digunakan sebagai model penetapan laju disipasi residu pestisida deltametrin dalam air dan dapat memberikan informasi mengenai penetapan kadar analisis residu pestisida deltametrin dalam sampel air dengan kromatografi gas menggunakan detektor penangkap elektron
B. Tujuan Penelitian
5
BAB II
PENELAAHAN PUSTAKA
A. Pestisida
1. Pengertian pestisida
Pestisida adalah substrat kimia yang digunakan untuk membunuh atau mengendalikan berbagai hama tanaman. Bagi petani, hama adalah tumbuhan pengganggu, penyakit tanaman yang disebabkan oleh fungi, bakteri, nematoda dan hewan lain yang dianggap merugikan (Sudarmo, 1991).
Menurut Food Agriculture Organization (FAO) 1986 dan Peraturan Pemerintah RI No. 7 Tahun 1973, pestisida adalah campuran bahan kimia yang digunakan untuk mencegah, membasmi dan mengendalikan hewan atau tumbuhan pengganggu seperti binatang perengat, termasuk serangga penyebar penyakit, dengan tujuan untuk kesejahteraan manusia.
2. Penggolongan pestisida
Berdasarkan pengaruh fisiologisnya, yaitu farmakologis atau klinis pestisida diklasifikasikan sebagai berikut:
b. Senyawa organoklorin. Senyawa organoklorin merupakan racun yang universal, degradasinya berlangsung sangat lambat dan senyawa ini berakumulasi di jaringan lemak.
c. Senyawa arsenat. Pada keracunan akut senyawa arsenat menimbulkan gastroentritis dan diare yang menyebabkan kejang sebelum kematian. Pada keadaan kronis menyebabkan pendarahan pada ginjal dan hati.
d. Senyawa karbamat. Senyawa golongan karbamat akan menyebabkan penghambatan aktivitas enzim chorinesterase.
e. Piretroid. Piretroid merupakan analog dari piretrin. Piretrin merupakan zat kimia yang bersifat insektisida yang terdapat pada piretrum. Piretroid mempunyai beberapa keunggulan, antara lain dapat diaplikasikan dalam jumlah yang relatif sedikit, spektrum pengendaliannya luas, tidak persisten, dan memiliki efek melumpuhkan yang sangat baik. Namun karena sifatnya yang kurang selektif, banyak piretroid yang tidak digunakan untuk program pengandalian hama terpadu (Djojosumarto, 1998)
Piretroid yang relatif stabil terhadap sinar matahari adalah deltametrin, permetrin, fenvalerate. Piretoid sintetis yang stabil terhadap sinar matahari dan sangat beracun bagi serangga adalah difetrin, sipermetrin, siflutrin (Wudianto,2001).
3. Efek buruk pestisida
absorpsi kulit, tetapi sejumlah kecil dapat masuk ke gastrointestinal (GI) akibat dari makan menggunakan tangan atau alat-alat yang tercemar (Lu, 1995).
Residu pestisida adalah zat yang terkandung dalam hasil pertanian, bahan pangan, atau pakan hewan, baik sebagai akibat langsung maupun tak langsung dari penggunaan pestisida. Istilah ini mencangkup senyawa turunan pestisida, seperti hasil metabolit, senyawa hasil reaksi, dan zat pengotor yang dapat memberikan pengaruh toksikologi (Anonim a, 1997)
B. Deltamethrin
Deltametrin ((S)-α-cyano-3-phenoxybenzyl (1R, 3R)-3-(2,2-dibromovinyl)-2,2-dimethylcyclopropane carboxylate) merupakan insektisida golongan piretroid yang memiliki struktur seperti Gambar 1.
Gambar 1. Struktur deltametrin (World Health Organization, 2012)
Deltametrin disintesis pada tahun 1974, dan pertama kali dipasarkan pada tahun 1977. Penggunaan deltametrin di dunia mencapai 250 ton/tahun pada tahun 1987. Deltametrin biasanya digunakan pada tanaman kapas dan pada lahan kopi, jagung, sereal, buah, sayuran, dan produk-produk yang dipasarkan. Deltametrin diformulasikan dalam bentuk emulsi konsentrat, suspensi konsentrat, serbuk, atau dikombinasikan dengan pestisida lainnya (World Health Organization, 1990).
Tabel I. Kelarutan deltametrin
1. Disipasi deltametrin
Disipasi pestisida memegang peranan penting dalam penentuan keberadaannya di lingkungan. Jalur disipasi pestisida di lingkungan meliputi translokasi dan degradasi. Deltametrin dapat hilang atau terdegradasi di tanah melalui proses fisika, kimia, dan mikrobiologis. Proses fisika meliputi penyerapan, penguapan, pelindihan, dan diserap tanaman. Proses kimia meliputi proses fotokimia dan mikrobiologis. Deltametrin kemungkinan tidak terjerap secara kuat pada bagian dedaunan dari tanaman, dan penguapan dari permukaan. Pada salah satu studi lapangan, 12-72% deltametrin menguap dari permukaan tanaman pada 24 jam setelah aplikasi (Anonim e, 2009).
Deltametrin diinkubasi pada pasir dan tanah organik pada suhu 28°C dalam kondisi laboratorium. Sekitar 52% dan 74% deltametrin yang diaplikasikan diperoleh kembali dari pasir dan tanah organik setelah 8 minggu perlakuan (World Health Organization, 1990).
anaerob atau kondisi steril, menunjukan bahwa mikroorganisme dan proses biologis yang lain memegang peranan yang sangat penting (World Health Organization, 1990).
Hidrolisis deltametrin tidak signifikan pada pH 5 dan 7. Hidrolisis deltametrin signifikan pada pH 9 dengan waktu paruh 2,5 dan 7 hari berturut-turut pada suhu 25 dan 12 ºC. Pada pH 8, waktu paruhnya 31 dan 75 hari berturut-turut pada suhu 23 dan 12 ºC (Standing Committee on Biocidal Products, 2011).
Pada lingkungan akuatik, deltametrin sangat cepat terpartisi ke sedimen dan biota. Pada laboratorium, 60% dari radioaktivitas yang diaplikasikan ditemukan pada sedimen sesaat setelah diaplikasikan. Dalam sistem air dan sedimen, dissipation time (DT50) sekitar 45 dan 141 hari. Pada 2 sistem yang
berbeda pada suhu 20 dan 12 ºC, DT50 berturut-turut 104 dan 253 hari. Pada
sistem digunakan pH fase air 8,0-9,1 dan hidrolisis mungkin mempengaruhi degradasi yang terjadi. Di tanah, nilai DT50 orde 1 adalah 11-27 hari. Pada suhu
12 ºC, DT50 adalah 31-74 hari (Standing Committee on Biocidal Products, 2011).
2. Efek toksik deltametrin
Deltametrin sangat toksik terhadap ikan, lethal concentration (LC50)
berkisar antara 0,4–2,0 µg/L pada waktu pengamatan selama 96 jam. Deltametrin juga sangat toksik untuk invertebrata akuatik, LC50 untuk Daphnia magna adalah
5 µg/L pada waktu pengamatan selama 48 jam (World Health Organization, 1990).
terbakar pada kulit dan vertigo. Kebanyakan efek ini hanya sementara dan menghilang setelah 5-7 hari. Tidak ada efek samping jangka panjang yang pernah dilaporkan (World Health Organization, 1990).
Pada manusia tanda keracunan pestisida deltametrin yang paling sering dilaporkan adalah paresthesia, selain itu rasa geli, gatal, rasa terbakar, dan mati rasa setelah pemejanan pada kulit. Paresthesia dilaporkan bersifat reversible kadang hingga 48 jam. Paresthesia terjadi di bagian pemejanan pada kulit. Seorang wanita berusia 25 tahun yang mengalami keracunan setelah menyemprotkan deltametrin pada ladang kapas mengeluh pusing, nausea, rasa lelah, pandangan menjadi kabur, kehilangan nafsu makan, rasa terbakar dan geli pada wajah, mual, vertigo, gangguan tidur, dan hilangnya kesadaran. Seorang pria berusia 31 tahun dengan gejala keracunan ringan setelah menyemprotkan deltametrin pada ladang kapas mengalami pusing, nausea, rasa lelah, pandangan menjadi kabur, kehilangan nafsu makan, sensasi terbakar dan gatal pada muka dan dada (National Pesticide Information Center, 2010).
3. Mekanisme aksi piretroid
Deltametrin termasuk piretroid tipe II, tanda keracunan meliputi tremor, pengeluaran air liur, dan konvulsi. Onset deltametrin cepat dan akan hilang setelah beberapa hari (World Health Organization, 1990).
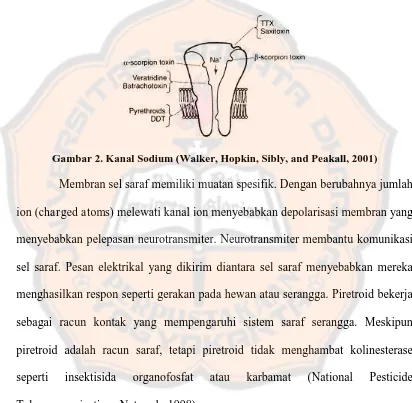
mempunyai gugus α-cyano yang menginduksi long lasting inhibiton dari sodium channel activation gate. Hasilnya adalah memperpanjang permeabilitas dari saraf ke sodium dan menghasilkan sinyal saraf berulang pada sensory organ, sensory nerves, dan otot (National Pesticide Information Center, 2010).
Gambar 2. Kanal Sodium (Walker, Hopkin, Sibly, and Peakall, 2001)
C. Air
1. Pengertian air
Air adalah zat cair yang tidak mempunyai rasa, warna, dan bau yang terdiri dari hidrogen dan oksigen dengan rumus kimia H2O. Air mempunyai sifat
universal, maka zat-zat alami maupun buatan manusia hingga tingkat tertentu larut didalamnya. Dengan demikian, dalam air mengandung zat-zat terlarut. Zat-zat ini sering disebut pencemar (Linsley, 1991).
2. Sifat air
Sifat air yang penting dapat digolongkan ke dalam sifat fisis, kimiawi, dan biologis. Sifat fisis dari air didapatkan dalam ketiga wujudnya, yakni berbentuk padat sebagai es, berbentuk cair sebagai air, dan berbentuk gas sebagai uap air (Slamet, 2002).
Sifat kimia dari air yaitu mempunyai pH 7 dan oksigen tertarut jenuh pada 9 mg/L. Air merupakan pelarut universal, hampir semua jenis zat dapat larut. Air merupakan cairan bilogis, yakni air yang terdapat dalam tubuh semua organisme ( Slamet, 2002).
Sifat biologis dari air yaitu di dalam perairan selalu terdapat kehidupan, yaitu flora dan fauna. Flora dan fauna berpengaruh timbal balik terhadap kualitas air ( Slamet, 2002).
3. Pencemaran air
atau tidak langsung ini dapat berupa fisik, kimia, dan biologi. Air yang tercemar dapat diamati dengan adanya perubahan air dari keadaan normal, diantaranya terjadi:
a. Perubahan suhu
b. Perubahan tingkat keasaman c. Perubahan warna, bau, dan rasa d. Terbentuknya endapan
e. Terdapat mikroorganisme (Situmorang, 2007)
D. Metode Pengayaan
E. Solid Phase Extaction (SPE)
Solid Phase Extaction (SPE) merupakan alternatif metode ektraksi yang cepat, mudah, dan ekonomis karena secara signifikan mengurangi volume pelarut organik yang dibutuhkan. SPE digunakan untuk mengekstrak senyawa dari cairan matrik dan dapat juga digunakan sebagai metode pemurnian (Escribano dan Santos, 2010).
SPE merupak teknik yang relatif baru dan cepat berkembang sebagai alat utama yang digunakan untuk pra-perlakuan sampel atau clean-up sampel yang kotor. Keunggulan SPE dibandingkan dengan ekstraksi cair-cair:
a. Proses ekstraksi lebih sempurna
b. Pemisahan analit dari pengganggu yang mungkin ada menjadi lebih efisien
c. Mengurangi pelarut organik yang digunakan
d. Fraksi analit yang diperoleh lebih mudah dikumpulkan e. Mampu menghilangkan partikulat
f. Lebih mudah diotomatisasi (Rohman, 2009).
dituju keluar (terelusi), sementara senyawa pengganggu tertahan pada penjerap (Gandjar dan Rohman, 2007).
Tahapan pertama menggunakan SPE adalah dengan mengkondisikan penjerap menggunakan pelarut yang sesuai. Penjerap nonpolar seperti C18 dan
penjerap penukar ion dikondisikan dengan mengalirinya menggunakan metanol lalu aquadest. Pencucian yang berlebih menggunakan air akan mengurangi recovery analit. Penjerap-penjerap polar seperti diol, sianol, amino, dan silika harus dibilas dengan menggunakan pelarut nonpolar seperti metilen klorida (Rohman, 2009).
Ada empat tahapan dalam prosedur SPE, yaitu:
a. Pengkondisian. Catridge (penjerap) dialiri dengan menggunakan pelarut sampel untuk membasahi permukaan penjerap dan untuk menciptakan nilai pH yang sama, sehingga perubahan-perubahan kimia yang tidak diharapkan ketika sampel dimasukan dapat dihindari.
b. Retansi (tertahannya) sampel. Larutan sampel dilewatkan ke catridge baik untuk menahan analit yang dituju, sementara komponen lain terelusi atau untuk menahan komponen yang tidak diharapkan sementara analit yang dituju terelusi.
c. Pembilasan. Tahap ini penting untuk menghilangkan seluruh komponen yang tidak tertahan oleh penjerap selama tahap retensi.
Gambar 3. Skematik prosedur SPE
F. Kromatografi Gas
1. Definisi dan instrumentasi
Kromatografi merupakan metode pemisahan dan identifikasi senyawa dari suatu campuran atas dasar perbedaan distribusi komponen diantara dua fase yaitu fase diam dan fase gerak. Dimana kedua fase ini memiliki kepolaran yang berbeda (Hendayana, 2006).
Kromatografi gas adalah teknik pemisahan yang mana solut-solut yang mudah menguap dan stabil dengan pemanasan bermigrasi melalui kolom yang mengandung fase diam dengan suatu kecepatan yang tergantung pada rasio distribusinya (Gandjar dan Rohman, 2007).
organik maupun anorganik dalam suatu campuran baik berupa pasta, cair maupun gas.
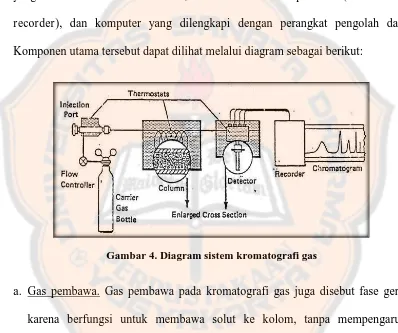
Komponen utama dari instrumentasi kromatografi gas yakni kolom dan penyedia gas pembawa, ruang suntik sampel, kolom yang diletakan dalam oven yang dikontrol secara termostatik, sistem deteksi dan pencatat (detektor dan recorder), dan komputer yang dilengkapi dengan perangkat pengolah data. Komponen utama tersebut dapat dilihat melalui diagram sebagai berikut:
Gambar 4. Diagram sistem kromatografi gas
a. Gas pembawa. Gas pembawa pada kromatografi gas juga disebut fase gerak karena berfungsi untuk membawa solut ke kolom, tanpa mempengaruhi selektifitas. Syarat gas pembawa adalah tidak reaktif, murni, dan dapat disimpan dalam tangki tekanan tinggi (Gandjar dan Rohman, 2007).
kromatografi gas hanya memerlukan waktu yang relatif cepat (Hendayana, 2006)
b. Ruang suntik sampel. Ruang suntik atau inlet berfungsi untuk mengantarkan sampel ke dalam aliran gas pembawa. Sampel yang akan dikromatografi dimasukan kedalam ruang suntikkan melalui lubang yang ditutup dengan septum atau pemisah karet. Ruang suntik harus dipanaskan tersendiri dan biasanya 10°-15°C lebih tinggi daripada suhu kolom supaya seluruh sampel segera menguap setelah disuntikan (Gandjar dan Rohman, 2007).
c. Kolom. Kolom merupakan tempat terjadinya proses pemisahan karena didalamnya terdapat fase diam (Hendayana, 2006). Menurut Gritter (1991), ada dua jenis kolom dalam kromatografi gas yaitu kolom kemasan (packing column) dan kolom kapiler (capillary column). Kolom kemasan terdiri atas fase cair yang tersebar pada permukaan penyangga inert yang terdapat pada tabung yang diameternya besar (diameter dalam 1-3 mm). Berikut ini merupakan tabel perbandingan kolom kemasan dan kolom kapiler
Tabel II. Perdedaan kolom kemasan dan kolom kapiler
Parameter Kolom kemasan Kolom kapiler
Tabung Baja tahan karat
Silika dengan Jumlah lempeng/meter 1000 5000
Total lempeng 5000 300.000
Tebal lapisan film 10 mikron 0,05-1 mikron
Resolusi Rendah Tingggi
Kec.alir (mL/menit) 10-60 0,5-1,5
Pipa kolom dapat terbuat dari tembaga, baja nikarat, aluminium, dan kaca yang berbentuk lurus, lengkung atau melingkar (Mc Nair, 1988). Panjang kolom yang dikemas cukup beragam, dapat beberapa cm sampai 15 meter. Panjang kolom analit biasanya 1-3 meter. Kolom yang lebih panjang menghasilkan jumlah pelat teori dan daya pisah yang lebih besar. Kecepatan gas pembawa berubah selama bergerak melalui kolom, jadi hanya pada bagian kolom yang lebih pendek saja bekerja pada laju alir yang optimum. Ini berarti dengan menggunakan kolom yang sangat panjang, jumlah pelat dan daya pisah menurun kembali. Di samping itu kolom yang panjang membutuhkan tekanan pemasukkan yang sangat tinggi. Tekanan yang tinggi menimbulkan masalah pada cara penyuntikkan dan pencegahan kebocoran gas. Tetapi, keuntungan kolom yang panjang ialah kapasitas cuplikan sebanding dengan banyaknya fase cair dalam kolom. Ini berarti kita dapat menyuntikkan lebih banyak cuplikan ke dalam kolom panjang (Mc Nair, 1988).
d. Fase diam. Pemilihan fase diam yang tepat merupakan parameter terpenting dalam kromatografi gas. Ciri utama yang diperlukan fase diam ialah bahwa fase itu dapat melarutkan senyawa yang dipisahkan sampai pada taraf tertentu (Mc Nair, 1988).
rendah sehingga pemisahan yang dikehendaki tercapai. Untuk kebanyakan cuplikan, semakin rendah kolom, semakin tinggi nisbah koefisien partisi dalam fase diam sehingga hasil pemisahan semakin baik. Pada beberapa kasus kita tidak dapat menggunakan suhu kolom yang cukup rendah, terutama bila cuplikan terdiri atas senyawa yang rentang titik didihnya lebar. Suhu pada detektor bergantung pada jenis detektor yang digunakan, tetapi sebagai dasar dapat dikatakan bahwa detektor dan sambungan antar kolom dan detektor harus cukup panas sehingga cuplikan dan fase diam tidak mengembun. Pelebaran puncak dan menghilangnya puncak komponen merupakan ciri khas terjadinya pengembungan (Gandjar dan Rohman, 2007).
f. Detektor. Detektor merupakan perangkat yang diletakkan pada ujung kolom tempat keluarnya fase gerak (gas pembawa) yang membawa komponen hasil pemisahhan. Detektor pada kromatografi adalah suatu sensor elektronik yang berfungsi mengubah sinyal gas pembawa dan komponen-komponen di dalamnya menjadi sinyal elektronik (Gandjar dan Rohman, 2007).
digunakan sebagai data kuantitatif yang keduanya telah dikonfirmasikan dengan senyawa baku.
Salah satu detektor yang digunakan pada kromatografi gas adalah detektor penangkap elektron (Electron Capture Detector, ECD). Detektor ini dilengkapi dengan sumber radio aktif yaitu tritium (3Hi) atau (63Ni) yang ditempatkan pada elektroda. Tegangan listrik yang dipasang antara katoda dan anoda tidak terlalu tinggi, antara 2-100 volt (Gandjar dan Rohman, 2007).
Dasar kerja dari detektor ini adalah penangkap elektron oleh senyawa yang mempunyai afinitas terhadap elektron bebas, yaitu senyawa yang mempunyai unsur elektronegatif. Bila fase gerak (gas pembawa N2) masuk ke
dalam detektor maka sinyal β akan mengionisasi molekul N2 menjadi ion-ion
N2- dan menghasilkan elektron bebas yang akan bergerak ke anoda dengan
2. Validasi metode analisis
Validasi metode analisis dapat diarikan sebagai suatu prosedur yang digunakan untuk membuktikan bahwa metode analisis tersebut dapat memberikan hasil seperti yang diharapkan dengan kecermatan dan ketelitian yang memadai (Mulja dan Suharman, 1995). Menurut Harmita (2004), validasi metode analisi adalah suatu tindakan penilaian terhadap parameter tertentu, berdasarkan percobaan laboratorium untuk membuktikan bahwa parameter tersebut memenuhi persyartan untuk penggunaannya.
Adapun parameter-parameter yang digunakan sebagai pedoman metode analisis adalah:
a. Akuras. Akurasi atau kecermatan adalah ukuran yang menunjukan derajat kedekatan hasil analit dengan kadar analit yang sebenarnya. Akurasi dinyatakan sebagai persen perolehan kembali (recovery) analit yang ditambahkan (Harmita, 2004).
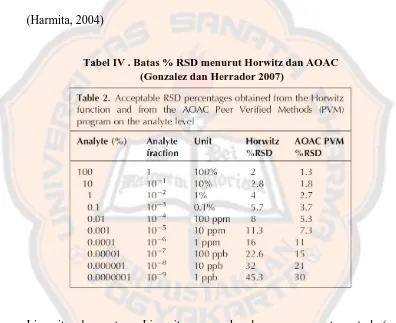
b. Presisi. Persisi merupakan ukuran yang menunjukkan tingkat kesesuaian antara hasil uji individual, diukur melalui penyebaran hasil individual dari rata-rata jika prosedur ditetapkan secara berulang pada sampel yang diambil dari campuran yang homogen. Suatu metode memiliki presisi yang baik apabila memiliki nilai % RSD < 2%. Namun tergantung dari sampel dan kondisi analit (Harmita, 2004)
Tabel IV . Batas % RSD menurut Horwitz dan AOAC (Gonzalez dan Herrador 2007)
memenuhi koefisien kolerasi (r) >0,99 atau r2≥ 0,997 (Chan, Lee, Herman, dan Xue, 2004).
d. LOD (Limit of Detection) dan LOQ (Limit of Quantitation). Limit of Detection adalah jumlah terkecil analit dalam sampel yang dapat dideteksi dan masih memberikan respon signifikan dibandingkan dengan blangko. Limit of quantitation adalah konsentrasi atau jumlah analit terkecil yang dapat dikuantifikasi dengan presis dan akurasi yang cocok. Limit of quantitation merupakan parameter kuantitatif untuk analit dalam suatu matriks dengan konsentrasi kecil dan digunakan untuk menentukan jumlah pengotor atau jumlah sampel yang terdegradasi (Chan, Lee, Herman, dan Xue, 2004).
G. Landasan teori
Pestisida merupakan bahan kimia yang digunakan untuk mencegah, membasmi, dan mengendalikan hama. Pestisida banyak digunakan dalam bidang pertanian, salah satu contoh pestisida yang digunakan adalah deltametrin. Deltametrin merupakan pestisida golongan piretroid yang dapat membunuh hama serangga melalui kontak langsung atau melalui makanan.
perairan bahkan kematian pada biota perairan dan selanjutnya berakibat pada manusia yang berada di lingkungan tersebut.
Penetapan kadar residu pestisida deltametrin dalam air berada dalam kisaran ppt, sedangkan batas deteksi berada dalam kisaran ppb sehingga perlu adanya pemekatan. Pemekatan pada sampel air dapat dilakukan dengan metode pengayaan menggunakan SPE cartridge C18 sehingga eluat dapat langsung
ditetapkan menggunakan instrumen kromatografi gas.
Penetapan kadar residu pestisida dalam air dapat dilakukan dengan menggunakan kromatografi gas dengan detektor penangkap elektron. Kromatografi gas detektor penangkap elektron memiliki selektifitas dan sensitifitas yang baik daripada kromatografi gas dengan detektor ionisasi nyala. Kromatografi gas dengan detektor penangkap elektron digunakan karena deltametrin memiliki gugus Br yang merupakan gugus penangkap elektron dan nantinya akan menangkap elekton bebas yang terdapat pada detektor.
H. Hipotesis
1. Deltametrin di lingkungan perairan mengalami disipasi dalam waktu yang relatif cepat.
27 BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian tentang “Validasi Metode Analisis Deltametrin dalam Air dan Aplikasinya pada Penetapan Laju Disipasi Deltametrin Menggunakan Model Lingkungan Perairan” merupakan jenis rancangan penelitian eksperimental karena terdapat perlakuan terhadap subjek uji, subjek uji yang dimaksud disini adalah air.
B. Variabel Penelitian dan Definisi Operasional
1. Variabel Penelitian
a. Variabel bebas. Variabel bebas dalam penelitian ini adalah konsentrasi pestisida deltametrin yang ditambahkan.
b. Variabel tergantung. Variabel tergantung dalam penelitian ini adalah jumlah ikan yang mati dan konsentrasi residu pestisida deltametrin dalam air.
2. Definisi Operasional
a. Deltametrin yang dianalisis merupakan pestisida golongan piretroid. b. Sistem kromatografi gas yang digunakan adalah seperangkat alat
kromatografi gas yang dilengkapi dengan detektor ECD 63Ni
c. Parameter validasi metode analisis yang diamati dalam penelitian ini adalah akurasi, presisi, linearitas, LOD, dan LOQ
C. Bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian ini adalah formula pestisida deltametrin (Decis®2,5EC), baku deltametrin, standar DCB (Dekaklorobifenil), metanol (p.a, E. Merck), aquadest (Laboratorium Analisis Instrumental Farmasi USD), aquabidest (Laboratorium Analisis Instrumental Farmasi USD), sampel air sumur dari rumah Bapak Bambang yang berada di Jalan Mawar No 6A, Rt 04/Rw 04, Maguwoharjo, Depok Sleman, DIY.
D. Alat Penelitian
Alat yang digunakan dalam penelitian ini adalah komatografi gas (HP, GC-5890 Series II) dilengkapi dengan detektor ECD 63Ni, Kolom SPE C18 yang
berisi 1 g C18 (SPE C18 1 g) dan yang berisi 200 mg C18 (SPE C18 0,2 g) (Bond
E. Tata Cara penelitian
1. Optimasi dan Validasi Metode Analisis
a. Pembuatan larutan stok deltametrin (2,575x10-1 μg/μL). Ditimbang 51,5 mg baku deltametrin, dilarutkan dalam 5,0 ml toluen. Kemudian diambil 25 μL, dilarutkan dalam 1000 μL toluen sehingga didapatkan baku deltametrin dengan konsentrasi 2,575x10-1μg/μL.
b. Pembuatan larutan intermediet ( 2,575x10-3 dan 2,575x10-2 μg/μL). Diambil 1 dan 10 μL stok larutan baku deltametrin 2,575x10-1 μg/μL,
diuapkan hingga kering, masing-masing ditambah 100 μL toluen sehingga diperoleh larutan intermediet dengan konsentrasi 2,575x10-3 μg/μL (intermediet A) dan 2,575x10-2μg/μL (
intermediet B). Larutan ini kemudian digunakan sebagai larutan stok dalam pembuatan kurva baku dan kurva baku adisi deltametrin.
deltametrin/DCB dan menentukan sensitivitas alat dengan menghitung LOD.
d. Presisi kromatografi gas. Presisi kromatografi gas dihitung dari % RSD luas puncak dan waktu retensi (tR) DCB dari kurva baku.
e. Optimasi SPE C18. Satu mikroliter larutan stok deltametrin konsentrasi
2,575x10-1 μg/μL diencerkan dalam air sampai volume 200,0 mL sehingga diperoleh konsentrasi 1,288 x10-6μg/μL, dimasukan dalam SPE C18 1 g dan SPE C18 0,2 g yang sebelumnya telah dikondisikan
menggunakan 3 mL metanol dan 3 mL aquabidest. Selanjutnya dicuci dengan 3 mL aquabidest. Pada SPE C18 1,0 g deltametrin dielusi dengan
aseton sedangkan pada SPEC18 0,2 g deltametrin dielusi dengan metanol.
Eluat diuapkan hingga kering. Ditambah 7,5 μg standar DCB dan 50 μL toluen. Sebanyak 1 μL diinjeksikan ke sistem kromatografi gas yang sudah optimum.
f. Optimasi pembersihan wadah. Dibuat dua larutan deltametrin dengan konsentrasi 1,288 x10-6μg/μL. Larutan pertama dimasukkan dalam SPE C18, wadah dibilas. Larutan kedua dimasukan dalam SPE C18, wadah
tidak dibilas metanol. Dielusi dengan 20 mL metanol. Eluat diuapkan hingga kering. Ditambah 7,5 μg standar DCB dan 50 μL toluen. Sebanyak 1 μL larutan diinjeksikan ke sistem kromatografi gas yang sudah optimum.
intermediet A dan 1, 2, dan 4 μL larutan intermediet B diencerkan dengan air hingga volume 200,0 mL. Larutan deltametrin dimasukkan dalam SPE C18 dan dielusi dengan 20 mL metanol. Eluat diuapkan
hingga kering. Ditambah 7,5 μg standar DCB dan 50 μL toluen. Sebanyak 1 μL larutan diinjeksikan ke sistem kromatografi gas yang sudah optimum. Proses ini dilakukan sebanyak tiga kali replikasi. Hasil pembacaan alat digunakan untuk menghitung % recovery, presisi, pengaruh preparasi sampel terhadap hasil akhir dan LOQ.
2. Penentuan Konsentrasi Deltametrin Dalam Air yang Diaplikasikan
pada Laju Disipasi Deltametrin
Empat belas aquarium yang berisi 40 L air sumur dibagi dalam 7 kelompok, masing-masing kelompok 2 aqurium. Setiap aquarium diberi label kontrol, 1, 2, 3, 4, 5, dan 6 dengan konsentrasi deltametrin 0,025; 0,304; 3,700; 8,512; 19,578; dan 45,029 μg/L. Masing-masing aquarium diisi 10 ekor ikan nila.
Pengamatan jumlah ikan yang mati dilakukan pada masing-masing aquarium mulai jam ke-0 hingga 96. Selain itu konsentrasi deltametrin ditetapkan pada jam ke-0 dan 96 dengan cara diekstraksi dengan SPE C18.
3. Penetapan Laju Disipasi Deltametrin Menggunakan Model
Lingkungan Perairan
Enam aquarium yang berisi 40 L air sumur dibagi dalam 3 kelompok, masing-masing kelompok 2 aqurium. Setiap aquarium diberi label kontrol, 1, dan 2 dengan konsentrasi deltametrin 0,1668 dan 0,3336 μg/L. Masing-masing aquarium diisi 10 ekor ikan nila.
Konsentasi deltametrin dalam air ditetapkan pada hari 0, 1, 2, 3, 5, 7, dan 14 dengan cara diekstraksi dengan SPE C18. Eluat diuapkan hingga
kering. Ditambah 7,5 μg standar DCB dan 50 μL toluen. Sebanyak 1 μL
diinjeksikan ke sistem kromatografi gas yang sudah optimum
F. Tata Cara Evaluasi Hasil
1. Sensitivitas kromatografi gas
a. Linearitas. Linearitas ditentukan dari koefisien korelasi (r) yang diperoleh dari kadar dan rasio luas puncak deltametrin/DCB dari data penentuan kurva baku ke dalam regresi linear.
b. Sensitivitas. Sensitivitas alat dapat ditentukan dengan menghitung LOD dengan rumus:
3,3 � �
Keterangan: Sa : standar deviasi dari intercept kurva baku dan b : slope
2. Validasi Metode dan penetapan laju disipasi
a. Akurasi. Akurasi dapat dihitung dengan rumus: Perolehan Kembali (recovery) = � � �
b. Presisi. Presisi dapat dihitung dengan rumus: Kesalahan Acak (% RSD) = � � �� � �
ℎ � − � 100%
c. Limit of Quantitation. Limit Of Quantitation (LOQ) dapat dihitung dengan rumus:
3,3 � �
Keterangan: Sa : standar deviasi dari intercept kurva adisi dan b : slope
d. Pengaruh Matriks terhadap Prosedur Analisis. Pengaruh matriks terhadap prosedur analisis ditentukan dengan membandingkan antara slope kurva baku dengan kurva adisi. Pengaruh prosedur analisis ditetapkan oleh signifikansi perbedaan slope.
G. Rancangan Penelitian
Gambar 5. Aquarium yang berisi 40 L air dan ikan nila
Metode Analisis
a. Optimasi SPE
b. Validasi metode
Sampling hari 0, 1, 2, 3,
5, 7, dan 14
Analisis
Evaluasi laju disipasi
Hipotesis I
35
BAB IV
HASIL DAN PEMBAHASAN
Penelitian yang berjudul “Validasi Metode Analisis Deltametrin dalam Air dan Aplikasinya pada Penetapan Laju Disipasi Deltametrin Menggunakan Model Lingkungan Perairan” dilakukan untuk mengetahui disipasi deltametrin dalam lingkungan perairan. Kadar residu pestisida deltametrin yang berada dalam lingkungan air sangat kecil sehingga diperlukan metode yang sensitif, salah satunya menggunakan kromatografi gas detektor penangkap elektron dengan pembersihan dan pemekatan sampel. Kromatografi gas detektor penangkap elektron dipilih karena memiliki batas deteksi hingga 0,05-1 pikogram. Penelitian ini dimulai dari uji kesesuaian sistem kromatografi gas detektor penangkap elektron diikuti dengan optimasi preparasi sampel kemudian validasi metode analisis dan aplikasinya, yaitu penetapan laju disipasi deltametrin dalam lingkungan perairan.
dibudidayakan, dan banyak dikonsumsi karena dagingnya empuk, tebal, lembut dan enak (Sutanto, 2012).
A. Metode Analisis Deltametrin dalam Air
1. Uji Kesesuaian Sistem
Uji kesesuaian sistem merupakan bagian terpenting dari metode kromatografi gas dan kromatografi cair yang berfungsi untuk memastikan bahwa sistem yang akan digunakan dapat menghasilkan akurasi dan presisi yang dapat diterima, sehingga instrumen dapat digunakan untuk analisis (Anonim b, 2001). Dalam penelitian ini uji kesesuaian sistem dilakukan dengan cara optimasi instrumen kromatografi gas, sensitivitas kromatografi gas, presisi kromatografi gas, dan linearitas kromatografi gas.
a. Optimasi instrumen kromatografi gas
Tabel V. Hasil optimasi kromatografi gas
Parameter Hasil optimasi
Injektor
Injektor Split
Kecepatan alir total gas 100 mL/menit
Coumn head pressure 100 kPa
Kecepatan alir septum purge 10 mL/menit
Suhu 235 °C
Volume injeksi 1μL
Waktu sampling 0,2 menit
Oven
Kolom CHROMPACK, CPSil.5.25m id 0,22 nm
Suhu
180°C (3 menit), 15 °C /menit; 260 °C (15 menit), 30 °C /menit; 265 °C (7menit)
Kecepatan alir gas 1 mL/menit
Detektor
Detektor ECD 63Ni
Suhu 300 °C
Auxiliary gas 10 mL/menit
b. Sensitivitas kromatografi gas
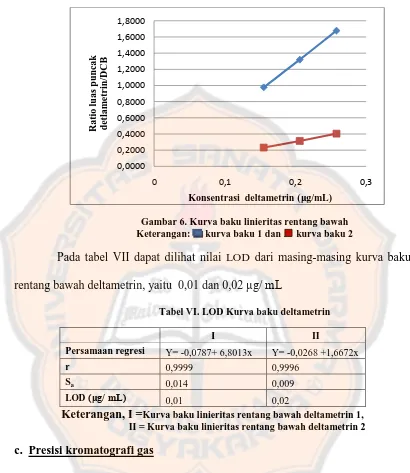
Gambar 6. Kurva baku linieritas rentang bawah Keterangan: kurva baku 1 dan kurva baku 2
Pada tabel VII dapat dilihat nilai LOD dari masing-masing kurva baku rentang bawah deltametrin, yaitu 0,01 dan 0,02 μg/ mL
Tabel VI. LOD Kurva baku deltametrin
I II
Persamaan regresi Y= -0,0787+ 6,8013x Y= -0,0268 +1,6672x
r 0,9999 0,9996
Sa 0,014 0,009
LOD (μg/ mL) 0,01 0,02
Keterangan, I =Kurva baku linieritas rentang bawah deltametrin 1, II = Kurva baku linieritas rentang bawah deltametrin 2
c. Presisi kromatografi gas
Presisi instrumen kromatografi gas dilihat dari tR danluas puncak DCB.
Tahap ini dilakukan dengan cara penyuntikan 6 kali baku DCB kemudian dihitung % RSD dari tR dan luas puncak. Tabel VI merupakan tR dan luas puncak DCB
Tabel VII. % RSD Waktu retensi dan luas puncak DCB
Parameter ± SD % RSD
Waktu retensi 15,07 ± 0,01 0,08
Luas puncak 151 ±158,31 10
Gambar 7. Kromatrogram DCB (0,15 μg/μL)
Berdasarkan hasil pesisi tR dan luas puncak dari DCB maka dalam
penelitian ini digunakan DCB sebagai standar internal, yang berfungsi untuk mengoreksi hasil determinasi kromatografi gas yang digunakan.
d. Linearitas kromatografi gas
Linearitas merupakan kemampuan dari prosedur analisis untuk memperoleh hasil percobaan yang berbanding lurus dengan konsentrasi analit dalam sampel (ICH, 2005). Sebagai parameter adanya hubungan linear digunakan koefisien korelasi (r) pada regresi linear Y= A + Bx.
Pada penelitian ini kurva baku dibuat setiap kali memulai proses penetapan kadar. Hal ini dimaksudkan agar kurva yang dibuat merupakan kurva yang teraktual dengan kondisi sistem kromatografi gas yang sudah ada. Karena dalam rentang waktu tertentu kurva baku yang ada biasa saja memiliki nilai r yang
sama dengan kurva baku yang sebelumnya namun tidak sama nilai slope (b) yang terbentuk. Untuk mendapatkan regresi linear dilakukan dengan cara mengeplotkan antara konsentrasi (sebagai sumbu x) dan luas puncak (sebagai sumbu y).
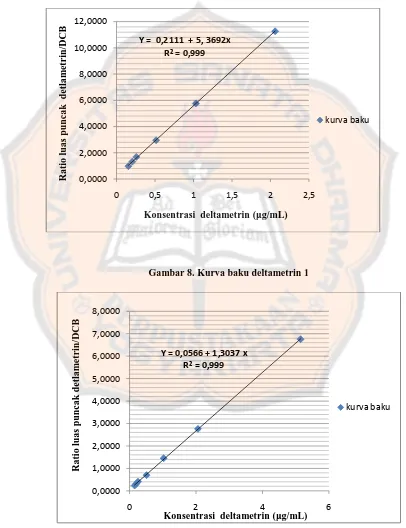
Gambar 8. Kurva baku deltametrin 1
Gambar 9. Kurva baku detlametrin 2
Y = 0,2111 + 5, 3692x
Konsentrasi deltametrin (μg/mL)
Gambar 7 diperoleh nial r2 0,999 dan pada gambar 8 diperoleh nilai r2=0,999. Untuk mendapatkan r maka data konsentrasi dan ratio luas puncak deltametrin/DCB dimasukan dalam program powerfit sehingga didapatkan nilai r 0,9999 untuk kurva baku deltametrin 1 dan r 0,9999 untuk kurva baku deltametrin 2. Nilai r2 maupun nilai r yang dihasilkan sesuai dengan Chan, Lee, Herman, dan Xue (2004) yaitu koefisien kolerasi (r) > 0,9985 atau r2 ≥ 0,997. Sehingga dapat disimpulkan bahwa detektor memberikan respon yang linear terhadap konsentrasi analit pada kisaran konsentari 0,155-5,15 μg/mL.
Berdasarkan hasil optimasi, sensitivitas, presisi dan linearitas kromatografi gas maka dapat disimpulkan bahwa sistem kromatografi gas detektor penangkap elektron dapat digunakan untuk analisis deltametrin dalam air.
2. Preparasi sampel
Dalam penelitian ini dilakukan optimasi pada tahapan preparasi sampel yaitu optimasi fase diam SPE C18 dan optimasi pembersihan wadah. Hal ini
bertujuan untuk mendapatkan hasil optimal dalam proses pengayaan deltametrin.
a. Optimasi SPEC18
Pemilihan volume fase diam dilakukan untuk mendapatkan sistem SPE yang selektif dan efisien. Fase diam yang digunakan dalam penelitian ini adalah C18, sehingga merupakan sistem kromatografi fase terbalik. Digunakan fase diam
C18 karena deltametrin merupakan senyawa yang non polar yang mempunyai log
P 4,6 (Anonim g, 2002) sehingga natinya akan tertahan dalam SPE C18 yang
metanol kemudian aquabidest. Digunakan metanol karena memiliki viskositas yang rendah sehingga dapat membasahi seluruh partikel C18 pada kolom.
Kemudian dialiri aquabidest untuk menciptakan nilai pH yang sama ketika tahap retensi.
Setelah dilakukan pengkondisian, sampel air yang mengandung pestisida deltametrin dimasukan ke dalam SPEC181 g dan SPE C180,2 g. Pada SPEC181
g dielusi dengan aseton sedangkan pada SPEC180,2 g dielusi dengan metanol.
Pada SPE C181 g dibutuhkan 50 mL aseton untuk mengelusi deltametrin
yang terjerap sedangkan pada SPE C180,2 mg dibutuhkan metanol 20 mL untuk
mengelusi deltametrin yang terjeap pada kolom. Oleh karena itu SPE C180,2 g
dipilih karena lebih efisien dibandingkan dengan SPE C18 1 g dan pelarut yang
Gambar 10. Kromatogram deltametrin yang dielusi menggunakan metanol
b. Optimasi pembersihan wadah
Optimasi pembersihan wadah dalam penelitian ini bertujuan untuk mendapatkan pembersihan wadah secara kuntitatif, sehingga tidak ada deltametrin yang tertinggal dalam wadah terutama pada dinding-dinding wadah. Optimasi ini dilakukan dengan cara membilas wadah sampel (labu takar 200 mL) dengan 3 mL metanol dan wadah yang tidak dibilas dengan metanol pada tahapan retensi sampel.
Tabel VIII menunjukan % recovery wadah yang dibilas dan wadah yang tidak dibilas menggunakan metanol. % recovery yang didapat pada wadah yang dibilas metanol sebesar 90,91% sedangkan wadah yang tidak dibilas metanol sebesar 64,04%. Hal ini dapat terjadi karena masih ada deltametrin yang tertinggal pada dinding wadah yang tidak dibilas metanol. Oleh karena itu dapat disimpulkan perlu dilakukan pembilasan wadah sampel menggunakan metanol.
Tabel VIII. % Recovery wadah yang dibilas dan tidak dibilas metanol
Validasi metode analisis merupakan suatu proses yang digunakan untuk membuktikan bahwa metode analisis tersebut dapat memberikan hasil seperti yang diharapkan dengan kecermatan dan ketelitian yang memadai (Mulja dan Suharman, 1995). Dalam penelitian ini validasi metode yang digunakan adalah akurasi, presisi, LOQ, dan pengaruh matriks terhadap prosedur analisis.
a. Akurasi
Akurasi adalah ketepatan prosedur analisis yang menyatakan kedekatan antara suatu nilai yang sebenarnya. Dalam penelitian ini akurasi ditentukan dengan metode penambahan baku (standard addition method). Metode adisi biasanya digunakan pada matriks sampel yang kompleks. Hal ini dilakukan karena matriks mengandung banyak komponen lain yang dapat mengganggu dalam pengukuran sehingga konsentrasi tidak tepat. Metode penambahan baku dilakukan dengan menambahkan sejumlah tertentu baku kedalam sampel. Akurasi dinyatakan dengan % recovery.
keseluruhan metode yang digunakan untuk penetapan kadar deltametrin pada air tidak menghilangkan deltametrin selama proses analisis. Nilai rasio luas puncak deltametrin/DCB yang diperoleh dari baku adisi selanjutnya dimasukkan kedalam persamaan kurva baku yakni Y = 0,05662 + 1,30367 x.
Tabel IX menunjukkan hasil penetapan % recovery deltametrin untuk keseluruhan proses analisis. Dari hasil penelitian semua replikasi masuk dalam kisaran persyaratan perolehan kembali. Sehingga dapat disimpulkan bahwa metode ini memiliki akurasi yang baik.
Tabel IX. Hasil % recovery Replikasi I Replikasi II Replikasi III
Menurut
syarat menurut AOAC kurang dari 30%. Tabel X menunjukan % RSD yang didapatkan dalam penelitian. Berdasarkan hasil tersebut maka dapat disimpulkan bahwa metode yang digunakan memiliki presisi yang baik.
Tabel X. % CV dari standar adisi
Persyaratan
Limit of Quantification (LOQ) merupakan konsentrasi terkecil dari analit dalam sampel uji yang masih dapat dianalisis secara kuantitatif. Dalam penelitian ini LOQ didapatkan dari perhitungan menggunakan rumus:
��� =3,3 � �
Untuk mendapatkan nilai Sa (standar deviasi intercept kurva adisi)
dengan memasukkan konsentrasi dan luas puncak pada program powerfit sehingga nantinya didapatkan nilai Sa. Dari penelitian yang dihasilkan didapatkan
d. Pengaruh matriks terhadap prosedur analisis
Pengaruh matriks terhadap prosedur analisis pada penelitian ini bertujuan untuk mengetahui apakah matriks yang digunakan memberikan pengaruh terhadap prosedur analisis yang dilakukan. Matriks yang digunakan pada penelitian ini adalah air. Ketika pengujian larutan baku untuk kalibrasi (penentuan linearitas) perlu dilakukan perbandingan slope dengan kurva adisi untuk melihat apakah terdapat perbedaan sensitivitas dari instrumen yang digunakan. Selain itu juga untuk melihat ketepatan estimasi antara kurva baku dengan kurva adisi terhadap jumlah dan distribusi dari titik-titik pengukuran (Ermer, Hon dan Miller, 2005).
Gambar 11. Hubungan kurva baku dan kurva adisi replikasi I,II,III Keterangan: kurva baku dan kurva adisi
Gamabar 11 menunjukan perbedaan dari kurva baku dan kurva adisi. Untuk mengetahai kebenaran hal tersebut makan dilakukan dengan uji signifikansi terhadap slope kurva baku dan kurva adisi. Uji signifikan yang
dilakukan adalah uji F dilanjutkan uji t (t-test) yang berfungsi untuk mengetahui signifikansi antara kurva baku dan kurva adisi.
Sebelum dilakukan uji t perlu dilakukan uji signifikansi dari standar deviasi slope kurva baku dan kurva baku standar adisi dengan menggunakan uji F dan dilihat apakan hasilnya signifikan atau tidak. Dari hasil perhitungan yang ditunjukan pada tabel XI dapat disimpulkan bahwa standar deviasi slope kurva baku dan kurva adisi tidak ada perbedaan yang signifikan.
Tabel XI. Uji F standar deviasi kurva baku dan adisi
Tahap selanjutnya dilakukan uji t menggunakan rumus: t =|b1−b2|
s �11+�12
dimana b1 merupakan slope kurva adisi dan b2 merupakan slope kurva baku standar adisi. Kemudian dilakukan perhitungan degree of freedom dengn persamaan:
�1 +�2−2
Hasil perhitungan yang ditunjukan dalam tabel XII dapat disimpulkan slope kurva adisi memberikan hasil yang signifikan terhadap kurva baku. Sehingga dapat disimpulkan matriks yang digunakan mempengaruhi prosedur analisis.
Tabel XII. Uji signifikansi slope kurva baku dan kurva adisi
α t Hitung t Tabel Kesimpulan 0,05 5,9261 2,75 Berbeda signifikan
Berdasarkan hasil uji optimasi dan validasi, maka dapat disimpulkan bahwa metode yang digunakan tervalidasi. Oleh karena itu dapat digunakan untuk analisis lebih lanjut.
B. Penentuan Konsentrasi Deltametrin dalam Air yang Diaplikasikan dalam Laju Disipasi Deltametrin
Tahapan ini dilakukan untuk mencari konsentasi deltametrin yang tidak mematikan pada ikan nila, yang selanjutnya digunakan pada tahap uji disipasi deltametrin dalam air. Konsentrasi deltametrin yang tidak mematikan ikan didapatkan dengan cara memasukan formula deltametrin dalam aquarium yang berisi 40 L air dengan konsentasi berturut-turut 0,025; 0,304; 3,700; 8,512; 19,578; dan 45,029 μg/L dan diamati ikan yang mati selama 96 jam. Tabel XII merupakan jumlah ikan yang mati hingga 96 jam.
Tabel XIII. Rata-rata jumlah ikanyang mati hingga 96 jam
C deltametrin
menimbulkan efek kronis atau 1% dari LC50 asymptotic; kedua, konsentrasi yang
digunakan adalah konsentasi diatas Limit of Quantification (LOQ).
LC50 deltametrin terhadap ikan nila dalam penelitian ini adalah 5,55 μg/L.
Tabel XIV merupakan konsentrasi deltametrin yang terukur. Berdasarkan tabel XIV maka konsentasi deltametrin yang terukur pada jam ke-0 yaitu 0,17 μg/L digunakan sebagai konsentrasi I pada tahap disipasi deltametrin pada air karena konsentrasi 0,17 μg/L diatas LOQ yaitu 0,06 μg/L (sesuai dengan persyaratan kedua menurut OECD) sedangkan untuk konsentrasi II, dua kali dari konsentrasi I yaitu 0,34 μg/L.
Tabel XIV. Konsentrasi deltametrin yang terukur
C yang
C. Disipasi Deltametrin Dalam Lingkungan Perairan
dan 14. Hasil penelitian ditunjukan oleh tabel XV dan dapat digambarkan seperti gambar 12.
Tabel XV. Rata-rata Kadar terukur deltamerin
Hari
Tabel XIV menunjukan bahwa kadar deltamerin dalam air diatas LOD (0,02 μg/ mL) tetapi di bawah LOQ (0,06 μg/L) serta berada dalam kisaran trace (analisis kelumit) yang memiliki ketidakpastian yang besar.
Gambar 12 menunjukan bahwa kontrol yang digunakan tidak mengandung deltametrin, pada konsentasi 0,17 μg/L kadar deltametrin hanya teramati pada hari ke-0 dan pada hari 1 hingga 14 tidak terdeteksi. Pada konsentrasi 0,34 μg/L deltametrin hanya teramati pada hari ke-0 hingga ke-1 dan pada hari ke-2 hingga ke-14 tidak terdeteksi. Hal ini menunjukan bahwa deltametrin dalam air akan cepat hilang, dengan laju disipasi model biphasic.
Laju disipasi deltametrin didapatkan dari hubungan antara ln kadar vs hari, nilai slope merupakan laju disipasi deltametrin dalam air. Gambar 13 merupakan kurva laju disipasi deltametrin dalam air. Berdasarkan gambar 13 laju disipasi deltametrin merupakan laju disipasi dengan model biphasic, yaitu laju disipasi ditentukan melalui fase penurunan. Pada gambar diatas mulai dari hari ke-0 hingga ke 2. Dari hubungan antara ln kadar vs hari maka didapatkan persamaan Y= 2,22767 – 1,3366x untuk C1 dan Y= 5,44060-2,4532x untuk C2 sehingga didapatkan laju disipasi deltametrin dalam air sebesar 1,34 dan 2,45 μg/hari untuk C1 dan C2. Besarnya laju disipasi dimungkinkan karena situs adsopsi aktif pada permukaan biotik dan non biotik sangat besar sehingga diduga sebagian deltametrin masuk ke dalam biota ikan. Menurut Sandjaja (2013), terjadi akumulasi deltametrin dalam ikan, yang ditunjukan pada gambar 14, selain itu hilangnya deltametrin dalam air kemungkinan disebabkan karena lingkungan, yaitu terjadi fotodegradasi (Agus, 2002)
Gambar 14. Kurva akumulasi deltametrin dalam ikan nila
D. Karakterisasi Resiko Residu Pestisida Deltametrin dalam Air
Tahapan penelitiaan yang telah dilakukan menggunakan pestisida deltametrin, dimana pestisida deltametrin memiliki efek yang merugikan bagi lingkungan. Salah satu efek tersebut adalah terjadinya kematian pada biota air jika air tercemar pestisida deltametrin dalam dosis yang tinggi, bahkan bisa menimbulkan kematian pada manusia sehingga perlu dilakukannya karaterisasi resiko residu pestisida deltametrin dalam air. Berdasarkan tahapan penelitian yang telah dilakukan, karakterisasi resiko residu pestisida deltametrin berdasarkan dari kelarutan deltametrin dalam air sangat kecil, yaitu 0,0002 mg/L dan laju disipasi deltametrin relatif cepat, sedangkan asupan air minum manusia 2 L/hari, jadi deltametrin yang masuk ke dalam air minum adalah 4x10-4 mg/kg, lebih kecil dari Acceptable Daily Intake (ADI) yaitu 0,01 mg/kg BB. ADI adalah batasan jumlah suatu bahan tambahan pangan yang dapat dikonsumsi per kg berat badan per hari
55
BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Berdasarkan dari hasil penelitian yang telah dilakukan, maka dapat disimpulkan:
1. Kromatografi gas detektor penangkap elektron memiliki validitas yang baik, sensitivitas dengan nilai LOD 0,02 μg/mL dan LOQ 0,06 μg/L; memiliki presisi dengan nilai RSD berkisar antara 0,47- 4,24 %; akurasi dengan nilai recovery berkisar antara 85,13 - 102,78 %, dan kisaran linieritas antara 0,15-5,15 μg/mL dengan r 0,9999 oleh karena itu penetapan laju disipasi deltametrin dalam lingkungan perairan dapat dilakukan dengan metode pengayaan mengunakan SPE C18.
2. Mengingat kelarutan deltametrin dalam air rendah (0,2 μg/L) dan laju disipasi deltametrin dalam lingkungan perairan relatif cepat oleh karena itu air yang tercemar pestisida deltametrin aman dikonsumsi manusia.
B. Saran
Berdasarkan dari hasil penelitian yang telah dilakukan, maka saran yang dapat penulis berikan adalah:
1. Perlu dilakukan analisis laju disipasi residu pestisida deltametrin dalam lingkungan non biotik, misalnya sedimen.
DAFTAR PUSTAKA
Agus, 2002, Penetapan Laju Degradasi Pestisida Deltametrin Dalam Air Secara GC-ECD.
Anonim a, 1997, Metode Pengujian Residu pestisida dalam Hasil Pertanian, Komisi pestisida Departemen Pertanian Jakarta.
Anonim b, 2001 , System Suitability Tests For Quantitative Chromatographic Method, http://www.cvg.ca/images/SystemStabilityTests.pdf, diakses tanggal 21 Oktober 2013.
Anonim c, 2002, Deltamethri, http://ec.europa.eu/food/plant/ protection/ evaluation/existactive/list1- 31_en, diakses tanggal 21 Oktober 2013. Anonim d, 2007, Theory of Calibration & Validation,
www.datainstrumentsindia.tristonsoftware.com/datainstrumentsindia/UI/U serPages/thCalibration.aspx,diaksestanggal 21 Oktober 2013.
Anonim e, 2009, Deltamethrin Technical Fact Sheet, NCIP, Oregon,p. 7-8.
Anonim f, 2011, Pestisida: Tingkat Pemakaian oleh Petani Mengkhawatirkan, http://bisnis-jabar.com/index.php/berita/pestisida-tingkat-pemakaian-oleh-petani-mengkhawatirkan, diakses tanggal 29 Oktober l 2013.
Anonim g, 2012, Standard and High-Speed Sample Enrichment and Clean-Up Sample Preparatio, http:// www.idex-hs.com/ about/d ata_sheets/ Sample_Enrichment.pdf diaksesa pada 28 Oktober 2013.
Association of Analytical Communities, 2007, Official Methods of Analysis of AOAC International 18th edition, AOAC International, Gaithersburg Maryland, pp 28-34.
Chan, Chung C., Y.C. Lee, Herman Lam, Xue-Ming Zhang, 2004, Analytical Method Validation and Instrument Performance Verification, A John Wiley & Sons, Inc., Publication, United Stated of America, p. 16-17, 108. Djojosumarto, P., 2008, Pestisida dan Aplikasinya, PT.Agromedia Pustaka,
Jakarta, pp.1,2,69.
Ermer, J., Hon H., Miller, 2005, Method Validation in Pharmaceutical Analysis, Wiley-VCH Verlag GmbH &Co. KGaA, Weinheim, Germany, pp. 87, 313.
Fishbein, L., 1972, Chomatography of Enviromental Hazard, 161, Vol 1, Carcinogens, Mutagens and Teratogens, Elseiver Pub. Co., Amsterdam. Gandjar, I. G. dan Rohman, A., 2007, Kimia Farmasi Analisis, cetakan kedua, Penerbit Pustaka Pelajar, Yogyakarta, pp. 378, 389-390.
Grob, L.R., 1995, Modern Practice of Gas Chromatography, John Wiley and Sons Inc., New York. p. 291-295
Harmita, 2004, Petunjuk Pelaksaaan Validasi Metode dan Cara Perhitungan, Majalah Ilmu Farmasi, Departemen Farmasi FMIPA UI, Jakarta, pp.117-128.
Hendayana, S., 2006, Kimia Pemisahan Metode Kromatografi dan Elektroforesis Modern, PT. Remaja Rosdakarya, Bandung, pp. 21-25.
Lu, F.C., 1995, Toksikologi Dasar, 327-329 diterjemahkan oleh Edi Nugroho, Edisi II, UI Press, Jakarta
Mc Nair H.M. and Bolelli, 1988, Dasar Kromatografi Gas, diterjemahkan oleh Kosasih Padmawinata, Penerbit ITB Bandung, pp. 1, 7-13.
Moechtar J., Darmawat A., Vani E., 2002, Validasi Metode Penetapak Kadar Deltametrin dalam Kubis (Brassica Oleracea Var. Capitata) Menggunakan Kromatografi Gas Dengan Detektor Ionisasi Nyala
National Pesticide Telecommunications Network, 1998, Pyrethrins and Pyrethroids, Oregon State University, Corvallis, pp. 1-3.
National Pesticide Information Center, 2010, Deltamethrin Technical Fact Sheet, Oregon State University, Corvallis, pp. 1-11.
Nurhamida , S., 20005, Pestisida untuk Pertanian dan Kehutanan, Departemen Pertanian RI, Jakarta, p.202.
Organization for Economic Co-operation and Development, 2002, Persistence, Bioaccumulative, and Toxic Pesticides in OECD Member Countries, OECD Environment, Health and Safety Publication, Paris, p. 19
Probowo, 2001, Validasi Metode Pestisida Deltametrin Dalam Lingkungan Budaya Cabai Merah Menggunakan Gas Chromatography-Electron Capture Detector (GC-ECD)