OPTIMASI DAN VALIDASI METODE KROMATOGRAFI
CAIR KINERJA TINGGI (KCKT) PADA PENETAPAN
KADAR SIKLAMAT DALAM MINUMAN RINGAN
SKRIPSI
OLEH:
BINTANG DWIPUTRA
NIM 091501050
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
OPTIMASI DAN VALIDASI METODE KROMATOGRAFI
CAIR KINERJA TINGGI (KCKT) PADA PENETAPAN
KADAR SIKLAMAT DALAM MINUMAN RINGAN
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
BINTANG DWIPUTRA NIM 091501050
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
OPTIMASI DAN VALIDASI METODE KROMATOGRAFI
CAIR KINERJA TINGGI (KCKT) PADA PENETAPAN
KADAR SIKLAMAT DALAM MINUMAN RINGAN
OLEH:
BINTANG DWIPUTRA 091501050
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: 16 Agustus 2014
Pembimbing I, Panitia Penguji,
Drs. Fathur Rahman Harun, M.Si., Apt Prof. Dr. Siti Morin Sinaga, M.Sc., Apt. NIP 195201041980031002 NIP 195008281976032002
Pembimbing II, Drs. Fathur Rahman Harun, M.Si., Apt. NIP 195201041980031002
Prof. Dr.rer.nat. E. De Lux Putra, SU., Apt. Drs. Nahitma Ginting, M.Si., Apt NIP 195306191983031001 NIP 195406281983031002
Dra. Sudarmi, M. Si., Apt.
NIP 195409101983032001
Medan, September 2014 Fakultas Farmasi
Universitas Sumatera Utara Dekan,
KATA PENGANTAR
Alhamdulillah, segala Puji dan syukur kehadirat Allah SWT yang telah
melimpahkan rahmat, hidayah, dan kemudahan kepada penulis sehingga dapat
menyelesaikan penelitian dan penyusunan skripsi dengan judul “Optimasi dan
Validasi Metode Kromatografi Cair Kinerja Tinggi (KCKT) pada Penetapan
Kadar Siklamat dalam Minuman Ringan”. Skripsi ini diajukan sebagai salah satu
syarat guna memperoleh gelar Sarjana Farmasi dari Fakultas Farmasi Universitas
Sumatera Utara.
Pada kesempatan ini penulis menyampaikan ucapan terimakasih yang
sebesar-besarnya kepada Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku
Dekan Fakultas Farmasi Universitas Sumatera Utara yang telah memberikan
fasilitas selama masa pendidikan. Bapak Drs. Fathur Rahman Harun, M.Si., Apt.,
dan Bapak Prof. Dr. rer. nat. Effendy De Lux Putra, S.U., Apt., yang membimbing
penulis dengan penuh kesabaran dan tanggung jawab selama penelitian hingga
selesainya penyusunan skripsi ini. Bapak dan Ibu staf pengajar Fakultas Farmasi
Universitas Sumatera Utara yang telah mendidik selama perkuliahan. Bapak
Koordinator Laboratorium Penelitian yang telah memberikan fasilitas, petunjuk
dan membantu selama penelitian. Ibu Prof. Dr. Siti Morin Sinaga, M.Sc., Apt.,
Bapak Drs. Nahitma Ginting, M.Si., Apt., dan Ibu Dra. Sudarmi, M.Si., Apt.,
selaku dosen penguji yang memberikan masukan, kritik, arahan dan saran dalam
penyusunan skripsi ini dan Ibu Sumaiyah, S.Si., M.Si., Apt., selaku dosen
penasehat akademik yang telah banyak membimbing penulis selama masa
Penulis juga mengucapkan terima kasih dan penghargaan yang tiada
terhingga kepada Ayahanda Kamaluddin, dan Ibunda Ns. Chuchum Sumiarty,
S.Kep. CVRN tercinta, atas doa dan pengorbanannya dengan tulus dan ikhlas,
juga kepada Kakanda Surya Gemilang, dan Adinda Sukma Juwita, serta
teman-teman mahasiswa Farmasi Angkatan 2009 yang selalu setia memberi doa,
dorongan dan motivasi kepada penulis selama menempuh pendidikan S-1
Farmasi.
Penulis menyadari bahwa skripsi ini masih banyak kekurangannya, oleh
karena itu sangat diharapkan kritik dan saran yang bersifat membangun dari
semua pihak guna perbaikan skripsi ini. Akhir kata penulis berharap semoga
skripsi ini bermanfaat bagi ilmu pengetahuan khususnya bidang farmasi.
.
Medan, Agustus 2014 Penulis,
OPTIMASI DAN VALIDASI METODE KROMATOGRAFI CAIR KINERJA TINGGI (KCKT) PADA PENETAPAN KADAR
SIKLAMAT DALAM MINUMAN RINGAN
Abstrak
Penggunaan bahan tambahan pangan dewasa ini sangat beragam, dari pengawet sampai pemberi aroma dan pemanis. Pemanis buatan yang termasuk dalam bahan tambahan pangan adalah pemanis pengganti gula (sukrosa), yang salah satunya adalah siklamat. Penggunaan siklamat dibatasi oleh BPOM karena memiliki efek samping, yaitu dapat menyebabkan kanker prostat. Metode penetapan kadar siklamat telah ditetapkan oleh BPOM untuk sediaan sirup, tetapi keberhasilan suatu metode tergantung daripada matriks sampel sehingga metode analisa siklamat dalam sirup belum tentu dapat digunakan untuk sediaan lain. Tujuan penelitian ini adalah untuk melakukan optimasi dan validasi metode Kromatografi Cair Kinerja Tinggi (KCKT) pada penetapan kadar natrium siklamat dalam minuman ringan dan untuk mengetahui kesesuaian kadar natrium siklamat dalam minuman ringan yang beredar di pasaran yang ditetapkan secara KCKT dengan ketentuan yang ditetapkan BPOM.
Penelitian ini dilakukan dengan menggunakan alat KCKT Agilent dengan kolom Agilent C18 (150 x 4,6 mm). Jenis sediaan minuman ringan yang digunakan
adalah Teajus, Sisri, X-Teh, Nutrijeruk, Vitacool, and Segar Sari yang beredar di pasaran. Optimasi yang dilakukan pada penetapan kadar secara KCKT antara lain pH dapar fosfat dan komposisi fase gerak dapar fosfat dan methanol yang dideteksi dengan detektor UV-Vis pada panjang gelombang 201 nm.
Hasil penelitian menunjukkan bahwa komposisi fase gerak dapar fosfat pH 7,0 : methanol dengan perbandingan 70:30 menghasilkan kondisi kromatografi yang optimal dalam penetapan kadar Na siklamat dalam minuman ringan secara KCKT. Metode ini memberikan hasil akurasi dan presisi yang baik dengan % recovery = 101,98%, relatif standar deviasi (RSD) = 0,15%; batas deteksi (LOD) = 9,37 ppm dan batas kuantitasi (LOQ) = 31,25 ppm. Dari enam minuman ringan yang dianalisis, tiga di antaranya, yaitu Nutrijeruk, Vitacool, dan Segar Sari dapat ditentukan kadarnya secara KCKT, dimana kadar Nutrijeruk dan Vitacool yang diperoleh melebihi batas yang ditentukan oleh BPOM sementara Segar Sari memenuhi persyaratan yaitu mengandung Na Siklamat tidak lebih dari 1000 ppm. Sedangkan untuk jenis minuman Teajus, Sisri, dan X-Teh tidak dapat dianalisis dengan kondisi kromatografi yang dilakukan.
OPTIMIZATION AND VALIDATION OF HIGH PERFORMANCE LIQUID CHROMATOGRAPHY METHOD FOR CYCLAMATE
DETERMINATION IN SOFT DRINKS
Abstract
The use of food additives nowadays is varied, from preservatives to aromatics and sweeteners. Artificial sweetener included in food additives is a sweetener used to replace sugar (sucrose), such as cyclamate. The usage of cyclamate is limited by BPOM because of the adverse effect of cyclamate that may cause prostate cancer. BPOM made a method to determine cyclamate amount in syrup. However, a success of a method depends on the matrix of the sample used, therefore, the method used for syrup may not be able to be used for soft drinks. The purposes of this study were to optimize and validate the HPLC method for determination of cyclamate in soft drinks and to determine whether the concentration of cyclamate in soft drinks distributed in the markets is suitable according to the BPOM regulations.
This study was done with Agilent HPLC with Agilent C18 column (150 x
4,6 mm). The soft drinks used in this study were Teajus, Sisri, X-Teh, Nutrijeruk, Vitacool, and Segar Sari distributed in the market. The optimations of the HPLC method in determining the concentration of Na Cyclamate were phosphate buffer’s pH and mobile phase composition of phosphate buffer and methanol detected with UV-Vis detector at 201 nm.
The research showed that phosphate buffer pH 7.0 : methanol as mobile phase was the optimal chromatography condition in determining Na cylamate in soft drinks using High performance Liquid Chromatography. This method gave good accuration and precision with % recovery = 101.98%, relative standard deviation (RSD) = 0.15%; limit of detection (LOD) = 9.37 ppm and limit of quantitation (LOQ) = 31.25 ppm. There were six soft drink samples analyzed, three samples -Nutrijeruk, Vitacool, and Segar Sari- could be determined using HPLC where the concentrations of cyclamate in Nutrijeruk and Vitacool were higher than the concentration allowed by BPOM while Segar Sari was acceptable according to the BPOM regulations (not more than 1000 ppm) and the samples Teajus, Sisri, and X-Teh could not be determined using the chromatography condition used.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
PENGESAHAN SKRIPSI ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL .. ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... ... xiv
BAB I PENDAHULUAN .... ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 4
1.6 Kerangka Pikir Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 6
2.1 Natrium Siklamat ... 6
2.1.1 Sifat Fisikokimia ... 6
2.1.2 Penggunaan ... 6
2.2 Minuman Ringan ... 7
2.3 Kromatografi ... 7
2.3.1 Penggunaan Kromatografi ... 7
2.3.2 Puncak Asimetris ... 8
2.4 Kromatografi Cair Kinerja Tinggi (KCKT) ... 8
2.4.1 Cara Kerja KCKT ... 9
2.4.2 Komponen KCKT ... 10
2.4.3 Wadah Fase Gerak ... 10
2.4.4 Pompa ... 10
2.4.5 Injektor ... 11
2.4.6 Kolom ... 11
2.4.7 Detektor ... 12
2.4.8 Pengolahan Data ... 12
2.4.9 Fase Gerak ... 13
2.4.10Dapar ... 14
2.4.11Jenis Pemisahan Kromatografi Cair Kinerja Tinggi .... 14
2.5 Validasi Metode ... 15
2.5.1 Akurasi (Kecermatan) ... 15
2.5.2 Presisi (Keseksamaan) ... 15
2.5.3 Spesifitas (Selektifitas) ... 15
2.5.4 Batas Deteksi dan Batas Kuantitasi ... 15
2.5.5 Linearitas ... 16
2.5.6 Rentang (Kisaran) ... 16
2.5.8 Kekasaran (Ketangguhan) ... 16
BAB III METODE PENELITIAN ... 17
3.1 Tempat dan Waktu Penelitian ... 17
3.2 Alat dan Bahan ... 17
3.2.1 Alat ... ... 17
3.2.2 Bahan ... ... 17
3.3 Pengambilan Sampel ... 18
3.4 Prosedur Kerja ... 18
3.4.1 Pembuatan fase gerak ... 18
3.4.2 Pembuatan pelarut ... 18
3.4.3 Prosedur analisis menggunakan KCKT ... 18
3.4.3.1 Penyiapan kromatografi cair kinerja tinggi ... 18
3.4.3.2 Penentuan perbandingan fase gerak yang optimum .. ... 18
3.4.4 Analisis kualitatif ... 19
3.4.4.1 Uji identifikasi Na Siklamat ... 19
3.4.5 Analisis kuantitatif ... 19
3.4.5.1 Pembuatan larutan induk baku Na Siklamat BPFI ... 19
3.4.5.2 Pembuatan kurva kalibrasi Na Siklamat BPFI 19
3.4.5.3 Penetapan kadar sampel ... 20
3.4.5.4 Analisis data penetapan kadar secara statistik .. 20
3.4.6 Validasi metode ... 21
3.4.6.2 Presisi (keseksamaan) ... 22
3.4.6.3 Batas deteksi (LOD) dan batas kuantitasi (LOQ) 22 BAB IV HASIL DAN PEMBAHASAN ... 24
4.1 Penentuan pH dapar fosfat ... 24
4.2 Penentuan Komposisi Fase Gerak ... 25
4.3 Analisis Kualitatif ... 26
4.4 Analisis Kuantitatif ... 27
4.4.1 Penentuan kurva kalibrasi ... 27
4.4.2 Penetapan kadar analit dalam sampel yang dianalisis . 28 4.5 Hasil Uji Validasi ... 29
BAB V KESIMPULAN DAN SARAN ... 31
5.1 Kesimpulan ... 31
5.2 Saran ... 31
DAFTAR PUSTAKA ... 32
DAFTAR TABEL
Halaman
Tabel 4.1 Pengaruh pH dapar fosfat terhadap parameter kromatogram ... 24
Tabel 4.2 Pengaruh komposisi fase gerak terhadap parameter kromatogram ... 25
Tabel 4.3 Hasil penetapan kadar Na Siklamat dalam minuman ringan ... 28
DAFTAR GAMBAR
Halaman
Gambar 1.1 Kerangka Pikir Penelitian ... 5
Gambar 4.1 Kromatogram Na Siklamat secara KCKT menggunakan kolom Agilent Eclipse XDB (150 x 4,6 mm) dengan perbandingan fase gerak dapar fosfat : methanol (70 : 30) dan laju alir 1 ml/menit, volume penyuntikan 20 µl dan deteksi pada panjang gelombang 201 nm ... 26
Gambar 4.2 Kromatogram hasil spike secara KCKT menggunakan kolom Agilent Eclipse XDB (150 x 4,6 mm) dengan perbandingan fase gerak dapar fosfat : methanol (70 : 30) dan laju alir 1 ml/menit, volume penyuntikan 20 µl dan deteksi pada panjang gelombang 201 nm ... 27
DAFTAR LAMPIRAN
Halaman
Lampiran 1 Kromatogram penyuntikan larutan Na Siklamat untuk mencari pH dapar fosfat yang optimum pada analisis ... ... 34
Lampiran 2 Kromatogram penyuntikan larutan Na Siklamat untuk mencari komposisi fase gerak dapar fosfat : methanol yang optimum pada analisis ... 37
Lampiran 3 Kromatogram larutan Na Siklamat BPFI pada pembuatan kurva kalibrasi ... 47
Lampiran 4 Perhitungan persamaan regresi dari kurva kalibrasi Na Siklamat BPFI yang diperoleh secara KCKT pada panjang gelombang 201 nm ... 50
Lampiran 5 Perhitungan recovery dengan metode adisi standar ... ... 52
Lampiran 6 Kromatogram hasil recovery dari sampel Vitacool ... ... 53
Lampiran 7 Hasil pengujian validasi, dengan parameter akurasi, presisi, batas deteksi (LOD), batas kuantitasi (LOQ) Na Siklamat pada tablet Vitacool dengan menggunakan metode adisi standar ….. ... 59
Lampiran 8 Contoh perhitungan % recovery dengan metode adisi standar ... 60
Lampiran 9 Perhitungan batas deteksi (LOD) dan batas kuantitasi (LOQ) ... 61
Lampiran 10 Kromatogram dari Nutrijeruk ... 62
Lampiran 11 Contoh perhitungan untuk mencari kadar Na siklamat dalam sampel ... 65
Lampiran 12 Analisis data statistik untuk mencari kadar sebenarnya
dari penyuntikkan larutan nutrijeruk ... 66
Lampiran 13 Tabel hasil analisa kadar Na siklamat dalam Nutrijeruk ... ... 69
Lampiran 15 Analisis data statistik untuk mencari kadar sebenarnya
dari penyuntikkan larutan Vitacool ... 73
Lampiran 16 Tabel hasil analisa kadar Na siklamat dalam Vitacool . 75 Lampiran 17 Kromatogram dari larutan Segar Sari ... 76
Lampiran 18 Analisis data statistik untuk mencari kadar sebenarnya dari penyuntikkan larutan Segar Sari ... 79
Lampiran 19 Tabel hasil analisa kadar Na siklamat dalam Segar Sari ... ... 81
Lampiran 20 Daftar Spesifikasi Sampel ... 82
Lampiran 21 Tabel Nilai Distribusi t ... 84
Lampiran 22 Sertifikat Na Siklamat BPFI ... 85
BAB I
PENDAHULUAN
1.1 Latar Belakang
Penggunaan bahan tambahan pangan dewasa ini sangat beragam, dari
pengawet sampai pemberi aroma dan pewarna. Berkembangnya bahan tambahan
pangan mendorong pula perkembangan makanan hasil olahan pabrik, yakni
bertambah aneka ragam jenisnya serta ragam cita rasa maupun kenampakannya
(Saparinto dan Hidayati, 2006). Pemanis buatan yang termasuk dalam bahan
tambahan pangan adalah pemanis pengganti gula (sukrosa), yaitu senyawa yang
memberikan persepsi rasa manis, tetapi tidak memberikan nilai gizi (non-nutritive
sweeteners). Salah satu jenis pemanis buatan ini adalah siklamat (Saparinto dan
Hidayati, 2006).
Penggunaan utama dari siklamat termasuk minuman ringan, minuman jus
buah, sirup, buah yang telah diproses, permen karet, jeli, selai dan topping
berbahan gelatin (Hunt., et al, 2011). Penggunaan siklamat dibatasi oleh Badan
Pengawas Obat dan Makanan (BPOM) karena efek samping dari siklamat, yaitu
dapat menyebabkan kanker prostat maka menurut Keputusan Kepala BPOM
Tahun 2004, penggunaan siklamat dalam minuman ringan tidak boleh melebihi
1000 ppm.
Minuman ringan adalah minuman yang tidak mengandung alkohol,
merupakan minuman olahan dalam bentuk bubuk atau cair yang mengandung
bahan makanan atau bahan tambahan lainnya baik alami maupun sintetik yang
Menurut Metode Analisis BPOM (2006) penetapan kadar siklamat untuk
sediaan sirup dilakukan secara KCKT menggunakan fase gerak dapar fosfat pH
4,5 : methanol dengan perbandingan 70:30 pada suhu 40ºC menggunakan kolom
C18 (250 x 4,6 mm) laju alir 1 ml/menit dan Ibrahim (2006) juga melakukan
penetapan kadar siklamat dalam sirup, cincau, manisan, dan es mambo dengan
KCKT menggunakan air dan asetonitril dengan perbandingan 95:5 menggunakan
kolom Luna C18 dan laju alir 1 ml/menit pada panjang gelombang 220 nm dan
suhu percobaan 25ºC, tetapi keberhasilan suatu metode tergantung daripada
matriks sampel sehingga metode yang digunakan untuk sirup belum tentu dapat
digunakaan untuk sampel lain. Sementara Wibowotomo (2008) melakukan
penetapan kadar Na Siklamat dalam minuman ringan dengan kondisi kromatografi
yang sama, tetapi dengan terlebih dahulu dilakukan ekstraksi menggunakan eter.
Metode lain yang dapat digunakan untuk penetapan kadar Na Siklamat antara lain
secara spektrofotometri UV (Sjöberg dan Alanko , 1987) dan Titrasi Nitrimetri
(FAO, 1996).
Metode Kromatografi Cair Kinerja Tinggi (KCKT) memiliki banyak
keuntungan antara lain dapat digunakan untuk analisis suatu zat dalam jumlah
kecil, waktu analisisnya relatif singkat, cukup sensitif dan selektif serta mudah
dalam interpretasi data yang diperoleh (Gandjar dan Rohman, 2007).
Berdasarkan hal tersebut di atas, peneliti ingin melakukan optimasi untuk
penetapan kadar natrium siklamat dalam minuman ringan menggunakan
kromatografi cair kinerja tinggi (KCKT) dengan berbagai pH dapar fosfat dan
perbandingan fase gerak dapar fosfat : methanol. Untuk menguji validitas kondisi
akurasi, presisi, Limit of Detection (LOD), dan Limit of Quantitation (LOQ).
Selain itu, peneliti ingin mengetahui apakah kadar natrium siklamat dalam
minuman ringan yang beredar di pasaran memenuhi syarat yang ditetapkan oleh
BPOM (2004) yaitu tidak lebih dari 1000 mg/kg.
1.2 Perumusan Masalah
Berdasarkan latar belakang di atas, maka yang menjadi perumusan
masalah dalam penelitian ini adalah:
Apakah metode penetapan kadar natrium siklamat dalam minuman ringan
dapat ditentukan dengan KCKT menggunakan fase gerak dapar fosfat pH
4,5 : methanol (70:30)
Apakah kadar natrium siklamat dalam minuman ringan yang beredar di
pasaran yang ditetapkan dengan metode KCKT memenuhi persyaratan
menurut BPOM (2004), yaitu tidak lebih dari 1000 mg/kg
1.3Hipotesis
Berdasarkan perumusan masalah di atas, maka yang menjadi hipotesis
dalam penelitian ini adalah:
Penetapan kadar natrium siklamat dalam minuman ringan tidak dapat
ditentukan dengan metode KCKT menggunakan fase gerak dapar fosfat
pH 4,5 : methanol (70:30)
Kadar natrium siklamat dalam minuman ringan yang beredar di pasaran
yang ditetapkan secara KCKT memenuhi persyaratan yang ditetapkan
1.4Tujuan Penelitian
Berdasarkan hipotesis di atas, maka yang menjadi tujuan dalam penelitian
ini adalah :
Melakukan optimasi dan validasi metode KCKT pada penetapan kadar
natrium siklamat dalam minuman ringan menggunakan fase gerak dapar
fosfat : methanol
Untuk mengetahui kesesuaian kadar natrium siklamat dalam minuman
ringan yang beredar di pasaran yang ditetapkan secara KCKT dengan
persyaratan yang ditetapkan BPOM (2004)
1.5 Manfaat Penelitian
Adapun manfaat penelitian ini adalah sebagai metode alternatif bagi
industri dan BPOM pada penetapan kadar natrium siklamat dalam minuman
ringan dengan metode kromatografi cair kinerja tinggi
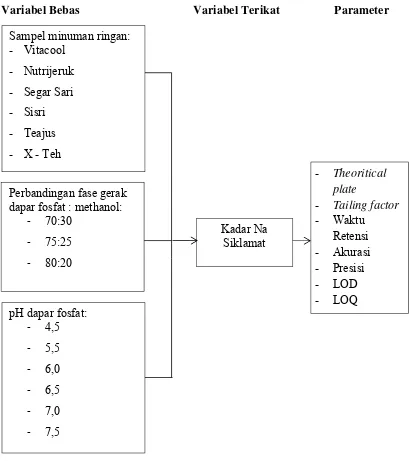
1.6 Kerangka Pikir Penelitian
Penelitian dimulai dengan pembuatan fase gerak, preparasi sampel, dan
penyuntikan sampel.
Secara skematis kerangka pikir penelitian ini ditunjukkan pada Gambar
Variabel Bebas Variabel Terikat Parameter
Gambar 1.1 Kerangka Pikir Penelitian Sampel minuman ringan:
- Vitacool
- Tailing factor
- Waktu Perbandingan fase gerak
dapar fosfat : methanol: ‐ 70:30
‐ 75:25 ‐ 80:20
Kadar Na Siklamat
dihilangkan dari daftar “Aman Secara Umum”, dan akhirnya dilarang untuk
digunakan pada makanan dan minuman di Amerika Serikat (Hunt et al. 2011).
2.2 Minuman Ringan
Minuman ringan adalah minuman yang tidak mengandung alkohol,
merupakan minuman olahan dalam bentuk bubuk atau cair yang mengandung
bahan makanan atau bahan tambahan lainnya baik alami maupun sintetik yang
dikemas dalam kemasan siap untuk dikonsumsi (Cahyadi, 2005).
2.3 Kromatografi
Kromatografi pertama kali dikembangkan oleh ahli botani Rusia pada tahun
1903 yang bernama Michael Tswett untuk memisahkan pigmen warna dalam
tanaman dengan cara perkolasi ekstrak petroleum eter dalam kolom gelas yang
berisi kalsium karbonat. Saat ini kromatografi merupakan teknik pemisahan yang
paling umum dan paling sering digunakan dalam bidang kimia analisis dan dapat
dimanfaatkan untuk melalukan analisis, baik analisis kualitatif, analisis kuantitatif,
atau preparatif dalam bidang farmasi dan industri. Kromatografi merupakan suatu
teknik pemisahan yang menggunakan fase diam (stationary phase) dan fase gerak
(mobile phase) (Gandjar dan Rohman, 2007).
2.3.1 Penggunaan Kromatografi
Menurut Gritter dkk (1985), penggunaan kromatografi adalah sebagai
berikut:
1. Pemakaian untuk tujuan kualitatif mengungkapkan ada atau tidak
senyawa tertentu dalam cuplikan
2. Pemakaian untuk tujuan kuantitatif menunjukkan banyaknya
masing-masing
komponen campuran
3. Pemakaian untuk tujuan preparatif untuk memperoleh komponen
campuran
dalam jumlah memadai dalam keadaan murni.
2.3.2 Puncak Asimetris
Puncak asimetris yakni membentuk pucak yang berekor (tailing) dan adanya
puncak pendahulu (fronting) jika ada perubahan rasio distribusi solut yang lebih
besar (Johnson dan Stevenson, 1991).
Baik tinggi puncak maupun luasnya dapat dihubungkan dengan konsentrasi.
Tinggi puncak mudah diukur, akan tetapi sangat dipengaruhi perubahan waktu
retensi yang disebabkan oleh variasi suhu dan komposisi pelarut. Oleh karena itu,
luas puncak dianggap merupakan parameter yang lebih akurat untuk pengukuran
kuantitatif (Ditjen POM, 1995).
2.4 Kromatografi Cair Kinerja Tinggi (KCKT)
Kromatografi cair kinerja tinggi (KCKT) merupakan sistem pemisahan
dengan kecepatan dan efisiensi yang tinggi. Hal ini karena didukung oleh
kemajuan dalam teknologi kolom, sistem pompa tekanan tinggi, dan detektor yang
sangat sensitif dan beragam. KCKT mampu menganalisa berbagai cuplikan secara
kualitatif maupun kuantitatif, baik dalam komponen tunggal maupun campuran
KCKT merupakan teknik pemisahan yang diterima secara luas untuk
analisis dan pemurnian senyawa tertentu dalam suatu sampel pada sejumlah
bidang antara lain: farmasi, lingkungan dan industri-industri makanan (Munson,
1991).
Kegunaan umum KCKT adalah untuk pemisahan sejumlah senyawa
organik, anorganik, maupun senyawa biologis, analisis ketidakmurnian
(impurities) dan analisis senyawa-senyawa yang tidak mudah menguap
(nonvolatil). KCKT paling sering digunakan untuk menetapkan kadar
senyawa-senyawa tertentu seperti asam-asam amino, asam-asam nukleat dan
protein-protein dalam cairan fisiologis, menentukan kadar senyawa-senyawa aktif obat
dan lain-lain (Munson, 1991).
Menurut Munson (1991), kelebihan KCKT antara lain:
Mampu memisahkan molekul-molekul dari suatu campuran
Resolusinya baik
Mudah melaksanakannya
Kecepatan analisis dan kepekaannya tinggi
Dapat dihindari terjadinya dekomposisi/kerusakan bahan yang dianalisis
Dapat digunakan bermacam-macam detektor
Kolom dapat digunakan kembali
Tekniknya tidak begitu tergantung pada keahlian operator dan
reprodusibilitasnya lebih baik
Instrumennya memungkinan untuk bekerja secara automatis dan kuantitatif
Waktu analisis umumnya singkat
dipompa dan detektor sehingga akan mengacaukan analisis (Gandjar dan Rohman,
2007).
2.4.4 Pompa
Pompa yang cocok digunakan untuk KCKT adalah pompa yang mempunyai
syarat sebagaimana syarat wadah pelarut yakni : pompa harus inert terhadap fase
gerak. Bahan yang umum dipakai untuk pompa adalah gelas, baja tahan karat,
teflon, dan batu nilam. Pompa yang digunakan sebaiknya mampu memberikan
tekanan sampai 6000 psi dan mampu mengalirkan fase gerak dengan kecepatan
alir 0,1-10 ml/menit. Aliran pelarut dari pompa harus tanpa denyut untuk
menghindari hasil yang menyimpang pada detektor (Gandjar dan Rohman, 2007).
2.4.5 Injektor
Ada 3 jenis injektor, yakni syringe injector, loop valve dan automatic
injector (autosampler). Syringe injector merupakan bentuk injektor yang paling
sederhana (Meyer, 2004).
Pada waktu sampel diinjeksikan ke dalam kolom, diharapkan agar aliran
pelarut tidak mengganggu masuknya keseluruhan sampel ke dalam kolom.
Sampel dapat langsung diinjeksikan ke dalam kolom (on column injection) atau
digunakan katup injeksi (Meyer, 2004).
Katup putaran (loop valve), tipe injektor ini umumnya digunakan untuk
menginjeksi volume lebih besar daripada 10 µl dan sekarang digunakan dengan
cara otomatis (dengan adaptor khusus, volume-volume lebih kecil dapat
diinjeksikan secara manual). Bila katup difungsikan, maka cuplikan di dalam
Automatic injector atau disebut juga autosampler memiliki prinsip yang
mirip, hanya saja sistem penyuntikannya bekerja secara otomatis (Meyer, 2004).
2.4.6 Kolom
Kolom kinerja tinggi yang dapat meminimalkan pelebaran puncak sampel
adalah jantung dari sistem kromatografi cair modern. Efisiensi kolom tertinggi
dapat dicapai dengan menggunakan kolom yang dipak dengan padat dan seragam
dan berdiameter 5-10 μm.
Kolom dengan diameter 2 – 5 mm biasanya digunakan untuk analisis.
Kolom yang lebih lebar dengan diameter antara 10 mm sampai 1 inchi (25,4 mm)
dapat digunakan untuk pekerjaan preparatif. Beberapa perusahaan bahkan
memasarkan kolom preparatif dengan diameter 30 cm ke atas. Kolom dengan
panjang 5, 10, 15, atau 25 cm adalah umum jika digunakan fase diam
mikropartikel berukuran 10 μm ke bawah. Jika diinginkan jumlah plate yang
lebih tinggi maka akan lebih baik jika meggunakan packing dengan partikel yang
lebih kecil daripada menggunakan kolom yang lebih panjang. Kolom yang lebih
panjang meningkatkan volume retensi, sehingga mengurangi konsentrasi puncak
pada zat yang terelusi.
Kolom umumnya dibuat dari stainless steel, tahan terhadap tekanan KCKT
normal dan relatif inert terhadap korosi kimiawi. (Meyer, 2004).
2.4.7 Detektor
Suatu detektor dibutuhkan untuk mendeteksi adanya komponen cuplikan
dalam aliran yang keluar dari kolom. Detektor-detektor yang baik memiliki
sensitifitas yang tinggi, gangguan (noise) yang rendah, kisar respons linier yang
yang rendah terhadap aliran dan fluktuasi temperatur sangat diinginkan, tetapi
tidak selalu dapat diperoleh (Johnson dan Stevenson, 1991).
Detektor yang paling banyak digunakan dalam kromatografi cair modern
kecepatan tinggi adalah detektor spektrofotometer UV 201 nm. Bermacam-macam
detektor dengan variasi panjang gelombang UV-Vis sekarang menjadi populer
karena mereka dapat digunakan untuk mendeteksi senyawa-senyawa dalam
rentang yang luas. Detektor lainnya, antara lain: detektor fluometer, detektor
ionisasi nyala, detektor elektrokimia dan lain-lain juga telah digunakan (Johnson
dan Stevenson, 1991).
2.4.8 Pengolahan Data
Komponen yang terelusi mengalir ke detektor dan dicatat sebagai
puncak-puncak yang secara keseluruhan disebut sebagai kromatogram (Johnson dan
Stevenson, 1991).
Guna kromatogram:
Menurut Johnson dan Stevenson (1991), guna kromatogram adalah sebagai
berikut:
1. Kualitatif : Waktu retensi selalu konstan dalam setiap kondisi kromatografi
yang sama dapat digunakan untuk identifikasi.
2. Kuantitatif : Luas puncak proporsional dengan jumlah sampel yang
diinjeksikan dan dapat digunakan untuk menghitung konsentrasi
2.4.9 Fase Gerak
Fase gerak harus dipilih berdasarkan sifat-sifat kromatografinya: yaitu harus
dan seefisien mungkin. Sebagai aturan umum, beberapa pelarut berpotensi dapat
menyelesaikan masalah tertentu, sehingga pemilihan harus didasari oleh kriteria
yang berbeda:
Viskositas: pelarut dengan viskositas rendah menghasilkan perubahan
tekanan yang rendah daripada pelarut dengan viskositas tingga pada laju alir
spesifik. Hal ini juga dapat mnegakibatkan proses kromatografi yang lebih
cepat.
Transparansi UV: jika digunakan detektor UV, fase gerak harus benar-benar
transparan pada panjang gelombang yang dibutuhkan.
Indeks refraktif: hanya penting jika menggunakan detektor indeks refraktif
Titik didih: titik didih fase gerak yang rendah dibutuhkan jika zat yang
terelusi ingin diperoleh kembali dan diproses lebih lanjut.
Kemurnian: kriteria ini mempunyai arti yang berbeda tergantung penggunaan
yang diinginkan
Inert dengan senyawa-senyawa di dalam sampel.
Ketahanan terhadap korosi: baja bahkan bisa terkorosi dengan methanol atau
asetonitril, sehingga mungkin diperlukan perawatan dengan asam nitrat atau
perubahan desain instrumen.
Harga
2.4.10Dapar
Dapar diperlukan dalam kromatografi pertukaran ion dan sering juga
digunakan dalam kromatografi fase balik. Jika senyawa ionik maupun senyawa
yang dapat terion perlu dipisahkan, sering, walaupun tidak selalu, merupakan
dapat dibuat menjadi sepenuhnya tidak terion maupun sepenuhnya terion,
tergantung dari mode pemisahan.
Larutan dapar sering dibuat dari konsentrat yang tersedia di pasaran; jika
pengenceran dilakukan dengan benar, pH yang diinginkan tidak perlu diperiksa
lagi. Jika tidak tersedia konsentrat di pasaran, sebaiknya senyawa kimia yang
dibutuhkan ditimbang dan diencerkan dengan volume yang sesuai (Meyer, 2004).
2.4.11 Jenis Pemisahan Kromatografi Cair Kinerja Tinggi
Berdasarkan jenis fase gerak dan fase diamnya, jenis pemisahan KCKT
dibedakan atas:
a.Kromatografi Fase Normal
Kromatografi dengan kolom yang fase diamnya bersifat polar, misalnya
silika gel, alumina, sedangkan fase geraknya bersifat non polar seperti heksan.
b.Kromatografi Fase Terbalik
Pada kromatografi fase terbalik, fase diamnya bersifat non polar, yang
banyak dipakai adalah oktadesilsilan (ODS atau C18) dan oktilsilan (C8).
Sedangkan fase geraknya bersifat polar, seperti air, metanol dan asetonitril
(Meyer, 2004).
2.5 Validasi metode
Validasi merupakan persyaratan mendasar yang diperlukan untuk menjamin
kualitas dan hasil dari semua aplikasi analitik (Ermer, 2005).
Adapun karakteristik dalam validasi metode menurut USP (United States
deteksi, batas kuantitasi, linieritas, rentang/kisaran dan kekuatan/ketahanan dan
kekasaran/ketangguhan.
2.5.1 Akurasi (Kecermatan)
Akurasi merupakan ketlitian metode analisis atau kedekatan antara nilai
terukur dengan nilai sebenarnya. Akurasi dinyatakan dalam persen perolehan
kembali (% recovery) (Harmita, 2004).
2.5.2 Presisi (Keseksamaan)
Presisi merupakan ukuran keterulangan metode analisis yang diperoleh dari
beberapa kali pengukuran pada sampel yang sama dan biasanya diekspresikan
sebagai relatif standar deviasi (RSD) (Gandjar dan Rohman, 2007).
2.5.3 Spesifisitas (Selektifitas)
Spesifisitas/selektifitas adalah kemampuan untuk mengukur analit yang
dituju secara tepat dan spesifik dengan adanya komponen lain dalam matriks
sampel seperti ketidakmurnian, produk degradatif dan komponen lain dari sampel
(Ermer, 2005).
2.5.4 Batas Deteksi dan Batas Kuantitasi
Batas deteksi adalah konsentrasi analit terendah dalam sampel yang masih
dapat dideteksi, meskipun tidak selalu dapat dikuantifikasi. Sedangkan batas
kuantitasi adalah konsentrasi analit terendah dalam sampel yang dapat ditentukan
dengan presisi dan akurasi yang dapat diterima pada kondisi metode yang
digunakan (USP, 2007).
2.5.5 Linearitas
Linieritas adalah kemampuan suatu metode untuk memperoleh hasil uji
diberikan. Linieritas dapat ditentukan secara langsung dengan pengukuran sampel
(analit) yang ditambahkan baku pada sekurang-kurangnya lima titik konsentrasi
yang mencakup seluruh rentang konsentrasi kerja (Ermer, 2005).
2.5.6 Rentang (Kisaran)
Rentang/kisaran adalah konsentrasi terendah dan tertinggi yang mana suatu
metode analitik menunjukkan akurasi, presisi dan linieritas yang dapat digunakan
untuk menganalisis sampel (Ermer, 2005).
2.5.7 Kekuatan (Ketahanan)
Kekuatan/ketahanan merupakan pengujian kemampuan dari suatu metode
untuk tidak terpengaruh oleh adanya perubahan parameter dalam melakukan
metode analitik seperti persentase kandungan pelarut organik dalam fase gerak,
pH larutan dapar, waktu pengekstraksian analit, komposisi pengekstraksi dan
perbandingan konsentrasi fase gerak (Épshtein, 2004).
2.5.8 Kekasaran (Ketangguhan)
Kekasaran/ketangguhan merupakan tingkat reprodusibilitas hasil yang
diperoleh dengan kondisi yang bervariasi dan dinyatakan sebagai simpangan baku
relative relative standard deviation (RSD). Kondisi ini meliputi laboratorium,
analis, reagen dan waktu percobaan yang berbeda (Gandjar dan Rohman, 2007).
BAB III
METODE PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Penelitian Fakultas Farmasi,
Universitas Sumatera Utara, Medan pada bulan Juni sampai Desember 2013.
3.2 Alat dan Bahan
3.2.1 Alat
Alat – alat yang digunakan dalam penelitian ini adalah seperangkat
instrumen KCKT lengkap (Agilent) dengan pompa, degasser, penyuntik
autosampler (20µl), kolom Agilent C18 (150 x 4,6 mm), detektor UV-Vis, wadah
fase gerak, vial, Sonifikator (Branson 1510), pompa vakum (Gast DOA – P604 –
BN), neraca analitik (Mettler Toledo), membrane filter PTFE 0,5 µm dan 0,2 µm,
cellulose nitrate membran filter 0,45 µm.
3.2.2 Bahan
Bahan-bahan yang digunakan adalah Methanol untuk HPLC (E.Merck),
Akuabides (Laboratorium Penelitian Fakultas Farmasi USU), Kalium dihidrogen
fosfat (E.Merck), Kalium Hidroksida (E.Merck), Na Siklamat BPFI (Badan POM
RI), Nutrijeruk (Union Pasifik Indonesia), Vitacool (PT Makmur Artha
Sejahtera), Segar Sari (PT Kinosentra Industrindo), Sisri (PT Forisa Nusapersada),
3.3 Pengambilan Sampel
Pengambilan sampel dilakukan secara random sampling (Sugiono, 2013)
yaitu tanpa membandingkan satu tempat dengan tempat yang lain karena semua
sampel dianggap homogen dan sampel diambil sebanyak √ .
3.4 Prosedur Kerja
3.4.1 Pembuatan fase gerak
Methanol 500 ml disaring dengan menggunakan membran filter PTFE 0,5
μm. Sebanyak 125 ml kalium dihidrogen fosfat 0,2 M ditambahkan dengan 72,75
ml KOH 0,2 M kemudian dicukupkan dengan akuabides dalam labu tentukur 500
ml, kocok. Kemudian diukur pH. Kemudian disaring dengan menggunakan
cellulosa nitrat membran filter 0,45 μm. Masing-masing diawaudarakan selama
30 menit.
3.4.2 Pembuatan pelarut
Dicampur 200 ml methanol dan 300 ml aquabides. Kemudian pelarut
disaring menggunakan membrane filter PTFE 0,5 μm dan diawaudarakan selama
20 menit.
3.4.3 Prosedur analisis menggunakan KCKT
3.4.3.1Penyiapan kromatografi cair kinerja tinggi
Masing-masing unit diatur, kolom yang digunakan Agilent C18 (150 x 4,6
mm), detektor UV-Vis dan dideteksi pada panjang gelombang 201 nm. Setelah
mengalir selama 30 menit dengan laju alir 1 ml/menit sampai diperoleh garis alas
yang datar, menandakan sistem tersebut telah stabil.
3.4.3.2Penentuan perbandingan fase gerak yang optimum
Pada kondisi kromatografi komposisi fase gerak divariasikan untuk mendap
at-kan hasil analisis yang optimum. Perbandingan fase gerak dapar
fosfat:methanol yang divariasikan adalah 75:25, 70:30, 80:20 dengan laju alir 1
ml/menit. Kondisi kromatografi yang memberikan data yang terbaik yang akan
dipilih dan digunakan dalam penelitian ini.
3.4.4 Analisis kualitatif
3.4.4.1 Uji identifikasi Na Siklamat
Sampel Na Siklamat dengan konsentrasi 100 ppm diinjeksikan sebanyak 20
µl, dianalisis pada kondisi KCKT dengan perbandingan fase gerak dapar
fosfat:methanol yang terpilih dengan laju alir 1 ml/menit pada panjang
gelombang 201 nm. Selanjutnya untuk mempertegas identifikasi, pada larutan
sampel tersebut ditambahkan sedikit larutan Na Siklamat BPFI (50 ppm)
kemudian diinjeksikan dan dianalisis kembali pada kondisi KCKT yang sama.
Bila waktu retensi tetap dan luas area yang diperoleh bertambah. Sampel
dinyatakan mengandung Na Siklamat.
3.4.5 Analisis kuantitatif
3.4.5.1 Pembuatan larutan induk baku Na Siklamat BPFI
Ditimbang seksama sejumlah 25,0 mg Na Siklamat BPFI, dimasukkan ke
dalam labu tentukur 100 ml, dicukupkan dengan pelarut sampai garis tanda,
disonikasi selama 15 menit dan diencerkan dengan pelarut hingga garis tanda
3.4.5.2 Pembuatan kurva kalibrasi Na Siklamat BPFI
Dipipet LIB I sebanyak 2,0 ml; 4,0 ml; 6,0 ml; 8,0 ml; dan 10,0 ml; dan,
dimasukkan ke dalam labu tentukur 10 ml, diencerkan dengan pelarut hingga garis
tanda. Dikocok sehingga diperoleh konsentrasi 50,0 ppm, 100,0 ppm, 150,0 ppm,
200,0 ppm, dan 250,0 ppm. Kemudian masing-masing larutan disaring dengan
membran filter PTFE 0,2 µm, dan diinjeksikan ke sistem KCKT sebanyak 20 µl
dan dideteksi pada panjang gelombang 201 nm. Dari luas area yang diperoleh
pada kromatogram dibuat kurva kalibrasi kemudian dihitung persamaan garis
regresi dan faktor korelasinya.
3.4.5.3 Penetapan kadar sampel
Ditimbang seksama 1 g sampel yang mengandung Na Siklamat (sebanyak
6 kali pengulangan). Masing-masing dimasukkan ke dalam labu tentukur 10 ml
dan dicukupkan dengan pelarut hingga garis tanda, dikocok, kemudian disaring
dengan membran filter PTFE 0,2 µm dan disonikasi selama 15 menit.
Diinjeksikan sebanyak 20 µl menggunakan autosampler ke sistem KCKT dan
dideteksi pada panjang gelombang 201 nm dengan perbandingan fase gerak
dapar fosfat pH 7,0:methanol (70:30), laju alir 1 ml/menit. Dilakukan sebanyak 6
kali perlakuan untuk setiap sampel.
Konsentrasi dapat dihitung dengan mensubstitusikan luas area sampel pada
Y dari persamaan regresi : Y = ax + b.
3.4.5.4 Analisis data penetapan kadar secara statistik
Data perhitungan kadar dianalisis secara statistik menggunakan uji T.
Menurut Rubin (2012), rumus yang digunakan untuk menghitung Standar
1
Kadar dapat dihitung menggunakan rumus:
K =
Dan untuk menentukan data diterima atau ditolak digunakan rumus:
t hitung
Dengan dasar penolakan data apabila t hitung ≥ t tabel, pada taraf
kepercayaan 99% dengan nilai α = 0,01, dk = n – 1.
Keterangan :
SD = Standar deviasi
X = Kadar dalam satu perlakuan
X = Kadar rata-rata dalam satu sampel n = Jumlah pengulangan
Untuk mencari kadar sebenarnya dapat digunakan rumus:
n
t = Harga ttabel sesuai dengan derajat kepercayaan
dk = Derajat kebebasan
3.4.6 Validasi metode
3.4.6.1 Akurasi (kecermatan)
Ditimbang seksama 1g sampel Vitacool lalu dilakukan prosedur yang sama
seperti pada penetapan kadar sampel. Ditimbang lagi sampel Vitacool sebanyak 1
sama seperti pada penetapan kadar sampel. Dilakukan 6 kali replikasi. Menurut
Harmita (2004), hasil dinyatakan dalam persen perolehan kembali (% recovery).
Persen perolehan kembali dapat dihitung dengan rumus:
% Perolehan kembali =
A
Untuk menguji data presisi (RSD), diambil rata-rata dari data % perolehan
kembali (6 kali replikasi) kemudian dihitung standar deviasi. Setelah itu, dihitung
% RSD dengan cara standar deviasi dibagi rata-rata dari % perolehan kembali
kemudian dikali 100%.
Menurut Gandjar dan Rohman (2007), nilai RSD dirumuskan dengan:
%
Sementara itu, nilai SD dihitung dengan :
∑ ²
Dimana :
X = nilai dari masing-masing pengukuran
3.4.6.3 Batas deteksi (LOD) dan batas kuantitasi (LOQ)
Nilai batas deteksi (LOD) dan batas kuantitasi (LOQ) dihitung dari
persamaan regresi yang diperoleh dari kurva kalibrasi. Menurut Ephstein (2004),
Batas Deteksi (Limit Of Detection/ LOD) dan Batas Kuantitasi (Limit Of
Quantitation/ LOQ) dapat dihitung dengan menggunakan rumus sebagai berikut :
2 Slope = Derajat Kemiringan
BAB IV
HASIL DAN PEMBAHASAN
4.1 Penentuan pH Dapar Fosfat
Pada penelitian ini ditentukan pH dapar fosfat yang optimal untuk
digunakan sebagai fase gerak yang digunakan dalam penentuan kadar Na
Siklamat dengan metode KCKT menggunakan kolom Agilent C18 (150 x 4,6
mm), detektor UV-Vis. Panjang gelombang yang dipilih adalah 201 nm.
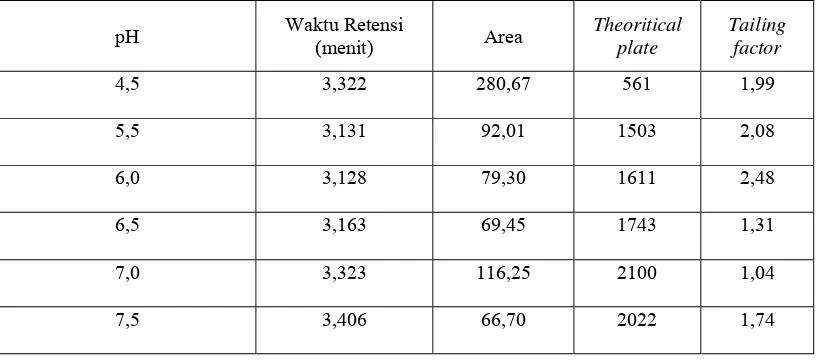
Hasil penelitian menunjukkan bahwa pH dapar fosfat yang optimal untuk
penetapan kadar Na Siklamat dalam minuman ringan adalah pH 7,0. Hal ini sesuai
dengan kestabilan Na Siklamat pada pH 5,5-7,5 (Windholz dkk, 1983) sehingga
Na Siklamat tidak terionisasi dan menghasilkan retensi yang lebih baik karena
tetap berada dalam bentuk nonionik karena dengan penambahan dapar fosfat pH
7,0 senyawa yang dapat terion tidak menghasilkan puncak dengan tailing yang
lebar dan reproduksibilitas retensinya baik (Heyrman dan Henry, 2006).
Hubungan antara pengaruh pH dapar fosfat terhadap parameter kromatogram
dapat dilihat pada Tabel 4.1 dibawah ini. Kromatogram dapat dilihat pada
Tabel 4.1 Pengaruh pH dapar fosfat terhadap parameter kromatogram
4.2 Penentuan Komposisi Fase Gerak
Pada penelitian ini sampel yang ditentukan merupakan sediaan minuman
ringan yang mengandung Na Siklamat dengan metode KCKT menggunakan
kolom Agilent C18 (150 x 4,6 mm), detektor UV-Vis dengan fase gerak dapar
fosfat : methanol. Panjang gelombang yang dipilih adalah 201 nm.
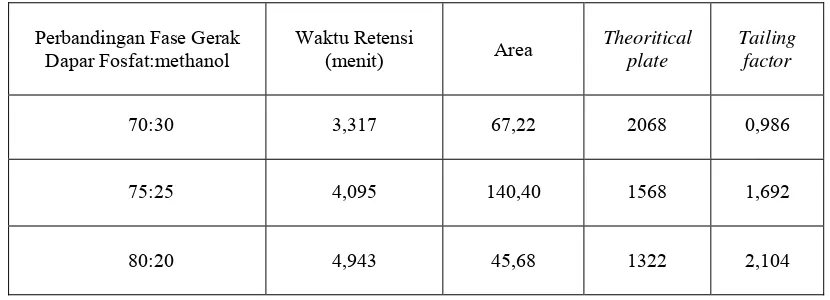
Dari hasil orientasi pada penentuan kondisi kromatografi yang terbaik untuk
Na Siklamat diperoleh komposisi fase gerak larutan dapar fosfat pH 7,0 dan
methanol 70 : 30, laju alir 1 ml/menit. Pemilihan fase gerak yang terbaik ini
didasarkan pada theoritical plate yang paling baik. Pada ketiga sampel dengan
rasa teh (Sisri, Teajus, X-Teh), tidak didapatkan bentuk kromatogram yang baik
pada perbandingan komposisi fase gerak manapun, sehingga tidak dilakukan
analisis lebih lanjut. Hal ini dikarenakan perbedaan komposisi bahan tambahan
dalam minuman ringan rasa teh yang memiliki senyawa yang memiliki waktu
retensi yang berhimpitan dengan waktu retensi Na Siklamat sehingga diperlukan
kondisi kromatografi yang berbeda. Hubungan antara pengaruh komposisi fase pH Waktu Retensi
(menit) Area
Theoritical plate
Tailing factor
4,5 3,322 280,67 561 1,99
5,5 3,131 92,01 1503 2,08
6,0 3,128 79,30 1611 2,48
6,5 3,163 69,45 1743 1,31
7,0 3,323 116,25 2100 1,04
gerak terhadap parameter kromatogram dapat dilihat pada Tabel 4.2 dibawah ini.
Kromatogram dapat dilihat pada Lampiran 2
Tabel 4.2 Pengaruh komposisi fase gerak terhadap parameter kromatogram
4.3 Analisis Kualitatif
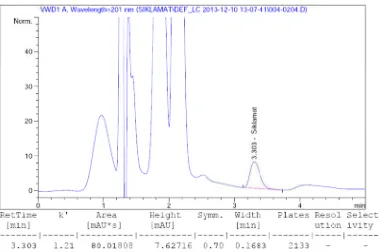
Pemisahan Na Siklamat dengan menggunakan kromatografi fase balik
terjadi karena Na Siklamat bersifat polar. Untuk mengetahui bahwa sampel yang
dianalisis mengandung Na Siklamat dilakukan spiking yaitu menambahkan bahan
baku ke dalam sampel pada kondisi kromatografi yang sama. Hal ini dilakukan
dengan cara : Pertama, dilakukan proses kromatografi sampel tanpa penambahan
baku. Kedua, sampel dengan penambahan bahan baku dilakukan proses
kromatografi. Hasil kromatogram dapat dilihat pada Gambar 1 dan Gambar 2 di
bawah ini :
Perbandingan Fase Gerak Dapar Fosfat:methanol
Waktu Retensi
(menit) Area
Theoritical plate
Tailing factor
70:30 3,317 67,22 2068 0,986
75:25 4,095 140,40 1568 1,692
Dari kromatogram diatas dapat dilihat bahwa terjadi peningkatan luas area
dan tinggi puncak pada kromatogram setelah penambahan baku dibandingkan
dengan sebelum penambahan bahan baku maka dapat diidentifikasi bahwa
sampel mengandung Na Siklamat (Johnson dan Stevenson, 1991).
4.4 Analisis Kuantitatif
4.4.1 Penentuan kurva kalibrasi
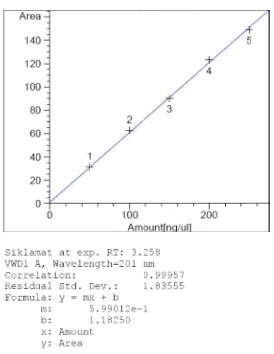
Penentuan kurva kalibrasi Na Siklamat BPFI ditentukan berdasarkan luas
area pada konsentrasi 50 ppm, 100 ppm, 150 ppm, 200 ppm, dan 250 ppm,
diperoleh hubungan yang linier dengan koefisien korelasi, r = 0,9996 dan
persamaan regresi Y = 0,5998 X + 1,69. Nilai r ≥ 0,995 menunjukkan adanya
korelasi linier yang menyatakan adanya hubungan antara luas area dan konsentrasi
(Moffat, dkk., 2005). Hasil penentuan kalibrasi dapat dilihat pada Gambar 3 di
Dari sediaan Na Siklamat dalam minuman ringan yang ditentukan kadarnya
berdasarkan luas area hanya Segar Sari yang memenuhi persyaratan kadar umum
untuk Na Siklamat dalam minuman ringan menurut BPOM (2004) dimana
persyaratan maksimal Na Siklamat dalam minuman ringan non karbonasi adalah
1000 ppm, sementara Nutrijeruk dan Vitacool melebihi batas yang ditentukan. Hal
ini dapat dikaitkan juga dengan tidak dicantumkannya kadar siklamat dalam label
minuman ringan Nutrijeruk dan Vitacool sehingga dapat membahayakan
konsumen yang kurang teliti melihat label kemasan.
4.5 Hasil Uji Validasi
Pada penelitian ini dilakukan uji validasi metode dengan metode standar
adisi terhadap sampel tablet Vitacool yang meliputi uji akurasi dengan parameter
% recovery dan uji presisi dengan parameter RSD (Relative Standard Deviasi),
LOD (Limit of Detection) dan LOQ (Limit of Quantitation).
Uji akurasi dengan parameter % recovery dilakukan dengan membuat enam
kali replikasi (Harmita, 2004).
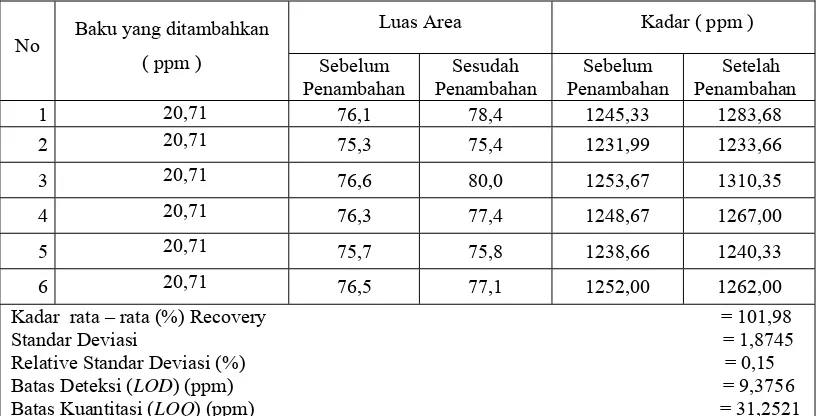
Data hasil ujivalidasi, dengan parameter akurasi dan presisi dengan metode
Tabel 4.4 Hasil Pengujian Validasi, dengan parameter akurasi, presisi, batas deteksi (LOD), batas kuantitasi (LOQ) Na Siklamat Vitacool dengan menggunakan metode adisi standar
Dari tabel di atas diperoleh hasil pengujian akurasi dengan kadar rata-rata
% recovery 101,98%, % recovery ini dapat diterima karena memenuhi syarat
akurasi, bahwa rentang rata-rata % recovery ialah 97-103%. Maka dapat
disimpulkan bahwa metode ini mempunyai akurasi yang baik (Epshtein, 2004).
Hasil uji presisi dengan parameter RSD (Relative Standard Deviasi)
diperoleh 0,15%, persyaratan nilai RSD yang ditentukan adalah < 2%. Maka dapat
disimpulkan bahwa metode analisis mempunyai presisi yang baik (Harmita,
2004).
Batas deteksi dan batas kuantitasi dihitung dari persamaan regresi yang
diperoleh dalam kurva kalibrasi. Dari hasil perhitungan diperoleh nilai LOD
9,3756 ppm dan nilai LOQ 31,2521 ppm. No Baku yang ditambahkan
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Natrium siklamat dalam minuman ringan dapat ditentukan kadarnya secara
Kromatografi Cair Kinerja Tinggi (KCKT) dengan kondisi kromatografi
yang optimal menggunakan kolom Agilent C18 (150 x 4,6 mm), detektor
UV-Vis dengan perbandingan fase gerak dapar fosfat pH 7,0:methanol
(70:30), laju alir 1 ml/menit pada panjang gelombang 201 nm. Metode ini
memberikan hasil akurasi dan presisi yang baik dengan % recovery =
101,98%, relatif standar deviasi (RSD) = 0,15%; batas deteksi (LOD) =
9,3756 ppm dan batas kuantitasi (LOQ) = 31,2521 ppm.
2. Dari enam minuman ringan yang dianalisis, tiga di antaranya, yaitu
Nutrijeruk, Vitacool, dan Segar Sari dapat ditentukan kadarnya secara
KCKT, dimana kadar Nutrijeruk dan Vitacool yang diperoleh melebihi
batas yang ditentukan oleh BPOM sementara Segar Sari memenuhi
persyaratan yaitu mengandung Na Siklamat tidak lebih dari 1000 ppm.
Sedangkan untuk jenis minuman Teajus, Sisri, dan X-Teh tidak dapat
dianalisis dengan kondisi kromatografi yang dilakukan.
5.2 Saran
Disarankan kepada peneliti selanjutnya untuk melakukan penetapan kadar
Na Siklamat dalam bentuk minuman ringan dengan rasa teh dan bentuk sediaan
DAFTAR PUSTAKA
BPOM. (2004). Keputusan Kepala Badan Pengawas Obat dan Makanan Republik Indonesia Nomor : HK.00.05.5.1.4547TentangPersyaratan Penggunaan Bahan Tamnbahan PanganPemanis Buatan dalam Produk Pangan.
Jakarta: BPOM RI. Hal. 36.
_____. (2006). Metode Analisa BPOM RI. Medan: BPOM RI. Hal. 31.
Cahyadi, W. (2005). Analisis dan Aspek Kesehatan Bahan Tambahan Pangan.
Jakarta: PT. Bumi Aksara. Hal. 67-74.
Ditjen POM. (1995). Farmakope Indonesia.Edisi ke IV. Jakarta: Departemen Kesehatan Republik Indonesia. Hal.288-289, 293.
Épshtein, N.A. (2004). Validation of HPLC Techniques for Pharmaceutical Analysis. Pharmaceutical Chemistry Journal 38(4): 212 – 228.
Ermer, J. (2005). Analytical Validation within the Pharmaceutical
Environment.In: J. Ermer and J.H. McB. Miller (eds).Method Validation in Pharmaceutical Analysis. Weinhein: Wiley-VCH Verlag GmbH & Co. KgaA. Hal. 54, 63-70,80,101.
FAO. (1996). Sodium Cyclamate.FNP 52. (4): 2.
Gandjar, I.G., dan Rohman, A. (2007). Kimia Farmasi Analisis. Yogyakarta: Pustaka Pelajar. Hal. 323-349.
Gritter, R.J, Bobbit, J.M, dan Schwarting, A.E. (1985). Introduction Chromatography.Edisi Ketiga. Penerjemah Kosasih
Padmawinata.Pengantar Kromatografi. Bandung: Penerbit ITB. Hal. 186.
Harmita. (2004). Petunjuk Pelaksanaan Validasi Metode dan Cara Perhitungannya. Majalah Ilmu Kefarmasian. (3): 117-135.
Heyrman, A.N., dan Henry, R.A. Importance of Controlling Mobile Phase pH in Reversed Phase HPLC.Keystone Technical Bulletin. Tanggal akses 13 Mei 2014. http://www.4uchem.cn/LiteratureChinese/HPLC-buffer.pdf
Hunt, F., Bopp, B.A., dan Price P. (2011). Cyclamate. Editor Lyn O’Brien-Nabors. Alternative Sweeteners. Edisi keempat. Boca Raton: CRC Press. Hal. 94-95.
Ibrahim, S., (2006). Penentuan Kadar Beberapa Pemanis Sintetis dalam Makanan Jajanan dengan Metode KCKT (Kromatografi Cair Kinerja Tinggi).
Johnson, E.L., dan Stevenson, R. (1978). Principle Liquid Chromatography.. Penerjemah Padmawinata, K. (1991). Dasar Kromatografi Cair.
Bandung: Penerbit ITB. Hal. 1-40.
Meyer, V.R. (2004). Practical High-Performance Liquid Chromatography. Edisi keempat. Chichester: John Wiley and Sons Inc. Hal. 4.
Moffat, A.C., Osselton, M.D., dan Widdop, B. (2005). Clarke’s Analysis Of Drug And Poisons. Edisi ketiga. London: Pharmaceutical Press. Electronic Version. Hal. 153.
Munson, J.W. (1984).Pharmaceutical Analysis Modern Methods. Part B.
Penerjemah Harjana. (1991). Analisis farmasi Metode Modern. Parwa B., Surabaya: Penerbit Air langga University Press. Hal. 14-46.
Rubin, A. (2013). Statistics for Evidence-Based Practice and Evaluation.Edisi ketiga. Belmont: Brooks/Cole. Hal. 71
Saparinto, C., dan Hidayati, D. (2006). Bahan Tambahan Pangan. Yogyakarta: Kanisius. Hal. 35, 78.
Sjöberg, A.M., dan Alanko T.A. (1987). Spectrophotometric Determination of Cyclamate in Foods:NMKL Collaborative Study.J Assoc Off Anal Chem..
70(3): 588-590.
Sugiono. (2011). Metode Penelitian Kuantitatif, Kualitatif, dan R&D. Bandung: Alfabeta. Hal. 82
USPNF. (2007). The United States Pharmacopeia. Edisi ke-30. New York: Penerbit Electronic Version. Hal. 1895.
Wibowotomo, B. (2008). Pengembangan Metode Penetapan Kadar Siklamat Berbasis Kromatografi Cair Kinerja Tinggi Guna Diimplementasikan Dalam Kajian Paparan. Bogor: IPB. Hal. 27-28.
Windholz, M., Budavari, S., Blumetti, R.F., dan Otterbein, E.S. (1983). The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals.
Edisi kesepuluh. Rahway: Merck & Co., Inc. Hal: 2692.
Lampiran
Dap
(70:30) da
Dap
(70:30) da
n 1. (Lanju
par fosfat pH
an laju alir 1
par fosfat pH
an laju alir 1
utan)
H 6,0 denga
1 ml/menit
H 6,5 dengan
1 ml/menit
an perbandin
an perbandin
ngan fase ge
ngan fase ge
erak dapar f
erak dapar f
fosfat : met
fosfat : meth hanol
Lampiran
Dap
(70:30) da
Dap
n 1. (Lanju
par fosfat pH
an laju alir 1
par fosfat pH
utan)
H 7,0 dengan
1 ml/menit
H 7,5 dengan
an perbandin
an perbandin
ngan fase ge
ngan fase ge
erak dapar f
erak dapar f
fosfat : meth
fosfat : meth hanol
Lampiran
n 2. Kroma kompo analisi
atogram pe osisi fase ge is
enyuntikan erak dapar
A
B
larutan Na fosfat : me
a Siklamat ethanol yang
untuk me g optimum
Lampirann 2. (Lanjuutan)
C
Lampirann 2. (Lanjuutan)
E
Lampiran
Pe Alir 1 ml/ (Sisri), F (
n 2. (Lanju
rbandingan /menit dari (Teajus), da
utan)
n Fase Gera A (BPFI), an G (X-Teh
G
ak dapar fos , B (Vitaco h)
A
sfat : metha ool), C (Nut
anol (70 : 3 trijeruk), D
30) dengan D (Segar Sa
Lampirann 2. (Lanjuutan)
B
Lampirann 2. (Lanjuutan)
D
Lampiran
Pe Alir 1 ml/ (Sisri), F (
n 2. (Lanju
rbandingan /menit dari (Teajus), da
utan)
n Fase Gera A (BPFI), an G (X-Teh
F
G
ak Dapar fo , B (Vitaco h)
osfat : meth ool), C (Nut
anol (75 : 2 trijeruk), D
25) dengan D (Segar Sa
Lampirann 2. (Lanjuutan)
A
Lampirann 2. (Lanjuutan)
C
D
Lampiran
Perb Alir 1 ml/ (Sisri), F (
n 2. (Lanju
bandingan F /menit dari (Teajus), da
utan)
Fase Gerak A (BPFI), an G (X-Teh
F
G
k Dapar fos , B (Vitaco h)
sfat : metha ool), C (Nut
anol (80 : 2 trijeruk), D
20) dengan D (Segar Sa
Lampiran
Per Alir 1 ml/m
Per Alir 1 ml/m
n 3. (Lanju
rbandingan menit, kons
rbandingan menit, kons
utan)
Fase Gerak sentrasi 150
Fase Gera sentrasi 200
C ak Dapar fo 0 ppm.
D ak Dapar fo 0 ppm.
sfat : meth
osfat : meth
anol (70:3
hanol (70:3
30) dengan
30) dengan n Laju
Lampiran 4. Perhitungan persamaan regresi dari kurva kalibrasi Na Siklamat BPFI yang diperoleh secara KCKT pada panjang gelombang 201 nm konsenterasi (X) vc luas area (Y) untuk Na Siklamat
Y = ax + b
,
= 0,5998
b = Y a
= (76,38) – (0,5998) (125)
= 1,405
Sehingga diperoleh persamaan regresi Y = 0,5998 X + 1,405
Untuk mencari hubungan konsentrasi (X) dengan luas area (Y) digunakan
pengujian koefisien korelasi (r)
r ∑XY ∑X ∑Y /n
∑X ∑X /n ∑Y ∑Y /n
, /
/ , , /
No.
Konsentrasi
(ppm) Luas Area
XY X2 Y2
X Y
1 0 0 0 0 0,0000
2 50 31,53 1575 2500 992,25
3 100 64,2 6420 10000 4121,64
4 150 90,8 13620 27500 8244,64
5 200 120,7 24140 40000 14568,49
6 250 151,1 37775 62500 22831,21
∑ 750 458,3 83530 137500 50758,23
= 26242,5 x ,
, ,
Lampiran 5. Perhitungan recovery dengan metode adisi standar
Ditimbang seksama 1,003 g sampel Vitacool dan ditambahkan baku Na
Siklamat sebanyak 1 ml (mengandung 200 ppm Na Siklamat) dan dimasukkan
kedalam labu tentukur 10 ml, dilarutkan dan dicukupkan dengan pelarut hingga
garis tanda sehingga diperoleh larutan dengan kadar baku siklamat 20,71 ppm,
dikocok, kemudian disaring dengan membran filter PTFE 0,2 µm. Diinjeksikan
sebanyak 20 µl menggunakan autosampler ke sistem KCKT dan dideteksi pada
panjang gelombang 201 nm dengan perbandingan fase gerak dapar fosfat :
Lampiran
n 6. Kromaatogram haasil recovery
A
B
Lampirann 6.(Lanjuutan)
C
Lampirann 6.(Lanjuutan)
A
Lampirann 6.(Lanjuutan)
C
Lampiran 7. Hasil pengujian validasi, dengan parameter akurasi, presisi, batas deteksi (LOD), batas kuantitasi (LOQ) Na Siklamat pada Vitacool dengan menggunakan metode adisi standar
No Baku yang ditambahkan ( ppm )
Luas Area Kadar ( ppm )
Sebelum Penambahan
Sesudah Penambahan
Sebelum Penambahan
Setelah Penambahan
1 20,71 76,1 78,4 1245,33 1283,68
2 20,71 75,3 75,4 1231,99 1233,66
3 20,71 76,6 0,0 1253,67 1310,35
4 20,71 76,3 77,4 1248,67 1267,00
5 20,71 75,7 75,8 1238,66 1240,33
6 20,71 76,5 77,1 1252,00 1262,00 Kadar rata – rata (%) Recovery = 101,98
Lampiran 8. Contoh perhitungan % recovery dengan metode adisi standar
% Recovery = A-B
Baku yang ditambahkanx 100%
Keterangan :
A = Konsentrasi sampel setelah penambahan baku siklamat B = Konsentrasi sampel sebelum penambahan baku siklamat
% Recovery = 1266,17 – 1245,05 x100%
20,71
Lampirann 10. Krommatogram daari Nutrijeru
A
Lampirann 10.(Lanjutan)
C
Lampiran 11. Contoh perhitungan untuk mencari kadar Na siklamat dalam
sampel
Y = 0,5998X + 1,405
Luas area = 57,97
Berat Sampel = 1,0307 g
X = 57,97 – 1,405
0,5998
= 94,3064 ppm
Rumus perhitungan kadar Na Siklamat =
Dimana K = Kadar total Na Siklamat dalam sampel (ppm)
X = Konsentrasi Na Siklamat Sesudah pengenceran (ppm)
V = Volume sampel (ml)
Fp = Faktor pengenceran
Bs = Berat sampel
Kadar total Na Siklamat = 9 , ppm /
1,002 g
= 188,82 mg/200 g
= 943,06 mg/kg
Kadar Na Siklamat ke-6 pengulangan pada sampel Nutrijeruk dan kadar
Na siklamat pada % perolehan kembali dapat dihitung dengan cara yang sama
Lampiran 12. Analisis data statistik untuk mencari kadar sebenarnya dari penyuntikkan larutan nutrijeruk
Jadi kadar sebenarnya terletak antara :
µ = X ± t(1-1/2α)dk x n SD
= 1085,444± 4,6041 x
5 16,28
Lampiran 13. Tabel hasil analisa kadar Na siklamat dalam Nutrijeruk
No
Berat
Sampel
(g)
Volume
(ml) Fp Kadar (ppm)
Theoritical
Plate
Tailing
Factor
Luas
Area
1 1,0307 200 10/1 1091,95 2525 1,01 66,9
2 1,0351 200 10/1 1106,45 2703 1,20 67,8
3 1,0402 200 10/1 943,06 2946 1,14 58,0
4 1,0415 200 10/1 1074,94 2530 1,16 65,9
5 1,0430 200 10/1 1064,27 2759 1,07 65,2
Lampirann 14. Kromaatogram darri larutan V
A
B
Lampiran
n 14. (Lanjuutan)
C
Lampiran 15. Analisis data statistik untuk mencari kadar sebenarnya dari
penyuntikkan larutan Vitacool
Lampiran 15. (Lanjutan)
t hitung data 6 =
6 / 56,48
64 , 86
= 3,67
Semua data diterima
Jadi kadar sebenarnya terletak antara :
µ = X ± t(1-1/2α)dk x n SD
= 1075,39 ± 4,0321 x
6 48 , 56
Lampiran 16. Tabel hasil analisa kadar Na siklamat dalam Vitacool
No
Berat
Sampel
(g)
Volume
(ml) Fp Kadar (ppm)
Theoritical
Plate
Tailing
Factor
Luas
Area
1 1,0052 10 10/1 1153,80 2782 1,51 70,6
2 1,0038 10 10/1 1077,11 2149 1,92 66,0
3 1,0047 10 10/1 1114,29 2988 1,54 68,2
4 1,0035 10 10/1 1041,93 2239 1,78 63,9
5 1,0038 10 10/1 1074,44 3053 1,42 65,9
Lampirann 17. Kromaatogram darri larutan Se
A
B
Lampirann 17. (Lanjuutan)
C
Lampiran 18. Analisis data statistik untuk mencari kadar sebenarnya dari penyuntikkan larutan Segar Sari
Lampiran 18. (Lanjutan)
Untuk itu dihitung kembali dengan cara yang sama tanpa mengikutsertakan data ke-4
No Kadar (mg/kg) ( X - ) ( X - )2
Semua data diterima. Jadi kadar sebenarnya terletak antara :
= 602,62 ± 4,6041 x
5 24,36
Lampiran 19. Tabel hasil analisa kadar Na siklamat dalam Segar Sari
No
Berat
Sampel
(g)
Volume
(ml) Fp Kadar (ppm)
Theoritical
Plate
Tailing
Factor
Luas
Area
1 1,0082 10 10/1 596,95 2782 0,79 37,2
2 1,0084 10 10/1 622,12 2149 0,77 38,7
3 1,0058 10 10/1 565,77 2988 0,83 35,3
4 1,0082 10 10/1 601,12 2239 1,22 37,5
5 1,0085 10 10/1 627,13 3053 1,21 39,0
Lampiran 20. Daftar Spesifikasi Sampel
1. Nutrijeruk
Komposisi : Air, gula pasir, asam sitrat, aroma orange, Na
siklamat, Na benzoat, CI 19140, FCF 15985,
Vitamin C
No Batch : 0CAFE
Produsen : Union Pasifik Indonesia
No. Pendaftaran : MD 213127501535
Tgl. Kadaluwarsa : 31 Desember 2014
2. Vitacool
Komposisi : Air, gula pasir, perisa stroberi, Na siklamat, Na
benzoat, pewarna merah
No. Batch : -
Produsen : PT Makmur Artha Sejahtera
No. Pendaftaran : MD 250010003826
Tgl. Kadaluwarsa : 20 April 2014
3. Segar Sari
Komposisi : Mengandung 0,194 g/sachet Na Siklamat
No. Batch : 004A13
Produsen : PT. Kinosentra Industrindo
No. Pendaftaran : MD 249911155354