3
II. TINJAUAN PUSTAKA
2.1 KEDELAI
Menurut para ahli botani, kedelai merupakan tanaman yang berasal dari Manchuria dan sebagian Cina. Kedelai menyebar ke daerah iklim tropis dan subtropis, serta dilakukan pemuliaan sehingga dihasilkan berbagai jenis kedelai bermutu unggul. Kedelai yang dikenal sekarang termasuk dalam famili Leguminosa, subfamili Papilionidae, genus Glycine dan spesies max, sehingga nama latinnya menjadi Glycine max. Tanaman ini tumbuh baik pada tanah dengan pH 4,5. Daerah pertumbuhannya tidak lebih dari 500 m di atas permukaan laut dengan iklim panas dan curah hujan rata-rata 200 mm/bulan. Umur tanaman kedelai berbeda-beda tergantung varietasnya, tetapi umurnya berkisar antara 75 sampai 105 hari (Koswara 1995).
Gambar 1. Kedelai kuning
Kedelai dibagi menjadi dua golongan, pertama berdasarkan jenisnya, yaitu kedelai kuning/putih, kedelai cokelat, kedelai hijau, dan kedelai hitam. Kedua, menurut umurnya terbagi atas umur pendek (60-80 hari), sedang (90-100 hari), dan panjang (110-120 hari) (Cahyadi 2007). Jenis-jenis kedelai tersebut dapat didefinisikan sebagai berikut:
Kedelai kuning, adalah kedelai yang bijinya berwarna kuning atau putih atau juga hijau yang apabila dipotong melintang akan memperlihatkan warna kuning pada irisan kepingnya. Kedelai ini biasa dijadikan tahu atau tempe
Kedelai hitam adalah kedelai yang kulit bijinya berwarna hitam. Kedelai inilah yang biasanya dijadikan kecap
Kedelai cokelat adalah kedelai yang kulit bijinya berwarna cokelat.
Bentuk biji kedelai bergantung pada kultivarnya, dapat berbentuk bulat, gepeng, dan sebagian besar bulat telur. Berdasarkan besar dan bobotnya, kedelai dibedakan menjadi tiga, yaitu:
Kedelai berbiji besar, apabila bobot 100 biji lebih dari 13 gram Kedelai berbiji sedang, apabila bobot 100 biji antara 11-13 gram Kedelai berbiji kecil, apabila bobot 100 biji antara 7-11 gram.
Secara fisik setiap biji kedelai berbeda dalam hal warna, ukuran, dan bentuk biji serta komposisi kimianya. Perbedaan fisik dan kimia tersebut dipengaruhi oleh varietas dan kondisi tempat kedelai tersebut tumbuh. Biji kedelai terdiri dari dua bagian, yaitu kulit biji (testa) dan janin (embrio). Kulit biji ini beragam warnanya, mulai dari kuning, hijau, cokelat, hitam, atau campuran antara warna-warna tersebut. Kulit biji terdiri dari tiga sel, sedangkan janin terdiri dari kotiledon, plumula, dan poros hipokotil bakal akar. Kotiledon merupakan bagian besar dari biji kedelai yang berisi bahan makanan, sebagian besar terdiri dari protein dan lemak (Cahyadi 2007).
4
2.1.1 Komposisi Kimia Kedelai
Dilihat dari segi pangan dan gizi, kedelai merupakan sumber protein yang paling murah di dunia. Berbagai varietas kedelai yang ada di Indonesia mempunyai kadar protein 30,53 sampai 44%, sedangkan kadar lemaknya 7,5 sampai 20,9% (Koswara 1995). Meskipun kadar lemaknya tinggi (sekitar 18%), tetapi kadar lemak jenuh dan nilai kalorinya rendah serta bebas kolesterol. Di dalam lemak kedelai terkandung beberapa fosfolipida penting, yaitu lesitin, sepalin, dan lipositol (Cahyadi 2007). Zat-zat dalam kedelai yang berfungsi menurunkan kolesterol, antara lain sterol tanaman, saponin, dan tokotrienol. Kedelai juga dikenal paling rendah kandungan racun kimia dan residu pestisidanya (Cahyadi 2007). Komposisi kimia kedelai dapat dilihat pada Tabel 1.
Tabel 1. Komposisi kimia biji kedelai kering per 100 gram
Komponen Jumlah Kalori (kkal) 331,0 Protein (gram) 34,9 Lemak (gram) 18,1 Karbohidrat (gram) 34,8 Kalsium (mg) 227,0 Fosfor (mg) 585,0 Besi (mg) 8,0 Vitamin A (SI) 110,0 Vitamin B1 (mg) 1,1 Air (gram) 7,5 Sumber: Koswara 1995
Jika dibandingkan dengan beras, jagung, tepung singkong, kacang hijau, daging, ikan segar, dan telur ayam, kedelai mempunyai kandungan protein yang lebih tinggi, hampir mendekati kadar protein susu skim kering (Tabel 2). Nilai protein kedelai jika difermentasi dan dimasak akan memiliki mutu yang lebih baik dari kacang-kacangan lain. Protein kedelai mempunyai kemampuan untuk ditambahkan dengan berbagai jenis komoditi dengan maksud memperbaiki nilai biologis bahan tersebut (Cahyadi 2007).
5 Tabel 2. Perbandingan antara kadar protein kedelai dengan beberapa bahan
Jenis Makanan Kadar Protein (% BK)
Susu skim kering 36,00
Kedelai 35,00 Kacang Hijau 22,00 Daging 19,00 Ikan segar 17,00 Telur ayam 13,00 Jagung 9,20 Beras 6,80 Tepung singkong 1,10 Sumber: Cahyadi 2007
Protein kedelai merupakan satu-satunya leguminosa yang mengandung semua asam amino esensial, berjumlah 10 asam amino esensial apabila dimasukkan sistein dan tirosin (Tabel 3). Kandungan asam amino yang terdapat dalam kedelai yaitu: 1) Isoleucine, 2) Leusin, 3) Lisin, 4) Methionin, 5) Phenylalanin, 6) Thhreonin, 7) Tryptophane, 8) Valine yang rata-rata tinggi. Kedelai kaya akan lisin dan triptofan tetapi kekurangan asam-asam amino metionin dan sistein, sedangkan serealia kaya akan metionin dan kandungan lisinnya rendah sehingga kedelai merupakan pelengkap yang baik untuk serealia. Kandungan asam amino metionin dan sistein agak rendah jika dibandingkan protein hewani. Selain mengandung asam amino yang relatif lengkap, kedelai juga mengandung asam lemak tidak jenuh tinggi yang dapat menurunkan total kolesterol dalam darah (Cahyadi 2007). Minyak kedelai banyak mengandung asam lemak tidak jenuh sekitar 86% terdiri dari sekitar 52% asam lemak linoleat, 30% asam oleat, 2% asam linolenat, dan 2% asam lemak tidak jenuh lainnya. Asam lemak jenuh hanya sekitar 14% yaitu 10% asam palmitat, 2% asam stearat, dan 2% asam arachidat. Dibandingkan dengan kacang tanah dan kacang hijau, kacang kedelai mengandung asam amino esensial yang lebih lengkap. Dalam kedelai maupun produk kedelai terdapat dua belas jenis isoflavon terdiri dari tiga bentuk nonkonjugasi yang disebut aglikon (yaitu genistein, daidzen, dan glisitein) dan tiga bentuk terkonjugasi untuk masing-masing aglikon yang disebut glikosida. Bentuk terkonjugasi memiliki gugus glukosa tambahan yang dapat bebas dari gugus lain (β-glikosida yaitu genistin, daidzin, dan glisitin) atau dapat terikat ke gugus asetil (6-o-asetilglikosida) atau gugus malonil (6-o-malonilglikosida) (Chiarello et al. 2006). Di samping itu, kedelai mengandung kalsium, fosfor, besi, dan potasium yang berguna bagi pertumbuhan manusia (Koswara 1992).
6 Tabel 3. Kandungan asam amino esensial biji kedelai
Asam Amino Jumlah (mg/g N)
Isoleusin 340 Leusin 480 Lisin 400 Fenilalanin 310 Tirosin 200 Sistin 110 Treonin 250 Triptofan 90 Valin 330 Metionin 80 Sumber: Cahyadi 2007
Kedelai mengandung karbohidrat sekitar 35% (basis kering). Dari kandungan tersebut, hanya 12-14% saja yang dapat digunakan oleh tubuh secara biologis. Karbohidrat pada kedelai terdiri atas golongan oligosakarida dan golongan polisakarida. Golongan oligosakarida terdiri dari sukrosa, stakiosa, dan rafinosa yang larut dalam air. Sementara golongan polisakarida terdiri dari arabinogalaktan dan bahan-bahan selulosa yang tidak larut dalam air dan alkohol. Secara umum, kedelai merupakan sumber vitamin B karena kandungan vitamin B1, B2, nisin, piridoksin dan golongan vitamin B lainnya banyak terdapat di dalamnya. Vitamin lain yang terkandung dalam jumlah cukup banyak yaitu vitamin E dan K. Sementara vitamin A dan D terkandung dalam jumlah yang sedikit. Dalam kedelai muda terdapat vitamin C dengan kadar yang rendah (Koswara 1992).
Kandungan zat bioaktif dalam kedelai diyakini berkhasiat untuk menyembuhkan berbagai penyakit, seperti diabetes, ginjal, anemia, rematik, diare, hepatitis, dan hipertensi. Kandungan genistein dan daidzen yang merupakan bagian dari isoflavon dapat membantu mengurangi kolesterol dalam darah. Kandungan serat dalam kedelai sangat baik untuk membantu sistem pencernaan tubuh. Serat tersebut dapat mengurangi waktu transit dari zat-zat racun yang tidak dibutuhkan oleh tubuh sehingga dapat mengurangi risiko terjadinya kanker kolon. Kedelai terbukti dapat meningkatkan kolesterol baik, yaitu HDL (High Density Lipoprotein), sementara kolesterol jahat, yaitu LDL (Low Density Lipoprotein) tetap rendah (Cahyadi 2007).
Di samping mengandung berbagai senyawa yang berguna bagi tubuh, ternyata pada kedelai terdapat juga senyawa off-flavor dan antigizi yang menyebabkan penyimpangan cita rasa dan aroma pada produk olahan kedelai. Di antara senyawa antigizi yang sangat mempengaruhi mutu olahan kedelai yaitu antitripsin, hemaglutinin, asam fitat, dan oligosakarida penyebab flatulensi. Senyawa off flavor pada kedelai yaitu glukosida, saponin, estrogen, dan senyawa penyebab alergi. Dalam pengolahan, senyawa-senyawa tersebut harus dihilangkan atau diinaktifkan sehingga dihasilkan produk olahan kedelai dengan mutu yang baik dan aman untuk dikonsumsi manusia (Koswara 1992). Apabila biji kedelai sudah direbus, pengaruh inhibitor dapat dinetralkan (Cahyadi 2007).
7 2.1.2 Protein Kedelai
Komponen kimia tertinggi dalam kedelai adalah protein, yaitu antara 38 sampai 49%. Sekitar 65 sampai 80% protein kedelai adalah globulin yang terdapat sebagai protein cadangan, sisanya merupakan enzim-enzim intraseluler (lipoksigenase, urease, dan amilase), hemaglutinin, protein inhibitor, dan lipoprotein membran (Muchtadi 2010).
Globulin merupakan protein terpenting pada kedelai. Protein ini tidak larut dalam air di sekitar titik isoelektriknya tetapi akan segera larut dengan penambahan garam seperti natrium klorida atau kalsium klorida. Globulin larut dalam larutan garam encer pada pH di atas atau di bawah titik isoelektriknya (Pearson 1983). Pada pH sekitar 4,2-4,6; kelarutan protein kedelai mencapai minimum. Kisaran pH tersebut dikenal sebagai titik isoelektrik protein kedelai. Menurut Zayas (1997), kelarutan protein kedelai dalam air meningkat dengan meningkatnya pH dari 6 ke 8 dan suhu dari 10 oC sampai 70 oC. Ketika suhu meningkat, struktur protein terbuka (unfold) menjadi rantai lurus sehingga memungkinkan terjadinya peningkatan interaksi antara protein dan air, kelarutan protein kedelai pun ikut meningkat.
Menurut Wolf dan Cowan (1975), protein kedelai terdiri dari campuran komponen-komponen yang mempunyai berat molekul 8 sampai 600 kDa. Melalui ultrasentrifugasi, protein kedelai dapat digolongkan menjadi empat golongan utama, yaitu protein 2S, 7S, 11S, dan 15S (Tabel 4) (Muchtadi 2010). Protein kedelai juga dapat digolongkan ke dalam 4 fraksi berdasarkan kelarutannya, yaitu albumin (larut dalam air), globulin (larut dalam larutan garam), prolamin (larut dalam alkohol 70%) dan glutelin (larut dalam basa encer).
Tabel 4. Komponen fraksi hasil ultrasentrifusa dari ekstrak protein kedelai
Fraksi Persentase Komponen BM (kDa)
2S 22 Tripsin inhibitor 8-21.5 Sitokrom C 12 7S 37 Hemaglutinin 110 Lipoksigenase 102 β-amilase 61.7 7S globulin 180-210 11S 31 11S globulin 350 15S 11 Polimer 600
Sumber: Wolf dan Cowan (1975)
Globulin 7S dan 11S merupakan dua komponen utama protein cadangan biji kedelai. Kedua fraksi ini disebut sebagai protein cadangan karena tidak mempunyai aktivitas biologis kecuali sebagai asam amino cadangan untuk germinasi biji (Murphy 2008). Protein 7S dan 11S merupakan dua protein utama penyusun globulin dengan jumlah masing-masing sekitar 37% dan 31% dari total protein kedelai (Wolf dan Cowan 1975). Baik globulin 7S maupun globulin 11S terdiri atas subunit-subunit protein. Glisinin atau protein 11S tersusun atas polipeptida asam dan basa yang saling dihubungkan oleh ikatan disulfida. Sementara β-konglisinin atau protein 7S, merupakan protein dengan struktur trimer yang terdiri atas 3 tipe subunit (α’, α dan β) (Liu et al. 2008). Identifikasi protein 7S dan 11S biasanya menggunakan elektroforesis, yang dapat menampilkan pita protein berdasarkan bobot molekulnya. Hasil publikasi Mujoo et
al. (2003) mengenai profil protein tujuh varietas kedelai (SDS-PAGE) dapat dilihat pada
8 Gambar 2. Profil protein tujuh varietas kedelai (SDS-PAGE)
1: Vinton-81; 2: S-20F8; 3: HP-204; 4: IA-2034;
5: Steyer; 6: IA 2020; 7: S-2020; M: marker (Mujoo et al. 2003)
a. Fraksi 11 S (Glisinin)
Glisinin merupakan protein heksamer dengan berat molekul berkisar 320-375 kDa. Subunit-subunit glisinin terdiri atas polipeptida asam (A) dan polipeptida basa (B) yang dihubungkan oleh ikatan disulfida. Polipeptida asam glisinin memiliki berat molekul sekitar 35 kDa, sedangkan polipetida basanya memiliki berat molekul sekitar 20 kDa. Glisinin mengandung paling sedikit 20 ikatan disulfida dan dua grup sulfhidril per mol protein. Ikatan disulfida ini dapat menyebabkan glisinin lebih tahan terhadap denaturasi. Struktur heksamer glisinin stabil karena adanya interaksi elektrostatik dan hidrofobik serta ikatan disulfida (Muchtadi 2010). Skematik struktur molekuler glisinin dapat dilihat pada Gambar 3.
Monomer Trimer Hexamer
Gambar 3. Skematik struktur molekular glisinin (monomer, trimer, dan heksamer); A: polipeptida asam; B: polipeptida basa; : ikatan disulfida
b. Fraksi 7 S (β-konglisinin)
Struktur trimer globulin 7S tersusun atas 3 subunit yaitu α’, α dan β yang dihubungkan melalui interaksi hidrofobik dengan berat molekul sekitar 180 kDa (Muchtadi 2010). Subunit α’ memiliki berat molekul sekitar 72 kDa, sedangkan α dan β memiliki berat molekul masing-masing sekitar 68 dan 52 kDa (Mujoo et al. 2003). Kombinasi subunit-subunit tersebut memberikan berat molekul sekitar 180 kDa tergantung dari subunit penyusunnya. Fraksi 7S
9 merupakan glikoprotein yang tidak mengandung gugus sulfihidril dan kandungan asam amino sulfurnya sangat rendah. Menurut Lewis dan Chen (1978) β-konglisinin merupakan glikoprotein yang mengandung 3,8 sampai 5,4% karbohidrat. Jenis gula yang terdapat dalam protein ini adalah manosa dan glukosamin. Struktur molekuler β-konglisinin dapat dilihat pada Gambar 4.
Gambar 4. Struktur molekul β-konglisinin
2.2 TEPUNG KEDELAI
Tepung kedelai mengandung 15 kali lebih banyak kalsium, 7 kali lebih banyak fosfor, 10 kali lebih banyak zat besi, 11 kali lebih banyak vitamin B1, 9 kali lebih banyak vitamin B2 dibandingkan tepung terigu. Tepung kedelai mengandung sekitar 42% protein. Tepung kedelai dapat dikatakan sebagai produk putih telur nabati yang tertinggi, didapatkan dengan cara menggiling atau menumbuk kacang kedelai. Tepung kedelai jauh lebih baik daripada tepung gandum. Berikut ini merupakan daftar yang menunjukkan betapa tingginya kadar putih telur dari tepung kedelai, jika dibandingkan dengan bahan makanan lain yang kaya akan putih telur (Graaff 2005).
Tabel 5. Perbandingan jenis makanan yang setara dengan kandungan putih telur Jenis Makanan Kandungan putih telur (gram) yang setara dengan bobot
500 gram masing-masing jenis makanan
Tapung kedelai 200 Keju 120 Buncis 110 Daging sapi 99 Telur 65 Sumber: Graaff 2005
Selain kandungan protein yang tinggi, secara kualitatif protein kedelai tersusun dari asam-asam amino esensial yang lengkap dan baik mutunya kecuali asam-asam amino bersulfur yang merupakan faktor pembatas pada kedelai. Bila dibandingkan dengan serealia, kedelai memiliki kelebihan yaitu kandungan asam amino lisin (sebagai asam amino esensial) yang tinggi dan melebihi persyaratan FAO (Food and Agriculture Organization). Bila dinyatakan dalam persentase terhadap persyaratan FAO, maka asam amino lisin pada beras dan gandum hanya mencapai masing-masing 94% dan 67% sedangkan kedelai mengandung lisin 154% dari persyaratan FAO. Begitu pula kandungan asam amino sulfur pada kedelai terdapat dalam jumlah yang lebih rendah daripada serealia (Widaningrum et al. 2005). Dibandingkan dengan produk turunan kedelai lain seperti tahu dan tempe, tepung kedelai lebih mudah dibuat, mudah penggunaannya, dan dapat disimpan lama. Di Amerika dan Eropa, tepung kedelai sering digunakan dalam roti, kue, manisan, karamel, permen, dan produk daging (Graaff 2005).
10 Perbedaan sifat fisiokimiawi tepung kedelai dibandingkan beberapa tepung lain dapat dilihat dalam Tabel 6.
Tabel 6. Sifat fisikokimiawi tepung kedelai, tepung gandum, dan tepung terigu
Komponen (%) Tepung kedelai Tepung garut Terigu*
Rendemen - 12,6 -
Derajat putih - 74,2 86,5
Daya serap air 242,4 120,6 65,8
Kadar air 6,6 7,0 13,2 Kadar abu 1,3 0,3 0,4 Serat kasar 3,2 6,0 1,9 Kadar lemak 27,1 1,4 2,3 Kadar protein 41,7 2,5 14,9 Karbohidrat 23,3 86,9 69,3 Pati - 46,8 33,0 Gula 0,7 0,6 0,3 Tannin - 3,7 -
Sumber: Widaningrum et al. 2005
Keterangan: *Tepung terigu komersial (-) Tidak dianalisis
Tepung kedelai merupakan suatu produk olahan kedelai yang paling sederhana. Proses pembuatan tepung kedelai tidak memerlukan banyak satuan operasi pengolahan. Proses pengolahannya meliputi proses penggilingan halus dari biji kedelai yang sudah dikuliti dan belum diambil lemaknya (full-fat dehulled soybean) ataupun kedelai yang telah diambil lemaknya (defatted flakes made from dehulled soybean) di mana 97% bahan harus lolos saringan standar 100 mesh. Bedasarkan biaya produksinya, tepung kedelai dapat dikategorikan sebagai sumber protein yang paling murah (Koswara 1992).
Proses pembuatan tepung kedelai melalui beberapa tahap proses yaitu proses sortasi dan pembersihan kedelai, pengeringan, pengupasan, penggilingan, dan pengayakan. Secara umum tepung kedelai dapat dibedakan menjadi berbagai jenis berdasarkan proses pembuatannya dan masing-masing tepung akan mempunyai kadar protein dan lemak yang berbeda-beda. Menurut Koswara (1992), tepung kedelai berdasarkan kadar lemaknya dapat dibedakan sebagai berikut:
1. Tepung kedelai tanpa lemak (defatted soy flour), diperoleh dari penggilingan kedelai yang telah diekstrak lemaknya dengan menggunakan larutan pengekstrak sehingga hanya mengandung lemak kurang dari 1%
2. Tepung kedelai lemak penuh (full-fat soy flour), dibuat dari biji kedelai pecah kulit yang masih mengandung minyak sekitar 18-20% yang belum diekstrak
3. Tepung kedelai rendah lemak (low fat soy flour), dibuat dengan penambahan kembali sebagian lemak/minyak ke dalam tepung kedelai tanpa lemak. Kandungan lemak bisa bervariasi sesuai dengan spesifikasi yang diminta, biasanya berkisar antara 4,5 sampai 9%. Kadar lemak yang paling umum untuk tepung kedelai rendah lemak ini adalah sekitar 5sampai 6%
11 4. Tepung kedelai tinggi lemak (high fat soy flour), diproduksi dengan penambahan kembali sebagian lemak/minyak ke dalam tepung kedelai tanpa lemak sampai mencapai kadar lemak sekitar 15%.
2.3 ALAT STEAM BLASTING
Alat steam blasting merupakan salah satu alat yang bekerja dengan prinsip perlakuan panas dan tekanan. Alat tersebut merupakan alat yang dikembangkan oleh Pusat Teknologi Bioindustri, BPPT (Badan Pengkajian dan Pengembangan Teknologi) (Laily et al. 2011).
Steam blasting memiliki prinsip kerja yang hampir sama dengan autoklaf. Perbedaan steam blasting dibandingkan autoklaf terletak pada kemampuannya untuk mencapai tekanan yang
lebih tinggi dan mempunyai katup khusus untuk mengeluarkan uap panas bertekanan secara spontan. Prinsip kerja alat ini yaitu memecah kedelai melalui proses pemanasan bertekanan tinggi dengan memanfaatkan steam generator sebagai pemanas dan penurunan tekanan secara tiba-tiba, sehingga uap air dalam biji yang keluar secara tiba-tiba dapat memecah biji.
(a) (b) (c)
Gambar 5. Gambaran umum alat steam blasting a. Skema alat steam blasting b. Alat steam blasting (tampak depan) c. Alat steam blasting (tampak samping)
(1. gas LPG; 2. kompor sembur; 3. penutup chamber; 4. chamber bahan; 5. katup uap dari boiler ke chamber; 6. katup steam blasting; 7. boiler; 8. katup pembuangan air; 9. katup pembuangan uap; 10. outlet steam; 11. barometer)
Standar cara pengoperasian alat steam blasting adalah sebagai berikut:
1. Tabung gas disiapkan dan dihubungkan dengan regulator kompor (kebocoran gas harus dicek terlebih dahulu)
2. Penutup chamber dibuka dengan sepasang kunci pas nomor 24 3. Keranjang bahan dikeluarkan dari dalam chamber
4. Katup antara chamber dan boiler dibuka, kemudian diisi air sebanyak 6 liter (katup pembuangan air dipastikan dalam posisi menutup)
5. Kompor dihidupkan, dalam waktu kurang lebih 20 menit kenaikan tekanan dalam boiler akan terbaca pada barometer
4 5 3 6 9 10 1 2 7 8 11 11 5 3 4 9 8 7 2 9 5 1
12 6. Bahan yang akan diproses dimasukkan ke dalam keranjang bahan
7. Keranjang bahan dimasukkan ke dalam chamber
8. Chamber ditutup kembali dengan rapat menggunakan kunci pas nomor 24 9. Sebelum memulai operasi, harus dipastikan semua katup dalam posisi menutup 10. Ketika tekanan yang diinginkan tercapai, api kompor dikecilkan
11. Katup antara chamber dan boiler dibuka selama perlakuan lama pemanasan yang diinginkan
12. Setelah pemanasan selesai, katup antara chamber dan boiler ditutup 13. Katup steam blasting dibuka dengan segera
14. Penutup chamber dibuka menggunakan kunci pas nomor 24 dan harus menggunakan sarung tangan tahan panas
15. Keranjang bahan dikeluarkan dan dilakukan penanganan bahan sesuai dengan metode penelitian/pengujian
16. Untuk pengujian lanjutan, dilakukan kembali proses mulai dari nomor 6
2.4 INDEKS KUALITAS KEDELAI
Penggunaan produk-produk berbasis kedelai terbatas karena adanya faktor antinutrisi. Sebagian besar faktor antinutrisi, seperti inhibitor protease dan lektin, rentan terhadap panas dan dapat rusak selama proses pengolahan kedelai. Pemanasan yang ringan (sekitar 90 oC) dapat meningkatkan nutrisi kedelai akibat terdenaturasinya protein dan terbentuknya sisi baru untuk hidrolisis enzimatik. Pemanasan yang kurang tidak dapat menghancurkan faktor antinutrisi sehingga menurunkan daya cerna dan nutrisi kedelai. Sementara pemanasan yang berlebihan dapat menyebabkan perubahan yang tidak diinginkan pada struktur kimia dari sebagian besar asam amino esensial, mengurangi ketersediaan lisin (melalui reaksi Maillard) dan nutrisi kedelai. Oleh karena itu, baik pemanasan yang kurang maupun pemanasan yang berlebihan menghasilkan kualitas kedelai yang rendah. Metode untuk membedakan kecukupan proses panas sangat diperlukan dalam proses pengolahan kedelai (Caprita et al. 2010).
Efek yang penting dan perlu diamati dari proses pengolahan pangan adalah penurunan kualitas nilai gizi, termasuk nilai gizi protein. Denaturasi protein dan penurunan jumlah asam amino karena cross linking, rasemisasi, degradasi, dan pembentukan kompleks dengan gula dapat menurunkan daya cerna protein. Oleh karena itu, ketika menguji kualitas protein, faktor pertama yang penting dan harus dievalusi adalah daya cernanya. Kualitas protein dari kedelai tergantung pada dua parameter, yaitu penurunan faktor antinutrisi dan optimisasi daya cerna protein. Analisis langsung dari kedua parameter tersebut sulit dilakukan pada operasi yang rutin sehingga digantikan dengan pengujian tidak langsung seperti pengukuran kelarutan protein dalam larutan basa dan larutan netral (Caprita et al. 2010). Pengukuran kelarutan protein dalam larutan basa dapat dilakukan dengan metode KOH Protein Solubility (KOH PS), sedangkan pengukuran kelarutan protein dalam larutan netral dapat dilakukan dengan metode
Protein Dispersibility Index (PDI). Sementara, penurunan faktor antinutrisi dapat dapat diukur
dengan metode indeks urease (IU).
Kedelai mengandung urease, yaitu suatu enzim yang menghidrolisis urea menjadi karbon dioksida dan amonia. Produksi amonia menyebabkan peningkatan pH larutan. Urease dapat rusak karena pemanasan. Kerusakan urease sangat berhubungan dengan kerusakan inhibitor tripsin dan faktor antinutrisi lainnya (Caprita R dan Caprita A 2010). Uji urease berdasarkan pada peningkatan pH dari amonia yang dilepaskan oleh urea dengan mengukur residu enzim urease pada kedelai. Amonia bersifat basa dan dapat diukur dengan menggunakan pH meter
13 atau indikator asam basa. Pada metode American Oil Chemists Society (AOCS), titik akhir ditentukan dengan mengukur peningkatan pH dari sampel. Sementara pada metode European
Economic Community (EEC), titk akhir menggambarkan jumlah asam yang dibutuhkan untuk
mempertahankan pH agar tetap konstan. Tujuan utama dari uji indeks urease adalah menentukan kecukupan pemanasan untuk merusak sebagian besar faktor antinutrisi pada kedelai. Peningkatan pH yang optimum umumnya antara 0,05 sampai 0,20 unit pH (Caprita R dan Caprita A 2010).
Kelarutan protein kedelai menurun seiring dengan pemanasan. Uji KOH Protein
Solubility berdasarkan pada kelarutan protein kedelai dalam larutan 0,2% kalium hidroksida.
Uji KOH Protein Solubility merupakan suatu uji yang digunakan untuk mendeteksi
overheating atau overprocessing pada proses pengolahan kedelai, namun tidak sensitif untuk
mendeteksi underheating atau underprocessing (Caprita et al. 2010). Semakin lama proses pemanasan, maka nilai KOH Protein Solubility semakin menurun. Menurut Araba dan Dale (1990), kisaran nilai KOH yang dapat diterima umumnya berkisar antara 70-85%. Batas kritis untuk KOH Protein Solubility sekitar 70% dan nilai di bawah ini mengindikasikan
overprocessing.
Uji PDI sudah digunakan selama 25 tahun pada industri pangan. Hasil penelitian baru-baru ini menunjukkan bahwa metode ini berguna untuk membedakan lebih jauh kualitas kedelai dan lebih baik dalam mengamati kualitas kedelai (Caprita et al. 2010). Selama ini dianggap bahwa kualitas kedelai yang baik hanya berdasarkan pada pengukuran indeks urease dan KOH Protein Solubility. Batal et al. (2000) menjelaskan bahwa PDI memberikan respon paling konsisten terhadap waktu pemanasan dibandingkan indeks urease dan KOH Protein
Solubility. Kedelai dengan nilai PDI sekitar 45% atau kurang umumnya menunjukkan
kecukupan proses pemanasan untuk menghancurkan faktor antinutrisi. Kisaran nilai ini lebih tinggi dibandingkan kisaran 15-30% yang direkomendasikan oleh National Oilseed Processor
Association (NOPA). Kombinasi PDI dan indeks urease dapat berguna untuk memonitor
kualitas kedelai dengan lebih baik. PDI juga lebih sensitif dibandingkan indeks urease dan
KOH Protein Solubility dalam menentukan proses pemanasan kedelai yang optimum. PDI
merupakan prosedur yang mudah dan efektif dalam pengujian kualitas dari kedelai yang telah mengalami pemanasan (Caprita et al. 2010).
Level inhibitor tripsin menurun seiring dengan meningkatnya waktu pemanasan, begitu pula dengan nilai KOH Protein Solubility. Namun, derajat pemanasan yang dibutuhkan untuk mengurangi level inhibitor tripsin lebih rendah daripada yang dibutuhkan untuk mengurangi nilai KOH Protein Solubility. Kedelai dengan nilai KOH Protein Solubility yang tinggi, paling mudah dicerna selama aktivitas ureasenya di bawah batas yang direkomendasikan (Lee dan Garlich 1992). Kedelai dengan nilai PDI yang tinggi (45-50%) dan indeks urease yang rendah (0,3 unit pH atau kurang) menunjukkan bahwa kedelai memiliki kualitas yang tinggi karena telah cukup proses pemanasannya namun tidak overprocessed (Batal et al. 2000).
2.5 ELEKTROFORESIS GEL POLIAKRILAMIDA SODIUM DODESIL
SULFAT (SDS GEL)
Elektroforesis merupakan suatu cara untuk memisahkan fraksi-fraksi campuran berdasarkan pergerakan partikel-partikel koloid yang bermuatan, di bawah pengaruh medan listrik. Elektroforesis banyak digunakan untuk analisis asam nukleat, virus, enzim, dan protein. Pemisahan senyawa dengan elektroforesis dilakukan berdasarkan perpindahan molekul bermuatan karena pengaruh medan listrik. Dalam larutan, protein akan bermuatan karena
14 bersifat amfoter. Pada titik isoelektriknya, protein tidak akan bergerak di bawah pengaruh medan listrik. Pada keadaan pH di bawah pH isoelektrik, protein bergerak sebagai kation di mana kecepatannya naik bersamaan dengan turunnya pH, kation ini akan bergerak ke arah elektroda negatif. Pada keadaan pH di atas pH isoelektrik, protein akan bergerak sebagai anion dan kecepatannya akan naik bersamaan dengan meningkatnya pH, anion ini akan bergerak ke arah elektroda positif (Bintang 2010).
Elektroforesis pada umumnya digunakan untuk menentukan berat molekul (BM), mendeteksi kemurnian dan kerusakan protein atau asam nukleat, menetapkan titik isolistrik, serta memisahkan spesies-spesies yang berbeda secara kualitatif dan kuantitatif. Faktor-faktor yang mempengaruhi pemisahan dengan elektroforesis adalah muatan penyangga, sistem buffer, suhu, waktu, dan besar arus. Semakin tinggi arus maka pemisahan semakin cepat, namun suhu akan bertambah (Bintang 2010).
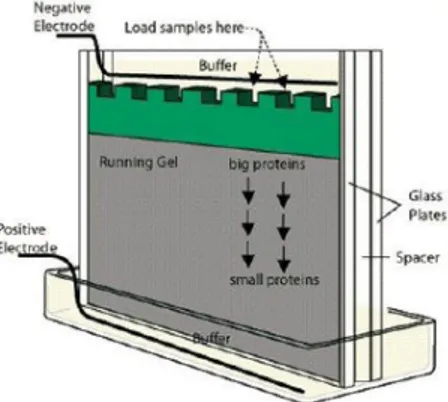
Salah satu jenis elektroforesis yang digunakan secara luas pada saat ini adalah elektroforesis SDS gel poliakrilamida (SDS PAGE) (Bintang 2010). SDS-PAGE (Sodium
Dodecyl Sulfate Polyacrylamide Gel Electrophoresis) adalah suatu metode yang sangat baik
untuk mengidentifikasi dan mengamati protein selama pemurnian serta untuk menilai homogenitas dari fraksi yang dimurnikan tersebut. SDS-PAGE biasanya digunakan untuk menentukan berat molekul subunit protein dan menentukan komposisi subunit dari protein yang dimurnikan. SDS-PAGE juga dapat digunakan dalam tahap persiapan dengan tujuan menghasilkan protein yang cukup untuk studi lebih lanjut (Garfin 1990). Metode SDS-PAGE merupakan metode yang paling sering digunakan untuk menganalisis campuran protein secara kualitatif. Metode ini memisahkan protein berdasarkan berat molekul (Gordon 1983). SDS-PAGE dinilai lebih menguntungkan dibandingkan elektroforesis kertas dan elektroforesis pati. Hal ini disebabkan karena besarnya pori medium penyangga serta perbandingan konsentrasi akrilamida dan bis-metilen akrilamida. Selain itu, gel ini juga tidak menimbulkan konveksi dan bersifat transparan (Bintang 2010). Skematik elektroforesis SDS-PAGE dapat dilihat pada Gambar 6.
Gambar 6. Skematik elektroforesis SDS-PAGE (Jage, 2008)
Medium penyangga dibuat dari reaksi polimerisasi akrilamid dan bis-metilen akrilamid yang dikatalisis oleh amonium persulfat dan tetrametiletilendiamin (TEMED). Polimerisasi akrilamid terjadi karena adanya cross linking antara N,N-metilen-bis akrilamid dan amonium persulfat sebagai katalisator. Polimerisasi ini memerlukan TEMED (N,N,N’,N’-tetrametilen-etilendiamin) sebagai katalisator utama dalam mengawali terjadinya polimerisasi. TEMED menyebabkan terbentuknya formasi radikal bebas amonium persulfat yang akan bereaksi
15 dengan akrilamid dan menghasilkan akrilamid aktif. terbentuklah Akrilamid aktif akan bereaksi dengan sesama akrilamid membentuk polimer yang panjang dan gel. Gel elektroforesis terdiri dari dua bagian yaitu stacking gel dan separating gel. Stacking gel diperlukan agar awal pergerakan sampel sama (Bintang 2010).
Penambahan SDS pada gel poliakrilamid menghasilkan SDS-PAGE yang digunakan
untuk sampel terdenaturasi. SDS merupakan detergen anionik. SDS bersama dengan β-merkaptoetanol yang dilanjutkan dengan pemanasan akan merusak struktur tiga dimensi
menjadi bentuk lilitan acak (Gordon 1983). Hal ini terjadi akibat reduksi ikatan disulfida membentuk gugus sulfidril yang dapat mengikat SDS sehingga protein bermuatan sangat negatif dan bergerak ke arah kutub positif (Bintang 2010). Sementara, Gordon (1983) menjelaskan bahwa SDS-PAGE digunakan pada pH netral dimana pada pH 7 SDS akan membentuk komplek negatif dengan protein sehingga sampel akan bergerak ke arah elektroda positif. Matriks yang digunakan pada SDS-PAGE yaitu agarose dan poliakrilamid. Bahan ini dapat memisahkan molekul berdasarkan ukurannya karena matrik tersebut adalah gel penyerap. Gel penyerap dapat bertindak sebagai penyaring dengan proses perlambatan, atau dalam beberapa kasus dapat menghalangi pergerakan dari molekul yang besar dan membiarkan molekul yang lebih kecil untuk lebih bebas bermigrasi. Agarose gel cair umumnya lebih kaku dan lebih mudah untuk ditangani daripada poliakrilamida pada konsentrasi yang sama sehingga agarose digunakan untuk memisahkan protein besar dan protein kompleks (Gordon 1983).
Gel poliakrilamida bersifat porous dengan ukuran lubang sekitar 0,6-4,0 nm (diameter molekul protein globular 1,6-8,0 nm) dan ditentukan dari persen total akrilamida ditambah bis-akrilamid di dalam campuran gel, serta perbandingan relatif akrilamid dan bis-akrilamid. Migrasi protein di dalam gel poliakrilamida terutama ditentukan oleh muatan molekul dan juga dipengaruhi oleh ukuran molekul. Keberhasilan pemisahan senyawa dengan menggunakan SDS-PAGE tergantung juga pada metode preparasi contoh yang dilakukan, di samping pengaruh ukuran pori gel pemisah dan sistem buffernya (Bintang 2010).
Gel poliakrilamida dapat digunakan tidak hanya untuk pemisahan dari berbagai protein, tetapi juga untuk membandingkan berat molekulnya. Teknik ini dapat digunakan baik untuk tujuan preparatif maupun pemisahan analitik dari sampel protein. Biasanya dengan teknik elektroforesis ini hanya diperlukan beberapa mikrogram sampel protein (Bintang 2010). Gel hasil elektroforesis menunjukkan pita-pita protein dengan berat molekul yang berbeda. Protein dengan berat molekul yang lebih besar akan tertahan diatas, sedangkan protein dengan berat molekul yang lebih kecil akan berada dibawah. Penentuan berat molekul pita protein sampel berdasarkan pita protein marker dapat menggunakan persamaan regresi antara mobilitas relatif (Rf) protein marker dengan logaritma dari berat molekul marker yang telah diketahui. Nilai Rf tersebut dirumuskan sebagai:
Rf = jarak migrasi protein jarak migrasi
Persamaan regresi standar tersebut dapat digunakan untuk menentukan berat molekul pita protein sampel (dengan y = log BM protein dan x = nilai Rf pita protein). Contoh persamaan regresi marker untuk uji SDS-PAGE dapat dilihat pada Gambar 7.
16 Gambar 7. Contoh persamaan regresi standar untuk uji SDS-PAGE
Interpretasi pita protein berdasarkan berat molekul ini umumnya dibandingkan dengan profil protein sejenis yang berasal dari pustaka lain. Profil protein kedelai dengan SDS-PAGE baik total protein maupun hasil pengisolasian protein 11S dan 7S sudah banyak dipublikasikan. Namun berat molekul subunit-subunit pada protein 11S maupun 7S merupakan suatu kisaran, sehingga ada beberapa literatur yang menyatakan berat molekul yang berbeda-beda.