PERBEDAAN AKTIVITAS ANTIOKSIDAN PADA
PERENDAMAN 1 JAM DAN 2 JAM EKSTRAK AIR JAMUR
TIRAM (
Pleorarus ostreatus
)
KARYA TULIS ILMIAH
PUJI RAHAYU HIDAYATI
141310064
PROGAM STUDI DIPLOMA III ANALIS KESEHATAN
SEKOLAH TINGGI KESEHATAN
INSAN CENDEKIA MEDIKA
JOMBANG
ii
PERBEDAAN AKTIVITAS ANTIOKSIDAN PADA
PERENDAMAN 1 JAM DAN 2 JAM EKSTRAK AIR JAMUR
TIRAM (
Pleorarus ostreatus
)
Karya Tulis Ilmiah:
Diajukan Dalam Rangka Memenuhi Persyaratan
Menyelesaikan Studi di Program Studi Diploma III Analis Kesehatan
PUJI RAHAYU HIDAYATI 141310064
PROGRAM STUDI DIPLOMA III ANALIS KESEHATAN
SEKOLAH TINGGI ILMU KESEHATAN
INSAN CENDEKIA MEDIKA
JOMBANG
iii
PERBEDAAN AKTIVITAS ANTIOKSIDAN PADA PERENDAMAN 1 JAM DAN 2 JAM EKSTRAK AIR JAMUR TIRAM (PLEORARUS OSTREATUS)
Puji Rahayu Hidayati*,Awaluddin Susanto**,Miftachul Sobirin*** D-III Analis Kesehatan STIKes ICMe Jombang
2017 jamurtiram. Untukitudilakukanpenelitianuntukmengetahui aktivitas antioksidan dari ekstrak jamur tiram yang direndam 1 jam dan direndam 2 jam.
Aktivitasantioksidandiperolehdenganmenggunakanmetodeperedamradikal bebas DPPH (1,1 difenil-1-prikrilhidrazil) diukur dengan spektrofotometri UV-Vis.
Hasil dari pengujian aktivitas ekstrak air jamur tiram yang direndam 1 jam didapatkan absorbansi 0,80262 dengan konsentrasi 0,21003 dan didapat kadar antioksidan sebesar 4,20 ppm. Pada perendaman 2 jam didapat nilai absorbansi 0,80462 dengan konsentrasi 0,14706 dan didapat kadar antioksidan sebesar 2,94 ppm.
Berdasarkan hasil pengujian aktivitas antioksidan dapat disimpulkan kadar aktivitas antioksidan yang direndam 1 jam sebesar 4,20 ppm dan yang direndam 2 jam sebesar 2,94 ppm.
iv
DIFFERENCESIN ANTIOXIDANT ACTIVITY AT IMMERSION 1 HOUR AND IMMERSION 2 HOUR OF EXTRACTWATER OYSTER MUSHROOM
(Pleurotus ostreatus)
Puji Rahayu Hidayati*,Awaluddin Susanto**,Miftachul Sobirin*** D-III Analis Kesehatan STIKes ICMe Jombang
2017 ABSTRACT
Oyster mushrooms have antioxidant compounds have role as a reaction inhibitor of free radicals by donating one electron to stabilize free radicals. But in the processing of oyster mushrooms can reduce the content of antioxidants in oyster mushrooms. The objectives of this research were to know antioxidant activity effect of immersion time to antioxidant activity of oyster mushroom water extract.
Antioxidant activity was obtained by using the free radical reducer method of DPPH (1,1 diphenyl-1-prikrilhidrazil) measured withUV-Vis spectrophotometric. The result from antioxidant activity test of extract water oyster mushroom was immersion 1 hour obtained absorbance value 0,80262 with concentration 0,21003 and obtained content antioxidant activity 4,20 ppm. At extract oyster mushroom with immersion 2 hour was obtained absorbance value 0,80462 with concentration 0,14706 and was obtained content antioxidant activity 2,94 ppm
Based result of antioxidant activity able conclution antioxidant content of oyster mushroom extract with immersion 1 hour 4,20 ppm, while antioxidant content oyster mushroom water extract immersion for 2 hours 2,94 ppm.
viii
RIWAYAT HIDUP
Penulis dilahirkan di Samarinda, 22 Samarinda 1995 dari pasangan bapak Sunanto dan ibu Khoiriyah. Penulis merupakan anak pertama dari tiga bersaudara.
Tahun 2008 penulis lulus dari SDN Sukoiber 1, tahun 2011 penulis lulus dari SMPN 1 Gudo, dan pada tahun 2014 penulis lulus dari SMA PGRI 2 Jombang. Pada tahun 2014 penulis lulus seleksi masuk STIKes ICMe Jombang melalui jalur PMDK dengan memilih program studi DIII Analis Kesehatan.
Demikian riwayat hidup ini dibuat sebenarnya
Jombang, Agustus 2017
Yang menyatakan
ix
MOTTO
“Mengerjakan secara bertahap akan mendapat hasil yang bertahap”
dengan hasil yang terjamin
“Daripada melakukan secara instan, mendapat hasil yang instan”
x
LEMBAR PERSEMBAHAN
Kupersembahkan Karya Tulis Ilmiah ini untuk Allah SWT
Atas rahmat, karunia dan kemudahan yang telah diberikan Untuk kedua orang tuaku
Sunanto dan Khoiriyah
Untuk dukungan moril maupun materi serta doa yang tiada henti untuk saya. Ucapan terima kasih takkan cukup untuk membalas semua pengorbanan kalian
Kedua Adikku
Amilia Sholikh Hidayati dan Chofifah Nur Hidayati
Senantiasa memberikan dukungan, semangat, senyum dan doanya Sahabat dan Temanku
Sinta, Nurkhasanah M. dan Maya Nurnaningsih
Yang senantiasa memberi masukan, saran, kritikan dan membantu dalam proses penelitian
Dosen Pembimbing
Awaluddin Susanto,S.Pd.,M.Kes dan Miftachul Sobirin,S.Pd.,M.Si
Atas bimbingan, masukan dan saran dalam menyusun karya tulis ini Dosen D III Analis Kesehatan
xi
KATA PENGANTAR
Dengan menyebut nama Allah Yang Maha Pengasih Lagi Maha Penyayang, segala puji syukur peneliti panjatkan kehadirat-Nya, atas segala karunia-Nya, sehingga peneliti dapat menyelesaikan penyusunan karya tulis ilmiah dengan judul “Perbedaan Aktivitas Antioksidan Pada Perendaman 1 Jam Dan 2 Jam Ekstrak Air Jamur Tiram (Pleorarus ostreatus)” sebagai salah satu syarat untuk memperoleh gelar Ahli Madya Analis Kesehatan STIKes Insan Cendekia Medika Jombang.
Keberhasilan karya tulis ilmiah ini tidak terlepas dari bantuan berbagai pihak, oleh karena itu pada kesempatan yang berbahagia ini peneliti ingin mengucapkan terima kasih kepada Bambang Tutuko, S.H.,S.Kep.,Ns.,M.H. selaku Ketua STIKes ICMe Jombang, Erni Setyorini, S.KM., M.M., dan staff dosen D-III Analis Kesehatan STIKes ICMe Jombang, Awaluddin Susanto, S.Si., M.Kes., selaku pembimbing, Miftachul Sobirin, S.Si., M.Si., selaku pembimbing, Begum Fauziah, S.Si., M.Farm., Ibu & Ayah, semua keluarga, serta semua pihak yang tidak dapat peneliti sebutkan satu persatu yang telah membantu peneliti dalam penyusunan proposal karya tulis ilmiah ini.
Peneliti menyadari bahwa dengan segala keterbatasan yang dimiliki, karya tulis ilmiah yang peneliti susun masih jauh dari kesempurnaan. Kritik, saran, dan nasihat sangat diharapkan oleh peneliti demi kesempurnaan karya ini.
Semoga karya tulis ini dapat bermanfaat terutama bagi peneliti dan bagi kita semua.
xii
SURAT PERNYATAAN... vii
RIWAYAT HIDUP ... viii
2.3.3 Bahaya Ros Sebagai Radikal Bebas ... 12
2.3.4 Pembentukan Radikal Bebas ... 12
xiii
2.4.2 Suhu ... 14
2.5 METODE DPPH ... 14
BAB III KERANGKA KONSEP 3.1 Kerangka konsep ... 16
3.2 Penjelasan Kerangka Konsep ... 17
BAB IV METODE PENELITIAN 4.1WAKTU DAN TEMPAT PENELITIAN 4.1.1 Tempat Penelitian ... 18
4.5 IDENTIFIKASI DAN DEFINISI OPERASIONAL VARIABEL 4.5.1 Identifikasi Variabel ... 20
4.5.2 Definisi Operasional ... 20
4.6 PERALATAN DAN BAHAN 4.6.1 Peralatan ... 21
4.6.2 Bahan ... 21
4.7 CARA PENGUMPULAN DATA 4.7.1 Penyiapan sampel ... 21
4.7.2 Uji aktivitas antioksidan dengan metode DPPH ... 22
4.8 ALUR PEMERIKSAAN ... 24
4.9 PENGOLAHAN DAN ANALISA DATA 4.9.1 Pengolahan Data ... 25
4.9.2 Analisa Data ... 26
BAB V HASIL DAN PEMBAHASAN 5.1Hasil ... 27
5.2Pembahasan ... 29
BAB VI SIMPULAN DAN SARAN 6.1Kesimpulan ... 33
6.2Saran ... 33 DAFTAR PUSTAKA
xv
DAFTAR TABEL
Tabel 4.1 Definisi Operasional ... 20
Tabel 5.1 Perbedaan Struktur Jamur Tiram Sebelum Dan Sesudah Perendaman ... 27
Tabel 5.2 Hasil Uji Antioksidan Ekstrak Jamur Tiram ... 28
Tabel 5.3 Hasil Uji Pengukuran Absorbansi Vitamin C ... 28
xvi
DAFTAR GAMBAR
Gambar 2.1 Morfologi Jamur Tiram ... 6
Gambar 3.1 Kerangka Konsep ... 16
Gambar 4.1 Kerangka Kerja ... 19
xvii
DAFTAR LAMPIRAN
Lampiran 1. Lembar Konsul Proposal dan Karya Tulis Ilmiah Pembimbing I Lampiran 2. Lembar Konsul Proposal dan Karya Tulis Ilmiah Pembimbing II Lampiran 3. Lembar Hasil Pemeriksaan Kadar Antioksidan Laboratorium ULP Lampiran 4. Hasil Perhitungan Persen Penghambat
Lampiran 5. Surat Penelitian Lampiran 6. Dokumentasi
1
BAB I
PENDAHULUAN
1.1 Latar BelakangRadikal bebas adalah sebuah molekul atau fragmen molekular yang berisi satu atau lebih elektron tidak berpasangan dibagian terluar atom atau orbital molekul. Keberadaan dari elektron yang tidak berpasangan menjadi sifat umum yang dimiliki oleh kebanyakan radikal. Radikal bebas menyerang makromolekul yang memicu kerusakan sel dan gangguan homeostatik. Target dari radikal bebas termasuk dalam semua macam molekul dalam tubuh, diantaranya, lipid, asam nukleat, dan protein. (Muhammed dkk.2015). Senyawa yang dapat mencegah atau mengurangi timbulnya aktivitas radikal bebas bebas adalah antioksidan (Lusiana.2015) Antioksidan sendiri bekerja dengan cara menunda dan menghambat pembentukan radikal bebas serta mengganggu propagasi dari radikal bebas. Satu molekul antioksidan dapat bereaksi dengan radikal bebas tunggal dan mampu untuk menetralkan radikal bebas dengan mendonasikan satu elektronnya, dengan berakhirnya reaksi hilangnya karbon ( Brewer.2011; Sen dkk.2010).
Tubuh dapat memproduksi antioksidan sendiri yang dinamakan dengan antioksidan endogen. Antioksidan endogen diproduksi untuk menetralkan radikal bebas dan melindungi tubuh dari penyakit yang serta kerusakan jaringan. Selain antioksidan endogen, terdapat pula antioksidan eksogen yang diperoleh melalui makanan yang juga berperan penting untuk melindungi tubuh. Sumber utama antioksidan eksogen secara alami
2
berasal dari biji padi-padian, buah, dan sayuran yang mengandung komponen antioksidan seperti vitamin C, vitamin E, karoten, asam fenolik, fitat, dan fitoestrogen yang telah diakui memiliki potensi untuk mengurangi resiko penyakit (Sen dkk.2010).
Antioksidan eksogen bekerja dengan cara mengganggu reaksi berantai radikal bebas. Senyawa pada tanaman yang memiliki kemampuan antioksidan eksogen adalah fenolat dan flavonoid. Fenolik memiliki kemampuan untuk donasi akitivitas atom H dan flavonoid berfungsi sebagai senyawa kelat dari logam (Brewer.2011). Sedangkan flavonoid sebagai salah satu kelompok antioksidan alami yang terdapat pada jenis padi-padian (sereal), sayur-sayuran dan buah. Flavonoid berperan sebagai antioksidan dengan cara mendonasikan atom hidrogennya atau melalui kemampuannya mengkelat logam, berada dalam bentuk glukosida (mengandung rantai samping glukosa) atau dalam bentuk bebas yang disebut aglikon (Redha.2010). Salah satu sumber makanan yang mempunyai kandungan antioksidan adalah jamur tiram.
3
memiliki fungsi sebagai antioksidan (Azhari.Yuliet.Khaerati.2016; Chang dan Miles.2004)
Pada penelitian yang dilakukan oleh Sari (2012) yang meneliti adanya antioksidan pada jamur tiram menggunakan ekstrak metanol, n-heksana hasil partisi, etil asetat hasil partisi, dan metanol hasil partisi semuanya dapat menunjukkan adanya antioksidan. Meskipun memiliki aktivitas antioksidan yang cukup tinggi pengolahan jamur tiram dapat mempengaruhi kandungan jamur tiram. Hal ini didukung oleh penelitian yang dilakukan oleh Momot dan Suryanto (2016) perendaman yang terlalu lama juga dapat menyebabkan penurunan aktivitas antioksidan
4
1.3 Tujuan Penelitian
Berdasarkan rumusan masalah tujuan dari penelitian ini adalah sebagai berikut :
1. Untuk mengetahui aktivitas antioksidan ekstrak air jamur tiram yang direndam 1 jam
2. Untuk mengetahui aktivitas antioksidan ekstrak air jamur tiram yang direndam 2 jam
1.4 Manfaat Penelitian
Manfaat penelitian ini adalah sebagai berikut :
1.4.1 Manfaat Teoritis
Secara teoritis hasil penelitian ini diharapkan mampu menambah pengetahuan dan pemahaman bagi semua pihak mengenai pengaruh suhu dan waktu perendaman ekstrak air jamur tiram terhadap aktivitas antioksidan.
1.4.2 Manfaat Praktis
a. Dapat menjadi acuan bagi peneliti lain untuk melakukan pengembangan metode pemeriksaan lain pada penelitian selanjutnya.
5 Kedudukan jamur tiram dalam dunia fungi adalah sebagai berikut:
Super Kingdom : Eukaryota
Kingdom : Fungi
Subdivisi : Eumycota
Kelas : Basidiomycota
Ordo : Agaricales
Genus : Pleurotus
Spesies : Pleurotus astreatus
2.1.2 Morfologi
Jamur tiram (P. astreatus) memiliki tekstur lembut dan memiliki variasi warna mencakup biru gelap, putih, kuning kecoklatan, kuning, dan merah muda. Tudung (pileus) biasanya berbentuk seperti kerang. Intensitas warna mungkin dapat berubah sesuai dengan perubahan faktor lingkungan, cahaya, dan suhu. Umumnya, warna menjadi lebih gelap dalam kondisi cahaya berlebih dan suhu dingin, dan warna akan terang dalam keadaan
6 morfologi secara umum dari jamur tiram.
Gambar 2.1 Morfologi Jamur Tiram
2.1.3 Kandungan Jamur Tiram
Jamur tiram putih mengandung protein, lemak , fosfor, besi, tiamin, dan riboflavin lebih tinggi disbanding dengan jamur tiram lainnya. Dalam 100 gram jamur tiram mengandung protein 19%-sangat rendah sehingga aman dikonsumsi (Nasution.2016). Jamur
tiram mengandung flavonoid yang mempunyai aktivitas
7
Reaktif Nitrogen) malaui transfer elektreon sera penghambat peroksidasi (Azhari, Yuliet, Khaerati.2016)
2.2 Antioksidan
2.2.1 Pengertian Antioksidan
Antioksidan adalah substansi yang menunda dan menghambat kerusakan oksidatif sebuah molekul. Pada satu waktu antioksidan dapat molekul dapat bereksi dengan satu radikal bebas dan sanggup menetralkan radikal bebas dengan medonorkan satu dari elektronnya. Antioksidan mencegah sel dan kerusakan jaringan. Sel memproduksi pertahanan melawan kelebihan radikal bebas dengan mekanisme pencegahan, mekanisme perbaikan, pertahanan fisik, dan pertahanan antioksidan.
2.2.2 Fungsi Antioksidan
Karakteristik dari antioksidan adalah mempunyai kemampuan untuk mengangkap radikal bebas. Radikal bebas sangat reaktif dan spesies oksigen diberikan dalam sistem biologi dari sumber variasi luas. Radikal bebas dapat mengoksidasi asam nukleat, protein, dan lipid, atau DNA, serta memicu penyakit degeneratif. Komponen antioksidan seperti asam fenolik, asam polyphenol, dan flavonoid mencari radikal bebas seperti peroksidase, hydroperoksidase atau peroksil lipid, dan menghambat mekanisme oksidatif yang memicu penyakit degeneratif (Parkash.2001)
8
dari spsies reaktif oksigen (ROS) dengan menggunaan mekanisme antioksidan enzimatik. Antioksidan enzimatik mengurangi level dari hidroperoksidase lipid dan H2O2, dengan demikian antioksidan enzimatik memiliki peran penting dalam mencegah peroksidase lipid, dan memelihara struktur dan fungsi membrane sel (Nimse.2015).
2.2.3 Cara Kerja Antioksidan
Antioksidan adalah komponen atau sistem yang menghambat formasi dari radikal bebas atau memotong perambatan dari radikal bebas oleh satu atau beberapa mekanisme (Brewer.2010) :
1. Mencari spesies yang memulai peroksidasi
2. Pengkelatan ion logam seperti yang tidak dapat menghasilkan spesies reaktif atau peruraian peroksidase
3. Pendinginan O2 pembentukan peroksidae 4. Memotong reaksi berantai autosidatif 5. Mengurai konsentrasi O2
2.2.4 Mekanisme Kerja
9
hilangnya salah satu atom hodrogen. Pada tahap selanjutnya yaitu propagasi, radikal asam lemak akan bereaksi dengan oksigen membentuk radikal peroksi. Radikal peroksi lebih lanjut akan menyerang asam lemak sehingga menghasilkan hidroperoksiase dan radikal asam lemak baru.
Inisiasi : RH R* + H* (reaksi 1)
Propagasi : R* + O2 ROO* (reaksi 2)
ROOH* + RH ROOH + R* (reaksi 3)
Hidroperoksida akan terbentuk sifat tidak stabil dan akan terdegradasi lebih lanjut menghasilkan senyawa-senyawa karbonil rantai pendek seperti aldehida dan keton yang bertanggung jawab atas flavor makanan berlemak. Tanpa adannya antioksidan reaksi oksidasi akan mengalami terminsai melalui reaksi antar radikal bebas yang membentuk bukan radikal bebas (Sari.2012)
Terminasi : ROO* + ROO* non radikal (reaksi 4)
R* + ROO* non radikal
R* + R* non radikal
2.2.5 Antioksidan Alami
10
buah telah banyak dipulikasikan. Flavonoid berperan sebagai antioksidan alami dengan cara mendonasikan atom hidrogen atau melalui kemampuan sebagai senyawa kelat logam berada dalam bentuk glukosa (mengandung rantai samping glukosa) ayau dalam bentuk bebas disebut aglikon (Redha.2010)
Setiap grup flavonoid memiliki kapasitas antioksidan. Flavon dan catechin rasaya menjadi flavonoid paling kuat untuk melindungi tubuh dari spesies reaktif oksigen. Sel tubuh dan jaringan secara terus menerus terancam mengalami kerusakan disebabkan radikal bebas dan spesies rekatif oksigen yang diproduksi secara selama mekanisme oksigen normal atau diinduksi oleh kerusakan eksogen.
Peningkatan spesies reaktif oksigen selama cidera hasil dari konsumsi dan penipisan senyawa antioksian endogen. Flavonoid memiliki efek adiktif sebagai senyawa antioksidan. Flavonoid dapat mengganggu ≥ 3 sistem produksi radikal bebas dan juga
dapat menigkatkan fungsi antioksidan endogen.
11
1. Secara langsung mencari spesie reaktif oksigen 2. Pergerakan dari antioksidan enzimtik
3. Aktivitas perkelatan logam 4. Reduksi dari radikal α- tocoperil
5. Menurunkan tekanan oksidasi yang disebabkan oksida nitrit 6. Meningkatkan kemampuan antioksidan dari antioksidan
molekular yang rendah (Prochazkova.2011). 2.3 Radikal Bebas
2.3.1 Pengertian Radikal Bebas
Radikal bebas adalah sebuah molekul atau fragmen molekular yang berisi satu atau lebih elektron tidak berpasangan dibagian terluar atom atau orbital melekul. Spesies reaktif oksigen (ROS) dan spesies reaktif nitrogen (RNS) gambaran dari radikal bebas dan non radikal bebas. Reaktivitas dari radikal bebas umumnya lebih kuat dari spesies non radikal meskipun radikal lebih kurang stabil. Radikal bebas dibentuk dari perpecahan molekul homolitik dari ikatan senyawa dan melalui reaksi redoks, dalam satu kali pembentukan reaktif yang tinggi dapat memulai reaksi berantai (Sen.2011)
2.3.2 Jenis Radikal Bebas
12
dioksigen membentuk radikal anion superoksida (O2-). Anion superoksida, timbul melalui proses metabolit atau mengikuti aktivitas oksigen oleh penyinaran fisik dianggap sebagai ROS utama, dan dapat berinteraksi lebih lanjut dengan molekul lain untuk menghasilkan ROS kedua, baik secara langsung atau umum melalui enzim, logam, proses katalis.(Valko.2007).
2.3.3 Bahaya ROS sebagai Radikal Bebas
Pada konsentrasi tinggi, ROS dapat menjadi mediator dari kerusakan struktur sel, asam nuklaer, lipid, dan protein. O2- radikal bertanggung jawan untuk peroksidase lipid dan kemampuan untuk menurunkan aktivitas pertahanan sistem enzim seperti katalase
(CAT) dan peroksidase glutathione (GPx), yang dapat
menyebabkan kerusakan ribonukleat yang dibutukan untuk sistesis DNA (Sen.2011)
2.3.4 Pembentukan Radikal Bebas
Pembentukan ROS (Spesies Reaktif Oksigen) dimulai dari penyerapan oksigen, aktivasi oksidasi NADPH, dan produksi radikal superoksida anion (O2-, 1). Kemudian O2- secara cepat diubah menjadi H2O2 oleh SOD (2)
ROS dapat berperan menjadi salah satu dari dua oksigen
13
moikroorganisme. Spesies reaktif dapat juga dibentuk oleh sistem myoloperoksidase-halida-H2O2. Enzim myeloperoksidase (MPO) dihasilkan di granula sitoplasma neutrophil, yang menhadirkan ion clorida, dimana H2O2 diubah menjadi hypochlorous (HOCl, 3) berpotensi oksidan kuat dan agen antimikroba.
ROS juga dibentuk dari O2- dan H2O2 melalui resoiratory burst oleh reaksi Fenton (4) dan Haber-Weiss (5)
2.4 Faktor yang Mempengaruhi Aktivitas Antioksidan
2.4.1 Pelarut Ekstraksi
14
2.4.2 Suhu
Suhu selama pengeringan dan ekstraksi, memberi pengaruh kepada stabilitas komponen karena kimia dan degradasi enzimatik, kehilangan karena penguapan dari dekomposisi termal. Selain itu, untuk antioksidan sintetik evaporasi dan dekomposisi menjadi mekanisme utama hilangnya aktivitas. Dalam penambaan dekomposisi termal, fenol dapat bereaksi komponen lainnya. Terjadi penurunan sekitar 20% antivitas antioksidan pada pemanasan 90O C. Suhu selama ekstraksi dapat mempengaruhi
perbedaan komponen ekstrak, pendidihan dan dibiarkan
meningkatkan kandungan total polyphenol (Moure.2001). 2.5 Metode DPPH (1,1-diphenyl-2picrylhydrazyl)
Metode DPPH digunakan untuk menentukan aktivitas antioksidan dengan cara menggunakan radikal bebas yang stabil α, α-diphenyl-β picrylhydrazyl (DPPH; C18H12N5O6, M=394.33). Metode ini berdasarkan
kemampuan kapasitas pencarian aktioksidan. Elektron ganjil dari atom
nitrogen dalam DPPH direduksi dengan menerima atom hydrogen dari
antiokisdan (Kadare dan Singh.2011)
15
Ketika larutan DPPH dicampur dengan subtansi yang dapat mendonorkan atom hydrogen menyebabkan reduksi dengan hilangnya warna violet (residu menjadi berwarna kuning pucat). Mewakili radikal DPPH oleh Z● dan donor molekul oleh AH, reaksi sebagai berikut
Ketika ZH direduksi dan A● merupakan radikal bebas diproduksi pada tahap pertama. Radial yang terakhir mengalami reaksi lebih lanjut yang mengontrol stoikiometri, yaitu berkurangnya jumlah molekul DPPH oleh satu molekul pereduksi.
Komponen antioksidan dapat larut air, lipid, dan tidak dapat larut atau melewati batas dinding sel. Bahan pelarut yang ditetapkan dalam mencari aktivitas radikal oleh DPPH adalah metanol dan etanol. Konsentrasi kerja larutan DPPH menggunakan konsentrasi antara 0,05 mM sampai 1,5 M. Lamanya reaksi dari pencarian aktivitas antara larutan DPPH dari sampel adalah 30 menit. Penentuan absorbansi dari pencarian aktivitas radikal bebas oleh DPPH pada panjang gelombang 517 nm dan 515 nm (Molyneux.2004).
16
BAB III
KERANGKA KONSEP
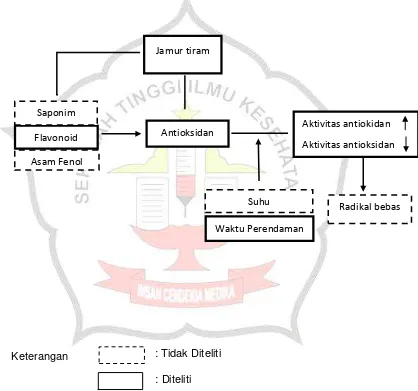
3.1 Kerangka KonsepKerangka konsep dalam penelitian ini disajikan pada gambar 3.1
Gambar 3.1 Kerangka Konseptual Perbedaan Aktivitas Antioksidan Pada Perendaman 1 Jam Dan 2 Jam Ekstrak Air Jamur Tiram (Pleorarus ostreatus)
Jamur tiram
Antioksidan
Radikal bebas Suhu
Flavonoid Saponim
Asam Fenol
Keterangan : Tidak Diteliti
: Diteliti
Waktu Perendaman
17
3.2 Penjelasan Kerangka Konseptual
Jamur tiram (Pleorarus ostreatus) memiliki kandungan flavonoid , asam fenol dan saponim. Kandungan flavonoid yang dimiliki oleh jamur tiram memiliki aktivitas antioksidan yang tinggi (Chang dan Miles.2004). Aktivitas aktioksidan pada sayuran dapat dipengaruhi oleh suhu dan waktu perendaman. Kandungan antioksidan akan menurun seiring dengan meningkatnya suhu dan lama pemansan (Wassalwa.2016). Sedangkan untuk waktu perendaman menunjukkan bahwa semakin lama perendaman
semakin menurunkan kemampuan antioksidan (Momuat dan
Suryanto.2016). Meningkat dan menurunnya aktivitas antioksidan akan berpengaruh terhadap kemampuan antioksidan dalam menangkal radikal bebas.
18
BAB IV
METODOLOGI PENELITIAN
4.1 Waktu dan Tempat Penelitian
4.1.1 Waktu Penelitian
Penelitian ini dilaksanakan mulai dari perencanaan (penyusunan proposal) sampai dengan penyusunan laporan akhir dari bulan November 2016 sampai dengan Mei 2017.
4.1.2 Tempat Penelitian
Lokasi penelitian untuk pembuatan ekstrak jamur tiram akan dilaksanakan di Laboratorium Mikrobiologi Program Studi DIII Analis Kesehatan STIKES ICME JOMBANG dan untuk uji DPPH dilakukan di Laboratorium ULP Fakultas Farmasi Universitas Airlangga. Sedangkan bahan jamur tiram dalam penelitian ini didapat dari tempat budidaya jamur tiram di Jalan dr. Sutomo gang Kecamatan 1-2 Jombang.
4.2 Desain Penelitian
Desain penelitian yang digunakan dalam penelitian ini adalah deskriptif yaitu penelitian bertujuan untuk mendeskriptikan, menjelaskan, memaparkan tentang perbedaanaktivitas antioksidan pada perendaman 1 jam dan 2 jam ekstrak air jamur tiram yang dibandingkan dengan vitamin C.
19
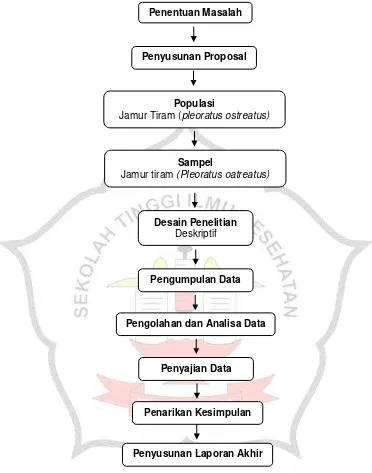
4.3 Kerangka Kerja
Kerangka kerja dalam penelitian ini disajikan pada gambar 4.1
Gambar 4.1 Kerangka Kerja Perbedaan Aktivitas Antioksidan Pada Perendaman 1 Jam Dan 2 Jam Ekstrak Air Jamur Tiram (Pleorarus ostreatus)
Penentuan Masalah
Penyusunan Proposal
Populasi
Jamur Tiram (pleoratus ostreatus)
Sampel
Jamur tiram (Pleoratus oatreatus)
Desain Penelitian Deskriptif
Pengolahan dan Analisa Data Pengumpulan Data
Penyajian Data
Penarikan Kesimpulan
20
4.4 Populasi, Sampel, dan Teknik Pegambilan Sampel
4.4.1 Populasi
Polulasi dalam penelitian ini adalah jamur tiram (Pleorarus ostreatus)
4.4.2 Sampel
Sampel dalam penelitian ini adalah adalah jamur tiram (Pleorarus ostreatus)
4.5 Identifikasi dan Definisi Operasional Variabel
21
4.7 Cara Pengumpulan Data
4.7.1 Penyiapan sampel
A. Jamur Tiram Dengan Air Suhu Kamar 1. Mencuci bersih jamur tiram hingga bersih 2. Memotong jamur tiram kecil-kecil
3. Menimbang jamur tiram yang sudah dipotong seberat 50 gr
22
5. Merendam jamur tiram dengan aquadets selama 1 jam dan 2 jam
6. Diperas dan disaring untuk menghasilkan ekstrak air
4.7.2 Uji Aktivitas Antioksidan dengan Metode DPPH
a. Pembuatan Kurva Kalibrasi Asam Askorbat
1. Sebanyak 0,2 mL larutan asam askorbat dimasukkan dalam tabung reaksi
2. Menambahkan dengan 1,5 mL metanol pada tabung reaksi yang sama
3. Kemudian dipipet sebanyak 0,3 mL
4. Menambahkan dengan metanol sebanyak 7,5 mL
5. Menambahkan dengan DPPH 0,3 mL
6. Diakukan pengkuran absorban dengan spektrofotometer dengan panjang gelombang 517 nm.
7. Menghitung persen aktivitasnya b. Penetapan serapan kontrol
1. Memipet 5 mL larutan DPPH 0,5 mM ke dalam labu ukur 25 mL
2. Menambahkan metanol pada labu ukur yang sama sampai pada garis tanda batas labu ukur
3. Mengukur absorbansi DPPH dengan spektrofotometer pada panjang gelombang 517 nm
23
1. Menimbang 25 mL ekstrak jamur tiram dilarukan dengan metanol 25 mL
2. Dimasukkan kedalam labu ukur 25 mL
3. Menambahkan dengan metanol pada labu ukur yang sama sampai garis tanda batas labu ukur
4. Larutan induk dipipet sebanyak 0,1 ml; 0,2 ml; 0,3 ml; 0,4 ml; ke dalam labu ukur 25 ml yang berbeda.
5. Didapatkan masing-masing konsentrasi uji 4 ppm, 8 ppm, 2 ppm, dan 16 ppm
6. Kedalam masing-masing labu ukur ditambahkan 0,5 ml larutan DPPH 0,5 mM
7. Menambahkan dengan metanol pada labu ukur yang sama sampai garis tanda batas labu ukur
8. Disimpan di tempat gelap selama 30 menit.
9. Masing-masing konsentrasi diukur absorbansi dengan
menggunakan spektrofotometer pada panjang gelombang 517 nm
d. Penentuan Aktivitas Antioksidan
Aktivitas antioksidan dinyatakan dalam persen penghambat (% inhibition) dan dapat dihitung dengan rumus sebagai berikut:
% 𝑖𝑛ℎ𝑖𝑏𝑖𝑡𝑖𝑜𝑛=𝐴𝑏𝑠𝑜𝑟𝑏𝑎𝑛𝑏𝑙𝑎𝑘𝑜 − 𝑎𝑏𝑠𝑜𝑟𝑏𝑎𝑛𝑠𝑎𝑚𝑝𝑒𝑙
24
4.8 Alur Pemeriksaan
Jamur Tiram (Pleoratus ostreatus) 50 gr
Ditambahkan Aquadest 500 ml
Perendaman 1 Jam
Ekstrak Air Jamur Tiram
Ekstrak Air
Spektrofotometer panjang gelombang 517 nm
Perhitungan % inhibition Larutan
Blanko DPPH
25 mg dilarutkan etanol dalam labu ukur 25 mL
0,1 ml 0,2 ml 0,3 ml 0,4 ml Dilakukan pengenceran dalam labu ukur 25 mL Larutan induk
Ditambahan 5 ml DPPH 0,5 mM Ditambahakan etanol sampai garis tanda
Ekstrak Air Jamur Tiram
16 ppm
Dipotong kecil-kecil
25
26
4.9 Pengolahan dan Analisa Data
4.9.1 Pengolahan data dalam penelitian ini dilakukan dengan cara :
Setelah data terkumpul, maka dilakukan pengolahan data terlebih dahulu melalui tahap coding, tabulating.
a. Coding
Pada penelitian ini,penelii memberikan kode sebagai berikut 1. Data umum
Katagori : 1. Nilai Absorbansi
2. Nilai Persen Penghamabat 3. Kadar Antioksidan
b. Tabulating
Dalam penelitian ini data disajikan dalam bentuk tabel yang menggambarkan hasil pemeriksaan aktivitas antioksidan jamur tiram: 1. Tabel data Perubahan Struktur dan Warna Jamur Tiram setelah
perlakuan
2. Tabel data Absorbansi dari Ekstrak Jamur Tiram
27
4.9.8 Analisa Data
28 gang Kecamatan 1-2 Jombang.
Sejumlah 50 gr jamur tiram direndam dengan aquadest sebanyak 500 mL dengan perbedaan waktu perendaman selama 1 jam dan 2 jam. setelah dilakukan perendaman didapatkan perbedaan morfologi jamur tiram. Selama proses perendaman terjadi penyerapan air kedalam sel sel jamur ditandai dengan perubuhanan warna dan tekstur jamur tiram. Perbedaan struktur jamur tiram setelah dilakukan perendaman disajikan pada tabel 5.1
Tabel 5.1 Perbedaan Tekstur Jamur Tiram Sebelum dan
Sesudah Perendamandi Laboratorium
Mikrobiologi D III Analis Kesehatan tahun 2017
Perlakuan Tekstur Jamur Tiram Warna
Sebelum perendaman Kering, tidak lembek Putih
Perendaman 1 jam Basah, lembek Putih pucat
Perendaman 2 jam Basah, lembek Putih pucat
5.1.2 Uji Aktivitas Antioksidan
Setelah didapat ekstrak jamur tiram dilakukan pengujian anktivitas antioksidan dengan melakukan perendaman radikal bebas DPPH (1,1 dipenhilpikrilhidrazil). Pengujian aktivitas
29
antioksidan masing-masing ekstrak menggunakan spektrofotometer UV-Vis dengan penjang gelombang 520 nm. Selanjutnya, diukur absorbansinya sehingga didapatkan konsentrasi dan kadar antioksidan dari jamur tiram. Hasil kadar antioksidan dapat dilihat pada tabel 5.2
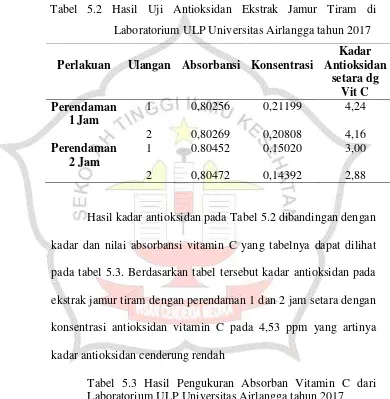
Tabel 5.2 Hasil Uji Antioksidan Ekstrak Jamur Tiram di Laboratorium ULP Universitas Airlangga tahun 2017
Perlakuan Ulangan Absorbansi Konsentrasi
Kadar
Hasil kadar antioksidan pada Tabel 5.2 dibandingan dengan kadar dan nilai absorbansi vitamin C yang tabelnya dapat dilihat pada tabel 5.3. Berdasarkan tabel tersebut kadar antioksidan pada ekstrak jamur tiram dengan perendaman 1 dan 2 jam setara dengan konsentrasi antioksidan vitamin C pada 4,53 ppm yang artinya kadar antioksidan cenderung rendah
Tabel 5.3 Hasil Pengukuran Absorban Vitamin C dari Laboratorium ULP Universitas Airlangga tahun 2017
30
Selain dibandingkan dengan kadar antioksidan vitamin C ekstrak jamur tiram dengan perendaman 1 dan 2 jam juga dihitung persen penghambat (% inhibition) yang dapat dilihat pada tabel 5.4 dari Laboratorium ULP Universitas Airlangga tahun 2017. Pada tabel tersebut rata-rata kemampuan antioksidan esktrak jamur tiram cenderung rendah jika dibandingkan dengan vitamin C.
Tabel 5.4 Nilai Persen Penghambat (% inhibition) dari Rumus Perhitungan Persen Penghambat tahun 2017
5.2 Pembahasan
5.2.1 Proses Perendaman
Pada proses perendaman jamur tiram menggunakan aquadest terjadi perubahan tesktur jamur. Jamur tiram yang awalnya keras dan kering menjadi basah dan lembek serta mengandung banyak air. Semakin lama perendaman semakin banyak pula kandungan air dalam jamur tiram. Hal ini menyebabkan kandungan flavonoid dalam jamur tiram berkurang seiring lamanya perendaman. Menurut Momout dan Suryanto (2016) perendaman yang semakin
Perlakuan Absorbansi Persen
31
lama menyebabkan penurunan kandungan flavonoid hal ini desebabkan karena adanya katalisis oleh enzim polyfenoloxidase Setelah direndam dan didapatkan ekstrak, pengujian dilanjutkan untuk mengetahui kandungan antioksidan dengan metode DPPH, adanya antioksidan pada sampel ditunjukkan dengan adanya perubahan warna dari ungu menjadi kuning. Perubahan warna menujukkan adanya reaksi antara kandungan senyawa metabolit yang ada pada ekstrak jamur tiram dengan radikal bebas DPPH. Perubahan warna juga menunjukkan adanya aktivitas antioksidan ekstrak jamur tiram yang mampu menurunkan kandungan radikal bebas DPPH. Hal ini sejalan dengan Prakash (2010) yang menyatakan bahwa aktivitas reduksi oleh antioksidan ditunjukkan dengan adanya perubahan warna yang menujukkan adanya reaksi antara elektron tunggal DPPH menjadi berpasangan dengan atom hidrogen yang didonorkan.
32
untuk menstabilkan radikal bebas (Praditasari,2016). Vitamin C dapat memutus reaksi radikal bebas yang dihasilkan melalui lipid peroksidasi.
5.2.2 Aktivitas Aktioksidan Pada Perendaman 1 Jam
Pada pengujian aktivitas antioksdan ekstrak air jamur tiram yang direndam 1 jam didapatkan hasil absorbansi sebesar 0,80256 pada pengulangan 1 dan 0,80269 pada pengulangan 2. Jika dibandingkan dengan nilai absorbansi dari vitamin C (Tabel 5.3) dengan nilai absorbansi tertinggi 0,23913 dan yang terendah 0,80713, absorbansi dari ekstrak jamur tiram terbilang rendah . Untuk nilai dari persen penghambat dari ekstrak air jamur tiram yang direndam 1 jam didapatkan nilai 0,56% dan 0,55 pada pengulangan 2. Kemampuan ekstrak jamur tiram dalam meredam radikal bebas masih rendah jika dibandingkan dengan persen penghambat dari vitamin C sebesar 70,33%. Setalah didapatkan nilai absorbansi dan persen penghambat, didapatkan hasil kadar antioksidan ekstrak air jamur tiram perendaman 1 jam yang diseratakan dengan kadar vitamin C sebesar 4,20 ppm.
5.2.3 Aktivitas antioksidan pada perendaman 2 jam
33
0,80452pada pengulangan 1 dan 0,80472 pada pengulangan 2. Jika dibandingkan dengan nilai absorbansi dari vitamin C (Tabel 5.3) dengan nilai absorbansi tertinggi 0,23913 dan yang terendah 0,80713, absorbansi dari ekstrak jamur tiram terbilang rendah . Untuk nilai dari persen penghambat dari ekstrak air jamur tiram yang direndam 2 jam didapatkan nilai 3,00 % pengulangan 1 dan pada pengulangan 2 sebesar 2,88 %. Kemampuan ekstrak jamur tiram dalam meredam radikal bebas masih rendah jika dibandingkan dengan persen penghambat dari vitamin C sebesar 70,33%. Setalah didapatkan nilai absorbansi dan persen penghambat, didapatkan hasil kadar antioksidan ekstrak air jamur tiram perendaman 1 jam yang diseratakan dengan kadar vitamin C sebesar 2,94 ppm
34 ekstrak air jamur tiram (Pleurotus ostreatus) dapat diambil kesimpulan bahwa
1. Pada perendaman selama satu jam menghasilkan kadar antioksidan setara dengan vitamin C sebesar 4,20 ppm
2. Pada perendaman selama dua jam menghasilkan kadar antioksidan setara dengan vitamin C sebesar 2,94 ppm
6.2 Saran
1. Penelitian ini menyimpulkan bahwa penelitian waktu yang digunakan memiliki perbedaan jangka waktu yang relatif jauh, sehingga disaranakan untuk peneliti selanjutnya yang untuk menggunakan jangka waktu yang tidak terlalu jauh.
2. Pada penelitian menggunakan aquadest sebagai pelarut ekstraksi yang memiliki kemampuan yang kurang baik dalam hal esktrasi. Dengan demikian kedepannya dimungkinkan untuk menggunakan pelarut organik seperti etanol untuk mendapat hasil ekstrak yang maksimal. 3. Pada peneliti selanjutnya disaranan untuk menganalisa pengaruh waktu
perendaman terhadap ativitas antioksidan.
DAFTAR PUSTAKA
Ahmad,dkk. 2013. Flavonoid : Struktur, Sifat Antioksidan, dan Peranan dalam Sistem Biologis. Jurnal Belian Vol 9 No 2
Antolovich, M dkk. 2002. Methods For Testing Antioxidant Activity. The Royal Society of Chemistry
Azhari.Yuliet.Khaerati. 2016. Uji Aktivitas Serbuk Jamur Tiram Jamur Tiram (Pleurotus ostreatus) Terhadap Kadar Glukosa Darah pada Model Hewan Coba Hiperkolesterolemia – Diabetes. Journal of Pharmacy Brewer, M.S. 2011. Natural Antioxidant: Sources, Compounds, Mechanisms of
Action, and Potensitial Application. Comprehensive Review in Food Science and Food Safety
Chang, S.T dan Miler, P.G. 2004. Mushroom,edisi ke-5.CRP Press
Kedare, S.B. dan Singh, R.P. 2010. Genesis And Development of DPPH Method of Antioxidant Assay. J Food Sci Technol
Lusiana. 2015. Potensi Antioksidan Ekstrak Jamur Tiram Putih (Pleurotus ostreatus). Jurnal Gradin Vol 11 No 1
Molyneux, P. 2004. The Use of The Stable Free Radical Diphenylpicrylhydrazyl (DPPH) for Estimating Antioxidant Activity. Songklanakarin J. Sci Technol.
Momout, I. R. dan Suryanto, E. 2016. Pengaruh Lama Perendaman Terhadap Aktivitas Antioksidan Dari Empelur Sagu Baruk ( Arenga microcharpha ). Fakultas FMIPA Universitas Sam Ratulangi. Chem. Prog. Vol 9 No. 1 Moure, Aet all. 2001. Natural antioxidant from residual sources. Food Chemistry
72
Muhammed, T M. 2015. Free Radical and Human Health. International Journal of Innovation Sciences and Research Vol 4 No 6
Nimse, S.B. dan Pal, D. 2015. Free Radical, Natural Antioxidant and Their Reaction Mechanisms. The Royal Society of ChemistryParkash, A., dkk. 2010. Antioxidant Activity. Medallion Laboratories Analilytical Progress Praditasari,A. 2016. Metode Uji Aktivitas Antioksidan Secara In Vitro Pada
Tanaman Ekstrak. Fakultas Farmasi Universitas Padjajaran
Prochazkova, D., Bousova, I., Wilhelmova. 2011. Antioxidant and Prooxidant of Flavonoids. https://www.researchgate.net/publication/49794711 diakses 13 Desember 2016
Ramadhan, T., Aminah, S. 2014. Pengaruh Pemasakan Terhadap Kandungan Antioksidan Sayuran. Buletin Pertanian Perkotaan Vol 4 No 2
Redha, A. 2010. Flavonoid: Struktur , Sifat Antioksidan dan Peranan dalam Sistem Biologis. Jurnal Belian Vol 9 No 2
Sari, I R M. 2012. Uji Aktivitas Ekstrak Jamur Tiram Pleurotus ostrearus Dengam Metode DPPH dan Identifikasi Golongan Senyawa Kimia Dari Fraksi Teraktif. Universitas Indonesia
Sen, S. 2011. Free Radical Antioxidant, Disease, And Phytomedicines: Current Status And Future Prospect. International Journal Of Pharmauntical Sciences Review And Research Vol 3
LAMPIRAN 4
Persen penghambat Ekstrak Jamur Tiram Perendaman 1 Jam
Persen penghambat Ekstrak Jamur Tiram Perendaman 1 Jam
1. Ulangan 1 = 𝑎𝑏𝑠𝑜𝑟𝑏𝑎𝑛 𝑏𝑙𝑎𝑛𝑘𝑜 −𝑎𝑏𝑠𝑜𝑟𝑏𝑎𝑛 𝑠𝑎𝑚𝑝𝑒𝑙
𝑎𝑏𝑠𝑜𝑟𝑏𝑎𝑛 𝑏𝑙𝑎𝑛𝑘𝑜 𝑥 100 %
= 0,80713−0,80452
0,80713 𝑥 100 % = 0,32 % %
2. Ulangan 2 = 𝑎𝑏𝑠𝑜𝑟𝑏𝑎𝑛 𝑏𝑙𝑎𝑛𝑘𝑜 −𝑎𝑏𝑠𝑜𝑟𝑏𝑎𝑛 𝑠𝑎𝑚𝑝𝑒𝑙
𝑎𝑏𝑠𝑜𝑟𝑏𝑎𝑛 𝑏𝑙𝑎𝑛𝑘𝑜 𝑥 100 %
= 0,8071 3−0,8047
LAMPIRAN 6
DOKUMENTASI
NO KETERANGAN GAMBAR
1. Jamur tiram
2. Proses penimbangan
3. Proses perendaman Jamur Tiram dengan