PEMAKAIAN TEPUNG DAUN LAMTOROGUNG
Leucaena leucocephala
SEBAGAI BAHAN BAKU PAKAN
IKAN NILA
Oreochromis niloticus
ANITA BIDARYATI
SKRIPSI
TEKNOLOGI DAN MANAJEMEN PERIKANAN BUDIDAYA FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR 2010
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul :
PEMAKAIAN TEPUNG DAUN LAMTOROGUNG Leucaena leucocephala SEBAGAI BAHAN BAKU PAKAN IKAN NILA Oreochromis niloticus
adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Maret 2010
ANITA BIDARYATI C.14050497
RINGKASAN
ANITA BIDARYATI. Pemakaian Tepung Daun Lamtorogung Leucaena leucocephala sebagai Bahan Baku Pakan Ikan Nila Oreochromis niloticus. Dibimbing oleh NUR BAMBANG PRIYO UTOMO.
Tepung daun lamtorogung Leucaena leucocephala (TDL) merupakan sumberdaya hayati lokal yang potensial untuk digunakan sebagai salah satu sumber protein nabati dalam pakan ikan antara lain karena kandungan proteinnya yang tinggi yaitu 25-30% (NAS 1994). Pemanfaatan tepung daun lamtorogung sebagai bahan baku pakan dibatasi dengan kandungan yang tinggi dari komponen serat kasar, defisiensi asam amino esensial (Agr, Thr, Ile, His, Met) dan kandungan antinutrisi mimosin. Penggunaan enzim dari isi rumen diharapkan dapat meningkatkan nilai guna TDL sebagai sumber protein nabati alternatif pakan ikan nila.
Enam jenis pakan yang digunakan dalam penelitian ini, yaitu pakan A: 0% TDL, pakan B: 10% TDL, pakan C: 15% TDL, pakan D: 20% TDL, pakan E: 25% TDL dan pakan F: 30% TDL. Delapan ekor ikan dengan bobot rata-rata 9,38±0,41 gram dipelihara di dalam akuarium berukuran 35x40x50 cm dengan ketinggian air rata-rata 30 cm. Ikan dipelihara selama 40 hari dalam sistem resirkulasi dengan frekuensi pemberian pakan 3 kali/hari secara at satiation. Analisa kualitas air dilakukan di awal dan akhir pemeliharaan meliputi pH, alkalinitas, kesadahan, TAN dan DO. Sampling dilakukan di awal dan akhir masa pemeliharaan. Analisa proksimat terhadap bahan dan pakan perlakuan meliputi kadar air, abu, serat kasar, lemak dan protein, sedangkan untuk ikan awal dan akhir meliputi kadar air, abu, lemak dan protein. Parameter uji yang diamati, yaitu laju pertumbuhan harian (LPH), efisiensi pemberian pakan (EP), jumlah konsumsi pakan (JKP), retensi protein (RP) dan retensi lemak (RL). Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap (RAL) dengan enam perlakuan dan tiga kali ulangan untuk setiap perlakuan. Data yang diperoleh kemudian ditabulasi dan dianalisis menggunakan program MS. Office Excel 2007 dan SPSS 15.0 dengan menggunakan uji lanjut Duncan.
Pertumbuhan dan konsumsi pakan ikan uji mengalami penurunan pada penggunaan TDL yang makin meningkat. Pertumbuhan pada perlakuan pakan A sampai C nilainya berbeda nyata jika dibandingkan dengan perlakuan pakan F. Sementara itu, EP tidak berbeda nyata pada semua perlakuan. Hal yang sama terjadi pada RP dan RL, yaitu perlakuan memperlihatkan pengaruh yang tidak berbeda nyata terhadap RP dan RL dari seluruh perlakuan. RP tertinggi adalah pakan perlakuan F. Sebaliknya, RL pada perlakuan ini adalah yang terendah dibandingkan dengan lima perlakuan lainnya.
Tepung daun lamtorogung (TDL) yang telah dihidrolisis dengan cairan rumen domba sebanyak 1000 ml/kg, dapat dimanfaatkan sebagai sumber protein nabati alternatif pada pakan ikan nila. Berdasarkan hasil penelitian ini, pakan dengan dosis TDL hingga 15% dapat mendukung pertumbuhan ikan nila dengan baik. Sementara itu, penggunaan TDL di atas 20% dapat mengganggu pertumbuhan dan menurunkan nafsu makan ikan.
PEMAKAIAN TEPUNG DAUN LAMTOROGUNG
Leucaena leucocephala
SEBAGAI BAHAN BAKU PAKAN
IKAN NILA
Oreochromis niloticus
ANITA BIDARYATI
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
TEKNOLOGI DAN MANAJEMEN PERIKANAN BUDIDAYA FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR 2010
Judul Skripsi : Pemakaian Tepung Daun Lamtorogung Leucaena leucocephala sebagai Bahan Baku Pakan Ikan Nila
Oreochromis niloticus
Nama Mahasiswa : Anita Bidaryati
Nomor Pokok : C14050497 Menyetujui, Pembimbing Dr. Nur Bambang P. U, M. Si NIP. 196508141993031005 Mengetahui
Dekan Fakultas Perikanan dan Ilmu Kelautan
Prof. Dr. Indra Jaya, M. Sc NIP. 196104101986011002
KATA PENGANTAR
Puji syukur penulis panjatkan kepada Alloh SWT atas segala karunia-Nya sehingga skripsi dari penelitian ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan pada bulan Agustus-Oktober 2009 adalah Pakan Ikan Berbasis Nabati, dengan judul “Pemakaian Tepung Daun Lamtorogung
Leucaena leucocephala sebagai Bahan Baku Pakan Ikan Nila Oreochromis niloticus”.
Pada kesempatan ini penulis mengucapkan terimakasih kepada:
1. Dr. Nur Bambang Priyo Utomo selaku Dosen Pembimbing Skripsi atas bimbingan, arahan, maupun masukan dalam pelaksanaan penelitian dan penyusunan skripsi.
2. Dr. Tatag Budiardi selaku Pembimbing Akademik dan Penguji Tamu 1 serta Dr. Kukuh Nirmala selaku Penguji Tamu 2 yang telah banyak memotivasi serta mendidik selama menjadi mahasiswa.
3. Keluarga penulis yaitu Bapak, Ibu, Mas Amin, Mbak Indah serta keponakan baru Azzam yang selalu memberikan dukungan dan sokongan. 4. Bu Indira, Pak Wasjan, Mas Yosi dan Mbak Retno yang banyak
membantu selama penelitian.
5. Sahabat-sahabat Nutrisi Ikan 2009 atas kerjasama yang terjalin indah sepanjang proses penelitian ini yaitu Mbak Ririn, Widy, Wastu, Johan, Angga, Bayu, Fatwa dan Dodi
6. Sahabat-sahabat terbaik sepanjang masa BDP 42, Wisma Do’I dan sahabat di IPB yang tidak tersebut di dalamnya yang telah menemani dan selalu berbagi.
Bogor, Maret 2010
DAFTAR RIWAYAT HIDUP
Penulis dilahirkan di Pacitan pada 22 Januari 1986 dari Ayah Bitarto dan Ibu Ismiyati. Penulis merupakan anak kedua dari dua bersaudara dengan kakak bernama Amin Mujianto.
Pendidikan formal yang dilalui penulis adalah SDN 1 Bandar-Pacitan dan lulus pada tahun 1999, SLTPN 1 Pacitan pada tahun 2002 dan SMUN 1 Pacitan pada tahun 2005. Penulis kemudian diterima di IPB melalui USMI (Undangan Seleksi Masuk IPB) dan melalui program Mayor-Minor pada tahun 2006 penulis diterima di Mayor Teknologi dan Manajemen Perikanan Budidaya dengan Minor Teknologi Penanganan dan Transportasi Biota Perairan.
Selama mengikuti perkuliahan, penulis aktif menjadi pengurus Himpunan Mahasiswa Akuakultur (HIMAKUA) periode 2006/2007 dan 2007/2008. Selain itu penulis juga pernah menjadi asisten pada mata kuliah Dasar-dasar Akuakultur (2008-2009), Nutrisi Ikan (2009), Teknologi Produksi Plankton, Benthos dan Alga (2008-2009) serta Teknologi Pembuatan Pakan Ikan (2009). Untuk menambah pengetahuan dalam perikanan budidaya, penulis mengikuti kegiatan magang di Tambak Pinang Gading- Lampung (2007), Loka Riset Sukamandi- Subang dan praktek lapang pembenihan abalone di Balai Budidaya Laut Lombok- NTB (2008).
Untuk menyelesaikan studi di Fakultas Perikanan dan Ilmu Kelautan, penulis melakukan penelitian yang berjudul “Pemakaian Tepung Daun Lamtorogung Leucaena leucocephala sebagai Bahan Baku Pakan Ikan Nila Oreochromis niloticus”.
DAFTAR ISI
Halaman
DAFTAR TABEL ... .. viii
DAFTAR LAMPIRAN ... .... ix
I. PENDAHULUAN 1.1 Latar Belakang ... .... ... 1
1.2 Tujuan ... .... ... 2
II. TINJAUAN PUSTAKA 2.1 Kebutuhan Nutrisi Ikan Nila ... .... ... 3
2.2 Tepung Daun Lamtorogung Leucaena leucocephala ... .... ... 6
2.3 Cairan Rumen sebagai Sumber Enzim ... .... ... 8
2.4 Enzim Pencernaan dan Perannya dalam Proses Perncernaan ... .... ... 9
2.5 Kualitas Air ... .... .... 13
III. BAHAN DAN METODE 3.1 Waktu dan Tempat ... .... .... 14
3.2 Pakan Uji ... .... .... 14
3.3 Pemeliharaan Ikan ... .... .... 15
3.4 Analisis Kimia Pakan dan Ikan Perlakuan ... .... .... 16
3.5 Pengumpulan dan Pengolahan Data ... .... .... 17
3.5.1 Laju Pertumbuhan Spesifik ... .... .... 17
3.5.2 Efisiensi Pakan ... .... .... 17
3.5.3 Retensi Protein dan Lemak ... .... .... 17
3.5.4 Jumlah Konsumsi Pakan ... .... .... 18
3.6 Analisis Statistik ... .... .... 18
IV. HASIL DAN PEMBAHASAN 4.1 Hasil ... .... .... 19
4.2 Pembahasan ... .... .... 20
V. KESIMPULAN DAN SARAN 5.1 Kesimpulan ... .... .... 24
5.2 Saran ... .... .... 24
DAFTAR PUSTAKA ... .... .... 25
DAFTAR TABEL
Halaman
1. Kebutuhan protein ikan nila dengan bobot tubuh yang berbeda ... 4
2. Perbandingan komposisi asam amino dan makro-mikro mineral antara tepung ikan, tepung bungkil kedelai dan tepung daun lamtoro ... 7
3. Komposisi enzim cairan rumen domba ... 9
4. Formulasi pakan uji untuk ikan nila (%) ... 15
5. Komposisi proksimat pakan perlakuan (% bobot kering) ... 15
DAFTAR LAMPIRAN
Halaman 1. Komposisi bahan dalam premix (vitamin dan mineral mix) ... 31 2. Hasil proksimat bahan baku (% bobot kering) ... 32 3. Prosedur analisa proksimat (Takeuchi 1988) ... 33 4. Nilai laju pertumbuhan spesifik (LPS), efisiensi pakan (EP), konsumsi pakan
(JKP), retensi protein (RP) dan retensi lemak (RL) ... 36 5. Skema akuarium pemeliharaan ikan ... 40 6. Data hasil pengukuran kualitas air selama masa pemeliharaan ... 41
I.
PENDAHULUAN
1.1 Latar Belakang
Sumber protein utama dalam bahan baku pakan buatan untuk ikan adalah tepung ikan. Namun demikian, untuk memperoleh tepung ikan berkualitas baik Indonesia masih harus mengimpor sehingga harga tepung ikan relatif mahal. Penggantian tepung ikan dengan berbagai bahan alternatif berprotein tinggi sudah dilakukan, termasuk dengan sumber protein nabati. Sumber protein nabati yang umum digunakan adalah tepung bungkil kedelai (SBM/soy bean meal) (Suprayudi
et al. 1999; Pebriyadi 2004; Elangovan dan Shim 2000). SBM mampu mengganti sebagian tepung ikan, namun ketersediannya masih bergantung dari impor. Volume impor SBM pada periode Januari-September 2008 mencapai 28.405.448 milyar ton dan harga mencapai Rp. 7.500-8.000,00 per kg (Departemen Kelautan dan Perikanan 2008).
Salah satu upaya untuk mengurangi ketergantungan bahan baku impor adalah dengan penggunaan bahan pakan lokal yang berkualitas. Tepung daun lamtorogung (TDL) merupakan sumberdaya hayati lokal yang potensial untuk digunakan sebagai salah satu sumber protein nabati dalam pakan ikan disebabkan kandungan proteinnya yang tinggi yaitu 25-30% (NAS 1994). Pemanfaatan TDL sebagai bahan baku pakan dibatasi dengan kandungan yang tinggi dari komponen
neutral detergent fiber (NDF) 39,5% dan acid detergent fiber (ADF) 35,10% (Garcia et al. 1996), defisiensi asam amino esensial (Agr, Thr, Ile, His, Met) dan kandungan mimosin (Lim dan Dominy 1991). Defisiensi asam amino esensial dapat diatasi dengan menambahkan asam amino esensial yang menjadi pembatas (Santiago dan Lovell 1988), dan untuk mengatasi mimosin telah dilaporkan beberapa metode untuk mereduksi mimosin seperti perendaman dan pemanasan (Wee dan Wang 1987). Keterbatasan ikan dalam memanfaatkan serat berkaitan dengan ketersediaan enzim selulotik yang terbatas dalam saluran pencernaan ikan, bahkan pada level tertentu dapat menghambat pertumbuhan ikan (Haming 1989).
Beberapa penelitian menyebutkan bahwa ikan tidak memiliki enzim selulose dan kemungkinan adanya populasi mikroba selulotik di saluran percernaan ikan juga masih menjadi kontroversi di kalangan peneliti (Saha dan
Ray 1998). Salah satu usaha untuk mengatasi kecernaan serat yang rendah adalah dengan menggunakan enzim eksogen untuk menghidrolisis serat, misalnya cairan rumen domba yang merupakan salah satu sumber bahan alternatif yang murah dan dapat dimanfaatkan dengan mudah sebagai sumber enzim hidrolase (Moharrey dan Das 2002).
Ikan nila (Oreochromis niloticus) adalah salah satu ikan yang banyak dibudidayakan dan berkembang pesat di Indonesia. Disebutkan bahwa terjadi kenaikan hasil budidaya nila yaitu sebesar 7.116 ton pada tahun 2004 menjadi 220.900 ton pada tahun 2008 (DKP 2009). Sedangkan di tingkat dunia, Indonesia berada pada peringkat keempat negara produsen nila terbesar di dunia setelah Cina, Mesir dan Filipina. Ikan nila adalah ikan omnivor yang cenderung herbivora sehingga lebih mudah beradaptasi dengan jenis pakan yang dicampur dengan sumber bahan nabati seperti tepung bungkil kedelai, tepung jagung, tepung biji kapuk, tepung enceng gondok, tepung alfalfa, serta tepung dari berbagai jenis tanaman legumes seperti daun lamtoro (El-Sayed dan Fattah 1999). Dengan penggunaan enzim dari isi rumen, diharapkan hidrolisis serat kasar pada bahan nabati berserat tinggi dapat memacu kinerja pertumbuhan dari ikan nila.
1.2Tujuan
Tujuan dari penelitian ini adalah untuk mengetahui dosis optimal pemakaian tepung daun lamtorogung (TDL) sebagai sumber protein nabati alternatif pakan ikan nila dengan memanfaatkan cairan rumen domba 1000 ml/kg TDL sebagai sumber enzim hidrolisis (predigestion).
II.
TINJAUAN PUSTAKA
2.1 Kebutuhan Nutrisi Ikan Nila
Kebutuhan nutrisi ikan pada budidaya intensif akan terpenuhi dengan pemberian pakan buatan. Komponen pakan yang berkontribusi terhadap penyediaan materi dan energi tumbuh adalah protein, karbohidrat dan lemak. Protein adalah nutrien yang sangat dibutuhkan untuk perbaikan jaringan tubuh yang rusak, pemeliharaan protein tubuh, penambahan protein tubuh untuk pertumbuhan, materi untuk pembentukan enzim dan beberapa jenis hormon serta sebagai sumber energi (National Research Council 1993).
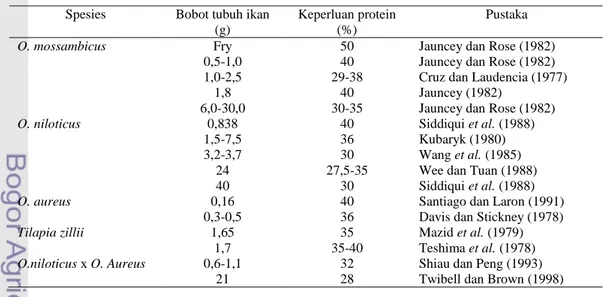
Kebutuhan protein ikan berbeda-beda menurut spesiesnya, pada umumnya ikan membutuhkan protein sekitar 30-40% dalam pakannya (Jobling 1994). Ikan air tawar dapat tumbuh baik dengan pemberian pakan yang mengandung kadar protein 25-35% dengan rasio energi berbanding protein sekitar 8 kkal/gram protein. Hal ini dipengaruhi oleh beberapa faktor yakni spesies ikan, ukuran ikan, umur ikan, temperatur air, kandungan energi pakan, kecernaan terhadap nutrien dan kualitas atau komposisi dari nutrien (NRC 1983). Kebutuhan protein ikan nila dengan bobot tubuh yang berbeda disajikan pada Tabel 1.
Tabel 1. Kebutuhan protein ikan nila dengan bobot tubuh yang berbeda
Penyediaan sumber protein pakan baik tepung ikan dan tepung bungkil kedelai masih tergantung pada impor. Oleh karenanya, penggunaan bahan pakan lokal yang berkualitas, harga layak, persediannya terjamin dan tidak bersaing
Spesies Bobot tubuh ikan (g)
Keperluan protein (%)
Pustaka
O. mossambicus Fry 50 Jauncey dan Rose (1982) 0,5-1,0 40 Jauncey dan Rose (1982) 1,0-2,5 29-38 Cruz dan Laudencia (1977)
1,8 40 Jauncey (1982)
6,0-30,0 30-35 Jauncey dan Rose (1982)
O. niloticus 0,838 40 Siddiqui et al. (1988) 1,5-7,5 36 Kubaryk (1980) 3,2-3,7 30 Wang et al. (1985)
24 27,5-35 Wee dan Tuan (1988) 40 30 Siddiqui et al. (1988)
O. aureus 0,16 40 Santiago dan Laron (1991) 0,3-0,5 36 Davis dan Stickney (1978)
Tilapia zillii 1,65 35 Mazid et al. (1979) 1,7 35-40 Teshima et al. (1978)
O.niloticus x O. Aureus 0,6-1,1 32 Shiau dan Peng (1993) 21 28 Twibell dan Brown (1998)
dengan kebutuhan manusia perlu dicoba. Tumbuhan leguminosa, sereal dan produksinya telah dicoba digunakan sebagai substitusi dari tepung bungkil kedelai di dalam pakan ikan nila (Meulen et al. 1979). Hal ini sangat memungkinkan digunakan untuk budidaya ikan nila karena merupakan ikan omnivora yang cenderung herbivora sehingga lebih mudah beradaptasi dengan jenis pakan yang dicampur dengan sumber bahan nabati seperti tepung bungkil kedelai, tepung jagung, tepung biji kapuk, tepung eceng gondok, tepung alfalfa, serta tepung daun dari berbagai jenis tanaman legumes seperti daun lamtorogung (El-Sayed dan Fatah 1999). Pada ikan air tawar yang bersifat herbivora dan cenderung omnivora seperti ikan nila (Popma 1982; Wilson dan Poe 1985) dapat mencerna lebih dari 70% dari energi kotor bahan non-strach, sedangkan pada ikan yang bersifat karnivora seperti ikan trout hanya mencerna kurang dari 50%-nya.
Tinggi rendahnya kandungan protein optimum dalam pakan dipengaruhi oleh kandungan energi non protein yaitu yang berasal dari karbohidrat dan lemak. Menurut Stickney (1979) dalam Pelawi (2003), energi yang terkandung dalam pakan yang berasal dari non-protein dapat mempengaruhi jumlah protein yang digunakan untuk pertumbuhan. Jika pakan kekurangan energi yang berasal dari non-protein maka sebagian besar protein yang seharusnya digunakan untuk pertumbuhan, akan dimanfaatkan sebagai sumber energi. Sebaliknya jika energi dalam pakan terlalu besar maka keadaan ini akan membatasi jumlah pakan yang dimakan oleh ikan yang selanjutnya akan membatasi jumlah protein yang dimakan sehingga pertumbuhan menjadi rendah.
Karbohidrat merupakan sumber energi yang penting meskipun kandungan karbohidrat dalam pakan berada dalam jumlah yang relatif rendah. Karbohidrat dalam pakan dapat berupa serat kasar serta bahan ekstrak tanpa nitrogen (BETN) (NRC 1993). BETN mengandung banyak gula dan pati yang bersifat mudah dicerna sedangkan serat kasar kaya akan lignin dan selulosa yang sukar untuk dicerna. Pieper dan Pfeffer (1980) menyatakan bahwa energi dari karbohidrat sama efektifnya dengan energi dari lemak. Sedangkan Lovell (1989) mengemukakan bahwa pemberian tingkat energi optimum dalam pakan sangat penting karena kelebihan dan kekurangan energi dapat menurunkan pertumbuhan ikan.
Pemanfaatan karbohidrat oleh ikan berbeda-beda bergantung pada kompleksitas karbohidrat. Ikan-ikan karnivora tidak mampu memanfaatkan karbohidrat kompleks seperti glukosa, sukrosa dan laktosa sebagai energi utama dalam pakannya pada level yang tinggi. Sedangkan ikan-ikan omnivora dan herbivora dapat mencerna karbohidrat yang berasal dari tumbuh-tumbuhan (Yamada 1983). Ikan-ikan karnivora dapat memanfaatkan karbohidrat optimum pada tingkat 10-20% dalam pakannya sedangkan ikan-ikan omnivora mampu memanfaatkan karbohidrat optimum sebesar 30-40% dalam pakan (Furuichi 1988).
Lemak pakan merupakan sumber asam lemak esensial (essential fatty acid
/EFA) yang dibutuhkan ikan untuk pertumbuhan, pemeliharaan dan metabolisme tubuh (NRC 1993). Lemak dalam bentuk triacyl-glycerol dapat dihidrolisis oleh enzim pencernaan menjadi asam lemak bebas dan 2-monoglycerides. Senyawa tersebut kemudian diserap dan juga digunakan untuk sintesis berbagai komponen sel atau diubah menjadi energi. Lemak sebagai salah satu makronutrien bagi ikan karena selain sebagai sumber energi nonprotein dan asam lemak essensial, juga berfungsi memelihara bentuk dan fungsi fosfolipid, membantu dalam absorbsi vitamin yang larut dalam lemak dan mempertahankan daya apung tubuh (NRC 1993).
Ikan air tawar secara aktif memiliki kemampuan untuk mengkonversi C18 PUFA menjadi C20 dan C22 HUFA, di mana sebagian besar komponen utama PUFA banyak terdapat pada daun tanaman darat maupun air. Sementara itu, ikan-ikan air laut lebih banyak membutuhkan asam lemak esensial dalam bentuk n-3 HUFA yang secara alami banyak terdapat pada alga dan fitoplankton laut. Pada umumnya, lemak 10-20% dari berat kering pakan cukup untuk mendukung protein sehingga dapat termanfaatkan secara efektif tanpa menyimpan kelebihan lemak di jaringan tubuh ikan (Sargent et al. 2002).
Komponen lain yang dibutuhkan dalam pakan ikan yaitu vitamin dan mineral. Jumlah yang dibutuhkan dari vitamin dan mineral dalam pembuatan pakan sangatlah kecil namun kehadirannya dalam pakan sangat penting karena dibutuhkan tubuh ikan untuk tumbuh dan menjalani beberapa fungsi tubuh. NRC (1993) menjelaskan bahwa mineral merupakan senyawa yang digunakan untuk
proses respirasi, osmoregulasi dan pembentukan kerangka tulang. Sedangkan vitamin merupakan senyawa organik kompleks yang diperlukan untuk tumbuh secara normal, reproduksi, kesehatan dan metabolisme secara umum.
2.2 Tepung Daun Lamtorogung Leucaena leucocephala
Lamtoro adalah tumbuhan leguminosa tropis, berasal dari Amerika Tengah. Disebarkan oleh orang-orang Mayan dan Zapotec ke seluruh Amerika Tengah. Klasifikasi Leucaena leucocephala menurut Brewbaker dan Hylin (1965) adalah, salah satu spesies dari genus Leucaena yang termasuk sub Famili Mimosoideae, Famili Leguminoseae, sub Ordo Rosicae, Ordo Rosales, sub Klas Dycotyledoea, Klas Angiospermopsidae, sub Divisio Spermatophyta, Divisio Traceophyta dan sub Kingdom Embryobionta.
Lamtoro (Leucaena) terdiri atas 53 spesies yang digolongkan ke dalam 10 spesies yang telah dikenal. Walaupun seluruh spesies tersebut mungkin sangat berguna bagi daerah tropis, tetapi hanya Leucaena leucocephala yang telah dimanfaatkan secara luas (NAS 1994). Tanaman lamtoro tumbuh baik di daerah dengan curah hujan tahunan antara 1000-3000 mm3. Sementara Garcia et al.
(1996) menyarankan agar tanaman lamtoro ditanam di daerah yang curah hujannya lebih dari 750 mm3 per tahun dan ketinggian lebih dari 1500 m dpl. Selanjutnya dinyatakan pula bahwa tanah yang sesuai dengan tanaman ini adalah tanah yang netral atau tanah basa. NAS (1994) menyebutkan bahwa pada umumnya tanaman lamtoro dapat menghasilkan bahan kering dari unsur-unsur yang dapat dimakan (daun dan ranting-ranting kecil) sebesar 6-8 ton per hektar per tahun atau sekitar 20-80 ton bahan segar per hektar per tahun.
TDL merupakan sumber daya hayati lokal yang potensial untuk digunakan sebagai salah satu sumber protein nabati dalam pakan ikan karena mengandung protein sekitar 25-30% (NAS 1994); 24% (Scott et al. 1982), yang merupakan nilai tertinggi dibandingkan sumber protein nabati lainnya. Komposisi asam amino daun lamtoro hampir seimbang dengan tepung ikan kecuali kandungan lysin dan methionin yang lebih rendah. Apabila dibandingkan dengan bungkil kedelai kandungan asam amino daun lamtoro cukup seimbang, hanya berbeda pada kandungan asam glutamat.
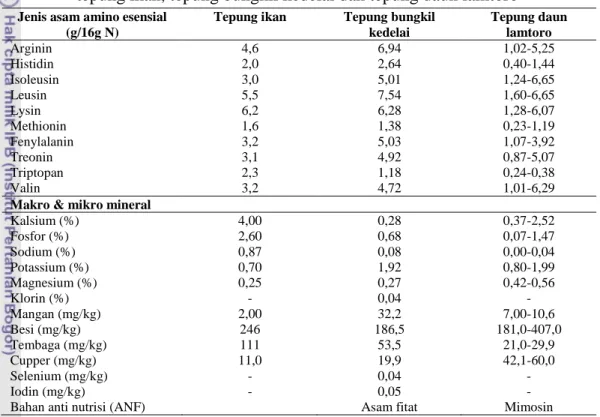
TDL juga merupakan sumber vitamin A dan kandungan -karoten yang relatif tinggi serta kandungan xantofil yang merupakan pigmentasi pada kulit dan kuning telur. Perbandingan komposisi asam amino dan makro-mikro mineral antara tepung ikan, tepung bungkil kedelai dan tepung daun lamtoro dapat dilihat pada Tabel 2.
Tabel 2. Perbandingan komposisi asam amino dan makro-mikro mineral antara tepung ikan, tepung bungkil kedelai dan tepung daun lamtoro
Jenis asam amino esensial (g/16g N)
Tepung ikan Tepung bungkil kedelai Tepung daun lamtoro Arginin 4,6 6,94 1,02-5,25 Histidin 2,0 2,64 0,40-1,44 Isoleusin 3,0 5,01 1,24-6,65 Leusin 5,5 7,54 1,60-6,65 Lysin 6,2 6,28 1,28-6,07 Methionin 1,6 1,38 0,23-1,19 Fenylalanin 3,2 5,03 1,07-3,92 Treonin 3,1 4,92 0,87-5,07 Triptopan 2,3 1,18 0,24-0,38 Valin 3,2 4,72 1,01-6,29
Makro & mikro mineral
Kalsium (%) 4,00 0,28 0,37-2,52 Fosfor (%) 2,60 0,68 0,07-1,47 Sodium (%) 0,87 0,08 0,00-0,04 Potassium (%) 0,70 1,92 0,80-1,99 Magnesium (%) 0,25 0,27 0,42-0,56 Klorin (%) - 0,04 - Mangan (mg/kg) 2,00 32,2 7,00-10,6 Besi (mg/kg) 246 186,5 181,0-407,0 Tembaga (mg/kg) 111 53,5 21,0-29,9 Cupper (mg/kg) 11,0 19,9 42,1-60,0 Selenium (mg/kg) - 0,04 - Iodin (mg/kg) - 0,05 - Bahan anti nutrisi (ANF) Asam fitat Mimosin
Sumber : Hertrampf dan Pascual (2000)
Pemanfaatan TDL di dalam pakan dibatasi oleh adanya ANF mimosin yang merupakan asam amino heterosiklik ( -amino- (N-(3-hidroxy-4-piridon)(asam propionat). Berbagai usaha yang dilakukan untuk menurunkan daya racun mimosin dalam daun lamtoro adalah dengan pemanasan, penambahan garam sulfat, penambahan senyawa analog mimosin, pencucian, mendapatkan varietas baru yang rendah kandungan mimosinnya. Disamping itu pemanfaatan bahan baku pakan ikan nila dari daun tumbuhan khususnya daun lamtorogung dibatasi dengan kandungan yang tinggi dari komponen neutral detergent fiber
(NDF) 39,5% dan acid detergent fiber (ADF) 35,10% (Garcia et al. 1996). Serat kasar merupakan komponen karbohidrat yang kaya akan lignin dan selulosa yang bersifat sukar dicerna. Selulosa merupakan kerangka sel tanaman yang terdiri dari
rantai -D-Glukosa dengan derajat polimerasi sebesar lebih kurang 14.000 (Baskoro 1996). Degradasi polisakarida yang terdapat pada dinding sel tanaman yang merupakan bagian terbesar komponen serat kasar bervariasi bergantung kepada jaringan tanaman, jenis tanaman dan umur tanaman (Amin 1997). Pada manusia fungsi utama selulosa adalah untuk menyediakan bahan bulky (tidak dapat dicerna) yang dapat meningkatkan efisiensi kerja saluran yang fungsinya dapat disamakan dengan fungsi serat dalam pakan ternak (Djojosoebagio dan Pilliang 1996). Salah satu usaha untuk mengatasi kecernaan serat yang rendah adalah penggunaan enzim eksogen untuk menghidrolisis serat.
2.3 Cairan Rumen sebagai Sumber Enzim
Perut hewan ruminansia terdiri atas rumen, retikulum, omasum dan abomasum. Rumen diakui sebagai sumber enzim pendegradasi polisakarida. Polisakarida dihidrolisis di rumen disebabkan pengaruh sinergis dan interaksi dari komplek mikro-organisme, terutama selulase dan xilanase (Trinci et al. 1994). Mikroorganisme terdapat pada cairan rumen (liquid phase) dan yang menempel pada digesta rumen. Enzim yang aktif mendegradasi struktural polisakarida hijauan kebanyakan aktif pada mikroorganisme yang menempel pada partikel pakan. Di dalam retikulo rumen terdapat mikrobia rumen yang terdiri atas protozoa dan bekteri yang berfungsi melaksanakan fermentasi untuk mensintesis asam amino, vitamin B-komplek dan vitamin K sebagai sumber zat makanan bagi hewan induk semang (Hungate 1966).
Mikroba-mikroba rumen mensekresikan enzim-enzim pencernaan ke dalam cairan rumen untuk membantu mendegradasi partikel makanan. Enzim-enzim tersebut antara lain adalah Enzim-enzim yang mendegradasi substrat selulosa yaitu selulase, hemiselulosa/xylosa adalah hemiselulase/xylanase, pati adalah amilase, pektin adalah pektinase, lipid/lemak adalah lipase, protein adalah protease dan lain-lain (Kamra 2005).
Aktivitas enzim dalam cairan rumen juga tergantung dari komposisi atau perlakuan makanan (Moharrey and Das 2001). Lee et al. (2002) memetakan enzim-enzim dalam cairan rumen domba. Enzim-enzim yang terdapat dalam cairan rumen domba antara lain adalah enzim-enzim selulolitik terdiri atas
beta-D-endoglukanase, beta-D-exoglukanase, beta-D-glukosidase dan beta-D-fucosida fucohydrolase, enzim-enzim xylanolitik terdiri atas xylanase, beta-D-xylosidase, acethyl esterase dan alfa-L-arabinofuranosidase, enzim-enzim pektinolitik terdiri atas polygalakturonase, pectate lyase dan pectin lyase, dan enzim-enzim lain yang terdiri atas beta-amilase, endo-arabilase, beta-D-gluanase (laminarinase), beta-D-glucanase (Lichenase), beta-D-glucanase (Pechimanase) dan protease. Beberapa enzim dalam cairan rumen dan aktivitas enzimnya disajikan pada Tabel 3.
Tabel 3. Komposisi enzim cairan rumen domba
Enzim
Lee et al. (2002)1
Agarwal et al (2003)2 Enzim hanya dalam
cairan rumen domba
Enzim dalam semua isi rumen domba
Total Enzim (IU) Selulase - CMCase 362,7 12,80 (IU/ml enzim/menit) 1183,7 20,39 (IU/ml enzim/menit) 3,60 0,63 umol glukosa/jam/ml Hemiselulase - Xylanase 528,6 29,03 (IU/ml enzim/menit) 1751 26,53 (IU/ml enzim/menit) 0,29 0,05 umol xylosa/menit/ml - Amilase 439,0 16,53 (IU/ml enzim/menit 637,9 14,80 (IU/ml enzim/menit) 0,33 0,09 (umol glukosa/menit/ml) - Protease 84,80 2,52 (IU/ml enzim/menit) 125,6 3,83 (IU/ml enzim/menit) 452,7 154,3 Ug hidrolisis protein/jam/ml) Aktivitas Spesifik (IU/mg protein)
Selulase - CMCase 206,7 9,03 (IU/mg protein/menit) 720,2 19,43 (IU/mg protein/menit) Hemiselulase - Xylanase 300,2 11,34 (IU/mg protein/menit) 1068,6 53,48 (IU/mg protein/menit) - Amilase 250,90 14,82 (IU/mg protein/menit) 390,2 25,68 (IU/mg protein/menit) - Protease 48,30 1,85 (IU/mg protein/menit) 76,7 4,70 (IU/mg protein/menit)
2.4 Enzim Pencernaan dan Perannya dalam Proses Pencernaan
Pemanfaatan materi dan energi pakan untuk pertumbuhan terlebih dahulu melalui suatu proses pencernaan dan metabolisme. Dalam proses pencernaan, makanan yang tadinya merupakan senyawa kompleks akan dipecah menjadi senyawa yang lebih sederhana sehingga mudah diserap melalui dinding usus dan disebarkan ke seluruh tubuh melalui sistem peredaran darah. Protein dihidrolisis menjadi asam amino bebas dan peptida-peptida pendek, karbohidrat dipecah
menjadi gula-gula sederhana dan lemak menjadi asam-asam lemak dan gliserol. Proses-proses di atas dilakukan oleh enzim-enzim pencernaan (Tillman et al. 1991).
Menurut Hepher (1990) kecernaan pakan dipengaruhi oleh keberadaan enzim dalam saluran pencernaan ikan; tingkat aktivitas enzim-enzim pencernaan dan lama kontak pakan yang dimakan dengan enzim pencernaan. Dengan demikian peranan enzim pencernaan dalam proses pencernaan sangat dominan, yaitu berperan dalam menghidrolisis senyawa kompleks menjadi senyawa sederhana yang siap untuk diserap.
Enzim adalah katalisator biologis dalam reaksi kimia yang sangat dibutuhkan dalam kehidupan. Enzim adalah protein, yang disintesis di dalam sel dan dikeluarkan dari sel yang membentuknya melalui proses eksositosis. Enzim yang disekresikan ke luar sel digunakan untuk pencernaan di luar sel (di dalam rongga pencernaan) atau ”extra cellular digestion”, sedangkan enzim yang
dipertahankan di dalam sel digunakan untuk pencernaan di dalam sel itu sendiri atau disebut ”intra cellular digestion” (Affandi et al. 1992).
Enzim pencernaan yang disekresikan dalam rongga pencernaan berasal dari sel-sel mukosa lambung, pilorik kaeka, pankreas dan mukosa usus. Oleh karena itu perkembangan sistem pencernaan erat kaitannya dengan perkembangan aktivitas enzim di dalam rongga saluran pencernaan (Watford dan Lam 1993). Enzim-enzim tersebut berperan sebagai katalisator dalam hidrolisis protein, lemak dan karbohidrat menjadi bahan-bahan yang sederhana. Sel-sel mukosa lambung menghasilkan enzim protease dengan suatu aktivitas proteolitik optimal pada pH rendah. Pilorik kaeka yang merupakan perpanjangan usus terutama mensekresikan enzim yang sama seperti yang dihasilkan pada bagian usus yaitu enzim pencernaan protein, lemak dan karbohidrat yang aktif pada pH netral dan sedikit basa. Cairan pankreatik kaya akan tripsin, yaitu suatu protease yang aktivitasnya optimal sedikit di bawah pH basa. Di samping itu cairan ini juga mengandung amilase, maltase dan lipase. Ikan yang tidak memiliki lambung dan pilorik kaeka, aktivitas proteolitik terutama berasal dari cairan pankreatik.
Kecernaan (digestibility) dipengaruhi oleh tiga faktor, yaitu (1) jenis pakan yang dimakan dan kadar kepekaan pakan terhadap pengaruh enzim pencernaan,
(2) aktivitas enzim-enzim pencernaan, (3) lama waktu pakan yang dimakan terkena aksi enzim pencernaan. Masing-masing faktor di atas dipengaruhi oleh berbagai faktor sekunder yang berkaitan dengan ikan itu sendiri (spesies, umur, ukuran) dan kondisi fisiologis, yang berkaitan dengan lingkungan (temperatur), dan yang berkaitan dengan pakannya (komposisi pakan, ukuran partikel dan jumlah pakan yang dimakan). Kecernaan berbeda antar spesies ikan, hal ini terjadi akibat perbedaan sistem dan enzim-enzim pencernaan.
Kemampuan ikan dalam mencerna makanan sangat bergantung pada kelengkapan organ pencernaan dan ketersediaan enzim pencernaan. Perkembangan saluran pencernaan tersebut berlangsung secara bertahap dan setelah mencapai ukuran/umur tertentu saluran pencernaan mencapai kesempurnaannya. Perkembangan struktur alat pencernaan ini diikuti oleh perkembangan enzim pencernaan dan perubahan kebiasaan makan (food habit). Kandungan nutrien pakan nampaknya berpengaruh pada aktivitas enzim pencernaan. Kuzmina (1996) mengungkapkan bahwa tersedianya substrat merupakan faktor yang nyata dalam pengaturan aktivitas enzim pada ikan dan mamalia. Kandungan protein pakan yang tinggi dikaitkan dengan kandungan selulosa yang rendah umumnya meningkatkan aktivitas protease pada ikan rainbow trout (Hepher 1990). Peningkatan proporsi pati kentang dalam pakan dari 10 menjadi 90% yang diikuti penurunan proporsi tepung ikan akan meningkatkan aktvitas enzim maltase dan amilase pada ikan mas, dan adaptasi enzim karbohidrase ini terhadap komposisi pakan sudah terlihat kurang dari satu minggu (Kawai dan Iceda 1972). Peningkatan protein pakan dan penurunan kadar selulose pakan menyebabkan peningkatan aktivitas enzim amilase pada ikan rainbow trout (Kawai dan Iceda 1972).
Stickney dan Shumway (1974) menyatakan bahwa enzim selulosa diproduksi oleh mikroflora usus, yang dihubungkan dengan aktivitas selulosa dalam usus dengan jumlah selulase/bakteri selulitik. Das dan Tripathi (1991) mendapatkan kemunduran drastis dalam aktivitas selulase ketika ikan grass carp diberi pakan dari makanan yang mengadung tetrasiklin. Pemanfaatan daun lamtorogung sangat dibatasi oleh kecernaan ikan yang terbatas terhadap jenis
dedaunan ini. Hal ini berkaitan dengan ketersediaan enzim selulotik yang terbatas dalam saluran pencernaan ikan.
Enzim protease menguraikan rantai-rantai peptida dari protein. Berdasarkan letak ikatan peptida pada tengah atau akhir molekul, peptidase diklasifikasikan menjadi endopeptidase dan eksopeptidase. Endopeptidase menghidrolisis protein dan peptida-peptida rantai panjang menjadi peptida-peptida pendek. Endopeptidase penting antara lain pepsin yang dihasilkan dari zimogen pepsinogen, tripsin dari tripsinogen dan kimotripsin dari kimotripsinogen. Eksopeptidase menghidrolisis peptida menjadi asam-asam amino. Karboksipeptidase, aminopeptidase dan dipeptidase termasuk dalam kelompok eksopeptidase. Alfa amilase adalah enzim yang bertanggung jawab menghidrolisis pati menjadi glukosa. Enzim ini memutuskan ikatan 1,4- -glukosidik dan mengubah pati menjadi glukosa dan maltosa. Sedangkan lipase adalah enzim penting dalam pencernaan lemak. Lipase memecah lemak menjadi gliserol dan asam lemak (Steffens 1989; Hepher 1990).
Enzim berperan dalam mengubah laju reaksi, sehingga kecepatan reaksi yang diperlihatkan dapat dijadikan ukuran keaktifan enzim. Satu unit enzim adalah jumlah enzim yang mengkatalisis transformasi 1 mikromol substrat dalam waktu 1 menit pada suhu 25 C dan pada keadaan pH optimal (Well 1979 dalam
Affandi et al. 1992). Aktivitas enzim bergantung pada konsentrasi enzim dan substrat, suhu, pH dan inhibitor. Huisman (1976) menyatakan bahwa enzim pencernaan yang dihasilkan oleh lambung ikan aktif pada pH 2 sampai 4.
2.5 Kualitas Air
Ikan hidup pada suatu lingkungan yang selalu berubah baik harian, musiman, bahkan tahunan. Ikan bersifat poikilothermal yang berarti suhu tubuhnya harus sesuai dengan kondisi lingkungan yang selalu berubah tersebut. Perubahan kondisi lingkungan ini tentunya akan mempengaruhi kehidupan organisme. Perubahan lingkungan terutama terjadi pada kualitas air. Kualitas air yang kurang baik mengakibatkan pertumbuhan ikan menjadi lambat.
Pada umumnya, Tilapia tidak tumbuh dengan baik pada suhu di bawah 16°C dan tidak dapat bertahan hidup setelah beberapa hari di bawah suhu 10°C
(Chervinski 1982 dalam Stickney 1993). Pertumbuhan ikan sangat dipengaruhi suhu lingkungan perairan. Metabolisme pada tubuh ikan akan semakin meningkat dengan meningkatnya suhu lingkungan. Sebagian besar spesies ikan yang hidup di perairan hangat (warmwater), pertumbuhan ikan berkisar pada suhu 17-18°C dan optimal pada suhu 28-30°C (Kinne 1960 dalam Hepher 1990).
Beberapa spesies Tilapia telah banyak diakui dapat bertahan hidup dalam kondisi oksigen terlarut yang rendah. Tingkat oksigen terlarut yang paling rendah untuk dapat bertahan hidup adalah 0,1 mg/l pada Tilapia mossambica dan Tilapia nilotica (Maruyama 1958; Magid dan Babiker 1975 dalam Stickney 1993). Wardoyo (1991) menyatakan bahwa kandungan oksigen terlarut yang baik bagi pertumbuhan ikan umumnya lebih dari 5 mg/l.
Selain suhu dan kandungan oksigen terlarut, pH atau derajat keasaman perairan juga mempengaruhi tingkat kelangsungan hidup dan pertumbuhan ikan. Bagi sebagian besar spesies ikan, pH yang rendah atau tinggi di luar kisaran 6,5-9,0 dapat menurunkan pertumbuhan rata-rata dan pada kondisi ekstrim dapat mengganggu kesehatan ikan (Swingle 1961; Alabaster dan Llyod 1980 dalam
Hepher 1990). Ammonia yang tidak terionisasi (NH3) memiliki pengaruh meracuni bagi ikan (Hepher 1990). Meade dalam Boyd (1990) menyimpulkan bahwa konsentrasi maksimum ammonia yang aman untuk ikan belum diketahui, tetapi kadar ammonia di atas 0,012 mg/l masih diperbolehkan dan pada umumnya dapat diterima oleh organisme budidaya.
III.
BAHAN DAN METODE
3.1Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Agustus sampai dengan bulan Oktober 2009. Analisis proksimat bahan baku dan pakan uji, pembuatan pakan serta pemeliharaan ikan dilakukan di Laboratorium Nutrisi Ikan, sedangkan pengujian kualitas air dilakukan di Laboratorium Lingkungan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
3.2Pakan Uji
Pakan yang digunakan selama penelitian berbentuk pelet dengan perlakuan campuran bahan nabati tepung daun lamtorogung (TDL) pada level yang berbeda. Pakan uji yang digunakan adalah:
a. Pakan kontrol tanpa TDL (A); b. Pakan dengan TDL 10% (B); c. Pakan dengan TDL 15% (C); d. Pakan dengan TDL 20% (D); e. Pakan dengan TDL 25% (E); f. Pakan dengan TDL 30% (F).
Dalam pembuatan TDL, daun lamtorogung direndam dalam air tawar selama 24 jam kemudian diangin-anginkan dan selanjutnya dioven dengan suhu 600C. Setelah kering, daun lalu digiling menjadi tepung (TDL). Sebelum dicampur dengan bahan pakan lainnya, TDL diinkubasi dengan enzim dari cairan rumen domba sebanyak 1000 ml/kg selama 24 jam. Isolasi dan produksi enzim dari rumen domba yang diambil diusahakan selalu dalam kondisi dingin. Selanjutnya cairan rumen disentrifugasi dengan kecepatan 12.000 rpm selama 20 menit pada suhu 4 C, kemudian cairan (supernatan) yang terbentuk dapat diambil sebagai sumber enzim.
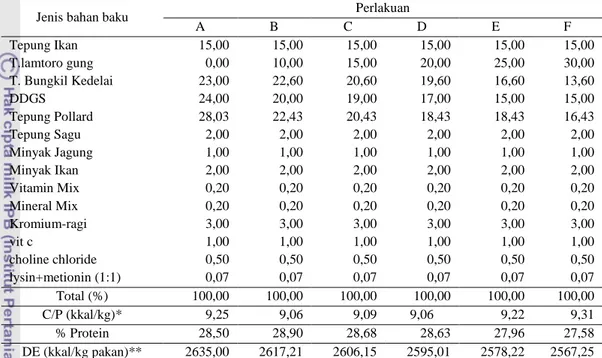
Semua bahan baku pakan terlebih dahulu dianalisis proksimat. Hasil analisa proksimat bahan kemudian digunakan untuk penyusunan formulasi pakan uji (Tabel 4) untuk selanjutnya dicetak menjadi pelet. Pakan yang telah dibuat
dalam bentuk pelet lalu dianalisis proksimat kembali untuk mengetahui pemenuhan target protein, energi protein rasio, maupun jumlah energi pakan yang ada (Tabel 5).
Tabel 4. Formulasi pakan uji untuk ikan nila (%)
Jenis bahan baku Perlakuan
A B C D E F Tepung Ikan 15,00 15,00 15,00 15,00 15,00 15,00 T.lamtoro gung 0,00 10,00 15,00 20,00 25,00 30,00 T. Bungkil Kedelai 23,00 22,60 20,60 19,60 16,60 13,60 DDGS 24,00 20,00 19,00 17,00 15,00 15,00 Tepung Pollard 28,03 22,43 20,43 18,43 18,43 16,43 Tepung Sagu 2,00 2,00 2,00 2,00 2,00 2,00 Minyak Jagung 1,00 1,00 1,00 1,00 1,00 1,00 Minyak Ikan 2,00 2,00 2,00 2,00 2,00 2,00 Vitamin Mix 0,20 0,20 0,20 0,20 0,20 0,20 Mineral Mix 0,20 0,20 0,20 0,20 0,20 0,20 Kromium-ragi 3,00 3,00 3,00 3,00 3,00 3,00 vit c 1,00 1,00 1,00 1,00 1,00 1,00 choline chloride 0,50 0,50 0,50 0,50 0,50 0,50 lysin+metionin (1:1) 0,07 0,07 0,07 0,07 0,07 0,07 Total (%) 100,00 100,00 100,00 100,00 100,00 100,00 C/P (kkal/kg)* 9,25 9,06 9,09 9,06 9,22 9,31 % Protein 28,50 28,90 28,68 28,63 27,96 27,58 DE (kkal/kg pakan)** 2635,00 2617,21 2606,15 2595,01 2578,22 2567,25 Keterangan : * C = energi ; P = protein
**1 g protein = 3,5 kkal DE, 1 g karbohidrat = 2,5 kkal DE, 1 g lemak = 8,1 DE (NRC 1977)
Tabel 5. Komposisi proksimat pakan perlakuan (% bobot kering)
Komposisi proksimat Pakan perlakuan
A (0%) B (10%) C (15%) D (20%) E (25%) F (30%) Protein 31,12 30,35 32,90 32,90 32,29 30,56 Lemak 8,79 8,21 9,38 9,26 9,35 9,55 Abu 9,73 9,82 9,71 9,05 10,13 8,91 Serat Kasar 6,03 5,97 5,56 4,78 5,81 5,83 BETN 36,08 38,46 33,39 35,27 33,09 36,17 DE 2703,09 2688,78 2745,92 2783,56 2714,58 2747,31 C/P 8,69 8,86 8,35 8,46 8,41 8,99 Keterangan:
BETN = Bahan Ekstrak Tanpa Nitrogen
3.3Pemeliharaan Ikan
Ikan yang dipelihara adalah ikan nila (Oreochromis niloticus) dengan bobot awal rata-rata 9,38±0,41 gram dan padat tebar 8 ekor/akuarium. Sebelum pemeliharaan dimulai, dilakukan terlebih dahulu persiapan wadah. Persiapan
wadah meliputi persiapan tata letak, sterilisasi wadah dan alat-alat menggunakan kaporit, pemasangan sistem aerasi dan resirkulasi, serta pengisian air. Penelitian yang dilakukan adalah 6 perlakuan dengan 3 kali ulangan sehingga akuarium yang dibutuhkan sebanyak 18 buah. Ukuran akuarium yang digunakan yaitu 35x40x50 cm dengan ketinggian air rata-rata 30 cm.
Persiapan ikan meliputi pengadaptasian ikan terhadap kondisi lingkungan dan pakan uji. Ikan yang baru datang diaklimatisasi terlebih dahulu dengan kondisi laboratorium selama 14 hari. Pakan yang diberikan mula-mula adalah pakan komersil. Sebelum perlakuan, ikan dipuasakan terlebih dahulu selama 24 jam dengan tujuan menghilangkan sisa pakan dalam saluran pencernaan selama masa aklimatisasi.
Ikan dipelihara selama 40 hari dan diberi pakan secara at satiation dengan frekuensi 3 kali sehari. Untuk mengetahui efisiensi pakan yang diberikan, maka pakan harus diketahui bobotnya. Selain itu, dilakukan penimbangan bobot ikan awal dan akhir serta yang mati. Untuk menjaga kualitas air, dilakukan penyiponan dan penggantian air serta menggunakan pemanas air elektrik (heater) agar suhu stabil. Faktor kualitas air yang diperhatikan adalah suhu yang diamati setiap pagi hari sebelum pemberian pakan serta pengukuran pH, alkalinitas, kesadahan, TAN dan DO di awal dan akhir pemeliharaan. Sampling bobot ikan hanya dilakukan di awal dan akhir pemeliharaan untuk menghindari ikan stres.
3.4 Analisis Kimia Pakan dan Ikan Perlakuan
Analisis proksimat dilakukan terhadap bahan dan pakan perlakuan yang meliputi kadar protein kasar, lemak kasar, serat kasar, abu, air dan Bahan Ekstrak Tanpa Nitrogen (BETN). Sedangkan untuk ikan awal dan akhir pemeliharaan, analisis proksimat yang dilakukan yaitu kadar protein kasar, lemak kasar dan air. Analisis proksimat untuk protein kasar dilakukan dengan metode Kjeldahl, lemak kasar pada bahan dan pakan perlakuan dengan metode Soxhlet, lemak pada tubuh ikan dengan metode Folch, abu dengan pemanasan sampel dalam tanur bersuhu 600 °C, serat kasar menggunakan metode pelarutan sampel dengan asam dan basa kuat serta pemanasan dan kadar air dengan metode pemanasan dalam oven
bersuhu 105-110 °C (Takeuchi 1988 dalam Watanabe 1988). Metode analisis proksimat dijelaskan pada Lampiran 3.
3.5Pengumpulan dan Pengolahan Data
Parameter yang diamati dalam penelitian ini adalah: 1) pertumbuhan, 2) efisiensi pakan, 3) retensi protein, 4) retensi lemak dan 5) konsumsi pakan.
3.5.1Laju Pertumbuhan Spesifik
Pertumbuahan diukur dengan menimbang ikan uji pada awal dan akhir perlakuan. Laju pertumbuhan spesifik dihitung dengan rumus Huisman (1976).
Keterangan : LPH = laju pertumbuhan spesifik Wt = bobot akhir ikan uji Wo = bobot awal ikan uji
t = masa pemeliharaan
3.5.2Efisiensi Pakan
Efisiensi pakan didefinisikan sebagai peningkatan berat basah daging per unit berat pakan kering. Efisiensi pakan dianalisis berdasarkan rumus Takeuchi (1988) dalam Watanabe (1988), yaitu:
100 F W0 D) (Wt EP
Keterangan: EP = efisiensi pakan (%)
Wt = bobot ikan pada waktu t (gram)
Wo= bobot ikan pada awal penelitian (gram) D = bobot ikan yang mati selama penelitian (gram) F = jumlah pakan yang dikonsumsi (gram)
3.5.3Retensi Protein dan Lemak
Retensi protein dan lemak dapat diketahui dengan melakukan analisis proksimat terhadap pakan serta tubuh ikan sebelum dan sesudah percobaan.
100 1 Wo Wt t LPS
Retensi protein dihitung dengan rumus Takeuchi (1988) dalam Watanabe (1988). 100 P I F Rp
Keterangan: Rp = retensi protein (%)
F = jumlah protein dalam tubuh ikan pada akhir penelitian I = jumlah protein dalam tubuh ikan pada awal pemeliharaan P = jumlah protein yang dikonsumsi ikan
Retensi lemak dihitung dengan rumus Takeuchi (1988) dalam Watanabe (1988). 100 L Lo Lt Rl
Keterangan: Rl = retensi lemak (%)
Lt = jumlah lemak dalam tubuh ikan pada akhir penelitian Lo = jumlah lemak dalam tubuh ikan pada awal pemeliharaan L = jumlah lemak yang dikonsumsi ikan
3.5.4Jumlah Konsumsi Pakan
Jumlah konsumsi pakan ditentukan dengan menimbang pakan yang diberikan pada ikan uji setiap hari selama percobaan dilakukan. Pada akhi percobaan, pakan yang telah diberikan dijumlahkan dan dikurangi sisa pakan yang telah dikeringkan menjadi data konsumsi pakan.
3.6 Analisis Statistik
Rancangan yang digunakan pada penelitian adalah Rancangan Acak Lengkap (RAL) dengan enam perlakuan dan tiga kali ulangan untuk setiap perlakuan. Data yang diperoleh kemudian ditabulasi dan dianalisis menggunakan program MS. Office Excel 2007 dan SPSS 15.0 dengan menggunakan uji lanjut Duncan.
IV.
HASIL DAN PEMBAHASAN
4.1Hasil
Data rata-rata parameter uji hasil penelitian, yaitu laju pertumbuhan spesifik (LPS), efisiensi pemberian pakan (EP), jumlah konsumsi pakan (JKP), retensi protein (RP) dan retensi lemak (RL) disajikan pada Tabel 6. Data tiap ulangan dan analisis statistiknya disajikan pada Lampiran 4.
Tabel 6. Data hasil parameter kinerja pertumbuhan ikan uji
Keterangan: huruf superskrip yang sama pada kolom yang sama menunjukkan hasil yang tidak berbeda nyata (P>0,05).
Berdasarkan Tabel 6, terlihat bahwa pertumbuhan (LPS) ikan uji mengalami penurunan pada penggunaan TDL yang makin meningkat. Perlakuan pakan dengan TDL 0% (A) sampai 15% (C) memberikan pengaruh yang berbeda nyata terhadap pertumbuhan jika dibandingkan dengan perlakuan pakan yang menggunakan TDL 30% (F). Sementara itu, efisiensi pakan (EP) pakan uji menunjukkan pengaruh yang sama pada semua perlakuan.
Pakan uji yang mengandung TDL 0%, 10%, 15%, 20% maupun 25% memberikan hasil yang tidak berbeda nyata terhadap jumlah konsumsi pakan (JKP). Akan tetapi, perlakuan pakan A menunjukkan pengaruh yang berbeda nyata terhadap perlakuan F. JKP tertinggi adalah pada perlakuan A sebanyak 223,20 ± 55,21gram dan terendah pada perlakuan F 152,98 ± 21,93 gram.
Nilai retensi menggambarkan jumlah protein atau lemak yang disimpan dalam tubuh ikan uji. Berdasarkan Tabel 6, nilai retensi protein (RP) tertinggi adalah pakan perlakuan F. Sebaliknya, retensi lemak (RL) pada perlakuan ini adalah yang terendah dibandingkan dengan lima perlakuan lainnya. Uji statistik terhadap nilai RP dan RL dari seluruh perlakuan memperlihatkan pengaruh yang tidak berbeda nyata.
Perlakuan LPS (%) EP (%) JKP (g) RP (%) RL (%) A (0%) 2,66 ± 0,34a 51,76 ± 6,25a 223,20 ± 55,21a 43,25 ± 17,33a 103,71 ± 27,19a B (10%) 2,60 ± 0,18a 59,28 ± 7,31a 197,43 ± 13,33ab 51,99 ± 15,34a 93,94 ± 20,38a C (15%) 2,20 ± 0,09a 45,90 ± 9,12a 180,42 ± 43,62ab 42,83 ± 4,63a 86,78 ± 6,25a D (20%) 2,11 ± 0,29ab 42,18 ± 5,48a 191,80 ± 33,69ab 25,17 ± 19,35a 81,20 ± 31,22a E (25%) 2,09 ± 0,21ab 45,87 ± 3,73a 180,93 ± 15,00ab 47,55 ± 22,97a 91,99 ± 31,12a F (30%) 1,47 ± 0,18b 48,07 ± 22,81a 152,98 ± 21,93b 56,17 ± 29,07a 55,84 ± 25,54a
4.2Pembahasan
Penelitian ini menggunakan pakan berbasis tepung daun lamtorogung (TDL) sebagai alternatif sumber protein nabati pada pakan ikan. TDL sebelumnya dihidrolisis dengan ekstrak enzim kasar cairan rumen domba (predigestion) untuk meningkatkan daya gunanya. Kinerja pertumbuhan ikan uji, yakni ikan nila, yang diamati adalah laju pertumbuhan spesifik (LPS), efisiensi pemberian pakan (EP), jumlah konsumsi pakan (JKP), retensi protein (RP) dan retensi lemak (RL).
Pertumbuhan ikan uji yang digambarkan dengan nilai LPS, berdasarkan Tabel 6 menunjukkan hasil yang terus menurun pada peningkatan level TDL. Laju pertumbuhan spesifik sendiri merupakan proses perubahan bobot individu pada periode waktu tertentu. Laju pertumbuhan juga menjelaskan kemampuan ikan dalam memanfaatkan nutrien pakan yang disimpan dalam tubuhnya kemudian mengkonversinya menjadi energi.
Pertumbuhan berkaitan dengan jumlah konsumsi pakan dan efisiensi pemanfaatan pakan yang diberikan. Pakan yang dikonsumsi (JKP) merupakan sumber nutrien untuk pertumbuhan, yaitu sebagai sumber energi dan materi pembangun tubuh. Sedangkan pemanfaatan pakan yang diberikan (EP) didefinisikan sebagai peningkatan berat basah daging per unit berat pakan kering. Semakin besar nilai efisiensi pakan, menunjukkan pemanfaatan pakan dalam tubuh ikan semakin efisien dan kualitas pakan tersebut makin baik.
Semakin kecilnya persentase pertumbuhan diikuti dengan menurunnya jumlah konsumsi pakan. Hal ini menunjukkan kecenderungan menurunnya nafsu makan ikan pada peningkatan dosis TDL di dalam komposisi pakan. Jumlah konsumsi pakan berdasarkan Tabel 6 nilainya cenderung menurun sejalan dengan meningkatnya penggunaan TDL. Konsumsi pakan tertinggi adalah pakan perlakuan A dengan TDL 0%. Perlakuan ini juga menghasilkan pertumbuhan tertinggi dibandingkan dengan lima perlakuan lainnya. Konsumsi pakan tertinggi kedua adalah perlakuan B dengan TDL 10% dan diikuti dengan nilai LPH yang tidak berbeda nyata dengan pakan perlakuan A. Pertumbuhan sampai level TDL 15%, menunjukkan hasil yang tidak berbeda nyata, demikian pula halnya dengan nilai EP dan JKP-nya.
Ikan sangat sensitif terhadap rasa dan bau tertentu di dalam makanannya (palatabilitas) dan hal ini akan mempengaruhi konsumsinya terhadap pakan. Sebagaimana disebutkan oleh Jackson et al. (1982) dalam Robert (2002) bahwa penelitian terhadap Leucaena yang mengandung mimosin di dalam komposisi pakannya memberikan hasil pertumbuhan dan nafsu makan ikan yang rendah. Diduga, hal ini disebabkan karena di dalam bahan TDL yang digunakan masih mengandung zat antinutrisi yaitu mimosin dan konsentrasinya semakin banyak pada peningkatan penggunaan TDL. Banyaknya kandungan mimosin pada TDL bergantung pada jenis dan umur tanaman serta pengolahannya hingga menjadi tepung (Hertrampf dan Pascual 2000). Selain itu, beberapa nutrien esensial yang dibutuhkan oleh ikan tidak sepenuhnya dimiliki oleh TDL. Akibatnya, metabolisme akan ikut terganggu sehingga akan berpengaruh pula terhadap kontrol nafsu makan, pengangkutan nutrien di dalam tubuh, penyerapan nutrien dari darah ke jaringan serta pertumbuhan.
Pertumbuhan ikan sangat bergantung pada pasokan energi dalam pakan dan pembelanjaan energi. Pertumbuhan akan terjadi apabila ada kelebihan energi dari pakan yang dikonsumsi setelah kebutuhan energi minimumnya (untuk hidup pokok) sudah terpenuhi, seperti bernafas, berenang, proses metabolisme dan perawatan (maintenance). Sementara itu, pemanfaatan materi dan energi pakan untuk pertumbuhan terlebih dahulu melalui proses pencernaan dan metabolisme. Dalam proses pencernaan, makanan yang tadinya merupakan senyawa kompleks akan dipecah menjadi senyawa yang lebih sederhana sehingga mudah diserap melalui dinding usus dan disebarkan ke seluruh tubuh melalui sistem peredaran darah.
Komponen pakan yang berkontribusi terhadap penyediaan materi dan energi tumbuh adalah protein, karbohidrat dan lemak. Pertumbuhan ikan yang relatif lambat disebabkan karena kandungan energi pakan khususnya yang berasal dari karbohidrat dan lemak tidak cukup untuk proses metabolisme. Akibatnya, protein digunakan dalam proses tersebut sehingga tidak mencukupi bagi ikan untuk proses pertumbuhan. Banyaknya protein pakan yang tersimpan dalam tubuh ikan (RP) tertinggi pada Tabel 6 adalah pada perlakuan F. Akan tetapi, lemak yang disimpan oleh ikan perlakuan ini (RL) justru adalah yang terendah
dibandingkan lima perlakuan lainnya. Dengan demikian, sebagian besar protein yang seharusnya digunakan untuk pertumbuhan akan dimanfaatkan sebagai sumber energi. Selain itu, konsumsi pakan ikan perlakuan F juga menunjukkan jumlah terendah sehingga meskipun nilai efisiesi pakannya tergolong tinggi, pasokan energi dari pakannya pun kurang.
Daya cerna didefinisikan sebagai bagian pakan yang diserap oleh hewan. Dari Tabel 6 terlihat bahwa pakan perlakuan memberikan pengaruh yang tidak berbeda nyata terhadap nilai RP dan RL. Dengan demikian, nilai retensi baik protein maupun lemak dapat memberikan gambaran mengenai kemampuan ikan nila dalam mencerna pakan dengan basis tepung daun lamtorogung. Ikan nila sendiri telah diketahui sebagai ikan omnivora yang cenderung herbivora sehingga akan lebih mudah beradaptasi dengan jenis pakan yang dicampur dengan sumber bahan nabati. Selain itu, aktivitas enzim amilase pada ikan omnivora lebih tinggi dan dapat memanfaatkan protein dari bahan nabati lebih baik. Ikan ini juga memiliki usus yang lebih panjang dibandingkan ikan karnivora sehingga materi makanan dari tanaman yang sulit dicerna lebih lama berada di dalam saluran pencernaan dan ikan memiliki kesempatan untuk mencernanya dengan lebih baik.
Pemanfaatan bahan baku pakan ikan nila dari daun tumbuhan khususnya daun lamtorogung dibatasi dengan kandungan yang tinggi dari komponen neutral detergent fiber (NDF) 39,5% dan acid detergent fiber (ADF) 35,10% (Gracia et al. 1996). Serat kasar merupakan komponen karbohidrat yang kaya akan lignin dan selulosa yang bersifat sukar dicerna oleh ikan. Polisakarida yang terdapat pada dinding sel tanaman merupakan bagian terbesar komponen serat kasar tersebut. Pada hewan ruminansia, komponen serat kasar ini dicerna dengan bantuan mikroba tertentu di dalam usus. Salah satu usaha untuk mengatasi kecernaan serat yang rendah pada ikan adalah penggunaan enzim eksogen untuk menghidrolisis serat.
Peranan enzim pencernaan dalam proses pencernaan sangat dominan, yaitu berperan dalam menghidrolisis senyawa kompleks menjadi senyawa sederhana yang siap diserap. Isi rumen diakui sebagai sumber enzim pendegradasi polisakarida. Rumen sendiri merupakan bagian dari perut hewan ruminansia dimana didalam retikulonya terdapat mikrobia rumen yang terdiri atas protozoa
dan bakteri yang berfungsi melaksanakan fermentasi untuk mensintesis asam amino, vitamin B-komplek dan vitamin K sebagai sumber zat makanan bagi hewan induk semang (Hungate 1966). Mikroba-mikroba rumen mensekresikan enzim-enzim pencernaan ke dalam cairan rumen untuk membantu mendegradasi partikel makanan. Penggunaan ekstrak enzim kasar cairan rumen domba ini diharapkan dapat meningkatkan daya guna TDL dalam komposisi pakan ikan dengan menurunkan serat kasarnya sehingga pakan akan lebih mudah dicerna.
V.
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Tepung daun lamtorogung (TDL) yang telah dihidrolisis dengan cairan rumen domba sebanyak 1000 ml/kg dapat dimanfaatkan sebagai sumber protein nabati alternatif pada pakan ikan nila. Berdasarkan hasil penelitian ini, pakan dengan dosis TDL hingga 15% dapat mendukung pertumbuhan ikan nila dengan baik. Sementara itu, penggunaan TDL di atas 20% dapat mengganggu pertumbuhan dan menurunkan nafsu makan ikan.
5.2 Saran
Sebaiknya dalam memanfaatkan TDL sebagai bahan pakan ikan nila digunakan dosis 15%. TDL perlu diolah dengan teknik yang lebih disempurnakan untuk menurunkan toksisitas mimosin yang ada di dalamnya sehingga penggunaannya dapat ditingkatkan. Untuk mengetahui kemampuan ikan dalam memanfaatkan pakan berbasis TDL, perlu dicobakan pula pada ikan dengan ukuran, umur maupun spesies yang berbeda.
DAFTAR PUSTAKA
Affandi R, Sjafei DS, Rahardjo MF, Sulistiono. 1992. Fisiologi ikan (pencernaan). Bogor : Institut Pertanian Bogor, Pusat Antar Universitas Ilmu Hayat.
Amisah S, Oteng MA, Ofori JK. 2009. Growth performance of the African catfish, Clarias gariepinus, fed varying inclusion levels of Leucaena leucocephala leaf meal. Journal of Applied Sciences & Environmental Management 13: 21-26.
Brewbaker LL, Hylin JW. 1965. Variation in mimosin contain among leucaena spesies and related mimmosaceae. Corp Sci: 348-349.
Boyd CE. 1990. Water quality in ponds for aquaculture. Department of Fisheries and Allied Aquacultures. Auburn University. Alabama.
Catacutan MR, Greorgia EP. 2004. Partial replacement of Fishmeal by defatted soybean meal in formulated diets for the mangrove red snapper,
Lutjanus argentimaculatus. Aquaculture Research 35: 299 - 306
Cheng ZJ, Hardy RW, Blair M. 2003. Effects of supplementing methionine hidroxy analogue in soybean meal and distiller’s dries grain-based diet on the performance and nutrient retention of rainbow trout
Oncorhynchus mykiss (Walbaum). AquacultureResearch 34: 1303.
Cho CY, Cower CW, Watanabe T. 1983. Finfish nutrition in Asia. Methodological approach to research and development: Ontario, University of Guelph. pp 154.
Cruz BM, Laudencia IL. 1977. Preliminary study on the protein requirement of Nile tilapia (Tilapia niloticus) fingerlings. Fisheries Research Journal, Philippines 3: 34-35.
Das KM, Tripathi SD. 1991. Studies on digestive enzymes of grass carp
Ctenopharyngodon idella (Val). Aquaculture 92: 11-21.
Departemen Kelautan dan Perikanan (DKP). 2008. Volume impor bahan baku pakan periode Januari-September 2008. www.dkp.go.id. [9 Agustus 2009].
Departemen Kelautan dan Perikanan (DKP). 2009. Volume produksi perikanan budidaya. www.dkp.go.id. [9 Agustus 2009].
El-Sayed M, Fattah MA. 1999. Alternative dietary protein sources for farmed tilapia Oreochromis sp.. Aquaculture 179: 149-106.
Elangovan A, Shim KF. 2000. The influence of replacing fish meal partially in the diet with soybean meal on growth and body composition of juvenile tin foil barb Barbodesw altus. Aquaculture 189: 133-144.
Furuichi M. 1988. Dietary vity of carbohydrates. Di dalam: Watanabe T (Editor). Fish nutrition and marine culture. Departement of Aquatic Biosciences Tokyo University of Fishes, Tokyo. pp 1-77.
Garcia GW, Fergusson TU, Neckles FA, Archibald KAE. 1996. The nutritive value and forage productivity of Leucaena leucocephala. Anim Feed Sci Technol, 60: 29-41.
Hepher B. 1990. Nutrition of pond fishes. New York: Cambridge, Cambridge University Press.
Hertrampf JW, Piedad-Pascual F. 2000. Handbook on ingredients for aquaculture feeds. Kluwer Academic Publishers. Dordrecht. Boston, London.
Huisman EA. 1976. Food conversion efficiencies at maintenance and production levels of carp (Cyprinus carpio) and rainbow trout (Salmo gairdiveri). Aquaculture 9: 259-273.
Hungate R. 1966. The rumen and its microbes. London and New York: Academic Press.
Jauncey K. 1982. The effect of varying dietary protein level on growth, food conversion, protein utilization and body composition of juvenile tilapias (S. mossambicus). Aquaculture 27: 43-54.
Jauncey K, Rose B. 1982. A guide to tilapia feeds and feeding. Institute of Aquaculture. Univ. of Sterling, Scotland.
Jobling M. 1994. Food intake in fish. Norwegian College of Fishery Science (NFH). University of Tromso 9037 Tromso, Norwegia.
Kamra DN. 2005. Special section microbial diversity: rumen microbial ecosystem. Current Science 89: 124-135.
Khoironi. 1996. Kelangsungan hidup dan pertumbuhan benih ikan nila merah (Oreochromis sp.) pada suhu media 28±0,25°C dengan salinitas 0, 10 dan 20 ppt. [Skripsi]. Departemen Budidaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor.
Kubaryk JM. 1980. Effects of diet, feeding schedule, and sex on food consumption, growth, and retention of protein and energy by Tilapia. [Ph.D. dissertation]. Auburn University, Auburn, Alabama.
Kuzmina W. 1996. Influence of age on digestive enzyme activity in some freshwater teleostei. Aquaculture 148: 25-37.
Lee SS, Kim CH, Ha JK, Moon YH, Choi NJ, Cheng KJ. 2002. Distribution and activities of hydrolytic enzymes in the rumen compartements of hereford bulls fed alfalfa based diet. Asian-Aust. J. Anim. Sci. 15: 1725-1731.
Lim C, Dominy WG. 1991. Utilization of plant proteins by warmwater fish. Di dalam: Akiyama DM dan Tan RKH (Editor). Proc Aquaculture Feed Processing and Nutrition Workshop. Thailand and Indonesia, 19-25 September 1991. pp 163-172.
Lovell T. 1989. Nutrition and feeding of fish. Van Nostrand Reinhold, New York.
Meulen US, Schulke, El-Harith EA. 1979. Review on the nutritive value and toxic aspects of Leucaena leucocephala. Trop. Anim. Prod. 4: 113-116.
Moharrey A, Das TK. 2002. Correlation between microbial enzyme activities in the rumen fluid of sheep under different treatments. Reprod. Nutr. Dev. 41: 513-529.
NAS. 1994. Leucaena: promising forage and tree crop for tropics, second edition. National Academy of Sciences, Washington.
National Research Council (NRC). 1983. Nutrient requirements of warmwater fishes and shellfish. National Academy of Sciences, Washington DC.
National Research Council (NRC). 1993. Nutrient requirements of fish. National Academy of Sciences, Washington DC.
Pebriyadi B. 2004. Penambahan metionina dan triptofan dalam pakan benih ikan nila yang mengandung tepung bungkil kedelai. [Tesis]. Program Pasca Sarjana. Institut Pertanian Bogor.
Pelawi TL. 2003. Pengaruh pemberian Daphnia sp. yang diperkaya dengan minyak ikan, minyak jagung dan minyak kelapa terhadap pertumbuhan dan tingkat kelangsungan hidup larva ikan nila (Oreochromis niloticus). [Skripsi]. Departemen Budidaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor.
Pieper A, Pfeffer E. 1980. Studies on the comparative efficiency of utilization of gross energy from some carbohydrates, proteins and fats by rainbow trout (Salmo gairdneri R.). Aquaculture 20: 323–332.
Popma TJ. 1982. Digestibility of selected feedstuffs and naturally occurring algae by tilapia. [Ph.D. dissertation]. Auburn University, Auburn, Alabama.
Rachmiwati LM. 2008. Pemanfaatan limbah budidaya ikan lele Clarias sp. oleh ikan nila Oreochromis niloticus melalui pengembangan bakteri heterotrof. [Skripsi]. Departemen Budidaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor.
Robert RJ. 2002. Nutritional pathology. Di dalam: Halver JE dan Hardy RW (Editor). Fish nutrition, third edition. Elsevier science academic press, USA.
Rosmawati. 2005. Hidrolisis pakan buatan oleh enzim pepsin dan pankreatin untuk meningkatkan daya cerna dan pertumbuhan benih ikan gurami (Osphronemus gouramy). [Tesis]. Sekolah Pasca Sarjana. Institut Pertanian Bogor.
Saha A, Ray AK. 1998. Cellulose activity in rohu fingerlings. Aquaculture International 6: 281-291.
Santiago CB, Lovell RT. 1988. Amino acid requirement for growth of Nile tilapia. Journal of Nutrition 118: 1540-1546.
Sargent JR, Tocher DR, Bell JG. 2002. The lipids. Di dalam: Halver JE dan Hardy RW (Editor). Fish nutrition, third edition. Elsevier science academic press, USA. pp 207-221.
Scott JR, Newton SH, Katayama RW. 1982. Evaluation of sunflower meal as a soybean meal replacement in rainbow trout diets. Proceeding of Thirty-Sixth Annual Conference. South-Eastern Association of Fish and Wildlife Agencies: October 31 to November 2, Jacksonville, Florida.
Siddiqui AQ, Howlader MS, Adam AA. 1988. Effects of dietary protein level on growth, feed conversion and utilization in fry and young Nile tilapia,
Oreochromis niloticus. Aquaculture 70: 63-73.
Steffens W. 1989. Principles of fish nutrition. Halsted Press: a Division of John Wiley & Sons, New York. pp 384.
Stickney RR, Shumway SE. 1974. Occurrence of cellulose activity in the stomachs. Journal of Fish Biology 6: 779-790.
Stickney RR. 1993. Culture of nonsalmonid freshwater fishes, second edition. CRC Press Inc, Florida.
Suprayudi MA, Bintang M, Takeuchi T, Mokoginta I, Toha S. 1999. Defatted soybean meal as an alternative source to substitute fish meal in the feed of giant gouramy Osphronemus gouramy Lac. Suisanzozhoku 47 (4): 551-557.
Takeuchi T. 1988. Laboratory work chemical evaluation of dietary nutrients. Di dalam: Fish nutrition and mariculture. Watanabe T (Editor). Department of Aquatic Bioscience. Tokyo University of Fisheries. JICA.
Trewavas, E. 1982. Tilapia: taxonomy and specification. Di dalam: Pullin RSV dan Lowe-Mc-Connel RH (Editor). The biology and culture of tilapias. ICLARM, Manila, the Philippines. pp 3-14.
Twibell RG, Brown PB. 1998. Optimal dietary protein concentration for hybrid tilapia, Oreochromis niloticus × O. aureus fed all-plant diets. Journal of the world aquaculture Society 29: 9-16.
Wardoyo TH. 1991. Pengelolaan kualitas air. Proyek Peningkatan Mutu Perguruan Tinggi. Institut Pertanian Bogor.
Watanabe T. 1988. Fish nutrition and marine culture. Department of Aquatic Bioscience. Tokyo University of Fisheries. JICA.
Watford JT, Lam TJ. 1993. Development of digestive tract and proteolitic enzyme activity in seabass (Lates calcarifer) larvae and juveniles. Aquaculture 109: 187-205.
Wee KL, Wang SS. 1987. Nutritive value of leucaena of leaf meal in pelleted feed for nile tilapia. Aquaculture 62: 97-108.
Wilson RP, Poe WE. 1985. Apparent digestibility protein and energy coefficients of feed ingredients for channel catfish. Prog. Fish-Cult. 47: 154-158.
Lampiran 1. Komposisi bahan dalam premix (vitamin dan mineral mix) Bahan dalam premix Dalam premix 1 kg Satuan
Vitamin Vitamin A 4.000.000 IU Vitamin D3 800.000 IU Vitamin E 4.500 Mg Vitamin K3 450 Mg Vitamin B1 450 Mg Vitamin B2 1.350 Mg Vitamin B6 480 Mg Vitamin B12 6 Mg Ca-d panthothenate 2.400 Mg Folic Acid 270 Mg Nicotinic acid 7.200 Mg Choline chloride 28.000 Mg Asam Amino DL Methionine 28.000 Mg L-Lysine 50.000 Mg Mineral Ferros 8.500 Mg Copper 700 Mg Manganese 18.500 Mg Zinc 14.000 Mg Cobalt 50 Mg Iodine 70 Mg Selenium 35 Mg
Antiox carrier add s/d 1kg -
Lampiran 2. Hasil proksimat bahan baku (% bobot kering) BAHAN Kadar Abu Serat Kasar Kadar Protein Kering ** Kadar Lemak Kering ** BETN* Tepung ikan 29,46 0,59 51,60 6,92 0,91 T. daun lamtorogung 7,04 12,14 24,43 7,07 39,61 T. bungkil kedelai 8,32 8,8 44,56 8,81 19,08 DDGS 4,21 18,27 27,80 9,69 40,03 Tepung pollard 3,89 7,16 13,41 6,19 59,91 Tepung sagu 0,13 0,39 3,82 1,37 84,35 Keterangan :
*BETN : Bahan Ekstrak Tanpa Nitrogen ** Kadar Air (%) :
Tepung Ikan : 10,53 % Tepung Daun Lamtorogung : 9,71 % Tepung Bungkil Kedelai : 10,44 % Tepung Pollard : 9,44 % Tepung Sagu : 9,94 %