SINTASAN DAN PERTUMBUHAN LARVA UDANG VANAME
YANG DIBERI PROBIOTIK Pseudoalteromonas 1UB DENGAN
DOSIS BERBEDA MELALUI Artemia sp.
DIAN NOVITA SARI
BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
2015
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi dengan judul Sintasan dan Pertumbuhan Larva Udang Vaname yang Diberi Probiotik Pseudoalteromonas 1UB dengan Dosis Berbeda Melalui Artemia sp. adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
Dian Novita Sari
ABSTRAK
DIAN NOVITA SARI. Sintasan dan Pertumbuhan Larva Udang Vaname yang Diberi Probiotik Pseudoalteromonas 1UB dengan Dosis Berbeda Melalui Artemia sp.. Dibimbing oleh WIDANARNI dan MUNTI YUHANA.
Penelitian ini bertujuan untuk menguji efektivitas pemberian probiotik
Pseudalteromonas 1UB melalui bioenkapsulasi Artemia sp. terhadap sintasan dan
pertumbuhan pada larva udang vaname. Stadia larva udang yang digunakan adalah mysis 1 dengan bobot 0,56±0,05 mg/ekor dan dipelihara dalam toples yang berisi 2 L air laut dengan kepadatan 30 ekor/L. Penelitian dilakukan dengan 4 perlakuan yaitu K (perlakuan kontrol, Artemia sp. tanpa bioenkapsulasi probiotik), A (bioenkapsulasi Artemia sp. dengan probiotik Pseudoalteromonas 1UBR 104 CFU/mL), B (bioenkapsulasi Artemia sp. dengan probiotik Pseudoalteromonas 1UBR 106 CFU/mL), dan C (bioenkapsulasi Artemia sp. dengan probiotik
Pseudoalteromonas 1UBR 108 CFU/mL). Kepadatan Artemia sp. yang digunakan saat bioenkapsulasi sebanyak 100 individu/mL dan stadia Artemia sp. yang digunakan adalah stadia instar 1-2. Hasil penelitian menunjukkan bahwa pemberian probiotik Pseudoalteromonas 1UBR 106 CFU/mL dan 108 CFU/mL masing-masing dapat meningkatkan sintasan larva udang vaname sebesar 19,13% dan 46,10% dengan pertumbuhan yang tidak berbeda nyata dibanding kontrol, yaitu masing-masing 23,11±2,87% dan 21,25±2,07%. Hasil terbaik diperoleh pada perlakuan C dengan sintasan 94,92% dan laju pertumbuhan harian 21,25±2,07%.
ABSTRACT
DIAN NOVITA SARI. Survival and Growth of White Shrimp Larvae Fed by
Artemia sp. Supplemented with Pseudoalteromonas 1UB Probiotics at Different
Dosages. Supervised by WIDANARNI and MUNTI YUHANA.
This study aimed to determine the effectiveness of Pseudoaltermonas 1UB probiotics bioencapsulated in Artemia sp. on the survival and growth of white shrimp larvae. The life stage of white shrimp larvae used in this study was mysis 1 with average body weight of 0,56±0,05 mg/larvae and reared in glass jars containing 2 L of seawaters with density 30 larvae/L. This study consisted of four treatments i.e. K (control treatment, without probiotics bioencapsulated in Artemia sp.), A (Pseudoalteromonas probiotics 1UBR 104 CFU/mL bioencapsulated in
Artemia sp.), B (Pseudoalteromonas 1UBR probiotics 106 CFU/mL bioencapsulated in Artemia sp.), and C (Pseudoalteromonas probiotics 1UBR 108 CFU/mL bioencapsulated in Artemia sp.). The density of Artemia sp. at bioencapsulation was as much 100 individuals/mL at the stage of instar 1-2. The result showed that the administration of probiotic Pseudoalteromonas 1UBR of 106 CFU/mL and 108 CFU/mL increased the survival rate white shrimp larvae of 19,13% and 46,10%, respectively. The growth rate was not significant compare to that of control, i.e. 23,11±2,87% and 21,25±2,07%, respectively. The best result was found in C treatment with survival rate was 94,92% and the specific growth rate was 21,25±2,07%.
SINTASAN DAN PERTUMBUHAN LARVA UDANG VANAME
YANG DIBERI PROBIOTIK Pseudoalteromonas 1UB DENGAN
DOSIS BERBEDA MELALUI Artemia sp.
DIAN NOVITA SARI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan
pada
Departemen Budidaya Perairan
BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
2015
Judul Skripsi : Sintasan dan Pertumbuhan Larva Udang Vaname yang Diberi Probiotik Pseudoalteromonas 1UB dengan Dosis Berbeda Melalui Artemia sp.
Nama : Dian Novita Sari
NIM : C14134005
Disetujui oleh
Dr Ir Widanarni, MSi Dr Munti Yuhana, SPi, MSi
Pembimbing I Pembimbing II
Diketahui oleh
Dr Ir Sukenda, MSc Ketua Departemen
PRAKATA
Segala puji bagi Allah SWT yang telah memberikan rahmat dan hidayah-Nya kepada penulis, sehingga penulis dapat menyelesaikan skripsi yang berjudul “Sintasan dan Pertumbuhan Larva Udang Vaname yang Diberi Probiotik
Pseudoalteromonas 1UB dengan Dosis Berbeda Melalui Artemia sp.”.
Penulis mengucapkan terima kasih kepada semua pihak yang telah
membantu dalam penyusunan skripsi ini. Penulis mengucapkan terima kasih kepada:
1. Dr Ir Widanarni, MSi dan Dr Munti Yuhana, SPi, MSi selaku dosen pembimbing skripsi yang telah memberikan saran dan dukungan dalam pelaksanaan penelitian dan penyusunan tugas akhir ini;
2. Dr Julie Ekasari, SPi, MSc selaku dosen penguji tamu dan komisi pendidikan departemen atas saran bagi perbaikan skripsi;
3. Seluruh dosen Departemen Budidaya Perairan yang telah memberikan ilmu dan bantuan selama masa perkuliahan;
4. Orang tua beserta keluarga yang selalu memberikan doa, kasih sayang, dan dukungannya.
5. Pak Ranta, Kak Dendi, Kak Yanti, Kak Haezy, Kak Rifki dan Kak Lukman yang telah banyak membantu pelaksanaan penelitian;
6. Teman-teman LKI BDP 48 atas bantuan, dukungan, dan kerjasamanya selama penelitian.
7. Teman-teman BDP 49 dan alih jenis BDP atas dukungan dan kebersamaannya, serta semua pihak yang telah memberikan bantuan. Semoga skripsi ini dapat bermanfaat dalam menambah ilmu dan informasi tentang kegiatan budidaya, khususnya bagi penulis, ilmu pengetahuan, masyarakat dan seluruh pihak yang membutuhkan. Terima kasih.
Bogor, Agustus 2015
DAFTAR
ISI
DAFTAR TABEL ix DAFTAR GAMBAR x DAFTAR LAMPIRAN x PENDAHULUAN 1 Latar Belakang 1 Tujuan Penelitian 2 METODE 2Waktu dan Tempat 2
Materi Uji 2
Penyiapan Probiotik 2
Penyiapan Artemia sp. 3
Pengujian Probiotik secara In Vivo 3
Persiapan Wadah dan Media Pemeliharaan 3
Persiapan Hewan Uji 3
Persiapan Bioenkapsulasi Artemia sp. 3
Pemeliharaan Hewan Uji 4
Rancangan Percobaan 4
Parameter Pengamatan 4
Sintasan 4
Laju Pertumbuhan Harian (LPH) 5
Pertumbuhan Panjang Mutlak 5
Penghitungan Kelimpahan Bakteri 5
Pengukuran Kualitas Air 5
Analisis Data 5
HASIL DAN PEMBAHASAN 6
Hasil 6
Sintasan 6
Laju Pertumbuhan Harian (LPH) 6
Pertumbuhan Panjang Mutlak 7
Kelimpahan Bakteri 8
Kualitas Air 8
Pembahasan 8
SIMPULAN DAN SARAN 10
Simpulan 10 Saran 10 DAFTAR PUSTAKA 11 LAMPIRAN 13 RIWAYAT HIDUP 16
DAFTAR TABEL
1 Total bakteri dan total Pseudoalteromonas 1UBR dalam tubuh larva udang vaname yang diberi probiotik Pseudoaltermonas 1UBR dosis
2 Hasil pengukuran kualitas air selama pemeliharaan larva udang vaname yang diberi probiotik Pseudoaltermonas 1UBR dosis berbeda melalui
bioenkapsulasi Artemia sp. 8
DAFTAR GAMBAR
1 Sintasan larva udang vaname yang diberi probiotik Pseudoaltermonas 1UBR dosis berbeda melalui bioenkapsulasi Artemia sp. pada akhir
perlakuan 6
2 Laju pertumbuhan harian (LPH) larva udang vaname yang diberi probiotik Pseudoaltermonas 1UBR dosis berbeda melalui
bioenkapsulasi Artemia sp. pada akhir perlakuan 7
3 Pertumbuhan panjang mutlak larva udang vaname yang diberi probiotik Pseudoaltermonas 1UBR dosis berbeda melalui
bioenkapsulasi Artemia sp. pada akhir perlakuan 7
DAFTAR LAMPIRAN
1 Pembuatan isolat bakteri Pseudoalteromonas 1UB mutan resisten
rifampisin 13
2 Skema aplikasi probiotik pada larva udang vaname (Litopenaeus
vannamei) pada masing-masing perlakuan 14
3 Penghitungan kelimpahan bakteri Pseudoalteromonas 1UBR hasil
kultur pada media SWC cair 14
4 Analisis statistik sintasan larva udang vaname yang diberi probiotik
Pseudoalteromonas 1UBR dosis berbeda melalui bioenkapsulasi
Artemia sp. pada akhir pemeliharaan 14
5 Analisis statistik laju pertumbuhan harian larva udang vaname yang diberi probiotik Pseudoalteromonas 1UBR dosis berbeda melalui
bioenkapsulasi Artemia sp. pada akhir pemeliharaan 15 6 Analisis statistik pertumbuhan panjang mutlak larva udang vaname
yang diberi probiotik Pseudoalteromonas 1UBR dosis berbeda
1
PENDAHULUAN
Latar Belakang
Udang vaname (Litopenaeus vannamei) merupakan udang hasil introduksi yang berasal dari Hawai, Amerika. Di Indonesia, udang vaname merupakan salah satu komoditas utama dalam sektor perikanan budidaya. Indonesia termasuk negara pengekspor udang, diantaranya ke Jepang, USA, Netherland, dan United Kingdom. Pada tahun 2012, Indonesia mengekspor udang sebanyak 111.100 ton dan pada tahun 2013 meningkat menjadi 120.500 ton (GLOBEFISH Highlights 2014). Tingkat produksi tersebut dapat dicapai dengan sistem budidaya intensif yang didukung oleh ketersediaan benur yang berkualitas unggul dan kuantitas tinggi. Namun, beberapa dekade terakhir, industri budidaya udang sedang menghadapi masalah infeksi bakteri dan virus yang serius sehingga menyebabkan kerugian ekonomis dan menghambat pengembangan industri udang di seluruh dunia (Zhang et al. 2012). Penyakit bakterial yang sering menginfeksi udang vaname adalah vibriosis, yang salah satunya disebabkan oleh bakteri Vibrio
harveyi (Phuoc et al. 2009). Penyakit tersebut dapat menyebabkan kematian pada
seluruh stadia udang, mulai dari stadia larva hingga udang dewasa, baik di
hatchery maupun di tambak udang (Saulnier et al. 2000). Penyakit viral yang
sering menginfeksi udang adalah WSSV (White Spot Syndrome Virus), TSV (Taura Syndrome Virus), YHV (Yellow Head Virus), IHHNV (Infectious
Hypodermal and Hematopoietic Necrosis Virus) (Flegel et al. 2008) dan IMNV
(Infectious Myonecrosis Virus) (Melo et al. 2014).
Antibiotik merupakan agen pengontrol bakteri yang telah banyak digunakan dalam akuakultur hampir selama 3 dekade. Penggunaan antibiotik mulai dikurangi karena memiliki dampak negatif terhadap konsumen dan lingkungan. Oleh sebab itu, banyak strategi yang mulai dikembangkan dan digunakan untuk menanggulangi serangan penyakit dan untuk menciptakan lingkungan industri yang ramah lingkungan. Imunostimulan, vaksin dan probiotik merupakan strategi yang baik dan efektif untuk mengontrol penyakit sehingga dapat membantu keberlanjutan akuakultur (Lazado dan Caipang 2014).
Probiotik merupakan bakteri hidup yang memberi pengaruh menguntungkan bagi manusia dan hewan (FAO/WHO 2006). Secara umum, bakteri probiotik untuk akuakultur diisolasi dari mikrobiota endogenus dan eksogenus hewan akuatik. Probiotik yang telah digunakan dalam akuakultur diantaranya
Lactobacillus, Carnobacterium, Vibrio, Roseobacter, Bacillus, Pseudomonas, Aeromonas, Saccharomyces, Enterococcus, Flavobacterium (Balcazar et al.
2006), Shewanella, Clostridium dan Brochochthrix (Nayak 2010). Beberapa penelitian tentang aplikasi probiotik ke udang menunjukkan hasil bahwa probiotik mampu meningkatkan ketahanan udang dan ikan terhadap infeksi penyakit dengan cara produksi zat inhibitor, kompetisi sumber energi, perebutan tempat pelekatan, meningkatkan respon imun, dan memperbaiki kualitas air (Verschuere et al. 2000).
Pada penelitian ini digunakan bakteri probiotik Pseudoalteromonas 1UB yang pada dosis 106 CFU/mL telah diuji efektif menghambat Vibrio harveyi dan meningkatkan sintasan pada larva udang windu (Widanarni et al. 2009). Aplikasi
2
probiotik Pseudoalteromonas 1UB melalui pakan buatan dengan perbandingan 3:1 (pakan:probiotik) juga dapat meningkatkan laju pertumbuhan udang windu sebesar 9,03% dan konversi pakan 1,35 (Widanarni et al. 2012).
Probiotik Pseudoalteromonas 1UB dalam tubuh larva udang dapat dimonitor dengan penggunaan penanda resisten antibiotik rifampisin. Penanda resisten antibiotik rifampisin efektif digunakan sebagai penanda untuk membedakan bakteri probiotik dengan bakteri lainnya yang secara alami telah terdapat pada larva udang (Widanarni 2004), sehingga bakteri probiotik
Pseudoalteromonas 1UB yang digunakan dalam penelitian ini diberi penanda
resisten rifampisin. Pemberian probiotik dilakukan melalui bioenkapsulasi
Artemia sp. selama 4 jam. Hal ini karena hasil penelitian Widanarni et al. (2008b)
menunjukkan bahwa pada 4 jam pertama, jumlah bakteri Vibrio SKT-b RfR pada
Artemia sp. terus meningkat dan akan mengalami penurunan sejak jam ke-5.
Pengetahuan dan informasi mengenai penggunaan probiotik Pseudoalteromonas 1UB ini, masih terbatas sehingga hal tersebut yang menjadi dasar dilakukannya penelitian ini.
Tujuan Penelitian
Penelitian ini bertujuan untuk menguji efektivitas pemberian probiotik
Pseudoalteromonas 1UB melalui bioenkapsulasi Artemia sp. terhadap sintasan
dan pertumbuhan pada larva udang vaname.
METODE
Waktu dan Tempat
Penelitian ini dilakukan pada bulan Februari-April 2015 di Laboratorium Kesehatan Ikan dan Laboratorium Lingkungan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Materi Uji Penyiapan Probiotik
Bakteri probiotik yang digunakan pada penelitian ini adalah bakteri
Pseudoalteromonas piscicida (1UB) (Widanarni et al. 2009). Bakteri yang
digunakan dibuat resisten terhadap antibiotik rifampisin sebagai penanda. Tahapan pembuatan bakteri resisten rifampisin dapat dilihat pada Lampiran 1. Bakteri probiotik Pseudoalteromonas 1UB resisten rifampisin disebut
Pseudoalteromonas 1UBR. Bakteri Pseudoalteromonas 1UBR dikultur pada media
Sea Water Complete (SWC) -agar miring dan diinkubasi pada suhu ruang selama
24 jam. Selanjutnya bakteri diinokulasikan ke media SWC cair dan diinkubasi di
3
Penyiapan Artemia sp.
Artemia sp. yang digunakan berbentuk siste dalam kemasan kaleng. Siste Artemia sp. ditetaskan dalam air laut 30 ppt sebanyak 2 g/L dan diberi aerasi kuat
selama 24 jam. Setelah itu naupli Artemia sp. dipanen dengan cara aerasi dimatikan dan ¾ bagian wadah penetasan Artemia sp. ditutup dengan plastik gelap. Kemudian didiamkan selama 20 menit hingga naupli Artemia sp. mendekati sumber cahaya. Siste yang tidak menetas akan mengendap di dasar wadah penetasan dan cangkang Artemia sp. akan mengapung. Naupli Artemia sp. kemudian dipanen dengan cara disifon menggunakan selang aerasi. Penetasan
Artemia sp. dilakukan setiap hari selama masa pemeliharaan larva stadia zoea 3
hingga panen (postlarva 11).
Pengujian Probiotik secara In Vivo Persiapan Wadah dan Media Pemeliharaan
Wadah yang digunakan dalam penelitian ini berupa toples kaca dengan volume 3 L sebanyak 12 buah. Toples tersebut dicuci terlebih dahulu dengan deterjen dan dibilas dengan air tawar hingga bersih lalu dikeringkan. Kemudian toples tersebut diisi air hingga penuh dan didesinfeksi dengan klorin 30 µ L/L selama 48 jam. Selanjutnya toples dibilas dengan air tawar hingga bersih. Air laut yang digunakan disimpan dalam wadah tandon lalu ditambahkan klorin 30 µ L/L untuk desinfeksi dan diaerasi kuat selama 48 jam. Toples yang telah didesinfeksi diisi air laut sebanyak 2 L dan diletakkan di dalam bak fiber ukuran 3 x 1 x 0,5 m3 yang telah diisi air tawar sebanyak 100 L. Kemudian pada bak fiber tersebut dipasang heater sebanyak 5 buah untuk menjaga suhu air dalam toples tetap stabil. Setiap toples diberi satu selang aerasi dan batu aerasi yang terhubung dengan instalasi aerasi untuk meningkatkan kadar oksigen terlarut dalam media pemeliharaan larva udang vaname.
Persiapan Hewan Uji
Hewan uji yang digunakan dalam penelitian ini adalah larva udang vaname (Litopenaeus vannamei). Larva udang yang digunakan berupa naupli 5 dengan bobot rata-rata 0,016±0,001 mg/ekor yang berasal dari PT. Biru Laut Khatulistiwa, Lampung. Larva tersebut dipelihara dalam media pemeliharaan dengan kepadatan awal 100 ekor/L hingga stadia mysis 1. Selama pemeliharaan, larva diberi pakan berupa Chaetoceros sp. sebanyak 105 sel/mL dan dilakukan pergantian air setiap 3 hari sekali sebanyak 5-10%.
Persiapan Bioenkapsulasi Artemia sp.
Pakan yang digunakan dalam penelitian ini adalah pakan alami berupa
Chaetoceros sp. dan Artemia sp.. Chaetoceros sp. diberikan pada stadia naupli 5
hingga zoea 3, sedangkan Artemia sp. diberikan pada stadia mysis 1 hingga PL 11. Pakan uji yang digunakan adalah Artemia sp. yang telah dibioenkapsulasi dengan probiotik Pseudoalteromonas 1UBR. Bioenkapsulasi Artemia sp. dengan probiotik Pseudoalteromonas 1UBR kepadatan 104 CFU/mL (perlakuan A), 106 CFU/mL (perlakuan B) dan 108 CFU/mL (perlakuan C) dilakukan dalam wadah terpisah. Bioenkapsulasi dilakukan selama 4 jam (Widanarni et al. 2008b) dan
4
kepadatan Artemia sp. pada masing-masing perlakuan adalah 100 individu/mL. Selanjutnya Artemia sp. dibilas dengan air laut steril. Stadia Artemia sp. yang digunakan adalah Artemia sp. yang berada pada stadia instar 1-2 (Touraki et al. 2012). Artemia sp. yang telah dibioenkapsulasi langsung diberikan ke larva udang dan selebihnya disimpan dalam lemari pendingin suhu 4 °C untuk digunakan selanjutnya pada hari yang sama.
Pemeliharaan Hewan Uji
Perlakuan pemberian probiotik melalui bioenkapsulasi Artemia sp. dimulai dari stadia mysis 1 hingga PL 11 dengan kepadatan awal 30 ekor/L. Sebelum diberi perlakuan, bobot dan panjang larva udang vaname pada stadia mysis 1 disampling dan digunakan sebagai data awal untuk parameter pertumbuhan. Selama pemeliharaan, larva diberi pakan Chaetoceros sp. dari stadia mysis 1 hingga mysis 2 sebanyak 105 sel/mL dengan frekuensi pemberian 6 kali dalam sehari dan mysis 3 hingga PL 11 sebanyak 1 kali dalam sehari. Pada stadia mysis 1 hingga mysis 3, Artemia sp. diberikan sebanyak 3-4 ekor/larva dan pada stadia PL 1 hingga PL 11 sebanyak 8-10 ekor/larva (Nimrat et al. 2011). Pakan diberikan setiap 4 jam sekali dengan frekuensi 6 kali dalam sehari pada pukul 02.00; 06.00; 10.00; 14.00; 18.00; dan 22.00 WIB. Selama pemeliharaan dilakukan pergantian air setiap 3 hari sekali sebanyak 5-10%. Skema aplikasi probiotik pada larva udang vaname dapat dilihat pada Lampiran 2.
Rancangan Percobaan
Aplikasi probiotik melalui bioenkapsulasi Artemia sp. menggunakan rancangan acak lengkap (RAL). Penelitian ini dilakukan dengan 4 perlakuan dengan masing-masing 3 ulangan, yaitu:
K : Kontrol (Larva udang diberi Artemia sp. tanpa bioenkapsulasi probiotik
Pseudoalteromonas 1UBR)
A : Larva udang diberi Artemia sp. dengan bioenkapsulasi probiotik
Pseudoalteromonas 1UBR 104 CFU/mL
B : Larva udang diberi Artemia sp. dengan bioenkapsulasi probiotik
Pseudoalteromonas 1UBR 106 CFU/mL
C : Larva udang diberi Artemia sp. dengan bioenkapsulasi probiotik
Pseudoalteromonas 1UBR 108 CFU/mL
Parameter Pengamatan Sintasan
Sintasan larva udang vaname dihitung pada akhir perlakuan. Sintasan dihitung dari stadia mysis 1 hingga PL 11 dengan rumus (Effendi 2012):
Keterangan:
SR : Survival Rate (sintasan) (%)
5
No : Jumlah udang pada awal pemeliharaan (ekor) Laju Pertumbuhan Harian (LPH)
Laju pertumbuhan harian atau laju pertumbuhan spesifik (Specific Growth
Rate/SGR) dihitung pada akhir perlakuan dengan rumus (Huissman 1987):
Keterangan:
LPH : Laju pertumbuhan harian (%)
Wt : Bobot rata-rata pada akhir perlakuan (mg) Wo : Bobot rata-rata pada awal perlakuan (mg) t : Periode pemeliharaan (hari)
Pertumbuhan Panjang Mutlak
Pertumbuhan panjang mutlak dihitung pada akhir perlakuan dengan rumus (Effendie 1997):
P (mm) = Pt – Po Keterangan:
P : Pertumbuhan panjang mutlak (mm)
Pt : Panjang rata-rata pada akhir perlakuan (mm) Po : Panjang rata-rata pada awal perlakuan (mm) Penghitungan Kelimpahan Bakteri
Penghitungan kelimpahan bakteri dilakukan pada stadia mysis 1 dan PL 11 dengan metode hitungan cawan. Pengamatan yang dilakukan meliputi Total
Viable Bacterial Count (TBC) dan total bakteri probiotik Pseudoalteromonas
1UBR. Media yang digunakan adalah agar untuk total bakteri dan SWC-agar + rifampisin 50 µg/mL untuk total Pseudoalteromonas 1UBR. Prosedur metode hitungan cawan dapat dilihat pada Lampiran 3. Kelimpahan bakteri dihitung dengan rumus (Madigan et al. 2003):
Total Bakteri = ∑ koloni x
Pengukuran Kualitas Air
Pengukuran kualitas air dilakukan setiap seminggu sekali selama pemeliharaan. Paramater kualitas air yang diukur selama pemeliharaan adalah DO, pH, suhu dan salinitas. Parameter DO, pH dan salinitas diukur seminggu sekali, sedangkan suhu media pemeliharaan diukur setiap hari.
Analisis Data
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL). Data yang diperoleh dianalisis menggunakan software Microsoft Excel 2007 dan SPSS versi 17.0, kemudian diuji lanjut menggunakan uji Duncan.
6
HASIL DAN PEMBAHASAN
Hasil Sintasan
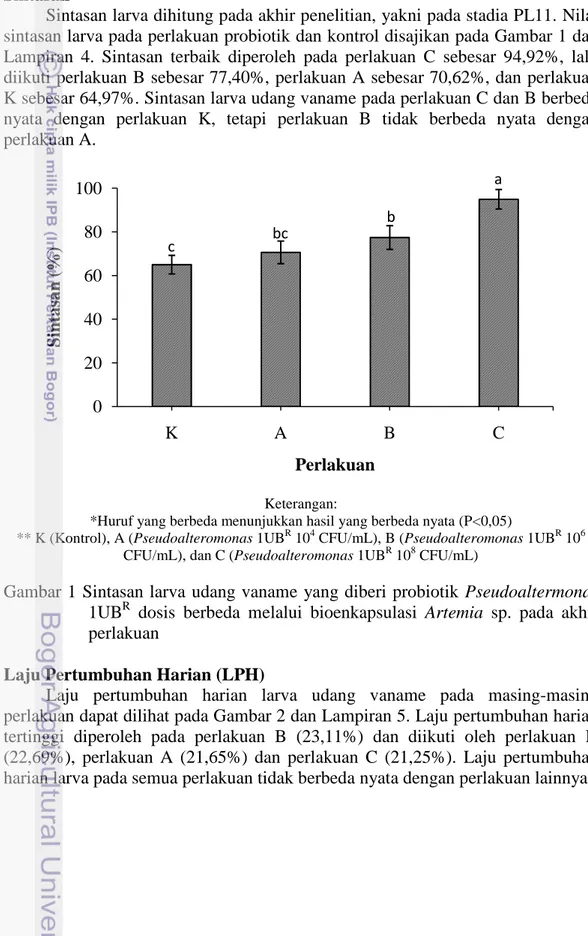
Sintasan larva dihitung pada akhir penelitian, yakni pada stadia PL11. Nilai sintasan larva pada perlakuan probiotik dan kontrol disajikan pada Gambar 1 dan Lampiran 4. Sintasan terbaik diperoleh pada perlakuan C sebesar 94,92%, lalu diikuti perlakuan B sebesar 77,40%, perlakuan A sebesar 70,62%, dan perlakuan K sebesar 64,97%. Sintasan larva udang vaname pada perlakuan C dan B berbeda nyata dengan perlakuan K, tetapi perlakuan B tidak berbeda nyata dengan perlakuan A.
Keterangan:
*Huruf yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05)
** K (Kontrol), A (Pseudoalteromonas 1UBR 104 CFU/mL), B (Pseudoalteromonas 1UBR 106
CFU/mL), dan C (Pseudoalteromonas 1UBR 108 CFU/mL)
Gambar 1 Sintasan larva udang vaname yang diberi probiotik Pseudoaltermonas 1UBR dosis berbeda melalui bioenkapsulasi Artemia sp. pada akhir perlakuan
Laju Pertumbuhan Harian (LPH)
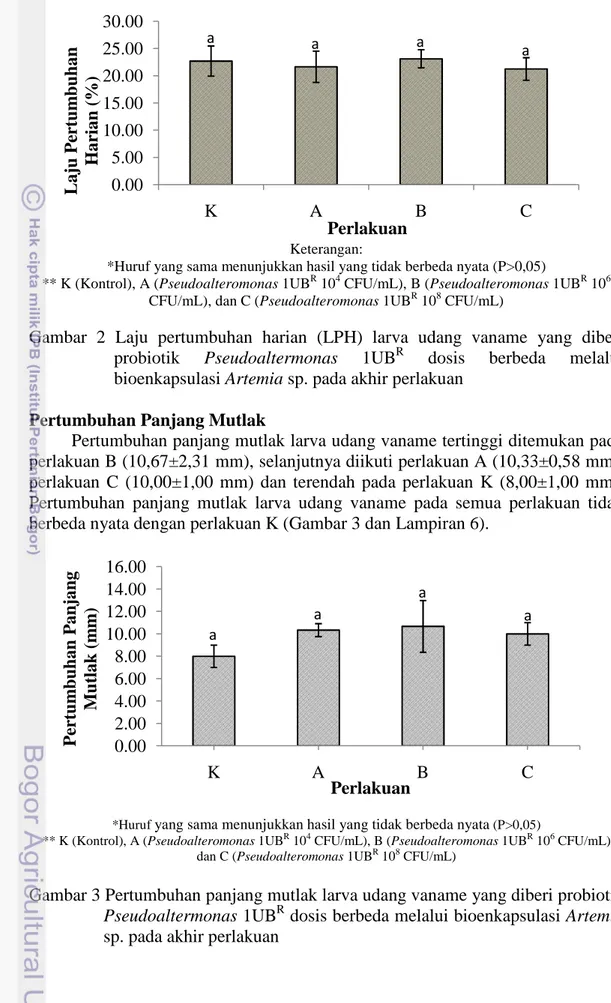
Laju pertumbuhan harian larva udang vaname pada masing-masing perlakuan dapat dilihat pada Gambar 2 dan Lampiran 5. Laju pertumbuhan harian tertinggi diperoleh pada perlakuan B (23,11%) dan diikuti oleh perlakuan K (22,69%), perlakuan A (21,65%) dan perlakuan C (21,25%). Laju pertumbuhan harian larva pada semua perlakuan tidak berbeda nyata dengan perlakuan lainnya.
0 20 40 60 80 100 K A B C S in tas an ( % ) Perlakuan c bc b a
7
Keterangan:
*Huruf yang sama menunjukkan hasil yang tidak berbeda nyata (P>0,05)
** K (Kontrol), A (Pseudoalteromonas 1UBR 104 CFU/mL), B (Pseudoalteromonas 1UBR 106
CFU/mL), dan C (Pseudoalteromonas 1UBR 108 CFU/mL)
Gambar 2 Laju pertumbuhan harian (LPH) larva udang vaname yang diberi probiotik Pseudoaltermonas 1UBR dosis berbeda melalui bioenkapsulasi Artemia sp. pada akhir perlakuan
Pertumbuhan Panjang Mutlak
Pertumbuhan panjang mutlak larva udang vaname tertinggi ditemukan pada perlakuan B (10,67±2,31 mm), selanjutnya diikuti perlakuan A (10,33±0,58 mm), perlakuan C (10,00±1,00 mm) dan terendah pada perlakuan K (8,00±1,00 mm). Pertumbuhan panjang mutlak larva udang vaname pada semua perlakuan tidak berbeda nyata dengan perlakuan K (Gambar 3 dan Lampiran 6).
*Huruf yang sama menunjukkan hasil yang tidak berbeda nyata (P>0,05)
** K (Kontrol), A (Pseudoalteromonas 1UBR 104 CFU/mL), B (Pseudoalteromonas 1UBR 106 CFU/mL),
dan C (Pseudoalteromonas 1UBR 108 CFU/mL)
Gambar 3 Pertumbuhan panjang mutlak larva udang vaname yang diberi probiotik
Pseudoaltermonas 1UBR dosis berbeda melalui bioenkapsulasi Artemia sp. pada akhir perlakuan
0.00 5.00 10.00 15.00 20.00 25.00 30.00 K A B C L aj u P er tu m b u h an H ar ian ( % ) Perlakuan a a a a 0.00 2.00 4.00 6.00 8.00 10.00 12.00 14.00 16.00 K A B C P er tu m b u h an P an jan g M u tl ak ( m m ) Perlakuan a a a a
8
Kelimpahan Bakteri
Jumlah total bakteri pada larva udang vaname di awal perlakuan relatif sama, yakni dengan kepadatan 3,50-9,60 x 104 CFU/larva. Pada akhir pemeliharaan (PL11), total bakteri pada semua perlakuan mengalami peningkatan dan jumlah total bakteri tertinggi ditemukan pada perlakuan C, yakni 4,00 x 106 CFU/larva, sedangkan perlakuan lainnya relatif sama. Total bakteri
Pseudoalteromonas 1UBR pada akhir pemeliharaan ditemukan pada perlakuan A, B, dan C. Pada akhir pemeliharaan, jumlah bakteri Pseudoalteromonas 1UBR tertinggi ditemukan pada perlakuan B (2,27 x 105 CFU/larva). Data total bakteri dan total Pseudoalteromonas 1UBR ditampilkan pada Tabel 1.
Tabel 1 Total bakteri dan total Pseudoalteromonas 1UBR dalam tubuh larva udang vaname yang diberi probiotik Pseudoaltermonas 1UBR dosis berbeda melalui bioenkapsulasi Artemia sp. selama perlakuan
Perlakuan
TBC (CFU/larva) Total Pseudoalteromonas 1UB
R (CFU/larva) M1 (CFU/Larva) PL11 (CFU/Larva) M1 (CFU/Larva) PL11 (CFU/Larva) K 9,60 x 104 2,48 x 105 0 0 A 8,00 x 104 7,68 x 105 0 4,00 x 102 B 3,50 x 104 9,50 x 105 0 2,27 x 105 C 7,40 x 104 4,00 x 106 0 4,92 x 104 Kualitas Air
Parameter kualitas air yang diamati dalam penelitian ini yaitu suhu, salinitas, pH dan DO. Kisaran nilai kualitas air di semua perlakuan disajikan pada Tabel 2.
Tabel 2 Hasil pengukuran kualitas air selama pemeliharaan larva udang vaname yang diberi probiotik Pseudoaltermonas 1UBR dosis berbeda melalui bioenkapsulasi Artemia sp.
Parameter Perlakuan SNI-7311-2009
K A B C Suhu (°C) 28-33 28-33 28-33 28-33 29-32 Salinitas (ppt) 29-33 29-32 29-33 29-33 29-34 pH (Unit) 8,22-8,32 8,22-8,32 8,13-8,22 8,21-8,31 7,50-8,50 DO (mg/L) 6,0-8,3 6,0-8,4 6,0-8,2 6,0-8,5 ≥5 Pembahasan
Sintasan merupakan jumlah ikan yang hidup setelah dipelihara beberapa waktu dibandingkan dengan jumlah ikan pada awal pemeliharaan yang dinyatakan dalam persen (%) (Effendi 2012). Berdasarkan hasil pengamatan selama pemeliharaan, diketahui bahwa sintasan tertinggi dihasilkan pada perlakuan C (94,92%), kemudian diikuti perlakuan B (77,4%), A (70,62%) dan K (64,97%). Sintasan larva udang vaname pada perlakuan C dan B berbeda nyata terhadap perlakuan K (P<0,05). Peningkatan sintasan pada perlakuan C dan B masing-masing mencapai 46,10% dan 19,13% dibanding kontrol. Nilai sintasan yang tinggi pada perlakuan B dan C diduga karena probiotik Pseudoalteromonas 1UBR
9
dapat meningkatkan kebugaran larva udang vaname. Hal ini sesuai dengan pendapat Widanarni et al. (2008a) yang menyatakan bahwa isolat probiotik 1UB dapat mempengaruhi kebugaran larva udang windu. Sintasan yang tinggi juga diduga disebabkan oleh kemampuan probiotik untuk merangsang respon imun non spesifik pada udang. Lakshmi et al. (2013) menyatakan bahwa probiotik
Lactobacillus plantarum dapat meningkatkan respon imun humoral dan selular
pada udang dengan meningkatkan aktivitas phenoloxidase (PO), aktivitas aglutinasi, aktivitas prophenoloxidase (ProPO), respiratory burst, superoxide
dismutase (SOD) dan transkripsi peroxinectin mRNA. Hasil penelitian ini juga
sesuai dengan penelitian Nimrat et al. (2011) yang menunjukkan bahwa penambahan probiotik Bacillus sp. secara nyata dapat meningkatkan sintasan postlarva udang vaname. Sintasan larva udang vaname yang dipelihara tanpa perlakuan dari stadia mysis 1 hingga PL 1 sebesar 69,02% (Panjaitan 2012) dan PL 1 hingga PL 12 sebesar 75,47 % (Nimrat et al. 2011). Dari hasil tersebut diduga bahwa kematian yang terjadi dalam penelitian ini masih normal dan juga diduga terjadi akibat masih adanya sifat kanibalisme dan kegagalan dalam pergantian kulit selama pemeliharaan.
Pertumbuhan merupakan pertambahan ukuran panjang atau berat dalam suatu waktu (Effendie 2002). Laju pertumbuhan harian larva udang vaname yang diperoleh berkisar 21,25%-23,11% (Gambar 2) dan tidak berbeda antar perlakuan. Pertumbuhan panjang mutlak larva udang vaname juga tidak berbeda antar perlakuan dengan nilai berkisar 8,00-10,67 mm (Gambar 3). Pertumbuhan larva udang vaname yang tidak berbeda nyata diduga karena pada perlakuan B dan C mengalami kekurangan pakan (under feeding) akibat kepadatannya yang lebih tinggi. Du et al. (2006) menyatakan bahwa pemberian pakan yang kurang pada juvenil ikan grass carp (Ctenopharyngodon idella) akan menyebabkan laju pertumbuhan yang lebih lambat. Hal tersebut terjadi karena pemberian pakan yang lebih rendah dari kebutuhannya akan menyebabkan ikan menggunakan energi cadangannya untuk memenuhi kebutuhan energi basal sehingga energi untuk pertumbuhan tidak terpenuhi. Dari hasil penelitian juga diketahui bahwa peningkatan sintasan yang signifikan pada perlakuan B dan C tidak menurunkan laju pertumbuhan harian dan pertumbuhan panjang mutlak larva udang vaname.
Hal ini diduga karena probiotik Pseudoalteromonas 1UBR dapat memberikan kontribusi enzim pencernaan sehingga aktivitas pencernaan dan penyerapan nutrisi menjadi lebih baik serta dapat memacu pertumbuhan larva udang. Probiotik Pseudoalteromonas 1UB yang teridentifikasi sebagai bakteri
Pseudoalteromonas piscicida dengan tingkat kemiripan 98% (Widanarni et al.
2008a) mampu menghasilkan enzim amilase dan lipase (El-Naggar et al. 2014) sehingga dapat meningkatkan kecernaan pakan. Hao et al. (2014) juga menunjukkan hasil bahwa penambahan probiotik Shewanella haliotis tidak memberikan pengaruh nyata terhadap laju pertumbuhan udang vaname. Namun, hasil penelitian Daniels et al. (2010) menunjukkan bahwa penambahan probiotik
Bacillus sp. dapat meningkatkan pertumbuhan larva lobster (Homarus gammarus). Pengaruh bakteri probiotik terhadap pertumbuhan diduga karena
adanya pemanjangan mikrofili di usus sehingga memperluas tempat penyerapan nutrisi (Merrifield et al. 2010) dan adanya aktivitas pengontrolan keseimbangan mikroba dalam saluran penceranaan, peningkatan penyerapan nutrien pakan, serta perbaikan nilai nutrisi pakan (Widanarni et al. 2013).
10
Hasil perhitungan total bakteri (TBC) pada larva udang vaname menunjukkan bahwa pada akhir pemeliharaan (PL11), total bakteri pada semua perlakuan mengalami peningkatan. Jumlah total bakteri tertinggi ditemukan pada perlakuan C, yakni 4,00 x 106 CFU/larva, sedangkan perlakuan lainnya relatif sama. Peningkatan juga terjadi pada total Pseudoalteromonas 1UBR di akhir pemeliharaan. Total Pseudoalteromonas 1UBR tertinggi ditemukan pada perlakuan B, yakni 2,27 x 105 CFU/larva. Hal tersebut diduga karena larva pada perlakuan C yang memiliki kepadatan lebih tinggi mengalami kekurangan pakan (under feeding) sehingga jumlah Artemia sp. yang dapat dikonsumsi menjadi lebih rendah. Kepadatan yang lebih tinggi akan menyebabkan tingkat persaingan pakan menjadi lebih tinggi sehingga peluang larva untuk mendapatkan pakan yang mengandung probiotik menjadi lebih rendah dibandingkan perlakuan B. Darmawangsa (2008) menyatakan bahwa tingkat kepadatan yang tinggi dapat mempengaruhi ruang gerak sehingga akan meningkatkan kompetisi pakan dan pada akhirnya akan menurunkan nafsu makan. Selain itu, Widanarni et al. (2010) menyatakan bahwa penambahan probiotik dengan dosis lebih tinggi tidak selalu diiringi dengan peningkatan total probiotik di dalam tubuh larva. Hal tersebut terjadi karena tidak semua bakteri probiotik yang ditambahkan ke media dapat diambil oleh larva. Seleksi alam dan kompetisi dengan bakteri lain di dalam tubuh larva serta adanya kematian atau bakteri probiotik terlepas kembali ke media pemeliharaan juga diduga menjadi faktor yang mempengaruhi total bakteri di dalam tubuh (Widanarni et al. 2010). Hal tersebut juga diduga terjadi selama proses bioenkapsulasi Artemia sp. sehingga jumlah probiotik yang masuk ke
Artemia sp. tidak sesuai dengan dosis perlakuan yang diberikan.
Kualitas air selama masa pemeliharaan (Tabel 2) di semua perlakuan masih berada dalam kisaran optimal untuk sintasan dan pertumbuhan larva udang vaname (SNI-7311-2009). Dari hasil tersebut diasumsikan bahwa perubahan sintasan dan laju pertumbuhan harian larva udang vaname tidak disebabkan oleh kualitas air.
SIMPULAN DAN SARAN
Simpulan
Pemberian probiotik Pseudoalteromonas 1UBR melalui bioenkapsulasi
Artemia sp. dapat meningkatkan sintasan larva udang vaname. Aplikasi probiotik Pseudoalteromonas 1UBR 108 CFU/mL melalui bioenkapsulasi Artemia sp. memberikan hasil terbaik, tetapi tidak memberikan pengaruh nyata terhadap laju pertumbuhan harian.
Saran
Berdasarkan hasil penelitian ini, maka untuk penelitian berikutnya dapat disarankan agar jumlah pakan yang diberikan perlu disesuaikan dengan kebutuhan larva udang vaname, dan perlunya penelitian lebih lanjut untuk mengetahui
11
pengaruh probiotik Pseudoalteromonas 1UB pada skala yang lebih besar (semi lapang).
DAFTAR PUSTAKA
Balcazar JL, De Blas I, Zarzuela IR, Cunningham D, Vendrell D, Muzquiz JL. 2006. The role of probiotics in aquaculture. Veterinary Microbiology. 114: 173-186.
Daniels CL, Merrifield DL, Boothroyd DP, Davies SJ, Factor JR, Arnold KE. 2010. Effect of dietary Bacillus spp. and mannan oligosaccharides (MOS) on European lobster Homarus gammarus L. larvae growth performance, gut morphology and gut microbiota. Aquaculture. 304: 49-57.
Darmawangsa GM. 2008. Pengaruh Padat Penebaran 10, 15, dan 20 Ekor/L terhadap Kelangsungan Hidup dan Pertumbuhan Benih Ikan Gurami
Osphronemus goramy Lac. Ukuran 2 CM [skripsi]. Bogor (ID): Institut
Pertanian Bogor.
Du Z, Liu Y, Tian L, He J, Cao J, Liang G. 2006. The influence of feeding rate on growth, feed efficiency and body composition of juvenile grass carp
Ctenopharyngodon idella. Aquaculture International. 14:247-257.
Effendi I. 2012. Pengantar Akuakultur. Edisi ke-3. Jakarta (ID): Penebar Swadaya.
Effendie MI. 1997. Biologi Perikanan. Yogyakarta (ID): Yayasan Pustaka Nusantara.
Effendie MI. 2002. Biologi Perikanan. Edisi ke-2. Yogyakarta (ID): Yayasan Pustakan Nusantara.
El-Naggar MM, Abdul-Raouf UM, Ibrahim HAH, El-Sayed WMM. 2014. Saccharification of Ulva lactuca via Pseudoalteromonas piscicida for biofuel production. Journal of Energy and Natural Resousces. 3(6): 77-84. [FAO/WHO] Food and Agriculture Organization/World Health Organization.
2006. Probiotics in food, health and nutritional properties and guidelines for evaluation. FAO Food and Nutrition Paper 85. ISSN 0254-4725.
Flegel TW, Lightner DV, Lo CF, Owens L. 2008. Shrimp disease control: past, present, and future. Di dalam: Bondad-Reantaso MG, Mohan CV, Crumlish M, Subasinghe RP (editor). Diseases in Asian Aquaculture V1. Fish Health Section, Asian Fisheries Society, Filipina (PH): Manila.
GLOBEFISH Highlights. 2014. A quarterly update on world seafood markets: full year 2013 statistics. FAO/GLOBEFISH Highlights. 2014(2): 64.
Hao K, Liu JY, Ling F, Liu XL, Lu L, Xia L, Wang GX. 2014. Effect of dietary administration of Shewanella haliotis D4, Bacillus cereus D7, and
Aeromonas bivalvium D15, single or combined, on the growth, innate
immunity and disease resistance of shrimp, Litopenaeus vannamei.
Aquaculture. 428-429: 141-149.
Huissman EA. 1987. The Principles of Fish Culture Production. Netherland (NL): Wageningen University.
Lakshmi B, Viswanath B, Gopal DVRS. 2013. Probiotics as antiviral agents in shrimp aquaculture. Journal of Phatogens. 2013: 1-13.
12
Lazado CC dan Caipang CMA. 2014. Mucosal immunity and probiotics in fish.
Fish & Shellfish Immunology. 39: 78-89.
Madigan MT, Martinko JM, Parker J. 2003. Brock Biology of Microorganisms. Tenth edition. USA (US). Prentice-Hall Inc.
Melo MVC, Guedes MIF, Málaga SR, de Almeida LM, Moreira MDF, de Olivera TR. 2014. Molecular characterization of Infectious Myonecrosis Virus (IMNV) isolated from the shrimp Litopenaeus vannamei farmed in Ceará State, Brazil. Latin American Journal of Aquatic Research. 42(3): 649-652. Merrifield DL, Harper GM, Dimitroglou A, Ringo E, Davies SJ. 2010. Possible
influence of probiotic adhesion to intestinal mucosa on the activity and morphology of rainbow trout Oncorhynchus mykiss enterocytes.
Aquaculture Research. 41: 1268-1272.
Nayak. SK. 2010. Probiotics and immunity: a fish perspective. Fish & Shellfish
Immunology. 29: 2-14.
Nimrat S, Boonthai T, Vuthiphandchai V. 2011. Effects of probiotic forms, compositions of and mode of probiotic administration on rearing of Pacific white shrimp Litopenaeus vannamei larvae and postlarvae. Animal Feed
Science and Technology. 169:244-258.
Panjaitan AS. 2012. Pemeliharaan larva udang vaname Litopenaeus vannamei, Boone 1931 dengan pemberian jenis fitoplankton yang berbeda [tesis]. Jakarta (ID): Universitas Terbuka.
Phuoc LH, Corteel M, Thanh NC, Nauwynck H, Pensaert M, Sanz VA, den Broeck WV, Sorgeloos P, Bossier P. 2009. Effect of dose and challenge routes of Vibrio spp. on co-infection with White Spot Syndrome Virus in
Penaeus vannamei. Aquaculture. 290:61-68.
Saulnier D, Haffner P, Goarant C, Levy P, Ansquer D. 2000. Experimental infection models for shrimp vibriosis studies: A Review. Aquaculture. 191: 133-144.
[SNI] Standar Nasional Indonesia. 2009. Produksi benih udang vaname
Litopenaues vannamei kelas benih sebar. Jakarta (ID): Badan Standarisasi
Nasional.
Touraki M, Karamanlidou G, Karavida P, Chrysi K. 2012. Evaluation of the probiotics Bacillus subtilis and Lactobacillus plantarum bioencapsulated in
Artemia sp. nauplii against vibriosis in European sea bass larvae Dicentracrchus labrax L.. World Journal Microbiol Biotechnol. 28:
2425-2433.
Verschuere L, Rombaut G, Sorgeloos P, Verstraete W. 2000. Probiotic bacteria as biological control agents in aquaculture. Microbiology and Molecular
Biology Reviews. 64(4): 655-671.
Widanarni, Ayuzar E, Sukenda. 2008a. Mekanisme penghambatan bakteri probiotik terhadap pertumbuhan Vibrio harveyi pada larva udang windu
Penaeus monodon. Jurnal Akuakultur Indonesia. 7(2): 179-188.
Widanarni, Elly, Soelistyowati DT, Suwanto A. 2008b. Pemberian bakteri probiotik Vibrio SKT-b pada larva udang windu melalui bioenkapsulasi
Artemia. Jurnal Akuakultur Indonesia. 7(2): 129-137.
Widanarni, Hadiroseyani Y, Susanti A. 2013. Pengaruh pemberian probiotik
13
pascalarva udang windu Penaeus monodon. Jurnal Akuakultur Indonesia. 12(1): 86-93.
Widanarni, Lidaeni MA, Wahjuningrum D. 2010. Pengaruh pemberian bakteri probiotik Vibrio SKT-b dengan dosis yang berbeda terhadap kelangsungan hidup dan pertumbuhan larva udang windu Penaeus monodon Fab. Jurnal
Akuakultur Indonesia. 9(1): 21-29.
Widanarni, Tepu I, Sukenda, Setiawati M. 2009. Seleksi bakteri probiotik untuk biokontrol vibriosis pada larva udang windu, Penaeus monodon menggunakan cara kultur bersama. Jurnal Riset Akuakultur. 4(1): 95-105. Widanarni, Wahjuningrum D, Puspita F. 2012. Aplikasi bakteri probiotik melalui
pakan buatan untuk meningkatkan kinerja pertumbuhan udang windu
Penaeus monodon. Jurnal Sains Terapan. 2(1): 32-49.
Widanarni. 2004. Penapisan bakteri probiotik untuk biokontrol vibriosis pada larva udang windu: konstruksi penanda molekuler dan esei pelekatan [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Zhang J, Liu Y, Tian L, Yang H, Liang G, Xu D. 2012. Effect of dietary mannan oligosaccharide on growth performance gut morphology and stress tolerance of juvenile pasicific white shrimp, Litopenaeus vannamei. Fish and Shellfish
Immunology. 30:1-6.
LAMPIRAN
Lampiran 1 Pembuatan isolat bakteri Pseudoalteromonas 1UB mutan resisten rifampisin
Bakteri 1UB dibuat resisten rifampisin dengan cara:
1. Biakan cair bakteri Pseudoalteromonas 1UB diambil sebanyak 1 mL dan disentrifuse dengan kecepatan 3000 rpm selama 5 menit.
2. Supernatan dibuang dan ditambahkan PBS sebanyak supernatan yang dibuang (1 mL) kemudian divorteks.
3. Suspensi bakteri tersebut disentrifuse kembali dengan kecepatan 3000 rpm selama 5 menit dan supernatan dibuang serta ditambahkan PBS sebanyak 1 mL.
4. Sebanyak 50 µl suspensi bakteri Pseudoalteromonas 1UB disebar secara merata pada permukaan media Sea Water Complete (SWC) yang telah mengandung antibiotik rifampisin dosis 50 µg/mL.
5. Sebanyak 50 µl suspensi bakteri Pseudoalteromonas 1UB hasil pengenceran serial 105 dan 106 disebar secara merata pada permukaan media agar yang tidak mengandung antibiotik.
6. Kemudian bakteri diinkubasi dalam inkubator pada suhu ruang selama 24 jam.
7. Koloni bakteri yang tumbuh pada media SWC yang mengandung rifampisin merupakan koloni bakteri yang resisten antibiotik rifampisin.
8. Koloni bakteri yang telah resisten diambil sebanyak 1 ose dan dipindahkan ke agar miring sebagai stok inokulan.
14
Lampiran 2 Skema aplikasi probiotik pada larva udang vaname (Litopenaeus
vannamei) pada masing-masing perlakuan
Lampiran 3 Penghitungan kelimpahan bakteri Pseudoalteromonas 1UBR hasil kultur pada media SWC cair
Sebanyak 0,1 mL bakteri Pseudoalteromonas 1UB dihomogenisasi dalam 0,9 mL Phosphate Buffer Saline (PBS) steril. Suspensi bakteri
Pseudoalteromonas 1UB diencerkan dengan metode pengenceran serial.
Sebanyak 0,1 mL suspensi bakteri Pseudoalteromonas 1UB diambil secara aseptik lalu dimasukkan ke eppendorf yang berisi 0,9 mL PBS pertama (10-1) dan dihomogenkan. Selanjutnya dari eppendorf pertama diambil 0,1 mL suspensi bakteri secara aseptik dan dimasukkan ke eppondorf kedua yang berisi 0,9 mL PBS (10-2) dan seterusnya untuk eppendorf selanjutnya. Kemudian sebanyak 50 µ L suspensi bakteri diambil dan disebar pada cawan petri yang berisi media agar dan diberi label sesuai dengan besar pengenceran sampel. Setelah itu diinkubasi selama 24 jam dan jumlah koloni yang tumbuh dihitung. Syarat penghitungan koloni bakteri adalah koloni yang tumbuh sebanyak 30-300 koloni.
Lampiran 4 Analisis statistik sintasan larva udang vaname yang diberi probiotik
Pseudoalteromonas 1UBR dosis berbeda melalui bioenkapsulasi
Artemia sp. pada akhir pemeliharaan
ANOVA
Sum of Squares Df Mean Square F Sig.
Between Groups 1519.539 3 506.513 21.381 .000
Within Groups 189.518 8 23.690
Total 1709.057 11
15
Uji Duncan
Perlakuan N Subset for alpha = 0.05
1 2 3
Duncana K 3 64.9733
B 3 77.4033
C 3 94.9167
Sig. .193 .126 1.000
Means for groups in homogeneous subsets are displayed
Lampiran 5 Analisis statistik laju pertumbuhan harian larva udang vaname yang diberi probiotik Pseudoalteromonas 1UBR dosis berbeda melalui bioenkapsulasi Artemia sp. pada akhir pemeliharaan
ANOVA
Sum of Squares Df Mean Square F Sig.
Between Groups 6.775 3 2.258 .393 .762
Within Groups 49.994 8 5.749
Total 52.769 11
Lampiran 6 Analisis statistik pertumbuhan panjang mutlak larva udang vaname yang diberi probiotik Pseudoalteromonas 1UBR dosis berbeda melalui bioenkapsulasi Artemia sp. pada akhir pemeliharaan
ANOVA
Sum of Squares Df Mean Square F Sig.
Between Groups 12.917 3 4.306 2.246 .160
Within Groups 15.333 8 1.917
16
RIWAYAT HIDUP
Penulis dilahirkan di Laloasa, Kabupaten Kepulauan Selayar, pada tanggal 19 September 1992 dari ayah yang bernama Mustari (Alm) dan ibu yang bernama Hj. Satu Alang. Penulis merupakan anak keempat dari empat bersaudara. Penulis menempuh pendidikan di SMA Negeri 1 Benteng dan lulus pada tahun 2010. Selama mengenyam pendidikan di sekolah menengah atas, penulis pernah mewakili Kab. Kep. Selayar dalam ajang OSN (Olimpiade Sains Nasional) tingkat Sulawesi Selatan dalam bidang Ilmu Ekonomi dan meraih juara 1 dalam ajang PORDA Sul-Sel XIV tahun 2010 cabang olahraga Sepaktakraw. Setelah lulus SMA, penulis melanjutkan pendidikan di tingkat perguruan tinggi dan diterima di Program Diploma III Institut Pertanian Bogor pada Program Keahlian Teknologi Produksi dan Manajemen Perikanan Budidaya melalui jalur Undangan Seleksi Masuk IPB (USMI). Tahun 2013, penulis melanjutkan studi ke jenjang Strata 1 IPB melalui jalur tes Alih Jenis di Program Studi Teknologi dan Manajemen Perikanan Budidaya, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan.
Selama mengenyam pendidikan di Program Diploma, penulis pernah meraih juara 3 cabang atletik (marathon) pada Olimpiade Mahasiswa IPB (OMI) tahun 2011. Pada tahun 2012, penulis meraih juara 1 cabang atletik (marathon) dan juara 2 cabang tenis lapangan dalam ajang Olimpiade Mahasiswa Diploma IPB (OMDI). Pada jenjang Strata 1, penulis pernah mengikuti BDP Cup dan meraih juara 1 cabang atletik (estafet), juara 1 cabang atletik (sprint), dan juara 1 cabang bulutangkis. Pada tahun yang sama penulis juga mengikuti Pekan Olahraga Fakultas Perikanan dan Ilmu Kelautan (PORIKAN) dan meraih juara 1 cabang atletik (marathon) dan juara 2 cabang atletik (sprint). Tahun 2015 penulis meraih juara 2 cabang atletik (sprint) dan juara 2 cabang futsal putri dalam ajang PORIKAN 2015 serta juara 3 cabang bulutangkis dalam ajang OMI 2015. Penulis juga aktif dalam kepanitian PORIKAN 2014 dan OMI 2014 pada divisi pertandingan, SPECTAQUA HILARITATE 2014 divisi keamanan dan AQUACULTURE FESTIVAL 2014 divisi acara. Penulis pernah menjadi asisten praktikum mata kuliah Penyakit Organisme Akuatik dan mata kuliah Manajemen Kesehatan Organisme Akuatik. Penulis juga pernah mendapatkan bantuan dana dari DIKTI untuk program PKM-P dengan judul “Demi Kau dan Si Buah Hati: Bioenkapsulasi Moina sp. untuk Meningkatkan Kelangsungan Hidup Larva Ikan Betok (Anabas testudineus)” pada tahun 2014.
Sebagai syarat untuk menyelesaikan studi dan mendapatkan gelar sarjana perikanan, penulis menyusun skripsi dengan judul “Sintasan dan Pertumbuhan Larva Udang Vaname Litopenaeus vannamei yang Diberi Probiotik Pseudoalteromonas 1UB dengan Dosis Berbeda melalui Artemia sp.”.