A.
LARUTAN PENYANGGA
B.
HIDROLISIS
LARUTAN PENYANGGA DAN HIDROLISIS
6
Pada bab sebelumnya, kita sudah mempelajari tentang reaksi asam-basa dan titrasi. Jika asam direaksikan dengan basa akan menghasilkan garam dan air, yang disebut reaksi penetralan. Garam adalah campuran antara asam de-ngan basa dan reaksinya disebut penetralan maka kita cenderung mengatakan bahwa garam bersifat netral. Jika garam bersifat netral, maka pH garam adalah 7, tetapi apakah semua demikian?
Perhatikan grafik titrasi asam – basa di bawah ini.
(Grafik titrasi antara 50 mL larutan CH3COOH 0,1 M dengan larutan NaOH 0,1 M)
10 20 30 40 50 60 70 80 90 100 10
9 8 7 6 5 4 3 2 1 11 12 13 14
Apakah yang dapat kamu simpulkan tentang grafik titrasi asam – basa di atas?
Dalam menjawab pertanyaan tersebut, marilah kita pelajari tentang larutan penyangga dan hidrolisis.
Sebelum kita pelajari lebih mendalam tentang larutan penyangga dan hidrolisis terlebih dahulu kita perhatikan peta konsep mengenai larutan penyangga dan hidrolisis.
Pete konsep kesetimbangan desosiasi
A. LARUTAN PENYANGGA
Tahukah kamu, bahwa buah-buahan dalam kaleng terdapat sistem penyangga? Sistem penyangga yang ada di sini adalah campuran antara Asam sitrat dan Natrium sitrat, yang berfungsi mempertahankan pH agar tidak mudah dirusak oleh bakteri. Apakah larutan penyangga itu?
1. Sifat Larutan Penyangga
Larutan penyangga (buffer) disebut juga larutan penahan atau larutan dapar. Disebut penyangga/penahan, karena larutan ini mempunyai sifat dapat menyangga/menahan pH larutan tersebut dari pengaruh penambahan sedikit asam, sedikit basa atau pengenceran. Artinya, bila ke dalam larutan buffer ditambahkan sedikit asam, sedikit basa atau air maka pH larutan tersebut tidak mengalami perubahan yang berarti (dianggap tetap).
KESETIMBANGAN
DISOSIASI
dibedakan terdapat pada
hidrolisis total larutan
penyangga asam
larutan penyangga
basa larutan
penyangga hidrolisis
hidrolisis parsial
hidrolisis anion hidrolisis
kation dibedakan
2. Pengertian Larutan Penyangga
Apa komposisi larutan ini, sehingga mampu mempertahankan harga pH-nya dari pengaruh zat-zat tersebut? Berdasarkan komponen penyusunnya, larutan buffer ini dibedakan menjadi dua.
a. Buffer Asam
Buffer asamadalah larutan yang berisi campuran antara asam lemah dengan basa konjugasinya.
Contoh: larutan yang berisi campuran
Ingat !
Antara asam dan basa konju-gasinya hanya ada selisih satu ion H+dalam rumus kimia-nya
asam lemah basa konjugasinya
Keterangan:
- basa konjugasi ini berasal dari garamnya (garam yang berasal dari asam tersebut dengan suatu basa kuat)
Contoh:
CH3COO- dapat berasal dari CH
3COONa, CH3COOK, (CH3COO)2Ba, (CH3COO)2Sr atau garam asetat lain yang basanya kuat. Atau dengan kata lain, buffer asam ini berisi campuran antara asam lemah dengan garamnya.
Contoh:
CH3COOH + CH3COONa CH3COOH + CH3COOK H3PO4+ NaH2PO4 NaH2PO4+ Na2HPO4
b. Buffer Basa
Buffer basa adalah larutan yang berisi campuran antara basa lemah dengan asam konjugasinya.
Contoh:
Larutan yang berisi campuran basa lemah NH3 dengan asam konjugasinya yaitu NH4+
CH3COO -HCO3 -H2PO4 -HC2O4 -+
Keterangan:
- NH3dalam air dapat ditulis NH3(aq)atau NH4OH(aq) - NH4+ini berasal dari garamnya (garam yang berasal dari NH
4dengan suatu asam kuat). Jadi NH4+ dapat berasal dari NH
4Cl, NH4NO3, (NH4)2SO4, dan sebagainya. Atau dapat dikatakan buffer basa berisi campuran antara basa lemah dengan garamnya.
Contoh:
NH4OH + NH4Cl NH4OH + (NH4)2SO4 NH4OH + NH4NO3
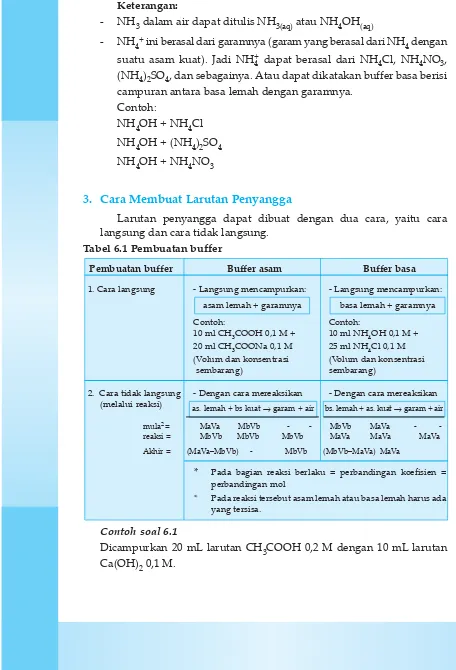
3. Cara Membuat Larutan Penyangga
Larutan penyangga dapat dibuat dengan dua cara, yaitu cara langsung dan cara tidak langsung.
Tabel 6.1 Pembuatan buffer
Contoh soal 6.1
Dicampurkan 20 mL larutan CH3COOH 0,2 M dengan 10 mL larutan Ca(OH)20,1 M.
Pembuatan buffer Buffer asam Buffer basa
1. Cara langsung - Langsung mencampurkan: - Langsung mencampurkan:
Contoh: Contoh:
10 ml CH3COOH 0,1 M + 10 ml NH4OH 0,1 M + 20 ml CH3COONa 0,1 M 25 ml NH4Cl 0,1 M (Volum dan konsentrasi (Volum dan konsentrasi
sembarang) sembarang)
2. Cara tidak langsung - Dengan cara mereaksikan - Dengan cara mereaksikan (melalui reaksi)
mula2 = MaVa MbVb - - MbVb MaVa
-reaksi = MbVb MbVb MbVb MaVa MaVa MaVa
Akhir = (MaVa–MbVb) - MbVb (MbVb–MaVa) MaVa
* Pada bagian reaksi berlaku = perbandingan koefisien = perbandingan mol
* Pada reaksi tersebut asam lemah atau basa lemah harus ada yang tersisa.
bs. lemah + as. kuat →garam + air as. lemah + bs kuat →garam + air
Pada akhir reaksi tentukan:
a. zat apa yang ada dalam campuran tersebut? b. apakah larutan tersebut termasuk sistem buffer? Jawab:
CH3COOH = asam asam ketemu basa maka harus direaksikan Ca(OH)2= basa (cara tidak langsung)
2CH3COOH + Ca(OH)2 ⎯→(CH3COO)2Ca + 2H2O
mula-mula = 20 . 0,2 = 4 mmol 10 . 0,1 mmol -
-bereaksi = 2 mmol 1 mmol 1 mmol 2 mmol
akhir = 2 mmol - 1 mmol 2 mmol
a. Setelah reaksi selesai, zat yang ada dalam larutan adalah: CH3COOH = 2 mmol
(CH3COO)2Ca = 1 mmol
H2O yang dihasilkan dari reaksi diabaikan, karena jumlahnya sa-ngat sedikit dan bergabung dengan H2O dari pelarut.
b. Ya, karena yang terakhir ada dalam larutan zatnya adalah campuran
CH3COOH (asam lemah) dengan (CH3COO)2Ca (garamnya)
Jadi merupakan pasangan buffer asam
Contoh soal 6.2
50 ml larutan NH4OH 0,1 M dicampur dengan 100 ml larutan HCl 0,1 M. Apakah campuran ini merupakan sistem buffer?
Jawab:
NH4OH + HCl ⎯→ NH4Cl + H2O
mula-mula = 5 mmol 10 mmol
-bereaksi = 5 mmol 5 mmol 5 mmol 5 mmol
akhir = 0 5 mmol 5 mmol ⇒ campuran
asam kuat dan garam
4. pH Larutan Penyangga
a. Buffer Asam (campuran asam lemah dengan garamnya)
Contoh: campuran CH3COOH + CH3COONa
- Dalam air, kedua senyawa tersebut mengalami ionisasi I. CH3COOH ← → H++ CH
3COO- (elektrolit lemah, α ≈ 0) II. CH3COONa →Na++ CH
3COO- (elektrolit kuat, α ≈ 1) - Pada reaksi I (asam lemah), mempunyai harga Ka:
- Dalam campuran ini, ion CH3COO-berasal dari 2 sumber, yaitu CH3COOH (asam) dan CH3COONa (garam)
[CH3COO-] = [CH
3COO-](asam) + [CH3COO-](garam)
Tetapi karena [CH3COO-](asam) jauh lebih kecil dibanding [CH3COO-](garam) maka [CH
3COO-](asam) diabaikan sehingga [CH3COO-] = [CH
3COO-](garam) = [CH3COONa] = [garam] - Bila [CH3COO-] = [asam] maka persamaan di atas dapat ditulis:
- Karena baik asam maupun garam berada dalam volum yang sama (yaitu volum campuran) maka volum asam = volum garam dan
atau
bila volum larutan bila volum larutan
dalam liter dalam mL
Bila garam mengikat basa konjugasi lebih dari satu, misal (CH3COO)2Sr maka garam ini akan terionisasi menjadi:
[H ] Ka. mmol asam
H Ka mol asam liter mol
+
+
=
= asam
garam/liter garam
(CH3COO)2Sr ⎯→Sr2++ 2CH
b. Buffer Basa
Contoh: Larutan yang berisi campuran NH4OH + NH4Cl. Dalam air, kedua larutan mengalami ionisasi
I. NH4OH ← Ν→ H4++ OH- (elektrolit lemah, α ≈ 0) II. NH4Cl →NH4++ Cl- (elektrolit kuat, α ≈ 1)
Pada reaksi I (basa lemah) mempunyai harga Kb
Dalam campuran, [NH4+] berasal dari NH
4OH (jumlahnya sangat kecil, diabaikan) dan dari NH4Cl.
Maka [NH4+] = [NH
4+] garam = konsentrasi garam NH4Cl = [garam] Bila [NH4OH] = konsentrasi basa = [basa] maka persamaan reaksi di
atas menjadi:
atau
Contoh soal 6.3
1. Berapakah pH campuran yang terbuat dari
a. 500 ml larutan CH3COOH 0,5 M + 200 ml larutan KOH 0,5 M
mula-mula = 250 mmol 100 mmol
reaksi = 100 mmol 100 mmol 100 mmol
akhir = 150 mmol 100 mmol (campuran asam lemah +garamnya)
b. NH4OH + HNO3 ⎯→ NH4NO3+ H2O mula-mula = 25 mmol 10 mmol
reaksi = 10 mmol 10 mmol 10 mmol
akhir = 15 mmol - 10 mmol (campuran
basa lemah + garamnya
c. 2NH4OH + H2SO4 ⎯→ (NH4)SO4+ 2H2O mula-mula = 20 mmol 5 mmol
reaksi = 10 mmol 5 mmol 5 mmol 10 mmol
akhir = 10 mmol - 5 mmol buffer basa
d. CH3COOH + CH3COONa →tidak bereaksi karena sudah merupakan 10 mmol dan 2,5 mmol pasangan buffer
2. Campuran HCOOH 0,5 M dengan HCOOK 0,4 M mempunyai pH = 4. Jika Ka HCOOH = 2 x 10-4, berapakah perbandingan volum HCOOH dan HCOOK?
Jawab: Misal:
Jadi, perbandingan volum HCOOH : volum HCOOK = 4 : 10 3. Tersedia larutan NH4OH 0,2 M sebanyak 50 ml. Untuk membuat
larutan penyangga dengan pH = 10. Berapakah volum HCl 1 M yang harus ditambahkan ke dalam larutan tersebut? Kb NH4OH = 10-5
Jawab:
- Terlebih dahulu perhatikan jenis zat-zat yang ada dalam campuran
- Karena yang ada dalam campuran NH4OH (basa) dan HCl (asam) maka asam basa tersebut harus direaksikan. Cantumkan yang diketahui
NH4OH + HCl ⎯→ NH4Cl + H2O
mula-mula = 10 mmol Va mmol
reaksi = Va mmol Va mmol Va mmol akhir = (10–Va) mmol 1 Va mmol
syarat buffer yang kuat harus habis (sebagai pereaksi pembatas) Kb = 10-5
volume asam dimisalkan = Va pH = 10 ⇒larutan bersifat basa pOH = 14 – 10 = 54
[OH-] = 10-4M
- Pada akhir reaksi, yang ada campuran NH4OH + NH4Cl (buffer basa) maka rumus yang dipakai
Jadi, larutan tersebut harus ditambah HCl 1 M sebanyak 0,9 ml.
[ ] .
.(
–
OH Kb asa
garam
Va Va
Va
−
−
=
= =
= ⇒
mmol b mmol
10 10 – Va) Va
Va = 0, 9 mL
-5
10
10 10
11 10
4
. .
,
Mg Vg Ma Va Vg
= =
=
. 0, 5 Va Va
Vg 2
0 4 2
5. Perbedaan Perubahan pH pada Larutan Penyangga dan
Nonpenyangga
Seperti telah dijelaskan di depan, bahwa sifat larutan penyangga adalah dapat mempertahankan harga pH dari pengaruh penambahan sedikit asam, sedikit basa, atau pengenceran
a. Penambahan sedikit asam
1) Penambahan sedikit asam pada larutan nonpenyangga
Misal: pada larutan NaCl 0,1 M sebanyak 50 ml, ditambahkan larutan HCl 0,1 M sebanyak 1 ml. Berapakah perubahan pH pada larutan bukan penyangga tersebut? (log 2 = 0,3)
- sebelum ditambahkan HCl, pH larutan NaCl = 7 (karena berasal dari asam kuat dan basa kuat maka bersifat netral) - setelah ditambah 1 ml HCl 0,1 M, pH larutan ini = pH
larut-an HCl
Jadi perubahan pH yang terjadi = 7 - 2,7 = 4,3 satuan.
2) Penambahan sedikit asam pada larutan penyangga
Bila 1 ml HCl 0,1 M tersebut ditambahkan pada larutan penyangga, misal pada larutan yang berisi campuran 25 ml larutan CH3COOH 0,1 M dengan 25 ml larutan CH3COONa 0,1 M. Ka CH3COOH = 10-5.
Berapakah perubahan pH pada larutan penyangga ini? - Sebelum ditambahkan HCl
- Sesudah ditambahkan HCl
ion H+ dari HCl ini bereaksi dengan ion CH
3COO- yang berasal dari CH3COONa
mula-mula = 2,5 mmol 0,1 mmol 2,5 mmol reaksi = 0,1 mmol 0,1 mmol 0,1 mmol
akhir = 2,4 mmol 0 2,6 mmol
(garam) (asam)
Jadi, perubahan pH yang terjadi = 5 – 4,965 = 0,00024 satuan
b. Penambahan sedikit basa
1) Pada larutan NaCl (nonpenyangga)
NaCl 0,1 M + NaOH 0,1 M⎯→pH = ...?
50 ml 1 ml
pH = 7
Setelah ditambah NaOH ada perubahan pH = 11,30 – 7 = 4,30 satuan
2) Pada larutan penyangga
CH3COOH 0,1 M + CH3COONa 0,1 M + NaOH 0,1 M→pH = ...?
25 ml (Ka = 10-5) 25 ml 1 ml
pH penyangga sebelum ditambahkan NaOH = 5
Pada penambahan NaOH, terjadi reaksi antara CH3COOH de-ngan OH-dari NaOH, menurut reaksi
Jadi, ada perubahan pH sebesar 0,0348 satuan
c. Pengenceran (penambahan air)
Ditinjau dari rumus penyangga
maka penambahan air tidak mempengaruhi besarnya [H+] atau [OH-]. Secara teoretis pH pun tidak berubah. Namun perlu juga diketahui bila penambahan air terlalu berlebihan (pada pengenceran 10 kali atau lebih) dapat menyebabkan garam yang ada terhidrolisis (ter-urai oleh air) sehingga menjadi berkurang dan sebaliknya asam atau basanya menjadi bertambah. Akibatnya pH-nya juga mengalami perubahan yang cukup besar.
Contoh 6.4
100 ml NH4OH 1 M dicampur dengan 100 ml NH4Br 2 M. Kb NH4OH = 10-5. Jika ke dalam campuran ini ditambahkan 800 ml air, tentukan pH campuran sebelum dan sesudah diencerkan!
Jawab:
a. Sebelum diencerkan
b. Setelah diencerkan
Diencerkan sama dengan ditambah air ⇒ yang berubah hanya volum larutan, sedangkan jumlah mol zat terlarutnya (mol basa dan mol garamnya) tetap.
Maka pH larutan pun tetap = 8 + log 5.
6. Fungsi Larutan Penyangga dalam Tubuh Makhluk Hidup dan
dalam Kehidupan Sehari-hari
a. Dalam tubuh manusia
Dalam tubuh manusia terdapat sistem penyangga yang berperan dalam mempertahankan pH, yaitu sebagai berikut.
1) Pasangan asam basa konjugasi dari H2CO3- + HCO- terdapat dalam darah. Pasangan buffer ini dapat bereaksi dengan asam maupun basa sebagai berikut.
(i) H2CO3(aq)+ OH
-(aq) ← → HCO3-(aq)+ H2O(l)
(ii) HCO3
-(aq)+ H+(aq) ← → H2CO3(aq)
- Bila darah menerima zat yang bersifat basa maka H2CO3 akan berubah menjadi HCO3-(lihat persamaan i). Bersamaan dengan itu untuk mengimbangi pertambahan ion HCO3 -maka darah mengikat CO2 yang ada dalam paru-paru sehingga berubah menjadi H2CO3 (CO2 bereaksi dengan H2O).
- Sebaliknya bila darah menerima zat yang bersifat asam (hasil metabolisme) maka ion HCO3-akan berubah menjadi H
2CO3 (lihat persamaan ii), akibatnya jumlah H2CO3makin banyak. H2CO3ini akan terurai menjadi H2O dan CO2. Kelebihan CO2 ini dikeluarkan melalui paru-paru pada waktu bernapas. Dengan adanya buffer H2CO3- – HCO
3- menyebabkan pH darah bertahan antara 7,35 - 7,45. Apabila mekanisme peng-aturan pH dalam tubuh gagal (misal sakit) sehingga pH turun sampai di bawah 7 atau naik sampai di atas 7,8 maka dapat menyebabkan kerusakan yang permanen pada organ tubuh, atau bahkan kematian.
2) Pada cairan intrasel dalam tubuh, terdapat sistem penyangga H2PO4-– HPO
42-.Sistem ini bereaksi dengan asam maupun basa. (i) H2PO4
(ii) HPO4
2-(aq)+ H+(aq) ← → H2PO4-(aq)
Campuran penyangga ini berperan dalam ekskresi ion H+pada ginjal.
3) Suatu enzim akan dapat bekerja dengan baik bila berada dalam pH tertentu. Untuk tetap dapat mempertahankan pH ini tentu saja diperlukan adanya suatu sistem penyangga tertentu.
Demikian juga, untuk tumbuhnya kultur suatu bakteri diperlukan lingkungan dengan pH tertentu.
b. Dalam industri farmasi
Dalam industri farmasi l
arutan buffer (biasanya digunakan senyawa H3PO4 – H2PO4-) biasa ditambahkan pada waktu pembuatan obat-obatan, dengan tujuan agar zat aktif obat tetap berada pada pH tertentu, meskipun ada pengaruh penambahan sedikit asam kuat atau basa kuat dan pengenceran.Di samping itu larutan buffer juga diperlukan di bidang fotografi, industri kulit, dan zat warna. Buah-buahan dalam kaleng, perlu ditambahkan asam sitrat dan Natrium sitrat untuk menjaga pH agar tidak mudah dirusak oleh bakteri.
B. HIDROLISIS
Seperti telah kita ketahui, reaksi
disebut reaksi penetralan.
Akan tetapi, apakah setiap senyawa garam bila dilarutkan dalam air selalu menghasilkan larutan yang bersifat netral? Berikut ini adalah peruba-han yang terjadi pada kertas lakmus bila dimasukkan dalam larutan garam.
Tabel 6.2 Sifat larutan garam
Larutan Perubahan kertas lakmus Sifat larutan
Biru Merah
NaCl biru merah netral
CH3COONa biru biru basa
NH4Cl merah merah asam
Na2SO4 biru biru netral
Na2CO3 biru biru basa
NH4F merah merah asam
CH3COONH4 biru merah netral
Data di atas dapat disimpulkan bahwa larutan garam ada yang bersifat asam, basa, atau netral. Mengapa larutan garam ada yang bersifat asam, basa, atau netral? Dalam menjelaskan sifat larutan garam ini digunakan konsep hidrolisis.
1. Pengertian hidrolisis
Hidrolisis berasal dari kata hidro yang berarti air dan analisis yang berarti peruraian. Jadi hidrolisis garam adalah peristiwa penguraian garam oleh air menjadi asam dan atau basa pembentuknya.
Garam tersusun oleh kation (ion positif) yang berasal dari basa dan anion (ion negatif) yang berasal dari asam. Sebagai elektrolit kuat, garam LA di dalam air terionisasi sempurna, menghasilkan kation L+ dan anion A-.
Reaksinya: LA(aq)⎯→L+
(aq)+ A-(aq)
Menurut konsep ini, hanya kation dan anion yang lemah saja yang mengalami hidrolisis (bereaksi dengan air) sehingga membentuk asam atau basa penyusun garam tersebut.
a. Hidrolisis garam yang berasal dari basa kuat dan asam lemah
Misal: CH3COONa Reaksinya:
CH3COONa(aq)⎯→CH3COO
-(aq)+ Na+(aq) CH3COO
-(aq)+ H2O(l)→← CH3COOHaq)+ OH-(aq) ⇒hidrolisis identik
(anion lemah) (asam) reaksi asam basa Bronsted-Lowry
Adanya ion OH- ini menunjukkan bahwa hasil hirolisis garam yang berasal dari basa kuat dan asam lemah menghasilkan larutan yang bersifat basa (pH > 7).
b. Hidrolisis garam yang berasal dari basa lemah dan asam kuat
Misal: NH4Cl Reaksinya:
NH4Cl(aq)⎯→NH4+
(aq)+ Cl-(aq) NH4+
(aq)+ H2O(l)→← NH4OH + H+(aq)
(kation lemah)
c. Hidrolisis garam yang berasal dari basa lemah dan asam lemah
Misal: CH3COONH4 Reaksinya:
CH3COONH4(aq)⎯→CH3COO
-(aq)+ NH4+(aq) CH3COO
-(aq)+ H2O(l)→← CH3COOHaq)+ OH-(aq)
(anion lemah) NH4+
(aq)+ H2O(l)→← NH4OHaq)+ H+(aq)
(kation lemah) (basa)
Pada garam yang berasal dari basa lemah dan asam lemah, baik kation maupun anionnya mengalami hidrolisis, sehingga menghaslkan asam dan sekaligus basa pembentuk garam tersebut. Peristiwa hidrolisis seperti ini disebut hidrolisis total atau sempurna. Adapun bila dalam hidrolisisnya hanya diperoleh asam atau basa pembentuk garam tersebut, hidrolisisnya disebut hidrolisis sebagian atau parsial.
Bagaimanakah sifat larutan yang dihasilkan dari hidrolisis garam jenis ini?
d. Garam yang berasal dari basa kuat dan asam kuat
Misal: NaCl Reaksinya:
NaCl(aq)⎯→Na+
(aq)+ Cl-(aq)
Baik ion Na+ maupun ion Cl- merupakan kation dan anion kuat, sehingga keduanya tidak bereaksi dengan air (tidak mengalami hidrolisis).
Na+
(aq)+ H2O(l)⎯→tidak bereaksi
Cl
-(aq)+ H2O(l)⎯→tidak bereaksi
Karena tidak dihasilkan ion H+ maupun OH- yang baru, maka berarti konsentrasi ion H+ dan ion OH- tetap sama seperti yang terkandung dalam pelarut (H2O). Dengan demikian larutan ini tetap bersifat netral (pH = 7).
2. Tetapan Hidrolisis (Kh) dan pH Larutan Hasil Hidrolisis Garam
a. Garam yang berasal dari asam kuat dan basa lemah
1) Penentuan rumusan Kh Contoh: Garam NH4Cl NH4Cl(aq)⎯→NH4+
(aq)+ Cl-(aq)... (i) NH4+
(aq)+ H2O(l)←→ NH4OH(aq)+ H+(aq) ... (ii)
Karena H2O yang bereaksi sangat sedikit, maka konsentrasinya dianggap tidak berubah (tetap)
[H2O] sebagai bilangan yang tetap disatukan dengan K yang juga suatu tetapan, menjadi
maka
2) Penentuan rumus [H+]
Karena pada garam ini asamnya lebih kuat, maka untuk menen-tukan harga pH larutan dilakukan dengan cara mencari [H+] sebagai berikut.
Dari persamaan (ii) diketahui NH4+
(aq)+ H2O(l)→← NH4OH(aq)+ H+(aq)
Pada kesetimbangan ini besarnya [NH4OH] = [H+] sehingga dapat ditulis:
maka
Karena [NH4+] berasal dari garam NH
4Cl (lihat persamaan (i)) maka [NH4+] = [NH
4Cl] = molaritas garam = Mg
Dan atau
Untuk garam (NH4)2SO4dalam air terionisasi menjadi: (NH4)2SO4(aq)⎯→2NH4+
(aq)+ SO42-(aq) Dari persamaan ini diketahui bahwa:
[NH4+] = 2 [(NH
4)2SO4] = 2 Mg. maka atau
b. Garam yang berasal dari basa kuat dan asam lemah
1) Penentuan rumus Kh Contoh: garam CH3COONa CH3COONa(aq)⎯→CH3COO
maka atau
Selanjutnya, bagaimana cara menghitung pH larutan ini? Karena pada garam ini basanya lebih kuat maka harus mencari besarnya [OH-] yang ada dalam larutan tersebut.
b. Penentuan rumusan [OH-] Perhatikan kembali persamaan: CH3COO
-(aq)+ H2O(l)→← CH3COOH(aq)+ OH-(aq)
dan
Pada reaksi hidrolisis ini, mol CH3COOH dan mol OH-yang ter-jadi adalah ekuivalen maka [CH3COOH] = [OH-], sehingga per-samaan di atas dapat ditulis:
Karena CH3COO-berasal dari CH
3COONa (lihat persamaan (i)) maka [CH3COO-] = [CH
3COONa] = molaritas garam = Mg
Dan atau
Untuk garam Ca(CH3COO)2yang mengandung [CH3COO-] = 2 x Mg berlaku:
atau [OH−]= Kw
Karena CH COOH
c. Garam yang berasal dari asam lemah dan basa lemah
1) Penentuan rumusan Kh
Misal: Garam CH3COONH4. Garam ini dalam air terionisasi menjadi
CH3COONH4(aq)⎯→CH3COO
-(aq)+ NH4+(aq)
Karena baik kation maupun anionnya lemah maka keduanya mengalami hirolisis.
Dengan demikian besarnya [H+] tidak bergantung pada konsentrasi garam, melainkan hanya bergantung pada harga Ka dan Kb.
1. Bila Ka = Kb maka larutan bersifat netral (pH = 7) 2. Bila Ka > Kb maka larutan bersifat asam (pH < 7) 3. Bila Kb > Ka maka larutan bersifat basa (pH > 7)
Tabel 6.3 Rumus pH dari hidrolisis garam
[H ] Ka Kw
No. Jenis garam Hidrolisis pH Rumus [H
+]
Kh larutan atau [OH-]
1. Garam dari asam tidak terhi- pH = 7 - -kuat dan basa -kuat drolisis (bersifat
netral)
2. Garam dari asam terhidrolisis pH < 7 kuat dan basa sebagian (bersifat
lemah asam)
3. Garam dari basa hidrolisis pH > 7 kuat dan asam sebagian (bersifat
lemah basa)
Contoh soal 6.5
1. Sebanyak 10,7 gram garam NH4Cl (Mr = 53,5) dilarutkan dalam air hingga volume larutan menjadi 500 ml.
a. Tentukan konsentrasi larutan NH4Cl!
b. Jika Kb NH4OH = 1 x 10-5berapa pH larutan garam tersebut? Jawab:
a.
Jadi konsentrasi larutan NH4Cl = 0,4 M = 4 . 10-1M
b. NH4Cl adalah garam, yang kuat asamnya, jadi digunakan rumus:
2. 100 ml larutan NaOH 0,1 M dicampur dengan 25 ml larutan CH3COOH 0,4 M. (Ka CH3COOH = 10-5)
a. Berapa pH larutan masing-masing sebelum dicampur? b. Berapa pH larutan setelah dicampur?
Jawab:
b. Campuran NaOH (basa) dan CH3COOH (asam) direaksikan dulu
Karena yang ada dalam larutan hanya garam CH3COONa (yang kuat basanya) maka digunakan rumus:
3. 100 ml larutan (NH4)2SO40,1 M, Kh = 10-9 Berapakah pH larutan tersebut?
Jawab:
Latihan
Data pH dan volum NaOH yang digunakan jika direaksikan 50 mL CH3COOH 0,1 M dengan NaOH 0,1 M adalah:
a. Buatlah grafik perubahan pH larutan sebagai fungsi volum larutan NaOH yang ditambahkan dari data di atas! Gunakan milimeter block!
b. Dari grafik tersebut, tentukan titik ekuivalennya!
c. (i) pada penambahaan volum NaOH sebanyak 25 mL ternyata pH, larut-an adalah 4,74
(ii) pada penambahan volum NaOH sebanyak 50 mL, pH larutan adalah 8,72
(iii)pada penambahan volum NaOH sebanyak 51 mL, pH larutan adalah 11,0
Menyataan di atas, berilah penjelasan dengan perhitungan mengapa demikian?
Volum NaOH 0 25 48 49 49,8 49,9 50 50,1 50,2 51
yang ditambahkan
pH larutan 2,87 4,74 6,12 6,43 7,34 7,44 8,72 10,0 10,3 11,0
log .
log
log
, pH
pH
−
= − = −
= − =
2 10
5 2
5 1
2 2
4 85
5
1 2
Larutan penyangga Buffer asam
Buffer basa Hidrolisis
Tetapan hidrolisis
- Larutan penyangga adalah larutan yang dapat mempertahankan pH bila ditam-bah sedikit asam basa atau air
- 2 jenis larutan buffer:
larutan buffer asam: campuran antara asam lemah dan basa konjugasi
larutan buffer basa: campuran antara basa lemah dan asam konjugasinya
- * Rumus mencari pH buffer asam
* Rumus mencari pH buffer basa
- Hidrolisis: peristiwa penguraian garam oleh air
- Jenis-jenis hidrolisis:
a. Hidrolisis garam yang berasal dari basa kuat dan asam lemah garamnya bersifat basa, garam terhidrolisis sebagian
b. Hidrolisis garam yang berasal dari asam kuat dan basa lemah, garamnya bersifat asam, garam terhidrolisis sebagian
c. Hidrolisis garam yang berasal dari basa lemah dan asam lemah, sifat garam tergantung harga Ka/Kb garam terhidrolisis total.
- pH hidrolisis
a. Garam yang berasal dari basa kuat dan asam lemah
Kh Kw Ka
OH Kh Mg
=
=
−
[ ] .
[OH ] Kb. mol mol
− = basa
garam [H+]=Ka. mol asam
mol garam
RANGKUMAN
KK
KK
aa
aa
tt
tt
aa
aa
KK
KK
uu
uu
b. Garam yang berasal dari basa lemah dan asam kuat
c. Garam yang berasal dari basa lemah dan asam kuat
Kh Kw
I. Pilihlah jawaban yang tepat!
ELATIHAN SOAL
P
P
1. Larutan penyangga berisi cam-puran ....
a. asam lemah dengan garam apa saja
b. asam lemah dengan basa kuat
c. asam kuat garamnya
d. basa lemah dengan asam konjugasinya
e. basa lemah dengan asam lemah
2. Campuran larutan-larutan berikut yang bukan bersifat buffer adalah ....
a. HCOOH + Ba(HCOO)2 b. NaOH + Ba(HCOO)2 c. NH3+ (NH4)2SO4 d. NaH2PO4+ Na2HPO4 e. H3PO4+ NaH2PO4
3. Iika larutan diencerkan menjadi 3 kali volum semula pH larutan tidak berubah. Hal ini terjadi pada larutan yang mengan-dung ....
4. Suatu larutan yang mengan-dung 0,1 mol asam asetat (Ka = 10-5) dan 0, 01 mol Natrium asetat mempunyai pH ....
a. 2 d. 5
b. 3 e. 6
5. Jika 100 ml HCl 0,1 M dicam-purkan dengan 200 ml larutan NH3 0,3 M, (Kb = 10-5) pH larutan adalah ....
a. 5 - log 5 68) dicampur dengan 100 ml larutan HCOOH 0,1 M (Ka = 10-6) diperoleh pH = 5. Maka harga p adalah ... gram.
a. 0,068 b. 0,68 c. 3,4 d. 6,8 e. 7,2
7. Campuran suatu basa lemah NH3(aq) 1 M dengan larutan garam NH4Cl 1 M mempunyai pH = 10. Jika Kb NH3(aq)= 10-5 maka perbandingan volum kedua larutan yang dicampur adalah .... setelah bereaksi adalah ....
a. 5,6 d. 9,6
b. 6,3 e. 10,8
c. 8,3
9. 100 ml larutan suatu asam lemah HA (Ka = 10-5) tepat bereaksi dengan 50 ml larutan KOH 0,2 M. Bila ke dalam 500 ml larutan asam ini ditambahkan 1 gram NaOH (Mr = 40) maka pH larut-an ylarut-ang terjadi adalah ....
a. 1 d. 4
b. 2 e. 5
c. 3
10. Ke dalam larutan basa lemah LOH ditambahkan padatan garam L2SO4, sehingga konsen-trasi LOH menjadi 0,1 M dan kon-sentrasi L2SO4 0,05 M. Bila Kb = 10-5maka pH campuran adalah .... a. 5 – log 2 d. 9 + log 2
b. 5 e. 11
c. 9
11. Garam berikut yang tidak me-ngalami hidrolisis adalah .... a. CH3COOK
b. CH3COONH4 c. NH4Cl
d. Na2SO4 e. K3PO4
12. Fenolftalin (PP) akan menjadi berwarna merah apabila diteteskan dalam larutan .... a. CH3COOH d. K2CO3 b. NaNO3 e. NH4Cl c. H2SO4
14. Garam yang dalam air me-ngalami hidrolisis sempurna adalah ....
15. Di antara senyawa-senyawa di bawah ini yang bila dilarutkan dalam air menghasilkan larutan dengan pH lebih dari 7 adalah ....
a. Amonium klorida b. Kalium nitrat c. Natrium asetat d. Amonium asetat e. Aluminium sulfat
16. Jika Ka CH3COOH = 2 x 10-5 dan Kb NH4OH = 2 x 10-5, maka pH larutan CH3COONH4 0,02 M adalah ....
a. 5,5 d. 8,5
b. 6,5 e. 10
c. 7
17. Dari campuran larutan di bawah ini yang menghasilkan garam terhidrolisis sebagian dan larutannya bersifat basa adalah .... punyai pH = 11. pH larutan NH4Cl 0,1 M adalah ....
a. 3 d. 9
b. 5 e. 11
c. 7
19. Jika diketahui Ka CH3COOH =
1 x 10-5. pH larutan
Ca(CH3COO)20,1 M adalah .... a. 5 - log 1,4 d. 9
b. 5 e. 9 + log 1,4
c. 9 - log 1,4
20. Agar diperoleh larutan dengan pH = 9 maka massa CH3COONa (Mr = 82) yang harus dilarutkan dalam 10 ml air adalah .... (Ka = 10-5)
a. 0,08 d. 4,1
b. 0,82 e. 8,2
c. 2,05
II. Jawabah pertanyaan di bawah ini!
1. Apakah yang dimaksud larutan penyangga?
Sebutkan 2 jenis larutan penyangga, masing-masing dengan 3 contoh! 2. Hitunglah pH dari 1 liter larutan yang mengandung 50 mmol
3. 200 ml larutan CH3COOH 0,2 M dicampur dengan 100 ml larutan NaOH 0,1 M. Tentukan pH larutan itu sebelum dan sesudah dicam-purkan! (Ka CH3COOH = 1 x 10-5)
4. Berapa ml larutan CH3COOH 0,1 M harus ditambahkan ke dalam 200 ml larutan CH3COOK 0,1 M untuk membuat larutan dengan pH = 5? (Ka CH3COOH = 1 x 10-5)
5. Berapa ml larutan NaOH 0,1 M dan larutan CH3COOH 0,1 M masing-masing diperlukan untuk membuat 120 ml larutan penyangga dengan pH = 5? (Ka CH3COOH = 1 x 10-5)
6. Manakah garam di bawah ini yang terhidrolisis sempurna, yang ter-hidrolisis sebagian, dan yang tidak terter-hidrolisis dalam air?
a. Perak nitrat b. Natrium karbonat c. Amonium sulfida d. Barium klorida
7. Sebutkan sifat laruutan (asam, basa, atau netral) berikut a. Amonium bromida
b. Barium klorida c. Aluminium sulfat d. Kalium asetat
8. Bila Ka HCN = 5 x 10-6, berapakah tetapan hidrolisis dari larutan NaCN? (Kw = 10-14)
9. Bila Kb NH4OH = 1,8 x 10-5berapakah pH larutan NH
4Cl 0,04 M? 10. 250 ml larutan HF 0,3 M direaksikan dengan 150 ml larutan KOH 0,5 M.