REAKSI IDENTIFIKASI KATION DAN ANION
I. TUJUAN PERCOBAAN
1. Memahami reaksi identifikasi untuk kation dan anion. 2. Memahami prinsip kisetimbangan senyawa sukar larut.
II. DASAR TEORI
Dua langkah utama dalam analisis adalah identifikasi dan estimasi komponen-komponen suatu senyawa. Langkah identifikasi dikenal sebagai analisis kualitatif, sedangkan langkah estimasinya adalah langkah kuantitatif. Analisis kualitatif dapat dikatakan lebih sederhana, sedangkan analisis kuantitatif agak lebih rumit. Analisis kualitatif bertujuan mengidentifikasi penyusun-penyusun suatu zat, campuran-campuran
zat, atau larutan-larutan yang biasanya unsur-unsur penyusunnya bergabung antara yang satu dengan yang lain. Sedangkan analisis kuantitatif bertujuan untuk menentukan banyaknya penyusun-penyusun suatu zat atau persenyawaan.
Biasanya identifikasi zat dilakukan dengan penambahan zat lain yang susunannya telah diketahui, sehingga terjadi perubahan (reaksi kimia). Zat yang susunannya telah diketahui dan yang menyebabkan terjadinya reaksi disebut pereaksi (reagen).
Analisis kualitatif dapat dilakukan dengan dua macam cara, yaitu reaksi kering dan reaksi basah. Cara kering biasanya digunakan pada zat padat, sedangkan cara basah digunakan pada zat cair (larutan) yang kebanyakan menggunakan pelarut air. Cara kering hanya menyediakan informasi yang diperlukan dan informasi tersebut bersifat jangka pendek. Sedangkan cara basah dapat digunakan untuk analisis makro, semimakro, dan mikro sehingga banyak keuntungan yang didapat, misalnya reaksi terjadi dengan cepat dan mudah dikerjakan. Perubahan yang terjadi pada cara basah adalah terjadinya endapan, perubahan warna larutan, dan timbulnya gas.
Penambahan suatu elektrolit yang mengandung ion sejenis ke dalam larutan jenuh suatu garam akan menurunkan kelarutan garam tersebut karena konsentrasi ion bertambah dan kesetimbangan bergeser ke arah pembentukan garamnya.
Untuk mempermudah dalam reaksi identifikasi kation-anion, maka digunakan metode analisis kualitatif sistematik.metode ini merupakan pengklasifikasian
Penggolongan kation-kation ini didasarkan pada produk hasil reaksi dengan suatu reagensia. Reagen yang umum digunakan adalah HCl, H2S, (NH4)2S, (NH4)2CO3. Kation biasanya bereaksi dengan reagen tertentu yang ditandai dengan terbentuknya endapan atau tdak. Jadi, bisa dikatakan bahwa klasifikasi kation yang paling umum didasarkan atas perbedaan kelarutan dari klorida, sulfida dan karbonat dari kation tersebut. Klasifikasi sebagai berikut
a. Golongan I
Kation golongan ini membentuk endapan-endapan dengan asam klorida encer. Kation pada golongan ini adalah timbal (Pb), merkuri (Hg+) dan perak (Ag).
b. Golongan II
Kation golongan II akan memberikan endapan jika direaksikan dengan hidrogen sulfida, dalam suasana asam mineral encer. Kation golongan II masih dibedakan menjadi:
o Kation yang dapat larut dalam polisulfida, yaitu: timah (III), arsenik (III), arsenik (V), timah (II), stibium (III), stibium (V), dan timah (IV).
o Kation yang tidak dapat larut dalam polisulfida, yaitu: bismuth, tembaga, merkuri (Hg2+), dan kadmium (Cd2+).
c. Golongan III
Kation golongan III akan membentuk endapan jika direaksikan dengan ammonium sulfida dalam suasana netral/amoniak. Kation golongan III tidak dapat bereaksi dengan H2S atau HCl encer. Kation golongan III adalah kobalt (II), nikel (II), besi (II), kromium (III), alumunium, seng dan mangan.
d. Golongan IV
Kation golongan ini tak bereaksi dengan reagensia golongan I, II, dan III. Kation-kation ini membentuk endapan dengan adanya ammonium klorida, dalam suasana netral atau sedikit asam. Kation-kation golongan ini adalah kalsium, strontium dan barium.
e. Golongan V
Kation golongan V tidak bereaksi dengan reagen golongan I, II, III, dan IV. Kation yang termasuk dalam golongan ini adalah magnesium, natrium, kalium, ammonium, litium, dan hidrogen.
Hasil kali kelarutan (Ksp)
Telah diketahui bahwa untuk elektrolit-elektrolit biner yang sukar larut (M < 10 -3) maka pada suhu tetap hasil kali konsentrasi ion-ionnya adalah tetap. Hasil kali ion-ion
inilah yang disebut hasil kali kelarutan.
Dalam larutan jenuh, suatu elektrolit biner sukar larut mengandung kelebihan zat
padatnya sehingga terjadi kesetimbangan : A+B- A+ + B
IV. PROSEDUR KERJA
+ Na2CO3 (aq) endapan putih Hg2CO3
+ Na2S (aq) mula-mula terbentuk end. putih, kuning, coklat dan akhirnya hitam
endapan kuning
7. Alumunium (Al3+)
+ NH3 (aq) Al(OH)3 berupa koloid
setelah dipanaskan, terbentuk
end. hijau dari garam basa yang larut dalam pereaksi berlebih end. hijau Ni(OH)2
+ Na2CO3 (aq)
+ NaOH (aq) end. biru dari garam basa Co(OH)2
end. merah dari garam basa
+ Na2SO4 (aq)
+ KOH (aq) end. putih Zn(OH)2 yang larut dalam pereaksi berlebih
end. tersier zink sulfat yang larut dalam amonia & asam
13. Barium (Ba2+)
+ PbCl2 (aq) end. putih yang tidak larut dalam HNO3 encer
+ AgNO3 (aq) endapan
larut
tak larut + H2SO4 encer
+ K2CrO4 (aq) end. kuning BaCrO4
end. putih BaSO4
+ (NH4)2CO3 (aq)
+ NaOH (aq) end. putih Mg(OH)2
end. putih dari garam basa
+ Hg2(NO3)2 (aq) terbentuk HBr dan Br2
uap kuning
+ AgNO3 (aq)
+ H2SO4 pekat terbentuk I2
6. Tiosianat (CNS-)
+ FeCl3 larutan coklat end. ferri asetat + FeCl3 (aq)
+ AgNO3 (aq) end. putih AgCNS
larutan merah Fe(CNS)3
+ HCl encer
+ AgNO3 (aq) end. hitam Ag2S
H2S (g)
+ AgNO3 (aq) end. putih Ag2C2O4
13. Tiosulfat (S2O32-)
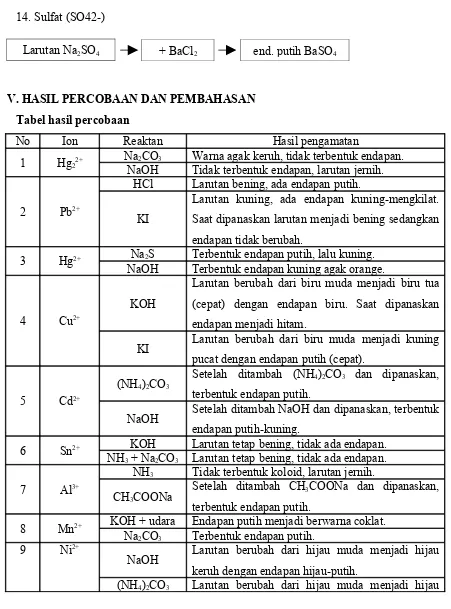
14. Sulfat (SO42-)
V. HASIL PERCOBAAN DAN PEMBAHASAN
Tabel hasil percobaan
No Ion Reaktan Hasil pengamatan
1 Hg22+ Na2CO3 Warna agak keruh, tidak terbentuk endapan. NaOH Tidak terbentuk endapan, larutan jernih.
2 Pb2+
HCl Larutan bening, ada endapan putih.
KI
Larutan kuning, ada endapan kuning-mengkilat. Saat dipanaskan larutan menjadi bening sedangkan endapan tidak berubah.
3 Hg2+ Na2S Terbentuk endapan putih, lalu kuning. NaOH Terbentuk endapan kuning agak orange.
4 Cu2+
KOH
Larutan berubah dari biru muda menjadi biru tua (cepat) dengan endapan biru. Saat dipanaskan endapan menjadi hitam.
KI Larutan berubah dari biru muda menjadi kuning pucat dengan endapan putih (cepat).
5 Cd2+
(NH4)2CO3 Setelah ditambah (NH4)2CO3 dan dipanaskan, terbentuk endapan putih.
NaOH Setelah ditambah NaOH dan dipanaskan, terbentuk endapan putih-kuning.
6 Sn2+ KOH Larutan tetap bening, tidak ada endapan. NH3 + Na2CO3 Larutan tetap bening, tidak ada endapan.
7 Al3+
NH3 Tidak terbentuk koloid, larutan jernih.
CH3COONa Setelah ditambah CH3COONa dan dipanaskan, terbentuk endapan putih.
8 Mn2+ KOH + udara Endapan putih menjadi berwarna coklat. Na2CO3 Terbentuk endapan putih.
9 Ni2+
NaOH Larutan berubah dari hijau muda menjadi hijau keruh dengan endapan hijau-putih.
(NH4)2CO3 Larutan berubah dari hijau muda menjadi hijau Larutan Na2SO4
Larutan Na2S2O3
+ BaCl2 end. putih BaSO4 + AgNO3 (aq)
+ H2SO4 (aq) end. sulfur + gas berbau rangsang
keruh dengan endapan hijau-putih (lebih keruh).
10 Co2+ NaOH Larutan berwarna biru, terbentuk endapan biru. Na2CO3 Larutan berwarna merah muda.
11 Zn2+ KOH
(NH4)2C2O4 Tidak ada endapan, larutan jernih.
13 Ba2+
K2CrO4 Larutan berubah dari bening menjadi agak keruh dengan endapan agak kuning.
H2SO4 encer Larutan berubah dari bening menjadi agak keruh dengan endapan putih.
14 Mg2+ NaOH Endapan putih.
(NH4)2CO3 Tidak terbentuk endapan.
15 Cl
-AgNO3 Terbentuk endapan berwarna putih. Saat ditambah amonia, endapan larut.
Hg2(NO3)2 Larutan berubah dari bening menjadi putih agak keruh. Ada sedikit endapan.
16 Br- H2SO4 pekat Setelah dipanaskan larutan berwarna coklat jernih dan muncul uap kuning.
17 I- H2SO4 pekat
Larutan berubah dari sedikit coklat bening menjadi coklat. Ada endapan coklat. Tabung reaksi terasa panas.
AgNO3 Terbentuk endapan putih-kuning.
18 Fe(CN6)4- PbCl2 Endapan putih dan tidak larut dalam HNO3. Larutannya berwarna kuning.
19 Fe(CN6)3- AgNO3 Tetap bening. Saat ditambah HNO3 tetap bening.
20 CNS- AgNO3 Endapan putih.
FeCl3 Larutan berwarna merah. 21 NO2
-Garam fero + H2SO4 encer
Saat ditambah garam fero, larutan menjadi kuning. Saat ditambah H2SO4 encer larutan berwarna lebih kuning. Setelah dipanaskan timbul gelembung gas. Saat ditambah garam fero lagi tidak terjadi perubahan.
22 S2- AgNO3 Endapan hitam yang larut dalam HNO3 panas. HCl encer Tidak timbul gas H2S
23 CH3COO
-FeCl3 Setelah ditambah FeCl3 larutan berwarna coklat setelah dipanaskan terbentuk endapan.
24 CO32- H2SO4 encer Tidak timbul gas, larutan jernih.
BaCl2 Endapan putih yang larut dalam HCl encer.
Terbentuk endapan putih yang larut dalam NH3.
BaCl2
Larutan berubah dari bening menjadi keruh (walau lebih keruh larutan dengan AgNO3). Terbentuk endapan putih.
26 PO43- KO3 Larutan keruh.
FeCl3 Larutan berwarna kuning.
27 S2O3
2-H2SO4 encer Larutan menjadi putih keruh dan terbentuk endapan putih.
AgNO3 Terbentuk endapan putih yang berubah warna menjadi kuning, kemudian coklat hitam.
28 SO42- BaCl2 Terbentuk endapan putih.
Pembahasan
Identifikasi kation 1. Merkuro (Hg22+)
Menurut teori, setelah direaksikan dengan larutan alkali karbonat (Na2CO3), akan terbentuk endapan putih merkuro karbonat. Dari hasil percobaan didapat larutan berubah menjadi agak keruh walau tidak terbentuk endapan. Reaksi yang terjadi adalah :
Hg2(NO3)2 (aq) + Na2CO3 (aq) Hg2CO3 ( ) + 2NaNO3 (aq)
Jika larutan Hg2(NO3)2 direaksikan dengan larutan NaOH, akan terbentuk endapan hitam. Dari hasil percobaan tidak terjadi perubahan yang teramati. Larutan tetap jernih serta tidak ada endapan yang terbentuk. Hal ini dimungkinkan karena penambahan NaOH yang berlebih. Reaksi yang mungkin terjadi adalah :
Hg2+2 (aq) + 2 OH- (aq) Hg2O ( ) + H2O (l) 2. Timbal (Pb2+)
Jika ion Pb2+ direaksikan dengan larutan HCl, akan terbentuk endapan yang berwarna putih. Dari hasil percobaan didapati endapan berwarna putih dengan larutan yang tidak
berwarna/ bening. Endapan ini dapat terbentuk karena larutan sudah lewat jenuh, konsentrasi ion-ion PbCl2 sudah melebihi harga Ksp-nya (Ksp PbCl2 = 2,4 x 10-9). Reaksi yang terjadi adalah :
Pb(NO3)2 (aq) + 2HCl (aq) PbCl2 (s) + 2HNO3 (aq)
Jika ion Pb2+ direaksikan dengan larutan KI, akan terbentuk endapan kuning PbI2. Dari hasil percobaan didapati endapan kuning mengkilat dengan larutan yang berwarna kuning. Setelah dipanaskan, larutan berubah menjadi jernih sedangkan endapan tidak berubah sama sekali. Larutan menjadi jernih karena PbI2 yang berupa koloid dalam larutan larut kembali. Reaksi yang terjadi adalah :
3. Merkuri (Hg2+)
Jika ion Hg2+ direaksikan dengan larutan Na2S, akan terbentuk endapan putih yang kemudian berubah menjadi kuning lalu coklat dan akhirnya hitam. Dari hasil percobaan didapati endapan putih yang berubah menjadi kuning. Reaksi yang terjadi adalah :
HgCl2 (aq) + Na2S (aq) HgS (s) + 2NaCl (aq)
Jika ion Hg2+ direaksikan dengan larutan NaOH, akan terbentuk endapan kuning Hg(OH)2. Dari hasil percobaan, didapati endapan kuning-orange. Reaksi yang terjadi adalah :
HgCl2 (aq) + 2NaOH (aq) HgO (s) + 2NaCl (aq) + H2O (l) 4. Kupri (Cu2+)
Jika ion Cu2+ direaksikan dengan larutan KOH, akan terbentuk endapan biru Cu(OH)2 yang jika dipanasi berubah menjadi hitam (CuO). Dari hasil percobaan, didapati endapan biru yang berubah menjadi hitam saat dipanaskan. Reaksi yang terjadi adalah :
CuSO4 (aq) + 2KOH (aq) Cu(OH)2 (s) + K2SO4 (aq) Cu(OH)2 (s) dipanaskan CuO (s) + H2O (l)
Jika ion Cu2+ direaksikan dengan larutan KI, akan terbentuk endapan putih CuI2 dengan warna larutan agak kuning dikarenakan ada I2 yang dibebaskan. Dari hasil percobaan
didapati warna larutan berubah dari biru muda menjadi kuning pucat dengan endapan putih. Reaksi yang terjadi adalah :
CuSO4 (aq) + 2KI (aq) CuI2 (s) + K2SO4 (aq) 2CuI2 (s) 2CuI (s) + I2 (g) atau
2CuSO4 (aq) + 4KI (aq) 2CuI (s) + 2K2SO4 (aq) + I2 (g) 5. Kadmium (Cd2+)
Jika ion Cd2+ direaksikan dengan larutan (NH4)2CO3, akan terbentuk endapan putih basa karbonat yang tidak larut dalam (NH4)2CO3 berlebih. Agar diperoleh endapan sempurna, saat proses reaksi dilakukuan, larutan dipanaskan. Dari hasil percobaan didapati endapan putih. Reaksi yang terjadi adalah :
CdI2 + (NH4)2CO3 CdCO3 ( ) + 2NH4I
Jika ion Cd2+ direaksikan dengan larutan NaOH, akan terbentuk endapan putih Cd(OH)2. Dari hasil percobaan didapati endapan putih-kuning. Reaksi yang terjadi adalah :
Jika ion Sn2+ direaksikan dengan larutan KOH, akan terbentuk endapan putih Sn(OH)2 yang larut dalam KOH berlebih. Dari hasil percobaan tidak ada perubahan yang dapat teramati. Ini dimungkinkan karena penggunaan KOH yang berlebih. Reaksi yang mungkin terjadi adalah :
Sn2+ (aq) + 2OH- (aq) Sn(OH)2 (s) Sn(OH)2 (s) + 2OH- (aq) [Sn(OH)4]
2-Jika ion Sn2+ direaksikan dengan larutan NH3 ditambah Na2CO3, akan terbentuk endapan putih Sn(OH)2 yang tidak larut dalam reagen berlebih. Dari hasil percobaan tidak ada perubahan yang dapat teramati. Reaksi yang mungkin terjadi :
Sn2+ + CO32- + NH3 + H2O Sn(OH)2 ( ) + (NH4)2CO3 7. Alumunium (Al3+)
Jika ion Al3+ direaksikan dengan larutan NH3, akan terbentuk Al(OH)3 yang berupa koloid. Dari hasil percobaan tidak ada perubahan yang dapat teramati. Hal ini mungkin dikarenakan kurangnya konsentrasi reagen atau pH yang kurang mendukung. Larutan tetap jernih seperti semula. Reaksi yang mungkin terjadi adalah :
Al3+ + 3NH3 + 3H2O Al(OH)3 + 3 NH4+
Jika ion Al3+ direaksikan dengan larutan NaCH3COO dan dipanaskan, akan terbentuk
endapan putih. Dari hasil percobaan didapati adanya endapan putih. Reaksi yang mungkin terjadi adalah :
Al3+ + 3CH3COO- + 2H2O Al(OH)2COO ( ) + 2CH3COOH 8. Mangan (Mn2+)
Jika ion Mn2+ direaksikan dengan larutan KOH, akan terbentuk endapan putih Mn(OH)2 yang karena pengaruh udara berubah menjadi coklat. Dari hasil percobaan didapati endapan putih yang kemudian berubah menjadi coklat. Reaksi yang terjadi adalah :
Mn2+ + 2OH- Mn(OH)2 ( ) saat kontak dengan udara terjadi reaksi :
Mn(OH)2 ( ) + O2 + H2O MnO(OH)2 ( ) + 2OH
-Jika ion Mn2+ direaksikan dengan larutan Na2CO3, akan terbentuk endapan putih MnCO3. Dari hasil percobaan didapati endapan putih. Reaksi yang terjadi adalah :
Mn2+ + CO32- MnCO3 ( ) 9. Nikel (Ni2+)
Jika ion Ni2+ direaksikan dengan larutan NaOH, akan terbentuk endapan hijau Ni(OH)2. Dari hasil percobaan didapati endapan hijau-putih. Reaksi yang terjadi adalah :
Jika ion Ni2+ direaksikan dengan larutan (NH4)2CO3, akan terbentuk endapan hijau dari garam basa yang larut dalam reagen berlebih. Dari hasil percobaan didapati endapan hijau-putih. Reaksi yang terjadi adalah :
Ni2+ + CO32- NiCO3 ( ) 10. Kobalt (Co2+)
Jika ion Co2+ direaksikan dengan larutan NaOH dalam keadaan dingin, akan terbentuk endapan biru dari garam basa. Jika dipanasi akan terbentuk kobalt hidroksida.Dari hasil percobaan didapati endapan biru. Reaksi yang terjadi adalah :
Co2+ + OH- + NO3- Co(OH)NO3 ( )
Dalam reagen berlebih dan dipanaskan akan tombul endapan merah jambu. Reaksi : Co(OH)NO3 ( ) + OH- Co(OH)2 ( ) + NO3
-Jika ion Co2+ direaksikan dengan larutan Na2CO3, akan terbentuk endapan merah dari garam basa. Dari hasil percobaan didapati larutan berwarna merah muda dan tidak ada endapan. Hal ini mungkin dikarenakan konsentrasi reagen yang kurang karena warna larutan sudah berwarna merah muda yang mengindikasikan hasil kali ion-ionnya sudah lebih besar daripada harga Ksp-nya.
Reaksi yang mungkin terjadi :
Co2+ + CO32- CoCO3 ( ) 11. Seng (Zn2+)
Jika ion Zn2+ direaksikan dengan larutan KOH, akan terbentuk endapan putih Zn(OH)2 yang larut dalam reagen berlebih. Dari hasil percobaan didapati larutan berubah dari bening menjadi agak keruh dengan sedikit endapan. Hal ini mungkin dikarenakan konsentrasi reagen yang kurang karena warna larutan sudah berwarna agak keruh yang mengindikasikan hasil kali ion-ionnya sudah lebih besar daripada harga Ksp-nya atau reagen yang berlebih sehingga endapan yang terbentuk larut kembali. Reaksi yang mungkin terjadi :
Zn2+ + 2OH- Zn(OH)2 ( ) Dalam reagen berlebih terjadi reaksi :
Zn(OH)2 ( ) + 2OH- [Zn(OH)4]
2-Jika ion Zn2+ direaksikan dengan larutan Na2SO4, akan terbentuk endapan tersier zink sulfat yang larut dalam amonia dan asam. Dari hasil percobaan didapati larutan tetap bening. Tidak ada perubahan yang dapat teramati. Ini mungkin dikarenakan kurangnya konsentrasi reagen atau kesalahan dalam percobaan. Reaksi yang mungkin terjadi adalah
12. Kalsium (Ca2+)
Jika ion Ca2+ direaksikan dengan larutan (NH4)2CO3, akan terbentuk endapan CaCO3 yang jika dipanasi akan menjadi kristalin. Dari hasil percobaan didapati endapan putih. Setelah dipanaskan tidak terbentuk kristal. Ini mungkin dikarenakan pemanasan yang dilakukan kurang. Reaksi yang terjadi :
Ca2+ + SO32- CaCO3 ( )
Jika ion Ca2+ direaksikan dengan larutan (NH4)2C2O4, dalam larutan yang dibuat alkalis akan terbentuk endapan CaC2O4. Dari hasil percobaan didapati larutan tetap jernih dan tidak ada endapan yang terbentuk. Ini mungkin dikarenakan kesalahan pengamatan atau zat yang digunakan sudah tidak valid lagi. Reaksi yang mungkin terjadi :
Ca2+ + C2O42- CaC2O4 ( ) 13. Barium (Ba2+)
Jika ion Ba2+ direaksikan dengan larutan K2CrO4, akan terbentuk endapan kuning BaCrO4. Dari hasil percobaan didapati endapan kuning. Reaksi yang terjadi adalah :
Ba2+ + CrO42- BaCrO4 ( )
Jika ion Ba2+ direaksikan dengan larutan H2SO4 encer, akan terbentuk endapan putih BaSO4. Dari hasil percobaan didapati endapan putih.
Ba2+ + SO42- BaSO4 ( ) 14. Magnesium (Mg2+)
Jika ion Mg2+ direaksikan dengan larutan NaOH, akan terbentuk endapan putih Mg(OH)2. Dari hasil percobaan didapati endapan putih. Reaksi yang terjadi adalah :
Mg2+ + 2OH- Mg(OH)2 ( )
Jika ion Mg2+ direaksikan dengan larutan (NH4)2CO3, akan terbentuk endapan putih dari garam basa. Dari hasil percobaan tidak ada perubahan yang dapat diamati. Hal ini mungkin dikarenakan terjadi kesetimbangan sehingga tidak terbentuk endapan. Reaksi yang mungkin terjadi :
5Mg2+ + 6 CO32- + 7 H2O 4 MgCO3.Mg(OH)2.5H2O ( ) + 2 HCO3 -Karena adanya garam-garam amonium, tidak terjadi pengendapan karena terbentuk kesetimbangan. Reaksi kesetimbangannya :
NH4+ + CO32- NH3 + HCO3 -Reaksi identifikasi anion
Jika ion Cl- direaksikan dengan larutan AgNO3, akan terbentuk endapan putih AgCl yang larut dalam NH3. Dari hasil percobaan didapati endapan putih. Setelah ditambah NH3, endapan larut. Reaksi yang terjadi adalah :
Ag+ + Cl- AgCl ( )
Jika ion Cl- direaksikan dengan larutan Hg2(NO3)2, akan terbentuk endapan putih Hg2Cl2. Dari hasil percobaan didapati larutan berwarna putih keruh dengan sedikit endapan putih. Reaksi yang terjadi adalah :
Hg22+ + 2Cl- Hg2Cl2 ( ) 2. Bromida (Br-)
Jika ion Br- direaksikan dengan larutan H2SO4 pekat, akan terbentuk HBr dan Br2 sehingga larutan berwarna coklat. Setelah dipanasi akan muncul uap kuning-coklat. Dari hasil percobaan didapati larutan berwarna coklat jernih dan muncul uap kuning. Reaksi yang terjadi adalah :
NaBr + H2SO4 HBr + Na+ + HSO4- (larutan coklat)
2NaBr + 2H2SO4 dipanaskan Br2 ( ) + SO2 ( ) + SO42- + 2Na+ + 2H2O
3. Yodida (I-)
Jika ion I- direaksikan dengan larutan H2SO4 pekat dingin, yodium dan yodida akan terbebaskan. Dari hasil percobaan didapati larutan berubah dari sedikit coklat menjadi coklat dan ada endapan coklat yang terbentuk. Tabung reaksi terasa panas. Reaksi yang terjadi adalah reaksi redoks :
2 I- + 2H2SO4 I2 ( ) + SO42- + 2H2O
Jika ion I- direaksikan dengan larutan AgNO3, akan terbentuk endapan kuning AgI. Ksp AgI = 0,9 x 10-16. Dari hasil percobaan didapati endapan putih-kuning. Reaksi yang terjadi adalah :
I- + AgNO3 AgI ( ) 4. Ferrosianida ([Fe(CN)6]4-)
Jika ion [Fe(CN)6]4- direaksikan dengan larutan PbCl2, akan terbentuk endapan putih yang tidak larut dalam HNO3 encer. Dari hasil percobaan didapati endapan putih. Setelah ditambah HNO3 encer, endapan tidak larut. Reaksi yang terjadi adalah :
3-Jika ion [Fe(CN)6]3- direaksikan dengan larutan AgNO3, akan terbentuk endapan yang larut dalam NH3 tetapi tidak larut dalam HNO3. Dari hasil percobaan tidak ada perubahan yang dapat diamati. Larutan tetap bening seperti semula. Hal ini mungkin dikarenakan kesalahan pengamatan atau zat yang digunakan sudah tidak valid. Reaksi yang mungkin terjadi :
[Fe(CN)6]3- + AgNO3 Ag3[Fe(CN)6] ( )
Pada saat penambahan NH3, endapan larut menjadi ion-ion. Reaksinya : Ag3[Fe(CN)6] ( ) + NH3 Ag3[Fe(CN)6]+ + Ag3[Fe(CN)6]3+ 6. Tiosianat (CNS-)
Jika ion CNS- direaksikan dengan larutan AgNO3, akan terbentuk endapan putih AgCNS. Dari hasil percobaan didapati endapan putih. Reaksi yang terjadi adalah :
CNS- + Ag+ AgCNS ( )
Jika ion CNS- direaksikan dengan larutan FeCl3, akan terbentuk larutan merah Fe(CNS)3. Dari hasil percobaan didapati larutan berwarna merah. Reaksi yang terjadi :
3 CNS- + Fe3+ Fe(CNS)3 (larutan merah) 7. Nitrit (NO2-)
Jika ion NO2- direaksikan dengan larutan garam fero ditambah H2SO4 encer, akan timbul
gas NO yang larut dalam air pada suhu dingin. Jika gas NO ini direaksikan dengan garam fero, akan terbentuk warna coklat. Dari hasil percobaan setelah larutan dipanaskan timbul gelembung gas. Saat ditambah garam fero lagi larutan tetap seperti semula. Ini mungkin disebabkan gas NO yang akan bereaksi dengan garam fero sudah tidak ada (telah dilepaskan) sehingga warna larutan tetap seperti semula. Reaksi yang terjadi adalah :
NO2- + H+ HNO2
3 HNO2 HNO3 + H2O + NO
Saat ditambah garam fero (misal FeSO4) terjadi reaksi : NO + FeSO4 [Fe,NO]SO4
8. Sulfida (S2-)
Jika ion S2- direaksikan dengan larutan AgNO3, akan terbentuk endapan hitam Ag2S yang larut dalam HNO3 panas. Dari hasil percobaan didapati endapan hitam yang larut dalam HNO3 panas. Reaksi yang terjadi adalah :
S2- + 2Ag+ Ag2S ( )
Jika ion S2- direaksikan dengan larutan HCl encer, akan terbentuk gas H2S yang dapat menghitamkan kertas saring yang ditetesi Pb(COO)2. Dari hasil percobaan tidak ada gas yang timbul/ teramati. Hal ini mungkin dikarenakan kesalahan pengamatan atau zat yang tidak valid lagi. Reaksi yang mungkin terjadi :
S2- + 2H+ H2S (bau khas) Reaksi dengan ion Pb :
H2S + 2Pb2+ PbS + H2 (bau khas) 9. Asetat (CH3COO-)
Jika ion CH3COO- direaksikan dengan larutan FeCl3 encer, akan terbentuk larutan berwarna coklat. Jika dipanaskan akan terbentuk endapan. Dari hasil percobaan didapati larutan berwarna agak coklat. Setelah larutan ini dipanaskan, terbentuk endapan.
3 CH3COO- + Fe3+ Fe(CH3COO)3 Saat dipanaskan terjadi reaksi :
Fe(CH3COO)3 + 2H2O Fe(OH)2. CH3COO ( ) + 2 CH3COOH (Vogel, 1953) 10. Karbonat (CO32-)
Jika ion CO32- direaksikan dengan larutan H2SO4 encer, akan terbentuk gas. Dari hasil
percobaan tidak ada gas yang timbul dan warna larutan tetap jernih. Ini mungkin dikarenakan kesalahan pengamatan karena gas yang timbul adalah gas CO2 yang tidak berbau sehingga susah dideteksi. Reaksi yang terjadi adalah :
CO32- + 2H+ CO2 ( ) + H2O
Jika ion CO32- direaksikan dengan larutan BaCl2, akan terbentuk endapan putih BaCO3 yang larut dalam HCl encer. Dari hasil percobaan didapati endapan putih yang larut dalam HCl encer. Reaksi yang terjadi adalah :
CO32- + Ba2+ BaCO3 ( ) Saat ditambah dengan HCl :
BaCO3 ( ) + 2HCl BaCl2 + CO2 + H2O 11. Oksalat (C2O42-)
Jika ion C2O42- direaksikan dengan larutan AgNO3, akan terbentuk endapan putih Ag2C2O4 yang larut dalam NH3 dan HNO3 encer. Dari hasil percobaan didapati endapan putih yang larut dalam NH3. Reaksi yang terjadi :
C2O42- + Ag+ Ag2C2O4 ( )
Jika ion C2O42- direaksikan dengan larutan BaCl2, akan terbentuk endapan putih BaC2O4 yang larut dalam asam asetat. Dari hasil percobaan didapati endapan putih. Reaksi yang terjadi adalah :
C2O42- + Ba2+ BaC2O4 ( ) 12. Fosfat (PO43-)
Jika ion PO43- direaksikan dengan larutan KO3, akan terbentuk endapan putih. Dari hasil percobaan didapati warna larutan menjadi keruh walau tidak terbentuk endapan. Ini mungkin dikarenakan hasil kali konsentrasi ion-ionnya hanya sedikit melebihi Ksp. Reaksi yang terjadi :
PO43- + 2K+ K2PO4 ( )
Jika ion PO43- direaksikan dengan larutan FeCl3, akan terbentuk endapan putih-kuning FePO4. Dari hasil percobaan didapati warna larutan menjadi kuning walau tidak terbentuk endapan. Ini mungkin dikarenakan hasil kali konsentrasi ion-ionnya hanya sedikit melebihi Ksp. Reaksi yang terjadi :
PO43- + Fe3+ FePO4 ( ) 13. Tiosulfat (S2O32-)
Jika ion S2O32- direaksikan dengan larutan H2SO4 encer, akan terbentuk gas yang berbau
rangsang dan endapan sulfur. Dari hasil percobaan didapati endapan putih. Reaksinya : S2O32- + 2H+ S ( ) + SO2 ( ) + H2O
Jika ion S2O32- direaksikan dengan larutan AgNO3, akan terbentuk endapan putih yang berubah menjadi kuning-coklat dan akhirnya hitam. Dari hasil percobaan didapati endapan putih yang berubah menjadi kuning dan akhirnya coklat-hitam. Reaksinya :
S2O32- + 2Ag+ Ag2S2O3 ( ) (putih)
Ag+ + 2S2O32- [Ag2(S2O3)2] ( ) (kuning-coklat) Ag2S2O3 ( ) + H2O Ag2S ( ) + 2H+ + SO42- (hitam)
14. Sulfat (SO42-)
Jika ion SO42- direaksikan dengan larutan BaCl2, akan terbentuk endapan putih BaSO4. Dari hasil percobaan didapati endapan putih. Reaksinya :
SO42- + Ba2+ BaSO4 ( )
VI.KESIMPULAN
2. Reaksi kimia yang terjadi ditandai dengan timbulnya gas dan endapan serta terjadinya sistem koloid, perubahan warna dan suhu (pada beberapa reaksi).
3. Endapan dapat terbentuk karena hasil kali konsentrasi ion-ion penyusun senyawa tersebut telah melampau harga Ksp-nya.
4. Pemanasan menyebabkan kelarutan lebih besar.
5. Pada beberapa endapan, jika ditambah reagen berlebih atau kontak dengan udara bebas, endapan akan bereaksi membentuk senyawa baru yang ditandai perubahan warna/ endapan (larut kembali).
VII. DAFTAR PUSTAKA
Akhmad, Sayid & Mudjiran. 1994. Diktat Kuliah Kimia Analitik. FMIPA UGM : Yogyakarta
Brady, James E. 1999. Kimia Universitas, Asas dan Struktur Jilid 1, edisi kelima. Bina Rupa Aksara : Jakarta
Cotton, Wilkinson. 1989. Kimia Anorganik Dasar. UI Press : Jakarta
Vogel, A. I. 1953. Macro and Semimicro Qualitative Inorganic Analysis. Longman Group Limited : London
Yogyakarta, 18 September 2007
Praktikan Asisten