BAB II
TINJAUAN PUSTAKA 2.1 Garam
2.1.1 Pengertian Garam
Secara fisik, garam adalah benda padatan berwarna putih berbentuk kristal yang merupakan kumpulan senyawa dengan bagian terbesar Natrium Klorida (>80%) serta senyawa lainnya seperti Magnesium Klorida, Magnesium Sulfat, Kalsium Klorida, dan lain-lain. Garam mempunyai sifat atau karakteristik higroskopik yang berarti mudah menyerap air, bulk density (tingkat kepadatan) sebesar 0,8 - 0,9 dan titik lebur pada tingkat suhu 801oC (Burhanuddin, 2001).
Garam Natrium Klorida untuk keperluan masak dan biasanya diperkaya dengan unsur iodin (dengan menambah 5 g NaI per kg NaCl) padatan kristal berwarna putih, berasa asin, tidak higroskopis, bila mengandung MgCl2 menjadi berasa agak pahit dan higroskopis. Digunakan terutama sebagai bumbu penting untuk makanan, bahan baku pembuatan logam Na dan NaOH (bahan untuk pembuatan keramik, kaca, dan pupuk), sebagai zat pengawet (Mulyono, 2009).
2.1.2 Sumber Garam
Sumber garam yang didapat di alam berasal dari: 1. Air laut, air danau asin
Yang bersumber air laut terdapat di Mexico, Brazilia, RRC, Australia, dan Indonesia yang mencapai ± 40% . Adapun yang bersumber dari danau asin terdapat di Yordania (Laut Mati), Amerika Serikat (Great Salt Lake), dan Australia yang mencapai produksi ± 20% dari total produk dunia.
2. Deposit dalam tanah, tambang garam
3. Sumber air dalam tanah
Sangat kecil, karena sampai saat ini dinilai kurang ekonimis maka jarang (sama sekali tidak) dijadikan pilihan usaha. Di Indonesia terdapat sumber air garam di wilayah Purwodadi, Jawa Tengah
(Burhanuddin, 2001).
2.2 Garam Beriodium
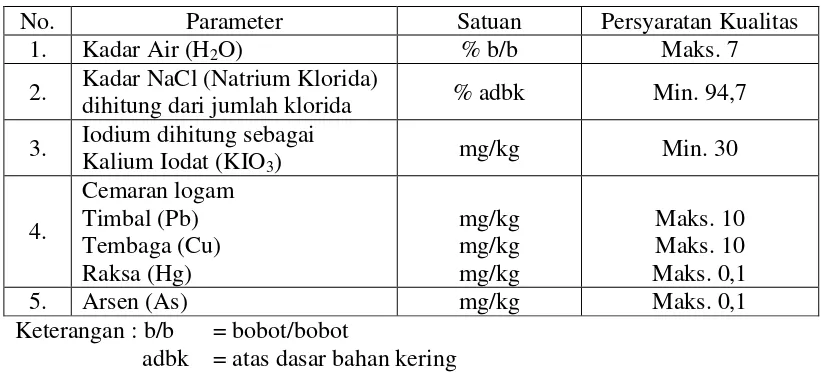
Garam beriodium adalah suatu produk yang ditawarkan kepada konsumen atau setiap keluarga untuk mencegah kekurangan iodium sebagai upaya jangka panjang. Kualitas garam beriodium mengacu kepada Standar Nasional Indonesia (SNI) No. 01-3556-2010 seperti tertera pada Tabel 2.1.
Tabel 2.1. Syarat Mutu Garam Konsumsi Beriodium
No. Parameter Satuan Persyaratan Kualitas
1. Kadar Air (H2O) % b/b Maks. 7
2. Kadar NaCl (Natrium Klorida)
dihitung dari jumlah klorida % adbk Min. 94,7 3. Iodium dihitung sebagai
Kalium Iodat (KIO3) mg/kg Min. 30
Keterangan : b/b = bobot/bobot
adbk = atas dasar bahan kering
sehari-hari, tidak ada pengolahan makanan yang tidak menggunakan garam (DGKM, 2007).
Hasil pemantauan Biro Pusat Statistik (BPS) terhadap garam konsumsi beriodium ditingkat rumah tangga sejak tahun 1997 sampai dengan 1999 dibagi dalam 3 kelompok yaitu (1) garam yang memenuhi syarat (kadar KIO3> 30-80 ppm), (2) garam yang tidak memenuhi syarat (kadar KIO3< 30 ppm), (3) garam yang tidak mengandung iodium (KIO3 0 ppm) (Burhanuddin, 2001).
Garam beriodium mengandung 0,0025% berat KIO (artinya dalam 100 gram total berat garam terkandung 2,5 mg KIO). Berikut ini dipaparkan cara sederhana untuk menghitung berapa banyak KIO yang dikonsumsi seseorang. Andaikan seorang ibu rumah tangga dalam sehari memasak satu panci sup (kapasitas dua liter) dengan menggunakan dua sendok garam beriodium (misalnya dengan berat 20 gram), dan tiap-tiap anggota keluarga pada hari tersebut melalap dua mangkok (anggap volume total kuah 100 ml). Maka, berat total garam KIO yang dikonsumsi tiap-tiap anggota keluarga itu dalam sehari (dengan asumsi tidak makan garam melalui makanan lainnya) adalah 0,0000025 gram atau 2,5 mikrogram (dari 0,0025% x 20 gram x 100 ml/200 ml). Jumlah garam yang sangat kecil, namun sangat diperlukan (Hasibuan, 2009).
2.2.1 Fortifikasi Iodium Pada Garam
garam digunakan secara luas dan oleh seluruh lapisan masyarakat. Prosesnya adalah sederhana dan tidak mahal (Albiner, 2003).
Fortifikasi yang biasa digunakan adalah Kalium Iodida (KI) dan Kalium Iodat (KIO3). Iodat lebih stabil dalam impure salt pada penyerapan dan kondisi lingkungan (kelembaban) yang buruk. Penambahan tidak mengakibatkan perubahan warna dan rasa. Negara-negara yang dengan program iodisasi garam yang efektif memperlihatkan pengurangan yang berkesinambungan akan prevalensi GAKI (Albiner, 2003).
2.3 Kalium Iodat
Kalium Iodat memiliki rumus molekul KIO3 dan bobot molekul 214,02 g mol-1 serta mempunyai komposisi I= 59,3%, K= 18,27%, O= 22,43%, berupa serbuk hablur putih atau kristal yang tidak berbau, tidak leleh 560oC dan bobot jenis 3,89 g/ml (Cahyadi, 2004).
Iodium dalam garam dihitung dengan kadar Kalium Iodat (KIO3), dimana iodium merupakan kandungan terpenting dalam kelenjar tiroid. Kandungan iodium yang dikonsumsi tidak seluruhnya diserap atau disintesa oleh hormon tiroid melainkan hanya sekitar 33%, sedangkan 67% dikeluarkan melalui urine dan feses (Manalu, 2007).
40 gram Kalium Iodat dalam tiap 1 liter air (1 Kg KIO3/25 liter air) (Manalu, 2007).
Persyaratan umum Kalium Iodat yang digunakan yakni:
1. Kadar (KIO3) : Min 99%
2. Kehalusan : 100 Mesh
3. Logam berbahaya (Pb, Hg, Zn, Cu, As) : Nihil
4. Grade : Food Grade
2.4 Iodium
Iodium merupakan senyawa yang diketahui pertama kali oleh Bernard Curtois pada tahun 1810. Namun iodium berasal dari bahasa Yunani Iode yang berarti warna violet. Kimiawi iodium dalam tubuh baru diketahui pada tahun 13-15, setelah Kendal berhasil mengisolasi senyawa yang mengandung iodium dalam kelenjar timid. Senyawa-senyawa tersebut adalah monoiodotirosin, diiodotirosin, triidotironin, dan tiroksin (Budiyanto, 2009).
Iodium dikonsentrasikan di dalam kelenjar gondok (glandula thyroide) untuk dipergunakan dalam sintesis hormon tiroksin. Hormon ini ditimbun dalam folikel kelenjar gondok, terkonjugasi dengan protein (globulin), dan disebut tiroglobulin, bila diperlukan tiroglobulin dipecah dan terlepas, hormon tiroksin yang dikeluarkan dari folikel kelenjar masuk ke dalam aliran darah (Sediaoetama, 2006).
Menurut Budiyanto (2001) pemenuhan gizi mikro Iodium bertumpu kepada pemanfaatan garam dapur yang telah mengalami fortifikasi iodium. Garam-garam beriodium relatif mudah didapat di toko-toko kecil. Beberapa produk yang terdapat di Malang, misalnya garam merk Bintang mengandung 30-80 ppm KIO3, sedangkan garam merk Kelir Mas mengandung minimal 30 ppm KIO3. Garam-garam tersebut telah sesuai dengan Standar Industri Indonesia. Jika penggunaan garam beriodium tersebut sesuai dengan sifat fisik dan kimia Iodium, maka upaya pemenuhan tersebut akan tercapai dengan baik sehingga dapat menurunkan GAKI. Ada 6 model yang mungkin dikembangkan masyarakat dalam rangka pemenuhan gizi mikro iodium, yaitu:
a. Menggunakan garam tidak beriodium (uyah grasak, bahasa Jawa)
b. Menggunakan garam beriodium (yang disimpan) dengan cara menggunakan dicampur dengan bumbu (saat mengerus), kemudian dimasukkan pada saat memasak makanan
d. Menggunakan garam beriodium (yang disimpan) dengan cara menggunakan semua garam yang dibutuhkan dimasukkan pada saat memasak makanan
e. Menggunakan garam beriodium (yang disimpan) dengan cara menggunakan semua garam yang dibutuhkan dimasukkan pada makanan yang selesai dimasak dan masih panas.
Iodium merupakan mineral yang diperlukan untuk tubuh dalam jumlah yang relatif sangat kecil, tetapi mempunyai peran yang sangat penting untuk pembentukan hormon tiroksin. Hormon tiroksin ini sangat berperan dalam metabolisme di dalam tubuh. Kekurangan iodium dapat berakibat buruk bagi manusia. Akibat yang dapat ditimbulkannya antara lain berkurangnya tingkat kecerdasan, pertumbuhan terhambat, penyakit gondok, kretin endemik (cebol), berkurangnya kemampuan mental dan psikologi, meningkatnya angka kematian prenatal, serta keterlambatan perkembangan fisik anak (Nadesul, 2000).
Menurut Farmakope Indonesia Edisi III (1979), Iodium mengandung tidak kurang dari 99,8% dan tidak lebih dari 100,5%.
1. Pemerian : keping atau granul, berat, hitam keabu-abuan, bau khas, berkilau seperti metal.
2. Kelarutan : sangat sukar larut dalam air, mudah larut dalam karbon disulfida, kloroform, eter, etanol, dan larutan iodida, agak sukar larut dalam gliserin.
3. Penetapan Kadar : serbukkan dan timbang seksama lebih kurang 500 mg dalam labu bersumbat kaca yang telah ditara, tambahkan 1 gram kalium iodida P yang dilarutkan dalam 5 mL air. Encerkan dengan air hingga lebih kurang 50 mL, tambahkan 1 mL asam klorida 3 N. Titrasi dengan natrium tiosulfat 0,1 N, menggunakan 3 mL indikator kanji.
WHO, Unicef, dan ICCIDD menganjurkan kebutuhan iodium sehari-hari sebagai berikut:
- 90 mg untuk anak prasekolah (0 - 59 bulan) - 120 mg untuk anak sekolah dasar (6 - 12 tahun) - 150 mg untuk dewasa (di atas 12 tahun)
- 200 mg untuk wanita hamil dan wanita menyusui
2.4.1 Sumber Iodium
Sumber iodium dalam makanan, antara lain: sayur-sayuran, ikan laut dan rumput laut, air mata air, dan garam beriodium (Budiyanto, 2009).
Sedangkan sumber iodium di alam, antara lain:
1. Air tanah, tergantung sumber air berasal dari batuan tertentu
2. Air laut, mengandung sedikit iodium, sehingga kandungan iodium garam rendah
3. Plankton, ganggang laut dan organisme laut lain berkadar iodium tinggi sebab organisme ini mengkonsentrasikan iodium dari lingkungan sekitarnya
4. Sumber bahan organik yang dalam oksidan, desinfektan, iodophor, zat warna makanan dan kosmetik, dan vitamin yang beredar di pasaran juga menambah iodium
2.4.2 Manfaat Iodium
Iodium sebagai unsur penting dalam sintesa hormon tiroksin, yaitu suatu hormon yang dihasilkan oleh kelenjar tiroid yang sangat dibutuhkan untuk proses pertumbuhan, perkembangan, dan kecerdasan. Iodium juga sebagai pembentukan hormon kalsitonin, yang juga dihasilkan oleh kelenjar tiroid, berasal dari sel parafoli-kular (sel CO). Hormon ini berperan aktif dalam metabolisme kalsium, maka harus selalu tersedia iodium yang cukup dan berkesinambungan (Djokomoeljanto, 2006).
2.5 Akibat Kekurangan dan Kelebihan Iodium 2.5.1 Akibat Kekurangan Iodium
Gangguan Akibat Kurang Iodium (GAKI) adalah gangguan yang diakibatkan oleh kurangnya zat iodium dalam tubuh, yaitu dapat mengakibatkan pembengkakan kelenjar tiroid (gondok) pada usia dewasa, dan pada bayi atau anak-anak dapat memperhambat pertumbuhan dan perkembangan fisik maupun intelektualnya (Almatsier, 2003).
pertumbuhan dan perkembangan janin, dan dalam keadaan berat bayi lahir dalam keadaan cacat mental yang permanen serta hambatan pertumbuhan yang dikenal sebagai kretinisme yaitu bentuk tubuh yang abnormal dan IQ dibawah 20. Hal ini dapat mengganggu proses belajar dari anak-anak (Almatsier, 2003).
2.5.2 Akibat Kelebihan Iodium
Asupan iodium dalam jumlah yang banyak, akibatnya sama seperti dalam hal kekurangan iodium, yaitu terjadi pembesaran kelenjar tiroid, sehingga dapat menimbulkan sesak napas yang diakibatkan oleh pembesaran tersebut menutupi jalan pernapasan (Almatsier, 2003).
2.6 Titrasi yang Melibatkan Iodium
Titrasi yang melibatkan iodium dapat dilakukan dengan 2 cara yaitu titrasi langsung (iodimetri) dan titrasi tidak langsung (iodometri).
a. Titrasi Langsung (Iodimetri)
Iodium merupakan oksidator yang relatif kuat. Pada saat reaksi oksidasi, iodium akan direduksi menjadi iodida sesuai reaksi:
I2 + 2e ↔ 2I-
b. Titrasi Tidak Langsung (Iodometri)
Iodometri merupakan titrasi tidak langsung dan digunakan untuk menetapkan senyawa-senyawa yang mempunyai potensial oksidasi yang lebih besar daripada sistem iodida-iodida atau senyawa-senyawa yang bersifat oksidator seperti CuSO4.5H2O. Pada iodometri, sampel yang bersifat oksidator direduksi dengan kalium iodida berlebihan dan akan menghasilkan iodium yang selanjutnya dititrasi dengan larutan baku natrium tiosulfat
(Rohman, 2007). Titrasi redoks dapat dibedakan menjadi beberapa cara berdasarkan pemakaiannya:
1. Na2S2O3 sebagai titran dikenal sebagai iodometri tak langsung
2. I2 sebagai titran dikenal sebagai titrasi iodometri langsung dan kadang-kadang dinamakan iodimetri
3. Suatu oksidator kuat sebagai titran. Diantaranya yang sering dipakai ialah:
a. KMnO4 b. K2Cr2O7 c. Ce (IV)
4. Suatu reduktor kuat sebagai titran
2.6.1 Perbedaan Iodimetri dan Iodometri
Menurut Basset (1994), metode cara langsung (iodimetri) jarang dilakukan mengingat iodium merupakan oksidator yang lemah. Cara langsung disebut iodimetri yang menggunakan larutan iodium untuk mengoksidasi reduktor-reduktor yang dapat dioksidasi secara kuantitatif pada titik ekivalennya. Sedangkan cara tidak langsung disebut iodometri yaitu oksidator yang dianalisis cukup kuat untuk direaksikan sempurna dengan ion iodida berlebih dalam keadaan sesuai yang selanjutnya iodium dibebaskan secara kuantitatif dan dititrasi dengan larutan natrium tiosulfat atau asam arsenit.
2.7 Iodometri (Metode Titrasi Tidak Langsung)
Iodometri merupakan titrasi tidak langsung dan digunakan untuk menetapkan senyawa-senyawa yang mempunyai potensial oksidasi yang lebih besar daripada sistem iodida-iodida atau senyawa-senyawa yang bersifat oksidator seperti CuSO4.5H2O. Pada iodometri, sampel yang bersifat oksidator direduksi dengan kalium iodida berlebihan dan akan menghasilkan iodium yang selanjutnya dititrasi dengan larutan baku natrium tiosulfat (Rohman, 2007).
2.7.1 Larutan Standar Na2S2O3
2.7.2 Indikator Amilum (Kanji)
Titrasi dapat dilakukan tanpa indikator dari luar karena warna I2 yang dititrasi itu akan lenyap bila titik akhir tercapai, warna itu mula-mula cokelat agak tua, menjadi lebih muda, lalu kuning, kuning muda dan seterusnya, sampai akhirnya lenyap. Bila diamati lebih cermat perubahan warna tersebut, maka titik akhir akan dapat ditentukan dengan cukup jelas. Konsentrasi iod masih tepat dapat dilihat dengan mata dan memungkinkan penghentian titrasi dengan kelebihan hanya senilai 1 tetes iod. Namun, lebih mudah dan lebih tegas bila ditambah amilum kedalam larutan sebagai indikator (Harjadi, 1986).
2.8 Penetapan Kadar KIO3 dalam Garam Konsumsi Beriodium
Penetapan kadar kalium iodat dalam hal ini menggunakan Analisis Kuantitatif dengan metode Volumetri. Metode Volumetri menggunakan titrasi iodometri. Metode ini masih digunakan secara luas karena merupakan metode yang tahan, murah dan mampu memberikan ketetapan yang tinggi. Dalam analisis volumetri atau analisis kuantitatif dengan mengukur volume, sejumlah zat yang diselidiki direaksikan dengan larutan baku (standar) yang kadar (konsentrasi) nya telah diketahui secara teliti dan reaksinya berlangsung secara kuantitatif (Rohman, 2007).
Daftar baku primer yang umum digunakan untuk membakukan larutan baku dapat dilihat pada Tabel 2.2.
Tabel 2.2 : Daftar Baku Primer
No. Baku Primer Kegunaan
1. Kalium Biftalat Pembakuan Natrium Hidroksida Pembakuan larutan Asam perklorat 2. Kalium Iodat Pembakuan larutan Natrium Tiosulfat
melalui pembentukan Iodium 3. Natrium Karbonat Anhidrat Pembakuan Asam Klorida
4. Logam Zn Pembakuan larutan EDTA
(Rohman, 2007). Larutan standar biasanya ditambahkan dari dalam sebuah buret. Proses penambahan larutan standar sampai reaksi tepat lengkap, disebut titrasi, dan zat yang akan ditetapkan, dititrasi. Titik (saat) pada mana reaksi itu lengkap disebut titik ekivalen (setara) atau titik akhir teoritis. Lengkapnya titrasi, harus terdeteksi oleh suatu perubahan, yang tidak dapat disalah lihat oleh mata, yang dihasilkan oleh larutan standar itu sendiri, atau lebih lazim lagi oleh penambahan suatu reagensia pembantu yang dikenal sebagai indikator. Setelah reaksi antara visual yang jelas dengan cairan yang sedang dititrasi, titik pada saat ini terjadi disebut titik akhir titrasi (Basset, 1994).
Banyaknya volum natrium tiosulfat yang digunakan sebagai titran setara dengan iodium yang dihasilkan dan setara dengan banyaknya sampel (Rohman, 2007).