\
PENETAPAN KADAR IODIUM PADA GARAM DAPUR
DI PASAR BESAR MALANG DENGAN METODE SPEKTROFOTOMETRI
KARYA TULIS ILMIAH
OLEH
RIYAN TAUFIK RIDWAN
NIM 09 028
AKADEMI ANALIS FARMASI DAN MAKANAN
PUTRA INDONESIA MALANG
PENETAPAN KADAR IODIUM PADA GARAM DAPUR
DI PASAR BESAR MALANG DENGAN METODE SPEKTROFOTOMETRI
KARYA TULIS ILMIAH
Diajukan kepada
Akademi Analis Farmasi dan Makanan Putra Indonesia Malang
untuk memenuhi salah satu persyaratan
dalam menyelesaikan program D III
bidang Analis Farmasi dan Makanan
OLEH
RIYAN TAUFIK RIDWAN
NIM 09 028
AKADEMI ANALIS FARMASI DAN MAKANAN
PUTRA INDONESIA MALANG
“Janganlah ada diantara kamu memperlakukan saudaranya dengan
cara yang ia sendiri tidak ingin mengalaminya” (Nabi Muhammad
SAW)
Karya tulis ilmiah ini kupersembahkan
Untuk kedua orang tuaku yang penuh kasih sayang dan doa
Untuk Bu Wahyu, atas bimbingannya selama ini
Untuk semua teman Akafarma ’09, yang telah membantu dan
menemani ku dalam susah maupun senang.
Untuk Keluarga besar PIM dan semua pihak yang tidak dapat
disebutkan satu
per satu saya ucapkan terima kasih yang sedalam-dalamnya,
disebutkan satu
ABSTRAK
Ridwan, Riyan Taufik. 2012. Penetapan Kadar Iodium Pada Garam Dapur Di Pasar Besar Malang Dengan Metode Spektrofotometri Karya tulis Ilmiah. Akademi Analis Farmasi dan Makanan putra Indonesia Malang. Pembimbing Dra. Wahyu Wuryandari, M. Pd.
Kata kunci : penetapan kadar, pasar besar malang, kadar iodium
Masih banyak garam beriodium yang beredar dimasyarakat berlabel tetapi tidak mencantumkan komposisi sesuai dengan SNI. Oleh karena itu, diperlukan penetapan kadar iodium pada garam beriodium, apakah kandungan iodiumnya sesuai dengan SNI atau tidak. Hal ini dilakukan sebagai tindakan preventif mencegah timbulnya GAKI. GAKI memang tidak secara langsung bisa didiagnosis. Namun, jika kekurangan iodium terjadi dalam jangka waktu yang lama dan bersifat kumulatif maka bisa menyebabkan timbulnya GAKI salah satunya yakni terganggunya kecerdasan.
Pasar Besar Malang merupakan tempat dimana aktifitas jual beli lebih ramai dibandingkan dengan pasar-pasar lain di Kota Malang. Di Pasar Besar Malang peneliti menemukan garam beriodium yang tidak mencantumkan komposisinya. Setelah peneliti menguji kandungan iodiumnya ternyata kandungan iodiumnya tidak sesuai dengan SNI. Oleh karena itu, peneliti melakukan penetapan kadar iodium pada garam beriodium yang beredar di Pasar besar Malang.
Berdasarkan hasil penetapan kadar iodium pada garam beriodium yang beredar di Pasar Besar Malang. Dari tujuh merk yang beredar hanya satu merk yang tidak memenuhi SNI yakni merk B, sedangkan yang enam merk lainnya memasuki SNI. Selain itu dari masing-masing merk, hanya merk G yang kandungan iodiumnya hampir sama setiap batchnya.
KATA PENGANTAR
Puji syukur kehadirat Tuhan Yang Maha Esa yang telah memberikan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan Karya Tulis Ilmiah yang berjudul “Penetapan Kadar Iodium Pada Garam Dapur Di Pasar Besar Malang Dengan Metode Spektrofotometri”tepat pada waktunya.
Adapun tujuan Karya Tulis Ilmiah ini adalah sebagai persyaratan untuk menyelesaikan program Diploma III di Akademi Analis Farmasi dan Makanan Putra Indonesia Malang.
Sehubungan dengan selesainya penulisan Karya Tulis Ilmiah ini, penulis mengucapkan terima kasih kepada :
1. Bapak Hendyk Krisna Dani, S.Si selaku Direktur Akademi Analis Farmasi dan Makanan Putra Indonesia Malang.
2. Ibu Dra. Wahyu Wuryandari, M. Pd. selaku Dosen Pembimbing
3. Bapak dan Ibu Dosen Akademi Analis Farmasi dan Makanan serta semua staff
4. Ibu Misgiati, A.Md, M.Pd selaku Dosen Penguji I 5. Bapak Erik Widiarto, S.Si. selaku Dosen Penguji II 6. Kedua orang tua yang memberikan do’a dan motivasi.
7. Teman-teman mahasiswa, dan semua pihak yang telah memberikan bimbingan, bantuan, dan arahan secara langsung maupun secara tidak langsung.
Penulis menyadari sepenuhnya bahwa Karya Tulis Ilmiah ini masih mempunyai beberapa kekurangan. Oleh karena itu, kritik dan saran akan sangat diharapkan.
Semoga Karya Tulis Ilmiah ini dapat berguna dan bermanfaat.
Malang, Agustus 2012
DAFTAR ISI HALAMAN PERSETUJUAN PEMBIMBING
ABSTRAK ... i
KATA PENGANTAR... ... ii
DAFTAR ISI ... iii
DAFTAR TABEL ... v DAFTAR GAMBAR ... vi BAB 1 PENDAHULUAN 1.1 Latar Belakang ... 1 1.2 Rumusan Masalah ... 4 1.3 Tujuan Penelitian ... 4 1.4 Manfaat Penelitian ... 4 1.5 Asumsi Penelitian ... 5
1.6 Ruang Lingkup dan Ketebatasan Penelitian ... 5
1.7 Definisi Istilah ... 6
BAB II TINJAUAN PUSTAKA 2.1 Garam... 7
2.3 Garam Beriodium ... 16
2.4 Spektrofotometri UV – Vis ... 17
2.5 Instrumentasi ... 20
2.6 Akibat Kekurangan dan Kelebihan Iodium ... 23
2.7 Kerangka Teori ... 26
2.8 Hipotesis ... 28
BAB III METODE PENELITIAN 3.1 Populasi dan Sampel ... 29
3.2 Variable Penelitian ... 30
3.3 Prosedur Penelitian ... 30
3.4 Analisis Data ... 32
BAB IV HASIL PENELITIAN DAN PEMBAHASAN 4.1 Penentuan Panjang Gelombang Maksimum ... 36
4.2 Kurva Kalibrasi larutan Standart KIO3 ... 37
4.3 Konsentrasi dan Kadar KIO3 dalam garam Beriodium ... 38
BAB V PENUTUP 5.1 Kesimpulan ... 43
DAFTAR RUJUKAN
DAFTAR TABEL
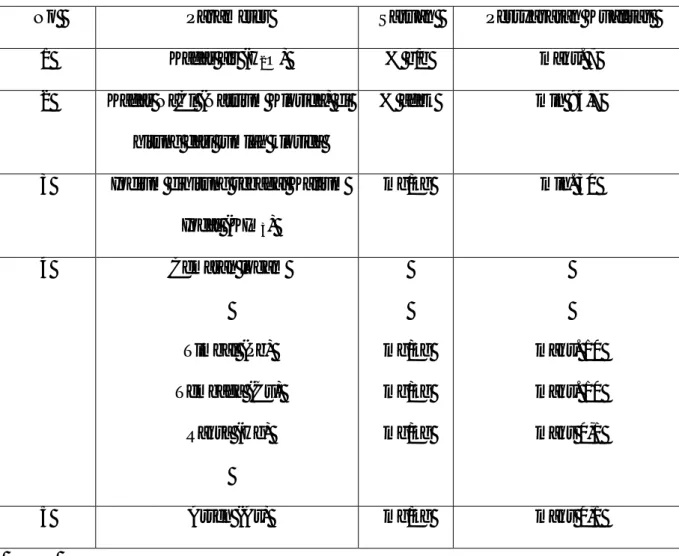
Tabel 1 SNI Garam Dapur ... 15
Tabel 2 Spektrum tampak dan warna-warna komplement ... 17
Tabel 3 Penentuan Panjang Gelombang ... 36
Tabel 4 Kurva Kalibrasi Larutan Standart KIO3 ... 37
DAFTAR GAMBAR
Gambar 1 Diagram spektrofotometri ... 19
Gambar 2 Hubungan antara absorbansi dan konsentrasi ... 32
Gambar 3 Skema Pembuatan Larutan Standar KIO3untukPembuatan Kurva Kalibrasi……… 33 Gambar 4 Skema Penentuan Konsentrasi dan Kadar KIO
3 Dalam Garam .
BAB I
PENDAHULUAN
1.1 Latar Belakang
Pada awalnya garam dapur hanya digunakan sebagai bahan tambahan pangan biasa yaitu sebagai perasa pada makanan. Lambat laun di Indonesia garam dapur digunakan pemerintah sebagai media untuk menanggulangi masalah gangguan akibat kurang iodium (GAKI). Yakni dengan penambahan iodium pada garam dapur yang dikenal dengan garam beriodium. Pemilihan garam dapur sebagai media dalam menanggulangi GAKI didasarkan atas mudah, murah dan berkesinambungan sehingga dapat dikonsumsi untuk mengatasi kekurangan iodium. Untuk kepentingan penanggulangan GAKI pemerintah membuat peraturan agar semua produsen garam beriodium menambahkan iodium pada garam dapur. Hal ini tercantum pada Peraturan menteri dalam negeri nomor 63 tahun 2010 tentang pedoman penanggulangan GAKI, bahwa garam beriodium yang beredar harus sesuai dengan SNI.
Iodium merupakan salah satu mineral penting bagi pertumbuhan badan dan perkembangan otak(buletin POM,2003). Iodium juga sangat berperan dalam pembentukan hormon tiroid yang berfungsi untuk mengontrol laju metabolisme dasar dan reproduksi (Casey, dkk, 1995; Hetsel, dkk, 1986). Gangguan akibat kurang iodium (GAKI) yang paling banyak dikenal yakni pembesaran kelenjar gondok dan kretin(kerdil) (buletin POM,2003). Hal ini dikarenakan konsentrasi hormon tiroid pada kelenjar menurun dan hormon perangsang tiroid meningkat agar kelenjar tiroid mampu menyerap lebih banyak iodium, bila kekurangan terus
berlanjut maka sel kelenjar tiroid membesar dalam usaha meningkatkan pengambilan iodium oleh kelenjar tersebut. Selain itu, kekurangan iodium tidak hanya menyebabkan gondok tetapi juga anak-anak yang mengalami kekurangan iodium akan terganggu kecerdasannya (Ali Khomsan, 2004). Melihat besarnya dampak dari GAKI maka perlu standar berskala nasional yang mengatur kadar iodium pada garam sehingga program Pemerintah menanggulangi GAKI bisa terlaksana.
Standar yang digunakan untuk mengatur kadar iodium pada garam yaitu SNI. Standar Nasional Indonesia( SNI) adalah satu-satunya standar yang berlaku secara nasional di Indonesia. SNI dirumuskan oleh Panitia Teknis dan ditetapkan oleh BSN (badan standarisasi nasional)(sumber Strategi BSN 2006-2009). Standar untuk garam beriodium tertera pada (SNI) No. 01-3556-2000. Yakni mengandung kadar iodium 30-80 mg/kg. Jika kadar iodium pada garam sesuai SNI maka terjadinya GAKI dapat dihindari. Oleh karena itu, garam beriodium yang beredar di pasar dan toko harus sesuai dengan SNI.
Pembuatan garam beriodium yakni dengan cara memurnikan garam terlebih dahulu kemudian menambahkan senyawa iodium kedalam garam. Iodisasi garam dilakukan dengan penambahan zat iodium berupa senyawa Kalium Iodat (KIO3) dengan kadar antara 30 – 80 ppm (mg/kg) kedalam garam secara mekanis dimana perbandingan KIO3 dengan garam adalah 30 – 80 gram KIO3 per ton garam. Proses ini dilakukan setelah garam ditiriskan atau dikeringkan. Proses iodisasi dilakukan secara mekanis dan kontinu untuk menjamin homogenitas atau meratanya kandungan iodium dalam garam dapur. Kandungan iodium akan berkurang selama garam dikeringkan dalam oven, selama proses distribusi atau
pemasaran dan penyimpanan, maka kandungan kalium iodat saat di iodisasi seharusnya dibuat berlebih dari besarnya kandungan iodat yang dipersyaratkan. (Marihati dan A.M. Soengkawati, 2001:17)
Pasar Besar Malang merupakan tempat dimana aktifitas jual beli lebih ramai dibandingkan dengan pasar-pasar lain di Kota Malang. Di Pasar Besar Malang peneliti menemukan garam beriodium yang tidak mencantumkan komposisinya. Setelah peneliti menguji kandungan iodiumnya ternyata kandungan iodiumnya tidak sesuai dengan SNI. Oleh karena itu perlu dilakukan penetapan kadar iodium pada garam beriodium yang beredar di Pasar Besar Malang. Hal ini dilakukan sebagai tindakan preventif untuk mencegah terjadinya GAKI. GAKI memang tidak secara langsung bisa didiagnosis. Namun, jika kekurangan iodium terjadi dalam jangka waktu yang lama dan bersifat kumulatif maka bisa menyebabkan timbulnya GAKI salah satunya yakni terganggunya kecerdasan.
Penetapan kadar iodium dapat dilakukan beberapa cara salah satunya yakni penetapan kadar iodium menggunakan metode spektrofotometri. Metode spektrofotometri yang digunakan yakni spektrofotometri UV-Vis.
1.2 Rumusan Masalah
1.2.1 Berapakah kadar iodium pada garam beriodium yang beredear di Pasar Besar Malang?
1.2.2 Apakah kadar iodium pada garam beriodium yang beredar di Pasar Besar Malang sesuai dengan SNI?
1.3 Tujuan Penelitaan
1.3.1 Untuk mengetahui kadar iodium pada garam yang beredar di Pasar besar Malang
1.3.2 Untuk mengetahui apakah kadar iodium pada garam di Pasar Besar Malang sesuai dengan SNI atau tidak.
1.4 Manfaat Penelitian
Adapun manfaat penelitian ini adalah sebagai berikut : 1.4.1 Bagi Institusi
Informasi yang didapatkan dari penelitian ini dapat menambah data serta referensi baru bagi institusi. Jadi, Karya Tulis Ilmiah pada tahun berikutnya dapat diperoleh hasil yang lebih maksimal.
1.4.2 Bagi Peneliti
Peneliti dapat mengaplikasikan pendidikan yang telah diterima selama tiga tahun. Sehingga bisa digunakan untuk mengukur kemampuan bila akan bekerja disuatu instansi misalnya BPOM maupun bekerja di industri.
1.4.3 Bagi Masyarakat
Masyarakat dapat mengetahui mutu dari garam beriodium yang beredar di Pasar Besar Malang
1.5 Asumsi Penelitian
1.5.1 Pasar Besar Malang pusat penyebaran garam beriodium terbesar di Kota Malang
1.5.2 Semua penjual garam dapur di Indonesia memberikan iodium pada garam 1.5.3 Penetapan kadar iodium pada garam dapat dilakukan dengan metode
Spektrofotometri UV-Vis.
1.6 Ruang Lingkup dan Keterbatasan Masalah
Adapun ruang lingkup dan keterbatasan masalah yaitu sebagai berikut: 16.1 Ruang Lingkup
Ruang lingkup pada penelitian ini yakni pengambilan sampel dilakukan di Pasar Besar Malang. Peneliti hanya melakukan penetapan kadar iodium pada garam beriodium dikawasan Malang.
16.2 Keterbatasan Masalah
Penelitian ini ditekankan pada penetapan kadar iodium yang ada pada garam. Untuk zat pengotor dan bahan tambahan tidak dilakukan identifikasi.
1.7 Definisi Istilah
Hormon tiroid: hasil sekresi dari kelenjar tiroid yang sangat berperan dalam metabolisme tubuh.
Metabolisme: jumlah keseluruhan reaksi kimia, fisik dan pengubahan energi dalam tubuh yang menopang dan mempertahankan hidup.
Kadar: tingkat kemurnian suatu benda.
Garam beriodium:produk bahan makanan yang komponen utamanya natrium klorida (NaCl) dengan penambahan kalium iodat (KIO3)
BAB II
TINJAUAN PUSTAKA
2.1 Garam
2.1.1 Pengertian Garam
Secara fisik, garam dapur adalah benda padatan berwarna putih berbentuk kristal yang merupakan kumpulan senyawa dengan bagian terbesar Natrium Chlorida (>80%) serta contoh senyawa lainnya seperti Magnesium Chlorida, Magnesium Sulfat, Calsium Chlorida, dan lain-lain. Garam mempunyai sifat/ karakteristik higroskopis yang berarti mudah menyerap air (burhanuddin 2001).
Garam dapur untuk keperluan masak dan biasanya diperkaya dengan unsur iodin (dengan menambahkan minimal 30mg KIO3 per kg NaCl) padatan Kristal berwarna putih, berasa asin, higroskopis, bila mengandung MgCl2 menjadi berasa agak pahit. Garam dapur digunakan terutama sebagai bumbu penting untuk makanan. Pada industri digunakan sebagai bahan baku pembuatan logam Na dan NaOH ( bahan untuk pembuatan keramik, kaca dan pupuk), sebagai zat pengawet (Mulyono,2009).
Menurut produsennya garam dapur biasanya dibedakan atas garam rakyat dan garam pemerintah. Garam rakyat adalah garam yang diproduksi oleh petani garam. Garam rakyat biasanya diproduksi oleh penduduk tepi pantai atau penduduk di daerah sumber air asin. Sedangkan garam Pemerintah adalah garam yang diproduksi oleh pabrik-pabrik garam. Berdasarkan bentuknya garam dibedakan atas garam yang berbentuk kristal dan garam briket yang dicetak.
2.1.2 Sifat-Sifat Garam Dapur
Sifat garam dapur:
a) Garam dapur sebagian besar berasal dari penguapan air laut dan sedikitnya mengandung 95% natrium klorida.
b) Merupakan kristal berwarna putih dan berbentuk kubus.
c) Mudah larut dalam air.
d) Pada suhu dibawah 00C garam dapur mempunyai rumus NaCl.H2O
e) Pada suhu normal (150C) larutan jenuh dari garam dapur mempunyai berat jenis 1, 204 dan mengandung NaCl 26, 4%.
f) Mudah rapuh karena peristiwa perubahan bentuk dan kehilangan air kristal sehingga mudah retak (Suryo Mursandi, 1986: 2).
2.1.3 Jenis dan kegunaan garam
2.1.3.1 Garam Industri
Garam dengan kadar NaCl yaitu 97 % dengan kandungan impurities (sulfat, magnesium dan kalsium serta kotoran lainnya) yang sangat kecil. kebutuhan garam industri antara lain untuk industri perminyakan, pembuatan soda dan chlor, penyamakan kulit dan pharmaceutical salt.
2.1.3.2 Garam Konsumsi
Garam dengan kadar NaCl, yaitu 97 % atas dasar bahan kering (dry basis), kandungan impuritis (sulfat, magnesium dan kalsium), yaitu 2%, dan kotoran
lainnya (lumpur, pasir), yaitu 1% serta kadar air maksimal yaitu 7%. Kelompok kebutuhan garam konsumsi antara lain untuk konsumsi rumah tangga, industri makanan, industri minyak goreng, industri pengasinan dan pengawaten ikan (Burhanuddin, 2001).
2.1.3.3 Garam Pengawetan
Garam biasa ditambahkan pada proses pengolahan pangan tertentu. Penambahan garam tersebut bertujuan untuk mendapatkan kondisi tertentu yang memungkinkan enzim atau mikroorganisme yang tahan garam (halotoleran) bereaksi menghasilkan produk makanan dengan karakteristik tertentu.
Kadar garam yang tinggi menyebabkan mikroorganisme yang tidak tahan terhadap garam akan mati. Kondisi ini juga memungkinkan mikroorganisme yang tahan garam dapat tumbuh. Pada kondisi tertentu penambahan garam berfungsi mengawetkan karena kadar garam yang tinggi menghasilkan tekanan osmotik yang tinggi dan aktivitas air rendah. Kondisi ekstrim ini menyebabkan kebanyakan mikroorganisme tidak dapat hidup. Pengolahan dengan garam biasanya merupakan kombinasi dengan pengolahan yang lain seperti fermentasi dan enzimatis. Contoh pengolahan pangan dengan garam adalah pengolahan acar (pickle), pembuatan kecap ikan, pembuatan daging kering, dan pembuatan keju(Estiasih, 2009).
2.1.4 Proses Pembuatan Garam Dapur
Pada umumnya pembuatan garam dapur di Indonesia menggunakan sinar matahari untuk penguapan. Hanya beberapa daerah yang penguapannya dengan
menggunakan pemanasan api dengan kayu bakar atau bahan bakar minyak seperti Aceh. Proses pembuatan garam di Indonesia di golongkan 4 macam, yaitu :
2.1.4.1 Proses penggaraman yang digunakan PN Garam
PN Garam menggunakan air laut untuk raw material, dan penguapannya 100 persen menggunakan tenaga matahari yang dibantu angin.
2.1.4.2 Proses penggaraman rakyat
Proses penggaraman rakyat hampir sama dengan proses PN Garam. Tetapi tidak ada standar prosesnya hingga hasilnya berbeda-beda, tergantung cara pembuatannya. Kebanyakan rakyat ingin lebih cepat mendapat hasil, sedangkan makin cepat prosesnya makin jelek mutu garam yang diperoleh.
2.1.4.3 Proses penggaraman lain
Proses penggaraman lain misalnya di Aceh semua dikerjakan oleh rakyat. Prosesnya agak unik, keunikan ini mungkin disebabkan karena tanah tempat penggaraman (tanah pesisir Aceh) merupakan tanah pasir yang sedikit sekali mengandung tanah liat dan keadaan iklimnya yang tidak menentu. Dalam musim kemarau, daerah Aceh masih relatif basah, karena masih sering hujan. Karena sinar matahari dan dibantu adanya angin akan mengeringkan tanah pasir tersebut sehingga tanah mempunyai daya untuk mengisap air disekitarnya. Maka air asin dari laut maupun air asin dari kanal-kanal yang sengaja dibuat di daerah penggaraman merembes ke tanah pasir tadi. Karena pemanasan dari sinar matahari dan adanya angin berlangsung terus, maka air dalam pasir tersebut
menguap, sehingga terjadilah kristal-kristal garam yang kecil-kecil pada tanah pasir tersebut, kristal-kristal inilah yang nantinya dibuat garam.
2.1.4.4 Proses garam tanah
Di Jawa Tengah ada 2 daerah yang dua-duanya terletak tidak jauh dari kota Purwodadi yaitu desa Jono dan Kelurahan Kuwu. Kedua daerah ini ada pembuatan garam yang tidak dibuat dari air laut, karena letaknya memang jauh dari laut (BPPI, 1984; 7).
2.1.3 Permasalahan Garam beriodium
Permasalahan yang ada pada garam beriodium meliputi:
1. Perbandingan KIO3dan garam sangat kecil yaitu 30: 1. 000. 000 sehingga sukar dicapai hasil yang benar-benar homogen pada saat iodisasi.
2. Garam non iodium masih banyak beredar di masyarakat 3. Pendistribusian garam beriodium masih belum merata
2.2 Iodium
Iodium merupakan bagian/unsur penting dari hormon tiroid, tetraiodotironin (tiroksin) dan triiodotironin. Keadaan defisiensi mengakibatkan terjadinya hyperplasia dan hipertrofi kelenjar tiroid (goiter endemik). Penyakit ini terjadi didaerah mana tanahnya kurang mengandung iodium dan sering terjadi sebelum tersedianya garam meja beriodium (Gunawan, 2007).
Menurut Farmakope, Ed. IV (1994), Iodium mengandung tidak kurang dari 99,8% dan tidak lebih dari 100,5%.
1. Pemerian : keping atau granul, berat, hitam keabu-abuan, bau khas, berkilau seperti metal.
2. Kelarutan : Sangat sukar larut dalam air, mudah larut dalam karbon disulfida, kloroform, eter, etanol, dan larutan iodida, agak sukar larut dalam gliserin.
3. Identifikasi :
a. Larutan dalam kloroform P (1 dalam 1000), dalam karbon tetraklorida P dan dalam karbon disulfida P berwarna lembayung.
b. Pada larutan jenuh, tambahkan kanji kalium iodida LP, terjadi warna biru. Bila campuran didihkan maka warna akan hilang, tetapi timbul lagi setelah campuran dingin, kecuali dididihkan dalam waktu lama. 4. Sisa penguapan : tidak lebih dari 0,05 %, lakukan penetapan menggunakan 5,0 gram zat dalam cawan porselen yang telah ditara, panaskan diatas tangas uap hingga iodium habis menguap, dan keringkan pada suhu 1050C selama 1 jam.
5. Klorida atau bromida : tidak lebih dari 0,028 % dihitung sebagai klorida, lakukan penetapan sebagai berikut: gerus 250 mg serbuk halus dengan 10 ml air, saring. Tambahkan tetes demi tetes asam sulfit bebas klorida P, yang telah diencerkan dengan beberapa bagian volume air, hingga warna iodium benar-benar hilang. Tambahkan 5 ml ammonium hidroksida 6 N, kemudian 5 ml perak nitrat LP sedikit demi sedikit. Saring, asamkan filtrate dengan asam nitrat P. larutan yang terjadi tidak lebih keruh dari larutan pembanding yang dibuat dengan jumlah
pereaksi yang sama, ditambah dengan 0,10 ml asam klorida 0,020 N, tanpa penambahan asam sulfit P.
6. Penetapan kadar : serbukkan dan timbang seksama lebih kurang 500 mg dalam labu bersumbat kaca yang telah ditara, tambahkan 1 gram kalium iodida P yang dilarutkan dalam 5 ml air. Encerkan dengan air hingga lebih kurang 50 ml, tambahkan 1 ml asam klorida 3 N. Titrasi dengan natrium tiosulfat 0,1 N LV, menggunakan 3 ml indicator kanji LP.
Iodium diserap oleh usus halus bagian atas dan lambung, dan 1/3 hingga ½ ditangkap oleh kelenjar tiroid, sisanya dikeluarkan lewat air kemih. Di taksir 95 % iodium tubuh tersimpan dalam kelenjar tiroid, sisanya dalam sirkulasi (0,04 – 0,57)% dan jaringan. Dalam keadaan keseimbangan (homoeostasis) masukan iodium sehari dapat diperkirakan dengan mengukur jumlah iodium yang dikeluarkan air kemih perhari.
Kadar Iodium dalam tubuh dapat diperiksa dengan cara langsung maupun tidak langsung. Pemeriksaan langsung dengan cara menganalisis makanan duplikat yang terdapat dalam makanan seseorang. Sedangkan, untuk pemeriksaan tidak langsung dipakai dengan cara memeriksa kadar iodium dalam urin, dan dengan studi kinetik iodium. Selain itu banyak hasil observasi yang menunjukkan bahwa defisiensi iodium memang merupakan penyebab utama endemik ini, namun pada beberapa keadaan defisiensi iodium merupakan faktor yang mempermudah bagi terjadinya gondok (Djokmoeljanto, 2006).
2.2.1 Sifat-sifat Iodium 2.2.1.1 Sifat Fisika
a) Pada temperatur biasa berupa zat padat yang mengkristal berbentuk keping-keping atau plat-plat rombis, berkilat seperti logam berwarna hitam kelabu serta bau khas yang menusuk.
b) Iodium mudah menyublim (uap iodium berwarna merah, sedangkan uap murni berwarna biru tua).
c) Iodium mempunyai berat atom 126, 93
d) Iodium mendidih pada suhu 1830C dengan titik lebur 1440C(Adang, 1977: 58)
2.2.1.2 Sifat Kimia
a) Molekul iodium terdiri dari atom (I2) tetapi jika dipanaskan di atas 5000C akan terurai menjadi 2 atom I-, menurut reaksi:
I2 (s) ↔2I- (g)
b) Iodium kurang reaktif terhadap hidrogen bila dibanding unsur halogen lainnya, tetapi sangat reaktif terhadap oksigen. Dengan logam-logam dan beberapa metalloid langsung dapat bersenyawa. Dengan fosfor, misalnya dapat membentuk tri ioda:
2P(s)+ 3I2 (g)→2PI3 (i)
c) Apabila gas dialirkan ke dalam larutan iodida maka terjadilah iodium. Reaksinya serupa dengan reaksi seng dengan asam klorida, hanya ionnya bermuatan negatif.
2KI (aq)+ Cl2 (g)→2KCl (aq)+ 2I- (aq) 2I-(aq)+ Cl2(g) →2Cl- (aq)+ I2 (aq)
(Adang, 1977: 58)
2.2.2 Proses Sintesa Iodium Dalam Tubuh
Iodium dalam tubuh digunakan untuk membantu pembuatan hormon pada kelenjar tiroid. Pada tahap pertama KIO3 yang masuk kedalam tubuh diabsorbsi dengan baik oleh usus halus. Kemudian kelenjar tiroid menarik iodida dari darah lalu dipekatkan disini sampai 25 kali dan dioksidasi oleh enzim peroksidase menjadi iod. Lalu iod ini secara enzimatis pula dipersenyawakan dengan asam amino tirosin menjadi mono- atai di-iodtirosin. Akhirnya zat-zat ini saling bersenyawa dan menghasilkan liotironin (T3) dan tiroksin (T4). Kemudian hormon-hormon pada kelenjar tiroid ini berfungsi meningkatkan metabolism sel dan penggunaan oksigen, selain itu juga mendorong sintesa protein didalam sel.
2.2.3 Manfaat Iodium
Iodium sebagai unsur penting dalam sintesa hormon tiroksin, yaitu suatu hormon yang dihasilkan oleh kelenjar tiroid yang sangat dibutuhkan untuk proses pertumbuhan, perkembangan, dan kecerdasan. Iodium juga sebagai pembentukan hormon kalsitonin, yang juga dihasilkan oleh kelenjar tiroid, berasal dari sel parafoli – kular (sel CO). hormon ini berperan aktif dalam metabolisme kalsium, maka harus selalu tersedia iodium yang cukup dan berkesinambungan (Djokomoeljanto, 2006).
2.3 Garam Beriodium
Garam dapur beriodium adalah produk makanan yang komponen utamanya natrium klorida (NaCl) dengan penambahan kalium iodat (KIO3). Kualitas garam beriodium mengacu kepada Standar Nasional Indonesia SNI 01-3556-2000 seperti tabel berikut:
Tabel 1. SNI Garam Dapur (01-3556-2000)
No Parameter Satuan Persyaratan Kualitas
1 Kadar air (H2O) % b/b maks. 7
2 Kadar NaCl (Natrium Klorida) di hitung dari jumlah klorida
% adbk min 94,7
3 Iodium dihitung sebagai Kalium Iodat (KIO3) mg/kg min. 30 4 Cemaran logam Timbal (Pb) Tembaga (Cu) Raksa (Hg) mg/kg mg/kg mg/kg maks. 10 maks. 10 maks 0,1
5 Arsen (As) mg/kg maks 0,1
Garam beriodium merupakan sumber iodium yang murah dan efisien. Selain itu iodium juga banyak didapatkan pada makanan laut. Iodium yang
dibutuhkan orang dewasa sekitar 1-2 μg/kgBB/hari. Di Amerika Serikat, kebutuhan harian iodium untuk anak-anak adalah 40-120 μg, dewasa 150 μg, untuk wanita hamil 220 μg, dan wanita menyusui 270 μg. makanan yang banyak mengandung iodium adalah makanan yang berasal dari laut, sedangkan sayuran dan daging sedikit mengandung iodium.
Cara yang praktis untuk memenuhi kebutuhan iodium, terutama untuk mereka yang bertempat tinggal dipegunungan yang jauh dari laut, yakni dengan menambahkan iodida pada garam dapur, yang sehari-harinya digunakan di meja makan (Gunawan, 2007). Hal ini disebabkan garam merupakan kebutuhan sehari-hari, tidak ada pengolahan makanan yang tidak menggunakan garam.
Hasil pemantauan Biro Pusat Statistik (BPS) terhadap garam konsumsi beriodium ditingkat rumah tangga sejak tahun 1997 sampai dengan 1999 dibagi dalam 3 kelompok yaitu (1) garam yang memenuhi syarat (kadar KIO3 > 30-80 ppm), (2) garam yang tidak memenuhi syarat (kadar KIO3 < 30 ppm), (3) garam yang tidak mengandung iodium (KIO3 0 ppm) (BRKP, 2001).
2.4 Spektrofotometri UV – Vis
Spektrofotometri UV–Vis adalah suatu metode analisis instrumental berdasarkan interaksi radiasi elektromagnetik dengan materi. Dimana radiasi elektromagnetiknya adalah sinar dengan daerah panjang gelombang UV–Vis, sedangkan materinya adalah molekul atau senyawa kimia.
Bila radiasi elektromagnetik pada daerah panjang gelombang UV–Vis melewati suatu molekul dan bila energi totalnya cukup, maka energi tersebut akan
diserap dan didalam molekul terjadi transisi elektronik yang disebut molekul itu tereksitasi.
2.4.1 Aspek Analisis Kuantitatif
Suatu senyawa kompleks bila dilewati sinar dengan panjang gelombang tertentu akan tampak berwarna. Hal ini terjadi karena sebagian sinar diserap dan sebagian lagi diteruskan atau ditransmisikan. Warna yang tampak dapat terjadi karena sebagian energi sinar digunakan untuk mentransmisikan elektron dari suatu orbital ke orbital yang lain yang energinya lebih tinggi, sehingga muncul warna yang spesifik.
Tabel 2. Spektrum tampak dan warna-warna komplementer
Panjang gelombang (nm) Warna sinar diserap Warna sinar diteruskan 400-435 435-480 480- 490 490-500 500-560 460-480 480-595 595-605 605-750 Ungu muda Biru Biru kehijauan Hijau kebiruan Hijau Hijau kekuningan Kuning Orange Merah Hijau kekuningan Kuning Orange Merah Ungu tua Ungu muda Biru Biru kehijauan Hijau kebiruan
Hukum Beer menyatakan bahwa absorbansi berbanding langsung dengan tebal larutan dan konsentrasi larutan. Rumus Beer ini dapat dijelaskan sebagai
berikut: bila suatu medium penyerap dibagi menjadi lapisan-lapisan imajiner yang sama tebalnya, kemudian suatu berkas sinar monokromatis dilewatkan pada medium tersebut maka sinar yang diteruskan intensitasnya berkurang.
Dari pernyataan diatas, Bouger, Lambert dan Beer membuat formula secara matematik hubungan antara transmitan atau absorban terhadap intensitas radiasi atau konsentrasi zat yang dianalisis dan tebal larutan yang mengabsorpsi sebagai:
T= = 10-Ɛ.c.b
A= log = .c.b
Dimana: T = persen transmitans
Io= intensitas radiasi yang datang It = intensitas radiasi yang diteruskan = absorbansi molar (Lt.mol-1 cm-1) c = konsentrasi (mol.Lt-1)
b = tebal larutan A= absorban
Persoalannya adalah bagaimana membaca rentang A dan T yang memenuhi syarat sehingga akan meminimumkan galat sistematik (galat individual).
Untuk pembacaan absorban (A) dan transmitan (T) pada daerah yang terbatas, kesalahan penentuan kadar hasil analisis dinyatakan sebagai:
Δ
Dari rumus tersebut dapat diperhitungkan kesalahan pembaca A atau T pada analisis dengan metode spektrofotometri UV-Vis. Pembaca A(0,2- 0,8) atau %T (15%-65%) akan memberikan presentase kesalahan analisis yang dapat diterima (0,5-1%), untuk T = 1%.
2.5 Instrumentasi
Instrumentasi yang digunakan untuk mempelajari absorbsi maupun emisi radiasi elektromagnetik sebagai fungsi panjang gelombang disebut spektrofotometer.
Diagram blok spektrofotometri UV-Vis seperti tersaji pada gambar.
Gambar 1. Diagram spektrofotometri 2.5.1 Sumber radiasi
Beberapa macam sumber radiasi yang dipakai pada spektrofotometer UV-Vis adalah lampu deuterium, lampu tungsten dan lampu merkuri. Sumber radiasi deuterium dapat dipakai pada panjang gelombang 190 nm sampai 380 nm (daerah ultraviolet terdekat), Sedangkan untuk sumber radiasi tungsten-iodine dipakai pada spektro UV-Vis sebagi sumber radiasi pada daerah pengukuran sinar tampak dengan rentangan panjang gelombang (380-900) nm. Untuk sumber radiasi merkuri dipakai untuk mengecek atau mengkalibrasi panjang gelombang pada
monokromator
Sumber radiasi Wadah Sampel
Visual display
detektor amplifier
spektrofotometer UV-vis pada daerah ultraviolet khususnya di sekitar panjang gelombang 365nm (365; 365,5 dan 366,3)nm dan sekaligus mengecek resolusi dari monokromator.
2.5.2 Monokromator
Monokromator adalah alat yang paling umum dipakai untuk menghasilkan berkas radiasi dengan satu panjang gelombang. Alat ini terdiri dari sistem optik untuk memisahkan sinar polikromatis menjadi sinar monokromatis. Monokromator terdiri dari serangkaian peralatan optik antara lain lensa cermin prisma atau grating.
2.5.3 Wadah sampel
Umumnya wadah sampel disebut sel atau kuvet, kuvet yang terbuat dari kuarsa baik untuk spektroskopi ultra violet maupun untuk spektroskopi sinar tampak. Sampel yang berbentuk cair ditempatkan dalam kuvet yang terbuat dari gelas atau kuartz dan diletakkan di antara monokromator dan detektor.
2.5.4 Detektor
Detektor mempunyai kegunaan untuk mendeteksi sampel, yang berperan mengubah energi sinar menjadi energi listrik. Untuk spektrofotometer UV-Vis detektor yang digunakan adalah photo sel atau suatu pelipat ganda photo yang mampu mengubah sinyal analitik radiasi elektromagnetik (foton) menjadi sinyal tegangan listrik. Energi listrik yang dihasilkan digunakan untuk menggerakkan jarum atau mengubah angka digital.
2.5.5 Amplifier
Amplifier ini berfungsi sebagai penguat sinyal listrik yang dihasilkan oleh detektor
2.5.6 Visual display
Sinyal listrik dari detektor biasanya diperkuat lalu direkam sebagai spektrum yang berbentuk puncak-puncak. Plot antara panjang gelombang dan absorbansi akan menghasilkan spektrum (Eko Sugiharto, 1990).
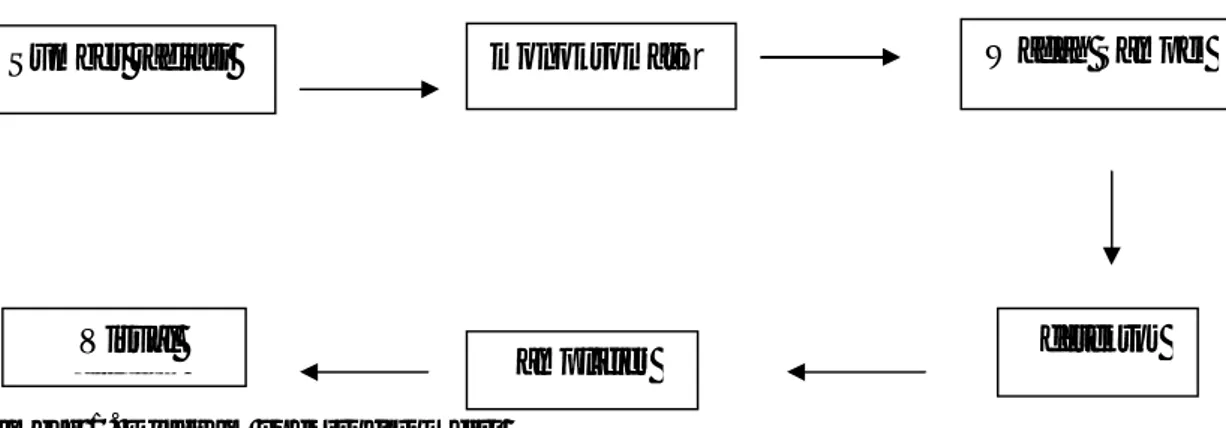
2.5.7 Tahapan Analisis Spektrofotometri Uv-Vis
Analisis dengan spektrofotometer Uv-Vis dilakukan dengan beberapa tahap, antara lain:
1. Pembuatan larutan baku induk dan baku kerja sampel
2. Optimasi panjang gelombang, dilakukan untuk menentukan panjang gelombang maksimum yang akan digunakan dalam pengukuran dengan spektrofotometer Uv-Vis dengan menggunakan salah satu larutan baku kerja sampel.
3. Penentuan absorbansi, dilakukan pada panjang gelombang maksimum Panjang gelombang yang digunakan untuk analisis kuantitatif adalah panjang gelombang yang mempunyai absorbansi maksimal. Ada beberapa alasan mengapa harus menggunakan panjang gelombang maksimal, yaitu: a. Pada panjang gelombang maksimal, kepekaannya juga maksimla
karena pada panjang gelombang maksimal tersebut, perubahan absorbansi untuk setiap satuan konsentrasi adalah yang paling besar.
b. Disekitar panjang gelombang maksimal, bentuk kurva absorbansi datar dan pada kondisi tersebut hukum lambert-beer akan terpenuhi
Jika dilakukan pengukuran ulang maka kealahan yang disebabkan oleh pemasangan ulang pnjang gelombang akan kecil sekali, ketika digunakan panjang gelombang maksimal (Rohman, Abdul, 2007).
2.6 Akibat Kekurangan dan Kelebihan Iodium 2.6.1 Hipofungsi Tiroid (Hipotiroidisme)
Hipotiroidisme bila hebat disebut miksedema, merupakan gangguan tiroid yang paling umum. Hampir seluruh dunia, hal ini disebabkan karena defisiensi iodium, pada daerah non-endemik dimana iodium cukup tersedia, umumnya disebabkan karena tiroiditis auto-imun yang kronik (tiroiditis Hashimoto). Penyakit ini ditandai oleh tingginya antibodi terhadap peroksidase tiroid di sirkulasi, dan mungkin juga dengan kadar trioglubulin yang tinggi mesti ini lebih jarang terjadi. Dapat juga terjadi hambatan antibodi terhadap reseptor TSH
(Thyroid Stimulating Hormone) sehingga terjadi eksaserbasi (perburukan)
hipotiroidisme.
Hipotiroidisme dengan goiter(pembesaran tiroid atau disebut penyakit
gondok) terjadi pada tiroiditis Hashimoto, atau bila ada gangguan sintesis hormon
tiroid yang hebat, bila penyakit ini bersifat ringan, gejala tidak nyata, sementara progresivitas penyakit dapat berjalan terus akibatnya gejala yang timbul berlebihan. Gambaran klinis pada pasien sangat spesifik, antara lain : muka tampak sangat ekspresif, membengkak, pucat, kulit dingin dan kering, kulit kepala bersisik, rambut kasar, kering dan mudah lepas, kuku jari menebal dan rapuh,
mungkin timbul edema, suara parau dengan nada rendah, bicaranya lambat, gangguan daya pikir, dan mungkin mengalami depresi, terjadi gejala gangguan saluran cerna, nafsu makan kurang, motilitas usus berkurang sehingga sering terjadi distensi abdominal dan konstipasi. Tonus otot kantung kemih juga berkurang sehingga mudah terjadi retensi urin. Pada pasien wanita dapat mengalami gangguan haid (Gunawan, 2007).
2.6.1.1 Konsep Gangguan Akibat Kekurangan Iodium (GAKI)
Gondok endemik hingga kini masih merupakan masalah kesehatan masyarakat yang penting di Indonesia maupun di negara berkembang. Dahulu hanya terfokus pada gondok endemik saja, sekarang lebih memfokuskan pada masalah gangguan yang lebih luas yang digabung dalam GAKI atau IDD (Gangguan Akibat Kekurangan Iodium, Iodine Deficiency Disorders), dimana akibat defisiensi iodium merupakan satu spektrum luas dan mengenai semua segmen usia, dari fetus hingga dewasa. Dengan demikian jelaslah bahwa gondok hanya sebagian kecil saja dari spektrum GAKI.
Dengan demikian kepentingan klinisnya tidak saja didasarkan atas akibat desakan mekanis yang ditimbulkan oleh gondok, tetapi justru gangguan fungsi lain yang dapat dan sering menyertainya seperti gangguan perkembangan mental, rendahnya IQ, hipotiroidisme dan kretinisme. Semua gangguan pada populasi tersebut akan tercegah dengan masukan iodium cukup pada penduduknya (Djokomoeljanto, 2006).
2.6.2 Hiperfungsi Tiroid (Hipertiroidisme)
Tiroksikosis adalah keadaan yang disebabkan oleh meningkatnya hormon tiroid bebas dalam darah. Sedangkan, hipertiroidisme adalah keadaan dimana produksi dan sekresi hormon tiroid meningkat akibat hiperfungsi kelenjar tiroid. Hampir semua keluhan dan gejala tirotoksikosis terjadi karena pembentukan panas yang berlebihan, peningkatan aktivitas motorik dan aktivitas saraf simpilis. Kulit kemerahan, panas, lembab, otot lemah dan terlihat tremor, frekuensi denyut nadi dan jantung cepat. Semua ini menyebabkan nafsu makan bertambah, dan bila kebutuhan ini tidak dipenuhi maka berat badan akan menurun. Mungkin pasien akan mengeluh sukar tidur, cemas, dan gelisah, tidak tahan hawa panas, dan peristaltik usus meningkat. Tiroksikosis yang tidak terdiagnosis setelah berlangsung lama atau terapinya tidak maksimal, dapat mengalami miopatia, atau osteoporosis akibat peningkatan bone-turnover (Djokomoeljanto, 2006 ).
2.7 Kerangka Teori
Garam dapur yang beredar
Akibat kelebihan dan kekurangan iodium
Tidak mencantumkan komposisi dengan jelas sesuai dengan SNI
Metode spektrofotometri Uv-Vis untuk penetapan kadar iodium
dalam garam dapur Kandungan iodiumnya tidak
sesuai dengan SNI
KIO3 dalam
Garam dapur beriodium adalah produk bahan makanan yang komponen utamanya natrium klorida (NaCl) dengan penambahan kalium iodat (KIO3). Garam beriodium yang beredar di masyarakat harus sesuai dengan SNI, yaitu harus mencantumkan label sehingga bisa diketahui komposisi dan kandungan iodiumnya. Kandungan iodium pada garam beriodium pada SNI yakni (30-80)ppm. Akan tetapi masih banyak garam beriodium yang beredar dimasyarakat berlabel tetapi tidak mencantumkan komposisi sesuai dengan SNI. Oleh karena itu, diperlukan penetapan kadar iodium pada garam beriodium, apakah kandungan iodiumnya sesuai dengan SNI atau tidak. Hal ini dilakukan sebagai tindakan preventif mencegah timbulnya GAKI. GAKI memang tidak secara langsung bisa didiagnosis. Namun, jika kekurangan iodium terjadi dalam jangka waktu yang lama dan bersifat kumulatif maka bisa menyebabkan timbulnya GAKI salah satunya yakni terganggunya kecerdasan.
Iodium merupakan senyawa yang diperlukan oleh tubuh untuk memproduksi hormon tiroid. Hormon tiroid berfungsi mengontrol metabolisme dasar dan reproduksi. Kekurangan iodium dapat mengakibatkan terjadinya gondok dan kretin(kerdil). Bila hal ini terjadi secara terus-menerus dapat mengganggu kecerdasan. Selain itu, kelebihan iodium juga dapat menyebabkan meningkatnya produksi dan sekresi hormon tiroid sehingga hormon tiroid dalam darah meningkat. Bila hal ini tidak terdiagnosis setelah berlangsung lama dapat mengakibatkan osteoporosis.
Dalam garam dapur senyawa iodium yang diiodisasi berupa KIO3. Dalam keadaan kering KIO 3 sangat stabil. Iodisasi tidak ditambahkan I2 murni karena I2
mempunyai sifat menyublim dan tidak stabil. Dengan demikian senyawa iodium yang ditambahkan berupa garam KIO3.
Untuk mengetahui kadar iodium dalam garam diperlukan uji secara kuantitatif. Uji kadar iodium ada beberapa cara yaitu Titrasi dan Spektrofotometri Visible. Spektrofotometri Visible memiliki ketelitian yang lebih tinggi daripada metode titrasi oleh karena itu dalam penelitian ini menggunakan metode spektrofotometri visible. Prinsip dari spektrofotometri yakni menggunakan sinar atau radiasi untuk mengetahui absorbansi suatu senyawa. Senyawa yang diuji dengan spektrofotometri visible harus senyawa yang mempunyai warna. Sinar atau radiasi jika mengenai larutan maka akan diteruskan(Transmitan) atau diserap(Absorbansi). Pada Spektrofotometri sinar yang diteruskan berbanding terbalik dengan sinar yang diserap. Hasil pembacaan dari spektrofotometri visible yakni berupa Transmitan (T). Transmitan yang diperoleh digunakan untuk menghitung nilai Absorbansi (A). Hukum Lambert Beer menyatakan A= -Log T. Kemudian, nilai Absorbansi yang diperoleh digunakan untuk menghitung kadar dari sampel. Dengan demikian, kadar iodium bisa ditentukan menggunakan spektrofotometri visible karena iodium merupakan senyawa yang berwarna.
2.8 Hipotesa
Dimungkinkan beberapa garam beriodium yang beredar di pasar tidak sesuai dengan SNI. Sehingga perlu adanyapenetapan kadar iodium pada garam beriodium yang beredar di pasar.
BAB III
METODE PENELITIAN
3.1 Populasi dan Sampel
3.1.1 Populasi dan Sampel
Populasi adalah keseluruhan objek penelitian (Suharsimi Arikunto, 1996: 115). Sedangkan sampel adalah sebagian atau wakil dari populasi yang diteliti (Suharsimi Arikunto, 1996: 117). Populasi dan sampel dalam penelitian ini adalah tujuh merk garam dapur yang beredar di pasar besar malang.
3.2 Metode Sampling
Sampel yang diambil adalah tujuh garam dapur yang dijual di pasar besar Malang. Tiap merk garam dapur diwakili oleh lima batch yang berbeda. Hal ini dilakukan agar diperoleh data yang valid. Tiap batch dilakukan uji dengan pengulangan tiga kali.
Sampel yang diambil yakni dari toko peracangan. Dengan asumsi kebanyakan toko peracangan menjual garam dengan berbagai merk dan orang lebih sering membeli garam di toko tersebut. Hal pertama yang dilakukan yakni survey garam yang dijual di semua toko peracangan. Setelah didapat tujuh merk yang berbeda. Kemudian tiap merk garam yang berbeda dilakukan pembelian sebanyak lima kali dengan batch yang berbeda. Bila batch tidak tercantum dilakukan survey berapa hari sekali pedagang tersebut melakukan stok garam.
3.3 Variabel Penelitian
Variabel dalam penelitian ini adalah:
3.3.1 Variabel terikat, yaitu variabel yang menjadikan titik pusat penelitian. Variabel dalam penelitian ini adalah kadar iodium dalam garam dapur.
3.3.2 Variabel bebas, yaitu variabel yang akan diselidiki pengaruhnya terhadap variabel terikat.
Variable bebas dalam penelitian ini yakni berbagai merk Garam dapur yang beredar di pasar malang.
3.4 Prosedur Penelitian
Adapun alat dan bahan yang digunakan adalah sebagai berikut: 3.3.1 Alat-alat yang digunakan sebagai berikut:
Neraca digital Spektrofotometer UV-Vis Pipet volume Botol timbang Beaker glass Labu ukur Pipet tetes Corong gelas Gelas pengaduk Kuvet
3.3.2 Bahan-bahan yang digunakan yaitu: Garam dapur yang beredar di pasar
KIO3 HNO3 KI
Aquadest
3.4.3 Pembuatan Larutan yang diperlukan
3.4.3.1 Larutan induk KIO3 100 ppm 500ml
Menimbang sebanyak 50 mg KIO3 dimasukan dalam labu takar 500ml kemudian diencerkan dengan aquadest sampai tanda batas.
3.4.3.2 Larutan HNO3 1M
Memipet sebanyak 36 ml HNO3 dimasukan dalam labu takar 500ml, kemudian diencerkan dengan aquadest samapai tanda batas.
3.4.3.3 Larutan KI 1M
Menimbang sebanyak 166 g KI dimasukkan dalam labu takar 1000ml, kemudian diencerkan dengan aquadest sampai tanda.
3.4.4 Cara kerja
3.4.4.1 Penentuan Panjang Gelombang Maksimum
Penentuan panjang gelonbang yakni dengan cara menggunakan salah satu konsentrasi, dari larutan yang akan digunakan untuk menentukan kurva kalibrasi. Kemudian diukur absorbansinya dengan panjang gelombang yang berbeda-beda yakni pada rentang 435-480. Absorbansi tertinggi digunakan sebagai panjang gelombang.
3.4.4.2 Penentuan Kurva Kalibrasi Larutan KIO3
Larutan KIO3100 ppm diambil 0ml ; 1ml add 50; 1ml add 25; 2ml add 25, 5ml add 50; 3ml add 25, masing-masing ditambah 1 mL HNO31 M dan 2 mL KI 1M (disesuaikan dengan jumlah add) sebelum di ad kan sampai tanda batas, dan pada akhirnya didapatkan larutan dengan konsentrasi 0 ppm, 2 ppm, 4 ppm, 8 ppm, 10 ppm, dan 12 ppm. Kemudian ditentukan absorbansinya pada panjang gelombang yang telah ditentukan dan membuat kurva kalibrasi larutan standar antara absorbansi (Y) dan Konsentrasi (X).
3.4.4.3 Penentuan konsentrasi dan Kadar KIO3 dalam Garam Beriodium
Menimbang 3 gram garam beriodium dilarutkan dengan 25 ml aquadest,kemudian ditambah 2,5 mL HNO31M dan 5 mL KI 1M. Kemudian melakukan analisis dengan spektrofotometer UV-Vis pada penjang gelombang 435 nm, dan diperoleh data absorbansi, dihitung konsentrasi dan kadar KIO3dalam garam beriodium.
3.5 Analisis Data
Berdasarkan hasil penelitian akan didapatkan data analisis garam dapur yang berupa data tentang penentuan panjang gelombang maksimum, penentuan kurva kalibrasi larutan KIO3 serta penentuan konsentrasi dan kadar KIO3dalam garam beriodium.
3.4.1 Penentuan Panjang Gelombang Maksimum dan Penentuan Kurva Kalibrasi Larutan KIO3
Membuat larutan dengan konsentrasi tertentu kemudian mengukur absorbansinya dengan panjang gelombang yang berbeda-beda menggunakan spektrofotometer UV-Vis. Absorbansi dengan nilai paling tinggi dijadikan sebagai panjang gelombang maksimum yang kemudian digunakan untuk menentukan kurva kalibrasi larutan standar.
3.4.2 Penentuan Konsentrasi dan Kadar KIO3dalam garam beriodium
Konsentrasi KIO3 dalam larutan ditentukan dengan menggunakan spektrofotometer UV-Vis dan diperoleh absorbansinya. Hasil absorbansinya dimasukkan ke dalam persamaan kurva kalibrasi larutan standar, sehingga konsentrasi dan kadar KIO3dapat ditentukan.
Gambar 2. Hubungan antara absorbansi dan konsentrasi
Hukum Beer menyatakan bahwa absorbansi berbanding langsung dengan tebal larutan dan konsentrasi larutan. Semakin besar konsentrasi larutan maka nilai absorbansi larutan tersebut juga semakin besar.
Absorbansi
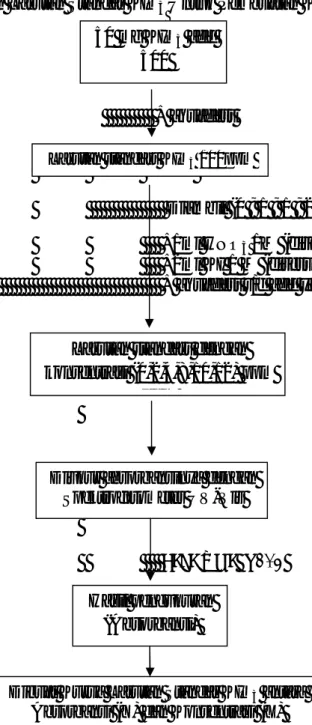
Skema Cara Kerja
Pembuatan Larutan Standar KIO3Untuk Pembuatan Kurva Kalibrasi
=
+ aquadest
Diambil (0 ; 1 ; 1 ; 2 ; 5 ; 3 ml)
+1ml HNO3 1M (disesuaikan jumlah add) +2ml KI 1 M (disesuaikan jumlah add) + aquadest s/d add yang ditentukan
Pada λ maks 435
Gambar 3. Skema Pembuatan Larutan Standar KIO3 untuk Pembuatan kurva kalibrasi
50 mg KIO3 add 500
Larutan standart KIO3 100ppm
Diukur absorbansinya dengan Spektrofotometer UV-Vis
Hasil pengukuran (Absorbansi) Larutan standart dengan konsentrasi (0,2,4,8,10,12) ppm
ppm
Dibuat Kurva Larutan Standar KIO3 antara Absorbansi (Y) dan Konsentrasi (X)
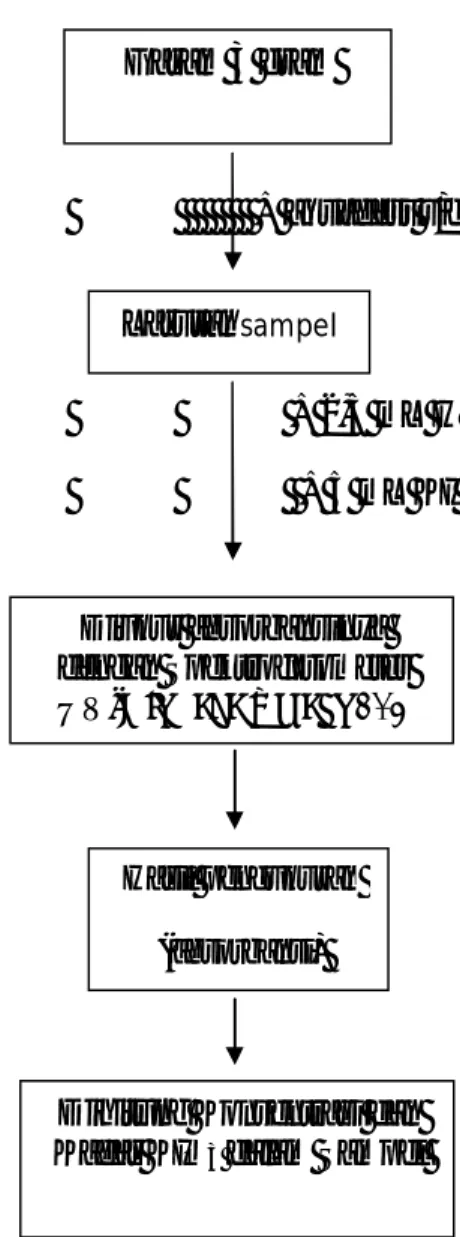
Skema Cara Kerja Penentuan Konsentrasi dan Kadar KIO
3 dalam Sampel
+ aquadest s/d 25ml
+ 2,5 mL HNO31M
+ 5 mL KI 1M
Gambar 4 . Skema Penentuan Konsentrasi dan Kadar KIO
3 Dalam Garam Beriodium
Larutan sampel
Diukur absorbansinya dengan Spektrofotometer UV-Vis pada λ maks 435
nm
Hasil pengukuran (absorbansi)
Dihitung Konsentrasi dan Kadar KIO3 dalam Sampel
BAB IV
HASIL PENELITIAN DAN PEMBAHASAN
Berdasarkan tujuan yang telah diuraikan pada BAB I serta penelitian yang telah dilakukan sesuai dengan prosedur penelitian, diperoleh hasil penelitian kurva kalibrasi larutan standar KIO3dan penentuan kadar KIO3dalam garam beriodium. Dari masing-masing tahap diperoleh data dan dibahas pada sub bab berikut:
4.1 Penentuan Panjang Gelombang Optimum
Warna yang dipantulkan oleh larutan KIO3 termasuk berada dalam spektrum sinar tampak, karenanya penentuan panjang gelombang larutan KIO3 dapat menggunakan spektrofotometer UV-Vis. Spektrofotometer UV-Vis adalah spektrofotometer yang mempunyai panjang gelombang (380-780)nm dengan selang masing-masing panjang gelombang 5 nm.
Larutan KIO3 memantulkan warna kuning sedangkan prinsip dari spektrofotometer Uv-Vis yakni mengidentifikasi senyawa yang mempunyai warna. Oleh karena itu, KIO3 bisa diidentifikasi menggunakan spektrofotometer visibel. Menurut Day, Ra & Underwood A. L (1989), larutan yang memantulkan warna kuning mempunyai panjang gelombang (435-480) nm. Panjang gelombang maksimum mempunyai arti bahwa pada panjang gelombang tersebut mempunyai absorbansi yang paling besar diantara panjang gelombang yang lain pada rentang panjang gelombang tertentu.
Tabel penentuan panjang gelombang.
Pada tabel penentuan panjang gelombang dapat dilihat bahwa pada rentang panjang (420-480)nm, diperoleh absorbansi maksimum pada panjang gelombang 435nm. Pada panjang gelombang maksimal, kepekaannya juga maksimal karena pada panjang gelombang maksimal perubahan absorbansi untuk setiap satuan konsentrasi adalah yang paling besar. Sehingga panjang gelombang yang digunakan untuk mengukur kurva kalibrasi dan penetapan kadar pada sampel yakni 435nm.
4.7. Kurva Kalibrasi Larutan Standar KIO3
Sebelum menentukan kadar KIO3dalam sampel dengan spektrofotometer UV-Vis, terlebih dahulu dibuat kurva kalibrasi standar. Pada pengukuran terhadap larutan standar KIO3yang dibuat dengan variasi konsentrasi 0, 2, 4, 8, 10, 12 ppm diperoleh data absorbansi. Kemudian data yang telah diperoleh tersebut dibuat sebagai kurva kalibrasi.
Panjang Gelombang Absorbansi 420 0,7958 425 0,8239 430 0,8860 435 0,9208 440 0,9208 445 0,8860 450 0,8860 455 0,8860 460 0,8538 465 0,8538 470 0,8239 475 0,7958 480 0,7958
Kemudian kurva tersebut akan digunakan untuk mengetahui berapa konsentrasi larutan KIO3 dalam sampel. Perhitungan sampel dilakukan dengan membandingkan absorbansi sampel dengan absorbansi kurva kalibrasi.
Konsentrasi %T T A 0 100 1 0 2,012 85 0,85 0,0705 4,024 76 0,76 0,1191 8,048 60 0,60 0,2218 10,06 52 0,52 0,2839 12,072 46 0,46 0,3272 a= 6,965476191 x 10-3 b= 0,027355509 r= 0,999080124
Tabel Kurva Kalibrasi Larutan Standar KIO3
Dari kurva tersebut diperoleh data a, b dan r. Kurva dapat dikatakan baik jika nilai r hampir mendekati satu.
4.3 Konsentrasi dan Kadar KIO3 dalam Garam Beriodium
Mengacu kepada Standar Nasional Indonesia SNI 01-3556-2000 dimana garam yang berkualitas baik harus mengandung KIO3 30 - 80 ppm. Dari hasil penelitian diperoleh data sebagai berikut:
Dari data tersebut menunjukan bahwa garam merk A kandungan iodiumnya memenuhi persyaratan SNI yakni diatas 30 ppm, tetapi ada beberapa batch yang melebihi persyaratan yakni diatas 80 ppm. Hal ini dimungkinkan produsen melebihkan kandungan iodium untuk meminimalisir hilangnya iodium pada saat didistribusikan. Selain itu dari setiap batch perbedaan kandungan iodiumnya terlalu besar, dapat dikatakan produsen garam merk A kemungkinan tidak menerapkan standart cara pembuatan garam beriodium. Seharusnya setiap batch harus sama kandungan iodiumnya yakni sebesar (30-80)ppm karena setiap konsumen berhak mendapatkan jumlah kandungan iodium yang sama dan sesuai dengan SNI.
Untuk garam merk B dari lima batch yang diuji terdapat tiga batch yang tidak memenuhi persyaratan SNI yakni dibawah 30 ppm. Sedangkan dua batch lainnya memenuhi standart namun masih riskan karena kandungan iodiumnya hanya terpaut sedikit dari standart minimum kandungan iodium yang ditetapkan SNI. KIO3 merupakan senyawa iodium yang sangat stabil, tetapi bila saat pendistribusian dan penyimpanan terjadi pelumeran pada garam maka dapat mempengaruhi kadar dari iodium. Hal ini dikarenakan kandungan air pada garam akan melepaskan atau malarutkan KIO3 yang menempel pada permukaan garam. Dengan demikian dimungkinkan pada garam merk B iodium hilang terlalu banyak pada saat proses pendistribusian atau penyimpanan sehingga kandungan iodium tidak memenuhi persyaratan.
Pada garam merk C dan E dihasilkan kandungan iodium yang berbeda jauh dari setiap batchnya. Dimungkinkan produsen garam merk C dan E tidak
menetapkan standart besarnya iodium atau tidak menghitung besarnya ppm iodium sebelum diiodisasi. Sehingga pada penambahan iodium ke garam berbeda-beda setiap batchnya. Meskipun memenuhi standart SNI tetapi kandungan tiap batch yang berbeda-beda dikhawatirkan setiap konsumen tidak mendapatkan kandungan iodium yang sama.
Garam merk D mempunyai kandungan iodium yang memenuhi persyaratan SNI. Selain itu dari setiap batch kandungan iodiumnya juga hampir sama. Hal ini dimungkinkan produsen garam merk D menghitung besarnya ppm iodium yang akan diiodisasikan ke garam. Namun, kadar iodium masih riskan dari standart SNI hal ini dimungkinkan iodium banyak yang hilang pada saat proses pendistribusian.
Pada garam merk F kandungan iodium melebihi standart dari SNI yakni diatas 80 ppm. Karena dari lima batch yang diuji hanya satu batch yang berada di rentang 30 ppm- 80 ppm. Tetapi dari ke empat batch yang melebihi standart jaraknya tidak terpaut jauh dari standart maksimum SNI. Dimungkinkan produsen garam merk F memperkirakan hilangnya iodium pada saat pendistribusiaan sehingga meskipun ada iodium yang hilang tetapi masih sesuai standart SNI. Hal ini terlihat dari kandungan iodium yang hampir sama dari setiap batchnya.
Pada garam merk G dari lima batch yang diuji semuanya memasuki standart. Selain itu kandungan iodium dari masing-masing batch juga hampir sama. Jadi dapat dikatakan produsen garam merk G memperkirakan dan menghitung besarnya ppm iodium yang akan diiodisasikan ke garam sehingga
diperoleh kandungan iodium yang sama setiap batchnya. Selain itu peluang setiap konsumen mendapatkan kandungan iodium yang sama juga besar.
Dari tujuh merk garam yang diuji enam merk memenuhi standart minimum SNI sedangkan satu merk tidak memenuhi standart minimum SNI yakni garam merk B. Dapat disimpulkan hampir semua produsen garam dapur sudah memberikan iodium seperti yang sudah ditetapkan oleh pemerintah. Akan tetapi masih ada beberapa merk yang kandungan iodiumnya berbeda-beda setiap batchnya. Hal ini dimungkinkan karena iodium hilang pada saat proses distribusi, saat iodisasi, dan pengaruh dari kemurnian NaCl itu sendiri. Seharusnya hal ini dapat diminimalisir dengan memperhitungkan hilangnya kandungan iodium selama proses pembuatan sampai garam tersebut terdistribusikan. Sehingga kandungan iodium pada garam beriodium yang beredar di masyarakat sesuai dengan SNI. Dengan demikian peluang setiap konsumen mendapatkan kandungan iodium sesuai SNI sama besar.
BAB V PENUTUP
5.1 Kesimpulan
Berdasarkan hasil penelitian dan pembahasan yang telah dilakukan maka dapat diambil kesimpulan:
5.1.1 Garam beriodium yang beredar di pasar Besar Malang hampir semuanya sudah memenuhi Standart Nasional Indonesia. Dari tujuh merk yang diuji hanya terdapat satu merk yang kadarnya tidak sesuai dengan Standart Nasional Indonesia.
5.1.2 Produsen garam sudah menerapkan standart yang telah ditetapkan pemerintah bahwa garam harus mengandung iodium.
5.2 Saran
Perlu diadakan penelitian lebih lanjut tentang garam beriodium karena banyak faktor yang bisa menyebabkan iodium hilang. Misalnya Kandungan iodium akan berkurang selama garam dikeringkan dalam oven, selama proses distribusi atau pemasaran dan penyimpanan, serta kemurnian NaCl juga berpengaruh.
DAFTAR RUJUKAN
BPOM. Tanpa Tahun. SNI 01-3556-2000/Rev.9. (online),
(www.pom.go.id/garam/yodium.pdf ,diakses 20 november 2011, pukul
21.40)
Buletin POM. 2003. Keamanan Pangan, (online),
(www.pom.go.id/public/publikasi/spkp/spkp03II2003.pdf, diakses 20
november 2011, pukul 21.40)
Departemen Kesehatan Republik Indonesia. 1995. Farmakope Indonesia. Edisi IV. Jakarta: Departemen Kesehatan.
Lindawati. 2005. Tugas akhir II, Jurusan Kimia, Fakultas MIPA. Pengaruh waktu penyimpanan dan pemanasan terhadap kadar iodium dalam garam beriodium, (online), (lib.unnes.ac.id/4241/1/1603.pdf), diakses 13 januari 2011, pukul 10.17
Mulja dan Suharman. 1995. Analisis Instrumental. Surabaya: Airlangga
Riyanto. 2004. Fakultas MIPA. Optimasi Metode Penentuan Kandungan Iodium Dalam Garam Dapur dengan Spektrofotometer UV-VIS,(online),
(journal.uii.ac.id/index.php/) diakses
Sugiyono. 2007. Statistika untuk Penelitian. Bandung: CV Alfabeta
Sumaningsih,Rahayu. Tanpa Tahun. Program Studi Kebidanan Magetan,Jurusan Kebidanan Poltekes. Hubungan Antara Defisiensi Yodium dengan Prestasi,(online) Belajar.(isjd.pdii.lipi.go.id/admin/jurnal/11104750.pdf) diakses 22 oktober 2011, pukul 10.13
LAMPIRAN GAMBAR
Larutan HNO3,KIO3KI. Larutan Baku standar
Spektrofotometri timbangan analitik
Garam Merk C Garam merk D
Garam Merk E Garam merk F
LAMPIRAN 1
Pembuatan larutan induk KIO3 100 ppm = , = = 100 ppm LAMPIRAN 2
Pembuatan larutan HNO3 1 M 500 ml HNO3= 65% ρ = 1,37 g/ml 1 ml =1,37 g/ml 65ml = 1,37 x 65 = 89,05 g Mol = = , , = 1,4132 Mol = M x V 1,4132 = M x 0,1 L M = 14,132
Σ HNO3(p) = Σ HNO3(e) M1 x V1 = M2 x V2
14,132 x V = 1 x 500
LAMPIRAN 3 Pembuatan Larutan KI 1M 1000ml Mol = M x V = 1 x 1000ml Mol = 1000 mg = mol x BM = 1000 x 166
= 166.000mg (166g) hasil penimbangan praktikum 166,0059g
LAMPIRAN 4
Data Absorbansi larutan KIO3 untuk Penentuan Panjang Gelombang Maksimum
Panjang Gelombang %T T Absorbansi 420 16% 0,16 0,7958 425 15% 0,15 0,8239 430 13% 0,13 0,8860 435 12% 0,12 0,9208 440 12% 0,12 0,9208 445 13% 0,13 0,8860 450 13% 0,13 0,8860 455 13% 0,13 0,8860 460 14% 0,14 0,8538 465 14% 0,14 0,8538 470 15% 0,15 0,8239 475 16% 0,16 0,7958 480 16% 0,16 0,7958
LAMPIRAN 5
Pembuatan baku kerja (0, 2, 4, 8, 10, 12) ppm 1ml HNO3 1M+ 2 ml KI 1M disesuaikan dengan peng add an
0 ppm : 1ml HNO3+ 2ml KI add 10ml C1 2 ppm : 1/50 x 100 ppm 5ml HNO3 1M + 10ml KI 1M C3 4 ppm : 1/25 x 100 ppm 2,5ml HNO3 1M + 5ml KI 1M C4 8 ppm : 2/25 x 100 ppm 2,5ml HNO3 1M + 5ml KI 1M C5 10 ppm : 5/50 x 100 ppm 5ml HNO3 1M + 10ml KI 1M C6 12 ppm : 3/25 x 100 ppm 2,5ml HNO3 1M + 5ml KI 1M C7 LAMPIRAN 6
Perhitungan kadar pada sampel
Penimbangan sampel teori (30-80) ppm SNI
30ppm= 30mg/L= 30mg/kg = 30mg/1000g= 0,09 mg/3g 0,09mg/3g = 0,09/25ml= 0,09/0,025 = 3,6mg/ 1L= 3,6ppm Contoh perhitungan sampel merk A batch 1 replikasi 1: Sampel yakni 15,5301ppm = 15,5301mg/L
= 0.3882525mg/0,025L = 0.3882525mg/25ml Dalam penimbangan praktek : ,
, = 0,3882525 x 1000 = 3,0023 x X 388,2525 = 3,0023 x X X = , , X = 129,3183
Merk (A) % T T A ppm Hasil (ppm) Batch 1 R1 = 3.0023 37 0.37 0.4318 15.5301 129.3183 R2 = 3.0040 37.5 0.375 0.4259 15.3144 127.4500 R3 = 3.0031 36 0.36 0.4436 15.9614 132.8743 Batch 2 R1 = 3.0024 60 0.60 0.2219 7.8570 65.4226 R2 = 3.0020 62 0.62 0.2076 7.3343 61.0784 R3 = 3.0051 60.5 0.605 0.2182 7.7218 64.2391 Batch 3 R1 = 3.0008 41 0.41 0.3872 13.8997 115.7999 R2 = 3.0019 42 0.42 0.3767 13.5159 112.5612 R3 = 3.0031 40 0.40 0.3872 13.8997 115.7112 Batch 4 R1 = 3.0004 42 0.42 0.3768 13.5195 112.6474 R2 = 3.0009 42.5 0.425 0.3761 13.4939 112.4154 R3 = 3.0030 41 0.41 0.3872 13.8997 115.7151 Batch 5 R1 = 3.0038 62 0.62 0.2076 7.3343 61.0418 R2 = 3.0021 62.5 0.625 0.2041 7.2063 60.0104 R3 = 3.0043 62 0.62 0.2076 7.3343 61.0316
Merk (B) % T T A ppm Hasil (ppm) Batch 1 R1 = 3.0018 80 0.80 0.0969 3.2876 27.3802 R2 = 3.0031 80 0.80 0.0969 3.2876 27.3683 R3 = 3.0093 80.5 0.805 0.0942 3.1889 26.4920 Batch 2 R1 = 3.0037 74 0.74 0.1307 4.5232 37.6469 R2 = 3.0046 74 0.74 0.1307 4.5232 37.6356 R3 = 3.0060 73 0.73 0.1366 4.7388 39.4111 Batch 3 R1 = 3.0148 78 0.78 0.1079 3.6897 30.5965 R2 = 3.0012 77 0.77 0.1135 3.8944 32.4403 R3 = 3.0071 77.5 0.775 0.1106 3.7884 31.4954 Batch 4 R1 = 3.0087 80.5 0.805 0.0942 3.1889 26.4973 R2 = 3.0031 80 0.80 0.0969 3.2876 27.3683 R3 = 3.0070 81 0.81 0.0915 3.0902 25.6917 Batch 5 R1 = 3.0083 80 0.80 0.0969 3.2876 27.3620 R2 = 3.0053 81 0.81 0.0915 3.0902 25.7062 R3 = 3.0009 79 0.79 0.1023 3.4850 29.0329
Merk (C) % T T A ppm Hasil (ppm) Batch 1 R1 = 3.0021 78.5 0.785 0.1051 3.5873 29.8732 R2 = 3.0063 78 0.78 0.1079 3.6897 30.6830 R3 = 3.0070 77 0.77 0.1135 3.8944 32.3777 Batch 2 R1 = 3.0063 66.5 0.665 0.1771 6.2193 51.7188 R2 = 3.0011 66 0.66 0.1804 6.3400 52.8139 R3 = 3.0100 66 0.66 0.1804 6.3400 52.6578 Batch 3 R1 = 3.0029 52 0.52 0.2839 10.1235 84.2810 R2 = 3.0052 52.5 0.525 0.2798 9.9736 82.9695 R3 = 3.0093 53 0.53 0.2757 9.8237 81.6111 Batch 4 R1 = 3.0069 77 0.77 0.1135 3.8944 32.37886 R2 = 3.0012 77.5 0.775 0.1106 3.7884 31.5573 R3 = 3.0050 76 0.76 0.1191 4.0991 34.1023 Batch 5 R1 = 3.0013 63.5 0.635 0.1972 6.9541 57.9257 R2 = 3.0092 64 0.64 0.1938 6.8298 56.7409 R3 = 3.0043 62 0.62 0.2076 7.3343 61.0311
Merk (D) % T T A ppm Hasil (ppm) Batch 1 R1 =3.0008 78 0.78 0.1079 3.6897 30.7393 R2 = 3.0070 77 0.77 0.1135 3.8944 32.3777 R3 = 3.0032 78 0.78 0.1079 3.6897 30.7147 Batch 2 R1 = 3.0021 77 0.77 0.1135 3.8944 32.4306 R2 = 3.0059 77.5 0.775 0.1106 3.7884 31.5080 R3 = 3.0071 78 0.78 0.1079 3.6897 30.6749 Batch 3 R1 = 3.0043 61 0.61 0.2146 7.5902 63.1611 R2 = 3.0013 61 0.61 0.2146 7.5902 63.2242 R3 = 3.0083 61.5 0.615 0.2111 7.4622 62.0134 Batch 4 R1= 3.0001 68 0.68 0.1674 5.8647 48.8708 R2 = 3.0023 68.5 0.685 0.1643 5.7514 47.8916 R3 = 3.0063 67 0.67 0.1739 6.1024 50.7467 Batch 5 R1 = 3.0034 77 0.77 0.1135 3.8944 32.4165 R2 = 3.0005 77 0.77 0.1135 3.8944 32.4479 R3 = 3.0071 76 0.76 0.1191 4.0991 34.0785
Merk (E) % T T A ppm Hasil (ppm) Batch 1 R1 = 3,0044 76 0,76 0,1192 4,1028 34,139 R2 =3,0013 76 0,76 0,1192 4,1028 34,1751 R3 =3,0091 75 0,75 0,1249 4,3111 35,8171 Batch 2 R1 =3,0034 53 0,53 0,2757 9,8237 81,7714 R2 =3,0011 53,5 0,535 0,2716 9,6739 80,5862 R3 =3,0007 53,5 0,535 0,2716 9,6739 80,5970 Batch 3 R1 =3,0030 48 0,48 0,3187 11,3956 94,8684 R2 =3,0073 47 0,47 0,3279 11,7319 97,5285 R3 =3,0015 48,5 0,485 0,3142 11,2311 93,5457 Batch 4 R1= 3,0001 67 0,67 0,1739 6,1024 50,8516 R2 =3,0033 66 0,66 0,1804 6,3400 52,7752 R3 =3,0071 66 0,66 0,1804 6,3400 52,7085 Batch 5 R1 =3,0034 71 0,71 0,1487 5,1812 43,1277 R2 =3,0093 70 0,70 0,1549 5,4078 44,9257 R3 =3,0083 71,5 0,715 0,1456 5.0678 42,1151
Merk (F) %T T A ppm Hasil (ppm) Batch 1 R1=3,0033 52 0,52 0,2839 10,1235 84,2698 R2= 3,0012 52 0,52 0,2839 10,1235 84,3287 R3=3,0075 51 0,51 0,2924 10,4342 86,6525 Batch 2 R1=3,0009 48 0,48 0,3187 11,3956 94,9348 R2=3,0035 48 0,48 0,3187 11,3956 94,8562 R3=3,0067 47 0,47 0,3279 11,7319 97,5479 Batch 3 R1=3,0023 51 0,51 0,2924 10,4342 86,8850 R2=3,0039 50 0,50 0,3010 10,7486 89,4553 R3=3,0021 51,5 0,515 0,2881 10,2770 85,5817 Batch 4 R1=3,0025 45 0,45 0,3467 12,4192 103,4071 R2=3,0077 44 0,44 0,3565 12,7774 106,2057 R3=3,0047 45 0,45 0,3467 12,4192 103,3314 Batch 5 R1=3,0006 55 0,55 0,2596 9,2352 76,9446 R2=3,0055 54 0,54 0,2676 9,5276 79,2513 R3=3,0019 55 0,55 0,2596 9,2352 76,9112
Merk (G) %T T A ppm Hasil (ppm) Batch 1 R1=3,0050 56 0,56 0,2518 8,9500 74,4592 R2=3,0043 56 0,56 0,2518 8,9500 74,4765 R3=3,0061 55 0,55 0,2596 9,2352 76,8038 Batch 2 R1=3,0023 59 0,59 0,2291 8,1202 67,6164 R2=3,0051 58 0,58 0,2365 8,3907 69,8038 R3=3,0013 59 0,59 0,2291 8,1202 67,6390 Batch 3 R1=3,0001 58,5 0,585 0,2328 8,2555 68,7935 R2=3,0037 58 0,58 0,2365 8,3907 69,8363 R3=3,0065 58,5 0,585 0,2328 8,2555 68,6470 Batch 4 R1=3,0016 59 0,59 0,2291 8,1202 67,6322 R2=3,0025 59 0,59 0,2291 8,1202 67,6119 R3=3,0007 58 0,58 0,2365 8,3907 69,9016 Batch 5 R1=3,0003 59 0,59 0,2291 8,1202 67,6615 R2=3,0066 59 0,59 0,2291 8,1202 67,5197 R3=3,0036 60 0,60 0,2218 7,8534 65,3665