PENETAPAN KADAR IODIUM PADA GARAM
DENGAN METODE IODOMETRI
TUGAS AKHIR
OLEH:
FAUZAL ARIKA
NIM 122410059
PROGRAM STUDIDIPLOMA III
ANALIS FARMASI DAN MAKANAN
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENETAPAN KADAR IODIUM PADA GARAM
DENGAN METODE IODOMETRI
TUGAS AKHIR
Diajukan Untuk Memenuhi Salah Satu Syarat Untuk Memperoleh Gelar Ahli MadyaPada Program Studi Diploma III Analis Farmasi dan Makanan
Fakultas FarmasiUniversitas Sumatera Utara
OLEH:
FAUZAL ARIKA
NIM 122410059
PROGRAM STUDIDIPLOMA III
ANALIS FARMASI DAN MAKANAN
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
LEMBAR PENGESAHAN
PENETAPAN KADAR IODIUM PADA GARAM
DENGAN METODE IODOMETRI
TUGAS AKHIR
Diajukan Untuk Memenuhi Salah Satu Syarat Untuk Memperoleh Gelar Ahli MadyaPada Program Studi Diploma III Analis Farmasi dan Makanan
Fakultas FarmasiUniversitas Sumatera Utara
Oleh:
FAUZAL ARIKA
NIM 122410059
Medan, Juni 2015
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT. yang telah melimpahkan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan Tugas Akhir yang berjudul “Penetapan Kadar Iodium Pada Garam Dengan Metode Iodometri
”.Tugas Akhir ini disusun sebagaisalah satu syarat dalam
menyelesaikan pendidikan dan memperoleh gelar Ahli Madya pada Program Studi D-IIIAnalis Farmasi dan Makanan pada Fakultas Farmasi Univesitas Sumatera Utara. Pada dasarnya Tugas Akhir ini disusun berdasarkan apa yang penulis lakukan pada Praktek Kerja Lapangan (PKL) di UPT. Balai Pengujian dan Sertifikasi Mutu Barang (BPSMB) Dinas Perindustrian dan Perdagangan Provinsi Sumatera Utara.Ucapan terima kasih dan rasa hormat yang tiada terhingga penulis persembahkan kepada Ibu tercinta Ariani dan Papa tersayang Asril Kadir. Atas kasih sayang, do’a, moril maupun materil yang selalu tercurah untuk penulis. Penulis juga menyampaikan terima kasih kepada Arvilla Mikartini dan Farhan Arika selaku kakak dan adik serta segenap keluarga yang senantiasa telah banyak memberikan motivasi, dukungan dan inspirasi yang begitu luar biasa sehingga tugas akhir ini dapat diselesaikan dengan baik.
Selanjutnya penulis menyadari sepenuhnya tanpa bantuan dariberbagaipihak, Tugas Akhir ini tidak akan terwujud. Oleh karena itu, pada kesepatan ini penulismenyampaikan rasa hormat dan terima kasih yang setulus-tulusnya kepada:
1. Bapak Prof. Dr. Sumadio Hadisaputra, Apt., selaku Dekan Fakultas Farmasi Universitas Sumatera Utara
2. Ibu Prof. Dr. Julia Reveny,M.Si., Apt.,selaku Wakil Dekan 1 Fakultas Farmasi Universitas Sumatera Utara
4. Ibu Dra. Suwarti Aris, M.Si., Apt., selaku Dosen Pembimbing yang telah memberikan arahan dan bimbingan dalam penyelesaikan Tugas Akhir ini 5. Bapak Prof. Dr. Ginda Haro, M.Sc., Apt., selaku dosen penasehat
akademik penulis
6. Ibu Ir. Novira Dwi Shanty Artsiwi selaku kepala UPT. BPSMB Medan dan juga sebagai Dosen Pembimbing Lapangan
7. Ibu Darwati selaku penyelia Laboratorium Minyak Nabati dan Rempah-rempah dan seluruh Staf Pegawai UPT. Balai Pengujian dan Sertifikasi Mutu Barang Medan
8. Seluruh teman-teman seperjuangan Stambuk 2012 yang tidak mungkin disebutkan satu per satu dan terkhusus kepada teman sekelompok penulis dalam Praktek Kerja Lapangan, Resnika, Marshinta, Yoesliana, Muheni, Yuniati, Avia, dan Siti Nilma yang memberikan dukungan dan membantu dalam penulisan tugas akhir ini
9. Terkhusus kepada adinda Awiddah Khairiami Putri Nst. yang senantiasa membantu baik dari segi do’a, moril serta kasih sayang yang tercurah kepada penulis
Akhirnya, Penulis mengucapkan terima kasih kepada semua pihak, dengan harapan semoga Tugas Akhir ini dapat bermanfaat khususnya bagi penulis sendiri dan umumnya bagi pembaca.
Medan, Mei 2015 Penulis
PENETAPAN KADAR IODIUM PADA GARAM DENGAN METODE IODOMETRI
Abstrak
Masalah Gangguan Akibat Kekurangan Iodium(GAKI) merupakan masalahyang serius mengingat dampaknya mempengaruhi kelangsungan hidup dan kualitassumberdaya manusia. GAKI menghambat proses tumbuh kembang anak sehinggaakan membentuk SDM yang tidak berkualitas, baik dari segi fisik, kecerdasan, sosial maupun ekonomi. Untuk mengatasi masalah GAKI tersebut maka garam dapur dapat digunakan sebagai sarana fortifikasi zat iodium menjadi garam konsumsi. Sehingga harus memenuhi persyaratan Standar Nasional Indonesia (SNI) dengan kadar kalium iodat (KIO3) 30-80 ppm. Tujuan penelitian ini adalah untuk mengetahui kadar air dan kadar iodium sebagai kalium iodat (KIO3) dalam beberapa garam konsumsi beriodium bermerk.
Pengambilan sampel garam konsumsi beriodium bermerk dilakukan di pusat perbelanjaan Berastagi Supermarket kota Medan. Sampel yang digunakan tersebut adalah garam merk Aji, garam merk Dolphin, garam merk Ikan Paus. Uji yang dilakukan adalah uji kuantitatif yaitu dengan penambahan pereaksi natrium tiosulfat, asam fosfat, dan indikator amilum. Uji kuantitatif ini dilakukan dengan metode titrasi iodometri. Percobaan dilakukan duplo.
Hasil penelitian menunjukkan bahwa rata-rata kadar air dari garam Aji percobaan pertama dan garam aji percobaan kedua sebesar 0,075%. Pada garam Dolphin percobaan pertama dan garam Dolphin percobaan kedua dengan rata-rata sebesar 1,6068%. Pada garam Ikan Paus percobaan pertama dan kedua diketahui kadar air rata-rata sebesar 8,25%. Hasil ini menunjukkan bahwa garam Aji dan garam Dolphin memenuhi persyaratan sesuai Standar Nasional Indonesia (SNI)01-3556-2010. Sedangkan garam Ikan Paus tidak memenuhi persyaratan Standar Nasional Indonesia (SNI)01-3556-2010.Untuk hasil kadar iodium sebagai KIO3pada garam Aji dengan hasil 35,6 mg/kg, pada garam Dolphin sebesar 35,6 mg/kg, dan garam Ikan Paussebesar 35,6 mg/kg. Parameter uji yang dilakukan memenuhi persyaratan sesuai SNI 01-3556-2010 yang menunjukkan bahwa kadar iodium sebesar >30-80 ppm.
Kata kunci: garam konsumsi beriodium, kalium iodat, penetapan kadar air, penetapan kadar iodium sebagai kalium iodat ( KIO3), iodometri, SNI
2.5 Akibat Kekurangan dan Kelebihan Iodium ... 13
2.5.1 Akibat Kekurangan Iodium ... 13
2.5.2 Akibat Kelebihan Iodium ... 14
2.6 Titrasi yang Melibatkan Iodium ... 14
2.6.1 Perbedaan Iodimetri dan Iodometri ... 16
2.7 Iodometri ... 16
2.7.1 Larutan Standar Na2S2O3 ... 16
2.7.2 Indikator Amilum (Kanji) ... 17
2.8 Penetapan Kadar KIO3 dalam Garam Konsumsi Beriodium ... 18
DAFTAR LAMPIRAN
Lampiran Halaman
DAFTAR TABEL
Tabel Halaman
DAFTAR GAMBAR
Gambar Halaman
1. Garam Aji ... 32
2. Garam Dolpin ... 32
3. Garam Ikan Paus ... 33
4. Indikator Amilum ... 33
5. Erlenmeyer berisi hasil standarisasi Na2S2O3 0,005 N ... 34
6. Labu ukur berisi larutan baku KIO3 0,005 N ... 34
7. Erlenmeyer berisi Garam Aji hasil titrasi ... 35
8. Erlenmeyer berisi Garam Dolpin hasil titrasi ... 35
PENETAPAN KADAR IODIUM PADA GARAM DENGAN METODE IODOMETRI
Abstrak
Masalah Gangguan Akibat Kekurangan Iodium(GAKI) merupakan masalahyang serius mengingat dampaknya mempengaruhi kelangsungan hidup dan kualitassumberdaya manusia. GAKI menghambat proses tumbuh kembang anak sehinggaakan membentuk SDM yang tidak berkualitas, baik dari segi fisik, kecerdasan, sosial maupun ekonomi. Untuk mengatasi masalah GAKI tersebut maka garam dapur dapat digunakan sebagai sarana fortifikasi zat iodium menjadi garam konsumsi. Sehingga harus memenuhi persyaratan Standar Nasional Indonesia (SNI) dengan kadar kalium iodat (KIO3) 30-80 ppm. Tujuan penelitian ini adalah untuk mengetahui kadar air dan kadar iodium sebagai kalium iodat (KIO3) dalam beberapa garam konsumsi beriodium bermerk.
Pengambilan sampel garam konsumsi beriodium bermerk dilakukan di pusat perbelanjaan Berastagi Supermarket kota Medan. Sampel yang digunakan tersebut adalah garam merk Aji, garam merk Dolphin, garam merk Ikan Paus. Uji yang dilakukan adalah uji kuantitatif yaitu dengan penambahan pereaksi natrium tiosulfat, asam fosfat, dan indikator amilum. Uji kuantitatif ini dilakukan dengan metode titrasi iodometri. Percobaan dilakukan duplo.
Hasil penelitian menunjukkan bahwa rata-rata kadar air dari garam Aji percobaan pertama dan garam aji percobaan kedua sebesar 0,075%. Pada garam Dolphin percobaan pertama dan garam Dolphin percobaan kedua dengan rata-rata sebesar 1,6068%. Pada garam Ikan Paus percobaan pertama dan kedua diketahui kadar air rata-rata sebesar 8,25%. Hasil ini menunjukkan bahwa garam Aji dan garam Dolphin memenuhi persyaratan sesuai Standar Nasional Indonesia (SNI)01-3556-2010. Sedangkan garam Ikan Paus tidak memenuhi persyaratan Standar Nasional Indonesia (SNI)01-3556-2010.Untuk hasil kadar iodium sebagai KIO3pada garam Aji dengan hasil 35,6 mg/kg, pada garam Dolphin sebesar 35,6 mg/kg, dan garam Ikan Paussebesar 35,6 mg/kg. Parameter uji yang dilakukan memenuhi persyaratan sesuai SNI 01-3556-2010 yang menunjukkan bahwa kadar iodium sebesar >30-80 ppm.
Kata kunci: garam konsumsi beriodium, kalium iodat, penetapan kadar air, penetapan kadar iodium sebagai kalium iodat ( KIO3), iodometri, SNI
BAB I
PENDAHULUAN
1.1 Latar Belakang
Gangguan Akibat Kekurangan Iodium (GAKI) merupakan sekumpulangejala yang timbul karena tubuh seseorang kekurangan unsur iodium secara terus menerus dalam jangka waktu yang cukup lama. Masalah GAKI merupakan masalahyang serius mengingat dampaknya mempengaruhi kelangsungan hidup dan kualitassumberdaya manusia. GAKI menghambat proses tumbuh kembang anak sehinggaakan membentuk SDM yang tidak berkualitas, baik dari segi fisik, kecerdasan, sosial maupun ekonomi (Mirandati, 2007).
Garam dipergunakan manusia sebagai salah satu metode pengawetan pangan yang pertama dan masih dipergunakan secara luas untuk mengawetkan berbagai macam makanan. Demikian pula, pengasaman pangan telah digunakan secara luas, sebelum peranannya sebagai penghambat kerusakan dipahami. Pengasapan dan pengeringan telah juga digunakan secara luas dalam kombinasinya dengan garam, terutama untuk produk-produk daging dan ikan (Buckle, 1985).
keterlambatan perkembangan fisik anak (lambat dalam mengangkat kepala, tengkurap dan berjalan) (Nadesul, 2000). Iodium yang berlebihan dapat menimbulkan kejadian kelainan autoimun. Kelebihan iodium juga dapat meningkatkan kejadian iodine-inducedhyperthyroidism (IIH), penyakit autoimun tiroid dan kanker tiroid (Gunung, 2004).
Menurut keputusan Presiden No. 69 tahun 1994, semua garam yang beredar di Indonesia harus mengandung iodium yaitu garam yang telah diperkaya dengan kalium iodat (KIO3). Hampir seluruh makanan menggunakan garam sebagai penyedap rasa, serta banyak digunakan untuk bahan tambahan dalam industri pangan, selain itu, karena harga garam dapur relatif murah dan terjangkau oleh semua lapisan masyarakat maka pemerintah memilih garam dapur menjadi garam konsumsi sebagai media penyampaian iodium ke dalam tubuh (Purnawati, 2006).
1.2 Tujuan
Tujuan dari penelitian ini antara lain untuk mengetahui kadar iodium sebagai kalium iodat (KIO3) yang terdapat dalam beberapa garam konsumsi beriodium yang bermerk dan kesesuaiannya terhadap persyaratan kadar air berdasarkan SNI 01-3556-2010.
1.3 Manfaat
Manfaat dari penelitian ini antara lain:
a. Dapat mengetahui kadar iodium sebagai kalium iodat (KIO3) yang terdapat dalam beberapa garam konsumsi beriodium yang bermerk dan kesesuaiannya terhadap persyaratan kadar air berdasarkan SNI 01-3556-2010.
BAB II
TINJAUAN PUSTAKA 2.1 Garam
2.1.1 Pengertian Garam
Secara fisik, garam adalah benda padatan berwarna putih berbentuk kristal yang merupakan kumpulan senyawa dengan bagian terbesar Natrium Klorida (>80%) serta senyawa lainnya seperti Magnesium Klorida, Magnesium Sulfat, Kalsium Klorida, dan lain-lain. Garam mempunyai sifat atau karakteristik higroskopik yang berarti mudah menyerap air, bulk density (tingkat kepadatan) sebesar 0,8 - 0,9 dan titik lebur pada tingkat suhu 801oC (Burhanuddin, 2001).
Garam Natrium Klorida untuk keperluan masak dan biasanya diperkaya dengan unsur iodin (dengan menambah 5 g NaI per kg NaCl) padatan kristal berwarna putih, berasa asin, tidak higroskopis, bila mengandung MgCl2 menjadi berasa agak pahit dan higroskopis. Digunakan terutama sebagai bumbu penting untuk makanan, bahan baku pembuatan logam Na dan NaOH (bahan untuk pembuatan keramik, kaca, dan pupuk), sebagai zat pengawet (Mulyono, 2009).
2.1.2 Sumber Garam
Sumber garam yang didapat di alam berasal dari: 1. Air laut, air danau asin
Yang bersumber air laut terdapat di Mexico, Brazilia, RRC, Australia, dan Indonesia yang mencapai ± 40% . Adapun yang bersumber dari danau asin terdapat di Yordania (Laut Mati), Amerika Serikat (Great Salt Lake), dan Australia yang mencapai produksi ± 20% dari total produk dunia.
2. Deposit dalam tanah, tambang garam
3. Sumber air dalam tanah
Sangat kecil, karena sampai saat ini dinilai kurang ekonimis maka jarang (sama sekali tidak) dijadikan pilihan usaha. Di Indonesia terdapat sumber air garam di wilayah Purwodadi, Jawa Tengah
(Burhanuddin, 2001).
2.2 Garam Beriodium
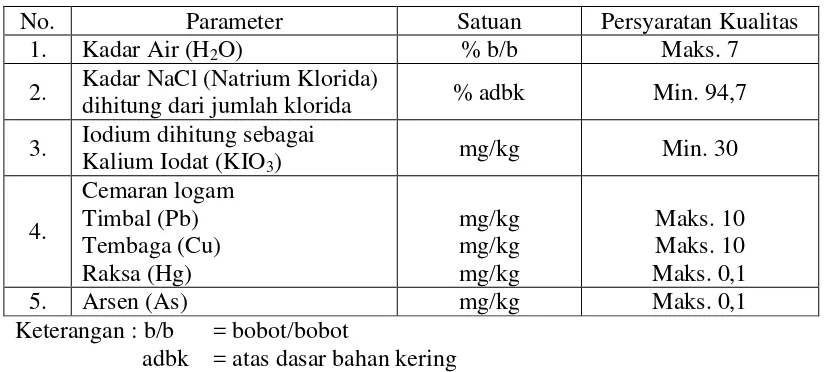
Garam beriodium adalah suatu produk yang ditawarkan kepada konsumen atau setiap keluarga untuk mencegah kekurangan iodium sebagai upaya jangka panjang. Kualitas garam beriodium mengacu kepada Standar Nasional Indonesia (SNI) No. 01-3556-2010 seperti tertera pada Tabel 2.1.
Tabel 2.1. Syarat Mutu Garam Konsumsi Beriodium
No. Parameter Satuan Persyaratan Kualitas
1. Kadar Air (H2O) % b/b Maks. 7
2. Kadar NaCl (Natrium Klorida)
dihitung dari jumlah klorida % adbk Min. 94,7 3. Iodium dihitung sebagai
Kalium Iodat (KIO3) mg/kg Min. 30
Keterangan : b/b = bobot/bobot
adbk = atas dasar bahan kering
sehari-hari, tidak ada pengolahan makanan yang tidak menggunakan garam (DGKM, 2007).
Hasil pemantauan Biro Pusat Statistik (BPS) terhadap garam konsumsi beriodium ditingkat rumah tangga sejak tahun 1997 sampai dengan 1999 dibagi dalam 3 kelompok yaitu (1) garam yang memenuhi syarat (kadar KIO3> 30-80 ppm), (2) garam yang tidak memenuhi syarat (kadar KIO3< 30 ppm), (3) garam yang tidak mengandung iodium (KIO3 0 ppm) (Burhanuddin, 2001).
Garam beriodium mengandung 0,0025% berat KIO (artinya dalam 100 gram total berat garam terkandung 2,5 mg KIO). Berikut ini dipaparkan cara sederhana untuk menghitung berapa banyak KIO yang dikonsumsi seseorang. Andaikan seorang ibu rumah tangga dalam sehari memasak satu panci sup (kapasitas dua liter) dengan menggunakan dua sendok garam beriodium (misalnya dengan berat 20 gram), dan tiap-tiap anggota keluarga pada hari tersebut melalap dua mangkok (anggap volume total kuah 100 ml). Maka, berat total garam KIO yang dikonsumsi tiap-tiap anggota keluarga itu dalam sehari (dengan asumsi tidak makan garam melalui makanan lainnya) adalah 0,0000025 gram atau 2,5 mikrogram (dari 0,0025% x 20 gram x 100 ml/200 ml). Jumlah garam yang sangat kecil, namun sangat diperlukan (Hasibuan, 2009).
2.2.1 Fortifikasi Iodium Pada Garam
garam digunakan secara luas dan oleh seluruh lapisan masyarakat. Prosesnya adalah sederhana dan tidak mahal (Albiner, 2003).
Fortifikasi yang biasa digunakan adalah Kalium Iodida (KI) dan Kalium Iodat (KIO3). Iodat lebih stabil dalam impure salt pada penyerapan dan kondisi lingkungan (kelembaban) yang buruk. Penambahan tidak mengakibatkan perubahan warna dan rasa. Negara-negara yang dengan program iodisasi garam yang efektif memperlihatkan pengurangan yang berkesinambungan akan prevalensi GAKI (Albiner, 2003).
2.3 Kalium Iodat
Kalium Iodat memiliki rumus molekul KIO3 dan bobot molekul 214,02 g mol-1 serta mempunyai komposisi I= 59,3%, K= 18,27%, O= 22,43%, berupa serbuk hablur putih atau kristal yang tidak berbau, tidak leleh 560oC dan bobot jenis 3,89 g/ml (Cahyadi, 2004).
Iodium dalam garam dihitung dengan kadar Kalium Iodat (KIO3), dimana iodium merupakan kandungan terpenting dalam kelenjar tiroid. Kandungan iodium yang dikonsumsi tidak seluruhnya diserap atau disintesa oleh hormon tiroid melainkan hanya sekitar 33%, sedangkan 67% dikeluarkan melalui urine dan feses (Manalu, 2007).
40 gram Kalium Iodat dalam tiap 1 liter air (1 Kg KIO3/25 liter air) (Manalu, 2007).
Persyaratan umum Kalium Iodat yang digunakan yakni:
1. Kadar (KIO3) : Min 99%
2. Kehalusan : 100 Mesh
3. Logam berbahaya (Pb, Hg, Zn, Cu, As) : Nihil
4. Grade : Food Grade
2.4 Iodium
Iodium merupakan senyawa yang diketahui pertama kali oleh Bernard Curtois pada tahun 1810. Namun iodium berasal dari bahasa Yunani Iode yang berarti warna violet. Kimiawi iodium dalam tubuh baru diketahui pada tahun 13-15, setelah Kendal berhasil mengisolasi senyawa yang mengandung iodium dalam kelenjar timid. Senyawa-senyawa tersebut adalah monoiodotirosin, diiodotirosin, triidotironin, dan tiroksin (Budiyanto, 2009).
Iodium dikonsentrasikan di dalam kelenjar gondok (glandula thyroide) untuk dipergunakan dalam sintesis hormon tiroksin. Hormon ini ditimbun dalam folikel kelenjar gondok, terkonjugasi dengan protein (globulin), dan disebut tiroglobulin, bila diperlukan tiroglobulin dipecah dan terlepas, hormon tiroksin yang dikeluarkan dari folikel kelenjar masuk ke dalam aliran darah (Sediaoetama, 2006).
Menurut Budiyanto (2001) pemenuhan gizi mikro Iodium bertumpu kepada pemanfaatan garam dapur yang telah mengalami fortifikasi iodium. Garam-garam beriodium relatif mudah didapat di toko-toko kecil. Beberapa produk yang terdapat di Malang, misalnya garam merk Bintang mengandung 30-80 ppm KIO3, sedangkan garam merk Kelir Mas mengandung minimal 30 ppm KIO3. Garam-garam tersebut telah sesuai dengan Standar Industri Indonesia. Jika penggunaan garam beriodium tersebut sesuai dengan sifat fisik dan kimia Iodium, maka upaya pemenuhan tersebut akan tercapai dengan baik sehingga dapat menurunkan GAKI. Ada 6 model yang mungkin dikembangkan masyarakat dalam rangka pemenuhan gizi mikro iodium, yaitu:
a. Menggunakan garam tidak beriodium (uyah grasak, bahasa Jawa)
b. Menggunakan garam beriodium (yang disimpan) dengan cara menggunakan dicampur dengan bumbu (saat mengerus), kemudian dimasukkan pada saat memasak makanan
d. Menggunakan garam beriodium (yang disimpan) dengan cara menggunakan semua garam yang dibutuhkan dimasukkan pada saat memasak makanan
e. Menggunakan garam beriodium (yang disimpan) dengan cara menggunakan semua garam yang dibutuhkan dimasukkan pada makanan yang selesai dimasak dan masih panas.
Iodium merupakan mineral yang diperlukan untuk tubuh dalam jumlah yang relatif sangat kecil, tetapi mempunyai peran yang sangat penting untuk pembentukan hormon tiroksin. Hormon tiroksin ini sangat berperan dalam metabolisme di dalam tubuh. Kekurangan iodium dapat berakibat buruk bagi manusia. Akibat yang dapat ditimbulkannya antara lain berkurangnya tingkat kecerdasan, pertumbuhan terhambat, penyakit gondok, kretin endemik (cebol), berkurangnya kemampuan mental dan psikologi, meningkatnya angka kematian prenatal, serta keterlambatan perkembangan fisik anak (Nadesul, 2000).
Menurut Farmakope Indonesia Edisi III (1979), Iodium mengandung tidak kurang dari 99,8% dan tidak lebih dari 100,5%.
1. Pemerian : keping atau granul, berat, hitam keabu-abuan, bau khas, berkilau seperti metal.
2. Kelarutan : sangat sukar larut dalam air, mudah larut dalam karbon disulfida, kloroform, eter, etanol, dan larutan iodida, agak sukar larut dalam gliserin.
3. Penetapan Kadar : serbukkan dan timbang seksama lebih kurang 500 mg dalam labu bersumbat kaca yang telah ditara, tambahkan 1 gram kalium iodida P yang dilarutkan dalam 5 mL air. Encerkan dengan air hingga lebih kurang 50 mL, tambahkan 1 mL asam klorida 3 N. Titrasi dengan natrium tiosulfat 0,1 N, menggunakan 3 mL indikator kanji.
WHO, Unicef, dan ICCIDD menganjurkan kebutuhan iodium sehari-hari sebagai berikut:
- 90 mg untuk anak prasekolah (0 - 59 bulan) - 120 mg untuk anak sekolah dasar (6 - 12 tahun) - 150 mg untuk dewasa (di atas 12 tahun)
- 200 mg untuk wanita hamil dan wanita menyusui
2.4.1 Sumber Iodium
Sumber iodium dalam makanan, antara lain: sayur-sayuran, ikan laut dan rumput laut, air mata air, dan garam beriodium (Budiyanto, 2009).
Sedangkan sumber iodium di alam, antara lain:
1. Air tanah, tergantung sumber air berasal dari batuan tertentu
2. Air laut, mengandung sedikit iodium, sehingga kandungan iodium garam rendah
3. Plankton, ganggang laut dan organisme laut lain berkadar iodium tinggi sebab organisme ini mengkonsentrasikan iodium dari lingkungan sekitarnya
4. Sumber bahan organik yang dalam oksidan, desinfektan, iodophor, zat warna makanan dan kosmetik, dan vitamin yang beredar di pasaran juga menambah iodium
2.4.2 Manfaat Iodium
Iodium sebagai unsur penting dalam sintesa hormon tiroksin, yaitu suatu hormon yang dihasilkan oleh kelenjar tiroid yang sangat dibutuhkan untuk proses pertumbuhan, perkembangan, dan kecerdasan. Iodium juga sebagai pembentukan hormon kalsitonin, yang juga dihasilkan oleh kelenjar tiroid, berasal dari sel parafoli-kular (sel CO). Hormon ini berperan aktif dalam metabolisme kalsium, maka harus selalu tersedia iodium yang cukup dan berkesinambungan (Djokomoeljanto, 2006).
2.5 Akibat Kekurangan dan Kelebihan Iodium
2.5.1 Akibat Kekurangan Iodium
Gangguan Akibat Kurang Iodium (GAKI) adalah gangguan yang diakibatkan oleh kurangnya zat iodium dalam tubuh, yaitu dapat mengakibatkan pembengkakan kelenjar tiroid (gondok) pada usia dewasa, dan pada bayi atau anak-anak dapat memperhambat pertumbuhan dan perkembangan fisik maupun intelektualnya (Almatsier, 2003).
pertumbuhan dan perkembangan janin, dan dalam keadaan berat bayi lahir dalam keadaan cacat mental yang permanen serta hambatan pertumbuhan yang dikenal sebagai kretinisme yaitu bentuk tubuh yang abnormal dan IQ dibawah 20. Hal ini dapat mengganggu proses belajar dari anak-anak (Almatsier, 2003).
2.5.2 Akibat Kelebihan Iodium
Asupan iodium dalam jumlah yang banyak, akibatnya sama seperti dalam hal kekurangan iodium, yaitu terjadi pembesaran kelenjar tiroid, sehingga dapat menimbulkan sesak napas yang diakibatkan oleh pembesaran tersebut menutupi jalan pernapasan (Almatsier, 2003).
2.6 Titrasi yang Melibatkan Iodium
Titrasi yang melibatkan iodium dapat dilakukan dengan 2 cara yaitu titrasi langsung (iodimetri) dan titrasi tidak langsung (iodometri).
a. Titrasi Langsung (Iodimetri)
Iodium merupakan oksidator yang relatif kuat. Pada saat reaksi oksidasi, iodium akan direduksi menjadi iodida sesuai reaksi:
I2 + 2e ↔ 2I-
b. Titrasi Tidak Langsung (Iodometri)
Iodometri merupakan titrasi tidak langsung dan digunakan untuk menetapkan senyawa-senyawa yang mempunyai potensial oksidasi yang lebih besar daripada sistem iodida-iodida atau senyawa-senyawa yang bersifat oksidator seperti CuSO4.5H2O. Pada iodometri, sampel yang bersifat oksidator direduksi dengan kalium iodida berlebihan dan akan menghasilkan iodium yang selanjutnya dititrasi dengan larutan baku natrium tiosulfat
(Rohman, 2007). Titrasi redoks dapat dibedakan menjadi beberapa cara berdasarkan pemakaiannya:
1. Na2S2O3 sebagai titran dikenal sebagai iodometri tak langsung
2. I2 sebagai titran dikenal sebagai titrasi iodometri langsung dan kadang-kadang dinamakan iodimetri
3. Suatu oksidator kuat sebagai titran. Diantaranya yang sering dipakai ialah:
a. KMnO4 b. K2Cr2O7 c. Ce (IV)
4. Suatu reduktor kuat sebagai titran
2.6.1 Perbedaan Iodimetri dan Iodometri
Menurut Basset (1994), metode cara langsung (iodimetri) jarang dilakukan mengingat iodium merupakan oksidator yang lemah. Cara langsung disebut iodimetri yang menggunakan larutan iodium untuk mengoksidasi reduktor-reduktor yang dapat dioksidasi secara kuantitatif pada titik ekivalennya. Sedangkan cara tidak langsung disebut iodometri yaitu oksidator yang dianalisis cukup kuat untuk direaksikan sempurna dengan ion iodida berlebih dalam keadaan sesuai yang selanjutnya iodium dibebaskan secara kuantitatif dan dititrasi dengan larutan natrium tiosulfat atau asam arsenit.
2.7 Iodometri (Metode Titrasi Tidak Langsung)
Iodometri merupakan titrasi tidak langsung dan digunakan untuk menetapkan senyawa-senyawa yang mempunyai potensial oksidasi yang lebih besar daripada sistem iodida-iodida atau senyawa-senyawa yang bersifat oksidator seperti CuSO4.5H2O. Pada iodometri, sampel yang bersifat oksidator direduksi dengan kalium iodida berlebihan dan akan menghasilkan iodium yang selanjutnya dititrasi dengan larutan baku natrium tiosulfat (Rohman, 2007).
2.7.1 Larutan Standar Na2S2O3
2.7.2 Indikator Amilum (Kanji)
Titrasi dapat dilakukan tanpa indikator dari luar karena warna I2 yang dititrasi itu akan lenyap bila titik akhir tercapai, warna itu mula-mula cokelat agak tua, menjadi lebih muda, lalu kuning, kuning muda dan seterusnya, sampai akhirnya lenyap. Bila diamati lebih cermat perubahan warna tersebut, maka titik akhir akan dapat ditentukan dengan cukup jelas. Konsentrasi iod masih tepat dapat dilihat dengan mata dan memungkinkan penghentian titrasi dengan kelebihan hanya senilai 1 tetes iod. Namun, lebih mudah dan lebih tegas bila ditambah amilum kedalam larutan sebagai indikator (Harjadi, 1986).
2.8 Penetapan Kadar KIO3 dalam Garam Konsumsi Beriodium
Penetapan kadar kalium iodat dalam hal ini menggunakan Analisis Kuantitatif dengan metode Volumetri. Metode Volumetri menggunakan titrasi iodometri. Metode ini masih digunakan secara luas karena merupakan metode yang tahan, murah dan mampu memberikan ketetapan yang tinggi. Dalam analisis volumetri atau analisis kuantitatif dengan mengukur volume, sejumlah zat yang diselidiki direaksikan dengan larutan baku (standar) yang kadar (konsentrasi) nya telah diketahui secara teliti dan reaksinya berlangsung secara kuantitatif (Rohman, 2007).
Daftar baku primer yang umum digunakan untuk membakukan larutan baku dapat dilihat pada Tabel 2.2.
Tabel 2.2 : Daftar Baku Primer
No. Baku Primer Kegunaan
1. Kalium Biftalat Pembakuan Natrium Hidroksida Pembakuan larutan Asam perklorat 2. Kalium Iodat Pembakuan larutan Natrium Tiosulfat
melalui pembentukan Iodium 3. Natrium Karbonat Anhidrat Pembakuan Asam Klorida
4. Logam Zn Pembakuan larutan EDTA
(Rohman, 2007). Larutan standar biasanya ditambahkan dari dalam sebuah buret. Proses penambahan larutan standar sampai reaksi tepat lengkap, disebut titrasi, dan zat yang akan ditetapkan, dititrasi. Titik (saat) pada mana reaksi itu lengkap disebut titik ekivalen (setara) atau titik akhir teoritis. Lengkapnya titrasi, harus terdeteksi oleh suatu perubahan, yang tidak dapat disalah lihat oleh mata, yang dihasilkan oleh larutan standar itu sendiri, atau lebih lazim lagi oleh penambahan suatu reagensia pembantu yang dikenal sebagai indikator. Setelah reaksi antara visual yang jelas dengan cairan yang sedang dititrasi, titik pada saat ini terjadi disebut titik akhir titrasi (Basset, 1994).
Banyaknya volum natrium tiosulfat yang digunakan sebagai titran setara dengan iodium yang dihasilkan dan setara dengan banyaknya sampel (Rohman, 2007).
BAB III
METODE PENGUJIAN
3.1 Tempat dan Waktu Pengujian
Pengujian ini dilakukan di Laboratorium Minyak Nabati dan Rempah-rempah UPT. Balai Pengujian dan Sertifikasi Mutu Barang (BPSMB) Jl. STM No. 17 Kampung Baru, Medan 20146 pada tanggal 2 sampai 13 Februari 2015.
3.2 Alat
Alat yang digunakan adalah botol timbang, buret 10 ml dan 50 ml (pyrex), desikator, erlenmeyer 250 ml (pyrex), gelas ukur 10 ml (pyrex), labu ukur 100 ml dan 250 ml (pyrex), mikroburet 5 ml (pyrex), neraca analitik (mettle toledo), oven (memmert), pipet volume 0,5 ml, 50 ml dan 20 ml (pyrex) dan pipet tetes.
3.3 Bahan
Bahan yang digunakan adalah air suling, asam phospat(H3PO4) 85%,garam konsumsi beriodium (garam aji, garam dolphin, dan garam ikan paus), indikator amilum 1%, kristal KIlarutan baku Kalium Iodat (KIO3) 0,005 N, dan larutan baku Natrium tiosulfat (Na2S2O3) 0,005 N.
3.4 Pembuatan Pereaksi
Pembuatan larutan baku Kalium Iodat, KIO3 0,005 N
Timbang 3,567 g KIO3 (pa), larutkan dengan air suling dalam labu ukur 100 mL, impitkan dengan air suling hingga tanda garis. Pipet 0,5 ml ke dalam labu ukur 100 ml yang lain encerkan dengan air suling impitkan hingga tanda garis.
b. Larutan baku Natrium tiosulfat, Na2S2O3 0,005 N Pembuatan Larutan baku Natirum tiosulfat 0,005 N
Timbang 6,25 g Na2S2O3.5H2O, larutkan dengan air suling dalam labu ukur 250 ml. Pipet 50 ml ke dalam labu ukur 250 ml yang lain. Encerkan dengan air suling impitkan hingga tanda garis.
c. Standarisasi larutan Natrium tiosulfat, Na2S2O3 Pembuatan larutan standarisasi Natrium tiosulfat
Timbang 10 g NaCl (pa) masukkan ke dalam erlenmeyer 300 ml, tambahkan 120 ml air suling, aduk sampai larut. Tambah 5 ml larutan baku KIO3 0,005 N dan kocok sampai homogen. Tambah 2 ml H3PO4 85%, 2 ml indikator amilum 1% dan 0,1 g kristal KI. Titer dengan larutan baku Na2S2O3 menggunakan mikroburet sampai warna biru hilang (V1).
3.5 Prosedur Pengujian
Prosedur pengujian penetapan kadar iodium sebagai kalium iodat (KIO3) pada garam adalah sebagai berikut:
a. Timbang 10 g contoh ke dalam Erlenmeyer 250 ml b. Larutkan dengan 125 ml air suling
c. Tambah 2 ml H3PO4 85% 2 ml indikator amilum dan 0,1 g kristal KI d. Titrasi dengan larutan baku Na2S2O3 menggunakan mikroburet (V2),
koreksidilakukan terhadap 10 g NaCl p.a Contoh perhitungan :
���������������������3 =
890 × �2
� × �2 �� ��⁄
Keterangan:
V1= volume Na2S2O3 pada penitaran larutan baku, dinyatakan dalam mililiter (ml) V2= volume Na2S2O3 pada penitaran larutan contoh, dinyatakan dalam mililiter (ml)
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil
Penetapan Kadar Iodium sebagai KIO3 Pada Garam
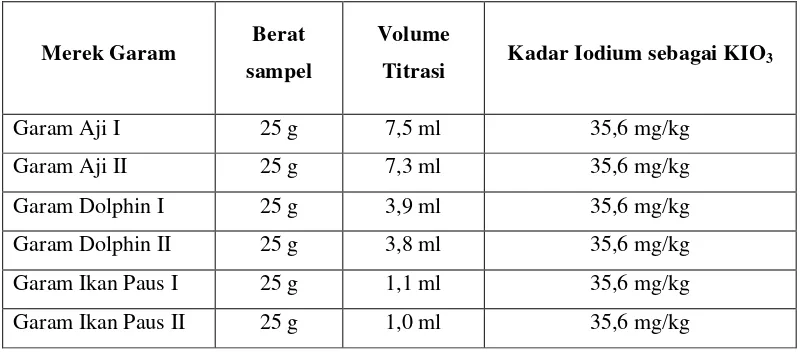
Hasil penetapan kadar iodium sebagai KIO3 pada garam dapat dilihat pada Tabel 4.1. Perhitungan penetapan kadar iodium dapat dilihat pada lampiran.
Tabel 4.1. HasilPenetapan Kadar Iodium sebagaiKIO3 pada Garam
Merek Garam Berat
sampel
Volume
Titrasi Kadar Iodium sebagai KIO3
Garam Aji I 25 g 7,5 ml 35,6 mg/kg
Garam Aji II 25 g 7,3 ml 35,6 mg/kg
Garam Dolphin I 25 g 3,9 ml 35,6 mg/kg
Garam Dolphin II 25 g 3,8 ml 35,6 mg/kg
Garam Ikan Paus I 25 g 1,1 ml 35,6 mg/kg
4.2 Pembahsan
Iodium dalam garam dihitung dengan kadar Kalium Iodat (KIO3), dimana iodium merupakan kandungan terpenting dalam kelenjar tiroid. Kandungan iodium yang dikonsumsi tidak seluruhnya diserap atau disintesa oleh hormon tiroid melainkan hanya sekitar 33%, sedangkan 67% dikeluarkan melalui urine dan feses (Manalu, 2007).
Berdasarkan kestabilannya kandungan Kalium Iodat (KIO3) pada saat ini merupakan senyawa iodium yang banyak digunakan dalam proses iodisasi garam. Kalium Iodat (KIO3) merupakan garam yang sukar larut dalam air, sehingga dalam membuat larutannya diperlukan larutan yang baik (Manalu, 2007).
Suhu yang tinggi akan memecah senyawa Kalium Iodat sehingga iodium akan terlepas dan menguap. Selain itu juga karena kelembaban udara yang tinggi serta waktu penyimpanan yang terlalu lama (> 6 bulan) dengan angka pengurangan 30 – 80 %.Penambahan jumlah KIO3 yang lebih tinggi mungkin sudah dilakukan untuk mencegah pengurangan tersebut. Dianjurkan pada kondisi demikian menggunakan garam beriodium dengan kadar> 50 ppm (Soetrisnanto, 2006).
Kualitas garam beriodium mengacu kepada Standar Nasional Indonesia (SNI) No. 01-3556-2010. Dapat dilihat pada tabel 2.1.
BAB V
KESIMPULAN DAN SARAN
5.1Kesimpulan
Berdasarkan Berdasarkan hasil yang didapat bahwa parameter yang dilakukan pada garam seperti kadar iodium sebagai KIO3 dengan hasil 35,6 mg/kg untuk garam Aji, 35,6 mg/kg untuk garam Dolphin, dan 35,6 mg/kg untuk garam ikan paus. Parameter uji yang dilakukan memenuhi persyaratan sesuai SNI 01-3556-2010 yang menunjukkan bahwa kadar iodium sebesar >30-80 ppm.
5.2 Saran
a. Sebaiknya dalam melakukan titrasi harus dilakukan dengan teliti agar volume
titrasi yang didapat tepat
b. Sebaiknya pemerintah melakukan pemeriksaan lebih ketat lagi terhadap beberapa
merek dagang dari Garam Konsumsi yang telah beredar di pasaran demi
menjamin kesehatan para konsumen
c. Sebaiknya pemantauan garam beriodium pada masyarakat agar terus
dilaksanakansehingga terus terpantau keadaan konsumsi garam di tingkat
DAFTAR PUSTAKA
Albiner. (2003). Pendekatan Fortifikasi Pangan untuk Mengatasi Masalah Kekurangan Gizi Mikro. http://repository.usu.ac.id. Tanggal 11 Maret 2015.
Almatsier, S. (2003). Prinsip Dasar Ilmu Gizi. Jakarta : PT. Gramedia Pustaka Utama. Hal: 251.
Badan Standardisasi Nasional. (2010). SNI 01-3556-2010, Garam Konsumsi Beriodium. Jakarta: Badan Standardisasi Nasional. Hal: 1, 7, 9-10.
Basset, J. et. all. (1994). Vogel Kimia Analitik Kuantitatif Anorganik. Jakarta: Penerbit Buku Kedokteran EGC. Hal: 308-364.
Buckle, K.A., et.al. (1985). Food Science. Alih bahasa oleh: Hari Purnomo dan Adiono. Jakarta: UI-Press. Hal: 166.
Budiyanto. (2009). Dasar-dasar Ilmu Gizi. Malang: UMM Press. Hal: 86-87. Burhanuddin. (2001). Proceeding Forum Pasar Garam Indonesia. Jakarta: Badan
Riset Kelautan dan Perikanan. Hal: 1-18.
Cahyadi, W. (2004). Peranan Iodium dalam Tubuh. Diambil dari: www.pikiranrakyat.com.
Day, R.A., dan Underwood, A.I. (1981). Quantitative Analysis. Alih bahasa oleh: Sopyan, Lis. (2001). Analisis Kimia Kuantitatif. Edisi 6. Jakarta: Erlangga. Hal: 99.
DGKM. (2007). Gizi dan Kesehatan Masyarakat. Jakarta: FKM Universitas Indonesia. Hal: 212-226.
Dirjen POM. (1979). Farmakope Indonesia. Edisi III. Jakarta: Departemen Kesehatan Republik Indonesia. Hal: 694.
Djokomoeljanto. (2006). Kelenjar Tiroid, Hipotiroidisme, dan Hipertiroidisme, dalam: Aru WS., editor. Buku Ajar Ilmu Penyakit Dalam, edisi IV, Jilid III. Jakarta: FKUI. Hal: 1802.
Gunung, I., K. (2004). Perhitungan Kadar Iodium dalam Iodisasi Garam untuk
Penanggulangan GAKI di Daerah Endemik. Majalah Kedokteran
Hasibuan, Dedi Julhadi. (2009). Gambaran Perilaku Ibu Rumah Tangga dalam Penggunaan Garam Beriodium di Desa Juma Teguh Kecamatan Siempat Nempu Kabupaten Dairi Tahun 2008. [Skripsi]. FKM USU. Hal: 29. Harjadi, W. (1986). Ilmu Kimia Analitik Dasar. Jakarta: Penerbit PT. Gramedia.
Keputusan Presiden RI. (1994). Nomor : 69 Tahun 1994. Tentang Pengadaan
GaramBeriodium.
Manalu, L. (2007). Pemeriksaan Kalium Iodat (KIO3) dalam Garam dan Air yang
Dikonsumsi Masyarakat Garoga Kabupaten Tapanuli Utara Tahun 2000.
[Skripsi]. FKM USU. Hal: 41.
Marihati. (2006). Pemantauan Mutu Garam Beriodium. Semarang: Jurnal GAKI Indonesia (Indonesia Journal of IDD). Vol. 5. No. 1-2.
Mirandati, D.A. (2007). Studi Implementasi Kebijakan Pengadaan Garam Beriodium di Kecamatan Batangan Kabupaten Pati. [Tesis]. Pascasarjana Universitas Diponegoro Semarang. Hal: 2.
Mulyono, Ham. (2009). Kamus Kimia. Jakarta: Bumi Aksara.
Nadesul, Handrawan. (2000). Makanan Sehat untuk Bayi. Jakarta: Puspa Swara. Hal: 14.
Purnawati, W. (2006). Pengaruh Teknik Iodisasi dan Lama Penyimpanan Terhadap Kadar Kalium Iodat. [Skripsi]. Fakultas MIPA UNS. Hal: 3. Rohman, Abdul. (2007). Kimia Farmasi Analisis.Yogyakarta: Pustaka Pelajar.
Universitas Islam Indonesia. Hal: 129-154.
Sartono. (2001). Racun dan Keracunan. Jakarta: Widya Medika. Hal: 179-180. Sediaoetama, Achmad Djaeni. (2008). Ilmu Gizi Untuk Mahasiswa dan Profesi di
Indonesia. Jilid I. Jakarta: Dian Rakyat. Hal: 177-178.
Lampiran 1PenetapanKadar Iodium sebagai KIO3 pada Garam
1. Sampel Garam Aji (I)
���������������������3 =
890 × �2
� × �2 �� ��⁄
= 890 × 7,5
25 × 7,5 �� ��⁄
= 6.675
187,5�� ��⁄
= 35,6 �� ��⁄
2. Sampel Garam Aji (II)
���������������������3 =
890 × �2
� × �2 �� ��⁄
= 890 × 7,3
25 × 7,3 �� ��⁄
= 6.497
182,5�� ��⁄
3. Sampel Garam Dolphin (I)
���������������������3 =
890 × �2
�× �2 �� ��⁄
= 890 × 3,9
25 × 3,9 �� ��⁄
= 3.471
97,5 �� ��⁄
= 35,6 �� ��⁄
4. Sampel Garam Dolphin (II)
���������������������3 =
890 × �2
� × �2 �� ��⁄
= 890 × 3,8
25 × 3,8 �� ��⁄
= 3.382
95 �� ��⁄
5. Sampel Garam Ikan Paus (I)
���������������������3 =
890 × �2
� × �2 �� ��⁄
= 890 × 1,1
25 × 1,1 �� ��⁄
= 979
27,5�� ��⁄
= 35,6 �� ��⁄
6. Sampel Garam Ikan Paus (II)
���������������������3 =
890 × �2
� × �2 �� ��⁄
= 890 × 1,0
25 × 1,0 �� ��⁄
= 890
25 �� ��⁄
Lampiran 2 Pengujian Garam
Gambar 1.Garam Aji
Gambar 1.Garam Aji
Gambar 3.Garam Ikan Paus
Gambar 5.Erlenmeyer berisi hasil standarisasi Na2S2O3 0,005 N
Gambar 7. Erlenmeyer berisi Garam Aji hasil titrasi