1 11
1 |Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009 |Kelompok Dua / Kimia B 2009
I. JUDUL :
Kinetika Reaksi Saponifikasi Etil Asetat
II. TANGGAL PERCOBAAN :
Rabu, 16 November 2011
III. TUJUAN :
1. Untuk memberikan gambaran bahwa reaksi penyabunan etil asetat oleh ion hidroksida adalah reaksi orde dua
2. Menentukan konstanta kecepatan reaksi pada reaksi tersebut.
IV. TINJAUAN PUSTAKA :
Saponifikasi
Saponifikasi pada dasarnya adalah proses pembuatan sabun yang berlangsung dengan mereaksikan asam lemak khususnya trigliserida dengan alkali yang menghasilkan gliserol dan garam karboksilat (sejenis sabun). Sabun merupakan garam (natrium) yang mempunyai rangkaian karbon yang panjang. Reaksi dibawah ini merupakan reaksi saponifikasi tripalmitin / trigliserida.
Gambar 2.1 Reaksi Saponifikasi tripalmitin
Selain dari reaksi diatas sabun juga bisa dihasilkan dari reaksi netralisasi Fatty Acid (FA), namun disini hanya didapat sabun tanpa adanya Gliserin (Glycerol), karena saat proses pembuatan Fatty Acid, glycerol sudah dipisahkan tersendiri.
2 22
2 |Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009 |Kelompok Dua / Kimia B 2009
Gambar 2.2 Reaksi saponifikasi Asam lemak
Selain dari minyak atau lemak dan NaOH pada pembuatan sabun dipergunakan bahan-bahan tambahan-bahan sebagai berikut:
a. Cairan pengisi seperti tepung tapioka, gapleh dan lain-lain. b. Zat pewarna
c. Parfum, agar baunya wangi. d. Zat pemutih, misal natrium sulfat
Untuk menentukan laju dari reaksi kimia yang diberikan, harus ditentukan seberapa cepat perubahan konsentrasi yang terjadi pada reaktan atau produknya. Secara umum, apabila terjadi reaksi A → B, maka mula-mula zat yang A dan zat B sama sekali belum ada. Setelah beberapa waktu, konsentrasi B akan meningkat sementara konsentrasi zat A akan menurun (Partana, 2003 : 47). Hukum laju dapat ditentukan dengan melakukan serangkain eksperimen secara sistematik pada reaksi A + B → C, untuk menentukan orde reaksi terhadap A maka konsentrasi A dibuat tetap sementara konsentrasi B divariasi kemudian ditentukan laju reaksinya pada variasi konsentrasi tersebut. Sedangkan untuk menentukan orde reaksi B, maka konsentrasi B dibuat tetap sementara itu konsentrasi A divariasi kemudian diukur laju reaksinya pada variasi konsentrasi tersebut (Partana, 2003 : 49).
Orde dari suatu reaksi menggambarkan bentuk matematika dimana hasil perubahan dapat ditunjukkan. Orde reaksi hanya dapat dihitung secara eksperimen dan hanya dapat diramalkan jika suatu mekanisme reaksi diketahui seluruh orde reaksi yang dapat ditentukan sebagai jumlah dari eksponen untuk masing-masing reaktan, sedangkan hanya eksponen untuk masing-masing reaktan dikenal sebagai orde reaksi untuk komponen itu. Orde reaksi adalah jumlah pangkat faktor konsentrasi dalam hukum laju bentuk diferensial. Pada umumnya orde reaksi terhadap suatu zat tertentu tidak sama dengan koefisien dalam persamaan stoikiometri reaksi (Hiskia, 2003).
3 33
3 |Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009 |Kelompok Dua / Kimia B 2009
persamaan laju diferensial adalah
] ][ [ ] [ 1 ] [ 1 B A k dt B d b dt A d a =− = − ……….1 Dan persamaan laju yang diintegralkan adalah
kt A B A B B A b o o o o = − [ ][ ] ] [ ] [ ln ] [ ] [ 1 ………2 Jika a=b=1. persamaan 2 menjadi
kt A B A B B A o o o o = − [ ][ ] ] [ ] [ ln ] [ ] [ 1
Plot sisi kiri persamaan 1 dan 2 terhadap t akan merupakan garis lurus, knstanta laju dapat dihitung dari kemiringan dan konsentrasi awal reaktan dari intersep tersebut (Dogra, 2008 : 629).
V. ALAT dan BAHAN :
• Alat – Alat : 1. Corong Kaca 2. Stopwatch 3. Gelas Kimia 4. Erlenmeyer 5. Buret
6. Statif dan Klem 7. Gelas Ukur 8. Termometer • Bahan – Bahan : 1. Etil asetat 0,02 N 2. Indikator PP 3. Larutan NaOH 0,02 N 4. Aquades 5. Larutan HCl 0,02 N
4 44
4 |Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009 |Kelompok Dua / Kimia B 2009
VI. CARA KERJA :
125 ml Larutan etil asetat 0,02N
100 ml larutan NaOH 0,02 N
- Diletakkan ke dalam thermostat untuk mencapai suhu yang sama
Kedua larutan mencapai suhu yang sama
- Kedua larutan dicampurkan dengan cepat - Dikocok dengan baik
- Dijalankan stopwatch ketika larutan dicampurkan - Tiga menit setelah dicampur, dipipet 5 ml dan
dimasukkan ke dalam salah satu Erlenmeyer yang berisi 10 ml larutan HCl
- Diaduk dengan baik dan segera dititrasi dengan larutan standar NaOH 0,02 N
- Dilakukan pengambilan kembali pada menit ke 8, 15, 25, 40 dan 65.
Larutan sisa Larutan berwarna merah muda
- Disimpan selama kurang lebih 2 hari
- Setelah 2 hari, dilakukan pemanasan agar reaksi sempurna
- Setelah dingin, dipipet 5 ml dan dimasukkan ke dalam Erlenmeyer yang telah berisi 10 ml HCl. - Dititrasi dengan larutan standar NaOH 0,02 N
Larutan berwarna merah muda
5 55
5 |Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009 |Kelompok Dua / Kimia B 2009
VII. DATA PENGAMATAN :
NO PERLAKUAN HASIL
PENGAMATAN
DUGAAN / REAKSI
KESIMPULAN
1 Etil asetat : tak
berwarna NaOH : tidak berwarna Etil asetar + NaOH : tidak berwarna +HCl = tidak berwarna +indikator pp = tidak berwarna V3menir= 7,9 V8menit=8,1 V15menit=8,2 V25menit=8,4 V40menit=8,4 V65menit=8,6 V2hari=9,9 Larutan berwarna merah muda C2H5OH + NaOH CH3COOC2H5 + H2O +OH -CH3COOC2H5+ HCl H+ + NaOH CH3COONa +H2O Reaksi saponifikasi merupakan reaksi berorde dua dengan persamaan : dx/dt = k[a-x]2 125 ml Larutan etil asetat 0,02N 100 ml larutan NaOH 0,02 N
-Diletakkan ke dalam thermostat untuk mencapai suhu yang sama
Kedua larutan mencapai suhu yang
-Kedua larutan dicampurkan dengan cepat
-Dikocok dengan baik
-Dijalankan stopwatch ketika larutan dicampurkan
-Tiga menit setelah dicampur, dipipet 5 ml dan dimasukkan ke dalam salah satu Erlenmeyer yang berisi 10 ml larutan HCl
-Diaduk dengan baik dan segera dititrasi dengan larutan standar NaOH 0,02 N
-Dilakukan pengambilan kembali pada menit ke 8, 15, 25, 40 dan 65.
Larutan sisa Larutan berwarna merah muda
-Disimpan selama kurang lebih 2 hari -Setelah 2 hari, dilakukan pemanasan
agar reaksi sempurna
-Setelah dingin, dipipet 5 ml dan dimasukkan ke dalam Erlenmeyer yang telah berisi 10 ml HCl. -Dititrasi dengan larutan standar
NaOH 0,02 N
Larutan berwarna
6 66
6 |Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009 |Kelompok Dua / Kimia B 2009
VIII. ANALISIS dan PEMBAHASAN :
Pada percobaan Kinetika Reaksi Saponifikasi Etil Asetat yang dilakukan ini bertujuan menunjukkan bahwa reaksi yang terjadi antara etil asetat (CH3COOC2H5) dengan NaOH merupakan reaksi dengan orde 2. Reaksi yang terjadi sebagai berikut:
CH3COOC2H5(aq) +NaOH(aq) CH3COOH(aq) + C2H5OH(aq)
Dari percobaan yang dilakukan didaptkan data berupa volume titrasi sebagai berikut:
t(menit) Volume titrasi
3 7,9 8 8,1 15 8,2 25 8,4 40 8,4 65 8,6 2880 9,9
Metode Integral secara Grafik
Dari data tersebut di atas dapat digunakan dalam perhitungan sebagai berikut: a. Milimol NaOH sisa
Untuk t = 3 menit
mmol NaOH sisa = mmol HCl awal – mmol HCl akhir
= M1V1 – M2V2 = 0,02.10 – 0,02.7,9 = 0,042
Untuk t = 8 menit
mmol NaOH sisa = mmol HCl awal – mmol HCl akhir
= M1V1 – M2V2 = 0,02.10 – 0,02.8,1 = 0,038
Untuk t = 15 menit
mmol NaOH sisa = mmol HCl awal – mmol HCl akhir
= M1V1 – M2V2 = 0,02.10 – 0,02.8,2
7 77
7 |Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009 |Kelompok Dua / Kimia B 2009
= 0,036 Untuk t = 25 menit
mmol NaOH sisa = mmol HCl awal – mmol HCl akhir
= M1V1 – M2V2 = 0,02.10 – 0,02.8,4 = 0,032
Untuk t = 40 menit
mmol NaOH sisa = mmol HCl awal – mmol HCl akhir
= M1V1 – M2V2 = 0,02.10 – 0,02.8,4 = 0,032
Untuk t = 65 menit
mmol NaOH sisa = mmol HCl awal – mmol HCl akhir
= M1V1 – M2V2 = 0,02.10 – 0,02.8,6 = 0,028
Untuk t = 2880 menit
mmol NaOH sisa = mmol HCl awal – mmol HCl akhir
= M1V1 – M2V2 = 0,02.10 – 0,02.9,9 = 0,002
b. Milimol NaOH yang bereaksi Untuk t = 3 menit
mmol NaOH = mmol HCl awal – mmol HCl akhir
= M1V1 – M2V2 = 0,02.10 – 0,042 = 1,958
Untuk t = 8 menit
mmol NaOH = mmol HCl awal – mmol HCl akhir
= M1V1 – M2V2 = 0,02.10 – 0,038 = 1,962
Untuk t = 15 menit
8 88
8 |Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009 |Kelompok Dua / Kimia B 2009
= M1V1 – M2V2 = 0,02.10 – 0,036 = 1,964
Untuk t = 25 menit
mmol NaOH = mmol HCl awal – mmol HCl akhir
= M1V1 – M2V2 = 0,02.10 – 0,032 = 1,968
Untuk t = 40 menit
mmol NaOH = mmol HCl awal – mmol HCl akhir
= M1V1 – M2V2 = 0,02.10 – 0,032 = 1,968
Untuk t = 65 menit
mmol NaOH = mmol HCl awal – mmol HCl akhir
= M1V1 – M2V2 = 0,02.10 – 0,028 = 1,972
Untuk t = 2880 menit
mmol NaOH = mmol HCl awal – mmol HCl akhir
= M1V1 – M2V2 = 0,02.10 – 0,002 = 1,998 c. Mencari nilai x Untuk t= 3 menit x = = , = 0,01958 Untuk t= 8 menit x = = , = 0,01962 Untuk t= 15 menit
9 99
9 |Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009 |Kelompok Dua / Kimia B 2009
x = = , = 0,01964 Untuk t= 25 menit x = = , = 0,01968 Untuk t= 40 menit x = = , = 0,01968 Untuk t= 65 menit x = = , = 0,01972 Untuk t= 2880 menit x = = , = 0,01998 d. Mencari nilai Untuk t= 3 menit = ,, = , = 2380,95 Untuk t= 8 menit = ,, = , = 2500 Untuk t= 15 menit = ,, = , = 2777 Untuk t= 25 menit = ,, = , = 3125 Untuk t= 40 menit
10 1010
10 |Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009
= ,, = , = 3125 Untuk t= 65 menit = ,, = , = 3571,42 Untuk t= 2880 menit = ,, = , = 50.000
Dari perhitungan di atas bisa didapatkan kurva sebagai berikut:
Dari grafik (antara t dengan
)yang didapat terlihat bahwa nilai regresi
mendekati 1, hal ini menunjukkan bahwa grafik yang dibuat telah sesuai dan
menunjukkan bahwa reaksi dari percobaan yang dilakukan merupakan reaksi berorde 2.
Metode Integral Non-Grafik
Untuk orde 2, rumus yang digunakan sebagai berikut:
kt = , maka Untuk t = 3 menit kt = k.3 = , , y = 699.43x - 861.33 R² = 0.914 -500 0 500 1000 1500 2000 2500 3000 3500 4000 4500 0 2 4 6 8
t(detik)
t(detik) Linear (t(detik))
11 1111
11 |Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009
k.3 = , , k.3 = 23,3 k.3 = , = 7,7 Untuk t = 8 menit kt = k.8 = , , k.8 = , , k.8 = 25,8 k.8 = , = 3,25 Untuk t = 15 menit kt = k.15 = , , k.15 = , , k.15 = 27,2 k.15 = , = 1,8 Untuk t = 25 menit kt =
12 1212
12 |Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009
k.25 = , , k.25 = , , k.25 = 30,75 k.25 = , = 1,23 Untuk t = 40 menit kt = k.40 = , , k.40 = 30,75 = 0,76 Untuk t = 65 menit kt = k.65 = , , k.65 = 35,2 = 0,54 Untuk t = 2880 menit kt = k.2880 = , , k.2880 = , , k.2880 = 499,5
13 1313
13 |Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009
k.2880 = ,
= 0,17
IX. DISKUSI :
Percobaan ini dilakukan ulang, karena pada percobaan sebelumnya volume yang didapat tidak sesuai karena menghasilkan nilai minus pada perhitungan menggunakan metode grafik. Untuk itu dilakukan praktikum ulang sehingga didapatkan data volume yang sesuai dan didapatkan grafik sebagai berikut.
Pada percobaan sebelumnya, kesalahan yang terjadi diakibatkan oleh praktikan yang kelebihan saat melakukan titrasi, sehingga volume yang didapatkan lebih dari 9 ml, hal ini mengakibatkan hasil perhitungan tidak sesuai dan tidak bisa dihasilkan grafik yang sesuai. Tetapi setelah dilakukan percobaan ulang, didapatkan volume titrasi yang sesuai dengan volume maksimal pada larutan yang didiamkan selama 2 hari menghasilkan volume titrasi sebesar 9,9 ml.
X. KESIMPULAN :
Reaksi saponifikasi dengan persamaan
CH3COOC2H5(aq)+NaOH(aq) CH3COOH(aq)+C2H5OH(aq) memiliki orde reaksi 2. Dan percobaan yang dilakukan sudah sesuai karena volume yang didapatkan sudah sesuai, sebagai berikut:
y = 699.43x - 861.33 R² = 0.914 -500 0 500 1000 1500 2000 2500 3000 3500 4000 4500 0 2 4 6 8
t(detik)
t(detik) Linear (t(detik))14 1414
14 |Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009
t(menit) Volume titrasi
3 7,9 8 8,1 15 8,2 25 8,4 40 8,4 65 8,6 2880 9,9
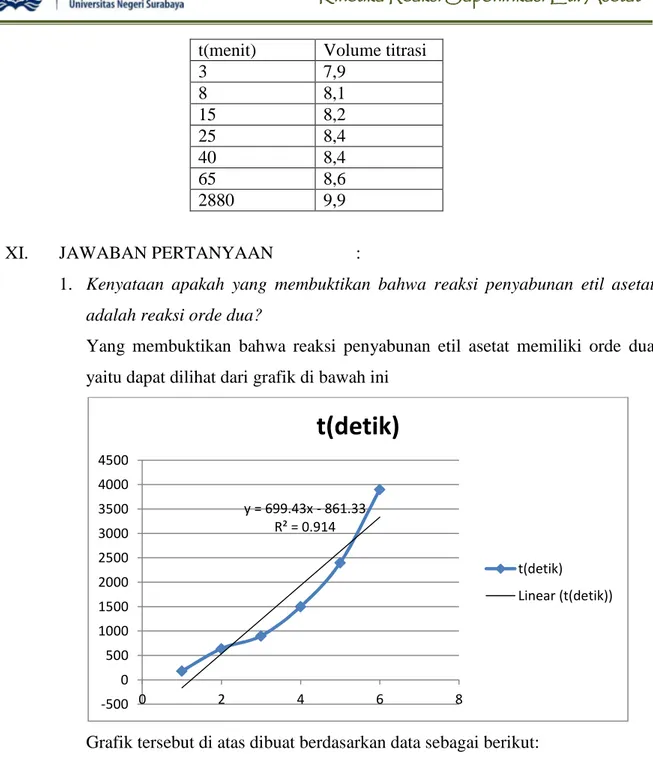
XI. JAWABAN PERTANYAAN :
1. Kenyataan apakah yang membuktikan bahwa reaksi penyabunan etil asetat adalah reaksi orde dua?
Yang membuktikan bahwa reaksi penyabunan etil asetat memiliki orde dua yaitu dapat dilihat dari grafik di bawah ini
Grafik tersebut di atas dibuat berdasarkan data sebagai berikut:
1/((a-x)) t(detik) 2380.95 180 2500 640 2777 900 3125 1500 3125 2400 3571.42 3900 y = 699.43x - 861.33 R² = 0.914 -500 0 500 1000 1500 2000 2500 3000 3500 4000 4500 0 2 4 6 8
t(detik)
t(detik) Linear (t(detik))
15 1515
15 |Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009
Nilai regresi yang mendekati satu menunjukkan bahwa perhitungan menggunakan metode grafik untuk orde dua sesuai dengan reaksi penyabunan etil asetat.
2. Apakah perbedaan antara orde reaksi dengan kemolekulan reaksi?
• Orde reaksi adalah banyaknya faktor konsentrasi zat reaktan yang mempengaruhi kecepatan reaksi.
• Kemolekulan reaksi merupakan banyaknya molekul zat pereaksi (reaktan) dalam sebuah persamaan stoikiometri reaksi yang sederhana. Kemolekulan reaksi selalu berupa bilangan bulat positif.
Contoh: Reaksi: a A + b B c C + d D Kemolekulan reaksinya = a + b
Reaksi: 2 A + B 3 C + 2 D Kemolekulan reaksinya = 2 + 1 = 3
3. Apakah yang mempengaruhi laju reaksi ? Jelaskan!
Faktor yang mempengaruhi laju reaksi
Laju reaksi dipengaruhi oleh beberapa faktor, antara lain: Luas permukaan sentuh
Luas permukaan sentuh memiliki peranan yang sangat penting dalam banyak, sehingga menyebabkan laju reaksi semakin cepat. Begitu juga, apabila semakin kecil luas permukaan bidang sentuh, maka semakin kecil tumbukan yang terjadi antar partikel, sehingga laju reaksi pun semakin kecil. Karakteristik kepingan yang direaksikan juga turut berpengaruh, yaitu semakin halus kepingan itu, maka semakin cepat waktu yang dibutuhkan untuk bereaksi; sedangkan semakin kasar kepingan itu, maka semakin lama waktu yang dibutuhkan untuk bereaksi.
Suhu
Suhu juga turut berperan dalam mempengaruhi laju reaksi. Apabila suhu pada suatu reaksi yang berlangusng dinaikkan, maka menyebabkan partikel semakin aktif bergerak, sehingga tumbukan yang terjadi semakin sering, menyebabkan laju reaksi semakin besar. Sebaliknya, apabila suhu
16 1616
16 |Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009
diturunkan, maka partikel semakin tak aktif, sehingga laju reaksi semakin kecil.
Katalis
Katalis adalah suatu zat yang mempercepat laju reaksi kimia pada suhu tertentu, tanpa mengalami perubahan atau terpakai oleh reaksi itu sendiri. Suatu katalis berperan dalam reaksi tapi bukan sebagai pereaksi ataupun produk. Katalis memungkinkan reaksi berlangsung lebih cepat atau memungkinkan reaksi pada suhu lebih rendah akibat perubahan yang dipicunya terhadap pereaksi. Katalis menyediakan suatu jalur pilihan dengan energi aktivasi yang lebih rendah. Katalis mengurangi energi yang dibutuhkan untuk berlangsungnya reaksi.
Katalis dapat dibedakan ke dalam dua golongan utama: katalis homogen dan katalis heterogen. Katalis heterogen adalah katalis yang ada dalam fase berbeda dengan pereaksi dalam reaksi yang dikatalisinya, sedangkan katalis homogen berada dalam fase yang sama. Satu contoh sederhana untuk katalisis heterogen yaitu bahwa katalis menyediakan suatu permukaan di mana pereaksi-pereaksi (atau substrat) untuk sementara terjerat. Ikatan dalam substrat-substrat menjadi lemah sedemikian sehingga memadai terbentuknya produk baru. Ikatan atara produk dan katalis lebih lemah, sehingga akhirnya terlepas.
Katalis homogen umumnya bereaksi dengan satu atau lebih pereaksi untuk membentuk suatu perantarakimia yang selanjutnya bereaksi membentuk produk akhir reaksi, dalam suatu proses yang memulihkan katalisnya. Berikut ini merupakan skema umum reaksi katalitik, di mana C melambangkan katalisnya:
... (1)
... (2)
Meskipun katalis (C) termakan oleh reaksi 1, namun selanjutnya dihasilkan kembali oleh reaksi 2, sehingga untuk reaksi keseluruhannya menjadi :
17 1717
17 |Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009
Beberapa katalis yang pernah dikembangkan antara lain berupa katalis Ziegler-Natta yang digunakan untuk produksi masal polietilen dan polipropilen. Reaksi katalitis yang paling dikenal adalah proses Haber, yaitu sintesis amonia menggunakan besi biasa sebagai katalis. Konverter katalitik yang dapat menghancurkan produk emisi kendaraan yang paling sulit diatasi, terbuat dari platina dan rodium.
Molaritas
Molaritas adalah banyaknya mol zat terlarut tiap satuan volum zat pelarut. Hubungannya dengan laju reaksi adalah bahwa semakin besar molaritas suatu zat, maka semakin cepat suatu reaksi berlangsung. Dengan demikian pada molaritas yang rendah suatu reaksi akan berjalan lebih lambat daripada molaritas yang tinggi.
Konsentrasi
Karena persamaan laju reaksi didefinisikan dalam bentuk konsentrsi reaktan maka dengan naiknya konsentrasi maka naik pula kecepatan reaksinya. Artinya semakin tinggi konsentrasi maka semakin banyak molekul reaktan yang tersedia dengan demikian kemungkinan bertumbukan akan semakin banyak juga sehingga kecepatan reaksi meningkat.
4. Apakah yang dimaksud dengan tetapan laju reaksi ?
Tetapan laju reaksi (k) adalah perbandingan antara laju reaksi dengan konsentrasi reaktan. Nilai k akan semakin besar jika reaksi berlangsung cepat, walaupun dengan konsentrasi reaktan dalam jumlah kecil. Nilai k hanya dapat diperoleh melalui analisis data eksperimen, tidak berdasarkan stoikiometri maupun koefisien reaksi.
XII. DAFTAR PUSTAKA :
Anonim A.2011.Laju Reaksi.http://Wikipedia.org (diakses pada Minggu, 20 November 2011,Pukul : 19.50 WIB).
Anonim B.2000.Orde Reaksi.http://bebas.ui.ac.id (diakses pada Minggu, 20 November 2011, Pukul : 19.55 WIB)
18 1818
18 |Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009|Kelompok Dua / Kimia B 2009
Irawan, wira. 2006. Laporan Praktikum : Proses Reaksi Saponifikasi. Medan: Jurusan Teknik Kimia, Fakultas Teknologi Industri. Institut Teknologi Medan.
Sahrun.2010.Laporan Tetap Praktikum Kimia Fisika II.Mataram:Jurusan Kimia, Fakultas MIPA, Universitas Mataram.
Supardiyo.2009.Kimia Dasar.http://wordpress.com (diakses pada Minggu, 20 November 2011, Pukul : 20.01 WIB)