DAN SUKROSA TERHADAP PEMBENTUKAN UMBI
LAPIS MIKRO BAWANG MERAH (Allium cepa L.
Aggregatum group) cv. BIMA CURUT
Oleh PURNAWATI
A34304010
PROGRAM STUDI HORTIKULTURA
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
2008
SUKROSA TERHADAP PEMBENTUKAN UMBI LAPIS
MIKRO BAWANG MERAH (Allium cepa L. Aggregatum
group) cv. BIMA CURUT
Skripsi sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Fakultas Pertanian Institut Pertanian Bogor
Oleh Purnawati A34304010
PROGRAM STUDI HORTIKULTURA
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
2008
PURNAWATI. Pengaruh Chlorocholine Chloride (CCC) dan Sukrosa terhadap Pembentukan Umbi Lapis Mikro Bawang Merah (Allium cepa L. Aggregatum group) cv. Bima Curut. Dibimbing oleh DINY DINARTI.
Penelitian ini bertujuan untuk mempelajari pengaruh CCC dan sukrosa terhadap pembentukan umbi lapis mikro bawang merah (Allium cepa L. Aggregatum group) cv. Bima Curut. Penelitian ini dilaksanakan mulai bulan September 2007 dan berakhir pada bulan Mei 2008. Penelitian ini dilaksanakan di Laboratorium Kultur Jaringan, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor.
Rancangan perlakuan yang digunakan dalam penelitian ini adalah Rancangan Acak Lengkap (RAL) dengan 2 faktor. Faktor pertama yaitu 3 taraf konsentrasi sukrosa (90 g/l, 120 g/l, dan 150 g/l). Faktor yang kedua adalah 4 taraf konsentrasi CCC masing-masing 0 ppm, 5 ppm, 50 ppm, dan 100 ppm. Penelitian ini terdiri dari 12 kombinasi perlakuan. Setiap kombinasi perlakuan diulang sebanyak 10 ulangan, sehingga terdapat 120 kultur.
Bahan tanaman yang digunakan sebagai eksplan dalam penelitian ini adalah umbi bawang merah yang mengandung setengah basal plate kultivar Bima Curut. Pengamatan dilakukan setiap minggu selama 8 MSP pada media pengumbian dengan peubah yang diamati antara lain: persentase kontaminasi, jumlah tunas, jumlah daun (jumlah daun total dan daun hijau), dan jumlah akar. Pada akhir pengamatan dilakukan pengukuran terhadap diameter umbi mikro diukur dari bagian yang paling lebar, bobot umbi mikro, tinggi tanaman, dan jumlah umbi yang terbentuk.
Perlakuan sukrosa 120 g/l dan 150 g/l nyata lebih baik terhadap bobot umbi dan diameter umbi bawang merah. Bobot umbi yang dihasilkan pada perlakuan 120 g/l sukrosa sebesar 0.177 gram dan pada perlakuan sukrosa 150 g/l sebesar 0.205 gram sedangkan diameter umbi sebesar 0.598 cm dan 0.512 cm masing-masing dihasilkan oleh perlakuan sukrosa 120 g/l dan 150 g/l.Konsentrasi sukrosa 90 g/l menghasilkan bobot umbi terkecil (0.089 gram), diameter umbi terkecil (0.288 cm), jumlah tunas tertinggi pada 7 MSP dan 8 MSP yaitu 1.75 tunas, dan tinggi tanaman sebesar 21.38 cm tetapi tidak berbeda nyata terhadap perlakuan sukrosa 120 g/l yang menghasilkan tinggi tanaman 18.69 cm.
Pemberian CCC pada berbagai konsentrasi yang diberikan tidak berpengaruh terhadap jumlah umbi lapis mikro, bobot umbi, dan diameter umbi yang dihasilkan. Perlakuan 100 ppm CCC menghasilkan jumlah akar terendah pada 7 MSP (13.5) dan 8 MSP (15.8) serta tinggi tanaman terendah yaitu 15.69 cm tetapi tidak berbeda nyata terhadap perlakuan 5 ppm yang menghasilkan tinggi tanaman 18.57 cm. Perlakuan tanpa pemberian CCC memberikan hasil tertinggi terhadap jumlah tunas pada 7 MSP dan 8 MSP (1.77 tunas), jumlah daun total tertinggi pada 3 MSP, 5 MSP, dan 7 MSP (2.5, 5.8, dan 6.4 tunas), dan jumlah daun hijau tertinggi pada 5 MSP, 6 MSP, dan 7 MSP (2.5, 3.0, dan 3.0).
Interaksi kedua perlakuan memberikan pengaruh yang nyata terhadap jumlah daun total pada 2 MSP dan 4 MSP dan sangat nyata pada 3 MSP. Interaksi antara konsentrasi sukrosa 90 g/l dan CCC 0 mg/l menghasilkan jumlah daun total sebanyak 4.0 daun pada 4 MSP.
SUKROSA TERHADAP PEMBENTUKAN UMBI LAPIS MIKRO BAWANG MERAH (Allium cepa L. Aggregatum group) cv. BIMA CURUT.
Nama : Purnawati NRP : A34304010
Menyetujui, Dosen Pembimbing
Ir Diny Dinarti, MSi. NIP. 131 999 963
Mengetahui, Dekan Fakultas Pertanian
Prof. Dr Ir Didy Sopandie, M.Agr. NIP. 131 124 019
Penulis dilahirkan di Purworejo, Propinsi Jawa Tengah pada tanggal 26 Januari 1986. Penulis merupakan anak ke-4 dari pasangan Bapak Sudarmono dan Ibu Ponisah.
Tahun 1998 penulis lulus dari SD Negeri Rejowinangun, kemudian pada tahun 2001 penulis menyelesaikan studi di SLTP Negeri 1 Kemiri. Pada tahun 2004 penulis lulus dari SMU Negeri 2 Purworejo. Pada tahun yang sama (2004) penulis diterima di Institut Pertanian Bogor melalui jalur USMI pada program studi Hortikultura, Departemen Budidaya Pertanian, Fakultas Pertanian.
Penulis aktif di beberapa organisasi seperti HIMAGRON (Himpunan Mahasiswa Agronomi) pada tahun 2005-2006, FKRD (Forum Komunikasi Rohis Departemen) pada tahun 2006-2007, dan GAMAPURI (Gabungan Mahasiswa Purworejo di IPB) pada tahun 2004-2008. Selama mengikuti perkuliahan di IPB, penulis pernah menjadi asisten mata kuliah Biologi pada tahun 2006-2007.
Puji syukur penulis panjatkan ke hadirat Allah SWT yang telah melimpahkan rahmat dan hidayah-Nya sehingga skripsi ini dapat diselesaikan dengan baik.
Penelitian pengaruh Chlorocholine Chloride (CCC) dan Sukrosa terhadap Pembentukan Umbi Lapis Mikro Bawang Merah (Allium cepa L. Aggregatum group) cv. Bima Curut dilaksanakan karena terdorong keinginan untuk mempelajari sejauh mana pengaruh CCC dan sukrosa dalam menginduksi pembentukan umbi lapis mikro bawang merah kultivar Bima Curut. Penulis menyampaikan terima kasih kepada:
1. Ibu dan Bapak tercinta atas segala pengorbanan, curahan kasih sayang, perhatian, doa, dorongan serta semangat yang selalu diberikan sehingga penulis dapat menyelesaikan studi di IPB dengan baik.
2. Ir Diny Dinarti, MSi. selaku pembimbing skripsi atas perhatian, dorongan, kesabaran, dan saran-saran yang berharga.
3. Dr Ir Winarso Drajad Widodo, MSi. selaku pembimbing akademik atas bimbingan, arahan dan kesabarannya.
4. Dr Dewi Sukma, SP. MSi. dan Dr Ir Darda Efendi, MSi. selaku dosen penguji atas masukan-masukan yang diberikan.
5. Pak Joko di Laboratorium Fisiologi Tanaman atas bantuannya.
6. Mba’ Hariyani, Mba’ Hariyati, Mas Tukh Fatul Akhyar, Mas Slamet, dan Mas Pendi atas kasih sayang, perhatian, dorongan, dan semangat yang diberikan.
7. Adik-adikku tercinta: Rohman, Rafi, dan Britcaine atas kelucuan dan senyum riangnya yang selalu menggugah semangat penulis.
8. Teman-teman seperjuangan: Yayu, Melly, Hana, Aji, dan Dony atas kebersamaan dan bantuannya.
9. Mba’ Ella, Mba’ Urip, Ka’ Rahmat, dan Mba’ Retno atas masukan dan saran-saran yang diberikan.
10. Wulan, Putri, Santi, Dede’, Nia, Yuli, Mega, Ratna, Awi, Rima, Indah, Nopy, dan warga wisma Nur Jannah atas persahabatan yang indah.
persahabatan ini akan selalu terjalin.
12. Teman-teman di wisma Nurul Fitri yang selalu ceria dalam kebersamaan. 13. Anjas, April, Anis, Ambar, Uus, Ria, Yuli, Retno, dan teman-teman
GAMAPURI yang selalu memberikan dukungannya kepada penulis. 14. Semua pihak yang telah membantu penyelesaian tugas akhir ini. Semoga hasil penelitian ini bermanfaat bagi yang memerlukan.
Bogor, Agustus 2008
Halaman PENDAHULUAN Latar belakang ... 1 Tujuan ... 4 Hipotesis ... 4 TINJAUAN PUSTAKA Deskripsi Bawang Merah Kultivar Bima Curut ... 5
Kultur Jaringan ... 5
Eksplan ... 6
Media Kultur Jaringan... 7
Sukrosa ... 8
Zat Pengatur Tumbuh ... 10
BAHAN DAN METODE Waktu dan Tempat ... 12
Bahan dan Alat ... 12
Metode Penelitian... 12
Pelaksanaan ... 13
Pengamatan... 15
HASIL DAN PEMBAHASAN Kondisi Umum Kultur ... 17
Jumlah Umbi Lapis Mikro ... 19
Bobot Umbi ... 23
Diameter Umbi... ... 25
Anatomi Umbi ... 28
Tinggi Tanaman ... 30
Jumlah Tunas Mikro ... 33
Jumlah Daun Total ... 36
Jumlah Daun Hijau ... 40
Jumlah Akar ... 44
KESIMPULAN DAN SARAN Kesimpulan ... 48
Saran... ... 48
DAFTAR PUSTAKA ... 49
Nomor Halaman
Teks
1. Rekapitulasi Hasil Sidik Ragam Pengaruh Sukrosa dan CCC terhadap
Parameter yang Diamati……… 18 2. Nilai Rata-rata Bobot Umbi Bawang Merah (Allium cepa L. Aggregatum
group) cv. Bima Curut pada Beberapa Konsentrasi Sukrosa………... 24 3. Nilai Rata-rata Diameter Umbi Bawang Merah (Allium Cepa L.
Aggregatum group) cv. Bima Curut pada Beberapa Konsentrasi Sukrosa.. 26 4. Nilai Rata-rata Tinggi Tanaman Bawang Merah (Allium cepa L.
Aggregatum group) cv. Bima Curut pada Beberapa Sukrosa.……...…... 31 5. Nilai Rata-rata Tinggi Tanaman Bawang Merah (Allium cepa L.
Aggregatum group) cv. Bima Curut pada Beberapa Konsentrasi CCC ... 32 6. Nilai Rata-rata Jumlah Tunas Mikro Bawang Merah (Allium cepa L.
Aggregatum group) cv. Bima Curut pada Beberapa Konsentrasi Sukrosa. 34 7. Nilai Rata-rata Jumlah Tunas Mikro Bawang Merah
(Allium Cepa L. Aggregatum group) cv. Bima Curut
pada Beberapa Konsentrasi CCC………. 35 8. Nilai Rata-rata Jumlah Daun Total Bawang Merah (Allium Cepa L.
Aggregatum group) cv. Bima Curut pada Beberapa Konsentrasi Sukrosa… 37 9. Nilai Rata-rata Jumlah Daun Total Bawang Merah (Allium Cepa L.
Aggregatum group) cv. Bima Curut pada Beberpa Konsentrasi CCC…... 39 10. Nilai Rata-rata Interaksi CCC dan Sukrosa Terhadap Jumlah Daun Total
Bawang Merah (Allium cepa L. Aggregatum group) cv. Bima Curut
pada 4 MSP…….………. 40 11. Nilai Rata-rata Jumlah Daun Hijau Bawang Merah (Allium Cepa L.
Aggregatum group) cv. Bima Curut pada Beberapa Konsentrasi Sukrosa… 41 12. Nilai Rata-rata Jumlah Daun Hijau Bawang Merah
(Allium Cepa L. Aggregatum group) cv. Bima Curut
pada Beberapa Konsentrasi CCC………..…... 43 13. Nilai Rata-rata Jumlah Akar Bawang Merah (Allium cepa L.
Lampiran
1. Perkembangan Luas Panen, Produksi, dan Produktivitas Bawang Merah di
Indonesia Tahun 2000-2006 ... 53
2. Perkembangan Ekspor dan Impor Bawang Merah di Indonesia Tahun 2003-2006 ... 53
3. Komposisi Media Murashige dan Skoog (MS)……….… 54
4. Koefisien Keragaman Jumlah Tunas Mikro Bawang Merah. ... . 55
5. Koefisien Keragaman Jumlah Daun Total Bawang Merah ... . 56
6. Koefisien Keragaman Jumlah Daun Hijau Bawang Merah. ... . 57
7. Koefisien Keragaman Tinggi Tanaman Bawang Merah. ... . 58
8. Koefisien Keragaman Jumlah Umbi Mikro Bawang Merah. ... . 58
9. Koefisien Keragaman Diameter Umbi Mikro Bawang Merah… ... . 58
10.Koefisien Keragaman Bobot Umbi Mikro Bawang Merah. ……….……... 58
Nomor Halaman
Teks
1. Struktur bangun sukrosa... 8 2. Struktur bangun CCC……….. 11
3. Morfologi Tunas Mikro Bawang Merah
(Allium cepa L. Aggregatum group)cv. Bima Curut pada 6 MSP... 17
4. Nilai Rata-rata Jumlah Umbi Bawang Merah (Allium cepa L. Aggregatum group)cv. Bima Curut pada Beberapa
Konsentrasi Sukrosa………...……… 20 5. Kultur yang Mengalami Multiplikasi pada Perlakuan 90 g/l (A),
pada Perlakuan 120 g/l, dan pada Perlakuan 150 g/l………... 21 6. Nilai Rata-rata Jumlah Umbi Bawang Merah (Allium cepa L.
Aggregatum group) cv. Bima Curut pada Beberapa Konsentrasi CCC... 22 7. Umbi lapis Mikro yang Dihasilkan pada Perlakuan 0 ppm CCC (A)
dan Perlakuan 50 ppm CCC (B)………..…...……… 23 8. Nilai Rata-rata Bobot Umbi Bawang Merah (Allium cepa L.
Aggregatum group) cv. Bima Curut pada Beberapa Konsentrasi CCC... 25 9. Nilai Rata-rata Diameter Umbi Bawang Merah (Allium cepa L.
Aggregatum group) cv. Bima Curut pada Beberapa Konsentrasi CCC..… 27 10. Anatomi Umbi Bawang Merah ((Allium cepa L. Aggregatum group)
cv. Bima Curut Melalui Mikroskop Tiga Dimensi... . 28
11. Struktur Umbi Bawang Merah secara In Vitro (A) dan Bawang Bombay di Lapang (B) ... . 29 12. Tinggi Tanaman Tertinggi pada Perlakuan Sukrosa 90 g/l.. ... . 31
13. Jumlah Tunas Mikro pada Perlakuan 90 g/l (A)
dan Perlakuan 120 g/l (B). ………..…. 33 14. Jumlah Tunas Mikro pada Perlakuan 5 ppm CCC (A)
dan Perlakuan 50 ppm CCC (B)….…….………..….. 36 15. Eksplan Sebelum Muncul Daun (A) dan Eksplan Berdaun (B)... 38
16. Grafik Regresi Jumlah Daun Total terhadap CCC pada 8 MSP.…..…... 39 17. Daun yang Masih Hijau (A) dan Daun mengalami senesen (B)
pada Kultur Bawang Merah………..………... 42 18. Grafik Regresi Jumlah Daun Hijau terhadap CCC pada 8 MSP.…..….. 44 19. Nilai Rata-rata Jumlah Akar Kultur Bawang Merah (Allium cepa L.
Aggregatum group) cv. Bima Curut pada Perlakuan Sukrosa...……..… 45 20. Grafik Regresi Jumlah Akar terhadap CCC pada 8 MSP.………..…… 47
Latar Belakang
Bawang merah banyak dibudidayakan di kawasan Asia Tenggara (India, Malaysia, Filipina, Indonesia, Srilanka dan Thailand), Afrika Barat (Ghana, Nigeria, Sierra Leone, Togo, Ivory Coast), Afrika Timur dan Tengah, Amerika Selatan, dan Karibia (Rabinowitch dan Kamenetsky, 2002) dan (Tindall, 1983).
Bawang merah merupakan salah satu jenis komoditas yang mempunyai arti penting bagi masyarakat, baik dilihat dari nilai ekonomisnya maupun kandungan gizinya. Bawang merah digemari karena karakteristik rasa dan aroma yang khas dari tanaman ini. Aroma bawang merah disebabkan karena aktivitas enzim allinase. Aroma ini akan tercium apabila jaringan tanaman rusak karena enzim allinase akan mengubah senyawa s-alkil sistein sulfoksida yang mengandung belerang. Umbi bawang merah juga mengandung allisin, flavonol, kuersetin, dan kuersetin glikosida yang dapat dicerna dalam kadar tinggi, yaitu sekitar 200-1000 mg/kg. Semua senyawa tersebut bersifat anti bakteri dan anti cendawan serta menunjukkan aktivitas enzim anti kanker dan bersifat antikoagulan (Rubatzky dan Yamaguchi, 1998).
Bawang merah merupakan salah satu komoditas sayuran utama yang tergolong ke dalam kelompok lima besar. Pada tahun 2006 data Direktorat Jenderal Hortikultura menunjukkan bahwa ketersediaan bawang merah mencapai 2.21 kg per kapita. Angka produksi ini lebih besar daripada angka konsumsi yaitu sebesar 2.08 kg per kapita. Angka ketersediaan yang lebih besar daripada angka konsumsi tidak berarti bahwa tidak ada permasalahan dalam aspek pengembangan. Permasalahan utama dalam pengembangan produksi bawang merah adalah ketersediaan bibit bermutu yang masih sangat kurang terutama untuk musim tanam utama yaitu bulan April sampai Juli. Kualitas umbi yang dihasilkan semakin menurun yang ditandai dengan semakin mengecilnya ukuran umbi (Majalah Hortikultura, 2007 dan Direktorat Jendelal Hortikultura, 2008).
Berdasarkan data BPS (2008) peningkatan luas panen, produksi dan produktivitas bawang merah di Indonesia selalu berfluktuasi. Peningkatan luas panen bawang merah tidak diikuti dengan peningkatan produksi bawang merah itu
sendiri (Tabel Lampiran 1). Hal tersebut mengakibatkan menurunnya produktivitas bawang merah. Permintaan terhadap bawang merah dari tahun ke tahun selalu mengalami perubahan. Meskipun jumlah produksi sudah dapat memenuhi kebutuhan bawang merah dalam negeri, impor bawang merah terus terjadi dalam jumlah besar karena harganya lebih murah serta penampilan bawang merah yang menarik (Tabel Lampiran 2). Menurut Wattimena (2000) pengembangan dan peningkatan produksi dipengaruhi oleh beberapa faktor diantaranya penyediaan bibit yang berkualitas.
Bawang merah dapat diperbanyak secara vegetatif maupun generatif. Teknik perbanyakan yang sering dilakukan petani adalah dengan menggunakan umbi. Hal ini dikarenakan sulitnya mendapatkan bibit dari biji botani (True
Shallot Seed atau TSS). Biji bawang merah tidak dapat disimpan terlalu lama
karena akan kehilangan vigoritasnya serta kemampuan biji semakin lemah (Putrasamedja, 1995). Alternatif dalam penyediaan umbi bibit bawang merah dapat dilakukan dengan teknik kultur jaringan. Menurut Gunawan (1992) salah satu metode perbanyakan tanaman berkualitas tinggi adalah menggunakan teknik kultur jaringan. Teknik ini sangat menguntungkan petani dalam menyediakan bibit bawang merah yang bebas patogen (jamur dan bakteri) atau virus. Keuntungan lain penggunaan teknik kultur jaringan adalah penyediaan bibit dapat dilakukan dalam waktu yang relatif singkat dengan hasil yang tinggi.
Teknik kultur jaringan bawang merah secara in vitro bertujuan untuk memproduksi umbi bibit mikro bawang merah. Penyediaan umbi bibit mikro bawang merah dapat dilakukan melalui tiga cara, yaitu dengan menggunakan tunas mikro, umbi lapis mikro, dan embriosomatik bawang merah.
Pembentukan umbi bawang merah di lapangan pada tanaman bawang merah berlangsung sebagai akibat dari respon terhadap lamanya fotoperiodisme, temperatur yang relatif tinggi, dan perbedaan kultivar yang dapat dibedakan dari panjang hari minimal yang dibutuhkan untuk menginduksi setiap kultivar dalam membentuk umbi. Pembentukan umbi juga dipengaruhi oleh komposisi media dan zat penghambat tumbuh (Rabinowitch dan Kamenetsky, 2002).
Penambahan karbohidrat dan zat penghambat tumbuh diperlukan untuk merangsang pembentukan umbi secara in vitro. Karbohidrat merupakan sumber
energi tanaman dalam kultur sebagai pengganti energi yang tidak dapat diperoleh dari fotosintesis (Fardani, 2005). Beberapa jenis dari retardan yang dapat digunakan dalam menginisiasi pembentukan umbi adalah ancymidol, SADH, daminozide, paclobutrazol, CCC, dan AMO 1618 (Wattimena, 1988).
Le guen-Le saos (2002) menyatakan bahwa umbi mikro bawang merah mulai terbentuk pada 12 MSP (Minggu Setelah Perlakuan) dalam media yang mengandung 30-50 g/l sukrosa. Berdasarkan penelitian Fardani (2005) umbi mikro belum mampu terbentuk pada konsentrasi sukrosa 90 g/l, yang terlihat hanyalah penggembungan pangkal tunas bawang merah yang menyerupai umbi. Rahmawati (2007) berhasil menginduksi umbi lapis mikro bawang merah hingga 1.82 umbi pada perlakuan SADH 0 mg/l dengan penambahan sukrosa 150 g/l. Umbi lapis mikro bawang merah yang dapat terbentuk sebesar 90.83% dari seluruh perlakuan. Angelia (2008) berhasil menginduksi umbi lapis mikro bawang merah lebih besar daripada penelitian Rahmawati (2007), yaitu sebesar 2.3 umbi pada perlakuan 0 mg/l paclobutrazol dan 150 g/l sukrosa.
Konsentrasi retardan yang digunakan dalam menginduksi pembentukan umbi berbeda sesuai dengan jenis retardan yang digunakan. Pada konsetrasi 10-15 µM, ancymidol dapat menginduksi terbentuknya umbi bawang merah (Le guen-Le saos et al., 2002). Perlakuan tanpa pemberian SADH menghasilkan jumlah umbi terbanyak yaitu 1.82 umbi (Rahmawati, 2007).
Arteca (1996) menyebutkan bahwa Chlorocholine Chloride (CCC) termasuk jenis retardan yang memiliki kemampuan menghambat biosintesis giberellin yang pada akhirnya dapat merangsang pembentukan umbi mikro. Menurut Audus (2006) bahan aktif yang dimiliki cycocel adalah chlormequat. Nama lain senyawa ini adalah 2-chloroethyl-trimethylammonium chloride. Penelitian tentang pengaruh CCC terhadap pembentukan umbi lapis mikro bawang merah belum pernah dilakukan, sehingga perlu dilakukan penelitian mengenai konsentrasi CCC yang dapat menginduksi pembentukan umbi lapis mikro bawang merah.
Tujuan
Penelitian ini bertujuan untuk mempelajari pengaruh CCC dan sukrosa terhadap pembentukan umbi lapis mikro bawang merah (Allium cepa L. Aggregatum group) cv. Bima Curut.
Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah:
1. Konsentrasi sukrosa yang tinggi dapat menginduksi pembentukan umbi lapis mikro bawang merah (Allium cepa L. Aggregatum group).
2. Retardan jenis CCC dapat menginduksi pembentukan umbi lapis mikro bawang merah (Allium cepa L. Aggregatum group).
3. Terdapat interaksi antara CCC dan sukrosa dalam menginduksi pembentukan umbi lapis mikro bawang merah (Allium cepa L. Aggregatum group).
TINJAUAN PUSTAKA
Deskripsi Bawang Merah Kultivar Bima Curut
Salah satu kultivar bawang merah yang dibudidayakan petani adalah kultivar Bima Curut. Kultivar Bima Curut termasuk kultivar lokal Brebes. Bima Curut mempunyai penampakan warna daun hijau kebiruan. Setiap kultivar bawang merah mempunyai ciri lengkungan daun yang berbeda satu sama lain. Lengkungan daun tidak terlihat pada Bima Curut. Pertumbuhan daun Bima Curut lurus ke atas dengan kekar. Bentuk umbi merupakan karakteristik yang dapat dibedakan antara beberapa kultivar bawang merah. Umbi Bima Curut berbentuk datar dengan warna umbi merah cerah. Bima Curut memiliki anakan berkisar antara 3 anakan sampai 22 anakan (Sari, 2007).
Kultur Jaringan
Menurut Gunawan (1992) kultur jaringan merupakan suatu metode untuk mengisolasi bagian-bagian dari tanaman seperti protoplasma, sel, kelompok sel, jaringan dan organ serta menumbuhkannya dalam lingkungan aseptik. Bagian-bagian tanaman tersebut akan memperbanyak diri dan beregenerasi menjadi tanaman utuh kembali. Metode ini merupakan pembuktian terhadap teori totipotensi sel. Teori ini menyatakan bahwa dalam masing-masing sel tumbuhan mungkin mengandung informasi genetik dan atau sarana fisiologis tertentu yang mampu membentuk tanaman lengkap bila ditempatkan dalam lingkungan yang sesuai.
Kultur jaringan merupakan suatu metode untuk mendapatkan tanaman dalam jumlah besar dalam waktu yang relatif singkat serta bebas penyakit. Multiplikasi tanaman yang tinggi dapat dihasilkan dari tanaman yang ditumbuhkan secara in vitro. Produksi bibit berkualitas juga dapat dihasilkan dengan metode kultur jaringan. Produksi bibit yang berkualitas baik, homogen, dalam jumlah banyak, dan dalam waktu singkat sulit didapatkan dengan teknik budidaya secara konvensional (Hobir et al., 1992).
Wattimena et al. (1992) menyatakan bahwa jenis tanaman yang diperbanyak dengan teknik kultur jaringan ditujukan terutama bagi tanaman yang
mengalami masalah seperti daya perkecambahan bijinya yang rendah, tanaman hibrida yang tetua jantannya steril, tanaman langka dan tanaman yang selalu diperbanyak dengan cara vegetatif.
Eksplan
Eksplan merupakan bagian dari tanaman yang digunakan sebagai bahan inisiasi dalam suatu kultur. Arah pertumbuhan dan perkembangan eksplan ditentukan oleh komposisi media, zat pengatur tumbuh, eksplan, genotipe, umur eksplan, letak pada cabang, kelamin serta lingkungan tumbuh. Setiap bagian tanaman dapat digunakan sebagai sumber eksplan tetapi sebaiknya dipilih bagian tanaman yang belum banyak mengalami perubahan bentuk dan diferensiasi fungsi (Gunawan, 1992).
Menurut Darwis (1992) daun, bunga, batang, akar, titik tumbuh, embrio, antera, meristem jaringan tertentu, sel, bahkan protoplas dapat digunakan sebagai eksplan. Keberhasilan penggunaan eksplan ini berbeda-beda. Penggunaan jaringan yang masih muda lebih diutamakan untuk mendapatkan hasil yang lebih tinggi daripada penggunaan jaringan yang sudah tua. Sebagai contoh pada penelitian
Solanum khasianum yang menunjukkan produksi kalus yang berbeda pada
penggunaan eksplan yang berbeda pada satu tanaman.
Ukuran eksplan juga berpengaruh terhadap keberhasilan kultur jaringan. Eksplan yang berukuran besar (>20 mm) lebih mudah mengalami kontaminasi daripada eksplan yang berukuran kecil (<20 mm) (George dan Sherrington, 1984). Ukuran eksplan yang terlalu kecil akan berkurang daya tahannya bila dikulturkan sedangkan bila terlalu besar maka akan sulit mendapatkan eksplan yang steril (Gunawan, 1992).
Media Kultur Jaringan
Pertumbuhan dan perkembangan eksplan pada kultur in vitro dipengaruhi oleh banyak hal, seperti komposisi media, zat pengatur tumbuh, eksplan, dan lingkungan kultur. Media kultur yang berbeda memberikan jenis nutrisi yang berbeda untuk pertumbuhan eksplan. Kebutuhan nutrisi setiap spesies tanaman berbeda satu sama lain (Bhojwani dan Razdan, 1983).
Menurut Gunawan (1988) media kultur dikatakan baik jika mengandung semua unsur-unsur yang diperlukan tanaman untuk pertumbuhannya. Unsur-unsur tersebut meliputi: hara makro, hara mikro, vitamin, gula, asam amino dan N organik, senyawa kompleks, buffer, arang aktif, zat pengatur tumbuh, dan zat pemadat. Menurut George dan Sherrington (1984) konsentrasi optimum dari setiap hara yang dikandung untuk menunjang laju pertumbuhan dan perkembangan maksimum sangat bervariasi. Perimbangan yang tepat antara senyawa organik, anorganik, dan zat pengatur tumbuh merupakan faktor yang sangat penting.
Tingkat kemasaman (pH) media berpengaruh terhadap pertumbuhan tanaman dalam kultur in vitro. Tingkat kemasaman media perlu diatur untuk menjaga agar fungsi membran sel dan sitoplasma tidak terganggu (Gunawan, 1992). Senyawa yang paling sering digunakan dalam pengaturan pH adalah NaOH dan HCl. Penambahan NaOH atau HCl dilakukan setelah semua larutan stok dan gula tercampur dan sebelum penambahan agar-agar. PH media yang terlalu rendah (<4.5) dan terlalu tinggi (lebih dari 7) dapat mempengaruhi pertumbuhan dan perkembangan kultur abnormal (Pierik, 1987).
Menurut Gunawan (1988) bahan pemadat yang sering digunakan adalah agar-agar. Hal ini dikarenakan agar-agar akan membeku pada temperatur <=450C dan mencair pada temperatur 1000C sehingga dalam temperatur kultur agar akan tetap dalam kondisi membeku yang stabil. Penggunaan agar- agar juga bertujuan agar senyawa-senyawa kimia yang terkandung dalam media tidak bereaksi dengan agar-agar. Selain itu agar tidak dicerna oleh enzim tanaman.
Sukrosa
Menurut Gunawan (1992) karbohidrat merupakan salah satu komponen yang dibutuhkan oleh berbagai macam tumbuhan dalam pemenuhan kebutuhan karbon dan energi. Sukrosa merupakan sumber karbon yang sering digunakan. Sukrosa berperan dalam menghasilkan energi dalam proses respirasi dan sebagai bahan pembentuk sel baru. Glukosa, maltosa dan rafinosa juga dapat digunakan sebagai pengganti sukrosa dalam menghasilkan energi akan tetapi kurang efektif. Sukrosa memiliki rumus bangun sebagai berikut:
Gambar 1. Struktur bangun sukrosa
Menurut Wattimena et al. (1992) sukrosa merupakan komponen yang wajib ada pada media sebagai sumber energi pada eksplan yang tidak berfotosintesis. Konsentrasi sukrosa yang tinggi pada media cenderung menginduksi pembentukan umbi sebagai cadangan makanan. Salisbury dan Ross (1995) menyatakan bahwa sukrosa merupakan sumber sel karbon dan energi paling aktif. Sukrosa digunakan sebagai cadangan karbohidrat yang akan digunakan untuk pertumbuhan sel. Menurut Harjadi (2005) sukrosa berperan penting dalam pertumbuhan vegetatif tanaman yang meliputi perkembangan akar, daun dan batang baru. Hal ini terjadi karena pada saat pembelahan sel-sel baru diperlukan karbohidrat dalam jumlah besar untuk membangun dinding-dinding sel yang mengandung protoplasma dan selulosa, sedangkan selusosa dan protoplasma disusun sebagian besar oleh gula.
Berbagai macam penelitian tentang pengaruh konsentrasi sukrosa terhadap pembentukan umbi sudah banyak dilakukan. Menurut Khuri dan Moorby (1995); Garner dan Blake (1989) dalam Khuri dan Moorby (1995) pembentukan umbi kentang mulai terbentuk setelah 6 minggu pada media yang mengandung sukrosa
80 g/l. Hasil penelitian Hidayat (1997) menunjukkan bahwa penambahan sukrosa sebesar 150 g/l pada media BDS mampu menginduksi umbi lapis mikro bawang merah kultivar Sumenep. Pada tahun yang sama (1997) Bonnier dan Tuyl juga berhasil menginduksi umbi mikro tanaman lily pada media MS dengan penambahan 90 g/l sukrosa dengan bantuan penggelapan. Penelitian Vreugdenhil
et al. (1998) menunjukkan bahwa penggunaan sukrosa 80 g/l berhasil
menginduksi umbi mikro kentang lebih baik daripada penggunaan sukrosa sebesar 10 g/l yang tidak menghasilkan kultur kentang berumbi.
Penelitian Le guen-Le saos et al. (2002) berhasil menginduksi umbi lapis mikro bawang merah (Allium cepa L. Aggregatum Group) pada media yang berisi 30 – 50 g/l sukrosa. Pada penelitian ini juga diberikan perlakuan kombinasi cahaya incandescent dan floresent. Soon-Seob et al. (2003) berhasil mengumbikan bawang putih sampai 96% pada media MS dengan penambahan 120 g/l sukrosa dan 2 g/l jasmonic acid, sedangkan Kim et al. (2003) berhasil menginduksi umbi mikro bawang putih pada media MS yang ditambahkan 110 g/l sukrosa. Menurut Mujica dan Mogollon (2004) pembentukan umbi mikro bawang putih terjadi pada media yang mengandung sitokinin (BA, Zeatin, dan 2-iP) yang dikombinasikan dengan 90 g/l sukrosa. Perlakuan lain yang diberikan dalam penelitian ini adalah pemberian cahaya terang selama 16 jam pada ruang kultur bersuhu 23 ± 2oC selama delapan minggu. Menurut Fardani (2005) pemberian sukrosa dengan konsentrasi 90 g/l belum mampu menginduksi pembentukan umbi lapis mikro bawang merah. Akan tetapi terjadi penggembungan pangkal tunas menyerupai umbi. Bentukan seperti ini diduga merupakan bentukan awal umbi mikro bawang merah.
Zat Pengatur Tumbuh
Faktor-faktor yang berpengaruh terhadap pertumbuhan dan perkembangan propagul in vitro antara lain eksplan, media tanam, kondisi fisik media, zat pengatur tumbuh, dan lingkungan tumbuh (Gunawan, 1998). Menurut Krishnamoorthy (1981) dan Wattimena (1988) zat pengatur tumbuh tanaman atau sering disebut plant growth subtances adalah senyawa organik bukan nutrisi yang aktif dalam jumlah kecil (10-6-10-5 mM) yang disintesiskan menuju bagian tertentu tanaman. Zat pengatur tumbuh ditranslokasikan ke bagian lain dari tanaman dimana zat tersebut akan menimbulkan tanggapan secara biokimia, fisiologis dan morfologis. Wattimena (1998) menyatakan bahwa suatu zat dapat dikatakan zat pengatur tumbuh jika memenuhi beberapa syarat, antara lain: senyawa organik yang terbentuk merupakan hasil kerja tanaman itu sendiri, harus dapat ditranslokasikan, tempat sintesis dan tempat bekerja zat pengatur tumbuh berbeda, serta zat tersebut harus aktif dalam konsentrasi rendah.
Cathey (1975) dalam Wattimena (1988) mendefinisikan zat penghambat tumbuh (retardan) sebagai suatu tipe senyawa organik baru yang menghambat perpanjangan batang, meningkatkan warna hijau daun, dan secara tidak langsung mempengaruhi pembungaan tanpa menyebabkan pertumbuhan yang abnormal.
Pemberian retardan akan berpengaruh terhadap fisiologis tanaman, yaitu penghambatan elongasi pada sub apikal meristem, memperpendek ruas tanaman, mempertebal batang, mencegah kerebahan, menghambat etiolasi, mempertinggi perakaran stek, menghambat senesen, memperpanjang masa simpan, meningkatkan pembuahan, dan membantu perkecambahan dan pertunasan (Wattimena, 1998).
Arteca (1996) menggolongkan jenis retardan ke dalam dua kelompok, yaitu kelompok retardan yang memiliki kemampuan menghambat biosintesis giberelin (Paclobutrazol, Ancymidol, CCC, dan AMO 1618) dan kelompok morphactin atau retardan yang memiliki mekanisme penghambat tumbuh selain menghambat biosintesis giberelin (Daminozide, Maleic Hydrazide, Dikegulac sodium, dan Cimectacarb). Arteca (1996) menyebutkan bahwa CCC termasuk
jenis retardan yang memiliki kemampuan menghambat biosintesis giberellin yang pada akhirnya akan merangsang pembentukan umbi mikro. Menurut Audus (2006) bahan aktif yang dimiliki cycocel adalah chlormequat. Nama lain senyawa ini adalah chlorocholine chloride atau (2-chloroethyl-trimethylammonium chloride). Rademacher (2000) mengatakan bahwa CCC termasuk jenis retardan yang menghambat biosintesis giberelin pada tahap yang lebih awal, yaitu dengan cara menghambat pembentukan Isopentyl pyrophospate menjadi Farnesyl pyrophosphate.
Gambar 2. Struktur bangun CCC
Konsentrasi retardan yang digunakan dalam menginduksi pembentukan umbi berbeda sesuai dengan jenis retardan yang digunakan. Pada konsetrasi 10-15µM, Ancymidol dapat menginduksi terbentuknya umbi bawang merah (Allium
cepa L. Aggregatum Group) (Le guen-Le saos et al., 2002). Paclobutrazol
berpengaruh terhadap pembentukan tuber Zantedeschia pada konsentrasi 3.4 x 10
-3
µM (Kubo et al., 2005). Perlakuan tanpa pemberian SADH menghasilkan jumlah umbi terbanyak yaitu 1.82 umbi (Rahmawati, 2007).
BAHAN DAN METODE
Waktu dan Tempat
Pelaksanaan penelitian dimulai pada bulan September 2007 dan berakhir pada bulan Mei 2008. Penelitian ini dilaksanakan di Laboratorium Kultur Jaringan, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor.
Bahan dan Alat
Bahan tanaman yang digunakan sebagai eksplan dalam penelitian ini adalah umbi bawang merah yang mengandung setengah basal plate kultivar Bima Curut. Bahan-bahan yang digunakan adalah media Murashige dan Skoog (MS), agar-agar, sukrosa, 2i-P, NAA, HCL, KOH, CaP, CCC, alkohol 70%, dithane, agrept, kloroks, spirtus, betadine, deterjen, dan aquades. Sukrosa yang digunakan dalam penelitian ini berupa gula dimana gula mengandung sukrosa sebesar 99.94%.
Alat-alat yang digunakan adalah laminar air flow cabinet, botol kultur, alat tanam (pinset, gunting, scalpel, mata pisau), plastik, karet gelang, tissue, cawan petri, spirtus, bunsen, pH paper, labu takar, erlenmeyer, timbangan, hand sprayer, otoklaf, dan rak kultur.
Metode Penelitian
Rancangan perlakuan yang digunakan adalah Rancangan Acak Lengkap (RAL) dengan 2 faktor. Faktor pertama yaitu 3 taraf konsentrasi sukrosa (90 g/l, 120 g/l, dan 150 g/l). Faktor yang kedua adalah 4 taraf konsentrasi CCC masing-masing 0 ppm, 5ppm, 50ppm, dan 100 ppm. Penelitian ini terdiri dari 12 kombinasi perlakuan. Setiap kombinasi perlakuan diulang sebanyak 10 ulangan, sehingga terdapat 120 kultur.
Model matematika yang digunakan adalah: Yijk = + Ai + Bj + (AB)ij + Eijk
dengan:
Yij = Respon pengaruh perlakuan sukrosa ke-i dan perlakuan CCC ke-j
= Nilai tengah umum
Ai = Pengaruh perlakuan sukrosa ke-i
Bj = Pengaruh perlakuan CCC (Chormequat) ke-j
(AB)ij =Pengaruh interaksi antara perlakuan sukrosa ke-i dan CCC
(Chlormequat) ke-j
Eijk = Pengaruh galat pada perlakuan sukrosa ke-i dan CCC ke-j
Untuk mengetahui pengaruh faktor tunggal dengan interaksinya dari perlakuan, maka diakukan uji F. Jika sidik ragam memberikan pengaruh yang nyata, selanjutnya dilakukan uji lanjut DMRT (Duncan Multiple Range Test) pada taraf α 5 % untuk mengetahui beda antar perlakuan.
Pelaksanaan Sterilisasi Alat
Alat-alat yang akan digunakan dicuci bersih dengan menggunakan deterjen, kemudian disterilisasi menggunakan autoklaf pada suhu 121oC dan tekanan 17.5 psi selama 60 menit Alat-alat yang perlu disterilisasi antara lain botol kultur, alat tanam (pinset, gunting, scalpel), cawan petri, dan Erlenmeyer.
Pembuatan Larutan Stok
Larutan stok dibuat dari komposisi media Murashige dan Skoog (MS) (Tabel Lampiran 3) yang disimpan dengan konsentrasi yang lebih pekat. Larutan stok yang sudah dibuat diletakkan di dalam erlenmeyer. Larutan stok A-E disimpan di dalam ruang kultur, sedangkan larutan stok F, myo-innositol, dan vitamin disimpan di dalam lemari pendingin.
Pembuatan Media
Pembuatan media dilakukan dengan memipet larutan stok sesuai dengan media yang akan digunakan. Media yang digunakan dalam penelitian ini terdiri dari tiga jenis media, yaitu media prekondisi, media perbanyakan dan media perlakuan. Media prekondisi merupakan media MS0 yang digunakan untuk mengetahui keberhasilan sterilisasi umbi bawang merah. Media MS0 dibuat berdasarkan komposisi bahan-bahan kimia Murashige dan Skoog tanpa penambahan zat pengatur tumbuh. Media perbanyakan merupakan media multiplikasi tunas bawang merah. Komposisi media perbanyakan yang digunakan adalah media MS yang ditambahkan 2i-P 6 ppm, CaP 10 ppm, dan NAA 0.5 ppm, dan sukrosa. Komposisi media perlakuan yang digunakan adalah media MS yang ditambahkan CCC dan sukrosa sesuai dengan perlakuan. Aquades ditambahkan ke dalam masing-masing media sampai tanda tera, kemudian pH diukur hingga 6.0. Ditambahkan agar-agar sebanyak 8 g/l. Media dipanaskan hingga agar-agar larut dan dituang ke dalam botol steril. Botol ditutup rapat dengan plastik dan disterilisasi pada suhu 121oC dan tekanan 17.5 psi selama 30 menit. Selanjutnya media yang telah disterilkan disimpan di dalam ruang kultur.
Persiapan Ruang Tanam
Sebelum dilakukan penanaman eksplan, laminar air flow cabinet dibersihkan dengan alkohol 70% dan disterilkan dengan lampu uv selama 1 jam.
Sterilisasi Eksplan
Eksplan yang akan digunakan disterilkan terlebih dahulu. Umbi bawang merah dikupas dan dicuci bersih dengan deterjen. Umbi yang sudah bersih direndam dalam deterjen selama 30 menit, kemudian direndam dalam larutan agrept dan dithane dengan konsentrasi masing-masing 2 g/l selama satu malam. Umbi dibiarkan di bawah air mengalir selama 30 menit. Umbi direndam dalam klorox 20% selama 30 menit, kemudian dilakukan pengupasan lapisan umbi terluar. Umbi kembali direndam dalam klorox 10% selama 30 menit dan dilakukan pengupasan umbi hingga mencapai ukuran yang sesuai untuk ditanam.
Umbi direndam kembali dalam klorox 5% selama 45 menit. Umbi selalu dibilas air steril setelah perendaman di dalam klorox.
Penanaman
Umbi yang telah disterilkan siap ditanam dalam media prekondisi yaitu media MS0. Media prekondisi yang telah ditanami eksplan disimpan di dalam ruang kultur dan diinkubasi selama 7 hari. Eksplan yang tidak terkontaminasi siap dipindahkan ke dalam media perbanyakan yang selanjutnya ditanam di dalam media perlakuan.
Pemeliharaan
Pemeliharaan pada media perbanyakan dan media perlakuan hampir sama, yaitu botol kultur diletakkan di ruang kultur yang bersuhu 20-25oC. Eksplan yang terkontaminasi langsung dikeluarkan agar tidak menimbulkan kontaminasi pada eksplan lain. Ruang kultur juga disterilisasi dengan formalin. Dilakukan penyemprotan alkohol pada botol kultur setiap 2 hari sekali untuk mengurangi kontaminasi. Perbedaan kedua pemeliharaan tersebut terletak pada pemberian cahaya. Pada saat eksplan di media perbanyakan, cahaya diberikan terus-menerus tanpa ada penggelapan. Sedangkan pada saat di media perlakuan, eksplan diberi perlakuan cahaya, yaitu 16 jam terang dan 8 jam gelap. Penggelapan pada saat di media perlakuan bertujuan untuk menginduksi pembentukan umbi.
Pengamatan
Pengamatan dilakukan setiap minggu selama 2 bulan pada media pengumbian dengan peubah yang diamati sebagai berikut:
1. persentase kontaminasi, dihitung pada saat eksplan berada dalam media pengumbian.
2. jumlah tunas, dihitung berdasarkan jumlah tunas yang keluar dari basal plate setiap eksplan.
3. jumlah daun (jumlah daun total dan daun hijau), dihitung berdasarkan jumlah daun yang muncul pada setiap eksplan.
4. jumlah akar, dihitung berdasarkan jumlah akar yang muncul dari basal plate pada setiap eksplan.
Pada akhir pengamatan dilakukan pengukuran terhadap:
1. diameter umbi mikro, diukur berdasarkan diameter umbi terlebar. 2. bobot umbi mikro.
3. tinggi tanaman, diukur dari basal plate hingga ujung daun terpanjang. 4. jumlah umbi mikro yang terbentuk, dihitung berdasarkan munculnya
perubahan warna pada pangkal tunas.
Alat yang digunakan untuk mengukur diameter umbi dan tinggi umbi adalah jangka sorong. Sedangkan tinggi tanaman diukur dengan menggunakan milimeter blok. Bobot umbi diukur dengan menggunakan timbangan analitik.
HASIL DAN PEMBAHASAN
Kondisi Umum Kultur
Eksplan yang digunakan dalam penelitian ini adalah umbi bawang merah (Allium cepa L. Aggregatum group) cv. Bima Curut. Propagul merupakan hasil perbanyakan tunas bawang merah yang telah melalui tahap prekondisi dan multiplikasi. Multiplikasi tunas yang tinggi (Gambar 3) akan meningkatkan jumlah propagul yang dapat digunakan. Tahap multiplikasi bertujuan untuk memperoleh tanaman yang mencapai perkembangan vegetatif yang cukup sehingga siap untuk diinduksi ke dalam media pengumbian. Kontaminasi eksplan pada media pengumbian sebesar 5%. Kontaminasi dikarenakan adanya perkembangan cendawan dan bakteri dalam media kultur serta kontaminasi yang berasal dari lapangan.
Kultur yang mengalami multiplikasi tunas mencapai 29.17% hingga akhir pengamatan. Tunas yang dapat membentuk umbi hingga akhir pengamatan adalah sebesar 87.5%. Pembentukan umbi ditandai dengan adanya perubahan warna tunas menjadi berwarna merah serta terjadinya penggembungan pangkal tunas menyerupai umbi.
Gambar 3. Morfologi Tunas Mikro Bawang Merah (Allium cepa L. Aggregatum group) cv. Bima Curut pada 6 MSP
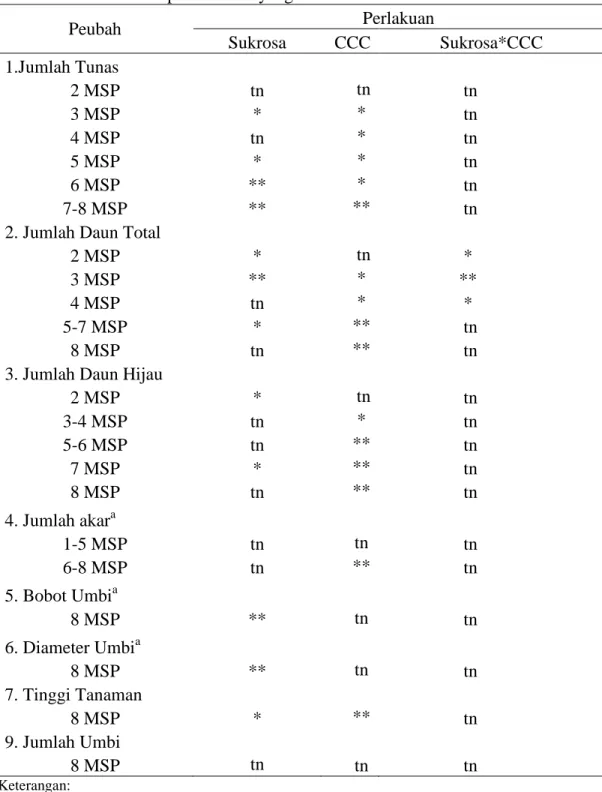
Tabel 1. Rekapitulasi Hasil Sidik Ragam Pengaruh Sukrosa dan CCC terhadap Parameter yang Diamati
Peubah Perlakuan Sukrosa CCC Sukrosa*CCC 1.Jumlah Tunas 2 MSP tn tn tn 3 MSP * * tn 4 MSP tn * tn 5 MSP * * tn 6 MSP ** * tn 7-8 MSP ** ** tn 2. Jumlah Daun Total
2 MSP * tn * 3 MSP ** * ** 4 MSP tn * * 5-7 MSP * ** tn
8 MSP tn ** tn 3. Jumlah Daun Hijau
2 MSP * tn tn 3-4 MSP tn * tn 5-6 MSP tn ** tn 7 MSP * ** tn 8 MSP tn ** tn 4. Jumlah akara 1-5 MSP tn tn tn 6-8 MSP tn ** tn 5. Bobot Umbia 8 MSP ** tn tn 6. Diameter Umbia 8 MSP ** tn tn 7. Tinggi Tanaman 8 MSP * ** tn 9. Jumlah Umbi 8 MSP tn tn tn Keterangan:
MSP : Minggu Setelah Perlakuan a : data hasil transformasi √(x+0.5) tn : tidak nyata pada uji F 5% * : nyata pada uji F 5% ** : sangat nyata pada uji F 1%
Berdasarkan data rekapitulasi hasil sidik ragam (Tabel 1), perlakuan tunggal sukrosa memberikan pengaruh yang nyata terhadap jumlah tunas pada 3 MSP dan 5 MSP; jumlah daun total pada 2 MSP hingga 7 MSP; jumlah daun hijau pada 2 MSP dan 7 MSP serta tinggi tanaman pada 8 MSP dan sangat nyata terhadap jumlah tunas pada 6, 7, 8 MSP; jumlah daun total pada 3 MSP; bobot umbi, dan diameter umbi.
Perlakuan CCC berpengaruh nyata terhadap jumlah tunas pada 3, 4, 5, 6 MSP ; jumlah daun total pada 3 MSP dan 4 MSP serta jumlah daun hijau pada 3 MSP dan 4 MSP dan sangat nyata terhadap jumlah tunas pada 7 MSP dan 8 MSP; jumlah daun total pada 5, 6, 7, 8 MSP; jumlah daun hijau pada 5, 6, 7, 8 MSP; jumlah akar pada 6, 7, 8 MSP serta tinggi tanaman pada 8 MSP. Interaksi kedua perlakuan memberikan pengaruh yang nyata terhadap jumlah daun total pada 2 MSP dan 4 MSP sangat nyata pada 3 MSP.
Jumlah Umbi Lapis Mikro
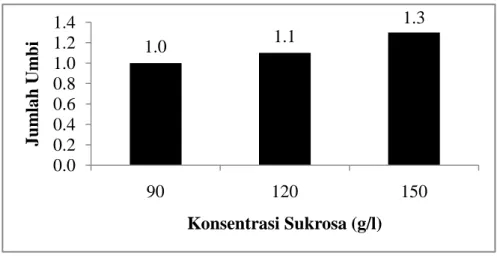
Berdasarkan data hasil sidik ragam, perlakuan tunggal sukrosa dan CCC serta interaksi kedua perlakuan tersebut tidak berpengaruh nyata terhadap jumlah umbi mikro yang terbentuk. Perlakuan sukrosa 150 g/l menghasilkan rata-rata jumlah umbi mikro sebesar 1.3 umbi (Gambar 4) dan tidak berbeda nyata dengan semua perlakuan yang diberikan. Semakin tinggi konsentrasi sukrosa yang digunakan jumlah tunas yang mengalami multiplikasi semakin menurun (Gambar 5). Perlakuan sukrosa 90 g/l menghasilkan multiplikasi tunas tertinggi, tetapi jumlah tunas yang dapat membentuk umbi paling kecil sehingga jumlah umbi yang terbentuk juga sedikit.
Gambar 4. Nilai Rata-rata Jumlah Umbi Bawang Merah (Allium cepa L. Aggregatum group) cv. Bima Curut pada Beberapa Konsentrasi Sukrosa
Konsentrasi sukrosa yang tinggi dalam media mampu meningkatkan pembentukan dan perkembangan umbi mikro serta kecepatan tunas dalam membentuk umbi mikro (Kubo et al., 2005 dan Wattimena, 1986). Pembentukan umbi mikro bawang merah pada penelitian ini cenderung disebabkan oleh konsentrasi sukrosa yang tinggi dalam media yaitu sebesar 120 g/l dan 150 g/l. Konsentrasi sukrosa ( 4-10 %) lebih tinggi dari normal (3 %) dalam media kultur jaringan mendorong pembentukan organ-organ penyimpanan dalam beberapa spesies tanaman (Wuryan, 2008). Hidayat (1997) dalam Rahmawati (2007) dan Fletcher et al. (1998) berhasil menginduksi umbi mikro bawang merah pada media dengan penambahan sukrosa 12% dan 15%.
1.0 1.1 1.3 0.0 0.2 0.4 0.6 0.8 1.0 1.2 1.4 90 120 150 Ju m lah Um b i Konsentrasi Sukrosa (g/l)
Gambar 5. Kultur yang Mengalami Multiplikasi pada Perlakuan 90 g/l (A), pada Perlakuan 120 g/l (B), dan pada perlakuan 150 g/l
Arteca (1996) dan Weaver (1972) menyebutkan bahwa CCC termasuk jenis retardan yang memiliki kemampuan menghambat biosintesis giberellin yang pada akhirnya akan merangsang pembentukan umbi mikro. Perlakuan tunggal CCC tidak berpengaruh nyata terhadap jumlah umbi mikro bawang merah yang terbentuk.
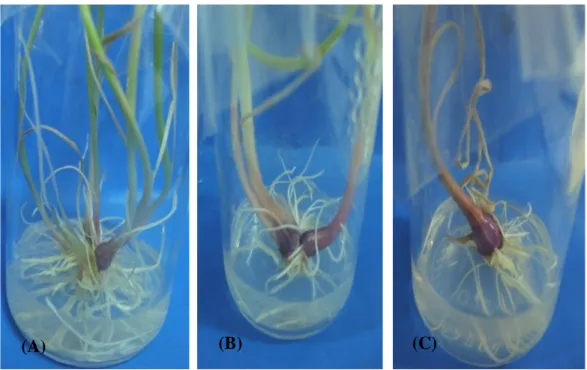
Kemampuan tunas bawang merah dalam membentuk umbi berpengaruh terhadap jumlah umbi mikro yang terbentuk. Menurut Reeve, Tim, dan Weaver (1973) dalam Fardani (2005) salah satu ciri awal pembentukan umbi adalah terjadinya pembengkakan dan pembesaran umbi sebagai akibat proses pembelahan sel dan pembesaran sel yang berfungsi sebagai sel-sel penyimpan baru (Gambar 6).
(B) (C)
Gambar 6. Umbi lapis Mikro yang Dihasilkan pada Perlakuan 0 ppm CCC (A) dan Perlakuan 50 ppm CCC (B)
Perlakuan tanpa CCC atau 0 ppm CCC menghasilkan rata-rata jumlah umbi mikro 1.4 umbi dan tidak berbeda nyata dengan semua konsentrasi yang diberikan. Pemberian CCC 5 ppm, 50 ppm, dan 100 ppm memberikan pengaruh yang sama terhadap jumlah umbi mikro yang terbentuk yaitu sebesar 1.1 umbi (Gambar 7). Perlakuan tanpa CCC diduga menginduksi multiplikasi tunas yang lebih tinggi daripada perlakuan yang lain sehingga jumlah umbi mikro yang dihasilkan juga meningkat.
Gambar 7. Nilai Rata-rata Jumlah Umbi Bawang Merah (Allium cepa L. Aggregatum group) cv. Bima Curut pada Beberapa Konsentrasi CCC
Menurut Chesworth et al. (1998) retardan paclobutrazol memberikan respon lebih efektif daripada pemberian CCC. Paclobutrazol efektif dalam konsentrasi yang lebih rendah, sedangkan CCC efektif dalam konsentrasi yang lebih tinggi. Konsentrasi perlakuan CCC yang diujikan pada penelitian ini diduga tidak mampu menginduksi pembentukan umbi mikro.
Bobot Umbi
Perlakuan CCC dan interaksi antara sukrosa dan CCC tidak berpengaruh nyata terhadap bobot umbi yang dihasilkan. Data pada Tabel 2 menunjukkan bahwa perlakuan tunggal sukrosa berpengaruh sangat nyata terhadap peubah bobot umbi. Perlakuan sukrosa 150 g/l menghasilkan rata-rata bobot umbi sebesar 0.205 gram dan tidak berbeda nyata dengan perlakuan sukrosa 120 g/l (0.177 g). Bobot umbi terkecil dimiliki oleh perlakuan sukrosa 90 g/l. Penelitian Kailola (2002) yang menyatakan bahwa bobot umbi mikro kentang terendah yaitu 130.82 mg/umbi dihasilkan oleh media pengumbian MS cair + sukrosa 90 g/l + 0 aspirin. Bobot umbi mikro kentang dikatakan berkualitas baik jika melebihi 0.1 gram (Wattimena, 1992). Bobot umbi mikro pada perlakuan 90 g/l kurang memenuhi standar kualitas yang sudah ditentukan pada umbi mikro kentang. Hal tersebut menunjukkan bahwa pemakaian sukrosa 90 g/l dalam pengumbian in vitro bawang merah kurang dianjurkan.
1.4 1.1 1.1 1.1 0.0 0.5 1.0 1.5 0 5 50 100 Ju m lah Um b i Konsentrasi CCC (ppm)
Data pada Tabel 2 menunjukkan bahwa semakin tinggi konsentrasi sukrosa, bobot umbi yang dihasilkan semakin besar pula. Menurut Mujica dan Mogollon (2004) pemberian sukrosa dalam konsentrasi yang tinggi pada bawang putih mampu meningkatkan bobot basah umbi yang dihasilkan. Bobot umbi juga dipengaruhi oleh multiplikasi tunas. Semakin banyak jumlah tunas, bobot umbi yang dihasilkan semakin rendah. Hal tersebut diduga karena terjadinya persaingan penyerapan unsur-unsur hara yang terkandung dalam media. Menurut Angelia (2008) bobot umbi yang rendah dimiliki oleh tanaman yang memiliki tunas lebih banyak karena adanya distribusi asimilat yang menyebar ke setiap umbi yang terbentuk.
Tabel 2. Nilai Rata-rata Bobot Umbi Bawang Merah (Allium cepa L. Aggregatum group) cv. Bima Curut pada Beberapa Konsentrasi Sukrosa
Sukrosa (g/l) Bobot Umbi (g)
8MSP
90 0.089b
120 0.177a
150 0.205a
Keterangan:
Nilai yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji DMRT 5%
Perlakuan tunggal CCC tidak memberikan pengaruh yang nyata terhadap bobot umbi bawang merah. Perlakuan CCC dengan konsentrasi 100 ppm memberikan bobot umbi bawang merah sebesar 0.183 gram dan tidak berbeda nyata dengan semua konsentrasi CCC yang diberikan (Gambar 8). Kailola (2002) menyatakan bahwa bobot basah umbi mikro kentang terbesar diperoleh pada media MS cair + sukrosa 90 g/l + CCC 600 mg/l + air kelapa 15% yaitu 236.60 mg/umbi.
Gambar 8. Nilai Rata-rata Bobot Umbi Bawang Merah (Allium cepa L. Aggregatum group) cv. Bima Curut pada Beberapa Konsentrasi CCC
Menurut Wattimena (1986) pemberian zat pengatur tumbuh eksogen seperti ABA dan CCC dapat mempercepat pembentukan umbi mikro kentang. Menurut Dicks (1979) dalam Lubis (1991) CCC mempunyai pengaruh penghambatan yang lemah terhadap lintasan precursor dalam konsentrasi rendah. Hal tersebut menyebabkan tidak terlihat perbedaan yang signifikan akibat perlakuan CCC pada taraf konsentrasi (0, 5, 50, 100 ppm) terhadap bobot umbi.
Diameter Umbi
Peubah diameter umbi hanya dipengaruhi sangat nyata oleh perlakuan sukrosa, sedangkan perlakuan CCC dan interaksi keduanya tidak memberikan pengaruh yang nyata terhadap diameter umbi bawang merah. Data pada Tabel 3 menunjukkan bahwa rata-rata diameter umbi dihasilkan oleh tanaman dengan perlakuan 120 g/l sukrosa yaitu 0.598 cm dan tidak berbeda nyata dengan perlakuan sukrosa 150 g/l yang memberikan diameter umbi sebesar 0.512 cm. Diameter umbi mikro perlakuan sukrosa 90 g/l paling kecil dibanding perlakuan lainnya. Menurut Kailola (2002) media MS cair + sukrosa 90 g/l menghasilkan ukuran umbi kentang terendah yaitu 4.86 mm.
0.144 0.165 0.137 0.183 0 0.05 0.1 0.15 0.2 0 5 50 100 B ob ot u m b i Konsentrasi CCC (ppm)
Tabel 3. Nilai Rata-rata Diameter Umbi Bawang Merah (Allium cepa L. Aggregatum group) cv. Bima Curut pada Beberapa Konsentrasi Sukrosa
Sukrosa (g/l) Diameter Umbi (cm)
8 MSP
90 0.288b
120 0.598a
150 0.512a
Keterangan:
Nilai yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji DMRT 5%
Data merupakan hasil transformasi √(x+0.5).
Tunas bawang merah yang terangsang untuk membentuk umbi mengalami pertambahan ukuran pada bagian pangkal tunasnya. Menurut Pelkonen (2005) sukrosa mempunyai pengaruh yang jelas terhadap morfogenesis karena sukrosa dalam konsentrasi yang tinggi akan meningkatkan ukuran umbi. Ukuran umbi antara kisaran 0.288 cm sampai 0.598 cm sudah dapat dikatakan sebagai umbi mikro. Wattimena (1986) menyatakan bahwa ukuran umbi yang terbentuk secara
in vitro melalui teknik kultur jaringan mempunyai ukuran umbi yang kecil, yaitu 1
cm atau kurang. Oleh karena itu, umbi tersebut dapat dikatakan sebagai umbi mikro karena ukurannya yang relatif kecil.
Besar diameter umbi mengalami peningkatan pada konsentrasi sukrosa 120 g/l dan menurun kembali pada konsentrasi sukrosa 150 g/l (Tabel 3). Hal tersebut diduga karena adanya pengaruh sitokinin dalam media yang telah terangsang pembentukan umbinya. Menurut Rahmawati (2007) sitokinin dalam media akan berinteraksi dengan sukrosa yang tinggi dalam meningkatkan diameter umbi bawang merah. Sitokinin berperan dalam pembelahan sel sehingga jumlah sel yang semakin banyak akan meningkatkan diameter umbi.
Menurut Plaisted (1975) dalam Kailola (2002) penambahan ukuran umbi terjadi terutama karena meningkatnya jumlah sel di dalam umbi dan bukan karena adanya aktivitas peningkatan ukuran sel. Hal tersebut didukung oleh Wattimena (1986) yang menyatakan bahwa sitokinin merupakan salah satu faktor yang berperan dalam menginisiasi pembentukan umbi. Kandungan sitokinin terutama zeatin dalam jaringan yang sudah terangsang pembentukan umbinya mempunyai kandungan yang tinggi dibandingkan pada jaringan yang belum terangsang.
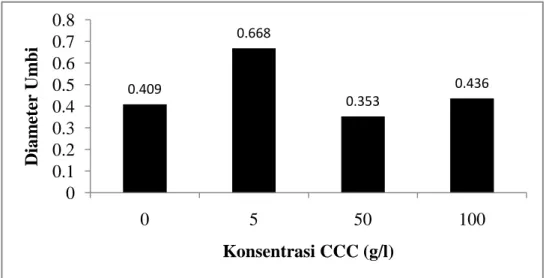
Perlakuan CCC secara statistik tidak berpengaruh nyata terhadap diameter umbi yang dihasilkan. Rata-rata diameter umbi mikro tertinggi diperoleh tanaman dengan perlakuan 5 ppm CCC yaitu sebesar 0.668 cm. Konsentrasi CCC 5 ppm tidak memberikan pengaruh yang berbeda dengan semua konsentrasi yang diujikan. Pengaruh CCC mulai menurun pada konsentrasi CCC 50 ppm dan mengalami peningkatan kembali pada konsentrasi 100 ppm. Gambar 9 menunjukkan bahwa diameter umbi antara satu perlakuan dengan perlakuan yang lain tidaklah jauh berbeda. Wattimena (1999) menyatakan bahwa penggunaan CCC dalam konsentrasi 5, 10, 15, dan 20 ppm merupakan konsentrasi yang rendah. Menurut Wattimena (2000) konsentrasi CCC yang digunakan untuk menginduksi pembentukan umbi mikro kentang adalah sebesar 600 mg/l.
Gambar 9. Nilai Rata-rata Diameter Umbi Bawang Merah (Allium cepa L. Aggregatum group) cv. Bima Curut pada Beberapa Konsentrasi CCC 0.409 0.668 0.353 0.436 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0 5 50 100 Diam ete r Um b i Konsentrasi CCC (g/l)
Anatomi Umbi
Menurut Sumarni dan Sumiati (1995) bawang merah memiliki batang sejati yang disebut sebagai “diskus” yang bentuknya seperti cakram, tipis dan pendek sebagai tempat melekat perakaran dan mata tunas (titik tumbuh). Batang semu terbentuk di atas “discus” yang tersusun dari pelepah-pelepah daun. Batang semu yang berada di dalam tanah akan berubah bentuk dan fungsinya menjadi umbi. Umbi bawang merah merupakan umbi lapis. Pada setiap umbi dijumpai tunas-tunas lateral yang akan tumbuh menjadi kelopak-kelopak daun baru (Gambar 10). Kelopak daun baru tersebut akan membentuk umbi lapis bawang merah.
Umbi lapis
Gambar 10. Anatomi Umbi Bawang Merah ((Allium cepa L. Aggregatum group) cv. Bima Curut Melalui Mikroskop Tiga Dimensi
Calon Tunas
Keterangan: SK (dry outer protective skin), SH (fleshy swollen sheaths), SC (swollen bulb scale), SP (sprout leaves)
Gambar 11. Struktur Umbi Bawang Merah secara In Vitro (A) dan Bawang Bombay di Lapang (B)
Umbi bawang merah terdiri dari lapisan-lapisan yang terbentuk dari pelepah daun. Lapisan-lapisan umbi yang terbentuk terbagi menjadi empat bagian, yaitu kulit pelindung terluar yang kering dan tipis atau dry outer protective skin (SK), daging yang membengkak yang berasal dari helai daun atau fleshy swollen
sheaths (SH), pembengkakan bulb scale tanpa helai daun atau swollen bulb scale
(SC), dan daun kecambah atau sprout leaves (SP) yang akan meningkatkan luas helai daun ketika umbi muncul dan tumbuh memanjang.
SP SC SH SK SC SH (A) (B)
Gambar 11 menunjukkan bahwa struktur umbi lapis mikro bawang merah yang terbentuk (A) sama seperti struktur umbi bawang bombay yang terbentuk di lapangan (B). Lapisan-lapisan umbi hasil in vitro lebih tipis daripada umbi di lapangan karena terbatasnya unsur-unsur hara yang ada dalam media. Kulit pelindung terluar (SK) pada umbi hasil in vitro melekat kuat pada bagian basal
plate karena kelembaban ruang kultur yang tinggi.
Menurut Brewster (1995) umbi lapis mikro terbentuk sebagai akibat pembengkakan pelepah-pelepah daun yang melekat pada batang semu bawang merah secara konsentris. Pada awal pembentukan umbi terjadi penebalan pelepah-pelepah daun yang didahului oleh perpanjangan yang tiba-tiba. Penebalan terjadi sebagai akibat perluasan sel lateral pada pelepah daun ketiga. Selama pembentukan umbi, tidak terjadi pertumbuhan daun muda karena pertumbuhan tanaman dialihkan ke arah pembengkakan daun untuk membentuk umbi. Pada saat umbi telah matang, satu sampai tiga daun paling luar mengalami kekeringan dan transparan. Lapisan-lapisan yang mengering ini berfungsi untuk melindungi bagian-bagian umbi yang lebih dalam atau yang sering disebut dry outer
protective skin (SK). Kematangan umbi juga ditandai dengan mengeringnya daun
akibat kemunduran jaringan-jaringan daun, leher umbi melunak dan kehilangan turgiditasnya.
Tinggi Tanaman
Perlakuan sukrosa dan CCC berpengaruh nyata terhadap tinggi tanaman. Interaksi kedua perlakuan tidak berpengaruh nyata terhadap tinggi tanaman pada semua perlakuan yang diberikan. Perlakuan sukrosa 90 g/l menghasilkan rata-rata tinggi tanaman sebesar 21.38 cm (Gambar 12) dan tidak berbeda nyata terhadap perlakuan sukrosa 120 g/l, akan tetapi berbeda nyata terhadap perlakuan sukrosa 150 g/l (Tabel 4). Konsentrasi sukrosa yang tinggi dalam media menghambat pertumbuhan tanaman. Konsentrasi sukrosa yang tinggi meningkatkan tekanan osmotik media sehingga menimbulkan stres lingkungan bagi plantlet. Menurut Salisbury & Ross (1995) stress yang diakibatkan oleh perubahan tekanan osmotik akan merangsang akumulasi asam absisik dalam jaringan tanaman yang pada gilirannya menghambat pertumbuhan tanaman dalam media in vitro. Pierik (1987)
juga menyatakan bahwa peningkatan konsentrasi gula akan meningkatkan pertumbuhan dan perkembangan tanaman, tetapi sebaliknya konsentrasi yang tinggi bersifat menghambat.
Tabel 4. Nilai Rata-rata Tinggi Tanaman Bawang Merah (Allium cepa L. Aggregatum group) cv. Bima Curut pada Beberapa Konsentrasi Sukrosa
Sukrosa (g/l) Tinggi Tanaman (cm)
8MSP
90 21.38a
120 18.69ab
150 17.25b
Keterangan:
Nilai yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji DMRT 5%
Gambar 12. Tinggi Tanaman Tertinggi pada Perlakuan Sukrosa 90 g/l
Perlakuan tunggal CCC memberikan pengaruh yang sangat nyata terhadap tinggi tanaman. Data pada Tabel 5 menunjukkan bahwa rata-rata tinggi tanaman pada perlakuan tanpa pemberian CCC memberikan pengaruh yang tidak berbeda
nyata terhadap konsentrasi CCC 5 ppm dan 50 ppm yang diujikan. Rata-rata tinggi tanaman pada perlakuan CCC 0 ppm dan 50 ppm memberikan pengaruh yang berbeda nyata terhadap perlakuan CCC 100 ppm. Tinggi tanaman mengalami penurunan seiring dengan penambahan konsentrasi CCC. Perlakuan CCC 100 ppm menghasilkan tinggi tanaman terendah sebesar 15.69 cm tetapi tidak berbeda nyata terhadap perlakuan CCC 5 ppm. Cathey (1975) dalam Wattimena (1988) dan Sachs, Lang, Bretz, dan Roach (1960) dalam Lubis (1991) mendefinisikan bahwa zat penghambat tumbuh (retardan) sebagai suatu tipe senyawa organik baru yang menghambat perpanjangan batang. Chlorocholine Chloride (CCC) merupakan salah satu jenis retardan yang prinsip kerjanya mereduksi perimbangan pembelahan melintang di dalam meristem sub-apikal. Akibat penghambatan tersebut batang tanaman menjadi lebih pendek. Perlakuan CCC juga dapat mereduksi panjang sel dewasa tanaman.
Krishnamoorthy (1981) menyatakan bahwa cara kerja retardan jenis CCC adalah dengan menghambat jalur biosintesis giberellin sehingga kandungan giberellin di dalam tanaman menurun. Penghambatan tersebut menyebabkan terhambatnya perpanjangan sel terutama didaerah meristem sub-apikal yang pada akhirnya akan menghambat tinggi tanaman.
Tabel 5. Nilai Rata-rata Tinggi Tanaman Bawang Merah (Allium cepa L. Aggregatum group) cv. Bima Curut pada Beberapa Konsentrasi CCC CCC (ppm) Tinggi Tanaman (cm) 8 MSP 0 21.99a 5 18.97ab 50 19.77a 100 15.69b Keterangan:
Nilai yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji DMRT 5%
Jumlah Tunas Mikro
Pembentukan tunas dapat terjadi secara langsung maupun tidak langsung. Multiplikasi tunas pada bawang merah terjadi secara langsung atau sering disebut sebagai organogenesis langsung. Menurut Armini et al. (1992) spesies-spesies tanaman yang membentuk umbi dapat membentuk tunas secara langsung dimana tunas bawang merah muncul dari bagian dasar basal plate.
Perlakuan tunggal sukrosa dan CCC berpengaruh nyata terhadap peubah jumlah tunas, sedangkan interaksi kedua perlakuan tidak memberikan pengaruh yang nyata. Jumlah tunas mengalami peningkatan pada setiap minggu pengamatan. Perlakuan sukrosa 90 g/l menghasilkan jumlah tunas tertinggi dibandingkan perlakuan lainnya mulai 7 MSP hingga 8 MSP, akan tetapi tidak berbeda nyata dengan perlakuan sukrosa 150 g/l pada 5 MSP hingga 6 MSP (Tabel 6). Jumlah tunas yang dihasilkan menurun pada penambahan konsentrasi sukrosa dalam media mulai 4 MSP hingga 8 MSP. Semakin tinggi konsentrasi sukrosa jumlah tunas yang dihasilkan semakin rendah (Gambar 13).
Gambar 13. Jumlah Tunas Mikro pada Perlakuan 90 g/l (A) dan Perlakuan 120 g/l (B)
Fardani (2005) menyatakan bahwa penambahan konsentrasi sukrosa hingga 70 g/l mampu meningkatkan rata-rata jumlah tunas bawang merah. Akan tetapi semakin tinggi konsetrasi sukrosa yang digunakan, jumlah tunas yang diperoleh semakin rendah. Pemberian sukrosa yang tinggi dalam media menghasilkan energi yang lebih sehingga energi tersebut akan disimpan dalam tunas bawang merah. Penyimpanan energi dalam bentuk cadangan makanan menyebabkan pangkal tunas bawang merah menggembung membentuk umbi. Hal tersebut didukung oleh Rahmawati (2003) sukrosa dalam konsentrasi tinggi akan menurunkan jumlah tunas pada tanaman jahe emprit. Sukrosa dalam konsentrasi tinggi akan disimpan dalam rimpang mikro jahe emprit sebagai cadangan makanan. Menurut Wattimena (1992) konsentrasi sukrosa yang tinggi akan efektif dalam membentuk tunas pada saat berada dalam kondisi gelap.
Tabel 6. Nilai Rata-rata Jumlah Tunas Mikro Bawang Merah (Allium
cepa L. Aggregatum group) cv. Bima Curut pada Beberapa
Konsentrasi Sukrosa Sukrosa
(g/l)
Jumlah Tunas Mikro
2MSP 3MSP 4MSP 5MSP 6MSP 7MSP 8MSP
90 1.00a 1.05ab 1.30a 1.48a 1.58a 1.75a 1.75a
120 1.00a 1.00b 1.10a 1.13b 1.13b 1.20b 1.20b 150 1.03a 1.13a 1.25a 1.28ab 1.30ab 1.33b 1.33b Keterangan:
Nilai yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji DMRT 5%
Berdasarkan hasil sidik ragam (Tabel 7), perlakuan tunggal CCC memberikan pengaruh yang nyata pada 3 MSP dan 5 MSP dan sangat nyata pada 6, 7, 8 MSP. Pengaruh tidak nyata perlakuan CCC ditunjukkan pada saat 2 MSP. Jumlah tunas mengalami peningkatan dari awal pengamatan hingga akhir pengamatan.
Tabel 7. Nilai Rata-rata Jumlah Tunas Mikro Bawang Merah (Allium
cepa L. Aggregatum group) cv. Bima Curut pada Beberapa
Konsentrasi CCC CCC
(ppm)
Jumlah Tunas Mikro
2MSP 3MSP 4MSP 5MSP 6MSP 7MSP 8MSP
0 1.00a 1.07ab 1.33ab 1.47a 1.57a 1.77a 1.77a
5 1.03a 1.17a 1.37a 1.40ab 1.43ab 1.43b 1.43b 50 1.00a 1.00b 1.07c 1.17b 1.20b 1.30b 1.30b 100 1.00a 1.00b 1.10bc 1.13b 1.13b 1.20b 1.20b Keterangan:
Nilai yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji DMRT 5%
Konsentrasi CCC yang semakin tinggi menurunkan jumlah tunas yang terbentuk (Gambar 14). Penurunan jumlah tunas mulai terjadi pada 5 MSP hingga 8 MSP. Jumlah tunas tertinggi mulai 7 MSP hingga 8 MSP dihasilkan oleh tanaman tanpa pemberian CCC, akan tetapi pada 5 MSP dan 6 MSP perlakuan tanpa pemberian CCC memberikan pengaruh yang tidak berbeda nyata dengan perlakuan 5 ppm CCC. Konsentrasi CCC 5 ppm mampu menginisiasi pembentukan tunas lebih awal. Hal tersebut didukung oleh penelitian Lubis pada tahun 1991 yang menyatakan bahwa tanaman yang diberi perlakuan CCC mampu meningkatkan jumlah anakan pada tanaman gandum lebih awal daripada tanaman yang tidak diberi perlakuan. Arteca (1996) menyatakan bahwa Daminozide mempengaruhi reduksi perkembangan vegetatif pada beberapa tanaman buah-buahan.
Gambar 14. Jumlah Tunas Mikro pada Perlakuan 5 ppm CCC (A) dan Perlakuan 50 ppm CCC (B)
Jumlah Daun Total
Semua perlakuan baik perlakuan tunggal sukrosa, perlakuan tunggal CCC serta interaksi kedua perlakuan memberikan pengaruh yang nyata terhadap jumlah daun total. Perlakuan tunggal sukrosa memberikan pengaruh yang nyata terhadap jumlah daun total pada 2, 5, 6, 7 MSP dan sangat nyata pada 3 MSP. Data pada Tabel 8 menunjukkan bahwa perlakuan sukrosa 90 g/l tidak memberikan pengaruh yang berbeda nyata dengan semua perlakuan yang diujikan pada 4 MSP dan 8 MSP. Perlakuan sukrosa 90 g/l dan 150 g/l memberikan pengaruh yang tidak berbeda nyata pada 3 MSP, 5 MSP, 6 MSP, dan 7 MSP. Akan tetapi perlakuan 90 g/l sukrosa berbeda nyata dengan perlakuan 120 g/l sukrosa. Jumlah daun total dipengaruhi oleh multiplikasi tunas dan mengalami peningkatan pada setiap minggu pengamatan. Eksplan bawang merah pada media pengumbian mulai membentuk daun pertama pada 1 MSP (Gambar 15).
Tabel 8. Nilai Rata-rata Jumlah Daun Total Bawang Merah (Allium cepa L. Aggregatum group) cv. Bima Curut pada Beberapa Konsentrasi Sukrosa
Sukrosa (g/l)
Jumlah Daun Total
2MSP 3MSP 4MSP 5MSP 6MSP 7MSP 8MSP
90 1.9a 2.4a 3.2a 3.9a 4.7a 5.2a 5.6a
120 1.5b 1.9b 2.8a 3.1b 3.7b 4.1b 4.6a
150 1.6b 2.2ab 3.1a 3.6ab 4.3ab 4.6ab 5.1a Keterangan:
Nilai yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji DMRT 5%
Rahmawati (2003) menyatakan bahwa konsentrasi sukrosa 20 g/l meningkatkan pembentukan jumlah daun tanaman jahe emprit, sedangkan sukrosa 50 g/l bersifat menghambat. Hal tersebut dikarenakan tingginya konsentrasi sukrosa menyebabkan larutan menjadi pekat dan tanaman mengalami stress air. Dalam kondisi stres, tanaman cenderung membentuk rimpang daripada membentuk daun. Pada Tabel terlihat bahwa jumlah daun total pada konsentrasi sukrosa 150 g/l lebih tinggi daripada sukrosa 120 g/l, tetapi lebih rendah daripada konsentrasi sukrosa 90 g/l.
Gambar 15. Eksplan Sebelum Muncul Daun (A) dan Eksplan Berdaun (B)
Berdasarkan data Tabel 9 perlakuan CCC berpengaruh nyata terhadap jumlah daun total pada 3 MSP dan 4 MSP dan berpengaruh sangat nyata pada 5, 6, 7, dan 8 MSP. Jumlah daun total tertinggi pada tanaman dengan perlakuan tanpa pemberian CCC terjadi pada 3 MSP, 5 MSP hingga 8 MSP. Hal tersebut diduga karena CCC dalam konsentrasi yang rendah menyebabkan multiplikasi tunas yang tinggi (Tabel 7) sehingga jumlah daun total yang dihasilkan juga tinggi, sedangkan CCC dalam konsentrasi yang tinggi akan menghambat pertumbuhan daun. Menurut Wattimena (1999) pemberian retardan CCC dengan konsentrasi 20 ppm CCC menunjukkan jumlah daun yang terbanyak.