UNIVERSITAS INDONESIA
LAPORAN PRAKTEK KERJA PROFESI APOTEKER DI PT. MOLEX AYUS
JL. RAYA SERANG KM 11,5 CIKUPA TANGERANG
PERIODE 6 FEBRUARI – 30 MARET 2012
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
AGATHA DWI SETIASTUTI, S.Farm.
1106046635
ANGKATAN LXXIV
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM PROGRAM PROFESI APOTEKER - DEPARTEMEN FARMASI
DEPOK JUNI 2012
ii
UNIVERSITAS INDONESIA
LAPORAN PRAKTEK KERJA PROFESI APOTEKER DI PT. MOLEX AYUS
JL. RAYA SERANG KM 11,5 CIKUPA TANGERANG
PERIODE 6 FEBRUARI – 30 MARET 2012
LAPORAN PRAKTEK KERJA PROFESI APOTEKER Diajukan sebagai salah satu syarat untuk memperoleh gelar
Apoteker
AGATHA DWI SETIASTUTI, S.Farm.
1106046635
ANGKATAN LXXIV
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM PROGRAM PROFESI APOTEKER - DEPARTEMEN FARMASI
DEPOK JUNI 2012
iii
iv
KATA PENGANTAR
Puji dan syukur kepada Tuhan Yesus Kristus untuk segala berkat dan penyertaan-Nya sehingga penulis dapat menyelesaikan Laporan Praktek Kerja Profesi Apoteker (PKPA) di PT. Molex Ayus Jl. Raya Serang Km 11,5 Cikupa Tangerang.
Pada kesempatan ini penulis hendak mengucapkan terima kasih kepada : 1. Bapak Drs. Jaka Supriyanta, Apt. selaku Plant Manajer PT Molex Ayus
Pharmaceutical sekaligus pembimbing yang telah membantu dalam pelaksanaan dan penyusunan Laporan Praktek Kerja Profesi Apoteker di PT Molex Ayus.
2. Prof. Dr. Yahdiana Harahap, MS., Apt. selaku Ketua Departemen Farmasi FMIPA UI.
3. Bapak Dr. Harmita, Apt. selaku ketua Program Profesi Apoteker Departemen Farmasi FMIPA Universitas Indonesia atas segala ilmu, nasihat dan dukungan yang telah diberikan.
4. Ibu Dra. Maryati K., M.Si, Apt. selaku pembimbing dari Departemen Farmasi FMIPA UI, yang telah memberikan bimbingan dalam penyusunan laporan ini.
5. Ibu Lindy Ridyawati, S.Farm, Apt. dan Ibu Ermas Diana Sari, S.Farm, Apt.
selaku pembimbing program Praktek Kerja Profesi Apoteker (PKPA) di PT.
Molex Ayus, serta Ibu Nisa Asma Maulida, S.Farm., Apt. dan Ibu Novri, S.Farm., Apt. selaku Pembimbing Tugas Khusus yang telah memberikan bimbingan dan pengarahan.
6. Bapak Dimas Ardiansyah, S.Farm., Apt., selaku Manajer PPIC yang telah memberikan kesempatan, membantu serta memberikan pengarahan kepada penulis.
7. Seluruh pimpinan dan staf PT. Molex Ayus yang memberikan ilmu, pengalaman serta bimbingan dan meluangkan waktunya untuk mengarahkan kami selama PKPA ini berlangsung.
8. Keluarga tercinta yang telah memberikan bantuan, dukungan dan doa selama masa Praktek Kerja Profesi Apoteker berlangsung.
v
9. Teman-teman Apoteker angkatan 74 yang telah berjuang bersama, teristimewa Maya, Loedfia, dan Mutiara
10. Sahabat tercinta, Veto, untuk dukungan dan doa yang diberikan kepada penulis, serta seluruh pihak yang tidak dapat disebutkan satu persatu, yang telah memberi bantuan dan dukungannya kepada penulis.
Penulis menyadari bahwa dalam penulisan laporan ini masih banyak terdapat kekurangan dan kesalahan. Penulis berharap semoga pengetahuan dan pengalaman yang diperoleh selama menjalani praktek kerja profesi apoteker ini dapat memberikan manfaat bagi rekan-rekan sejawat dan semua pihak yang membutuhkan.
Depok, Juni 2012
Penulis
HALAMAN SAMPUL ... i
HALAMAN JUDUL ... ii
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
DAFTAR ISI ... vi
DAFTAR LAMPIRAN ... vii
BAB 1. PENDAHULUAN ... 1
1.1 Latar belakang ... 1
1.2 Tujuan ... 2
BAB 2. TINJAUAN PUSTAKA ... 3
2.1 Industri Farmasi ... 3
2.2 Cara Pembuatan Obat yang Baik (CPOB) ... 9
BAB 3. TINJAUAN KHUSUS PT MOLEX AYUS ... 26
3.1 Sejarah Perkembangan PT. Molex Ayus ... 26
3.2 Visi dan Misi ... 26
3.3 Lokasi dan Tata Letak Bangunan... 27
3.4 Struktur Organisasi ... 27
3.5 Sumber Daya Manusia ... 29
3.6 Bidang Usaha ... 29
3.7 Jenis Produk ... 31
3.8 Departemen di PT. Molex Ayus ... 32
3.9 Sistem Pengolahan Limbah ... 56
3.10 Pengolahan Air untuk Proses Produksi ... 60
3.11 Sistem Tata Udara ... 61
BAB 4. PEMBAHASAN ... 64
BAB 5. KESIMPULAN DAN SARAN ... 84
5.1 Kesimpulan ... 84
5.2 Saran ... 84
DAFTAR ACUAN ... 86
Lampiran 1. Struktur Organisasi PT. Molex Ayus……….. 87
Lampiran 2. Produk PT. Molex Ayus………. 88
Lampiran 3. Skema Proses Pembuatan Sediaan Solid (Granulasi Basah)…... 91
Lampiran 4. Skema Proses Pembuatan Sediaan Solid (Granulasi Kering). 92 Lampiran 5. Skema Proses Pembuatan Sediaan Solid (Cetak Langsung)... 93
Lampiran 6. Skema Proses Pembuatan Sediaan Solid (Penyalutan)... 94
Lampiran 7. Skema Proses Pembuatan Sediaan Liquid... 95
Lampiran 8. Skema Proses Pembuatan Sediaan Semisolid... 96
Lampiran 9. Laporan Barang Datang………... 97
Lampiran 10. Daftar Periksa Penerimaan Barang……….. 98
Lampiran 11. Form Pengambilan Contoh……….. 99
Lampiran 12. Sampel telah diambil oleh bagian Pengawasan Mutu……. 99
Lampiran 13. Label Karantina Bahan Baku dan Bahan Kemas…………. 100
Lampiran 14. Label Karantina oleh bagian Pengawasan Mutu………….. 100
Lampiran 15. Label Release oleh bagian Pengawasan Mutu………. 101
Lampiran 16. Label Ditolak oleh bagian Pengawasan Mutu………. 101
Lampiran 17. Serah Terima Produk……… 102
Lampiran 18. Catatan Pengolahan Bets……… 103
Lampiran 19. Catatan Pengemasan Bets……… 104
Lampiran 20. Label Bersih Alat……… 105
Lampiran 21. Label Ruangan Telah Dibersihkan……… 105
Lampiran 22. Label Produk Antara/Ruahan……….. 106
Lampiran 23. Label Bahan Baku………... 106
Lampiran 24. Surat Penyerahan Barang……….. 107
Lampiran 25. Skema Pengolahan Air di PT. Molex Ayus……….. 108 Lampiran 26. Instalasi Pengolahan Air Limbah (IPAL) di PT. Molex Ayus 109
1.1 Latar Belakang
Kesehatan merupakan salah satu tolak ukur kualitas sumber daya manusia.
Oleh karena itu, pelayanan kesehatan yang memadai dapat menunjang pembangunan sumber daya manusia Indonesia yang lebih berkualitas. Salah satu indikator dari tercapainya pelayanan kesehatan yang bermutu adalah ketersediaan obat. Obat merupakan bahan yang digunakan untuk menyembuhkan, mengurangi gejala, memperlambat keparahan, atau mencegah suatu penyakit. Dengan demikian, obat memiliki peranan dalam meningkatkan derajat kesehatan masyarakat. Obat dirancang untuk dapat dikonsumsi oleh manusia sehingga harus dibuat dengan cara yang baik agar dihasilkan produk yang bermutu dan tidak membahayakan kesehatan.
Industri farmasi, sebagai penghasil obat, memiliki peran dan tanggung jawab yang penting dalam mewujudkan tersedianya obat dalam jumlah, jenis, dan kualitas yang memadai. Seiring dengan meningkatnya pendidikan dan kesadaran masyarakat akan pentingnya kesehatan, persyaratan mutu obat semakin diperketat.
Persyaratan yang harus dipenuhi oleh obat yaitu berkhasiat (efficacy), aman (safety), dan bermutu (quality) dalam dosis yang digunakan untuk tujuan pengobatan. Industri farmasi, sebagai produsen obat, berkewajiban menghasilkan obat yang memenuhi persyaratan tersebut. Industri farmasi dan produk industri farmasi diatur secara ketat karena menyangkut nyawa manusia.
Pemerintah mengatur dan mengawasi pembuatan maupun peredaran obat di Indonesia. Salah satu bentuk pengaturan tersebut tertuang dalam Cara Pembuatan Obat yang Baik (CPOB) yang menjadi pedoman bagi industri farmasi dalam memproduksi suatu obat. Setiap industri farmasi wajib memenuhi persyaratan dalam CPOB untuk menjamin khasiat, mutu, dan keamanan dari obat yang dihasilkan. Produk industri farmasi nasional dapat pula diperdagangkan secara internasional, sesuai dengan panduan dan ketentuan internasional, misalnya ISO 9000 series, c-GMP, PIC/S, dan lain-lain.
Berdasarkan Peraturan Pemerintah No. 51 tahun 2009 tentang Pekerjaan Kefarmasian, tiga posisi kunci dalam industri farmasi, yaitu Penanggung jawab pengawasan mutu, pemastian mutu, dan produksi harus ditangani oleh seorang apoteker. Dengan demikian, apoteker dalam industri farmasi memegang peranan yang penting. Peranan tersebut dimulai dari segi perencanaan produksi, proses produksi, pengawasan mutu, dan pengelolaan manajemen industri farmasi. Oleh karena itu, seorang apoteker dituntut untuk memiliki wawasan dan keterampilan yang cukup dalam melaksanakan tugasnya. Wawasan dan keterampilan tersebut tidak hanya diperoleh melalui kegiatan perkuliahan, namun juga dapat diperoleh melalui kegiatan Praktek Kerja Profesi Apoteker (PKPA) di industri farmasi.
Salah satu industri farmasi adalah PT. Molex Ayus.
Universitas Indonesia sebagai salah satu perguruan tinggi yang menghasilkan tenaga apoteker, mengadakan kerja sama dalam bentuk Praktek Kerja Profesi Apoteker dengan PT. Molex Ayus. Praktek Kerja Profesi Apoteker ini dilaksanakan pada tanggal 6 Februari 2012 sampai dengan 30 Maret 2012.
1.2 Tujuan
Praktek Kerja Profesi Apoteker yang dilakukan di PT. Molex Ayus bertujuan untuk :
1. Mengetahui gambaran umum kegiatan di industri farmasi khususnya di PT.
Molex Ayus dalam rangka penerapan prinsip-prinsip Cara Pembuatan Obat yang Baik (CPOB).
2. Mengetahui peran dan tanggung jawab seorang apoteker dalam menjalankan pekerjaan kefarmasian di industri farmasi, khususnya di PT. Molex Ayus.
2.1 Industri Farmasi
2.1.1 Pengertian Industri Farmasi
Berdasarkan Peraturan Menteri Kesehatan No.1799/MENKES/PER/XII/
2010 tentang Industri Farmasi, yang dimaksud dengan Industri Farmasi adalah badan usaha yang memiliki izin dari Menteri Kesehatan untuk melakukan kegiatan pembuatan obat atau bahan obat. Definisi obat adalah bahan atau paduan bahan, termasuk produk biologi yang digunakan untuk mempengaruhi atau menyelidiki sistem fisiologi atau keadaan patologi dalam rangka penetapan diagnosis, pencegahan, penyembuhan, pemulihan, peningkatan kesehatan dan kontrasepsi, untuk manusia. Bahan obat adalah bahan baik yang berkhasiat maupun tidak berkhasiat yang digunakan dalam pengolahan obat dengan standar dan mutu sebagai bahan baku farmasi. Sedangkan pembuatan obat adalah seluruh tahapan kegiatan dalam menghasilkan obat, yang meliputi pengadaan bahan awal dan bahan pengemas, produksi, pengemasan, pengawasan mutu, dan pemastian mutu sampai diperoleh obat untuk didistribusikan.
2.1.2 Perizinan Industri Farmasi
Setiap pendirian industri farmasi wajib memperoleh izin industri farmasi dari Direktur Jenderal pada Kementrian Kesehatan yang bertugas dan bertanggung jawab dalam pembinaan kefarmasian dan alat kesehatan (Direktur Jenderal).
Namun, untuk memperoleh izin industri farmasi diperlukan persetujuan prinsip.
Persetujuan prinsip dapat diberikan oleh Direktur Jenderal setelah mendapat rekomendasi dari Kepala Badan Pengawas Obat dan Makanan (BPOM) yaitu Kepala Badan yang tugas dan tanggung jawabnya di bidang pengawasan obat dan makanan. Berikut ini adalah uraian tata cara memperoleh izin industri farmasi.
2.1.2.1 Persetujuan Prinsip Industri Farmasi
Persetujuan prinsip industri farmasi diperlukan sebagai perizinan untuk melakukan persiapan, pembangunan, pengadaan, pemasangan, dan instalasi
peralatan, termasuk produksi percobaan. Permohonan persetujuan prinsip dilakukan oleh semua industri farmasi termasuk industri Penanaman Modal Asing (PMA) atau Penanaman Modal Dalam Negeri (PMDN). Terlebih dahulu, pemohon harus memperoleh Surat Persetujuan Penanaman Modal dari instansi yang menyelenggarakan urusan penanaman modal sesuai ketentuan peraturan perundang-undangan. Dalam pengajuan permohonan persetujuan prinsip, terdapat 2 tahap yang harus dilalui. Pertama, pemohon wajib mengajukan permohonan persetujuan Rencana Induk Pembangunan (RIP) kepada Kepala Badan Pengawas Obat dan Makanan (BPOM). Setelah persetujuan RIP diberikan oleh Kepala BPOM, tahap selanjutnya adalah mengajukan permohonan persetujuan prinsip kepada Direktur Jenderal dengan tembusan kepada Kepala BPOM dan Kepala Dinas Kesehatan Provinsi. Persyaratan yang harus dipenuhi dalam mengajukan persetujuan prinsip adalah sebagai berikut:
a. Fotokopi akta pendirian badan hukum yang sah sesuai ketentuan peraturan perundang-undangan
b. Fotokopi Kartu Tanda Penduduk/identitas direksi dan komisaris perusahaan c. Susunan direksi dan komisaris
d. Pernyataan direksi dan komisaris tidak pernah terlibat pelanggaran peraturan Perundang-undangan di bidang farmasi
e. Fotokopi sertifikat tanah atau bukti kepemilikan tanah
f. Fotokopi Surat Izin Tempat Usaha berdasarkan Undang-Undang Gangguan (HO)
g. Fotokopi Surat Tanda Daftar Perusahaan h. Fotokopi Surat Izin Usaha Perdagangan i. Fotokopi Nomor Pokok Wajib Pajak (NPWP) j. Persetujuan lokasi dari pemerintah daerah provinsi
k. Persetujuan Rencana Induk Pembangunan (RIP) dari Kepala Badan l. Rencana investasi dan kegiatan pembuatan obat
m. Asli surat pernyataan kesediaan bekerja penuh dari masing–masing apoteker penanggung jawab produksi, apoteker penanggung jawab pengawasan mutu, dan apoteker penanggung jawab pemastian mutu; dan
n. Fotokopi surat pengangkatan bagi masing-masing apoteker penanggung jawab produksi, apoteker penanggung jawab pengawasan mutu, dan apoteker penanggung jawab pemastian mutu dari pimpinan perusahaan.
Persetujuan prinsip berlaku selama tiga tahun. Persetujuan prinsip dapat diubah berdasarkan permohonan dari pemohon izin industri farmasi yang bersangkutan. Dalam hal tertentu yang berkaitan dengan pelaksanaan penyelesaian pembangunan fisik, atas permohonan pemohon, persetujuan prinsip dapat diperpanjang paling lama satu tahun. Selama melaksanakan pembangunan fisik, yang bersangkutan wajib menyampaikan laporan informasi kemajuan pembangunan fisik setiap enam bulan sekali kepada Direktur Jenderal dengan tembusan kepada Kepala BPOM dan Kepala Dinas Kesehatan Provinsi.
Persetujuan prinsip batal demi hukum apabila setelah jangka waktu tiga tahun dan/atau setelah jangka waktu satu tahun perpanjangan, pemohon belum menyelesaikan pembangunan fisik.
2.1.2.2Izin Industri Farmasi
Permohonan izin industri farmasi dapat diajukan setelah tahap persetujuan prinsip dilaksanakan. Dalam mengajukan permohonan izin industri farmasi, terdapat beberapa hal yang harus dipenuhi diantaranya surat permohonan izin industri farmasi harus ditandatangani oleh direktur utama dan apoteker penanggung jawab pemastian mutu dengan kelengkapan
sebagai berikut:
a. Fotokopi persetujuan prinsip Industri Farmasi
b. Surat Persetujuan Penanaman Modal untuk Industri Farmasi dalam rangka Penanaman Modal Asing atau Penanaman Modal Dalam Negeri
c. Daftar peralatan dan mesin-mesin yang digunakan d. Jumlah tenaga kerja dan kualifikasinya
e. Fotokopi sertifikat Upaya Pengelolaan Lingkungan dan Upaya Pemantauan Lingkungan /Analisis Mengenai Dampak Lingkungan
f. Rekomendasi kelengkapan administratif izin industri farmasi dari Kepala Dinas Kesehatan Provinsi
g. Rekomendasi pemenuhan persyaratan CPOB dari Kepala BPOM
h. Daftar pustaka wajib seperti Farmakope Indonesia edisi terakhir
i. Asli surat pernyataan kesediaan bekerja penuh dari masing-masing apoteker penanggung jawab produksi, apoteker penanggung jawab pengawasan mutu, dan apoteker penanggung jawab pemastian mutu
j. Fotokopi surat pengangkatan bagi masing-masing apoteker penanggung jawab produksi, apoteker penanggung jawab pengawasan mutu, dan apoteker penanggung jawab pemastian mutu dari pimpinan perusahaan;
k. Fotokopi ijazah dan Surat Tanda Registrasi Apoteker (STRA) dari masing- masing apoteker penanggung jawab produksi, apoteker penanggung jawab pengawasan mutu dan apoteker penanggung jawab pemastian mutu
l. Surat pernyataan komisaris dan direksi tidak pernah terlibat, baik langsung atau tidak langsung dalam pelanggaran perundang-undangan di bidang kefarmasian.
Izin industri farmasi berlaku untuk seterusnya selama Industri Farmasi yang bersangkutan masih berproduksi dan memenuhi ketentuan peraturan perundang-undangan. Setiap perubahan alamat di lokasi yang sama atau perubahan alamat dan pindah lokasi, perubahan penanggung jawab, atau nama industri, perubahan terhadap akte pendirian perseroan terbatas harus dilakukan perubahan izin. Permohonan perubahan izin diajukan kepada Direktur Jenderal dengan tembusan kepada Kepala BPOM dan Kepala Dinas Kesehatan Provinsi setempat.
2.1.3 Fungsi dan Kewajiban Industri Farmasi
Industri farmasi mempunyai beberapa fungsi yaitu pembuatan obat dan bahan obat, pendidikan dan pelatihan serta penelitian dan pengembangan. Selain memiliki fungsi, industri farmasi mempunyai kewajiban yang harus dipenuhi diantaranya:
a. Pendirian Industri farmasi wajib memenuhi ketentuan peraturan perundang- undangan di bidang tata ruang dan lingkungan hidup.
b. Industri Farmasi wajib memenuhi persyaratan Cara Pembuatan Obat yang Baik (CPOB) yang dibuktikan dengan sertifikat.
c. Industri Farmasi wajib melakukan farmakovigilans atau seluruh kegiatan tentang pendeteksian, penilaian (assessment), pemahaman, dan pencegahan efek samping atau masalah lainnya terkait dengan penggunaan obat. Apabila dalam melakukan farmakovigilans Industri Farmasi menemukan obat, bahan obat hasil produksinya yang tidak memenuhi standar dan/atau persyaratan keamanan, khasiat / kemanfaatan dan mutu, Industri Farmasi wajib melaporkan hal tersebut kepada Kepala BPOM.
2.1.4 Penyelenggaraan Industri Farmasi
Kegiatan proses pembuatan obat dan bahan obat yang dilakukan industri farmasi dapat berupa sebagian tahapan dan/atau semua tahapan. Pada kegiatan proses pembuatan obat dan bahan obat untuk sebagian tahapan harus berdasarkan penelitian dan penggembangan yang menyangkut produk sebagai hasil kemajuan ilmu pengetahuan dan teknologi. Produk hasil penelitian dan pengembangan tersebut dapat dilakukan proses pembuatan sebagian tahapan oleh industri farmasi di Indonesia.
Industri farmasi yang menghasilkan obat dapat mendistribusikan atau menyalurkan hasil produksinya langsung kepada pedagang besar farmasi, apotek, instalasi farmasi rumah sakit, pusat kesehatan masyarakat, klinik, dan toko obat.
Sedangkan industri farmasi yang menghasilkan bahan obat dapat mendistribusikan atau menyalurkan hasil produksinya langsung kepada pedagang besar bahan baku farmasi, dan instalasi farmasi rumah sakit. Pendistribusian tersebut harus sesuai dengan ketentuan peraturan perundang-undangan.
Industri Farmasi dapat membuat obat secara kontrak kepada Industri Farmasi lain yang telah menerapkan Cara Pembuatan obat yang Baik (CPOB).
Pemberi kontrak wajib memiliki izin industri farmasi dan paling sedikit memiliki satu fasilitas produksi sediaan yang telah memenuhi persyaratan CPOB. Pemberi kontrak dan penerima kontrak bertanggung jawab terhadap keamanan, khasiat / kemanfaatan, dan mutu obat.
Pembuatan sediaan radiofarmaka hanya dapat dilakukan oleh Industri Farmasi dan/atau lembaga setelah mendapat pertimbangan dari lembaga yang berwenang di bidang atom. Pembuatan sediaan radiofarmaka tersebut harus
memenuhi persyaratan CPOB. Industri Farmasi dapat melakukan perjanjian dengan perorangan atau badan usaha yang memiliki hak kekayaan intelektual di bidang obat dan bahan obat untuk membuat obat dan bahan obat.
2.1.5 Pelaporan
Dalam melaksanakan kegiatan usahanya, industri farmasi diwajibkan menyampaikan laporan industri secara berkala. Laporan tersebut terdiri dari dua jenis yaitu laporan industri farmasi enam bulan sekali dan laporan industri farmasi satu tahun sekali. Pada laporan enam bulan sekali, hal-hal yang dilaporkan meliputi jumlah dan nilai produksi setiap obat atau bahan obat yang dihasilkan.
Jangka waktu penyampaian laporan enam bulan sekali adalah tanggal 15 Januari dan tanggal 15 Juli. Sedangkan pada laporan industri farmasi satu tahun sekali, jangka waktu pelaporan industri farmasi tahunan ini paling lambat 15 Januari.
Kedua laporan ini dapat dilaporkan secara elektronik.
2.1.6 Pengawasan terhadap Industri Farmasi
Pengawasan terhadap industri farmasi dilakukan oleh Kepala BPOM.
Dalam melaksanakan pengawasan, tenaga pengawas dapat melakukan pemeriksaan berupa:
a. Memasuki setiap tempat yang diduga digunakan dalam kegiatan pembuatan, penyimpanan, pengangkutan, dan perdagangan obat dan bahan obat untuk memeriksa, meneliti, dan mengambil contoh segala sesuatu yang digunakan dalam kegiatan pembuatan, penyimpanan, pengangkutan, dan perdagangan obat dan bahan obat
b. Membuka dan meneliti kemasan obat dan bahan obat
c. Memeriksa dokumen atau catatan lain yang diduga memuat keterangan mengenai kegiatan pembuatan, penyimpanan, pengangkutan, dan perdagangan obat dan bahan obat, termasuk menggandakan atau mengutip keterangan tersebut
d. Mengambil gambar (foto) seluruh atau sebagian fasilitas dan peralatan yang digunakan dalam pembuatan, penyimpanan, pengangkutan, dan/atau perdagangan obat dan bahan obat.
Namun, apabila tenaga pengawas yang bersangkutan tidak dilengkapi dengan tanda pengenal dan surat perintah pemeriksaan, penanggung jawab atas tempat dilakukannya pemeriksaan oleh tenaga pengawas mempunyai hak untuk menolak pemeriksaan.
Apabila hasil pemeriksaan menunjukkan adanya dugaan atau patut diduga adanya pelanggaran pidana di bidang obat dan bahan obat, segera dilakukan penyidikan oleh Penyidik Pegawai Negeri Sipil yang berwenang. Pelanggaran terhadap ketentuan yang telah ditetapkan dapat dikenakan sanksi administratif berupa:
a. Peringatan secara tertulis
b. Larangan mengedarkan untuk sementara waktu dan perintah untuk penarikan kembali obat atau bahan obat dari peredaran bagi obat atau bahan obat yang tidak memenuhi standar dan persyaratan keamanan, khasiat / kemanfaatan, atau mutu
c. Perintah pemusnahan obat atau bahan obat, jika terbukti tidak memenuhi persyaratan keamanan, khasiat / kemanfaatan, atau mutu
d. Penghentian sementara kegiatan untuk seluruh kegiatan atau sebagian kegiatan.
e. Pembekuan izin industri farmasi f. Pencabutan izin industri farmasi.
Sanksi administratif berupa pembekuan izin industri farmasi dan pencabutan izin farmasi diberikan oleh Direktur Jenderal atas rekomendasi Kepala BPOM.
Sedangkan untuk sanksi administrasi lainnya diberikan langsung oleh Kepala BPOM.
2.2 Cara Pembuatan Obat yang Baik (CPOB)
CPOB merupakan suatu konsep dalam industri farmasi mengenai prosedur atau langkah-langkah yang dilakukan dalam suatu industri farmasi untuk menjamin mutu obat jadi, yang diproduksi dengan menerapkan “Good Manufacturing Practices (GMP)” dalam seluruh aspek dan rangkaian kegiatan produksi sehingga obat yang dihasilkan senantiasa memenuhi persyaratan mutu yang ditentukan sesuai dengan tujuan penggunaannya.
CPOB adalah pedoman yang bertujuan untuk menjamin obat dibuat secara konsisten, memenuhi persyaratan yang ditetapkan dan sesuai dengan tujuan penggunaannya. CPOB menjadi hal yang penting sebab pada pembuatan obat, pengendalian menyeluruh adalah sangat esensial untuk menjamin bahwa konsumen menerima obat yang bermutu tinggi. Pembuatan secara sembaarangan tidak dibenarkan bagi produk yang digunakan untuk menyelamatkan jiwa, atau memulihkan atau memelihara kesehatan. CPOB mencakup seluruh aspek produksi dan pengendalian mutu. Aspek dalam CPOB 2006 meliputi (BPOM, 2006):
2.2.1 Manajemen Mutu
Manajemen mutu merupakan suatu aspek fungsi manajemen yang menentukan dan mengimplementasikan Kebijakan Mutu, yang merupakan pernyataan formal dari manajemen puncak suatu industri farmasi, yang menyatakan arahan dan komitmen dalam hal mutu produknya (BPOM, 2009).
Prinsip dari manajemen mutu yaitu industri farmasi harus membuat obat sedemikian rupa agar sesuai dengan tujuan penggunaannya, memenuhi persyaratan yang tercantum dalam izin edar (registrasi) dan tidak menimbulkan resiko yang membahayakan penggunanya karena tidak aman, mutu rendah atau tidak efektif. Manajemen mutu bertanggung jawab untuk pencapaian tujuan ini melalui suatu “Kebijakan Mutu”, yang memerlukan partisipasi dan komitmen dari semua jajaran di semua departemen di dalam perusahaan, para pemasok dan para distributor. Untuk mencapai tujuan mutu secara konsisten dan dapat diandalkan diperlukan manajemen mutu yang didesain secara menyeluruh dan diterapkan secara benar (BPOM, 2006).
Unsur melaksanakan Kebijakan Mutu dibutuhkan 2 unsur dasar yaitu (BPOM, 2006):
a. Suatu Infrastruktur atau sistem mutu yang tepat mencakup struktur organisasi, prosedur, proses dan sumber daya
b. Tindakan sistematis diperlukan untuk mendapatkan kepastian dengan tingkat kepercayaan yang tinggi, sehingga produk (atau jasa pelayanan) yang dihasilkan akan selalu memenuhi persyaratan yang telah ditetapkan.
Keseluruhan tindakan tersebut disebut Pemastian Mutu atau Quality Assurance (QA).
2.2.2 Personalia
Sumber daya manusia sangat penting dalam pembentukan dan penerapan sistem pemastian mutu yang memuaskan dan pembuatan obat yang benar. Oleh sebab itu industri farmasi bertanggung jawab untuk menyediakan personil yang sehat, terkualifikasi, berpengalaman praktis, dan dalam jumlah yang memadai agar tugas dapat dilaksanakan dengan baik. Selain itu, semua personil harus memahami prinsip CPOB agar produk yang dihasilkan bermutu.
2.2.2.1 Kesehatan Personil
Kesehatan personil dilakukan pada saat perekrutan, sehingga dapat dipastikan bahwa semua calon karyawan (mulai dari petugas kebersihan, pemasangan dan perawatan peralatan, personil produksi dan pengawasan hingga personil tingkat manajerial) memiliki kesehatan fisik dan mental yang baik sehingga tidak akan berdampak pada mutu produk yang dibuat. Disamping itu dibuat dan dilaksanakan program pemeriksaan kesehatan berkala yang mencakup pemeriksaan jenis-jenis penyakit yang dapat berdampak pada mutu dan kemurnian produk akhir. Untuk masing-masing karyawan harus ada catatan tentang kesehatan mental dan fisiknya (BPOM, 2009).
2.2.2.2 Kualifikasi dan Pengalaman Personil
Dalam kualifikasi dan pengalaman personil yang diperlukan untuk tiap posisi tidak hanya ditetapkan secara tertulis yang disimpan oleh bagian SDM, tapi juga dapat ditampilkan pada uraian tugas masing-masing (BPOM, 2009). Tugas penanggung jawab boleh didelegasikan kepada wakil yang ditunjuk serta mempunyai tingkat kualifikasi yang memadai (BPOM, 2006).
2.2.2.3 Jumlah Personil
Jumlah personil yang memadai sangat penting dalam proses produksi.
Kekurangan jumlah personil cenderung mempengaruhi kualitas obat, karena tugas
akan dilakukan secara tergesa-gesa dengan segala akibatnya. Di samping itu kekurangan jumlah karyawan biasanya mengakibatkan kerja lembur sering dilakukan yang dapat menimbulkan kelelahan fisik dan mental baik bagi operator maupun supervisor atau malahan bagi personil pada tingkat lebih atas atau yang melakukan evaluasi dan/atau mengambil keputusan (BPOM, 2009).
2.2.2.4 Struktur Organisasi
Industri farmasi harus memiliki struktur organisasi. Struktur organisasi industri farmasi dibuat sedemikian rupa sehingga bagian produksi, pemastian mutu, dan pengawasan mutu dipimpin oleh orang yang berlainan, yang tidak saling bertanggung jawab satu terhadap yang lain. Masing-masing diberi wewenang penuh dan sarana pendukung yang diperlukan untuk dapat melaksanakan tugasnya secara efektif. Personil tersebut tidak mempunyai kepentingan lain di luar organisasi yang dapat menghambat atau membatasi kewajibannya dalam melaksanakan tanggung jawab atau yang dapat menimbulkan konflik kepentingan pribadi atau finansial.
2.2.2.5 Personil Kunci
Kepala bagian produksi dan kepala bagian pengawasan mutu harus seorang apoteker yang cakap, terlatih, dan memiliki pengalaman praktis yang memadai di bidang industri farmasi dan keterampilan dalam kepemimpinan sehingga memungkinkan melaksanakan tugas secara profesional. Kepala bagian produksi memiliki wewenang serta tanggung jawab penuh untuk mengelola produksi obat. Kepala bagian pengawasan mutu adalah satu-satunya yang memiliki wewenang untuk meluluskan bahan awal, produk antara, produk ruahan, dan obat jadi bila produk tersebut sesuai dengan spesifikasinya, atau menolaknya bila tidak cocok dengan spesifikasinya, atau bila tidak dibuat sesuai dengan prosedur yang disetujui dan kondisi yang ditentukan.
Kategori personil kunci bergantung pada kebijakan perusahaan/industri apakah terbatas hanya pada Kepala Bagian Produksi, Kepala Bagian Pengawasan Mutu dan Kepala Bagian Manajemen Mutu (Pemastian Mutu). Industri dapat menentukan posisi lain yang lebih tinggi, sama atau lebih rendah dicakup dalam
kategori personil kunci. Yang harus dipertahankan adalah semua Kepala Bagian Produksi dan Kepala Bagian Manajemen Mutu (Pemastian Mutu) atau Kepala Bagian pengawasan Mutu harus independen satu terhadap yang lain (BPOM, 2009).
2.2.2.6 Pelatihan
Industri farmasi memberikan pelatihan bagi seluruh personil yang karena tugasnya harus berada di dalam area produksi, gudang penyimpanan atau laboratorium (termasuk personil teknik, perawatan dan petugas kebersihan), dan bagi personil lain yang kegiatannya dapat berdampak pada mutu produk.
Disamping pelatihan dasar mengenai CPOB, personil baru mendapat pelatihan sesuai dengan tugas yang diberikan. Pelatihan berkesinambungan juga diberikan dan efektivitas penerapannya dinilai secara berkala. Program pelatihan yang disetujui kepala bagian masing-masing harus tersedia (BPOM, 2006).
2.2.3 Bangunan dan Fasilitas (BPOM, 2006)
Bangunan dan fasilitas untuk pembuatan obat memiliki desain, konstruksi dan letak yang memadai, serta disesuaikan kondisinya dan dirawat dengan baik untuk memudahkan pelaksanaan operasi yang benar. Tata letak dan desain ruangan harus dibuat sedemikian rupa untuk memperkecil risiko terjadinya kekeliruan, pencemaran silang dan kesalahan lain, dan memudahkan pembersihan, sanitasi, dan perawatan yang efektif untuk menghindari pencemaran silang, penumpukan debu atau kotoran, dan dampak lain yang dapat menurunkan mutu obat.
Letak bangunan harus sedemikian rupa untuk menghindari pencemaran dari lingkungan sekelilingnya, seperti pencemaran dari udara, tanah, dan air serta dari kegiatan industri lain yang berdekatan. Bangunan dan fasilitas dikonstruksi, dilengkapi, dan dirawat dengan tepat agar memperoleh perlindungan maksimal dari pengaruh cuaca, banjir, rembesan dari tanah serta masuk dan bersarangnya serangga, burung, binatang pengerat, kutu, atau hewan lain. Bangunan dan fasilitas dibersihkan dan didesinfeksi sesuai prosedur tertulis yang rinci.
Desain dan tata letak dibuat sedemikian rupa agar kegiatan yang dilakukan sesuai dengan area yang telah ditentukan. Area yang terdapat pada bangunan meliputi area penerimaan bahan, karantina barang masuk, penyimpanan bahan awal dan bahan pengemas, penimbangan dan penyerahan bahan atau produk, pengolahan, pencucian peralatan, penyimpanan peralatan, penyimpanan produk ruahan, pengemasan, karantina produk jadi sebelum memperoleh pelulusan akhir, pengiriman produk, dan laboratorium pengawasan mutu.
2.2.4 Peralatan
Peralatan untuk pembuatan obat harus memiliki desain dan konstruksi yang tepat, ukuran yang memadai, serta ditempatkan dan dikualifikasi dengan tepat agar mutu obat terjamin sesuai desain serta seragam dari bets ke bets dan untuk memudahkan pembersihan serta perawatan.
Pada prinsipnya pengadaan peralatan harus mempertimbangkan apakah sesuai dengan penggunaan dengan produksi / pengujian obat, apakah terbuat dari material yang memenuhi syarat dan aman dalam penggunaannya. Permukaan peralatan yang bersentuhan dengan bahan awal, produk antara, atau produk jadi tidak boleh menimbulkan reaksi, adisi, atau absorbsi yang dapat mempengaruhi identitas, mutu atau kemurnian di luar batas yang ditentukan.
2.2.5 Sanitasi dan Higiene
Tingkat sanitasi dan higiene yang tinggi diterapkan pada setiap aspek pembuatan obat. Ruang lingkup sanitasi meliputi bangunan, peralatan dan perlengkapan, bahan produksi serta wadahnya, dan setiap hal yang merupakan sumber pencemaran produk (lingkungan), sedangkan ruang lingkup higiene meliputi personalia. Sumber pencemaran dihilangkan melalui suatu program sanitasi dan higiene yang menyeluruh dan terpadu. Selain itu, prosedur sanitasi dan higiene hendaknya divalidasi dan dievaluasi secara berkala untuk memastikan bahwa prosedur yang diterapkan cukup efektif dan memenuhi persyaratan.
Untuk menjamin perlindungan produk dari pencemaran dan untuk keamanan, personil mengenakan pakaian pelindung yang bersih dan sesuai dengan tugasnya termasuk penutup rambut. Harus dihindarkan kontak langsung
antara tangan operator dengan bahan awal, produk antara dan produk ruahan yang terbuka dan juga dengan bagian peralatan yang bersentuhan dengan produk.
Untuk sanitasi dan higiene bangunan dan fasilitas menggunakan rodentisida, insektisida, agen fumigasi dan bahan sanitasi. Namun tidak boleh mencemari peralatan, bahan wal, bahan pengemas, bahan yang sedang diproses atau produk jadi. Peralatan yang telah digunakan dibersihkan baik bagian luar maupun bagian dalam sesuai prosedur yang telah ditetapkan, serta dijaga dan disimpan dalam kondisi yang bersih.
2.2.6 Produksi
Produksi dilaksanakan dengan mengikuti prosedur yang telah ditetapkan dan memenuhi ketentuan CPOB yang senantiasa dapat menjamin produk obat jadi dan memenuhi ketentuan izin pembuatan serta izin edar (registrasi) sesuai dengan spesifikasinya (BPOM, 2006).
Selain itu, produksi sebaiknya dilakukan dan diawasi oleh personil yang kompeten. Mutu suatu obat tidak hanya ditentukan oleh hasil analisa terhadap produk akhir, melainkan juga oleh mutu yang dibangun selama tahapan proses produksi sejak pemilihan bahan awal, penimbangan, proses produksi, personalia, bangunan, peralatan, sanitasi dan hygiene sampai dengan pengemasan.
Prinsip utama produksi adalah :
a. Adanya keseragaman atau homogenitas dari bets ke bets.
b. Proses produksi dan pengemasan senantiasa menghasilkan produk yang seidentik mungkin (dalam batas syarat mutu) baik bagi bets yang sudah diproduksi maupun yang akan diproduksi.
Hal-hal yang perlu diperhatikan dalam produksi antara lain (BPOM, 2006):
a. Bahan Awal
Pengadaan bahan awal hanya dari pemasok yang telah disetujui dan memenuhi spesifikasi yang relevan. Semua penerimaan, pengeluaran dan jumlah bahan tersisa harus dicatat. Catatan personil berisi keterangan mengenai pasokan, nomor bets / lot, tanggal penerimaan, tanggal pelulusan,
dan tanggal kadaluarsa. Bahan awal yang diterima personil diuji dan dikarantina sampai disetujui dan diluluskan.
b. Pencegahan Pencemaran Silang
Tiap tahap proses, produk dan bahan personil dilindungi terhadap pencemaran mikroba dan pencemaran lain. Resiko pencemaran silang ini dapat timbul akibat tidak terkendalinya debu, uap, percikan atau organisme dari bahan atau produk yang sedang diproses, dari sisa yang tertinggal pada alat dan pakaian kerja operator. Tingkat resiko pencemaran ini tergantung dari jenis pencemar dan produk yang tercemar.
c. Sistem Penomoran Bets / Lot
Sistem yang menjelaskan secara rinci penomoran bets / lot harus tersedia dengan tujuan untuk memastikan bahwa tiap bets / lot produk antara, produk ruahan atau produk jadi dapat diidentifikasi. Sistem penomoran bets/lot personil menjamin bahwa nomor bets / lot yang sama tidak dipakai berulang.
d. Penimbangan dan Penyerahan
Penimbangan dan penyerahan bahan awal, bahan pengemas, produk antara dan produk ruahan dianggap sebagai bagian dari siklus produksi dan memerlukan dokumentasi yang lengkap. Hanya bahan awal, bahan pengemas, produk antara dan produk ruahan yang telah diluluskan oleh pengawasan mutu dan masih belum kadaluarsa yang boleh diserahkan.
e. Pengembalian
Semua bahan awal dan bahan pengemas yang dikembalikan ke gudang penyimpanan personil didokumentasikan dengan benar dan direkonsiliasi.
f. Pengolahan
Semua bahan yang dipakai di dalam pengolahan personil diperiksa sebelum dipakai. Semua peralatan yang dipakai dalam pengolahan personil diperiksa sebelum digunakan. Peralatan personil dinyatakan bersih secara tertulis sebelum digunakan. Semua kegiatan pengolahan personil dilaksanakan mengikuti prosedur yang tertulis. Tiap penyimpangan personil dilaporkan.
Semua produk antara personil diberi label yang benar dan dikarantina sampai diluluskan oleh bagian pengawasan mutu.
g. Kegiatan Pengemasan
Kegiatan pengemasan berfungsi mengemas produk ruahan menjadi produk jadi. Pengemasan personil dilaksanakan di bawah pengendalian yang ketat untuk menjaga identitas, keutuhan dan mutu produk akhir yang dikemas.
Semua kegiatan pengemasan personil dilaksanakan sesuai dengan instruksi yang diberikan dan menggunakan bahan pengemas yang tercantum dalam prosedur pengemasan induk. Rincian pelaksanaan pengemasan personil dicatat dalam catatan pengemasan bets.
h. Pengawasan Selama Proses
Pengawasan selama proses dilakukan untuk memastikan keseragaman bets dan keutuhan obat, prosedur tertulis yang menjelaskan pengambilan sampel, pengujian atau pemeriksaan yang harus dilakukan selama proses yang dari tiap bets produk personil dilaksanakan dengan metode yang telah disetujui oleh kepala pengawasan mutu. Selama proses pengolahan dan pengemasan bets personil diambil sampel pada awal, tengah, dan akhir proses oleh personil yang ditunjuk. Pengawasan selama proses personil mencakup : a) Semua parameter produk, volume atau jumlah isi produk diperiksa pada
saat awal dan selama proses pengolahan atau pengemasan.
b) Kemasan akhir diperiksa selama proses pengemasan dengan selang waktu yang teratur untuk memastikan kesesuaiannya dengan spesifikasi dan memastikan semua komponen sesuai dengan yang ditetapkan dalam prosedur pengemasan induk.
i. Karantina Produk Jadi
Karantina produk jadi merupakan tahap akhir pengendalian sebelum penyerahan ke gudang dan siap untuk didistribusikan. Sebelum diluluskan untuk diserahkan ke gudang, pengawasan yang ketat personil dilaksanakan untuk memastikan produk dan catatan pengolahan bets memenuhi semua spesifikasi yang ditentukan.
2.2.7 Pengawasan Mutu
Pengawasan mutu adalah bagian yang penting dari Cara Pembuatan Obat yang Baik (CPOB) untuk memastikan tiap obat yang dibuat senantiasa memenuhi
persyaratan mutu yang sesuai dengan tujuan penggunaannya. Sistem pengawasan mutu personil dirancang dengan tepat untuk menjamin bahwa tiap obat mengandung bahan yang benar dengan mutu dan jumlah yang telah ditetapkan dan dibuat pada kondisi yang tepat dan mengikuti prosedur standar sehingga obat tesebut senantiasa memenuhi spesifikasi yang telah ditetapkan untuk identitas, kadar, kemurnian, mutu, dan keamanannya. Pengawasan mutu tidak terbatas pada kegiatan laboratorium, tapi juga harus terlibat dalam semua keputusan yang terkait dengan mutu produk (BPOM, 2006).
Pengawasan mutu personil mencakup semua kegiatan analisis yang dilakukan di laboratorium, termasuk pengambilan sampel, pemeriksaan dan pengujian bahan awal, produk antara, produk ruahan dan produk jadi. Kegiatan ini mencakup juga uji stabilitas, program pemantauan lingkungan, pengujian yang dilakukan dalam rangka validasi, menyusun dan memperbaharui spesifikasi bahan dan produk serta metode pengujiannya (BPOM, 2006).
Area laboratorium pengawasan mutu personil terpisah dari area produksi.
Selain itu bagi suatu laboratorium untuk pengawasan selama proses mungkin lebih memudahkan apabila letaknya di daerah tempat pembuatan atau pengemasan dimana dilakukan pengujian fisik seperti penimbangan dan uji monitoring lainnya secara periodik.
Dokumentasi dan prosedur pelulusan yang diterapkan bagian pengawasan mutu menjamin bahwa pengujian yang diperlukan telah dilakukan sebelum bahan digunakan dalam produksi dan produk disetujui sebelum didistribusikan. Personil pengawasan mutu memiliki akses ke area produksi untuk pengambilan sampel dan penyelidikan yang diperlukan.
2.2.8 Inspeksi Diri dan Audit Mutu
Tujuan inspeksi diri adalah untuk mengevaluasi apakah semua aspek produksi dan pengawasan mutu industri farmasi memenuhi ketentuan CPOB.
Program inspeksi diri dirancang untuk mendeteksi kelemahan dalam pelaksanaan CPOB dan untuk menetapkan tindakan perbaikan yang diperlukan (BPOM, 2006).
Inspeksi diri dilakukan secara independen oleh orang yang kompeten yaitu terkualifikasi dan mempunyai pengalaman yang memadai dalam melakukan
inspeksi diri. Inspeksi diri dapat dilakukan sendiri oleh pihak perusahaan dengan membentuk suatu tim atau oleh konsultan yang independen dari luar perusahaan.
Inspeksi diri mencakup semua bagian yaitu pemastian mutu, produksi, pengawasan mutu, teknik dan gudang (termasuk gudang obat jadi, Bahan baku, dan bahan pengemas) (BPOM, 2009).
Inspeksi diri dilakukan secara rutin dan disamping itu pada situasi khusus, misalnya dalam hal terjadi penarikan kembali obat jadi atau terjadi penolakan berulang. Inspeksi diri dapat dilakukan oleh tiap bagian sesuai dengan kebutuhan pabrik namun inspeksi diri yang dilakukan secara menyeluruh dilaksanakan minimal satu kali dalam setahun. Frekuensi inspeksi diri tertulis dalam prosedur tetap inspeksi diri (BPOM, 2009).
Laporan inspeksi diri dibuat setelah inspeksi diri selesai dilaksanakan.
Laporan inspeksi mencakup hasil inspeksi diri, evaluasi serta kesimpulan, dan saran tindakan perbaikan. Selanjutnya dapat dilakukan evaluasi terhadap laporan inspeksi dan dibuat program tindak lanjut yang efektif.
Penyelenggaraan audit mutu berguna sebagai pelengkap inspeksi diri.
Audit mutu meliputi pemeriksaan dan penilaian semua atau sebagian dari system manajemen mutu dengan tujuan spesifik untuk meningkatkan mutu. Audit mutu umumnya dilaksanakan oleh spesialis dari luar atau independen atau tim yang dibentuk khusus untuk hal ini oleh manajemen perusahaan.
2.2.9 Penanganan Keluhan Terhadap Produk, Penarikan Kembali Produk dan Produk Kembalian
Semua keluhan dan informasi lain yang berkaitan dengan kemungkinan terjadi kerusakan obat dikaji dengan teliti sesuai dengan prosedur tertulis.
Laporan dan keluhan mengenai produk dapat disebabkan oleh keluhan mengenai mutu yang berupa kerusakan fisik, kimiawi, atau biologis dari produk atau kemasannya. Keluhan lainnya adalah karena reaksi yang merugikan seperti alergi, toksisitas, reaksi fatal, dan reaksi medis lainnya, serta keluhan mengenai efek terapetik seperti produk tidak berkhasiat atau respon klinis yang rendah (BPOM, 2009). Keluhan yang berupa keluhan mutu menjadi tanggung jawab Quality Assurance, sedangkan keluhan medis menjadi tanggung jawab Medical Advisor.
Efek samping dan cacat kualitas yang kritis dapat mengakibatkan penarikan obat atau penghentian peredaran obat.
Penarikan kembali produk adalah suatu proses penarikan kembali dari satu atau beberapa bets atau seluruh bets produk tertentu dari peredaran. Penarikan kembali produk dilakukan jika ditemukan produk yang cacat mutu atau jika ada laporan mengenai reaksi merugikan yang serius serta berisiko terhadap kesehatan.
Penarikan kembali produk dapat berakibat penundaan atau penghentian pembuatan obat tersebut. Produk yang ditarik kembali diberi identifikasi dan disimpan terpisah di area yang aman sementara menunggu keputusan terhadap produk tersebut (BPOM, 2009).
Produk kembalian adalah obat jadi yang telah beredar, kemudian dikembalikan ke industri farmasi karena keluhan mengenai kerusakan, daluwarsa, atau alasan lain misalnya kondisi wadah atau kemasan yang menimbulkan keraguan akan identitas, mutu, jumlah, dan keamanan obat yang bersangkutan.
Penanganan produk kembalian dan tindak lanjutnya didokumentasikan dan dilaporkan. Bila produk harus dimusnahkan, dokumentasi mencakup berita acara pemusnahan yang diberi tanggal dan ditandatangani oleh personil yang melaksanakan dan saksi (BPOM, 2009).
2.2.10 Dokumentasi
Dokumentasi pembuatan obat adalah bagian dari sistem informasi manajemen dan dokumentasi yang baik merupakan bagian yang esensial dari pemastian mutu. Dokumentasi yang jelas adalah fundamental untuk memastikan bahwa tiap personil menerima uraian tugas yang relevan secara jelas dan rinci sehingga memperkecil resiko terjadinya salah tafsir dan kekeliruan yang biasanya timbul karena hanya mengandalkan komunikasi lisan. Keterbacaan dokumen sangat penting (BPOM, 2006).
Spesifikasi menguraikan secara rinci persyaratan yang harus dipenuhi produk atau bahan yang digunakan atau diperoleh selama pembuatan. Dokumen ini merupakan dasar untuk mengevaluasi mutu. Prosedur berisi cara untuk melaksanakan operasi tertentu, misalnya pembersihan, berpakaian, pengendalian
lingkungan, pengambilan sampel, pengujian, dan pengoperasian peralatan (BPOM, 2006).
Semua perubahan yang dilakukan terhadap pencatatan pada dokumen ditandatangani dan diberi tanggal serta perubahan tetap memungkinkan pembacaan informasi semula. Dokumen didesain, disiapkan, dikaji, dan didistribusikan dengan cermat. Dokumen dikaji ulang secara berkala dan dijaga agar selalu sesuai dengan zaman. Bila suatu dokumen direvisi, sebaiknya dijalankan suatu sistem untuk menghindarkan penggunaan dokumen yang sudah tidak berlaku secara tidak sengaja (BPOM, 2006).
2.2.11 Pembuatan dan Analisis Berdasarkan Kontrak
Pembuatan dan analisis berdasarkan kontrak harus dibuat secara benar, disetujui dan dikendalikan untuk menghindari kesalahpahaman yang dapat menyebabkan produk atau pekerjaan dengan mutu yang tidak memuaskan.
Kontrak tertulis antara Pemberi Kontrak dan Penerima Kontrak harus dibuat secara jelas menentukan tanggung jawab dan kewajiban masing-masing pihak.
Kontrak harus menyatakan secara jelas prosedur pelulusan tiap bets produk untuk diedarkan yang menjadi tanggung jawab penuh kepala bagian Manajemen Mutu (BPOM, 2006).
Semua pengaturan untuk pembuatan dan analisis berdasarkan kontrak termasuk usul perubahan dalam pengaturan teknis atau pengaturan lain harus sesuai dengan izin edar untuk produk bersangkutan. Kontrak yang dibuat hendaknya mengizinkan pemberi kontrak untuk mengaudit sarana dari penerima kontrak. Dalam hal analisis berdasarkan kontrak, pelulusan akhir harus diberikan oleh kepala bagian Manajemen Mutu pemberi kontrak.
2.2.12 Kualifikasi dan Validasi
Validasi adalah tindakan pembuktian dengan cara yang sesuai bahwa tiap bahan, proses, prosedur, kegiatan, sistem, perlengkapan atau mekanisme yang digunakan dalam produksi maupun pengawasan mutu akan senantiasa mencapai hasil yang diinginkan (CPOB, 2006).
Kualifikasi adalah kegiatan pembuktian bahwa perlengkapan, fasilitas atau sistem yang digunakan dalam suatu proses / sistem akan selalu bekerja sesuai dengan kriteria yang diinginkan dan konsisten.
CPOB menguraikan prinsip kualifikasi dan validasi yang dilakukan di industri farmasi. CPOB mensyaratkan industri farmasi untuk mengidentifikasi validasi yang perlu dilakukan sebagai bukti pengendalian terhadap aspek kritis dari kegiatan yang dilakukan. Perubahan signifikan terhadap fasilitas, peralatan dan proses yang dapat mempengaruhi mutu produk harus divalidasi. Pendekatan dengan kajian risiko digunakan untuk menentukan ruang lingkup dan cakupan validasi.
Seluruh kegiatan validasi harus direncanakan terlebih dahulu. Unsur utama program validasi dirinci dengan jelas dan didokumentasikan dalam Rencana Induk Validasi (Validation Master Plan). Protokol validasi mencakup sekurang- kurangnya data sebagai berikut: kebijakan validasi; struktur organisasi kegiatan validasi; ringkasan fasilitas, sistem, peralatan dan proses yang akan divalidasi;
format dokumen: format protokol dan laporan validasi, perencanaan dan jadwal pelaksanaan; pengendalian perubahan; dan acuan dokumen yang digunakan.
Protokol validasi merinci langkah kritis dan kriteria penerimaan. Setelah kualifikasi selesai dilakukan, maka diberikan persetujuan tertulis untuk dapat melakukan tahap kualifikasi dan validasi selanjutnya.
Laporan harus dibuat mengacu pada protokol kualifikasi dan / atau protokol validasi dan memuat ringkasan hasil yang diperoleh, tanggapan terhadap penyimpangan yang terjadi, kesimpulan dan rekomendasi perbaikan. Tiap perubahan terhadap rencana yang ditetapkan dalam protokol didokumentasikan dengan pertimbangan yang sesuai.
Kualifikasi terdiri dari:
a. Kualifikasi Desain
Kualifikasi desain adalah unsur pertama dalam melakukan validasi terhadap fasilitas sistem atau peralatan baru. Desain harus memenuhi ketentuan CPOB dan didokumentasikan.
b. Kualifikasi Instalasi
Kualifikasi instalasi dilakukan terhadap fasilitas sistem dan peralatan baru atau yang dimodifikasi. Cakupan kualifikasi instalasi meliputi beberapa hal.
Pertama instalasi peralatan, pipa, sarana penunjang, instrumentasi disesuaikan dengan spesifikasi dan gambar teknik yang didesain. ke da namun tidak terbatas.
Kedua pengumpulan dan penyusunan dokumen pengoprasian dan perawatan peralatan dari pemasok. Ketiga ketentuan dan persyaratan kalibrasi. Keempat, verifikasi bahan konstruksi. Namun, cakupan kualifikasi instalasi tidak hanya terbatas pada hal-hal yang telah disebutkan sebelumnya.
c. Kualifikasi Operasional
Kualifikasi operasional dilakukan setelah kualifikasi instalasi selesai dilaksanakan, dikaji dan disetujui. Cakupan kualifikasi operasional meliputi beberapa hal. Pertama pengujian yang perlu dilakukan berdasarkan pengetahuan tentang proses, sisitem dan peralatan. Kedua pengujian yang meliputi satu atau beberapa kondisi yang mencakup batas operasional atas dan bawah sering dikenal sebagai kondisi terburuk (worst case). Namun, cakupan kualifikasi operasional tidak hanya terbatas pada hal-hal yang telah disebutkan sebelumnya.
d. Kualifikasi Kinerja
Kualifikasi kinerja dilakukan setelah kualifikasi operasional selesai dilaksanakan, dikaji dan disetujui. Cakupan kualifikasi kinerja meliputi beberapa hal. Pertama, pengujian dengan menggunakan bahan baku, bahan pengganti, yang memenuhi spesifikasi atau produk simulasi yang dilakukan berdasarkan pengetahuan tentang proses, fasilitas, sistem, dan peralatan. Kedua, uji yang meliputi satu atau beberapa kondisi yang mencakup batas operasional atas dan bawah (worst case). Namun, cakupan kualifikasi operasional tidak hanya terbatas pada hal-hal yang telah disebutkan sebelumnya.
e. Kualifikasi Fasilitas, Peralatan dan Sistem Terpasang yang telah Operasional Bukti untuk mendukung dan memverifikasi parameter operasional dan batas variabel kritis pengoperasian alat harus tersedia. Selain itu, kalibrasi, prosedur
pengoperasian, pembersihan, perawatan preventif serta prosedur dan catatan pelatihan didokumentasikan.
Validasi terdiri dari:
a. Validasi Proses
Validasi proses dilakukan sebelum produk dipasarkan (validasi prospektif).
Dalam keadaan tertentu, jika hal diatas tidak memungkinkan, validasi dapat juga dilakukan selama proses produksi rutin dilakukan (validasi konkuren). Proses yang sudah berjalan juga divalidasi (validasi retrospektif).
Pada validasi prospektif, dengan menggunakan prosedur (termasuk komponen) yang telah ditetapkan, bets- bets dapat diproduksi dalam kondisi rutin.
Secara umum, tiga bets berurutan yang memenuhi parameter yang disetujui dapat diterima memenuhi persyaratan validasi proses. Sedangkan validasi konkuren dilaksanakan sambil melakukan produksi rutin untuk dijual dan sesuai dengan protokol yang telah disiapkan dan disetujui. Bets dapat diluluskan berdasarkan hasil serangkaian uji pengawasan mutu yang intensif, pengkajian, kondisi, pembuatan, dan persetujuan dari pemastian mutu. Dalam hal tertentu validasi konkuren dilakukan terhadap produk yang sudah diproduksi secara rutin apabila terjadi perubahan pabrik pembuat eksipien dengan spesifikasi yang sama dan perubahan mesin dengan spesifikasi yang sama. Sementara itu, validasi retospektif merupakan validasi proses pembuatan produk yang telah dipasarkan yang dilaksanakan berdasarkan data pembuatan, pengujian, dan pengawasan bets yang dikumpulkan sesuai dengan protokol yang telah disiapkan dan disetujui.
Validasi ini mencakup analisis kecenderungan (trend analysis) dengan menggunakan control chart dari data riwayat pembuatan dan pengendalian mutu (uji kadar, disolusi, pH, dan bobot jenis). Pada umumnya validasi retrospektif memerlukan data 10-30 bets.
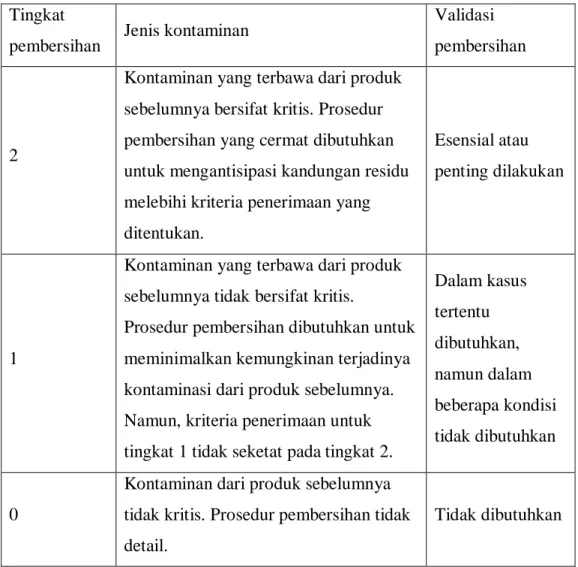
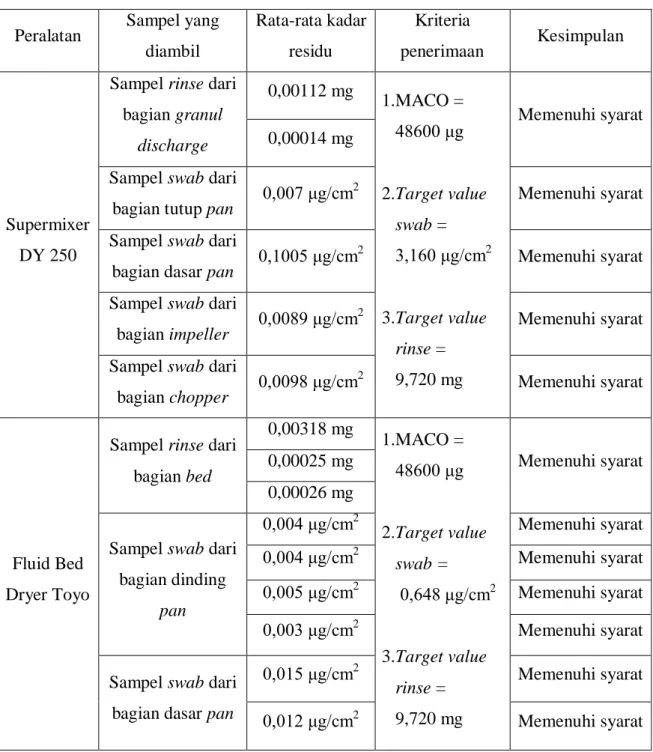
b. Validasi Pembersihan
Validasi pembersihan dilakukan untuk konfirmasi efektifitas prosedur pembersihan. Penentuan batas kandungan residu suatu produk, bahan pembersih dan pencemaran mikroba, secara rasional, didasarkan pada bahan yang terkait dengan proses pembersihan. Batas tersebut dapat dicapai dan diverifikasi.
c. Validasi Ulang
Secara berkala fasilitas, sistem, peralatan, dan proses (termasuk proses pembersihan) dievaluasi untuk konfirmasi bahwa validasi masih absah. Jika tidak ada perubahan yang signifikan dalam status validasinya, kajian ulang data yang menunjukkan bahwa fasilitas, sistem, peralatan, dan proses memenuhi persyaratan untuk validasi ulang.
d. Validasi Metode Analisis
Validasi metode analisis bertujuan untuk mengetahui bahwa metode analisis sesuai dengan tujuan penggunaannya. Validasi metode analisis umumnya dilakukan terhadap uji identifikasi, uji kuantitatif kandungan impuritas, uji batas impuritas, uji kuantitas zat aktif daam sampel bahan atau obat atau komponen tertentu dalam obat. metode analisis lain seperti uji disolusi dan untuk obat atau penetuan partikel untuk bahan baku aktif juga divalidasi.