i
METALOPROTEINASE 9 PADA KARSINOMA TIROID
PAPILER VARIAN KLASIK DAN VARIAN FOLIKULER
DENGAN INFILTRASI INTRAKOMPARTEMEN DAN
EKSTRAKOMPARTEMEN
dr. NI WAYAN ARMERINAYANTI NIM 1114098102
PROGRAM M AGISTER
PROGRAM STUDI ILM U BIOM EDIK PROGRAM PASCASARJANA
UNIVERSITAS UDAYANA DENPASAR
ii
DENGAN INFILTRASI INTRAKOMPARTEMEN DAN
EKSTRAKOMPARTEMEN
Tesis untuk Memperoleh Gelar Magister
pada Program Magister, Program Studi Ilmu Biomedik Program Pascasarjana Universitas Udayana
NI WAYAN ARMERINAYANTI NIM 1114098102
PROGRAM MAGISTER
PROGRAM STUDI ILMU BIOMEDIK PROGRAM PASCASARJANA
UNIVERSITAS UDAYANA DENPASAR
iii
TESIS INI TELAH DISETUJUI TANGGAL 16 Maret 2015
Pembimbing I, Pembimbing II,
dr. I Ketut Mulyadi, SpPA (K) dr. Luh Putu Iin Indrayani Maker, SpPA (K) NIP. 130 327 316 NIP. 197511042008012013
Mengetahui, Ketua Program Studi
Pendidikan Dokter Spesialis-1 Patologi Anatomi
Fakultas Kedokteran Universitas Udayana/RSUP Sanglah Denpasar
iv
Tesis Ini Telah Diuji pada Tanggal 26 Maret 2015
Panitia Penguji Tesis Berdasarkan SK Rektor Universitas Udayana, Nomor: 727 Tanggal 12 Maret 2015
Ketua : dr. I Ketut Mulyadi, SpPA (K) Anggota :
1. Dr. Luh Putu Iin Indrayani Maker, SpPA (K) 2. Prof. dr. I Gusti Alit Artha, MS., SpPA (K), MIAC 3. Dr. Herman Saputra, SpPA (K)
v
Nama : dr. Ni Wayan Armerinayanti
NIM : 1114098102
Program Studi : Magister Ilmu Biomedik (Combine-Degree)
Judul : Perbedaan Skor Ekspresi Matriks Metaloproteinase 9 pada Karsinoma Tiroid Papiler Varian Klasik dan Varian Folikuler dengan Infiltrasi Intrakompartemen dan Ekstrakompartemen
Dengan ini menyatakan bahwa karya ilmiah Tesis ini bebas plagiat.
Apabila di kemudian hari terbukti terdapat plagiat dalam karya ilmiah ini, maka saya bersedia menerima sanksi sesuai peraturan Mendiknas RI No. 17 tahun 2010 dan peraturan peundang-undangan yang berlaku.
Denpasar, 26 Maret 2015 Yang membuat pernyataan,
vi
Pertama-tama penulis memanjatkan puji syukur kepada Ida Sang Hyang Widhi Wasa-Tuhan Yang Maha Esa, atas asung wara nugraha-Nya, sehingga tesis
dengan judul Perbedaan Skor Ekspresi Matriks Metaloproteinase 9 pada Karsinoma Tiroid Papiler Varian Klasik dan Varian Folikuler dengan Infiltrasi Intrakompartemen dan Ekstrakompartemen, dapat penulis
vii
fasilitas untuk mengikuti dan menyelesaikan Program Magister Pascasarjana dan Program Pendidikan Dokter Spesialis I di Universitas Udayana.
2. Direktur Program Pascasarjana Universitas Udayana, Prof. Dr. dr. A. A. Raka Sudewi, SpS (K), atas kesempatan dan fasilitas yang diberikan untuk menjadi mahasiswa Program Pascasarjana Universitas Udayana.
3. Prof. Dr. dr. Wimpie I. Pangkahila, Sp.And., FAACS selaku Ketua Program Studi Ilmu Biomedik (Combined Degree) Program Pascasarjana Universitas Udayana yang telah memberikan kesempatan mengikuti program pendidikan Combined Degree.
4. Direktur RSUP Sanglah Denpasar, dr. Anak Ayu Saraswati, M.Kes atas kesempatan dan fasilitas yang diberikan untuk melanjutkan pendidikan di Bagian Ilmu Patologi Anatomi dan melakukan penelitian di RSUP Sanglah Denpasar.
viii
memberikan bimbingan selama menjalani pendidikan spesialisasi.
7. Prof. dr. I Gusti Alit Artha, MS.,SpPA (K), MIAC, dr. Herman Saputra, SpPA (K), Prof. Dr. dr. I Gede Raka Widiana, SpPD-KGH, selaku penguji, atas semua saran, koreksi, sanggahan, petunjuk dan masukan dalam penyusunan tesis ini.
8. Seluruh staf dosen/pengajar PPDS-1 Patologi Anatomi Fakultas Kedokteran Universitas Udayana/RSUP Sanglah Denpasar, dan semua dosen Pascasarjana Program Magister Ilmu Biomedik Combined Degree, yang telah membimbing, memberikan masukan, dan bekal pendidikan kepada penulis, sehingga membantu menyelesaikan tesis ini.
9. Keluarga besar Fakultas Kedokteran dan Ilmu Kesehatan Universitas Warmadewa yang telah memberikan dukungan, semangat, dan kesempatan mengikuti program pendidikan spesialisasi.
10.Seluruh teman sejawat residen di bagian Patologi Anatomi dan pegawai di bagian/SMF Patologi Anatomi FK Unud/RSUP Sanglah, Denpasar atas bantuan dan kerjasamanya selama ini.
ix
Bagus Gita Pranata Putra dan ananda terkasih, I Putu Bagus Ngurah Nararya Wibawa Pranata, kalian adalah keberuntungan dalam hidupku, terima kasih atas semangat, perhatian, pengorbanan, pengertian dan cinta kasih yang tulus dan tak terhingga selama penulis menjalani masa pendidikan dan menyelesaikan tesis ini. Semoga tesis ini memberikan manfaat dan sumbangan yang berguna bagi perkembangan pelayanan di Laboratorium Patologi Anatomi dan bidang Ilmu patologi Anatomi. Terakhir, semoga Ida Sang Hyang Widhi Wasa-Tuhan Yang Maha Esa, selalu melimpahkan rahmatnya kepada kita semua.
Om Santih, Santih, Santih, Om
Denpasar, Maret 2015
x ABSTRAK
Karsinoma tiroid papiler (KTP) merupakan 80% dari seluruh karsinoma tiroid berdiferensiasi baik dengan 2 tipe tersering yaitu KTP varian klasik dan KTP varian folikuler.(KTPVF) Agresivitas antara kedua tipe karsinoma tiroid ini masih kontroversi, selain itu agresivitas juga sering dikaitkan dengan luas infiltrasi tumor. Matriks Metaloproteinase 9 (MMP-9) merupakan marka relevan dalam memprediksi agresivitas tumor karena mempengaruhi proses invasi dan metastasis tumor. Penelitian ini bertujuan untuk menelusuri mekanisme molekuler keterlibatan MMP-9 dalam menentukan agresivitas KTP dengan membuktikan perbedaan skor ekspresi MMP-9 pada KTP klasik dan KTPVF baik yang menunjukkan infiltrasi intrakompartemen maupun ekstrakompartemen
Penelitian analitik potong lintang ini menggunakan sampel sebesar 40 sampel yang dibagi menjadi 4 kelompok, masing-masing terdiri dari 10 KTP klasik intrakompartemen, 10 KTP klasik ekstrakompartemen, 10 KTPVF intrakompartemen dan 10 KTPVF ekstrakompartemen. Sampel diambil dari arsip blok parafin Laboratorium Patologi Anatomi FK Universitas Udayana/RSUP Sanglah, Denpasar sepanjang tahun 2011 sampai Juni 2014. Kemudian dilakukan pulasan imunohistokimia MMP-9 untuk melihat perbedaan skor ekspresi MMP-9 antar seluruh kelompok, yang dianalisis melalui uji One Way Anova sedangkan pengaruh seluruh variabel independen terhadap skor ekspresi MMP-9 dinilai dengan uji regresi berganda ANCOVA dengan tingkat kemaknaan (α) pada p<0,05.
Terdapat perbedaan rerata skor ekspresi MMP-9 antar keempat kelompok, dimana ditemukan nilai perbedaan yang sangat bermakna antara KTP intrakompartemen dengan KTP ekstrakompartemen (p<0,001). Uji regresi berganda menunjukkan tidak terdapat pengaruh faktor usia, jenis kelamin dan ukuran tumor terhadap skor ekspresi MMP-9 (p>0,05).
Agresivitas karsinoma tiroid papiler ditentukan oleh luas infiltrasi tumor, sedangkan perbedaan tipe histologis (klasik dan varian folikuler), maupun faktor usia, jenis kelamin dan ukuran tumor tidak mempengaruhi agresivitasnya.
xi ABSTRACT
Papillary Thyroid Carcinoma (PTC) was 80% of well differentiated thyroid tumors constitutes two frequently types included classic PTC and follicular variant of PTC (FVPTC). Aggressiveness between those distinct types was still controversies, although aggressiveness also associated with extent of tumor infiltration. Matrix Metalloproteinases 9 (MMP-9) was relevance marker predicting tumor aggressiveness because its role of invasive and metastatic process. The aim of this study was to explore molecular mechanism of MMP-9 in aggressiveness of PTC by proofed difference of MMP-9 expression score in classic PTC and follicular variant of PTC with intra compartment and extra compartment infiltration.
This cross-sectional study was performed on 40 samples that divided into 4 groups which consists of 10 classic PTC intra compartment, 10 classic PTC extra compartment, 10 FVPTC intra compartment and 10 FVPTC extra compartment, taken from paraffin block archive from Pathology Anatomy Departement Faculty of Medicine Udayana University/Sanglah General Hospital Denpasar during 2011 until June 2014. Immunostaining was performed to determined the difference of MMP-9 score expression between four group. Result was analyzed by One Way Anova, while impact of all independent variables on MMP-9 expression was analyzed by multiple regression test ANCOVA, with confidence level (α)<0,05. There was difference of MMP-9 expression score between four group, which showed very significant difference between intra compartment and extra compartment PTC (p<0,001). Multiple regression test showed no impact of age, sex and size of tumor on MMP-9 expression score.
It was concluded that PTC aggressiveness was determined by extent of tumor infiltration, while histological type (classic and follicular variant), age, sex and tumor size were not impacting aggressiveness.
xii
PRASYARAT GELAR ... ii
LEMBAR PENGESAHAN ... iii
LEMBAR PENETAPAN PANITIA PENGUJI ... iv
SURAT PERNYATAAN BEBAS PLAGIAT ... v
UCAPAN TERIMA KASIH ... vi
ABSTRAK ... x
ABSTRACT ... xi
DAFTAR ISI ... xii
DAFTAR TABEL ... xvi
DAFTAR GAMBAR ... xvii
DAFTAR SINGKATAN ... xx
DAFTAR LAMPIRAN ... xxiii
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Rumusan Masalah ... 5
1.3 Tujuan Penelitian ... 5
1.3.1 Tujuan Umum ... 5
1.3.2 Tujuan Khusus ... 5
1.4 Manfaat Penelitian ... 6
1.4.2 Manfaat Praktis ... 6
BAB II KAJIAN PUSTAKA ... 7
2.1 Definisi Karsinoma Tiroid Papiler ... 7
2.2 Klasifikasi Karsinoma Tiroid Papiler ... 7
2.3 Epidemiologi ... 9
2.4 Faktor risiko ... 15
2.5 Patogenesis Karsinoma Tiroid Papiler Klasik dan Varian Folikuler ... 20
2.6 Gejala Klinis dan Makroskopis ... 28
2.7 Mikroskopis Karsinoma Papiler Tiroid Klasik dan Varian Folikuler .... 30
2.8 Sistem Stadium dan Pola Perluasan Karsinoma Tiroid Papiler ... 35
2.9 Penanganan Karsinoma Tiroid Papiler ... 40
2.10 Struktur, Jenis dan Fungsi Umum Matriks Metalloproteinase (MMP)…. ... …….. 44
2.11 Fungsi Matriks Metaloproteinase 9 (MMP-9/Gelatinase………..…..50
2.12 Peranan Matriks Metaloproteinase 9 (MMP-9)/Gelatinase B pada Karsinoma Tiroid Papiler ... 55
BAB III KERANGKA BERPIKIR, KONSEP DAN HIPOTESIS PENELITIAN.... ... 59
3.1 Kerangka Berpikir ... 59
3.2 Konsep Penelitian ... 63
3.3 Hipotesis Penelitian ... 63
BAB IV METODE PENELITIAN ... 64
4.1 Rancangan Penelitian ... 64
4.3 Populasi dan Sampel Penelitian ... 64
4.3.1 Populasi Target ... 64
4.3.2 Populasi Terjangkau ... 64
4.3.3 Sampel ... 65
4.3.4 Perhitungan dan Cara Pengambilan Sampel ... 65
4.4 Kriteria Inklusi dan Eksklusi ... 66
4.4.1 Kriteria Inklusi ... 66
4.4.2 Kriteria Eksklusi ... 66
4.5 Identifikasi Variabel Penelitian ... 68
4.6 Definisi Operasional Variabel ... 69
4.7 Prosedur Penelitian ... 70
4.8 Skema Alur Penelitian ... 75
4.9 Analisis Data ... 76
BAB V HASIL PENELITIAN ... 77
5.1 Karakteristik Subyek Penelitian Berdasarkan Data Klinis Pasien ... 77
5.2 Perbedaan Skor Ekspresi MMP-9 antara kelompok KTP Klasik Intrakompartemen, KTP Klasik Ekstrakompartemen, KTPVF Intrakompartemen dan KTPVF Ekstrakompartemen ... 81
5.3 Hubungan Antar Variabel ... 87
BAB VI PEMBAHASAN ... 89
6.1 Distribusi Kasus Berdasarkan Data Klinis Usia Pasien ... 89
6.2 Distribusi Kasus Berdasarkan Data Klinis Jenis Kelamin Pasien... 92
6.3 Distribusi Kasus Berdasarkan Data Klinis Ukuran Tumor ... 95
6.5 Pengaruh Antar Seluruh Variabel dengan Skor Ekspresi MMP-9 ... 109
BAB VII SIMPULAN DAN SARAN ... 112
DAFTAR PUSTAKA ... 114
xvi
DAFTAR TABEL
Halaman
2.1 Klasifikasi histologik tumor tiroid berdasarkan WHO ... 8
2.2 Tipe histopatologis karsinoma sel folikel tiroid berdasarkan AJCC……….. . 9
2.3 Tabel temuan beberapa studi di Malaysia dan Myanmar tentang hubungan antara karsinoma tiroid dan goiter ... 13
2.4 Prevalensi kasus karsinoma tiroid selama 3 tahun (2008-2010) di Indonesia berdasarkan kelompok usia ... 14
2.5 Sistem TNM brdasarkan AJCC ... 36
2.6 Jenis matriks metaloproteinase ... 48
5.1 Karakteristik Subyek Penelitian ... 79
5.2 Distribusi rerata ukuran tumor pada kelompok KTP Klasik Intrakompartemen, KTP Klasik Ekstrakompartemen, KTPVF Intrakompartemen dan KTPVF Ekstrakompartemen ... 80
5.3 Perbedaan skor ekspresi MMP-9 antara kelompok KTP Klasik Intrakompartemen, KTP Klasik Ekstrakompartemen, KTPVF Intrakompartemen, dan KTPVF Ekstrakompartemen ... 82
xvii
DAFTAR GAMBAR
Halaman
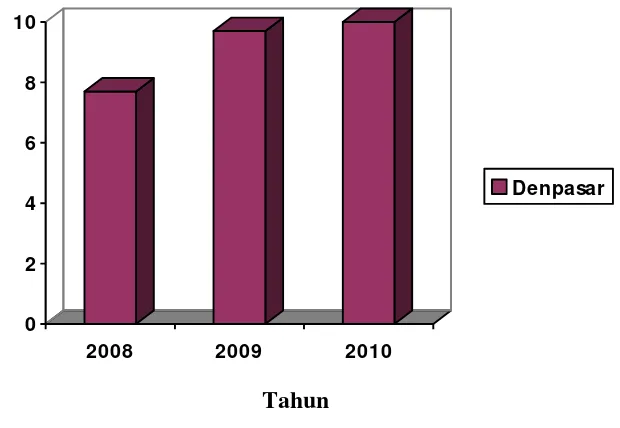
2.1 Grafik prevalensi kasus karsinoma tiroid di Denpasar tahun 2008-2010 berdasarkan data registrasi kanker Perhimpunan Dokter Spesialis Patologi
Anatomi Indonesia………... 11
2.2 Mekanisme nodul goiter sebagai faktor risiko KTP……… ... 17
2.3 Mekanisme beberapa faktor risiko seperti radiasi dalam memicu karsinoma tiroid ... 18
2.4 Kaskade karsinogenesis neoplasma tiroid... 21
2.5 Jalur sinyal sel pada neoplasma sel folikuler….. ... 22
2.6 Tata ulang gen RET/PTC ... 24
2.7 Interaksi antar sel dengan sel dan sel dengan ECM pada karsinoma tiroid.. 27
2.8 Makroskopis karsinoma tiroid papiler ……….29
2.9 Karakteristik inti KTP ... 32
2.10 Mikroskopis KTP Klasik ... 32
2.11 KTPVF yang encapsulated ... 34
2.12 Gambaran Skematik Interpretasi Invasi Kapsel ... 38
2.13 Struktur matriks metalloproteinase (MMP) ... 46
2.14 Fungsi seluler MMP dalam perkembangan dan fisiologi normal ... .. 47
2.15 Struktur MMP (Gelatinase B) ... 51
xviii
2.17 Transisi epithelial menjadi mesenkimal (EMT) yang dipicu MMP-9. ... 5
2.18 Peranan MMP-9 dalam mengaktifkan angiogenesis ... … 54
2.19 Kaitan MMP-9 dengan kemampuan metastasis tumor ... 55
2.20 Pulasan MMP-9 pada KTP ... 58
3.1 Bagan Kerangka Berpikir ... 62
3.2 Bagan Konsep Penelitian ... 63
5.1 Grafik Distribusi Kasus KTP Klasik dan KTPVF dengan Infiltrasi Intrakompartemen dan Ekstrakompartemen berdasarkan Jenis Kelamin Pasien ... 80
5.2 Grafik Beda Rerata Skor Ekspresi MMP-9 kasus KTP Klasik dan KTPVF dengan infiltrasi intrakompartemen dan ekstrakompartemen………. ... 83
5.3 Kasus sampel 1 pulasan imunohistokimia MMP-9 pada KTP Klasik intrakompartemen ... 84
5.4 Kasus sampel 4 pulasan imunohistokimia MMP-9 pada KTP Klasik intrakompartemen ... 84
5.5 Kasus sampel 13 pulasan imunohistokimia MMP-9 pada KTP Klasik ekstrakompartemen ... 85
5.6 Kasus sampel 22 pulasan imunohistokimia MMP-9 pada KTPVF intrakompartemen ... 85
xix
5.8 Kasus sampel 34 pulasan imunohistokimia MMP-9 pada KTPVF ekstrakompartemen ... 86 6.1 Bagan jalur patogenesis keterlibatan MMP-9 dalam proses infiltrasi tumor
pada penelitian………... 99
6.2 Pola Distribusi Ekspresi MMP-9 ... 102 6.3 Pola Ekspresi MMP-9 pada Stroma sekitar Tumor dan pada Makrofag ... 105 6.4 Bagan Jalur Transkripsi MMP-9 yang dilibatkan oleh beberapa Jalur
xx
DAFTAR SINGKATAN
AJCC : American Joint Commission on Cancer AKAP9 : A-kinase anchor protein 9
APC : Adenomatous Polyposis Coli ATA : American Thyroid Association
BRAF : V-raf murine sarcoma viral oncogene homolog B1 cAMP : cyclic Adenosine Mono Phosphate
DNA : Deoxyribonucleic Acid ECM : Extra Cellular Matrix
EMT : Epithelial Mesenchymal Transition ERK : Extracellular-signal-Regulated Kinase
ERα : Estrogen Receptor alpha
ERβ : Estrogen Receptor beta
FGF : Fibroblast growth factor
FGFR : Fibroblast growth factor receptor FNA : fine needle aspiration
Nucleotide-KTM : Karsinoma Tiroid Meduler KTP : Karsinoma Tiroid Papiler
KTPVF : Karsinoma Tiroid Varian Folikuler LOH : Loss of Heterozygosity
LT4 : Levotiroxin
MAPK : Mitogen Activated Protein Kinase MMP-9 : Matriks Metaloproteinase 9
NCCN : National Comprehensive Cancer Network
NTCTCS : National Thyroid Cancer Treatment Cooperative Study NTRK : Neurotropic thyrosine kinase receptor
PARP : Poly-ADP-ribose-polymerase
PTEN : Phosphatase with Tensin Homology Gene RAI : Radioactive Iodine
RAS : Rat sarcoma oncogen
RET : Rearranged during transfection RLN : Recurrent Laryngeal Nerve RND ; Radical Neck Dissection
SEER : Surveillance, Epidemiology, and End Results TIMP : Tissue Inhibitors of Matrix Metalloproteinases TNM : Tumor, Nodes, Metastazes
TRK : Tyrosine Receptor Kinase TSH : Thyroid Stimulating Hormone
TSHR : Thyroid Stimulating Hormone Receptor TTF-1 : Thyroid Transcription Factor-1
VEGF : Vascular endothelial growth factor WHO : World Health Organization
DAFTAR LAMPIRAN
Lampiran 1 Ethical Clearance……… 122
Lampiran 2 Surat Ijin Penelitian………..………... 123 Lampiran 3 Data Subyek Penelitian………..………. 124 Lampiran 4a Uji Normalitas Data Usia………..………….. 125 Lampiran 4b Data Deskriptif Usia pada Seluruh Kelompok KTP…………... 125 Lampiran 4c Statistik Deskriptif Usia secara Keseluruhan………. 126 Lampiran 4d Analisis Beda Rerata Usia antar Seluruh Kelompok KTP…… 126 Lampiran 4e Analisis Beda Rerata Usia Kelompok KTP Intrakompartemen vs
KTP Ekstrakompartemen……… 126
Lampiran 4f Analisis Beda Rerata Usia Kelompok KTP Klasik vs KTPVF.. 126 Lampiran 5a Data Deskriptif Perbandingan Jenis Kelamin antar seluruh
Kelompok KTP ……….. 127
Lampiran 5b Analisis Statistik Perbandingan Jenis Kelamin antar seluruh
kelompok KTP……… 127
Lampiran 6a Uji Normalitas data Ukuran Tumor……… 128 Lampiran 6b Data Deskriptif Ukuran Tumor secara Keseluruhan………….. 128 Lampiran 6c Data Deskriptif Ukuran Tumor Pada Seluruh Kelompok KTP.. 129 Lampiran 6d Analisis Statistik Beda Rerata Ukuran Tumor Pada Seluruh
Kelompok KTP……… 130
Lampiran 6e Analisis Statistik Beda Rerata Ukuran Tumor antara KTP Klasik
Lampiran 6f Analisis Beda Rerata Ukuran Tumor antara KTP Intrakompartemen dan Ekstrakompartemen……… 130 Lampiran 6g Analisis Beda Rerata Ukuran Tumor antara KTP Klasik Intrakompartemen dan KTPVF Intrakompartemen…………. 130 Lampiran 6h Analisis Beda Rerata Ukuran Tumor antara KTP Klasik Intrakompartemen dan KTP Klasik Ekstrakompartemen…… 131 Lampiran 6i Analisis Beda Rerata Ukuran Tumor antara KTP Klasik Ekstrakompartemen dan KTPVF Intrakompartemen………… 131 Lampiran 6j Analisis Beda Rerata Ukuran Tumor antara KTPVF Intrakompartemen dan KTPVF Ekstrakompartemen…………. 131 Lampiran 6k Analisis Beda Rerata Ukuran Tumor antara KTP Klasik Ekstrakompartemen dan KTPVF Ekstrakompartemen………. 131 Lampiran 7a Data Deskriptif Perbandingan Skor Ekspresi MMP-9 antar seluruh
Kelompok KTP ………. 132
Lampiran 7b Uji Homogenitas Skor Ekspresi MMP-9 antar Kelompok
KTP……… 132
Lampiran 7c Uji Analisis Perbedaan Skor MMP-9 Antar Seluruh Kelompok
KTP……… 132
Lampiran 7d Uji Komparasi Multipel antar Seluruh Kelompok KTP………. 133 Lampiran 8 Analisis Statistik (Uji ANCOVA) Pengaruh Antar Seluruh
1
BAB I
PENDAHULUAN
1.1 Latar Belakang
Di Indonesia dan di Bali khususnya insiden karsinoma tiroid sangat tinggi sejalan dengan tingginya insiden goiter. Goiter merupakan faktor predisposisi karsinoma tiroid yang dapat mempengaruhi perangai biologis karsinoma tiroid. Hal ini sangat berbeda dengan insiden karsinoma tiroid di dunia barat yang lebih sering berkaitan dengan efek radiasi. Sedangkan penelitian yang menelusuri agresivitas karsinoma tiroid khususnya karsinoma tiroid papiler (KTP) di wilayah dengan insiden goiter yang tinggi masih terbatas.
Sekitar 90% karsinoma tiroid tergolong berdiferensiasi baik dan 80% diklasifikasikan sebagai KTP sedangkan 10% merupakan karsinoma tiroid folikuler (KTF). Diantara kedua tipe tersebut terdapat tipe campuran yang dahulu dikenal sebagai mixed papillary and follicular carcinoma karena karakteristik intinya sesuai KTP sedangkan polanya histologisnya menyerupai karsinoma folikuler dan saat ini istilah tersebut diganti dengan KTP varian folikuler (KTPVF) (Chang et al., 2006). KTPVF merupakan varian KTP kedua terbanyak setelah KTP varian klasik (Gupta et al., 2012). Di Laboratorium Patologi Anatomi FK Unud/ RSUP Sanglah selama periode 2011-2013 tercatat 96,86% kasus KTP dengan 63,32% kasus diantaranya merupakan KTPVF dan 36,68% kasus merupakan KTP klasik, namun setelah diagnosis ulang ditetapkan 57,67% kasus merupakan KTP klasik dan 42,33% kasus KTPVF. Temuan ini menjadi landasan yang kuat untuk pentingnya pemeriksaan marka tambahan yang dapat menentukan perangai biologis kedua varian KTP ini.
sehingga cenderung bermetastasis jauh dengan ataupun tanpa disertai metastasis ke KGB (Gupta et al., 2012).
Adanya variasi latar belakang molekuler pada KTPVF menyebabkan perangai biologis KTPVF masih sulit diprediksi, beberapa laporan morfologi dan studi longitudinal menyebutkan bahwa area berdiferensiasi buruk, lesi bilateral/multipel, invasi intravasa, invasi perineural maupun infiltrasi ekstrakompartemen meliputi invasi kapsel, perluasan ekstratiroid dan metastasis jauh lebih banyak dijumpai pada KTPVF dibandingkan dengan KTP klasik tetapi risiko metastasis ke limfonodi lebih rendah dibandingkan KTP klasik (Chang et al., 2006; Chrisoulidou et al., 2011; Chen et al., 2012; Gupta et al., 2012). Penelitian lainya justru melaporkan bahwa KTPVF
memiliki perangai klinis maupun patologis yang sebanding dengan KTP klasik (Gonzalez et al., 2011; Der Lin et al., 2010; Salajegheh et al., 2008; De Lellis et al., 2004). Beberapa kasus KTPVF berkembang secara lambat selama bertahun-tahun sehingga dianggap memiliki perangai yang serupa dengan tumor jinak tiroid. Faktor kliniko-patologis lain juga dipercaya mempengaruhi agresivitas KTP, seperti usia dan jenis kelamin pasien, ukuran tumor primer, adanya invasi kapsel, multisentrisitas tumor, serta adanya lesi jinak tiroid sebelumnya (Rosai et al., 2011). Dengan demikian agresivitas KTPVF masih menimbulkan perdebatan tetapi penelitian yang membandingkan agresivitas KTPVF dengan KTP klasik masih sangat terbatas.
terapi tambahan maupun monitoring lanjutan terutama pada kasus KTP yang belum menunjukkan perluasan ekstrakompartemen (Ito et al., 2007; Haigh et al., 2005). Pemahaman tentang mekanisme molekuler yang berkaitan dengan agresivitas KTP sangat penting untuk menemukan strategi terbaru dalam deteksi dini, pencegahan, diagnosis, penentuan terapi dan monitoring KTP. Mekanisme molekuler tersebut sifatnya sangat kompleks dan melibatkan komponen intraseluler dan ekstraseluler. Komponen molekuler yang telah ditemukan perubahannya pada karsinoma tiroid antara lain CK19, Tiroglobulin, Ki67, MMP, Kalsitonin, TTF-1, BRAF, RET, HBME-1, SERPINA1, TfR1/CD71, galectin-3, dan E-cadherin (Ito, 2012).
ekspresi MMP-9 tinggi pada KTP, peningkatan ekspresinya berkorelasi signifikan dengan stadium, ukuran tumor dan adanya metastasis ke limfonodi (Meng et al., 2012; Bouchet et al., 2014). Namun belum ada penelitian yang melaporkan perbedaan skor ekspresi MMP-9 pada KTP klasik dan KTPVF untuk membedakan sifat agresifnya.
Penelitian ini dibuat untuk memahami mekanisme molekular MMP-9 sebagai marka agresivitas dengan menilai perbedaan skor ekspresi MMP-9 pada KTP klasik dan KTPVF baik yang menunjukkan infiltrasi intrakompartemen maupun ekstrakompartemen.
1.2 Rumusan Masalah
Apakah terdapat perbedaan skor ekspresi MMP-9 pada KTP klasik infiltrasi intrakompartemen, KTP klasik infiltrasi ekstrakompartemen, KTPVF infiltrasi intrakompartemen dan KTPVF infiltrasi ekstrakompartemen?
1.3 Tujuan Penelitian 1.3.1 Tujuan Umum
1.3.2 Tujuan Khusus
Membuktikan adanya perbedaan skor ekspresi MMP-9 pada KTP klasik infiltrasi intrakompartemen, KTP klasik infiltrasi ekstrakompartemen, KTPVF infiltrasi intrakompartemen dan KTPVF infiltrasi ekstrakompartemen.
1.4 Manfaat Penelitian 1.4.1 Manfaat Akademik
1. Penelitian ini diharapkan dapat menentukan hubungan antara varian KTP (KTP klasik dan KTPVF) pada berbagai luas infiltrasi tumor (intrakompartemen dan ekstrakompartemen) dengan skor ekspresi MMP-9. 2. Mengetahui peranan MMP-9 sebagai marka biologi prediktif agresivitas KTP.
1.4.2 Manfaat Praktis
1. Penentuan perbedaan skor ekspresi MMP-9 antara KTP Klasik dan KTPVF pada berbagai luas infiltrasi tumor (intrakompartemen dan ekstrakompartemen) dapat dipakai sebagai rujukan penentuan terapi maupun tindakan monitoring lanjutan.
7 BAB II
KAJIAN PUSTAKA
2.1 Definisi Karsinoma Tiroid Papiler
Karsinoma tiroid papiler (KTP) merupakan neoplasma ganas sel epitel folikel tiroid yang membentuk pola pertumbuhan papiler atau disertai dengan pola folikuler dan utamanya ditandai oleh karakteristik inti khas KTP. Gambaran inti yang khas KTP meliputi ukuran inti membesar, berbentuk oval, mengalami elongasi, saling tumpang tindih dengan gambaran clearing atau ground glass appearance atau dengan kontur inti yang ireguler mencakup adanya groove dan inklusi sitoplasma intranuklear. KTP tergolong tumor ganas tiroid yang berdiferensiasi baik (De Lellis et al., 2004).
2.2Klasifikasi Karsinoma Tiroid
Berdasarkan WHO, tumor primer tiroid diklasifikasikan menjadi epitelial dan nonepitelial, jinak atau ganas, dengan kategori yang terpisah untuk limfoma dan keganasan lainnya (tabel 2.1) (De Lellis et al., 2004). Klasifikasi karsinoma tiroid berdasarkan garis besar diferensiasinya dijabarkan menurut American Joint Commission on Cancer (AJCC) sesuai yang dijabarkan tabel 2.2 (Rubin et al., 2012).
Tabel 2.1
Klasifikasi histologik tumor tiroid berdasarkan WHO (Rubin et al., 2012) I. Tumor epitelial
A. Jinak
1. Adenoma Folikuler 2. Lainnya
B. Ganas
1. Karsinoma Folikuler 2. Karsinoma Papiler 3. Karsinoma Meduler*
4. Karsinoma Undifferentiated (anaplastik) 5. Lainnya
II. Tumor Non-epitelial A. Jinak
B. Ganas
III. Limfoma maligna IV. Lainnya
V. Tumor sekunder
VI. Tumor yang tidak dapat diklasifikasikan VII. Lesi yang menyerupai tumor
Tabel 2.2
Tipe Histopatologis Karsinoma Sel Folikel Tiroid (Rubin et al., 2012)
A. Karsinoma papiler (mencakup KTPVF)
B. Karsinoma folikuler (mencakup karsinoma sel hurtle) C. Karsinoma poorly differentiated
D. Karsinoma undifferentiated (anaplastic)
2.3Epidemiologi
dengan kecepatan pertumbuhan 2,4% per tahun antara tahun 1980 hingga 1997 dan 6,5% per tahun sejak tahun 1997 serta saat ini menduduki lima besar karsinoma yang mengalami peningkatan insiden tercepat, baik pada pria maupun wanita. Insiden karsinoma tiroid di seluruh dunia bervariasi pada masing-masing daerah geografis dan secara keseluruhan lebih tinggi pada negara ekonomi berkembang (Nikiforov, 2009).
Peningkatan insiden karsinoma tiroid terutama terjadi pada KTP, sedangkan tipe lain seperti folikuler, meduler, maupun anaplastik tidak menunjukkan perubahan yang signifikan. KTP berjumlah sekitar 83% dari keseluruhan keganasan tiroid dan 80% dari keseluruhan tumor ganas tiroid yang berdiferensiasi baik (Nikiforov, 2009; Meng et al., 2012; Zidan et al., 2003). Peningkatan insiden KTP mencakup KTP klasik dan KTPVF, baik pada tumor yang berukuran <1 cm maupun >1 cm atau bahkan >4 cm hingga 5 cm. Peningkatan temuan insiden KTP kemungkinan terkait dengan semakin maraknya metode deteksi dini melalui pemeriksaan ultrasonografi maupun biopsi jarum halus (FNA/ fine needle aspiration). Alasan lainnya yaitu karena telah dikenalnya perubahan inti yang khas menjadi kriteria morfologi KTP (Nikiforov, 2009; Kondo et al,. 2006).
perempuan. Di Denpasar pada rentang tahun yang sama kanker tiroid menduduki urutan ke 3 dari 10 kanker terbanyak dengan prevalensi secara berurutan yaitu 155/2000 kasus, 84/865 kasus, 118/1124 kasus. Diantara keseluruhan kasus tersebut, diperkirakan sekitar 80% merupakan kasus KTP, dengan varian klasik (KTP Klasik) sebagai subtipe KTP terbanyak (80%) dan diikuti oleh KTPVF sebagai subtipe kedua terbanyak (9-22,5% kasus KTP) (Ditjen Yan Med, 2008-2010; Gupta et al., 2012).
0
Grafik prevalensi kasus karsinoma tiroid di Denpasar tahun 2008-2010 berdasarkan data registrasi kanker Perhimpunan Dokter Spesialis Patologi
Anatomi Indonesia (Ditjen Yan Med, 2008-2010).
Hingga saat ini epidemiologi KTP masih sangat menarik untuk ditelusuri. Penelitian berbagai negara di dunia telah membandingkan insiden tumor ini pada populasi yang tinggal di area dataran tinggi (pegunungan) dengan populasi yang tinggal di sekitar pantai membuktikan bahwa konsentrasi asupan iodium mempengaruhi insiden KTP bahkan pada beberapa kasus berkaitan dengan morfologi
KTP (LiVolsi., 2011). Dilaporkan bahwa insiden KTP lebih sering pada daerah dengan asupan iodium yang cukup, sedangkan insiden KTF berkaitan dengan defisiensi iodium (Knobel et al., 2007).
Kasus goiter baik endemik maupun non endemik (sporadik) diyakini merupakan prekursor perkembangan kanker tiroid. Prevalensi goiter di seluruh dunia pada populasi umum sekitar 4-7%, dan insiden keganasan terjadi pada 10% kasus tiroid goiter. Dilaporkan bahwa insiden karsinoma tiroid tercatat meningkat pada daerah goiter endemik seperti Kolumbia dan Austria serta daerah non endemik seperti Jerman. Peningkatan insiden karsinoma tiroid terkait goiter juga menjadi permasalahan di negara Asia Tenggara termasuk Indonesia. WHO mencatat sekitar 655 juta jiwa di dunia mengalami goiter dan 27% diantaranya berada di Asia Tenggara (Htwe, 2012). Adapun perbandingan hasil studi epidemiologi karsinoma tiroid terkait goiter di beberapa Negara Asia Tenggara sesuai tabel 2.3.
Tabel 2.3
Tabel temuan beberapa studi di Malaysia dan Myanmar tentang hubungan antara karsinoma tiroid dan goiter (Htwe, 2012)
Studi; tahun
•Insiden secara signifikan lebih tinggi pada pria (p=0,01)
•Prevalensi tertinggi pada rentang usia 21-40 tahun
•Tipe histologis tersering: KTP
•28,1% dari 1.480 lesi tiroid merupakan lesi neoplastik
•Tersering adalah KTP (76,6%)
•Mayoritas kasus (59.9%) terjadi dengan latar belakang hiperplasia noduler
•Studi menunjukkan karsinoma tiroid yang berkembang dari MNT terbanyak pada area defisiensi iodium
•Bukan merupakan area endemik , sampel sedikit tetapi Karsinoma tiroid lebih tinggi dari daerah lain (11%) dan KTP (57,5%)
•Rentang usia 21-60 tahun, tertinggi pada ras malay, diikuti india kemudian china.
•Kejadian karsinoma tiroid diantara keseluuhan kasus lebih tinggi secara signifikan; p< 0,0001
•Frekuensi secara signifikan lebih tinggi pada pasien usia 21-60 tahun; p < 0,008
•KTP dan adenoma folikuler secara signifikan lebih tinggi dari tipe lainnya; p = 0,003
Studi epidemiologis lain telah melaporkan kaitan KTP dengan radiasi. Pada pertengahan abad yang lalu, karsinoma tiroid seringkali terdiagnosis pada individu yang sebelumnya pernah menjalani terapi radiasi dosis rendah pada bagian kepala leher untuk penyakit jinak seperti hemangioma, limfangioma, pembesaran kelenjar tymus, pembesaran tonsil dan adenoid. Laporan selanjutnya menyebutkan KTP dijumpai pada korban serangan bom atom di Jepang pada akhir perang dunia II (LiVolsi., 2011). Terakhir diketahui terjadi peningkatan tajam KTP pada anak-anak usia di bawah 15 tahun akibat bencana Chernobyl di Belarusia pada bulan april 1986 yang dikenal sebagai epidemik KTP (LiVolsi., 2011; De Lellis et al., 2004).
Tabel 2.4
Prevalensi kasus karsinoma tiroid selama 3 tahun (2008-2010) di Indonesia berdasarkan kelompok usia
44 tahun dengan rasio perbandingan perempuan terhadap laki-laki yaitu 6:1 (De Lellis et al., 2004; Gupta et al., 2012; Chen et al., 2012). Sesuai tabel 2.4 di Indonesia, selama tahun 2008-2010 lebih dari 75% kasus karsinoma tiroid terjadi pada rentang usia 25-64 tahun, median usia yaitu 49 tahun, dengan rasio perbandingan antara kelompok perempuan terhadap laki-laki yaitu 4:1.
Tingkat mortalitas akibat karsinoma tiroid masih rendah, namun kejadiannya telah mengalami peningkatan sejak tahun 1992 dengan kecepatan 0,6% per tahun. Pada tahun 2010, data terbaru WHO menyebutkan insiden mortalitas karsinoma tiroid sebanyak 3,78%. Sedangkan untuk karsinoma berdiferensiasi baik seperti KTP, angka harapan hidup tergolong tinggi yaitu sekitar 82-86% dan sebanding antara KTP klasik maupun KTPVF (De Matos et al., 2012)
2.4 Faktor risiko
intrinsik (prevalensi goiter lima hingga sepuluh kali lipat lebih sering terjadi pada wanita daripada laki-laki), goitrogen alami, merokok, defisiensi zinc atau selenium dan stress emosional (Fuhrer et al., 2012).
Goiter dapat menimbulkan hiperplasia yang bersifat difusa maupun noduler (nodul tunggal dan multipel) dan dipercaya mempengaruhi peningkatan insiden KTP. Analisis klonal telah dimanfaatkan dalam membedakan hiperplasia dengan neoplasia, dimana hiperplasia digolongkan sebagai proliferasi yang bersifat poliklonal sedangkan neoplasia merupakan proliferasi monoklonal dari sel yang mengalami transformasi genetik. Pada tiroid, ditemukan perubahan pola monoklonal pada kelompok nodul yang sebelumnya merupakan nodul hiperplastik (Kondo et al., 2006). Mekanisme bagaimana perubahan poliklonal menjadi monoklonal ini merupakan interaksi antara faktor risiko goiter dan adanya predisposisi genetik yang selanjutnya menciptakan lingkungan mutagenik yang ditandai oleh peningkatan proliferasi sel disertai pembentukan radikal bebas yang memicu adanya mutasi somatik tirosit. Klonal tumor terbentuk jika defek genetik tidak dapat diperbaiki. Pada kondisi ini, mutasi merupakan pencetus proliferasi sel (Fuhrer et al., 2012). Goiter meningkatkan risiko karsinoma tiroid sebanyak dua setengah kali lipat (Cossu et al., 2013)
Sebuah penelitian eksperimental pada hewan coba yang sebelumnya dengan asupan iodium rendah kemudian diberikan suplementasi iodium didapatkan terjadinya perubahan morfologi folikuler menjadi papiler. Hal ini menunjukkan peranan kadar iodium lebih penting dalam memodulasi morfologi tumor daripada inisiator pada karsinogenesis tiroid. Jika propilaksis iodium diberikan, maka terjadi penurunan rata-rata TSH (Thyroid Stimulating Hormone) serum dan peningkatan perbandingan rasio struktur papiler : folikuler (Kondo et al., 2006). Selain itu peningkatan iodium juga berkaitan dengan frekuensi mutasi BRAFV600E dengan mekanisme yang belum
diketahui dan baru dibuktikan melalui beberapa studi epidemiologi (Pellegriti et al., 2013)
Gambar 2.2
Mekanisme nodul goiter sebagai faktor risiko KTP (Fuhrer et al., 2012) Radiasi meningkatkan risiko karsinoma tiroid hingga enam kali lipat (DeLellis et al., 2004) Paparan radiasi menyebabkan terjadinya tata ulang kromosom yang
yang melibatkan jalur sinyal mitogen activated protein kinase (MAPK). Aktivasi onkogenik sinyal MAPK selanjutnya meningkatkan instabilitas genomik, memicu perubahan lanjut genetik yang melibatkan jalur sinyal lainnya, regulator siklus sel dan berbagai molekul adesi. Instabilitas genomik dan perubahan genetik secara bersama-sama memicu progresi karsinoma tiroid (Kondo et al., 2006)
Gambar 2.3
Mekanisme beberapa faktor risiko seperti radiasi dalam memicu karsinoma tiroid (Kondo et al., 2006)
terjadinya KTP akibat pengaruh imunologis sekitar satu sepertiga kali lipat dibandingkan populasi normal (Baloch et al., 2010).
Terjadinya kasus KTP yang dua hingga empat kali lebih sering pada wanita menunjukkan bahwa hormon pada wanita mengatur karsinogenesis tiroid. Beberapa penelitian melaporkan bahwa reseptor estrogen diekspresikan oleh sel-sel epitel folikel, sehingga pada pasien pemakai kontrasepsi oral maupun yang menjalani terapi estrogen rentan mengalami karsinoma tiroid karena estrogen dapat memicu proliferasi sel epitel folikel. Faktor lain seperti pada kehamilan terjadi peningkatan hormon tiroid serum dan estrogen yang mendukung peranan estrogen dalam karsinogenesis tiroid. Penelitian terbaru menyebutkan bahwa estrogen dapat
meningkatkan ekspresi reseptor estrogen α (ERα) pada sel KTP non anaplastik,
meningkatkan proliferasi sel dan menghambat ekspresi protein pro-apoptosis. Sinyal estrogen berkaitan dengan KTP yang tidak agresif, dengan diferensiasi dan prognosis yang baik. Hal ini terjadi karena pada mayoritas KTP, efek proliferasi ERα akan dihambat oleh ekspresi dominan reseptor estrogen β (ERβ) (Kondo et al., 2006; Kavanagh et al., 2010)
disease (terkait mutasi gen PTEN/ Phosphatase with tensin homology gene), sindrom
Werner (terkait mutasi gen WRN) serta karsinoma sel renal papiler (terjadi kerentanan pada lokus 1q21) dan goiter multinoduler familial (kerentanan pada lokus 19p13.2) (Kondo et al., 2006)
2.5 Patogenesis Karsinoma Tiroid Papiler Klasik dan Varian Folikuler
Karsinoma tiroid terjadi akibat akumulasi dari sejumlah perubahan di tingkat genomik (mutasi) yang dikenal sebagai instabilitas genomik. Berbeda dengan KTF, pada KTP kromosom masih diploid atau mendekati diploid dengan frekuensi Loss of Heterozygosity (LOH) yang lebih jarang. Perbedaan pola instabilitas kromosom ini
Gambar 2.4
Kaskade karsinogenesis neoplasma tiroid (Viglietto et al., 2012).
nucleotide-tiroid, meskipun beberapa laporan kasus pernah menunjukkan adanya mutasi GNAS1 pada karsinoma tiroid berdiferensiasi baik (Kondo et al., 2006).
Gambar 2.5
Jalur sinyal sel pada neoplasia sel folikuler (Kondo et al., 2006).
atau NTRK selanjutnya menyandi reseptor tirosin kinase (TRK) transmembran (Chien et al, 2012). Sedangkan aktivasi point mutation pada BRAF, akan menjadi komponen signaling intermediet dari jalur MAPK, hal ini terjadi terutama pada tumor yang bersifat sporadik (Chien et al, 2012; Fuhrer et al., 2006; Viglietto et al., 2012)
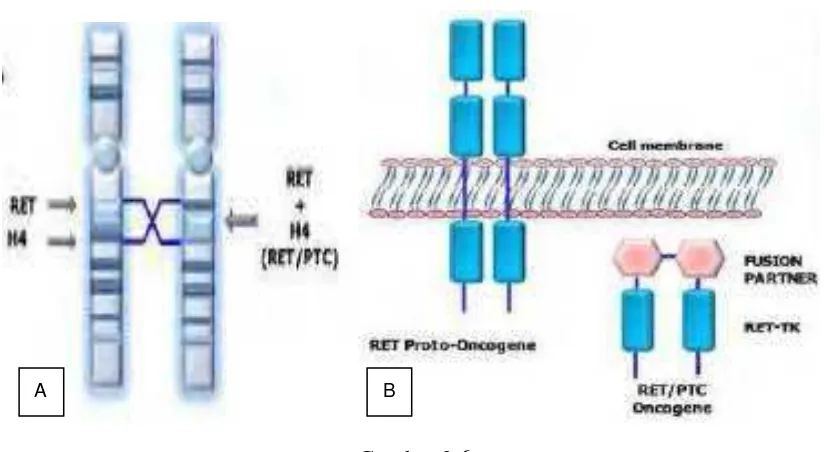
Tata ulang gen RET/PTC diketahui sebagai alterasi genetik spesifik pertama pada karsinogenesis tiroid. Gen RET mengkode reseptor tirosin kinase dari glial cell-derived nervous growth factor dan secara endogen terekspresi pada sel
neuroendokrin. Terjadi ekspresi yang salah dari potongan gen RET pada melalui fusi promotor pada regio N-terminal dari gen terkait (disebut PTC-1,2 dan seterusnya) dan regio C-terminal fungsional dari gen RET (mengandung tirosin kinase). Hasilnya adalah aktivasi RAS-RAF-MAPK signaling. Saat ini teridentifikasi lebih dari 8 protein chimera RET/PTC pada karsinoma tiroid, dimana RET/PTC-1
(inv(10)(q11.2;q21) dan RET/PTC-3 atau ELE1-RET (inv(10)(q11.2;q10) terhitung kira-kira 80% dan merupakan fusi gen yang tersering (Chien et al, 2012). Keduanya melibatkan inversi pada lengan panjang kromosom 10, menghasilkan perpaduan antara RET dengan gen Histone H4 (histone protein nucleosome) pada RET/PTC-1 atau RET dengan nuclear receptor coactivator 4 (NCOA4) pada RET/PTC-3 (Chien et al., 2012; Santoro et al., 2006).
sampai 15%) pada kanker yang sporadis. KTP varian klasik berkaitan dengan RET/PTC1 (Chien et al., 2012).
Gambar 2.6
Tata ulang gen RET/PTC. A.Skema tampilan mekanisme molekuler terbentuknya onkogen PTC. B.Perbandingan antara protoonkogen RET dan onkogen RET/PTC
(Viglietto et al., 2012)
Tata ulang gen lainnya pada KTP adalah inversi kromosom 7q menghasilkan fusi antara BRAF dan AKAP 9 (A-kinase anchor protein 9 gene). Fusi protein ini meningkatkan aktivitas kinase. Sepertiga sampai setengah dari kasus KTP ditemukan gain-of-function mutation pada gen BRAF (Chien et al, 2012; Constantine et al,
2007). BRAF berlokasi pada kromosom 7q32, dan terjadi transversi thymine ke adenine yang menyebabkan perubahan valine menjadi glutamate pada kodon 600
(BRAF V600E) (Constantine et al., 2007; Salajegheh et al., 2008). Mutasi pada BRAF
V600E dapat menyebabkan aktivasi RAF kinase dan secara in vitro dapat
menyebabkan transformasi sel dengan efikasi yang lebih tinggi daripada wild-type
BRAF. Mutasi BRAF V600E dilaporkan sebagai defek molekular yang sering terjadi
pada KTP yang sporadis (berkisar antara 36% sampai 69%) dan pada KTP klasik (antara 29-69%). Sementara tata ulang gen AKAP9/BRAF (inv(7)(q21-22q34) terjadi pada radiation-induced karsinoma tiroid. Mutasi BRAF berkaitan dengan tumor yang lebih agresif, sehingga memiliki prognosis yang buruk (Chien et al., 2012).
Seperti halnya yang sering dijumpai pada KTF, 13% KTPVF mengalami translokasi kromosom t(2;3)(q13;p25) yang menggabungkan faktor transkripsi khusus tiroid PAX8 ke PPARɤ, reseptor hormon inti yang secara normal terlibat dalam diferensiasi sel berbagai jaringan. Selanjutnya ditemukan bahwa terdapat hubungan antara adanya translokasi PAX8-PPARɤ dengan KTPVF yang multifokal dan dengan invasi vaskuler. Sehingga tata ulangnya ini kemungkinan berperan memicu proses metastasis (Chien et al., 2012; Salajegheh et al., 2008).
Translokasi PAX8-PPARɤ juga disertai mutasi BRAF non konvensional (K601E)
yang menimbulkan penggantian lisin oleh glutamat pada kodon 601 (BRAF K601E),
akibatnya terjadi peningkatan aktivitas kinase seperti yang terjadi pada mutasi BRAF V600E pada KTP klasik. Namun aktivitas kinase BRAF V600E 2,5 kali lebih besar
daripada aktivitas kinase oleh BRAF K601E. Penelitian Trovisco dkk meyakinkan
bahwa mutasi BRAF K601E spesifik untuk KTPVF (Chien et al., 2012; Salajegheh et
al., 2008).
korelasi yang sangat kuat antara mutasi Ras dengan diferensiasi folikuler pada karsinogenesis tiroid. Terdapat tiga protoonkogen Ras, diantaranya HRAS (pada kromosom 11p11), KRAS (pada kromosom 12p12), dan NRAS (pada kromosom 1p13) merupakan kelompok famili besar protein yang berikatan dengan guanosin triposfat (GTP) (Salajegheh et al., 2008). Mutasi pada karsinoma tiroid ini melibatkan kodon 61 dari HRAS dan NRAS. Diketahui bahwa insiden mutasi Ras lebih jarang dijumpai pada karsinoma tiroid yang berdiferensiasi baik dibandingkan dengan yang berdiferensiasi buruk maupun yang anaplastik. Hal ini membuktikan bahwa mutasi Ras berhubungan dengan progresi tumor (Kondo et al., 2006).
Selain keseluruhan proses intraseluler tersebut, progresi KTP berkaitan dengan berbagai proses ekstraseluler seperti interaksi antar sel maupun interaksi sel dengan ECM yang pada akhirnya juga mempengaruhi kondisi intraseluler (gambar 2.7). Fibroblast growth factor (FGF) dan reseptornya (FGFR) merupakan regulator
penting dalam proses tomorigenesis maupun angiogenesis pada KTP. Pada berbagai karsinoma tiroid akan terekspresi FGFR1, FGFR3 maupun FGFR4, sedangkan FGFR2 hanya terekspresi pada tiroid normal dewasa. FGFR4 akan terekspresi pada fenotip yang agresif mempengaruhi proliferasi, migrasi maupun diferensiasi sel. Selain itu reseptor tirosin kinase MET yang merupakan reseptor untuk hepatocyte growth factor (HGF) diketahui terekspresi kuat pada KTP (77-93%) dan berkaitan
Gambar 2.7
Interaksi antar sel dengan sel dan sel dengan ECM pada karsinoma tiroid (Kondo et al., 2006).
2.6 Gejala klinis dan Makroskopis
Secara umum, KTP tampak sebagai massa tiroid atau cold nodule pada scan radioaktif iodium atau seperti limfadenopati regio servikal. Pada area dengan defisiensi iodium, KTP dapat berkembang dan tampak sebagai nodul yang berbeda diantara goiter multinoduler. Sedangkan pada populasi dengan asupan iodium yang cukup, KTP tampak sebagai nodul soliter yang teraba diantara kelenjar tiroid normal. KTP seringkali ditemukan secara insidental pada nodul tiroid yang tidak teraba, misalnya pada kasus trauma atau penyakit lainnya saat pemeriksaan imaging seperti USG (Ultrasonografi). Nodul preklinis yang berupa fokus kecil atau fokus mikroskopik KTP juga kadang ditemukan pada saat otopsi. Pentingnya arti klinis karsinoma papiler yang tidak teraba tidak terlalu diperdebatkan sejak diketahui bahwa karsinoma papiler dengan ukuran yang besar dan teraba pada pasien usia muda memiliki harapan hidup 20 tahun sebanyak lebih dari 98% (De Lellis et al., 2004).
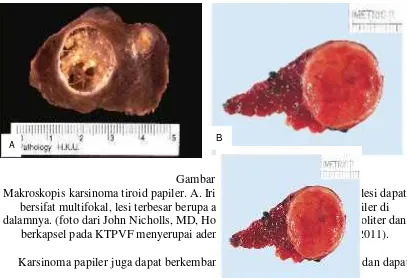
Gambar 2.8
Makroskopis karsinoma tiroid papiler. A. Irisan KTP klasik menunjukkan lesi dapat bersifat multifokal, lesi terbesar berupa area kistik dengan tonjolan papiler di dalamnya. (foto dari John Nicholls, MD, Hong Kong University) B. Lesi soliter dan
berkapsel pada KTPVF menyerupai adenoma folikuler (Baloch et al., 2011). Karsinoma papiler juga dapat berkembang dari kista duktus tiroglosus dan dapat menunjukkan perluasan langsung ke lemak peritiroid, otot skeletal, esofagus, larynx dan trakea. Karsinoma papiler memiliki kemampuan menginvasi sistem limfatik dalam kelenjar tiroid sehingga metastasis ke kelenjar getah bening sering terjadi.
Untuk KTPVF, secara makroskopis sering menyerupai adenoma folikuler encapsulated yaitu berupa tumor cenderung soliter berbentuk bulat hingga ovoid, dan berkapsel (De Lellis et al., 2004). Pada irisan akan tampak berwarna kuning kecoklatan, mengkilat (glassy) karena kandungan koloid yang dimilikinya (Baloch et al., 2010).
2.7 Mikroskopis Karsinoma Papiler Tiroid Klasik dan Varian Folikuler
Terdapat berbagai varian/ subtipe KTP, diantaranya varian terbanyak yaitu varian klasik yang didominasi pola pertumbuhan papiler dan varian terbanyak berikutnya yaitu varian folikuler (KTPVF) yang didominasi dengan pola pertumbuhan folikuler. Selain itu terdapat pula varian lain yang lebih agresif dilihat dari pola pertumbuhan, tipe sel dan reaksi stroma seperti tall cell, columnar cell, diffuse sclerosing, clear cell dan varian onkositik (Salajegheh et al., 2008). Secara umum, kriteria diagnosis KTP awalnya didasarkan pada pola pertumbuhan papiler, namun saat ini sesuai ketetapan WHO, hallmark diagnosis KTP didasarkan pada karakteristik inti (LiVolsi, 2011).
Gambaran histologi karakteristik inti KTP yaitu inti sel yang jernih, kosong, atau Orphan Annie eye. Inti jernih ini berukuran lebih besar dengan bentuk yang lebih
lainnya yaitu adanya nuclear groove yaitu gambaran inti yang terbelah seperti biji kopi (LiVolsi, 2011; Gonzalez et al., 2011).
Pada KTP klasik, susunan sel didominasi oleh struktur papiler namun dapat bervariasi dan bercampur dengan struktur folikuler (Gonzalez et al., 2011). Struktur papiler umumnya kompleks dan bercabang, pada beberapa kasus papil bisa sangat edematous. Struktur papiler ini dilapisi oleh epitel dengan polaritas yang terganggu dan sitoplasma yang eosinofilik. Pola arsitektur lain seperti folikuler maupun solid umumnya bersamaan dengan struktur papiler dan sangat jarang menemukan pola petumbuhan papiler murni (Livolsi, 2011).
Gambar 2.9 Karakteristik inti KTP
A.Inti menggambarkan ground glass appearance (tanda panah). B.Karakeristik lain inti KTP yaitu nuclear groove (tanda panah) (Livolsi, 2011; DeLellis et al., 2004)
Gambar 2.10 Mikroskopis KTP klasik
A. KTP dengan struktur papiler yang dominan. B. Fibrovascular core pada KTP klasik (Gonzales et al., 2011)
A B
Gambar 2.11
KTPVF yang encapsulated. KTP tersusun membentuk struktur folikuler pada seluruh area tumor dengan inti menunjukkan karakteristik KTP (Gonzalez et al.,
2011).
KTPVF memiliki beberapa varian, diantaranya varian encapsulated, nonencapsulated, dan difus (Gupta et al., 2012). KTPVF varian encapsulated
menyimpulkan diagnosis. Kriteria minor tersebut mencakup: (1) adanya papil abortif, (2) didominasi oleh folikel yang memanjang atau ireguler, (3) koloid berwarna gelap, (4) adanya pseudoinklusi inti, dan (5) histiosit berinti banyak pada lumen folikel (Chen et al., 2012). Selain itu, folikel neoplastik pada KTPVF umumnya dengan bentuk yang ireguler dan ukuran yang lebih bervariasi daripada karsinoma maupun adenoma folikuler (Baloch et al., 2011).
Gambaran psammoma bodies, kalsifikasi dan respon desmoplastik dapat ditemukan pada KTPVF tapi cenderung lebih jarang jika dibandingkan dengan KTP klasik. Psammoma bodies tampak sebagai “bayangan” papil yang telah mati merupakan diferensiasi kalsifikasi distrofik terbentuk dari area infark fokal pada ujung papil yang menarik kalsium. Infark yang terus menerus disertai deposit kalsium menimbulkan lamelasi. Psammoma bodies biasanya tampak pada bagian sentral tangkai, pada stroma tumor, atau pembuluh limfatik, namun tidak pernah berada di dalam folikel neoplastik (koloid) (Livolsi 2011; De Lellis et al., 2004).
2.8 Sistem Stadium dan Pola Perluasan Karsinoma Tiroid Papiler
Klasifikasi stadium tumor tiroid sesuai sistem TNM yang didasarkan pada ukuran tumor (T), penyebaran limfatik (N), dan metastasis jauh (M). Sistem TNM ini disahkan oleh International Union Against Cancer (IUCC) dan American Joint Commission on Cancer (AJCC). Berikut penjabaran klasifikasi sistem TNM
Tabel 2.5
Sistem TNM berdasarkan AJCC (Rubin et al., 2012)
Invasi kapsel maupun invasi intravasa merupakan faktor prediktif terjadinya metastasis pada KTP. Selanjutnya adanya metastasis baik ke KGB maupun metastasis jauh mempengaruhi tingginya angka kekambuhan dan mortalitas pada pasien KTP (Gupta et al., 2012). Secara morfologi, KTPVF cenderung lebih sering berkapsel dibandingkan KTP klasik sehingga gambaran invasi kapsel lebih sering dijumpai pada kasus KTPVF, seperti halnya pada KTF maupun adenoma folikuler. Frekuensi invasi kapsel pada KTPVF encapsulated lebih tinggi dibandingkan KTP klasik yaitu 65% berbanding 38% (Gupta et al., 2012; Chen et al., 2012). Pada KTPVF encapsulated, kaskade perluasan tumor diawali dengan invasi tumor melewati kapselnya, baik tanpa atau disertai adanya invasi vasa intra kapsuler maupun ekstra kapsuler. Seiring dengan peningkatan ukuran tumor dan kemampuan invasifnya, akhirnya terjadi kaskade lanjutan berupa perluasan tumor ke jaringan ekstra tiroid. Namun proses lanjutan ini jarang terjadi pada KTPVF encapsulated, perluasan ekstra tiroid lebih sering dijumpai pada KTPVF nonencapsulated dalam frekuensi yang sebanding dengan KTP klasik (Chen et al., 2012; Chrisoulidou et al., 2011; Ghossein et al., 2009). Penentuan kriteria adanya invasi kapsel pada KTPVF sama seperti
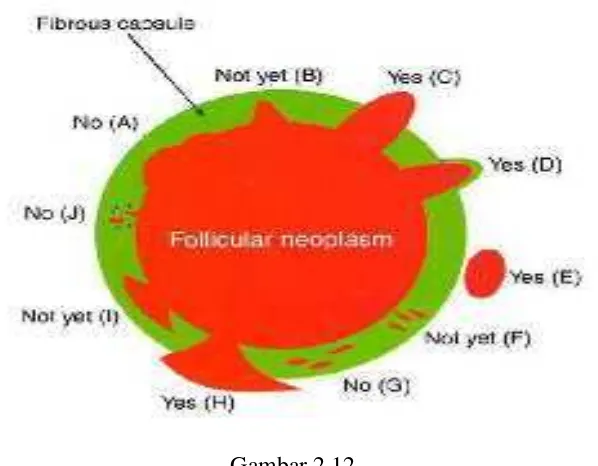
Gambar 2.12
Gambaran Skematik Interpretasi Invasi Kapsel (Ghossein et al., 2009)
telah mengalami invasi kapsel adalah C, D, E dan H sedangkan A, B, F, G, I dan J belum dinyatakan mengalami invasi kapsel (Ghossein et al., 2009).
KTPVF merupakan varian KTP yang unik karena pola invasinya beragam, selain menembus kapsel dan menimbulkan perluasan ke jaringan ekstratiroid, KTPVF dapat meluas melalui vaskuler sehingga menimbulkan metastasis ke organ jauh dan dapat pula serupa dengan KTP klasik yang melalui jalur limfonodi dan akhirnya bermatastasis di KGB. Hal ini berkaitan dengan latar belakang molekuler KTPVF yang dapat mengikuti pola molekuler KTP klasik maupun KTF (Chen et al., 2012; Chrisoulidou et al., 2011; Ghossein et al., 2009).
molekulernya yaitu adanya perubahan genetik akibat mutasi BRAF dan tata ulang RET/PTC (Chen et al., 2012; Chrisoulidou et al., 2011; Ghossein et al., 2009; NCNN, 2012).
2.9Penanganan Karsinoma Tiroid Papiler
Penanganan pasien dengan KTP secara umum terdiri dari empat komponen utama diantaranya ekstirpasi pembedahan yang adekuat, ablasi RAI (Radioactive Iodine) tambahan pada kasus tertentu, supresi TSH, dan surveillance. Keseluruhan strategi terapi tergantung pada temuan preoperatif dan intraoperatif sesuai klasifikasi TNM serta evaluasi postoperatif yang berkaitan dengan perangai biologis tumor (Cooper et al., 2006; NCCN, 2012). Penelitan sebelumnya menunjukkan perangai KTPVF
varian encapsulated berbeda dengan KTP klasik, terkait tingkat mutasi BRAF V600E
Pilihan terapi untuk reseksi tumor primer tiroid sering diperdebatkan, apakah harus memilih lobektomi atau tiroidektomi total atau near-total (mendekati total). Hingga saat ini masih diperdebatkan luas tiroidektomi yang harus dilakukan, terutama untuk KTP yang berukuran kecil, intratiroid, berisiko rendah dan berdiferensiasi baik. Beberapa memaparkan bahwa terapi lobektomi tidak memberikan keuntungan harapan hidup dibandingkan tiroidektomi yang lebih luas namun bisa mengurangi risiko terjadinya komplikasi cedera RLN (Recurrent Laryngeal Nerve) dan hipoparatiroidisme permanen (Cooper et al., 2006; Bilimoria et
al., 2007)
limfonodi atau metastasis jauh, atau varian histologis KTP bersifat agresif (Toniato et al., 2008; Haigh et al., 2005)
Metastasis KGB pada kasus KTP sering ditemukan, melalui tindakan diseksi leher propilaktik didapatkan prevalensi 33-63% untuk metastasis KGB leher sentral (pre-atau paratrakea/ level VI), dan prevalensi 57-64% untuk metastasis KGB leher lateral (level II, III, dan IV) yang sebelumnya tidak terdeteksi melalui pemeriksaan ultrasonografi preoperatif. Diseksi limfonodi yang berorientasi pada terapeutik kompartemen diindikasikan bagi metastasis limfonodi servikal yang sudah diketahui. Meskipun jumlah ini tinggi, namun arti pentingnya metastasis limfonodi masih belum jelas karena beberapa studi menunjukkan bahwa metastasis limfonodi tidak berpengaruh pada keseluruhan harapan hidup, terutama pada pasien yang berusia dibawah 45 tahun (Shindo et al., 2006; Ito et al., 2006; Pereira et al., 2005)
Kegunaan limfadenektomi propilaktik dalam terapi kasus KTP masih kontroversi. Kelompok pendukung RND berpendapat bahwa metastasis limfonodi regional sering terjadi dan berkaitan dengan tingginya tingkat kekambuhan dan kematian. Sedangkan kelompok yang menetang berpendapat bahwa metastasis limfonodi tidak berpengaruh pada keseluruhan harapan hidup, dan prosedur ini justru meningkatkan risiko komplikasi dengan dilaporkannya 2-7% kasus paralisis vocal cord sementara, 14-60% hipoparatiroidisme sementara dan 2-5% hipoparatiroidisme permanen. American Thyroid Association Guidelines (ATA) 2009 memberi rekomendasi untuk tindakan
primer bersifat lanjut (T3 atau T4) meskipun secara klinis tidak ditemukan keterlibatan limfonodi sentral leher (Ito et al., 2012).Disisi lainnya, pedoman NCCN (National Comprehensive Cancer Network) tidak menganjurkan tindakan diseksi leher sentral rutin, kecuali jika pada pemeriksaan palpasi atau biopsi limfonodi positif menunjukkan lesi metastasis (Ito et al., 2012; Pereira et al., 2005).
Komponen kedua pada strategi penanganan global pasien KTP adalah ablasi RAI yang diberikan pada 4-12 minggu setelah tindakan pembedahan, bertujuan untuk menghancurkan sisa jaringan tiroid setelah tiroidektomi dan menangani lesi metastasis yang masih tersembunyi ataupun telah diketahui. Kontroversi tindakan ablasi RAI timbul karena meskipun dapat mengurangi tingkat kekambuhan dan mortalitas, beberapa studi justru menunjukkan tidak ada keuntungan, terutama bagi pasien yang masuk dalam kelompok risiko rendah. Baik pedoman ATA maupun NCCN menganjurkan ablasi RAI untuk seluruh pasien KTP kecuali pasien stadium 1 yang memiliki risiko kekambuhan sangat rendah (pasien dengan diferensiasi baik, unifokal, tumor berukuran lebih kecil dari 1 cm, tanpa perluasan ekstratirod atau invasi vaskuler, dan tanpa metastasis limfonodi maupun jauh (Sawka et al., 2004).
pasien risiko tinggi. Pedoman ATA menganjurkan penekanan TSH dibawah 0.1 mIU/mL untuk kelompok risiko tinggi dan antara 0.1-0.5 mIU/mL untuk kelompok risiko rendah (McGriff et al., 2004).
Komponen terakhir pada strategi penanganan global kasus KTP adalah surveilens. Lonjakan terjadinya tumor dipantau secara periodik oleh klinisi yang berpengalaman. Pengukuran TSH, Tg dan anti-TG serum, USG servikal dan scan RAI sensitif untuk adanya lesi sisa atau kekambuhan (Cooper et al., 2006).
Terapi terbaru untuk pasien dengan KTP lanjut dan metastatik meliputi pemberian agen rediferensiasi, dimana agen tersebut memiliki target pada jalur RAS, BRAF, VEGF dan reseptornya, jalur reseptor EGF dan jalur angiogenik lain dengan agen seperti thalidomide dan proteasome (Xing et al., 2005; Ito et al., 2007).
MMP dilepaskan sebagai proenzim yang tidak aktif, tetapi selanjutnya diaktifkan oleh berbagai faktor yang dikendalikan oleh TIMP (tissue inhibitors of matrix metalloproteinases). Kelompok/ famili TIMP dibentuk oleh empat enzim. Kondisi
patologis akan timbul jika terjadi ketidakseimbangan tingkat MMP dan TIMP. Berbagai penelitian juga melaporkan bahwa peningkatan ekspresi MMP memicu berbagai penyakit inflamasi, keganasan dan degeneratif. Disinilah pentingnya aktivitas penghambat MMP dalam terapi (Ansari et al., 2013). Seperti yang tampak pada gambar 2.13, MMP memiliki tiga domain utama, yaitu:
1) Pro-peptida yang berperan menjaga enzim dalam bentuk tidak aktif. Domain
ini mengandung “Cystein switch” yakni residu cystein unik dan selalu terjaga,
yang berinteraksi dengan zinc pada bagian aktif. Saat aktivasi enzim, bagian ini akan dipecah secara proteolitik oleh furin secara intraseluler atau MMP lainnya dan protease serin secara ekstraseluler.
2) Domain katalitik yang menjadi penanda struktural corak pengikat zinc. Ion Zn2+, diikat oleh tiga residu histidin membentuk area aktif. Area aktif ini berjalan secara horizontal melewati molekul sebagai celah dangkal dan berikatan dengan substrat.
4) Domain terminal-C yang menyerupai hemopexin merupakan domain yang rangkaiannya menyerupai protein serum hemopexin. Rantai polipeptida
domain ini tersusun dalam empat lembaran β yang simetris. Permukaan datar
yang disediakan oleh struktur ini dipercaya terlibat dalam interaksi antar protein dan merupakan penentu spesifisitas substrat, contohnya: TIMP berinteraksi pada area ini.
Gambar 2.13
Struktur Matriks Metaloproteinase (MMP) (Ansari et al., 2013)
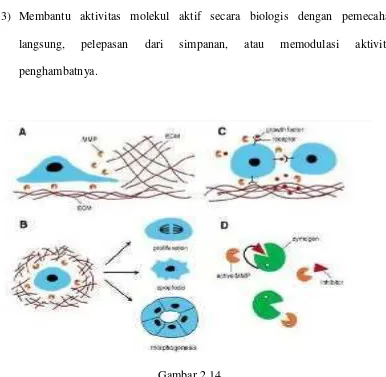
(Loffek et al., 2011). Secara sistematis, beberapa fungsi seluler MMP selama perkembangan dan fisiologis normal, yaitu (sesuai gambar 2.15) (Ansari et al., 2013):
1) Membantu migrasi sel melalui degradasi molekul ECM
2) Mengubah perangai seluler dengan mengubah lingkungan mikro ECM
3) Membantu aktivitas molekul aktif secara biologis dengan pemecahan langsung, pelepasan dari simpanan, atau memodulasi aktivitas penghambatnya.
Gambar 2.14
Fungsi seluler MMP selama perkembangan dan fisiologis normal.
delapan kelas struktural MMP, 5 disekresikan dan 3 lainnya merupakan MMP tipe membran (MT-MMP) (Ansari et al., 2013).
Tabel 2.6
Jenis Matriks Metaloproteinase (Ansari et al., 2013)
Jenis MMP Kelas struktural Nama umum
MMP-1 Simple hemopexin domain Kolagenase-1, interstitial Kolagenase, fibroblast kolagenase, tissue kolagenase
MMP-2 Gelatin-binding Gelatinase A, 72-kDa gelatinase, 72-kDa typeIV
kolagenase, neutrophil gelatinase
MMP-3 Simple hemopexin domain Stromelysin-1, transin-1, proteoglikanase, protein pengaktivasi prokolagenase
MMP-7 Minimal domain Matrilysin, matrin, PUMP1, small uterine
metalloproteinase
MMP-8 Simple hemopexin domain Kolagenase-2, kolagenase neutrophil, kolagenase PMN, kolagenase granulosit
MMP-9 Gelatin-binding Gelatinase B, gelatinase kDa, kolagenase
92-kDa tipe IV
MMP-10 Simple hemopexin domain Stromelysin-2, transin-2 MMP-11 Furin-activated dan Stromelysin-3
MMP-12 Simple hemopexin domain Metalloelastase, elastase makrofag, metalloelastase makrofag
MMP-13 Simple hemopexin domain Kolagenase-3
MMP-14 Transmembrane MT1-MMP, MT-MMP1
MMP-15 Transmembrane MT2-MMP, MT-MMP2
MMP-16 Transmembrane MT3-MMP, MT-MMP3
MMP-17 GPI-linked MT4-MMP, MT-MMP4
MMP-18 Simple hemopexin domain Kolagenase-4 (Xenopus)
MMP-19 Simple hemopexin domain RASI-1, MMP-18
MMP-20 Simple hemopexin domain Enamelysin
MMP-21 Vitronectin-like insert Homolog dari Xenopus XMMP
MMP-22 Simple hemopexin domain CMMP (pada ayam)
MMP-23 Type II transmembrane Cysteine array MMP (CA-MMP), femalysin,
MIFR,MMP-21/MMP-22
MMP-24 Transmembrane MT5-MMP, MT-MMP5
MMP-25 GPI-linked MT6-MMP, MT-MMP6, leukolysin
MMP-26 Minimal domain Endometase, matrilysin-2
MMP-27 Simple hemopexin domain
MMP-28 Furin-activated and secreted Epilysin
Tanpa nama Simple hemopexin domain Mcol-A (pada tikus)
Tanpa nama Simple hemopexin domain Mcol-B (pada tikus)
Dalam proses keganasan, peranan MMP juga menyerupai yang terjadi dalam proses fisiologis namun terjadi ketidakseimbangan dengan aktivitas penghambatnya. Terjadi degradasi komponen ECM pada membran basalis dan jaringan ikat interstisial yang tersusun atas kolagen, glikoprotein dan proteoglikan. Suatu karsinoma pertama-tama harus menembus membran basalis dibawahnya, kemudian melintasi jaringan ikat, dan secara cepat mencapai sirkulasi dengan cara menembus membran basalis pembuluh darah. Proses ini berulang lagi jika emboli sel tumor mengalami ekstravasasi ke tempat jauh. Invasi melalui ECM mengawali kaskade metastasis dan merupakan proses aktif yang melibatkan beberapa tahap, diantaranya perubahan interaksi antara sel tumor dengan sel, degradasi ECM, perlekatan ke komponen terbaru ECM dan migrasi sel tumor (Kumar et al., 2010).
MMP terlibat dalam tahap kedua proses invasi yaitu degradasi lokal membran basalis dan jaringan ikat interstisial. Sekresi MMP tersebut dapat berasal langsung dari sel tumor atau dari induksi terhadap sel stroma (seperti fibroblast dan sel inflamasi). Protease lain yang juga disekresikan yaitu cathepsin D dan urokinase plasminogen activator. MMP mengatur invasi tumor tidak hanya dengan cara
2.11 Fungsi Matriks Metaloproteinase 9 (MMP-9/Gelatinase)
Diantara seluruh MMP, salah satu kelompok gelatinase yaitu MMP-9 (gelatinase B) mendapat perhatian pada beberapa penelitian dalam memahami sifat invasif dan metastatik tumor terkait kemampuannya dalam mendegradasi kolagen IV, komponen utama dari membran basalis epitel dan vaskuler. Hubungan antara komponen radang, stroma dan tumor mempengaruhi aktivasi dan produksi MMP-9/ gelatinase B. Gen MMP-9/ gelatinase B berlokasi pada kromosom 20q11.2-q13.1, terdiri dari 7.654 basa dan ditranskripsikan sebagai 2.4 kb mRNA tunggal (Bouchet et al., 2014; Marecko et al., 2014).
Protein MMP-9 merupakan enzim metallo-multidomain, dengan catalytic site tersusun atas domain pengikat logam yang dipisahkan dari active site oleh ulangan tiga fibronektin yang memfasilitasi degradasi substrat besar seperti elastin dan penghancuran kolagen. Dalam regio ini, asam amino Asp309, Asn319, Asp232, Tyr320 dan Arg3076 penting untuk pengikat gelatin. Catalytic site tetap dipertahankan dalam bentuk tidak aktif oleh amino-terminal pro-peptide PRCGXPD, dengan koordinasi cysteine bersama katalitik Zn2+. Ujung terminal COOH dari MMP-9 mengandung domain hemopexin yang mengatur ikatan dengan substrat, berinteraksi dengan inhibitor dan membantu ikatan ke permukaan sel. Domain O-glycosylated sentral memberikan fleksibilitas molekuler, mengatur spesifisitas
substrat makromolekuler dan melepaskan ikatan kolagen sebelum dipecahkan oleh enzim lainnya (Farina et al., 2014; Loffek et al., 2011).
Keterangan:
Gambar 2.15
Struktur MMP-9 (Gelatinase B) (Loffek et al., 2011)
MMP-9 dihasilkan oleh sel tubuh manusia, seperti sel fibroblast stroma, sel endotelial, sel polimorfonuklear (PMN), keratinosit, makrofag dan beberapa sel epitel. Aktivitas enzimatik MMP-9 dihambat oleh inhibitor protease sistemik α2 -makrogloblin, anggota famili TIMP dan antagonis terhadap domain hemopexinnya sendiri. MMP-9 mendapat perhatian khusus karena ekspresi basalnya rendah secara normal, sedangkan pada kondisi kanker MMP-9 terekspresi kuat akibat respon terhadap berbagai faktor pertumbuhan dan sitokin. Melalui penelitian eksperimental terhadap tikus dengan defisiensi MMP-9 menunjukkan kegagalan metastasis dan pertumbuhan tumor (Farina et al., 2014).
dapat menempati inti sel, meskipun memiliki sinyal lokalisasi inti klasik yang rendah dan aktivitas gelatinase inti menyatu dengan peningkatan fragmentasi DNA. Gelatinase inti ini mendegradasi matriks protein inti yaitu PARP (poly-ADP-ribose-polymerase), menghindarkannya dari proses perbaikan DNA (Farina et al., 2014).
Gambar 2.16
Peranan MMP-9 yang bebas TIMP yang berasal dari sel radang PMN sel tumor maupun stroma dalam inisiasi tumor dan promosi instabilitas genetik. Melalui degradasi matriks ekstraseluler (ECM), dan aktivitas kemokin, sitokin dan growth
factor (Farina et al., 2014).