KIMED
1.a). Apa beda antara SN1 dan SN2. Jelaskan
b). Tulislah mekanisme reaksi antara t-butil bromida dengan etanol. Sebutkan tahap
penentuan laju reaksinya !
2.sebutkan dan jelaskan contoh nukleofil dan leaving group yang kuat !
3.factor apa saja yang dapat digunakan untuk memperkirakan apakah suatu raksi berjalan dengan mekanisme SN1 atau SN2?
4. Efek struktur terhadap kecepatan reaksi SN2 alkilhalida CH3-Br (metilbromida : I); CH3-CH2-Br (etil bromida : II), dan CH3-CH-Br-CH3 (2-bromopropana : III). Urutan reaksi SN2 adalah : I >II > III.
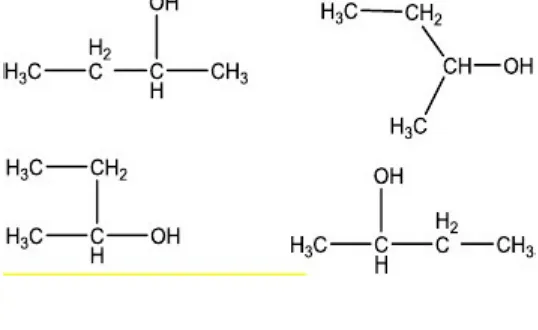
5. Urutkan reaktivitas senyawa-senyawa berikut ini menurut reaksi SN1
6. For the SN2 reaction.
CH3CH2CH2CH2Br + NaOH CH3CH2CH2CH2OH + NaBr Ethanol
answer the following questions:
A. What the rate expression for the reaction?
B. Draw an energy diagram for the reaction. Label all parts. You may assume that the products are lower in energy than the starting materials. C. What will be the effect on the rate of reaction if concentration of n-butyl
bromide is doubled?
D. What will be the effect on the rate of reaction if the concentration of sodium hydroxide is halved?
answer the following question
a. What the rate expression for the reaction?
b. Draw an energy diagram for the reaction. Label all parts. You may assume that the products are lower in energy than the starting materials.
c. What will be the effect on the rate of reaction if concentration of doubling the initial concentration of 1-bromo-1,1-diphenylethane? d. Will the rate of the SN1 reaction change significantly if some water is
added to the solvent ethanol?
Pak resmi
1. Rumus struktur gugus fungsi keton adalah...
a. R-OH c. R-CO-R’
b. R-COH d. R-COO-R’
2. Diantara senyawa berikut, yang tergolong keton adalah..
a. CH3-CH2-CO-H c. CH3-CH2-CO-OCH3
b. CH3-CH2-CO-CH3 d. CH3COOH
3. Nama IUPAC senyawa berikut adalah
a. 3-etil-5-etil-2-heksanon c. 3-etil-5-metil-5-heksanon
b. 3-metil-5-etil-5-heksanon d. 3-etil-5-metil-2-heksanon
4. Nama lazim dari senyawa CH3-CH2-CO-CH3 adalah...
a. etil metil keton c. dietil keton
b. metil etil keton d. dimetil keton
5.
Gugus fungsi dalam suatu senyawa karbon dapat menentukan …. A. jenis atom dalam molekulB. sifat-sifat senyawa
C. jumlah atom dalam molekul D. macam ikatan antaratom karbon E. struktur molekul
6. 5. Di antara senyawa berikut yang tergolong alkohol primer adalah …. A. n–pentil alkohol
B. neopentil alkohol C. isopentil alkohol D. isobutil alkohol E. isopropil alcohol
7. Senyawa dengan rumus molekul C5H12O termasuk kelompok senyawa ….
A. aldehid B. ester C. eter D. alkanon
E. asam karboksilat
(2) Rumus molekul C6H5OH
(3) Digunakan sebagai antiseptik
(4) Digunakan pengawet makanan dan minuman
Pernyataan yang sesuai dengan senyawa karbon tersebut adalah . . .
a. 1, 2, dan 3
b. 1 dan 3 c. 2 dan 4 d. 4 saja
9. Senyawa dengan rumus molekul C5H12O termasuk kelompok senyawa…..
a.Aldehida b.Ester
c.Eter
d.Alkanon
10.Sebutkan penamaan senyawa sikloalkana berikut
a. C3H6, (CH2)3 Siklo propane
b. C4H8, (CH2)4 Siklo butane
c. C5H10, (CH2)5 Siklo pentane
11.Gambarkan struktur dari senyawa berikut
a. 1,1,2-tribromo siklo butane
b. 1,1,2-trietil-3-metil siklo heksana
a. bisiklo [3.1.1] heptane
b. 1,2,4-trimetil sikloheksana
c. bisiklo[3.1.0]heptane
d. 1-ethy-3-isopropyl-2-methylcyclohexane
SETELAH UTS
1. Aturan Zaitsev menyatakan bahwa _____ paling mudah terbentuk b. Alkana tersubstitusi paling sedikit
c. Alkana tersubstitusi paling banyak d. Alkena tersubstitusi paling sedikit e. Alkena tersubstitusi paling banyak
2. Reaksi 2-pr0panol dengan asam bromida menghasilkan 2-bromopropana merupakan reaksi...
b. Substitusi c. Eliminasi d. Redoks e. Polomerasi
3. Tuliskan mekanisme reaksi eliminasi 1 pada t-butil bromida dengan nukleofil H2O!
4. Pada reaksi Eliminasi 1, sifat reaksi adalah: a. bekerja baik dalam pelarut non polar b. stereospesifik
c. regioselektif
d. basa kuat yang menyerang e. laju reaksi = K
5. Berdasarkan aturan saytseff , berikut ini yang mana produk yang lebih stabil dalam reaksi E2 dari 2 -bromobutana ?
a. 1-butena b. 2- butena
c. semua produk yang dihasilkan stabil d. tidak terjadi reaksi
6. Perhatikan pernyataan dibawah ini
1. Merupakan reaksi eliminasi bimolecular
2. Merupakan reaksi eliminasi unimolekular
3. Terdiri dari dua langkah yaitu ionisasi dan pembentukan ikatan rangkap
4. Terdiri dari dua langkah yaitu ionisasi dan deprotonasi
5. Menggunakan basa lemah
6. Menggunakan basa kuat
Yang merupakan ciri dari reaksi E1 adalah...
B. 1,4,5
C. 2,3,5
D. 2,4,5
E. 2,4,6
7. Reaksi dibawah ini menunjukan aplikasi dari aturan? a. Aturan zaitzen3
b. Aturan E1
c. Aturan disubstitusi d. Aturan monosubtitusi
8. Dibawah ini mMerupakan contoh reaksi dari..
A. SN 1 B. Sn 2 C. E 1 D. E 2
9. di bawah ini merupakan faktor-faktor yang mempengaruhi jalannya reaksi
eliminasi dari alkil halida, kecuali... a. struktur alkil halida
c. sifat zat terlarut d. sifat nukleofil
10. Reaksi eliminasi alkil halida menghasilkan ?
a. Alkil halida (dengan inversi)
b. Alkil alkohol
c. Alkena
d. Alkuna
11. Tuliskan rumus produk Hoffmann dari reaksi E2 senyawa tersebut
H H
│ │
(CH3)2 CCHCHCH3
│
Br
a. (CH3)2 CHCH= CHCH3 b. (CH3)2 C=CHCH2CH3 c. (CH3)3 CCH=CHCH3 d. (CH3)2 CHCH2CH=CH2 e. (CH3)3CCH2CH=CH2
12. Perhatikan pernyataan dibawah ini
1. Terdapat karbokation
3. Merupakan eliminasi unimolekular
4. Menggunakan mekanisme electron pushing
Yang merupakan reaksi E1 ialah...
A. 1,2,dan 3
B. 1 dan 3
C. 2 dan 4
D. 4 saja
E. Semua benar
13. Perhatikan reaksi di bawah ini ! CH₃CH₂CH₂Br+KOH CH3CH2OH
Produk utama dan reaksi yang terjadi pada mekanisme reaksi diatas adalah …..
a. CH₃-CH = CH₂ dan E1 c. CH₃-CH = CH₂ dan E2
b. CH₃-CH2-CH=CH₂ dan E2 d. CH₃CH₂CH₂OH dan SN1
e. CH3CH2OH dan SN2
14.Reaksi yang terjadi antara 1,3 dikloro propane dan natrium sianida dengan bantuan campuran pelarut polar adalah…
A. SN2 B. SN1 C. E2 D. E1
15. Faktor yang menentuaknprodukalkena yang terbentukdarireaksieliminasi, kecuali
a. Gugus lepas (X)
b. Keasaman Hβ
d. Faktorsterik (Crowded)
e. Pelarut
16. Perhatikan persamaan reaksi berikit I CH2+CH2+Br2 CH2 Br –CH2 Br
II CH3-CH2-CH2Cl + NaOH CH3-CH=CH2+ NaCl+H2O
Jenis reaksi yang terjadi pada persamaan reaksi I dan II berturut turut adalah
A. adisi dan subtitusi B. adisi dan eliminasi C. subtitusi dan adisi D. eliminasi dan adisi E. eliminasi dan subtitusi
17. Apabila suatu senyawa bereaksi dengan suatu etanol, maka yang terjadi adalah reaksi...
a. Adisi b. Eliminasi
c. Substitusi d. Kondensasi e. Oksidasi
18. Tentukan substrat yang dapat mengalami substitusi nukleofilik dengan mekanisme SN1 dan SN2 diantara substrat di bawah ini
I : Ar-CH2-X
II : CH2=CH-CH2-X
III : CH2=CH-CR2-X
IV : R-CH2-X
Jawaban yang benar adalah
a. I dan II
b. II dan III
c. II dan IV
19. Perhatikan persamaan reaksi berikut! I. CH2 = CH2 + Br2 → CH2 Br − CH2Br
II. CH3 − CH2 − CH2Cl + NaOH → CH3 − CH = CH2 + NaCl + H2O
Jenis reaksi yang terjadi pada persamaan reaksi I dan II berturut-turut adalah….
A. adisi dan substitusi B. adisi dan eliminasi C. substitusi dan eliminasi D. eliminasi dan adisi E. eliminasi dan substitusi
20. Senyawa 2-bromopropana dipanaskan dengan NaOH pekat akan menghasilkan senyawa golongan ….
A. Alkena
B. Alkanal
C. Aldehid
D. Alkanoat
E. Alkana
21.
Apa saja tahapan yang terdapat pada Eliminasi 1 ?
a. Eliminasi
b. Pematahan alkil halida dan Eliminasi
c. Ionisasi alkil ion halida dan Reaksi eliminasi
d. Pemasangan Karbokation dan Eliminasi
22. Pada reaksi eliminasi dapat dipengaruhi oleh beberapa
faktor,begitu juga untuk mempertinggi produk eliminasi.Apa saja yang bisa untuk meningkatkatkan hasil produk eliminasi?
A.CH3-CH2-CH2-CH2-OH CH3-CH2-CH = CH2
B. CH3-CH2-CH2-CH2-OH CH3 –CH2CH2-COOH
C. CH3-CH2-CH2-CH2-OH CH3-CH2-CH2-CH2CL
D.CH3-CH2-CH2-CHO CH3-CH2-CH2-CH2OH
E.CH3-CH2-CH2-CHO CH3-CH2-CH2-COOH
24. Berikut ini adalah contoh nukleofil netral, kecuali... a. Air
b. Alkohol c. Alkoksida d. Amonia e. Amina
25. Jelaskan mekanisme reaksi dibawah ini? termasuk E1 atau E2? dan alasan kenapa digunakannya reaksi E1 atau E2?
a. reaksi pembentukan propena dari alkil halogenida b. reaksi pembentukan etena dari etanol
c. reaksi 2-kloropropana dengan KOH
26. Ciri ciri reaksi eliminasi 2 adalah 1. stereokimia: tidak stereospesifik
2. stereokimia: eliminasi anti H dan X
3. laju relatif : RX Tersier > RX Sekunder
4. laju relatif : RX Tersier > RX Sekunder > RX Primer
27. Faktor-faktor berikut ini memengaruhi laju eliminasi E2, kecuali… a. Reaktivitas halogen
b. Pergantian pelarut c. Jenis RX
d. Konsentrasi R-X e. Konsentrasi basa
A.Cis-trans
B.Konfromer goyang C.Aksial-ekuatorial D.Enantiomer +/- E.Senyawa meso
29. Gambar struktur dibawah termasuk ke dalam jenis struktur apa?
A. Isomer geometri B. Isomer struktural C. Isomer fungsional D. Bukan termasuk isomer E. A, B, dan C benar
30. Pada reaksi eliminasi alkil halida (Reaksi E2) cenderung dominan menggunakan…
a. Basa lemah b. Basa kuat c. Asam kuat d. Asam lemah
CH3 – C – Br ... + H2O +
CH3
a. 2 bromo propena b. Metil propena c. Metil butena d. 2,2 dimetil etanol
32. Perhatikan persamaan reaksi berikut!
CH3 − CH2 − CH2Cl + NaOH → CH3 − CH = CH2 + NaCl + H2O
Jenis reaksi yang terjadi pada persamaan reaksi di atas adalah…. a. SN2
b. eliminasi c. SN1 d. Adisi e. sterokimia
33.
Pada gambar diatas merupakan reaksi E2. Atom yang akan diserang oleh basa adalah atom yang bernomor…
a.
1b.
2c.
3d.
4e.
534. Tuliskan mekanisme reaksi E2 dari CH3CH2C(CH3)2Cl!
35. Dibawah ini yang termasuk dalam terjadinya mekanisme reaksi eliminasi (E2) adalah …..
a. Pada konsentrasi basa rendah
b. Dengan solvolisis (pelarut adalah basa)
d. Dengan substrat tersier dan beresonansi (alkil halide) e. Berlangsung dalam dua tahap reaksi
36. Manakah yang bukan merupakan faktor yang mempengaruhi reaksi eliminasi?
a. sifat pelarut b. temperatur
c. struktur alkil halida d. sifat halogen
e. sifat nukleofil atau basa
37. Yang benar tentang mekanisme E2 adalah
a. Basa kuat menyerang Hidrogen pada Cβ dan berlangsung 2 tahap b. Basa kuat menyerang Hidrogen pada Cβ dan berlangsung 1 tahap c. Basa kuat menyerang Hidrogen pada Cα dan berlangsung 2 tahap d. Basa Kuat menyerang Hidrogen pada Cα dan berlangsung 1 tahap
38. Reaksi E1 ditunjukkan oleh contoh reaksi yang mana ? a.
b.
c.
e.
39. Temperatu
r pada reaksi eliminasi cenderung lebih...dibanding tempetur pada reaksi substitusi.
A. tinggi B. rendah C. konstan
D. berubah-ubah
40. Di bawah ini pernyataan yang salah mengenai reaksi E1 adalah a. Terjadi pada konsentrasi basa rendah dan pelarut basa
b. Reaksi :
c. Profil Energi:
41. Diketahui reaksi senyawa karbon: CH4(g) + Cl2(g) → CH3Cl(g) + HCl(g)
CH4(g) + CH2Br(g) → CH2 ─ CH2(g) + HBr(g)
Kedua reasi tersebut termasuk jenis reaksi ....
A. adisi dan substitusi B. adisi dan eliminasi C. substitusi dan adisi D. substitusi dan eliminasi E. eliminasi dan adisi
42. Yang merupakan reaksi Eliminasi 1 adalah … a. Alkil halida + basa kuat dan panas
b. Alkil halida + basa lemah dan panas c. Alkohol + asam kuat dan panas d. Alkohol + asam lemah dan panas e. Alkohol + basa lemah dan panas
43. Gambar di bawah ini merupakan contoh reaksi....
a. SN1 c. E1
b. SN2 d. E2
44. Klasifikasikanlah molekul atau ion berikut ini, apakah nukleofi atau elektrofil, dan berikan alasannya ?
b. Cl jawab : Nukleofil
c. Ag jawab : elektrofil
d. S2- jawab : Nukleofil
e. Al3+ jawan :elektrofil
45. Berikut adalah factor-faktor yang memengaruhi reaksi eliminasi, kecuali…
a. Suhu
b. Sifat pelarut c. Stuktur substrat
d. sifat asam yang digunakan e. konsentrasi nukleofil
46. CH3–CH3 –> CH2=CH2 + H2
Reaksi diatas termasuk ke dalam reaksi...
a. Substitusi b. Eliminasi c. Adisi d. Oksidasi e. Esterifikasi
47. Reaksi dibawah berlangsung secara setahap. Mekanisme reaksi yang ditunjukkan merupakan….
a. Mekanisme Reaksi SN1 b. Mekanisme Reaksi SN2 c. Mekanisme Reaksi E1
d. Mekanisme Reaksi E2
48.CH3 − CH2 − CH2Cl + NaOH → CH3 − CH = CH2 + NaCl + H2O
A. Substitusi B. Eliminasi C. Adisi
D. Halogenasi
49. Factors that can determine a compound be through E1 or E2 reactions are ...
i. The stability of the carbocation formed ii. The power base
iii. Structure RX iv. Activation energy
a. 1, 2 ,3 d. 4 only
b. 1 and 3 e. All the answers are correct c. 2 and 4
50. Perhatikan reaksi dibawah ini: I. CH3–CH2Br –> CH2=CH2 + HBr II. C3H8 + Cl2 –> C3H7Cl + HCl III. CH4 + Cl2 → CH3Cl + HCl IV.
Yang merupakan reaksi eliminasi adalah ....
a. I dan II b. I dan III c. II dan III d. I dan IV e. II dan IV
51. Perhatikan reaksi dibawah ini:
b. Keadaan transisi c. Orde reaksi
d. Kompleks teraktivasi e. Tahap penentu kecepatan
53. Aturan Hoffman berlaku dalam reaksi eliminasi... a. Unimolekuler
b. Bimolekuler c. Trimolekuler d. Atomik e. Diatomik
54. Yang termasuk ke dalam reaksi eliminasi adalah… a. CH3 – CH2 – CH3 → CH3 – CH2 – CH2Cl
b. CH2 – H2 – CH3 → CH3 – CH = CH2
c. CH4 + 2O2 → CO2 + 2H2O
d. CH4(g) + Cl2(g) → CH3Cl(g) + HCl(g)
55. Di bawah ini yang tidak termasuk faktor-faktor yang mengatur reaksi eliminasi dan substitusi adalah....
a. struktur alkil halida
b. sifat nukleofil atau basa
c. sifat zat terlarut
d. konsentrasi nukleofil atau basa
e. temperatur
56. Reaksi E2 alkil halida cenderung dominan akan bereaksi apabila dalam keadaan..
a. Temperature tinggi b. Temperature rendah c. Suhu kamar
d. Suhu 0oC
57. Manakah yang merupakan reaksi E1?
a. Pergantian posisi basa dan eliminasi gugus lepas berlangsung secara serentak
b. Tidak menghasilkan zat antara ionic
c. Pembentukan ikatan ganda terjadi melalui deprotonasi Bereaksi dengan basa kuat
58. Yang merupakan reaksi E2 ialah…
b. Tidak dapat membentuk ikatan dengan hidrogen c. Mekanisme reaksi melibatkan electron pushing
d. Alkil halide tersier bereaksi paling lama dan alkil primer paling cepat
59. Reaksi E2 berlangsung dalam ….. A. 1 tahap
B. 2 tahap C. 3 tahap D. 4 tahap
60. Jelaskan arti dari masing-masing tanda berikut:
a. melepaskan ikatan (memindahkan dua elektron)
b. Reaksi berjalan searah
c. reaksi berjalan dua arah
d. Reaksi berjlan karena ada katalis (kesetimbangan)
e. Reaksi berjalan karena adanya kesetimbangan
(resonansi antara dua molekul)
61. Jelaskan proses terbentuknya sp pada karbon.
62. Jelaskan apa itu ikatan vander walls. Berikan contohnya.
Ikatan yang terjadi pada senyawa yang memiliki dua kutub yang berbeda + dan -. Contoh : hcl
63. Apa yang kamu ketahui tentang stereoisomer. Berikanu contohnya. 64. Apa yang kamu ketahui tentang enantiomer. Berikan contohnya. 65. CH3 - CH2 - CH= NH
Hibridisasi atom C berturut-turut dari kanan ke kiri... A. sp2, sp3, sp3
66. Berapa jumlah ikatan Sigma dan Pi yang terdapat pada senyawa
67. pasangan unsur yang membentuk ikatan kovalen adalah..? a.17X dan 11Y
b.12P dan 17Q c.6R dan 17Q d.20M dan 16T
e.19A dan 35B
68. Jika XeF6 memiliki kulit terakhir di kulit ke 5. Maka, hibridisasi yang terbentuk dari molekul XeF6 adalah.... sp3d2
a. sp3d b. sp3d c. sp2 d. sp3d e. sp3
69. Senyawa yang tersusun dari dua buah unsur 6X dan 17Y, bila berikatan akan memiliki bentuk molekul dan kepolaran berturut-turut adalah...
a. Tetrahedral dan polar
b. Bentuk V dan polar c. Tetrahedral dan nonpolar d. Bentuk V dan nonpolar
e. Trigonal bipiramida dan polar
71. Perhatikan struktur Lewis senyawa berikut ini:
Pada senyawa tersebut, atom atom karbon yang
membentuk hibridsasi sp3 adalah:
A. C1, C2 , C3 , C4 B. C, C2 , C4 1
C. C1, C3 , C5 D. C3
E. C5
72. Senyawa NI3 mempunyai 3 pasangan elektron yang terikat dan1 pasangan elektron bebas. Bentuk geometri molekul tersebut adalah….
A.piramida segitiga D. segitiga datar
B.piramida bujur sangkar E. segi empat datar C.oktahedron
Jawaban : D Penyelesaian : 7N = 1s² 2s² 2p³
53I = 1s² 2s² 2p6 3s² 3p6 4s² 3d10 4p6 5s² 4d10 5p5
73. Struktur disamping merupakan nama dari senyawa? a. 8-bisiklo [3,2] heptana
b. 8-bisiklo [3,2,1] oktana c. 8-klorobisiklo [3,2] heptana d. 8-klorobisiklo [3,2,1] oktana
e. 5-klorobisiklo [3,2,1] oktana
Jawab : D
74. Unsur Y dan X memiliki konfigurasi electron
Y : 1s2 2s2 2p6 3s2 3p3
X : 1s2 2s2 2p6 3s2 3p5
Jika kedua unsur berikatan,bentuk molekul senyawa yang terbentuk… C
75. Apa nama senyawa tersebut menurut aturan tata nama senyawa alkana siklik ?
Jawaban yang di atas
a. 1-bromo-2-metil-3-etilsiklopentana b. 1-bromo-3-etil-2-metilsiklopentana c. 2-metil-1-bromo-3-etilsiklopentana d. 4-bromo-1-etil-5metilsiklopentana
76. -prisma trigonal -hibridisasi 5d5
Yang diatas adalah logam transisi dari jenis molekul... A. AX5
B. AX4 C. AX3 D. AX1 E. AX6
77. Perhatikan gambar dibawah ini
78. Pada molekul CH2, pada kulit terluar terdapat … electron dan terletak dalam orbital….
a. 2, pada 2s b. 2, pada 2px c. 2, pada 2py d. 1, pada 2s
Tipe hibridisasi dan sifat kepolaran berdasarkan bentuk molekul disamping berturut turut adalah…
a. piramida segitiga, non polar b. piramida segitiga, polar c. segitiga planar, non polar d. segitiga planar, polar
e. 1, pada 1s
Jawaban: A
Alasan: Atom karbon memiliki konfigurasi ground-state 1s2 2s2 2px1 2py1.pada kulit terluar terdapat dua elektron dalam orbital 2s, dan dua elektron tak perpasangan dalam orbital 2p.
Contohnya pada CH2.
79.
80. Untuk memperoleh susunan elektron yang stabil dapat dilakukan dengan cara: Suatu unsurdengan nomor atom 12 dapat membentuk ikatan ion dengan unsur bernomor atom ….
A. 3 B. 11 C. 17 D. 18 E. 20
81. Menurut teori VSEPR, molekul SF6 diketahui berbentuk Oktahedral. Manakah orbital hibrida dari SF6 ?
a. sp b. sp3 c. sp3d2 d. sp2 e. sp3d
82. Nama senyawa bisiklis disamping adalah...
83. Pembentukan molekul BeCl2 akan mengalami hibridisasi membentuk orbital ....
A. Hibridisasi sp3 B. Hibridisasi sp C. Hibridisasi sd4 D. Hibridisasi sp2 E. Hibridisasi sd5
84. Sebutkan set orbital hibrida yang terdapat pada atom karbon terminal dalam molekul berikut ini
A. s p B. s p2 C. s p3 D. s p3 d E. sp3d2
85. Molekul AB4 memiliki hibridisasi sp3d untuk atom A dan memiliki satu pasang elektron bebas. Bentuk molekul AB4 adalah
a. Segitiga piramida b. tetrahedral
c. segiempat planar
d. Bentuk jungkat-jungkit e. Bentuk T
B. Bujur sangkar C. Tetrahedron D. Oktahedron E. Piramida trigonal
Jawab : Konfigurasi elektron: 7N=(1S2 2S2 2P3)
xx
H xx N xx H
xx H
Terdapat 3 PEI dan 1 PEB (bentuk molekul piramida trigonal).
87. Jika unsur P dengan nomor atom 5 bersenyawa dengan unsur Q dengan nomor atom 17, maka bentuk molekulnya adalah ….
a.linier d. segi empat planar
b.segitiga planar e. tetrahedral c.piramida segitiga Jawaban : B
Penyelesaian :
Jumlah elektron valensi P = 3 Jumlah elektron valensi 3Q = 3 Jumlah elektron = 6
Jumlah pasangan elektron terikat = 3 Jumlah pasangan elektron tak terikat = 0 Bentuk molekulnya segitiga planar
88. Hibridisasi dan bentuk molekul dari PCl5 adalah: a. sp3 dan tetrahedral
b. sp3 dan segitiga piramida c. sp3 dan bentuk V
d. sp3d dan bipiramida trigonal e. sp3d dan segitiga piramida
89. Suatu senyawa dengan rumus molekul XY. Jika konfigurasi elektron atom X: 1s2 2s2 2p6 3s2 dan konfigurasi elektron atom Y: 1s2 2s2 2p4, maka XY mempunyai ikatan …
a. Kovalen polar
90. Berapa jumlah ikatan sigma (σ) dan pi (π) yang terdapat pada molekul etuna (C2H2)?
91. Asam Propanoat Dapat Dibuat dengan cara mengoksidasi…..
a. CH3COOH
b. CH3CH(OH)CH3
c. CH3CH2OH
d. CH3CH2CHO
e. CH2(OH)CH2CH2(OH)
92. Atom unsur 15Xberikatan dengan atom unsur 9Y membentuk senyawa kovalen XY3. Hibridisasi yang terjadi dalam molekul XY3 adalah...
a. sp d. dsp2 b. sp2 e. sp3d c. sp3
93. Yang merupakan prinsip Aufbau ialah:
a. Orbital dengan energi paling tinggi diisi pertama kali
c. Orbital dengan energi paling rendah diisi pertama kali
d. Hanya ada dua elektron yang dapat mengisi orbital yang sama, dan keduanya harus memiliki spin yang sama
e. Orbital dengan energi paling rendah diisi terakhir
94. Mana kah dari opsi di bawah yang merupakan bentuk dari molekul N2?
Jawaban: D. NN, Karena NN adalah ikatan kovalen rangkap 3, karena electron valensi N adalah 5, jadi ketika mereka
berikatan, akan membentuk ikatan kovalen rangkap 3.
95. Tentukan jenis hibridisasi dari H2O dan NH3. 96. Berapa jumlah ikatan Sigma dan Phi pada C2H4 ?
A. Sigma : 4, Phi : 1 B. Sigma : 5, Phi : 1 C. Sigma : 4, Phi : 2 D. Sigma : 5, Phi : 2 E. Sigma : 5, Phi : 0
97. Unsur-unsur golongan alkali tanah sifat-sifat kimianya hampir sama karena
a. jumlah elektronnya sama
b. jumlah elektron pada dua orbital terluarnya sama c. jumlah elektron pada kulit terluarnya sama
d. jumlah protonnya sama e. konfigurasi elektronnya sama Jawab : c.
a. potensial ionisasinya makin besar b. jari-jari atomnya makin besar c. afinitas elektronnya makin besar
d. nomor massanya makin besar e. muatan intinya makin besar
jawab : b
99. Model atom mekanika kuantum timbul berdasarkan pandangan dari beberapa ahli meliputi....
a. Rutherford, Neils Bohr, dan Broglie b. Pauli, Neils Bohr, dan de Broglie c. Rutherford, de Broglie, dan Hund
d. Schrodinger, de Broglie, dan Heisenberg e. Dalton, de Broglie, dan Heisenberg Jawab : d
100. Unsur X dengan konfigurasi elektron 1s2 2s2 2p6 2s1 mempunyai sifat …
a. mempunyai potensial ionisasi terbesar di antara unsur seperioda b. dapat membentuk oksida dengan rumus XO2
c. dapat membentuk hidroksida yang sukar larut dalam air
d. dapat membentuk senyawa halida dengan klor dengan rumus XCl e. mempunyai jari-jari terkecil di antara unsur seperioda
Jawab : d
101. Berikut merupakan senyawa dengan orbital hibdrida sp3, kecuali... a. CH4
b. KrF2 c. SiH4 d. BF4-e. NH4+
102. Berapa jumlah ikatan sigma dan ikatan pi yang terdapat pada molekul alkuna 4 metil, 2 pentuna?
a. 5 ikatan sigma dan 2 ikatan pi b. 6 ikatan sigma dan 1 ikatan pi c. 2 ikatan sigma dan 5 ikatan pi d. 4 ikatan sigma dan 3 ikatan pi e. 1 ikatan sigma dan 6 ikatan pi Jawaban : A
103. Dari pernyataan berikut ini yang merupakan prinsip Aufbau yang benar adalah...
a. Orbital dengan energi sederhana diisi pertama kali
b. Hanya ada dua elektron yang dapat mengisi orbital yang sama dan keduanya harus memiliki spin yang berlawanan
c. Orbital dengan energi tertinggi tidak diisi
d. Orbital dengan energi paling rendah diisi pertama kali e. Hanya boleh ada 2 elektron di setiap orbitalnya
104. manakah kombinasi orbital atom berikut ini yang akan memberikan orbital molekul ....
A. S dan Pz B. S dan Px C. Px dan Px D. Py dan Dyz
105. Mengapa jumlah elektron setiap kulit berbeda (jumlah elektron di kulit k berbeda dengan jumlah elektron maksimal di kulit l dan
seterusnya) ?
106. Jumlah ikatan sigma dan ikatan phi yang terdapat pada asampropionat adalah ……
c. 8 dan 1 d. 9 dan 1 e. 10 dan 1
107. Berapakah jumlah ikatan sigma dan ikatan pi pada C2H4O2 ? a. Ikatan sigma: 5, Ikatan pi: 0
b. Ikatan sigma: 4, Ikatan pi: 1 c. Ikatan sigma: 4, Ikatan pi: 0 d. Ikatan sigma: 3, Ikatan pi: 2 e. Ikatan sigma: 5, Ikatan pi: 1
108. Sebutkanbentukmolekuldanhibridisasiapakah XeF4? a. Segiempatdatardan sp3d2
b. Octahedral dan sp3d2 c. Tetrahedral dan sp3
d. Trigonalbipiramidadan sp3d e. Linear dansp
Pembahasan:
Strukturmolekul XeF4: ada 4 pasang electron ikatandan 2 pasang electron bebas, sehinggatipemolekulnyamenurut VSEPR adlaah AX4E2
Diagram orbital Xe
5s 5p 5d
Karenaada 4 atom F, maka 4 elektrondari orbital 5p dariXepindahke orbital 5d yang
Sehinggaterjadihibridisasi yang terdiridari 1 orbital s, 3 orbital p, 2 orbital d anterjadilahhibridisasi yang di sebut sp3d2.
Bentukmolekul: segiempatdatar.
109. Perhatikan struktur molekul di bawah ini! CH3-COO-CH2-CH2-CH3
Banyak ikatan sigma dan ikatan phi yang terdapat pada molekul propil metanoat adalah………
a. 12 ikatan sigma dan 6 ikatan phi
b. 13 ikatan sigma dan 5 ikatan phi
c. 14 ikatan sigma dan 6 ikatan phi
d. 16 ikatan sigma dan 2 ikatan phi
110. Konfigurasi atom karbon yang terhibridisasi Sp2 adalah
↑ ↑ _ a. ↑↓
↑ ↑ ↑ b. ↑
c. ↑↓ ↑ ↑
d. ↑ ↑ ↑ ↑
↑
e. ↑ ↑ ↑
111. unsur logam dibawah ini yang mengikut 2 elektron agar diperoleh konfigurasi
electron yang stabil adalah………
a. 11 Na d. 19K
b. 16S e. 20CA
c. 14SI
112. Hibridisasi sp3 menghasilkan orbital yang berbentuk...
a. tetrahedral b. linear
c. segitiga piramida d. segitiga bipiramida e. bentuk T
113. Tuliskan hibridisasi dan bentuk molekul dari ClF3! a. Sp3 – Tetrahedron
b. Sp - Segitiga samasisi c. Sp3d – Tetrahedron d. Sp3d2 – Oktahedron e. Sp2 – Linier
114. Bentuk konfigurasi elektron saat ingin berikatan dengan 4 atom H harus berubah menjadi ?
A.
C.
D.
E.
115. Orbital s dan 3 orbital p berkombinasi dan terhibridisasi membentuk 4 orbital atom yang ekuivalen dengan bentuk …. a.Segitiga planar
b.Linear c.Oktahedral d.Tetrahedral
e.Segitiga bipiramida
116. Suatu unsur X dengan nomor atom 27 mempunyai jumlah orbital …
117. Senyawa berikut ini yang memiliki orbital sp3 adalah... a.H2SO4 c.NaOH
b.SnCl4 d.NH3
118. Hibridisasi satu orbital s dan tiga orbital p, membentuk orbital hibrida sp3 yang strukturnya tetrahedral. Sudut ikatan dengan orbital ini mendekati …….
119. Orbital-s berbentuk bola. Hal ini disebabkan oleh …. a.bentuk kerapatan elektron di dalam atom
b.aturan dalam teori atom mekanika kuantum c.subkulit berharga nol
e.bilangan kuantum spin berharga ½
120. Beri nama IUPAC senyawa berikut !
A. 1-etil,3,4,5-trimetil sikloheksana B. 5-etil,1,2,3-trimetil sikloheksana C. 1-etil,3,4,5- trimetil siklopentana D. 5-etil,1,2,3-trimetil sikloheksena E. 1-etil,3,4,5-trimetil siklopentana
121. Pembentukan molekul BeCl2 akan mengalami hibridisasi membentuk orbital ....
122. ikatan kovalen terdapat pada pasangan senyawa……….. a. NaCI dan H2O d. NH3dan HCI
b. MgO dan CO2 e. K2S dan BACI2
c. MgS dan CI2
123. Unsur X bernomor atom 8, maka harga keempat bilangan kuantum elektron terakhir unsur tersebut adalah …
a. n = 2; l = 0; m = 0; s = – ½ d. n = 2; l = 1; m = -1; s = + 1/2
b. n = 2; l = 1; m = 1; s = +1/2 e. n = 2; l = 1; m = -1; s = – 1/2
c. n = 2; l = 1; m = 0; s = – ½
jawaban : e
b. kovalen tungal e. antarlogam
c. kovalen rangkap.
125. Aldehid dan keton memiliki gugus fungsi yang sama, yaitu... A. gugus hidroksil
B. gugus karbinol C. karboksilat D. gugus karbonil
E.gugus amina
Jawaban: d
126. Berapa jumlah ikatan sigma dan ikatan pi yang terdapat pada molekul alkuna 4 metil, 2
pentuna?
a. 5 ikatan sigma dan 2 ikatan pi
b. 6 ikatan sigma dan 1 ikatan pi
c. 2 ikatan sigma dan 5 ikatan pi
d. 4 ikatan sigma dan 3 ikatan pi
e. 1 ikatan sigma dan 6 ikatan pi
Jawaban : A
127. Konfigurasi electron X2- dari suatu ion unsur 2652X adalah? Dan letaknya di table
Jawab :
Ion unsure X konfigurasinya adalah 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Karena X2- maka 26 +2 = 28 jadi susunan konfigurasi elektronnya
1s2 2s2 2p6 3s2 3p6 4s2 3d8
Letak unsur X adalah n= 4, berarti perioda 4 (kulit N)
Karena belakangnya 3d6 4s2 maka X Golongan VIII B
128. Carilah dan jelaskan tentang gambar orbital F !
Yang paling kompleks dari orbital adalah orbital f. Ketika l = 3, nilai ml dapat -3, -2, -1, 0, +1, +2, +3 dengan total tujuh bentuk orbital yang berbeda. Sekali lagi, perhatikan orientasi khusus dari orbital f yang berbeda.
Jelaskan perbedaan antara orbital 1s dan 2s !
Jawab : Orbital yang dihuni oleh elektron hidrogen disebut dengan
orbital 1s. Angka “1” menunjukkan bahwa orbital tersebut memiliki tingkat energi yang terdekat dengan nukleus. Huruf “s” menunjukkan bentuk dari orbital tersebut. Orbital s berbentuk bulat simetris yang mengelilingi nukleus. Sedangkan, orbital 2s bentuknya sama dengan orbital 1s kecuali ruang wilayahnya yang lebih jauh dari nukleus – di mana letaknya pada tingkat energi kedua. Orbital 2s juga tempatnya sangat dekat dengan nukleus, maka efek dari ini adalah pengurangan energi dari elektron dalam orbital s.
Tuliskan dan tunjukkan jumlah ikatan sigma dan phi pada gambar berikut!
Jawab : Ikatan Sigma : 8 Ikatan Phi : 1
130. unsur P dan Q masing-masing mempunyai nomor atom 14 dan 17, keduanya berikatan membentuk senyawa…
a. ion pQ4 d. ion P4Q
b. kovalen P4Q e. kovalen PQ