PENGERTIAN SENYAWA KOMPLEKS DAN ION KOMPLEKS
Senyawa kompleks adalah suatu suatu senyawa yang mengandung ion kompleks dan ion lawan (counter ion). Ion kompleks adalah ion yang tersusun dari ion pusat (atom pusat) yang dikelilingi oleh molekul atau ion yang disebut ligan. Antara ion pusat dengan ligan terjadiikatan koordinasi. Jumlah ikaan koordinasi yang terjadi antara atompusat dengan ligan disebut bilangan koordinasi. ditempati oleh pasangan elektron dari suatu ligan. Unsur-unsur transisi dapat menjadi atom pusat suatu ion kompleks karena mempunyai orbital kosong di subkulit 3d atau 4p.
Ligan dari suatu ion kompleks dapat berupa molekul netral atau anion yang mempunyai pasangan elektron bebas yang digunakan untuk membentuk ikatan koordinasi dengan atom pusat.
Unsur-unsur transisi umumnya mempunyai konfigurasi elektron dengan subkulit d yang belum penuh. Dengan demikian dapat memberikan orbital kosong untuk membentuk ikatan koordinasi dengan pasangan elektron dari ligan yang diikatnya.
1. TATA NAMA SENYAWA KOMPLEKS
Penamaan senyawa kompleks menurut IUPAC mengikuti aturan sebagai berikut:
a. Nama kation (ion positif) disebut lebih dahulu, baru kemudian diikuti dengan nama anion (ion negatif) sperti pada penamaan senyawa ion.
b. Pada ion kompleks, urutan penyebutannya adalah: jumlah ligan – nama ligan – nama atom pusat (bilangan oksidasi atom pusat)
c. Jumlah ligan disebut dengan nama latin.
1: mono 4: tetra
3: tri 6: heksa
d. Nama ligan ditambah dengan akhiran –o dengan cara:
1. Ligan-ligan yang berakhiran –ida diganti dengan –o.
2. Ligan-ligan yang berakhiran –it atau –at diganti dengan –ito dan –ato.
3. Ligan netral diberi nama sesuai nama molekulnya (dalam bahasa latin)
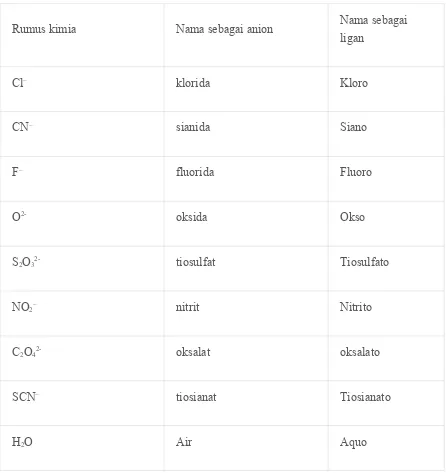
Tabel beberapa nama ligan
Rumus kimia Nama sebagai anion Nama sebagai
ligan
Cl– klorida Kloro
CN– sianida Siano
F– fluorida Fluoro
O2- oksida Okso
S2O32- tiosulfat Tiosulfato
NO2– nitrit Nitrito
C2O42- oksalat oksalato
SCN– tiosianat Tiosianato
NH3 amonia Amin
e. Jika ligannya lebih dari satu macam, urutan penyebutannya dimulai sesuai dengan urutan abjad nama depan dari ligan tersebut.
f. Nama atom atau ion pusat:
1. Jika ion kompleksnya bermuatan negatif, nama atom pusat diberi akhiran –at. 2. Jika ion kompleksnya tidak bermuatan atau bermuatan positif, tidak ditambah
akhiran.
g. Bilangan oksidasi atompusat ditulis dengan angka Romawi dalam kurung setelah nama atom pusat.
Contoh senyawa kompleks:
[Co(H2O)6]3+ : ion heksaaquokobalt (III)
[Cr(NH3)5Cl]2+ : ion pentaminoklorokrom (III)
[Fe(CN)6]4- : ion heksasianoferat (II)
[Ag(NH3)2]+ : ion diaminperak(I)
[Ag(S2O3)2]3- : ion ditiosulfatoargentat (I)
Na3[Cr(NO2)6] : natrium heksanitroferat (II)
2. STRUKTUR ION KOMPLEKS
Ion kompleks terbentuk karena adanya ikatan koordinasi antara atom pusat dengan ligan. Atom pusat menyediakan orbital kosong yang akan ditempati oleh pasangan elektron dari ligan. Menurut teori Warner, ikatan terbentuk melalui pembentukan orbital gabungan dari atom pusat. Orbital gabungan ini sering disebut dengan ortbital bastar atau hibridisasi.
3. IONISASI SENYAWA KOMPLEKS
Apabila senyawa kompleks mengalami ionisasi dalam air, maka akan dihasilkan ion kompleks dan ion sederhana, atau ion kompleks kedua-duanya.
K4[Fe(CN)6](aq) → 4K+(aq) + [Fe(CN)6]4-(aq)
Dari beberapa kemungkinan tersebut, untuk memastikan struktur yang sesuai dengan keadaan sebenarnyaa, dapat dilakukan pelarutan senyawa tersebut ke dalam air dan mereaksikannya dengan larutan AgNO3. Berdasarkan perbandingan mol secara
stoikiometris, jika kemungkinan strukturnya adalah [Cr(H2O)6]Cl3, setiap satu mol
senyawa ini akan menghasilkan 3 mol endapan AgCl, sesuai dengan reaksi berikut.
[Cr(H2O)6]Cl3(aq) → [Cr(H2O)6]3+(aq) + 3Cl–(aq)
1 mol 3 mol
Ag+(aq) + 3Cl–(aq) → AgCl(s)
3 mol 3 mol
Jika strukturnya sebagai [Cr(H2O)6Cl2]Cl.2H2O, setiap 1 mol senyawa ini akan
menghasilkan 1 mol endapan AgCl, sesuai reaksi berikut:
[Cr(H2O)6Cl2]Cl.2H2O(aq) → [Cr(H2O)6Cl2]+(aq) + Cl–(aq) + 2H2O(l)
1mol 1 mol
Ag+(aq) + Cl–(aq) → AgCl(s)
Berbicara mengenai unsur-unsur golongan transisi sangatlah mengasyikkan. Terutama unsur transisi yang dikelompokkan sebagai blok–d di dalam sistem periodik unsur mempunyai banyak sekali keistimewaan apabila ditelaah dari konfigurasi elektronnya. Berdasarkan konfigurasi elektron ini bisa dipelajari juga sifat fisisnya, antara lain tren dalam panjang diameter atomnya, standar entalpi maupun potensial reduksi, sifat magnetnya, dan penampakannya yang berwarna-warni.
Pertama-tama, mari kita pelajari mengapa unsur-unsur transisi ini menunjukkan warna warni yang sangat menarik. Unsur transisi blok-d memiliki orbital 3d yang masih kosong atau yang baru yang diisi sebagian oleh elektron, sehingga memungkinkan transisi elektron dari satu orbital ke orbital lainnya. Inilah yang menyebabkan mereka berwarna-warni. Pada gambar larutan ion beberapa unsur transisi di atas, kita bisa lihat warna ungu kemerahan, hijau, biru, dan bening. Mari kita coba uraikan pengisian orbital untuk dan yang warnanya kontras satu sama lain.
Sementara itu, konfigurasi elektron untuk Zn2+ adalah:
Di sini kita bisa lihat orbital d pada Co+2 masih belum penuh, sedangkan pada Zn2+ sudah terisi penuh. Perbedaan pengisian orbital ini menghasilkan warna yang berbeda. Transisi elektron akan menyerap panjang gelombang komplementer dari warna yang bersesuaian.
Selanjutnya, apa untungnya orbital-orbital kosong maupun orbital yang belum penuh elektronnya tersebut? Adanya tempat untuk elektron itu berpotensi bagi logam-logam transisi untuk berikatan dengan senyawa yang disebut ligan (ligand). Dalam hal ini, ligan bersifat sebagai basa Lewis (Lewis base), yang berperan sebagai donor elektron, yaitu karena ligan mempunyai pasangan elektron bebas untuk disumbangkan, sedangkan logam transisi menyediakan orbital kosong yang berperan sebagai asam Lewis. Ikatan seperti inilah yang dinamakan ikatan kovalen koordinasi. Sebagai contohnya adalah kompleks , dengan Ag berperan sebagai logam pusat (Lewis acid) sedangkan NH3 dengan N yang mempunyai sepasang elektron bebas berperan sebagai basa lewis. Sementara itu, SO2
4- berperan untuk mengompensasi muatan total dalam senyawa kompleks tersebut.
Reaksi pembentukan kompleks adalah sebagai berikut:
diformulasikan sp. Beberapa geometri lainnya misalnya seperti sp3 (untuk
tetrahedral), (oktahedral), serta (segi empat planar).
Apa sebenarnya manfaat pengetahuan dasar geometri seperti ini dipelajari? Coba perhatikan struktur molekul tiga dimensi (3D) dari MOF-5 (Metal Organic Frameworks) berikut ini.
Cluster digambarkan di sebelah kiri dalam bentuk model ball and
stick (Zn, biru; O, hijau; C, abu). Gambar tengah sebenarnya sama, yaitu , tetapi digambarkan dalam bentuk tetrahedron (berupa warna hijau). Dan di sebelah kanan juga sama, hanya saja tetrahedral digambarkan dalam warna biru.