TUGAS KIMIA
ANORGANIK
Logam transisi dan senyawa koordinasi
Oleh :
Nama
: Andre Prayoga
NIM
: 2103011412003
Kelas
: A
JURUSAN TEKNIK KIMIA
FAKULTAS TEKNIK
UNIVERSITAS DIPONEGORO
CHAPTER 23 UNSUR-UNSUR TRANSISI DAN
SENYAWAKOORDINASINYA
A.
Unsur unsur transisi
SIFAT DARI UNSUR TRANSISI
Unsur-unsur transisi berbeda dalam perilaku fisik dan kimia dari unsur-unsur golongan utama. Dalam beberapa hal,mereka memiliki kemiripan: unsur golongan utama dalam setiap perubahan periode dari logam dan nonlogam, tapi semua elemen transisi adalah logam. Perbedaan lainnya adalah, unsur-unsur transisi yang lebih beragam: sebagian besar senyawa ion golongan utama tidak berwarna dan diamagnetik, tetapi banyak senyawa logam transisiberwarna dan paramagnetik. Kita bahas dulu konfigurasi elektron dari atom dan ion, dan kemudian memeriksa sifat kunci tertentu dari unsur transisi, dengan perbandingan unsur-unsur golongan utama.
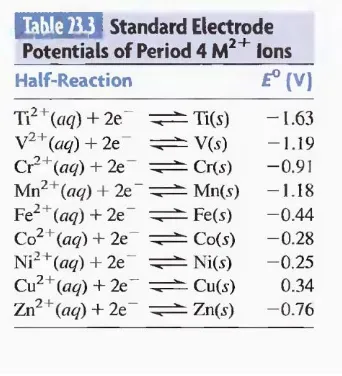
Elektron Konfigurasi dari Logam Transisi dan Ionnya
kromium dan tembaga adalah dua pengecualian umum untuk ini. Pola: 4s dan 3d orbital di Cr keduanya setengah penuh untuk memberikan [Ar] 4s 1 3d 5, dan 4s di Cu setengah penuh untuk memberikan [Ar] 4s 1 3d 10. Alasan pengecualian ini disertai perubahan energi relatif 4s dan orbital 3d seperti elektron ditambahkan di seri dan stabilitas yang tidak biasa, sublevel setengah penuh dan penuh.
Ion logam transisi terbentuk melalui hilangnya ns elektron sebelum (n - l) d elektron. Oleh karena itu, konfigurasi elektron Ti2⁺ + adalah [Ar] 3d 2, bukan[Ar] 4s 2. Ion logam yang berbeda tetapi dengan konfigurasi yang sama sering memiliki sifat yang mirip. Sebagai contoh, kedua Mn 2 + dan Fe3 + yang d 5 ion; keduanya memiliki warna pucat dalam larutan berair dan. Sebagian akan kita bahas kemudian, yaitu bentuk ion kompleks dengan sifat magnetik yang sama.
Tabel 23.1 menunjukkan pola umum dalam jumlah elektron yang tidak berpasangan (atau setengah- orbital diisi) seluruh Periode 4 seri transisi. Perhatikan bahwa jumlah meningkat pada semester pertama dari seri dan, ketika pasangan mulai, menurun melalui sekond - yang setengah. Seperti yang Anda lihat, itu adalah konfigurasi elektron dari atom logam transisi yang berkorelasi dengan sifat fisik dari elemen, seperti kepadatan dan Magma perilaku netic, sedangkan itu adalah konfigurasi elektron dari ion yang menentukan sifat-sifat senyawa.
Atom dan Sifat Fisik Unsur Transisi
•Ukuran atom
•Elektronegativitas
Umumnya meningkat di Periode tapi sekali lagi unsur-unsur transisi menunjukkan perubahan yang relatif kecil dalam keelektronegatifan, seperti halnya perubahan yang relatif kecil dalam ukuran. Sebaliknya, golongan utama menunjukkan stabil, kenaikan lebih curam antara logam kalium (0,8) dan bromin yang nonlogam (2,8). Unsur-unsur transisi semua memiliki nilai elektronegativitas intermediate.
•Energi ionisasi
Periode 4 unsur utama golongan meningkat tajam dari kiri ke kanan, tiga kali lipat dari kalium (419 kJ / mol) ke kripton (1351 kJ / mol).
Kesamaan Sifat dalam Grup Vertikal untuk elemen transisi juga berbeda dari golongan utama.
•Ukuran atom. Seperti yang diketahui, ukuran meningkat atom dari Periode 4 sampai 5, seperti halnya untuk elemen golongan utama. Tapi hampir tidak ada Periode dari periode 5 sampai 6.
•Energi ionisasi. Terjadi peningkatan yang relative kecil dan ini berlawanan dengan apa yang terjadi di golongan utama.
•Kepadatan. Ukuran atom dan volume. berbanding terbalik dengan kepadatan. Di periode yang bersebelahan , kepadatan meningkat, kemudian berhenti, dan akhirnya mencelupkan sedikit di akhir periode (Gambar 23.40). Golongan transisi dalam, kepadatan meningkat drastis karena volume atom berubah sedikit dari Periode 5 sampai 6, tapi massa atom meningkat secara signifikan.
Sifat Kimia dari Logam Transisi
Tingkat Oksidasi
Perilaku logam dan Kekuatan Mereduksi
Ukuran atom dan tingkat oksidasi memiliki pengaruh besar pada sifat ikatan senyawa logam transisi. Seperti logam di Grup 3A (l3), 4A (14), dan 5A (l5), unsur-unsur transisi mereka memiliki tingkat oksidasi yang lebih rendah namun menunjukkan sifat kimia yang lebih dari logam. Artinya, ion bonding lebih umum untuk keadaan oksidasi yang lebih rendah, dan ikatan kovalen lebih lazim untuk tingkat oksiasi yang lebih tinggi. Sebagai
contoh, pada suhu kamar, TiCl₂ adalah ionik padat, sedangkan TiCl₄ adalah cairan molekul.
menurun di setiap periode. Semua Periode 4 logam transisi, kecuali tembaga, cukup aktif untuk mengurangi H + dari berair untuk membentuk gas hidrogen
Warna dan Magnet Senyawa
senyawa golongan utama ion yang kurang warna karena ion logam memiliki kulit terluar yang penuh (gas mulia configuration electron). Dengan orbital energi hanya jauh lebih tinggi untuk menerima elektron, ion tidak menyerap cahaya tampak. Sebaliknya, elektron dalam sebagian diisi d sublevel dapat menyerap panjang gelombang terlihat dan pindah ke sedikit lebih tinggi energi orbital d. Sebagai hasilnya,banyak senyawa logam transisi memiliki warna mencolok. Pengecualian adalah senyawa dari skandium, titanium (IV), dan seng, yang tidak berwarna karena ion logam mereka memiliki baik kosong d sublevel (Sc H atau Ti4 +: [Ar] 3DO) atau satu diisi (Zn2 +: Lar] 3d IO) (Gambar 23.6),
Sifat magnetik juga terkait dengan ini. Ingat bahwa zat paramagnetik memiliki atom atau ion dengan elektron yang tidak berpasangan, yang menyebabkan ia akan tertarik ke medan magnet luar.
Perilaku kimia dalam Kelompok
Semua unsur transisi adalah logam. Atom-atom dari unsur-unsur blok d memiliki (n - 1) d orbital yang diisi, dan ion mereka memiliki ns orbital kosong. Berbeda dengan keadaan di unsur golongan utama, ukuran atom, elektronegativitas, dan perubahan energi ionisasi pertama relatif menurun di serangkaian transisi, Karena kontraksi lantanida, Ukuran atom perubahan sedikit dari Periode 5 sampai 6 dalam golongan logam transisi; dengan demikian, electronegativity, energi ionisasi pertama, dan kepadatan meningkat ke golongan. Logam transisi turun tajam memiliki beberapa tingkat oksidasi, dengan +2 tingkat yang paling umum. unsur-unsur menunjukkan perilaku logam lainnya di tingkat yang lebih rendah. Kebanyakan logam transisi Periode 4 cukup aktif untuk mengurangi ion hidrogen dari larutan asam. Banyak senyawa logam transisi yang berwarna dan paramagnetik karena ion logam memiliki berpasangan d electron
UNSUR TRANSISI DALAM
Lantanida
Lantanida kadang-kadang disebut unsur-unsur tanah yang jarang ditemukan, yang mengacu pada keterkandungan mereka di berbagai oksida . Tetapi mereka sebenarnya tidak langka sama sekali.
Senyawa lantanida dan campuran mereka memiliki banyak kegunaan. beberapa oksida digunakan untuk kacamata hitam dan kacamata Tinting tukang las dan untuk menambahkan warna pada lapisan serbuk fluorescent pada layar TV.
Aktinida
Semua aktinida bersifat radioaktif. Seperti lantanida. mereka sangat mirip dari berbagi hal, misalnya secara fisik dan kimia sifat. Torium dan uranium terdapat di alam, tetapi unsur transuranium, sangat sulit untuk didapatkan. Aktinida dan lantanida memiliki konfigurasi elektron terluar yang sama. Meskipun keadaan oksidasi + 3 merupakan karakteristik dari aktinida, sedangkan lantanida tidak, sedangkan di tingkat oksidasi lain juga terjadi. Sebagai contoh, uranium dari + 3 sampai +6. dengan tingkat oksidasi +6 yang paling umum.
Ada dua seri unsur transisi batin. Lantanida (seri 4f) memiliki umum oksidasi +3 dan pameran sifat yang sangat mirip. aktinida
(5f series) bersifat radioaktif. Semua aktinida memiliki oksidasi +3; beberapa, termasuk uranium, memiliki negara yang lebih tinggi juga.
BEBERAPA HIGHLIGHT LOGAM TRANSISI
Chromium
Kromium merubakan logam yang sangat mengkilap, logam keperakan, yang namanya (dari bahasa Yunani, "warna") mengacu pada banyak senyawa yang memiliki warna. Kromium biasanya digunakan pada pabrik stainless steal.
Mangan
Mangan bersifat keras dan mengkilap seperti vanadium dan kromium, digunakan sebagian besar untuk membuat paduan baja. Sejumlah kecil Mn «1%) membuat baja lebih mudah untuk roll, menempa, dan las. Sejumlah kecil mangan ditambahkan ke kaleng minuman aluminium dan paduan perunggu untuk membuat mereka kaku dan lebih tangguh juga.
Perak
Perak, anggota kedua dari logam mata uang, telah dikagumi selama ribuan tahun dan masih berharga untuk digunakan dalam perhiasan dan juga sendok atau garpu. Karena bagaimanapun juga logam murni terlalu lunak untuk tujuan ini.
Raksa
Mercury telah dikenal sejak zaman dahulu karena cinnabar (prinsipbijih pal), yang merupakan pigmen merah alami (vermilion).
Chromium dan mangan menambahkan ketahanan korosi dan kekerasan terhadap baja. mereka adalah logamkhas transisi dalam memiliki beberapa negara oksidasi. Elektron valensi mengacu pada kemampuan suatu unsur di berbagai negara oksidasi untuk menarik elektron ikatan. Ini meningkat dengan bilangan oksidasi, yang merupakan unsur-unsur alasan bertindak lebih logam (senyawa yang lebih ionik, oksida lebih mendasar) di tingkatyang lebih rendah dan lebih non-logam (oksida lebih asam, oxoanions asam) di tingkat yang lebih tinggi. Cr dan Mn menghasilkan H 2 dalam asam. Cr (VI) mengalami pH-sensitif dehidrasi-kondensasi reaksi. Kedua Cr (VI) dan Mn (V11) adalah oksidator kuat dalam asam daripada dalam basis. Satu-satunya negara oksidasi penting bagi perak + 1. halida perak peka cahaya tive dan digunakan dalam fotografi. Mercury, satu-satunya logam yang cair pada ruang template perature, melarutkan banyak logam lain dalam aplikasi penting. Merkuri (l) ion diatomik dan memiliki kovalen ikatan logam-logam. Unsur dan senyawanya adalah beracun dan menjadi terkonsentrasi karena mereka bergerak ke atas rantai makanan
.
B.
SENYAWA KOORDINASI
Senyawa kompleks atau senyawa koordinasi merupakan senyawa yang terbentuk akibat adanya ikatan kovalen koordinasi antar atom-atomnya. Ikatan in terjadi karena pemakaian pasangan electron bersama yang berasal dari salah satu atomnya.
Senyawa kompleks harus memiliki ion kompleks yaitu ion yang terdiri dari atom pusat bermuatan positif dan anion yang mengelilinginya (ligan). Ion ini juga memerlukan counter ion agar dapat bermuatan netral. Senyawa koordinasi ini dapat bersifat elektrolit jika berada di dalam air. Ion kompleks dan counters ion terpisah antara satu sama lainnya, tetapi ion kompleks bersifat seperti ion polyatomic (beratom banyak).
Ion Kompleks: Bilangan Koordinasi, Geometrid an Ligan
Ion kompleks adalah bagian dari senyawa kompleks yang terdiri dari ion pusat (kation) serta ligan yang mengelilinginya. Strukturnya tersusun dari bilangan koordinasi, geometri dan banyaknya atom donor dari setiap ligannya.
Bilangan koordinasi : yaitu banyaknya ligan dalam suatu ion kompleks yang berikatan langsung dengan ion pusat. Bilangan koordinasi ion CO3+ dalam [Co(NH3)6]3+ adalah 6 karena ad 6 ligan (NH3) tarikat dengan ion pusat.
Geometri : bentuk ion kompleks bergantung pada bilangan koordinasi dan sifat dasar dari ion logam. Penulisannya memiliki kesamaan dengan teori VSEPR.
Atom donor setiap ligan : ligan dari ion kompleks adalah molekul atau anion dengan satu atau lebih atom donor yang masing-masing memberikan pasangan elektron pada ion pusat untuk berikatan kovalen. Berasal dari golongan 5A(15), 6A(16), atau 7A(17).
Ligan diklasifikasikan berdasarkan jumlah atom donor yang digunakan untuk mengikat atom pusat.
RUMUS DAN NAMA SENYAWA KOORDINASI
Ada tiga aturan penting dalam penulisan rumus senyawa koordinasi : 1. Anion ditulis sebelum kation
2. Muatan kation harus seimbang dengan muatan anion
3. Dalam ion kompleks, ligan anionik ditulis setelah ligan netral, dan rumus ion tersebut diletakkan didalam tanda kurung
Penerapan aturan tersebut untuk menentukan muatan ion-ion pada senyawa koordinasi. Contoh K2[Co(NH3)2Cl4], dua K+ bermuatan 2+ sama dengan muatan anion kompleks [Co(NH3)2Cl4]2- yaitu 2-, terdiri dari dua molekul NH3 dan empat ion Cl- sebagai ligan. Dua NH3 netral, empat Cl- bermuatan 4- dan ion kom pleks bermuatan 2-, sehingga muatan Co2+ (ion pusat) adalah :
Muatan ion kompleks = muatan ion pusat + muatan ligan total 2- = muatan ion pusat + { (2x0) + (4x1-) }
Jadi, muatan ion logam = (2-) – (4-) = 2+
Penamaan senyawa koordinasi
1. Nama kation sebelum anion. Contohnya: Contoh [Co(NH3)2Cl2]Cl , kation [Co(NH3)2Cl2]+ dan anion Cl- sehingga namanya tetraaminadiklorokobalt(II)klorida.
3. Ligan netral memiliki nama molekul misal NH3 bernama amina. Ligan anion berakhiran –
ida diubah menjadi berakhiran –o. Nama flourida untuk F- menjadi nama ligan flouro.
4. Nama imbuhan angka pada ligan menunjukkan jumlah ligan itu sendiri. Contoh tetraamin menunjukkan empat NH3 dan dikloro menunjukkan dua Cl-. Imbuhan lain seperti tri, penta, dan heksa. Imbuhan ini tidak berpengaruh pada urutan abjad. Beberapa ligan yang sudah memiliki imbuhan angka didalamnya (seperti etilenediamin) digunakan bis(2), tris(3), atau tetrakis(4) untuk menunjukkan jumlah ligan tersebut. Jadi, ion kompleks yang memiliki dua buah ligan etilenediamin diberi nama bis(etilendiamin).
5. Tingkat oksidasi dari beberapa ion pusat yang mempunyai lebih dari satu tingkat ditulis dengan angka romawi (I), (II), (III) atau (IV). Misalnya [Co(H2O)6]3+ heksaaquokobalt(II) dan [Cu(NH3)4]3+ tetraamintembaga(II).
6. Jika ion kompleks adalah anion maka akhiran nama ion pusat adalah nama latin ditambah –at, contoh K[Pt(NH3)Cl5] yang diberi nama Kalium amina pentakloro platinat(IV).
Sejarah Perspektif: Alfred Werner dan Teori Koordinasi
Senyawa koordinasi sudah dikenal hampir 200 tahun. Ditemukan oleh Alfred
Beberapa hasil percobaan cobalt dari senyawa koordinasi oleh Warner.
Ion logam pusat yang dikelilingi oleh jumlah total konstan molekul/anion yang terikat kovalen. Kompleks koordinasi dapat netral dan bermuatan, jika bermuatan dikombinasikan dengan muatan counter ion yang berlawanan. Dalam kasus ini adalah Cl- membentuk senyawa netral. Werner mengemukakan dua jenis valensi untuk ion logam yaitu valensi primer dan valensi sekunder. Valensi primer sekarang disebut oxidation state adalah
muatan positif ion logam yang sama dengan muatan negatif. Valensi sekunder biasa disebut bilangan koordinasi adalah jumlah kesatuan total dari anion atau ligan netral dalam ion kompleks. Data Werner menunjukkan bahwa jumlah total ligan pada masing-masing senyawa adalah sama, walaupun jumlah ion Cl- dan molekul NH3 pada ion kompleks berbeda.
Isomer Dalam Senyawa Koordinasi
Isomer adalah senyawa yang memiliki rumus kimia sama tapi struktur dan sifatnya berbeda.
1. Isomer Konstitusional
Yaitu senyawa dengan rumus sama tapi terikat pada atom yang berbeda. Biasa juga disebut dengan isomer struktur. Isomer ini dibagi menjadi 2 jenis, yaitu:
•Isomer koordinasi, terjadi jika komposisi ion kompleksnya berubah, tetapi senyawanya tetap.
•Isomer Linkage, terjadi jika komposisi ion kompleksnya sama tetapi ikatan ligan atom donornya berubah.
2. Isomer Stereoisometri
Yaitu senyawa yang memiliki ikatan atom yang sama tetapi tempat penyusunannya berbeda. Terbagi menjadi 2, yaitu:
•Isomer Optik, biasa disebut enansiomer adalah isomer yang didasarkan kepada arah rotasi terhadap sumbu polarisasi.
Senyawa koordinasi terdiri dari ion kompleks dan counter ion dimana ion kompleks terdiri
dari ion pusat (kation) yang dikelilingi oleh ligan netral atau anion, yang memiliki satu atau lebih atom donor yang masing-masing menyediakan pasangan elektron bebas. Kebanyakan
bentuk senyawa koordinasi adalah oktahedral (ikatan atom dengan enam ligan). Rumus dan penamaan senyawa koordinasi mengikuti aturan yang sistematik. Werner menetapkan
struktur dasar senyawa koordinasi. Senyawa koordinasi memiliki isomer konstitusional (koordinasi dan linkage) dan stereoisomer (isomer geometri dan optik).
TEORI DASAR IKATAN DAN SIFAT KOMPLEKS
Penerapan Teori Ikatan Valensi pada ion kompleks
Teori ikatan valensi digunakan untuk membantu mengetahui ikatan dan struktur golongan utama suatu senyawa. Teori ini juga digunakan untuk menjelaskan ikatan pada ion kompleks. Ligan menyumbangkan pasangan elektron dan ion logam menerimanya untuk membentuk suatu ikatan kovalen menjadi ion kompleks.
Kompleks Oktahedral
Sebagai contoh adalah ion heksaaminakromiun(III), Cr3+ memiliki 6 orbital kosong yang energinya lebih rendah yaitu dua 3d, satu 4s dan tiga 4p membentuk d2sp3. Enam molekul NH3 menyumbangkan sepasang dari nitrogennya untuk membentuk enam ikatan logam-ligan.
Kompleks Segi Empat Planar
Ion logam dengan konfigurasi d8 biasanya membentuk square planar complexes. Contohnya ion [Ni(CN)4]2- . Model ini mengusulkan satu orbtal 3d, satu orbital 4s dan dua orbital 4p dari Ni2+ membentuk empat orbital dsp2.
Berdasarkan gambar tesebut ion Ni2+ memiliki dua orbital 3d yang berisi masing-masing satu elektron, kemudian bergabung, empat pasang ion CN- mengisi satu orbital 3d, satu orbital 4s dan dua orbital 4p membentuk dsp2.
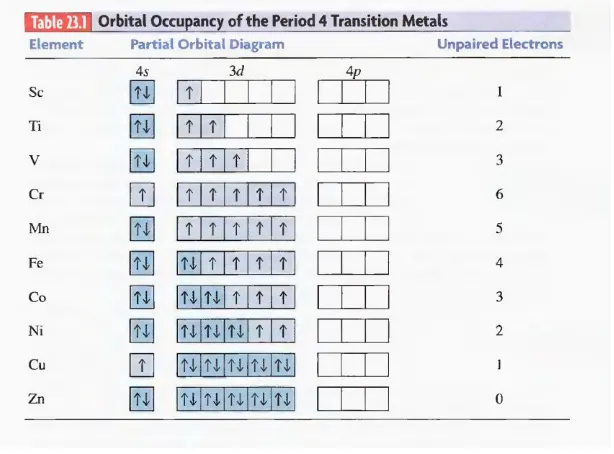
Kompleks Tetrahedral
Teori Bidang Kristal
Teori ni menjelaskan sedikit pengertian ikatan metal-ligan, warna dan sifat magnetik kompleks. Dia juga menyoroti energi orbital d ion pusat oleh ligan yang mengikatnya.
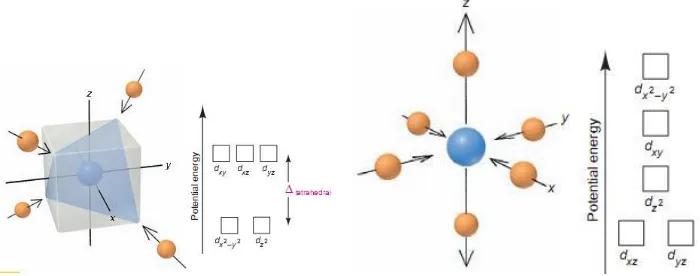
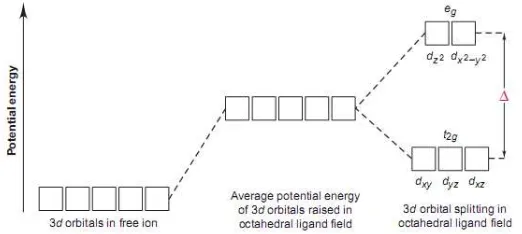
Pemisahan Orbital d pada Ligan Oktahedral
Teori ini menjelaskan mengenai sifat kompleks hasil dari pemisahan energi orbital d. Pemisahan ini didasarkan pada interaksi elektrostatis antara ion logam dengan ligan. Model ini mengasumsikan bahwa ion kompleks terbentuk dari hasil tarikan elektrostatis antara logam positif dengan ion negatif dari ligan
.
Enam buah ligan yang bergerak menuju atom logan untuk membentuk geometri oktahedral. Ligan menghampiri atom pusat untuk meminimalisir energi pada sistem
Pemisahan energi pada orbital d seperti yang terlihat pada gambar diatas disebut efek bidang kristal. Perbedaan energi antara 2 orbital d dengan 3 orbital d lainnya disebut energi pemisah kristal. Ligan terbagi menjadi ligan kuat yaitu ligan yang memiliki energi pemisah besar serta ligan lemah yaitu ligan yang memiliki energi pemisah yang kecil.
Penjelasan Warna pada Logam Transisi
Beberapa warna dari senyawa koordinasi berasal dari perbedaan energi pada orbital dalam ion kompleks. Elektron berpindah dari energi yang rendah ke energi tinggi ketika ion menyerap warna. Perbedaan energi pada orbital sebanding dengan energi penyerapan foton.
Gambar tersebut memperlihatkan pada gelas A larutan [V(H2O)6]2+ berwarna ungu berbeda dengan larutan yang memiliki ligan yang sama namun ion logamnya berbeda seperti [V(H2O)6]3+ yang berwarna kuning. Hal serupa juga terlihat pada gambar B, senyawa [Cr(NH3)6]3+ yang berwarna kuning memiliki perbedaan warna
dengan[Cr(NH3)6]2+ yang berwana ungu.
Dari keterangan tersebut dapat disimpulkan bahwa warna pada logam transisi dipengaruhi oleh jenis ligan.
Penjelasan Sifat Magnetik Logam Transisi Kompleks
Pemisahan tingkat energi berpengaruh terhadap sifat logam mengakibatkan
sejumlah elektron pada orbital d ion logam tidak berpasangan. Sesuai aturan Hud, elektron menempati satu orbital selama dalam tingkatan yang sama.
Cara orbital mempengaruhi ligan ada 2, yaitu: •Weak-field ligans and hight-spin complexes.
•Strong-field ligans and low-spin complexes. Ligan CN- pada Mn2+ memiliki delta besar sehingga energi untuk berpindah besar dan energi untuk berpasangan lebih kecil dari energi pemisahan
Tempat Pemisahan Kristal dalam Tetrahedral
Empat ligan mengelilingi ion logam juga menyebabkan orbital d berpisah, tapi besar dan pola pemisahan bergantung pada apakah ligan tersusun tetrahedral atau segi empat planar.
Gambar pemisahan orbital d oleh bidang ligan tetrahedral dan gambar pemisahan orbital d oleh bidang ligan segi empat planar
Teori ikatan valensi menggambarkan ikatan dalam ion kompleks yang timbul dari ikatan kovalen koordinasi antara basa lewis (ligan) dan asam lewis (ion logam). Sepasang ligan bebas menempati orbital ion logam untuk membentuk ion kompleks dengan bentuk yang khas.
Teori bidang kristal menjelaskan secara jelas mengenai warna dan sifat magnetik suatu senyawa. Sebagai akibat dari mengelilingi bidang ligan, energi orbital d membagi ion logam. Sifat magnetik dari pembagian bidang kristal membelah energi bergantung pada tuntutan ion logam dan kekuatan bidang kristal ligan. Hasilnya mempengaruhi energi foton untuk menyerap warna dan jumlah elektron yang tidak berpasangan.
![Gambar tersebut memperlihatkan pada gelas A larutan [V(H2O)6]2+ berwarna ungu](https://thumb-ap.123doks.com/thumbv2/123dok/4014368.1957788/18.595.238.392.241.420/gambar-memperlihatkan-gelas-a-larutan-v-berwarna-ungu.webp)