PENUNTUN PRAKTIKUM
KIMIA DASAR I
Disusun oleh:
Indah Langitasari, S.Si., M.Pd.
JURUSAN PENDIDIKAN KIMIA
FAKULTAS KEGURUAN DAN ILMU PENDIDIKAN
UNIVERSITAS SULTAN AGENG TIRTAYASA
SERANG
i LEMBAR PENGESAHAN
PENUNTUN PRAKTIKUM KIMIA DASAR I
Disusun Oleh:
Indah Langitasari, S.Si., M.Pd.
Setelah menelaah penuntun praktikum ini dengan seksama, menurut pertimbangan kami telah memenuhi persyaratan ilmiah sebagai sebuah
penuntun praktikum
Mengetahui,
Ketua Jurusan Pendidikan Kimia Kepala Laboratorium Kimia
Najmi Firdaus, M. Si. Robby Zidny, S. Pd., M. Si.
NIP. 198003112005011002 NIP. 198908152015041002
Dekan FKIP
ii
TATA TERTIB PRAKTIKUM
A. Instruksi Bekerja di Laboratorium
1. Praktikan wajib hadir 10 menit sebelum praktikum dimulai dengan mengumpulkan laporan dan jurnal parktikum. Keterlambatan lebih dari 15 menit akan dikenakan sanksi.
2. Jas laboratorium dipakai diluar ruangan
3. Tas diletakkan di tempat yang telah disediakan dan amankan barang berharga anda. 4. Praktikan ajib membaca dan memahami prosedur kerja sebelum melakukan percobaan 5. Praktikan wajib mengikuti instruksi dosen/asisten praktikum.
6. Praktikan melakukan kegiatan praktikum dalam kelompok dan membuat laporan secara individu
7. Mencatat semua hasil percobaan di jurnal dan membuat laporan sementara (laporan pendahuluan) untuk dimintakan ACC pembimbing
8. Sanksi akan diberikan pada praktikan yang melanggar tata tertib praktikum B. Peralatan Laboratorium
1. Setiap kelompok mahasiswa akan mendapatkan satu set peralatan untuk setiap percobaan. Tidak diperkenankan meminjam peralatan dalam kelompok lain. 2. Alat-alat tertentu diluar set alat percobaan adalah untuk pemakaian bersama dan
dipergunakan secara bertanggung jawab.
3. Peralatan yang rusak atau pecah harus segera dilaporkan pada dosen/asisten untuk mendapatkan gantinya. Mahasiswa yang merusakkan atau memecahkan alat wajib mengganti sesuai spesifikasinya.
4. Menjaga kebersihan meja, alat dan ruangan laboratorium selama dan sesudah praktikum. Kebersihan adalah salah satu komponen dalam penilaian kinerja.
C. Bahan-bahan Kimia
1. Botol reagen atau bahan kimia harus memiliki identitas (label) yang menunjukkan isi, spesifikasi dan tanda bahanyanya. Baca terlebih dahulu informasi bahaya bahan kimia yang akan digunakan. Dilarang menggunakan bahan kimia yang tidak berlabel. 2. Dilarag memindahkan botol reagen dari tempatnya tanpa seizin dosen atau asisten. 3. Gunakan bahan kimia secukupnya (sesuai kebutuhan). Reagen atau bahan kimia yang
telah diambil dari tempatnya tidak boleh dikembalikan ke wadah semula.
4. Limbah bahan kimia baik padat maupun cairan harus dibuang ke dalam temaot yang telah disediakan sesuai dengan labelnya.
D. Keselamatan Kerja
1. Praktikan wajib menggunakan alat pelindung diri seperti jas laboratorium, sepatu, kaca mata pelindung dan makser selama berada di dalam laboratorium.
2. Mengetahui letak kotak P3K, tabung pemadam kebakaran, pintu darurat diarea laboratorium.
iii
bahan kimia jatuh mengenai pakaian, lepaskan pakaian dan segera bersihkan kulian dibawahnya dengan air yang mengalir.
4. Hindari tubuh dari paparan uap bahan kimia yang berbahaya. Jika inggin membaui hasil reaksi kimia, kipaslan dengan tangan ke arah hidung. Jangan membaui reaksi secara langsung.
5. Tidak menggosok-gosok mata atau bagian tubuh lainnya dengan tangan yang terkontaminasi bahan kimia.
6. Ketika memanaskan tabung reaksi, panaskan dengan perlahan-lahan dan jangan arahkan mulut tabung ke diri praktikan atau praktikan lain.
7. Gunakan lemari asam jika bekerja dengan bahan kimia konsentrasi pekat dan bahan berbahaya.
8. Asam pekat diencerkan dengan cara menuangkan asam pekat ke dalam air dan tidak sebaliknya.
9. Tidak menyalakan api secara sembarangan di area yang ada pelarut organik. Matikan api pada bunsen yang sudah tidak digunakan.
10. Dilarang memipet bahan kimia dengan menggunakan mulut. Gunakan filler atau bola hisap.
11. Dilarang mencicipi bahan kimia serta makan dan minum di area laboratorium. E. Format Penuliasan Laporan Praktikum
Laporan praktikum disusun dengan format berikut: Halaman Sampul
Judul Praktikum A. Tujuan Praktikum B. Prinsip Percobaan C. Reaksi Kimia D. Kajian teori E. Alat dan bahan F. Prosedur kerja
G. Data Pengamatan dan Perhitungan H. Pembahasan
I. Kesimpulan J. Daftar pustaka
K. Lampiran (jawaban tugas dan laporan sementara) F. Penilaian
Sistem penilaian diatur untuk menjaga keobyektifitas hasil kerja praktikan berdasarkan kriteria berikut.
1. Praktikan diwajibkan mengikuti kegiatan praktikum dengan kehadiran 100%. 2. Nilai akhir praktikum dikumpulkan dari komponen nilai: Nilai kinerja laboratorium
(15%), jurnal dan kuis (15%), nilai presentasi (10%), nilai laporan (30%), dan nilai ujian akhir praktikum (30%).
iv
MATERI PRAKTIKUM KIMIA DASAR I
1. Pengenalan Alat dan Bahan
2. Pemisahan dan Pemurnian Zat secara Fisik
3. Struktur Lewis dan Model Molekul
4. Preparasi Larutan
5. Hukum Kekalan Massa
6. Stoikiometri
7. Pereaksi Pembatas
8. Volume Molar Gas Hidrogen
9. Reaksi Eksoterm dan Endoterm
1 PERCOBAAN I
PENGENALAN ALAT DAN BAHAN
TUJUAN
Setelah melakukan percobaan ini mahasiswa diharapkan dapat:
1. mengenal dan menyebutkan alat-alat yang digunakan di laboratorium kimia beserta fungsinya
2. mengenal dan menyebutkan spesifikasi bahan-bahan yang umum digunakan pada praktikum kimia dasar
PENDAHULUAN
Laboratorium kimia merupakan bagian penting dalam pengajaran kimia.
Laboratorium kimia berfungsi selain sebagai pembelajaran juga penelitian kimia. Di dalam laboraotirum kimia, pengalaman nyata tentang kerja kimia dapat diperoleh melalui
kegiatan paraktikum. Langkah awal sebelum bekerja di laboratorium kimia adalah harus mengenal alat-alat dan bahan-bahan kimia. Berbagai alat terdapat dilaboratroium kimia dengan spesifikasi dan fungsi yang berbeda-beda. Setiap alat kimia memiliki ukuran teretntu fungsi dan spesikfikasi yang harus dipahami oleh parktikan. Setiap alat didesain sedemikian rupa sehingga mempunyai bentuk ukuran tertentu sesuai dengan fungsi alat tersebut. Secara garis besar alat yang digunakan di Laboratorium dapat dikategorikan ke dalam Alat gelas dengan ukuran tertentu, Alat gelas dengan ukuran skala, Alat dari porselen, alat dari plasitik, Instrumen, Alat penunjang seperti klep, statif, penjepit. Semua alat yang akan digunakan dan yang telah selesai digunakan harus disimpan kembali dalam keadaan bersih. Artinya alat-alat tersebut harus bebas dari zat lain. Apabila tidak segera dibersihkan akan melekat dan sulit dihilangkan. Praktikan juga harus mengetahu cara menggunakan masing-masing alat dengan baik untuk menghindari alat pecah atau rusak.
Bekerja di laboratorium kimia juga harus mengenal berbagai bahan kimia terutama sifat-sifatnya demi menjaga keselamatan kerja. Ditijau dari sifatnya, bahan kimia
dikelompokkan menjadi bahan yang mudah meledak, bahan yang mudah terbakar, bahan beracu, bahan kausatif dan bahan yang bersifat oksidator kuat. Penggunaan bahan-bahan kimia selama kerja dilaboratorium haru memperahtikan sifatnya agar tidak terjadi hal-hal yang tidak diinginkan. Penyimpanan bahan kimia juga harus diperhatikan sifat-sifatnya. Jangan menyimpan bahan kimia yang mudah meledak bersama dengan bahan-bahan kimia yang bersifat oksidator kuat. Mengenal alat dan bahan dengan baik sangat diperlukan demi keselamatan kerja di laboratorium.
PERCOBAAN Prosedur Kerja
1. Amati dan dokumentasikan alat-alat laboratorium yang diberikan oleh asisten 2. Catatlah fungsi masing-masing alat-alat laboratorium.
2 Tabel Pengamatan
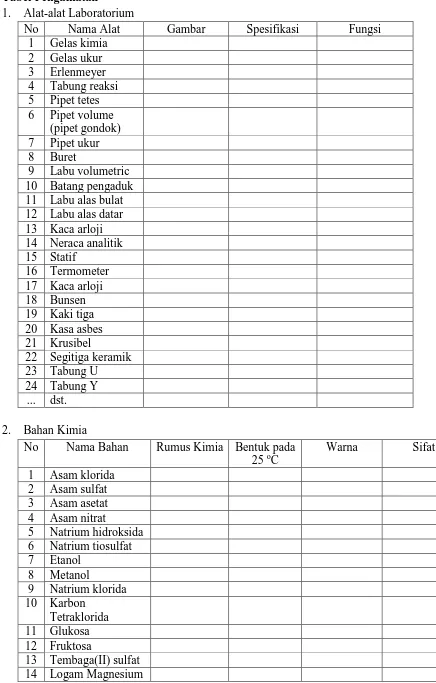
1. Alat-alat Laboratorium
No Nama Alat Gambar Spesifikasi Fungsi
1 Gelas kimia
9 Labu volumetric 10 Batang pengaduk 11 Labu alas bulat 12 Labu alas datar 13 Kaca arloji 14 Neraca analitik 15 Statif
16 Termometer 17 Kaca arloji 18 Bunsen 19 Kaki tiga 20 Kasa asbes 21 Krusibel
22 Segitiga keramik 23 Tabung U 6 Natrium tiosulfat 7 Etanol
8 Metanol
9 Natrium klorida 10 Karbon
Tetraklorida 11 Glukosa 12 Fruktosa
3 15 Logam tembaga
16 Logam seng 17 Kalium iodide 18 Timbal(II) nitrat 19 Hidrogen peroksida 20 Benzena
21 Fenol 22 Aseton
23 Kalium perming 24 Kalium kromat 25 Kalium dikromat 26 Asam oksalat 27 Amonium
hidroksida 28 Natrium asetat 29 Kalium kromat 30 Perak nitrat
... dst. TUGAS
1. Dua jenis larutan akan dibuat dalam sebuah percobaan di laboratorium yaitu HCl 1M dan NaOH 1M. Sebutkan alat-alat laboratorim yang diperlukan untuk membuat kedua larutan tersebut.
2. Kelompokkan bahan-bahan kimia yang anda amati berdasarkan sifatnya a. Explosif
4 PERCOBAAN II
PEMISAHAN DAN PEMURNIAN ZAT SECARA FISIK
TUJUAN
Setelah melakukan percobaan ini mahasiswa diharapkan dapat: 1. menjelaskan cara-cara pemisahan dan pemurnian zat dari campurannya 2. melakukan pemisahan dan pemurnian zat dari campurannya
PENDAHULUAN
Pemisahan dan pemurnian zat-zat secara fisik dapat dilakukan dengan berbagai metode tergantung pada sifat fisik campuran zat-zat yang akan dipisahkan. Metode-metode pemisahana dan pemurnian secara fisik antara lain dekantasi, filtrasi, ekstrassi koagulasi, adsorpsi, destilasi dan sublimasi. Dekantasi merupakan proses pemisahan campuran berdasarkan perbedaan ukuran, dapat digunakan untuk memisahkan padatan dari cairan. Padatan dibiarkan turun di dasar wadah, selanjunya cairan dituangkan dengan hati-hati ke wadah lain. Filtrasi merupakan proses pemisahan padatan dari cairan dengan menggunakan bahan berpori yang hanya dapat dilalui oleh cairan. Ekstraksi merupakan proses pemisahan campuran berdasarkan perbedaan kelarutan salah satu komponene dalam pelarut tertentu. Destilasi adalah proses pemisahan dan pemurnian cairan dalam campuran berdasarkan perbedaan titik didih zat-zat yang bercampur. Proses destilasi diawali dengan mendidihkan campuran pada suhu salah satu komponen campuran, mendinginkan uap yang terbentuk dan mengumpulkan cairan yang diperoleh dari pendingian uap. Sublimasi merupakan proses pemurnian suatu zat padat didasarkan pada sifat zat yang dapat
langsung menguap tanpa melebur terlebih dahulu ketika dipanaskan pada tekanan atmosfer.
PERCOBAAN Alat –Alat
1. Set alat destilasi 2. Erlenmeyer 3. Gelas kimia 4. Corong pisah 5. Kertas saring 6. Batang pengaduk 7. Pemanas bunsen 8. Gelas arloji 9. Corong 10. Ring
Bahan – Bahan
1. Campuran pasir dan air 2. Campuran gula dan etanol 3. Iod dalam air
4. CCl4
5. Campuran NaCl-Iod 6. Pewarna makanan 7. Aquades
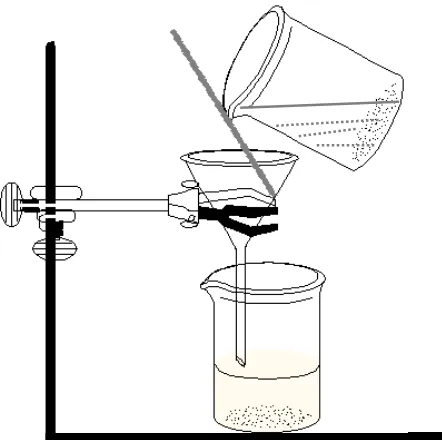
Prosedur Kerja Dekantasi
5 3. Siapkan gelas kimia lain sebagai penampung (II), kemudian tuangkan cairan melalui
batang pengaduk dengan hati-hati sehingga semua padatan tertinggal di beaker I. (lihat gambar berikut).
Filtrasi
1. Ambilah selembar kertas saring, kemudian lipatlah seperti gambar berikut.
2. Pasang kertas saring pada corong. Basahi kertas saring melalui ujung pipet dengan pelarut yang digunakan kemudian tekan dengan batang pengaduk.
3. Ambil 25 mL campuran gula dan etanol yang telah dikocok dengan baik
4. Tuangkan campuran tersebut pada kertas saring dengan bantuan batang pengaduk seperti gambar berikut.
Gambar 2.1 Dekantasi
6 Ekstraksi
1. Ambilah 10 mL larutan iod-air dan catat warnanya, kemudian masukkan ke dalam corong pisah 50 mL
2. Ambilah 10 mL CCl4 dan catat warnanya, kemudian masukkan ke dalam corong pisah yang sudah berisi larutan iod-air.*
3. Tutuplah corong dan kocok dengan baik. Pengocokkan akan menyebabkan larutan menjadi sedikit hangat dan menyebabkan tekanan dalam corong naik, karena tekanan uap itu naik. Kurangi tekanan dengan cara membuka kran corong pisah.
4. Tutup kran kembali dan pasanglah corong pada ring di statif.
5. Diamkan campuran sampai cairan-cairan yang bercampur memisah menjadi dua lapisan.
6. Catat warna masing-masing lapisan larutan.
7. Buka tutup corong, kemudian bukalah kran untuk megalirkan lapisan bawah ke dalam gelas kimia
8. Hentikan langkah 7 sebelum lapisan atas ikut mengalir ke luar. * Hindari menghirup uap larutan CCl4 karena sangat beracun Destilasi
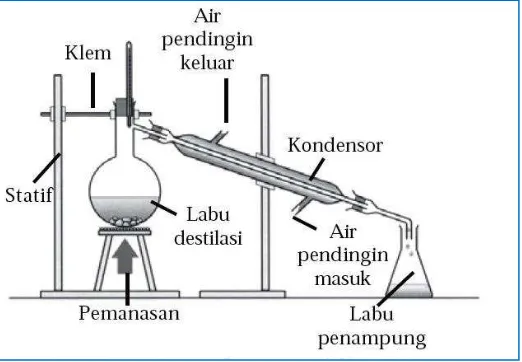
1. Rangkailah alat destilasi seperti gambar berikut.
2. Buatlah sampel larutan berwarna dengan menambahkan beberapa tetes pewarna makanan ke dalam 50 ml air.
3. Masukan larutan sampel ke dalam labu destilasi dengan menggunakan corong.* 4. Masukkan 2-3 buah batu didih, kemudian pasang termometer pada mulut labu
destilasi.
5. Alirkan air dari kran ke pendingin, kemudian panaskan labu destilasi. Atur besanya pemanas sesuai dengan suhu titik didih salahsatu komponen dalam larutan.
6. Tampung cairan yang keluar (destilat) dari pendingin ke dalam labu penampung (erlenmeyer).
7 7. Hentikan pemanasan bila cairan dalam labu tinggal sedikit.
* Volume larutan dalam labu destilasi hendaknya tidak lebih dari separuh volume labu, agar pada ssat mendidih tidak ada cairan yang memercik ke pendingin
Sublimasi
1. Ambilah 1 sendok kecil campuran NaCl-Iod dan masukkan ke dalam gelas kimia 100 mL.*
2. Tutup gelas kimia dengan kaca arloji, kemudian letakkan es di atas gelas arloji 3. Panskan gelas kimia perlahan-lahan pada hotplate atau dengan menggunakan api. Iod
akan menguap dari dasar gelas kimia dan memadat sebagai kristal pada bagian bawah gelas arloji yang dingin
4. Setelah proses sublimasi selesai, ambilah gelas arloji tersebut, kemudian kumpulkan kristal iod murni ke dalam gelas arloji menggunakan spatula. Catat perbedaan penampakan iod sebelum dan sesudah sublimasi.
* Jangan menyentuh iod dengan jari atau menghirup uapnya karena uap iod bersifat korosif dan beracun
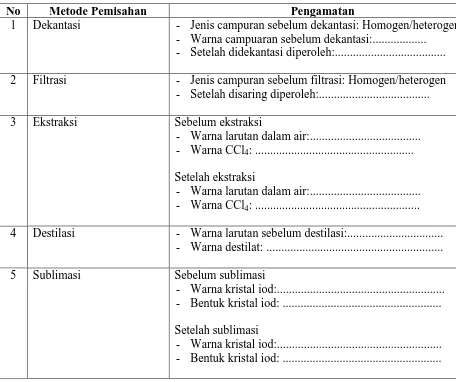
Tabel Pengamatan
No Metode Pemisahan Pengamatan
1 Dekantasi - Jenis campuran sebelum dekantasi: Homogen/heterogen - Warna campuaran sebelum dekantasi:...
- Setelah didekantasi diperoleh:... 2 Filtrasi - Jenis campuran sebelum filtrasi: Homogen/heterogen
- Setelah disaring diperoleh:...
3 Ekstraksi Sebelum ekstraksi
- Warna larutan dalam air:... - Warna CCl4: ... Setelah ekstraksi
- Warna larutan dalam air:... - Warna CCl4: ... 4 Destilasi - Warna larutan sebelum destilasi:...
- Warna destilat: ...
5 Sublimasi Sebelum sublimasi
- Warna kristal iod:... - Bentuk kristal iod: ... Setelah sublimasi
8 TUGAS
1. Bagainakah cara menghilangkan sisa cairan pada pasir basah yang tertinggal setelah proses dekantasi?
2. Pada filtrasi, filtrat gula-etanol merupakan campuran homogen atau heterogen? Jelaskan!
3. Bagaimana cara memperoleh etanol murni dari filtar gula-etanol tersebut?
9 PERCOBAAN III
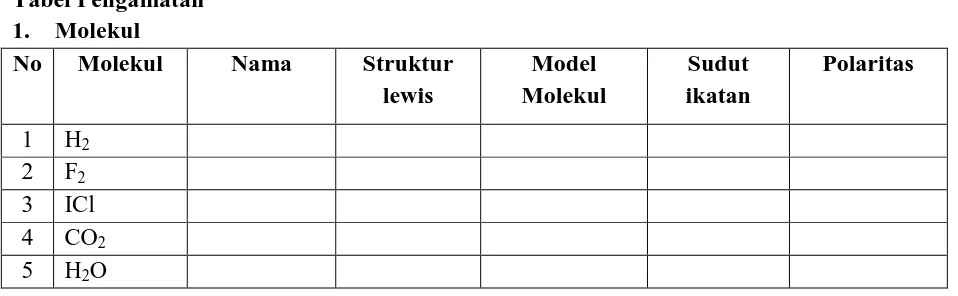
STRUKTUR LEWIS DAN MODEL MOLEKUL
TUJUAN
Setelah melakukan percobaan ini mahasiswa diharapkan dapat menggambarkan struktur lewis dan membuat model-model molekul dari molekul sederhana dan
mengembangkannya untuk ion-ion poliatomik PENDAHULUAN
Struktur lewis merupakan kombinasi simbol lewis dari atom-atom yang
menggambarkan jumlah elektron dengan benar untuk molekul maupun ion poliatomik. Struktur lewis suatu molekul atau ion berguna untuk memahami polaritas, struktur resonansi, reaktifitas kimia dan isomerisasi. Untuk menggambarkan struktur lewis dapat dilakukan dengan membuat daftar unsur yang diperlukan, berapa jumlah elektron
valensinya, dan berapa elektron yang diperlukan untuk membentuk oktet atau duplet untuk hidrogen. Untuk struktur yang berbeda perlu dipertimbangkan muatan formalnya, struktur dengan muatan formal paling kecil adalah yang benar. Disis lain, penentuan geometri (bentuk) molekul dapat dilakukan dengan menerapkan teori VSEPR (tolakan pasangan elektron pada kulit terluar) atau model hibridisasi. Penggambaran struktur lewis dan geometrinya yang benar dapat digunakan untuk menentukan polaritas molekul. Molekul polar apabila ikatan kovalen polar dan mempunyai geometri yang tidak menghasilkan peniadaan dipol-dipol ikatan.
PERCOBAAN Alat dan Bahan
Model Molekul (molimud) Prosedur Kerja
1. Gambarkan struktur lewis masing-masing molekul pada tabel pengamatan 1 dan buatlah model molekulnya dengan molimud.
2. Tentukan sudut ikatan dan polaritas molekul (Polar atau nonpolar).
10 6 BF3
7 NH3 8 N2H4 9 CH4 10 C2H6 11 C2H4 12 C2H2 13 PCl5 14 SF6
2. Ion poliatomik
Ion Poliatomik Nama Struktur lewis
Model Sudut Ikatan
-11 PERCOBAAN IV
PREPARASI LARUTAN
TUJUAN
Setelah melakukan percobaan ini mahasiswa diharapkan dapat membuat berbagai larutan baik yang berasal dari padatan maupun larutan pekat.
PENDAHULUAN
Larutan mempunyai peran penting dalam berbagai proses dan reaksi kimia. Larutan merupakan campuran homogen antara dua zat atau lebih. Larutan mengandung dua
komponen yaitu zat terlarut (solute) dan pelarut (solvent). Dalam larutan, zat yang jumlahnya lebih kecil disebut zat terlarut (solute), sedangkan zat yang jumlahnya lebih besar disebut pelarut (solvent). Pelarut yang umum dipakai adalah air. Konsentrasi suatu larutan dapat dinyatakan dalam bentuk Molaritas (M). Molaritas (M) merupakan jumlah mol zat dalam 1 liter larutan. Larutan dapat dibaut dari bahan padatan ataupun larutan pekat. Pembuatan larutan dari larutan pekat disebut juga sebagai pengenceran larutan.
PERCOBAAN Alat dan Bahan
1. Gelas kimia 100 mL 2. Gelas arloji
3. Spatula
4. Labu volumetrik 100 mL 5. Pipet ukur 10 mL
6. Pipet tetes 7. Filler
8. Aquades 9. HCl pekat 10. Padatan NaOH 11. Padatan CuSO4 12. H2SO4 Pekat
Prosedur Kerja
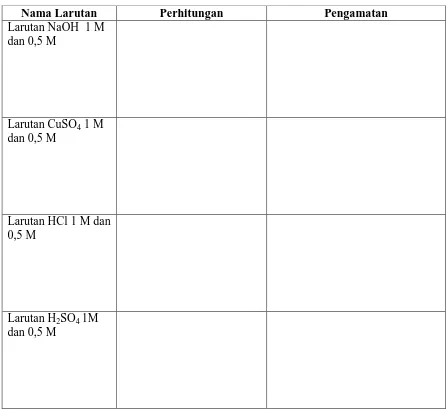
1. Membuat Larutan dari Zat Padat
Membuat 100 mL Larutan NaOH 1 M. Langkah pertama, hitung massa NaOH padat yang dibutuhkan untuk membuat 100 mL larutan NaOH 1 M. Timbang NaOH sebanyak x gram (hasil perhitungan) dengan mengunakan gelas arloji. Masukkan NaOH padat ke dalam gelas kimia kemudian tambahkan ± 50 mL aquades. Aduk hingga semua padatan larut. Masukkan larutan ke dalam labu volumetrik 100 mL, kemudian tambahkan aquades sampai tanda batas. Tutup labu volumetrik, kemudian kocok sampai homogen. Pindahkan larutan ke dalam botol reagen dan diberi label
larutan NaOH 1M. Ulangi langkah diatas untuk membuat larutan NaOH 0,5 M, larutan CuSO4 1 M dan larutan CuSO4 0,5 M dengan volume masing-masing 100 mL. 2. Membuat Larutan dari Zat Cair pekat (Pengenceran)
12 Selanjutnya tambahkan sedikit demi sedikit aquades sampai tanda batas. Tutup labu volumetrik, kemudian kocok sampai homogen. Pindahkan larutan ke dalam botol reagen dan diberi label Larutan HCl 1M. Ulangi langkah diatas untuk membuat larutan HCl 0,5 M, larutan H2SO4 1 M dan larutan H2SO4 0,5 M dengan volume masing-masing 100 mL.
Tabel Pengamatan
Nama Larutan Perhitungan Pengamatan
Larutan NaOH 1 M dan 0,5 M
Larutan CuSO4 1 M dan 0,5 M
Larutan HCl 1 M dan 0,5 M
Larutan H2SO4 1M dan 0,5 M
TUGAS
1. Mengapa botol NaOH padat harus segera ditutup setelah mengambil NaOH? 2. Mengapa labu volumetrik harus diisi air terlebih dahulu sebelum memasukkan HCl
13 PERCOBAAN V
HUKUM KEKALAN MASSA
TUJUAN
Membuktikan hukum kekekalan massa (hukum Lavoiser) melalui percobaan sederhana
PENDAHULUAN
Antoine Lavoisier, seorang ahli kimia Prancis merupakan ilmuwan pertama yang menggunakan prinsip kesetimbangan dalam penelitian kimia. Lavoisier menunjukkan bahwa ketika gas hidrogen (H2) dibakar dan beraksi dengan gas oksigen (O2) dalam wadah tertutup menghasilkankan uap air (H2O), ternyata massa uap air yang dihasilkan sebanding dengan masa gas hidrogen dan oksigen yang bereaksi.
2H2(g) + O2(g) H2O(g)
Berdasarkan eksperimen tersebut, Lavoisier merumuskan hukum kekekalan massa yang menyatakan bahwa selama proses kimia berlangsung tidak ada massa yang hilang atau massa yang diciptakan, sehingga massa zat sebelum dan sesudah reaksi tetap.
PERCOBAAN Alat dan Bahan 1. Tabung Y 2. Tabung Reaksi 3. Gelas ukur 4. Neraca analitik 5. CuSO4
6. NaOH 7. KI 8. Pb(NO3)2 Prosedur Kerja
1. Masukan larutan CuSO4 1M dan larutan NaOH 1 M dalam jumlah yang sama ke dalam tabung bentuk Y di dua sisi yang berbeda dan kemudian tutup tabung Y dengan
penyumap
2. Timbang tabung Y dan catat hasilnya.
3. Reaksikan kedua larutan yang ada di dalam tabung Y dengan cara memiringkan tabung, dan kemudian timbang kembali.
14 Tabel Pengamatan
Reaksi Pengamatan
Reaksi CuSO4 + NaOH
Massa tabung Y sebelum bereaksi = ... Massa tabung Y setelah bereaksi = ... Pengamatan reaksi =...
Reaksi Pb(NO3)2 + KI
Massa tabung Y sebelum bereaksi = ... Massa tabung Y setelah bereaksi = ... Pengamatan reaksi =...
Reaksi HCl + Mg
Massa tabung Y sebelum bereaksi = ... Massa tabung Y setelah bereaksi = ... Pengamatan reaksi =...
Reaksi HCl + Mg (tanpa tutup tabung)
Massa tabung Y sebelum bereaksi = ... Massa tabung Y setelah bereaksi = ... Pengamatan reaksi =...
TUGAS
15 PERCOBAAN VI
STOIKIOMETRI
TUJUAN
Setelah melakukan percobaan ini mahasiswa diharapkan mampu memahami titik ekivalen reaksi asam basa (HCl-NaOH) dan tembaga(II) sulfat-natrium hidroksida melalui percobaan sederhana.
PENDAHULUAN
Penentuan stoikiometri reaksi kimia dapat dilakukan dengan metode iod atau variasi kontinyu. Prinsip dasar metode ini adalah memvariasi jumlah pereaksi tetapi jumlah totalnya tetap. Karena jumlah masing-masing pereeaksi berbeda-beda, maka
perubahan massa/volume/suhu/daya serap dapat digunakan untuk meramalkan stoikiometri sistem. Jika dibuat grafik massa/volume/suhu/daya serap vs jumlah pereaksi, akan
diperoleh titik optimum yang merupakan titik stoikiometri system. Titik stoikiometri ini menunjukkan perbandingan pereaksi-pereaksi dalam senyawa. Sebagai contoh, dari percobaan diperoleh data bahwa pada titik oprimum jumlah mol Pb(NO3)2 : KI = 1:2, dan jika dianggap endapan yang terbentuk pada reaksi ini adalah timbal iodida, maka titik ini menyatakan perbandingan 1 Pb2+ dan 2 I-. Stoikiometri system ini dapat ditulis dengan persamaan:
Pb2+ (aq) + 2 I-(aq) PbI2(s)
PERCOBAAN Alat dan Bahan Gelas kimia
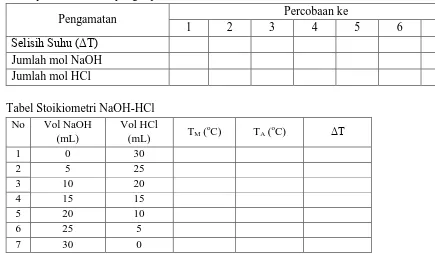
A. Stoikiometri NaOH-HCl
1. Masukkan 5 mL larutan NaOH 0,5 M, kemudian catat suhunya.
2. Ke dalam gelas kimia lain, masukkan 25 mL larutan HCl 0,5 M dan catat suhunya. Usahakan suhu kedua larutan sama sebelum dicampurkan.
3. Campurkan kedua larutan tersebut dan catat suhu maksimum campuran. 4. Ulangi langkah diatas dengan menggunakan:
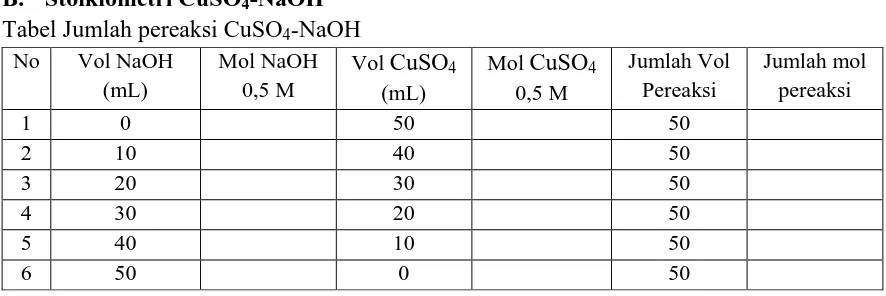
16 B. Stoikiometri CuSO4-NaOH
1. Masukkan 10 mL larutan NaOH 0,5 M, kemudian catat suhunya.
2. Ke dalam gelas kimia lain, masukkan 40 mL larutan CuSO4 0,5 M dan catat suhunya. Usahakan suhu kedua larutan sama sebelum dicampurkan.
3. Campurkan kedua larutan tersebut dan catat suhu maksimum campuran. 4. Ulangi langkah diatas dengan menggunakan:
a. 20 mL NaOH 0,5 M dan 30 mL CuSO4 0,5 M b. 30 mL NaOH 0,5 M dan 20 mL CuSO4 0,5 M c. 40 mL NaOH 0,5 M dan 10 mL CuSO4 0,5 M Tabel Pengamatan
A. Stoikiometri NaOH-HCl Tabel Jumlah pereaksi NaOH-HCl
No Vol NaOH
Tabel perubahan suhu yang diperoleh dari sistem NaOH-HCl
Pengamatan Percobaan ke
1 2 3 4 5 6 7
Selisih Suhu (ΔT)
Jumlah mol NaOH Jumlah mol HCl
17 B. Stoikiometri CuSO4-NaOH
Tabel Jumlah pereaksi CuSO4-NaOH
No Vol NaOH
Tabel perubahan suhu yang diperoleh dari sistem CuSO4-NaOH
Pengamatan Percobaan ke
1 2 3 4 5 6
Selisih Suhu (ΔT)
Jumlah mol NaOH Jumlah mol CuSO4
Tabel Stoikiometri CuSO4-NaOH
No Vol NaOH
1. Gambarkan grafik jumlah mol NaOH dan HCl (sumbu x) vs ΔT (sumbu y)! 2. Tentukan titik optimum kedua grafik diatas!
3. Berapakah jumlah mol NaOH dan HCl pada titik optimum (lihat grafik)
4. Dari data jumlah mol NaOH atau HCl tersebut, berapakah jumlah mol HCl dan NaOh yang bereaksi?
5. Berdasarkan data tersebut, berapakah perbandingan terkecil jumlah mol NaOH: mol HCl?
18 Sistem CuSO4-NaOH
1. Gambarkan grafik jumlah mol NaOH dan CuSO4(sumbu x) vs ΔT (sumbu y)! 2. Tentukan titik optimum kedua grafik diatas!
3. Berapakah jumlah mol NaOH dan CuSO4 pada titik optimum (lihat grafik)
4. Dari data jumlah mol NaOH atau CuSO4 tersebut, berapakah jumlah mol HCl dan NaOh yang bereaksi?
5. Berdasarkan data tersebut, berapakah perbandingan terkecil jumlah mol NaOH: mol CuSO4?
19 PERCOBAAN VII
PEREAKSI PEMBATAS
TUJUAN
Setelah melakukan percobaan ini mahsiswa diharapkan mampu memahami: 1. Pereaski pembatas pada campuran garam natrium fosfat dodekahidrat-barium klorida
dihidrat.
2. Persen komposisi masing-masing senyawa dalam campuran garam tersebut. PENDAHULUAN
Pada suatu reaksi kimia sering kali di jumpai satu atau lebih pereaksi yang digunakan ada dalam jumlah berlebih. Reaksi akan berhenti segera setelah salah satu pereaski habis berekasi, sedangkan pereaksi lain yang bersisa akan bercampur dengan produk yang terbentuk. Pereaksi yang hasis bereaksi dalam suatu reaksi kimia disebut sebagai pereaksi pembatas. Pereaksi pemtasa yang nantinya akan menentukan jumlah mol yang terbentuk.
PERCOBAAN Alat dan Bahan Gelas kimia sudah dihaluskan pada gelas arloji yang sudah ditimbang.
2. Larutkan campuran garam tersebut ke dalam gelas kimia dengan 200 mL aquades. Aduk selama 1 menit dan biarkan endapan turun ke dasar gelas kimia.
3. Tutup gelas kimia dengan gelas arloji, hangatkan larutan pada suhu 80-90oC selama 30 menit. Diamkan beberapa saat sampai diperoleh supernatan jernih.
4. Lakukan dekantasi untuk memisahkan supernatan dari endapan yang terbentuk. 5. Supernatan dibagi dua dan masing-masing ditempatkan dalam gelas kimia yang sudah
20 6. Residu hasil dekantasi disaring menggunakan kertas saring yang sudah timbang
sebelumnya. Cuci endapan yang tersisa di gelas kimia dengan air hangat dan saring kembali. Cuci endapan pada kertas saring dengan air hangat.
7. Keringkan dan timbang endapan yang diperoleh. B. Penentuan Pereaksi Pembatas
1. Tambahkan 2 tetes larutan BaCl2 0,5 M ke dalam gelas kimia dengan label S1. Amati apakah terbentuk endapan?
2. Tambahkan 2 tetes larutan Na3PO4 0,5 M ke dalam gelas kimia dengan label S2. Amati apakah terbentuk endapan?
Tabel Pengamatan
A. Pembentukan Ba3(PO4)2
Pengamatan Hasil Pengamatan
Massa campuran garam (g) Massa kertas saring (g) Massa kertas saring dan endapan Ba3(PO4)2 (g) Massa Ba3(PO4)2 (g)
B. Penentuan Pereaksi Pembatas
Gelas Kimia S1 Gelas Kimia S2 Uji Ba2+
Uji PO4
3-Pengamatan adanya endapan Kesimpulan
TUGAS
1. Berdasarkan hasil percobaan yang anda peroleh hitunglah: a. Mol Ba3(PO4)2 yang terbentuk
b. Mol pereaksi pembatas c. Mol pereaksi berlebih
d. Persentase pereaksi pembatas dalam campuran garam e. Persentase pereaksi berlebih dalam campuran garam
2. Tentukan massa pereaksi pematas yang tersisa setelah reaksi berhenti
21 PERCOBAAN VIII
VOLUME MOLAR GAS HIDROGEN
TUJUAN
Mahasiswa mampu memahami volume molar gas hidrogen melalui percobaan sederhana
PENDAHULUAN
Volume molar gas adalah volume 1 mol gas yang diukur pada keadaan standar (STP), yaitu pada suhu 0oC (273 K) dan tekanan 1 atm. Volume setiap gas pada keadaan standar adalah 22,4 liter. Volume molar gas hidrogen diukur berdasarkan sifatnya yang sangat sedikit larut dalam air sehingga dapat ditampung dengan cara pendesakan air. Misalnya dalam suatu tabung reaksi yang berisi penuh air yang diletakkan terbalik dalam suatu bejana yang berisi air penuh, kemudian direaksikan dengan zat-zat yang
menghasilkan gas, maka gas yang terbetuk mendesak permukaan air ke bawah. Volume gas hidrogen yang terbentuk dapat diketahui dengan mengkur air yang terdesak.
PERCOBAAN Alat dan Bahan
1. Gelas ukur 2. Barometer 3. Kertas 4. Baskom
5. Termometer 6. Kertas gosok 7. Pita magnesium 8. Larutan HCl 2 M Prosedur Kerja
1. Ambil sepotong pita magnesium yang telah di amplas kemudian timbang dengan teliti 2. Isi gelas ukur dengan larutan HCl 2 M sampai setengahnya, keudian tambahkan air
sampai penuh.
3. Tutup gelas ukur dengan kertas kemudian baliklah dalam baskum yang telah berisi air dan ambil kertas secara perlahan-lahan
4. Amati ada tidaknya gelembung udara dalam gelas ukur. Jika terdapat gelembung udara, maka ulangi langkah 2-3.
5. Masukkan pita magnesium ke dalam gelas takar melalui arah bawah.
6. Tunggu sampai pita magnesium habis bereaksi dan dibiarkan suhu larutan sama dengan suhu kamar.
7. Atur tinggi permukaan air dalam gelas ukur agar sama dengan permukaan air dalam baskom
8. Catat volume gas hidrogen yang terbentuk 9. Catat suhu ruang dan tekanan barometer 10. Ulangi langkah 1-9 di atas.
22 Tabel Pengamatan
Pengamatan Percobaan 1 Percobaan 2
Massa Mg
Volume Larutan HCl 2M Volume hidrogen
Suhu ruang Pada saat Percobaan Tekanan atmosfer (Barometer)
Perhitungan dan Pertanyaan
1. Tentukan tekanan uap air pada suhu ruang saat percobaan dari tabel 1. Hitung tekanan parsial gas hidrogen dengen rumus:
Patmosfer = PH2 + PH2O
2. Berdasarkan data tekanan parsial gas hidrogen dan suhu ruang pada saat percobaan, hitunglah volume gas hidrogen pada keadaan STP (0oC dan 101,3 kPa) dengan mengunakan hukum gas kombinasi.
3. Hitung massa dan jumlah mol magnesiun yang digunakan dalam percobaan 4. Hitung volume gas hidrogen yang dihasilkan jika anda menggunakan 1 mol
magnesium.
5. Tuliskan persamaan reaksi setara untuk reaksi logam magnesium dan larutan HCl. Berdasarkan persamaan tersebut, hitunglah jumlah gas hidrogen yang dapat terbentuk dari reaksi satu mol logam Mg.
6. Berdasarkan jawaban no.4 dan no.5, hitung volume molar gas hidrogen pada STP. Bandingkan hasilnya dengan nilai volume molar gas pada STP yang sudah ada! 7. Hitunglah persen kesalahan percobaan anda!
23 PERCOBAAN IX
PROSES EKSOTERM DAN ENDOTERM
TUJUAN
Mengidentifikasi proses endoterm dan eksoterm melalui percobaan sederhana PENDAHULUAN
Termokimia mempelajari tentang sejumlah energi yang diresap atau dibebaskan oleh reaksi kimia. Reaksi kimia akan melepaskan energi ketika reaktan mempunyai energi yang lebih tinggi dari pada produk, dan sebaliknya reaksi kimia akan menyerap energi ketika energi reaktan lebih rendah daripada energi produk. Energi kimia tersimpan dalam suatu zat merupakan jenis energi potensial. Energi potensial yang dikandung dalam suatu zat disebut entalpi (H). Reaksi kimia merupakan sebuah system dan segala sesuatu diluar system disebut lingkungan. Reaksi kimia yang melepaskan energi ke lingkungan disebut reaksi eksoterm, sedangkan reaksi kimia yang menyerap energi dari lingkungan disebut reaksi endoterm.
PERCOBAAN Alat dan Bahan
1. Termometer (-10-110oC) 2. Gelas kimia 100 mL 3. Spatula
4. Padatan NaOH 5. Padatan NaCl 6. Padatan NH4Cl 7. Padatan CH3COONa 8. Padatan NH4SCN 9. Padatan Ba(OH)2 10. Aquades
Prosedur Kerja A. Proses Pelarutan
1. Tempatkan 20 mL aquades ke dalam gelas kimia 100 mL dan ukur suhunya 2. Tambahkan 1 spatula NaOH, aduk hingga semua padatan larut kemudian ukur
kembali suhunya.
3. Ulangi langkah 1-2 untuk padatan NaCl, NH4Cl, dan CH3COOH B. Reaksi antara Amonium tiosianat dan Barium hidroksida
1. Ambilah padatan amonium tiosianat dan padatan barium hidroksida masing-masing setengah sendok kecil kemudian masukkan ke dalam tabung reaksi.
2. Tutup tabung reaksi dan kocok perlahan-lahan sampai terbentuk larutan.
3. Buka tutup tabung dan baui aroma yang dihasilkan dengan hati-hati. Identifikasi produk yang terbentuk.
24 Tabel Pengamatan
Proses Pelarutan
Percobaan Solut Solven Suhu awal (oC) Suhu Akhir (oC) Tipe reaksi 1
2 3 4
Reaksi NH4SCN dan Ba(OH)2
TUGAS
25 PERCOBAAN X
FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI
TUJUAN
Setelah melakukan praktikum ini, mahasiswa diharapkan mampu; 1) memahami faktor-faktor yang mempengaruhi laju reaksi; 2) menentukan orde reaksi dan persamaan laju reaksi
PENDAHULUAN
Laju reaksi dapat dianalogkan dengan kecepatan suatu kendaraan berjalan. Semakin besar kecepatannya, semakin pendek waktu yang dibutuhkan oleh kendaraan untuk mencapai tujuan. Demikian juga dengan reaksi kimia, semakin besar laju suatu reaksi kimia semakin singkat waktu yang dibutuhkan untuk berlangsungnya reaksi dari sejumlah tertentu pereaksi. Oleh karena itu, dapat dinyatakan bahwa
Banyak faktor yang mempengaruhi laju reaksi. Pengetahuan tentang faktor-faktor ini akan berguna dalam mengatur laju suatu reaksi . Hal tersebut sangat penting, terutama dalam mengontrol proses-prose kimia di industri. Proses kimia yang berlangsung lambat merupakan proses yang tidak ekonomis. Adapun faktor-faktor yang mempengaruhi laju reaksi kimia antara lain konsentrasi, luas permukaan, suhu dan katalis. Pada umunya laju reaksi kimia berbanding lurus dengan konsentrasi dan luas permukaan reaktan. Semakin besar konsentrasi reaktan maka laju reaksi kimia akan semakin cepat dan semakin luas permukaan reaktan, maka laju reaskinya juga akan semakin cepat. Ketergantungan laju terhadap suhu tergambar secara implisit dalam hukum laju, yakni melalaui ketergantungan k terhadap suhu. Biasanya, setiap kenaikan suhu reaksi 10oC akan diikuti dengan peningkatan laju reaksi dua atau tiga kali.
26 Prosedur Kerja
A. Pengaruh Luas Permukaan terhadap Laju Reaksi
Siapkan kepingan batu pualam dan sebuk patu pualam. Timbanglah masing-masing bahan ± 0,2 gram (atau massa harus sama). Masukkan masing-masing bahan ke dalam tabung reaksi berbeda. Tambahkan 10 mL HCl 0,5 M ke dalam masing-masing tabung reaksi yang sudah berisi batu pualam. Jalankan stopwatch untuk setiap reaksi sejak pencampuran sampai reaksi berhenti. Catat waktu yang diperlukan untuk berlangsunganya reaksi.
B. Pengaruh Suhu terhadap Laju Reaksi
1. Masukkan 50 mL larutan Na2S2O3 0,05 M ke dalam gelas kimia ukuran 100 mL. Letakkan gelas kimia tersebut diatas kertas bertanda. Ukur suhunya. Siapkan 10 mL HCl 0,5 M dalam gelas ukur dan stopwatch. Masukkan 10 mL HCl 0,5 M ke dalam gelas kimia yang berisi larutan Na2S2O3. Jalankan stopwatch sejak pencampuran sampai tanda di bawah gelas kimia tidak teramati lagi. Catat waktu yang diperlukan untuk berlangsunganya reaksi.
2. Masukkan 50 mL larutan Na2S2O3 0,05 M ke dalam gelas kimia ukuran 100 mL. Panaskan larutan sampai suhunya 37oC. Letakkan gelas kimia tersebut diatas kertas bertanda. Masukkan 10 mL HCl 0,5 M ke dalam gelas kimia yang berisi larutan Na2S2O3. Jalankan stopwatch sejak pencampuran sampai tanda di bawah gelas kimia tidak teramati lagi. Catat waktu yang diperlukan untuk berlangsunganya reaksi. C. Pengaruh Katalis terhadap Laju Reaksi
1. Masukkan 20 mL larutan H2O2 10% ke dalam gelas kimia 100 mL. Amati apakah terjadi reaksi? Tambahkan 10 tetes NaCl ke dalam gelas kimia. Amati beberapa saat, apakah terjadi reaksi?
2. Lakukan percobaan yang sama dengan mengganti larutan NaCl dengan: a) 10 tetes FeCl3, b) sedikit MnO2, dan c) sepotong kecil kentang segar.
D. Pengaruh Konsentrasi terhadap Laju Reaksi, Menentukan Orde Reaksi dan Persamaan laju Reaksi
Masukkan 50 mL larutan Na2S2O3 0,05 M ke dalam gelas kimia ukuran 100 mL. Letakkan gelas kimia tersebut diatas kertas bertanda. Masukkan 10 mL HCl 0,25 M ke dalam gelas kimia yang berisi larutan Na2S2O3. Jalankan stopwatch sejak
pencampuran sampai tanda di bawah gelas kimia tidak teramati lagi. Catat waktu yang diperlukan untuk berlangsunganya reaksi. Ulangi langkah diatas dengan
27 Tabel Pengamatan
Tabel 1. Pengaruh luas permukaan terhadap laju reaksi
Percobaan Pereaksi Waktu
1 CaCO3 (keping) + HCl 2 CaCO3 (serbuk) + HCl Tabel 2. Pengaruh suhu terhadap laju reaksi
Percobaan Pereaksi Waktu
1 Na2S2O3 0,05M + HCl 0,5M 2 Na2S2O3 0,05M + HCl 0,5M Tabel 3. Pengaruh katalis terhadap laju reaksi
Percobaan Pereaksi Reaksi (+/-)
1 H2O2 6 % + NaCl 2 H2O2 6 % + FeCl3 3 H2O2 6 % + MnO2
4 H2O2 6 % + kentang segar
Tabel 4. Pengaruh konsetrasi terhadap laju reaksi dan penentuan orde serta persamaan laju reaksi
Percobaan Pereaksi Waktu
1 50 mL Na2S2O3 0,05M + 10 mL HCl 0,25M 2 50 mL Na2S2O3 0,05M + 10 mL HCl 0,5M 3 50 mL Na2S2O3 0,1M + 10 mL HCl 0,5M TUGAS
1. Bagaimanakah pengaruh luas permukaan terhadap laju reaksi? 2. Bagaimanakah pengaruh suhu terhadap laju reaksi?
3. Bagimana pengaruh katalis terhadap laju reaksi? Dan sebutkan za-zat yang berperan sebagai katalis pada percobaan yang telah anda lakukan!
4. Bagaimanakah pengaruh konsentrasi terhadap laju reaksi?
28 DAFTAR PUSTAKA
1. Beran, J. A. 1994. Laboratory Manual for Principles of General Chemistry 5th ed. USA: John Wiley & Sons, Inc.
2. Garnet, P. J., Anderton, J.D., Garnet P. J. 2001. Chemistry Laboratory Manual.
Australia: Pearson Education Australia Pty Limited.
3. Tim Kimia Dasar 1. 2006. Petunjuk Praktikum Kimia Dasar I. Jurusan Kimia, FMIPA, Universitas Negeri Malang
1
LAMPIRAN 1
JADWAL PELAKSANAAN
PRAKTIKUM KIMIA DASAR I
Kegiatan Lab
Materi Praktikum Shift (Kloter)
1 Pengenalan Alat dan Bahan
1 1, 2, 3, 4, 5,
2 Pemisahan dan Pemurnian Zat secara Fisik
1 1, 2, 3, 4, 5,
3 Struktur Lewis dan Model Molekul
4 1. Preparasi Larutan 2. Hukum Kekalan Massa
1 1, 2, 3, 4, 5,
5 Stoikiometri
1 1, 2, 3, 4, 5,
6 Pereaksi Pembatas
1 1, 2, 3, 4, 5,
2. Reaksi Eksoterm dan Endoterm
8 Faktor-Faktor yang
Mempengaruhi Laju Reaksi
1 1, 2, 3, 4, 5,