ANALISIS NUMERIK UNTUK IMMUNOTHERAPY
PADA INFEKSI HIV-1
ROSIDAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2010
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa tesis Analisis Numerik untuk
Immunotherapy pada Infeksi HIV-1 adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Febuari 2010
Rosidah
NRP G751080031
ABSTRACT
ROSIDAH. Numerical Analysis for Immunotherapy on HIV-1 Infection. Under direction of AGUS KARTONO and IRZAMAN
Using an mathematical model which describes the interaction of immune system with the human immunodeficiency virus (HIV), we introduce
immunotherapy with the used cytokine interleukin-2 (IL-2) may boost the immune respone to fight HIV infection. The typical disease dynamics based on the phenomenon of interactions between the two populations, that are uninfected CD4+ T cells and free virus. With comparison model to existing experimental data, we can better understand what mechanisms of immune-viral dynamics are necessary to produce the typical disease dynamics. We also consider effects of IL-2 treatment on viral growth and CD4+ T cell population dynamics. We show that the method giving doses, that the use dose level and initial level CD4+ T cells before treatment are the play an important role in determining the outcome therapy. Then prediction of the immunotherapy to this model can be increasing of the level CD4+ T cells and that does not stimulate viral replication.
RINGKASAN
ROSIDAH. Analisis Numerik untuk Immunotherapy pada Infeksi HIV-1. Dibimbing oleh AGUS KARTONO dan IRZAMAN.
AIDS (Acquired Immunodeficiency Syndrome) pada dasarnya adalah kumpulan gejala penyakit yang timbul akibat menurunnya sistem kekebalan tubuh, yang disebabkan oleh virus HIV (Human Immunodevviciency Virus) suatu
Retrovirus yang termasuk dalam famili Lentivirus, virus ini memiliki kemampuan replikasi balik yang dapat „menyandera‟ sel inang untuk digunakan sebagai „mesin replikatif‟ dalam memproduksi dirinya sendiri, maupun zat yang diinginkan oleh virus itu sendiri. Dengan adanya kemampuan yang unik dari virus ini menyebabkan penyakit ini tidak bisa diobati atau disembuhkan. Ada beberapa pilihan jenis obat yang dapat memperlambat perkembangan HIV yang dapat ditawarkan apabila jumlah sel CD4+ telah diketahui secara pasti, antara lain dengan antiretroviral (ARV) yang terbagi lagi menjadi beberapa golongan yaitu: NRTI, NNRTI, PI dan FI. Pengobatan HIV dengan menggunakan ARV bertujuan menekan produksi virus dan penggunaannya bersifat kombinasi karena adanya resistansi dan mutasi dari virus. Pengobatan lain adalah dengan cara
immunotherapy dengan menggunakan interleukin-2 (IL-2). Tipe pengobatan ini dapat menaikkan sistem imun yang dapat membantu tubuh melawan terhadap infeksinya sendiri. Usaha untuk menaikkan respon imun akan cocok untuk mengurangi muatan virus. Ini membawa harapan baru untuk pengobatan infeksi HIV, dan tipe pengobatan ini yang akan kami pelajari.
Interleukin-2 (IL-2) adalah sebagian besar dari Sitokinin yang merupakan protein yang dibuat oleh tubuh. T-sel pembantu, sejenis sel darah putih, menghasilkan IL-2 ketika mereka sedang dirangsang oleh infeksi. Percobaan klinik itu memperlihatkan ada korelasi yang tinggi antara konsentrasi IL-2 rendah dan penurunan jumlah sel T CD4+ dengan progresi penyakit. Ini adalah petunjuk untuk mengurangi IL-2 pada level yang tidak dapat ditemukan dalam nodus limfa pada semua tingkatan penyakit. Pasien yang menggunakan IL-2 memiliki peningkatan besar dalam jumlah CD4+. IL-2 disebut modulasi kekebalan. IL-2 merangsang sistem kekebalan tubuh dan meningkatkan jumlah sel CD4. Sejak IL-2 telah memperlihatkan pengembalian beberapa fungsi imun yang menjadi lemah oleh infeksi HIV. Kami mengembangkan model matematika yang menggambarkan dinamika progresi penyakit HIV, kemudian kami coba memasukkan fungsi pengobatan immunotherapy dengan menggunakan IL-2 untuk melihat interaksi antara populasi virus dan populasi sel T CD4+ pada pasien yang terinfeksi HIV-1. Kemudian kami mencoba menvalidasi model tersebut dengan data dari hasil eksperimen yang didapat dari beberapa literatur.
Kami mengembangkan sebuah model progresi penyakit HIV dari individu yang tidak diobati, kemudian kami menunjukkan model matematika dari
immunotherapy berdasarkan persamaan diferensial biasa (ODE) untuk melihat dinamika populasi virus dan populasi sel T CD4+ dari penyakit HIV.
Penelitian ini bertujuan untuk mengembangkan model matematika
immunotherapy pada infeksi HIV dan mengembangkan strategi pengobatan dalam memprediksi hasil immunotherapy pada infeksi HIV.
Penelitian ini menjadi dasar acuan teori biofisika tentang dinamika terapi imun pada infeksi HIV dan juga diharapkan dapat digunakan pada penyakit yang memiliki kesamaan dengan mekanisme sistem infeksi virus lainnya seperti tuberkolosis (TBC) dan sel kanker/tumor.
Peralatan yang digunakan dalam penelitian ini adalah berupa komputer AMD Turion X2 Dual-Core (U405D), 4,0GB of RAM. Software yang digunakan untuk proses komputasi adalah bahasa pemprogaman Matlab R2008b dari
Mathwork, Inc. Untuk mendukung penelitian ini sumber referensi yang digunakan selain buku (literature) juga berbagai informasi yang di peroleh dari internet yang diakses dari Laboratorium. Pembuatan program dengan mengunakan bahasa pemprograman Matlab R2008b yang diperlukan untuk memudahkan perhitungan secara numerik, juga memudahkan dalam pembuatan grafik solusi persamaan, baik ruang fasa maupun laju perubahan populasi pada model immunotherapy
infeksi HIV.
Dari solusi numerik dari model progresi HIV diketahui bahwa dinamika penyakit HIV dari individu yang tidak diobati terjadi kurang lebih 6 tahun. Hal ini terlihat dari penurunan jumlah populasi sel T CD4+ sampai ke batas nol dan peningkatan terus-menerus dari populasi virus ke batas tak terhingga dari nilai awal “set point” yang ditentukan.
Terapi IL-2 dengan cara suntik subkutan menggunakan dosis rendah r(t) = 0.0001 tidak bisa meningkatkan jumlah sel T CD4+, baik itu pada tahap asimptomatik maupun tahap simptomatik. Dengan menggunakan dosis sedang
r(t) = 0.003, pada tahap asimptomatik (T(0) = 347 mm3) terjadi peningkatan jumlah sel T CD4+ selama 6 bulan terapi sebesar 156 mm3, dan jumlah populasi virus mengalami penurunan sebesar 969.48 ml selama 6 bulan. Tetapi jika pengobatan dilakukan pada tahap simptomatik (T(0) = 100 mm3), dengan menggunakan dosis sedang tidak bisa meningkatkan jumlah sel T CD4+. Untuk terapi dengan menggunakan dosis tinggi r(t) = 0,006 pada tahap asimptomatik maupun tahap simptomatik terjadi kenaikan jumlah sel T CD4+. Pada tahap asimptomatik kenaikan terjadi cukup besar yaitu sebesar 509.52 mm3 selama 6 bulan, sedangkan pada tahap asimptomatik kenaikannya yang terjadi tidak cukup signifikan, selama 6 bulan terapi masih belum melewati batas tahap simptomatik. Dari data eksperimen terapi menggunakan dosis tinggi bisa menimbulkan efek toksis atau beracun pada individu tertentu, jadi terapi dengan dosis tinggi hanya bisa digunakan pada individu tertentu.
Terapi IL-2 dengan cara infus intravena dimana dimulai dengan dosis besar dan berakhir dengan dosis kecil, pada tahap asimptomatik bisa meningkatkan jumlah sel T CD4+ sebesar 498.96 mm3 selama 12 bulan. Sedangkan pada tahap simptomatik terjadi penurunan jumlah sel CD4+ selama 12 bulan.
Pada saat penyakit sudah masuk tahap simptomatik (T(0) = 100 mm3) pengobatan dengan menggunakan terapi IL-2 pada infeksi HIV-1 baik itu dengan cara suntik subkutan maupun dengan cara infus intravena, rata-rata tidak bisa meningkatkan jumlah sel T CD4+. Hal ini menunjukkan bahwa terapi mengalami kegagalan. Sedangkan pada tahap asimptomatik (T(0) > 200 mm3) rata-rata bisa meningkatkan jumlah sel T CD4+, baik itu dengan cara suntik subkutan maupun
dengan infus intravena. Tetapi dari kedua cara pemberian dosis, cara yang paling aman digunakan adalah dengan menggunakan suntik subkutan karena efek toksik yang ditimbulkan lebih bisa ditoleransi dari pada menggunakan cara suntik subkutan. Dan dosis IL-2 yang paling optimal adalah r(t) = 0.0035, karena dengan menggunakan dosis ini akan didapatkan hasil yang mendekati hasil data eksperimen serta tidak bersifat toksis atau beracun. Dengan menggunakan dosis ini selama 6 bulan jumlah sel T CD4+ mengalami peningkatan sebesar 547.9741 mm3.
Berdasarkan model immunotherapy pada infeksi HIV yang kami sajikan dan dengan pemahaman berbagai aspek efek terapi, maka dapat diambil kesimpulan bahwa dinamika progresi penyakit HIV dapat nilai dari penurunan jumlah sel T CD4+ dan peningkatan jumlah virus ke nilai yang tak terhingga. Immunotherapy
dengan menggunakan IL-2 dapat meningkatkan jumlah sel T CD4+, tetapi tidak bisa mengurangi jumlah virus HIV sampai habis, jadi dapat memperlambat penyakit HIV ke tingkatan oportunistik. Dosis IL-2 yang optimal adalah dosis yang dapat meningkatkan jumlah sel T CD4+ secara signifikan, tetapi bersifat tidak toksik/beracun dan tidak meningkatkan replikasi virus. Immunotherapy
dengan IL-2 dapat digabung dengan terapi/pengobatan lainnya untuk menghindari mutasi dan resistansi dari virus HIV. Cara pemberian dosis, jumlah dosis yang di berikan dan jumlah sel T CD4+ awal dimulai terapi adalah hal utama yang menentukan hasil terapi yang optimal.
Kata kunci: HIV, sel T CD4+, immunotherapy, model matematika
© Hak Cipta milik IPB, tahun 2010 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh Karya tulis dalam bentuk apa pun tanpa izin IPB
ANALISIS NUMERIK UNTUK IMMUNOTHERAPY
PADA INFEKSI HIV-1
ROSIDAH
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Biofisika
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2010
Judul Tesis : Analisis Numerik untuk Immunotherapy pada Infeksi HIV-1. Nama : Rosidah
N R P : G751080031
Disetujui Komisi pembimbing
Dr. Agus Kartono, M.Si Dr. Ir. Irzaman, M.Si Ketua Anggota
Diketahui,
Ketua Program Studi Dekan Sekolah Pascasarjana Biofisika
Dr. Agus Kartono, M.Si. Prof. Dr. Ir. Khairil A. Notodiputro, M.S
Tanggal Ujian: 12 Maret 2010 Tanggal Lulus: 17 Maret 2010
KATA PENGANTAR
Alhamdulillahirobbil‟alamin, puji dan syukur kehadirat Allah SWT atas rahmat, anugrah dan kasih sayang-Nya, sehingga penulis dapat menyelesaikan pembuatan karya ilmiah yang dilaksanakan sejak bulan Juli 2009 dengan judul “Analisis Numerik untuk Immunotherapy pada Infeksi HIV-1”, sebagai syarat untuk menyelesaikan Program Magister Sains pada Program Studi Biofisika, Sekolah Pascasarjana IPB.
Penyusunan penulisan karya ilmiah ini dapat diselesaikan karena dukungan dan bantuan berbagai pihak. Oleh karena itu penulis mengucapkan terima kasih kepada Bapak Dr. Agus Kartono, M.Si dan Bapak Dr. Ir. Irzaman, M.Si selaku pembimbing atas segala bimbingan dan motivasinya yang diberikan kepada penulis untuk segera menyelesaikan penelitian ini. Di samping itu, penghargaan penulis sampaikan kepada Pemerintah Daerah Kabupaten Bulungan Propinsi Kalimantan Timur yang telah memberikan beasiswa kepada penulis, pihak-pihak terkait yang tidak bisa penulis sebutkan satu persatu termasuk teman-teman sejawat yang telah membantu dalam pembuatan karya ilmiah ini. Ungkapan terima kasih juga penulis sampaikan kepada ayah, ibu, suami, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Penulis mengharapkan kritik dan saran untuk kesempurnaan penulisan karya selanjutnya. Semoga hasil penulisan ini dapat menjadi wacana yang memberikan wawasan yang bermanfaat bagi semua pihak.
Bogor, Febuari 2010
RIWAYAT HIDUP
Penulis dilahirkan di Muara Muntai pada tanggal 8 April 1981 dari seorang ayah bernama Hamran AB dan ibu Juwita. Penulis merupakan putri keempat dari sebelas bersaudara.
Pendidikan sarjana ditempuh di Program Studi Pendidikan Biologi, Fakultas Keguruan dan Ilmu Pendidikan Universitas Mulawarman, lulus pada tahun 2004. Pada tahun 2008, penulis mendapat kesempatan untuk melanjutkan ke program Magister Sains Program Studi Biofisika di Institut Pertanian Bogor melalui Beasiswa Unggulan Daerah Kabupaten Bulungan Propinsi Kalimantan Timur.
Penulis bekerja sebagai guru di SMP Negeri 2 Tanjung Palas sejak tahun 2005 di Kabupaten Bulungan Propinsi Kalimantan Timur.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xvi
PENDAHULUAN Latar Belakang ... 1
Perumusan Masalah ... 3
Tujuan Penelitian ... 3
Manfaat Penelitian ... 4
Ruang Lingkup Penelitian ... 4
TINJAUAN PUSTAKA Model Progresi HIV-1 ... 5
Model Immunotherapy ... 7
METODOLOGI PENELITIAN Waktu dan Tempat Penelitian ... 9
Peralatan ... 9
Studi Pustaka ... 9
Pembuatan Program ... 9
Analisis Output ... 9
HASIL DAN PEMBAHASAN Dinamika Progresi Penyakit HIV-1 ... 10
Validasi Model dengan Data Eksperimen ... 10
Solusi Numerik untuk Immunotherapy ... 11
Terapi Suntik Subkutan ... 11
Prediksi Immunotherapy dosis rendah ... 11
Prediksi Immunotherapy dosis sedang ... 12
Prediksi Immunotherapy dosis tinggi ... 13
Terapi Infus Intravena ... 14
Prediksi Immunotherapy gagal ... 16
Prediksi Immunotherapy optimal ... 18
SIMPULAN ... 20
DAFTAR PUSTAKA ... 21
DAFTAR GAMBAR
Halaman 1 Tipe dinamika dari individu yang terinfeksi HIV dari data
eksperimen. Data ini diambil dari [Pennisi dan Cohen, 1996] ... 10 2 Progresi penyakit dari individu yang tidak diobati. Simulasi
numerik dari model persamaan 1 – 2 dengan nilai parameter dari
Tabel 1 ... 11 3 Model terapi subkutan dari IL-2 dengan dosis rendah dimana r(t) =
0.0001. Model persamaan (3) dan (4) dibandingkan dengan data
dari [Jacobson, 1996]. (a) untuk sel T CD4+ dan (b) untuk virus ... 12 4 Model terapi subkutan IL-2 dengan dosis sedang dimana r(t) =
0.003. Model persamaan (3) - (4) dibandingkan dengan data dari
[Jacobson, 1996]. (a) untuk sel T CD4+ dan (b) untuk virus ... 13 5 Model terapi subkutan IL-2 dengan dosis tinggi dimana r(t) =
0.006. Model persamaan (3) dan (4) dibandingkan dengan data dari
[Jacobson, 1996]. (a) untuk sel T CD4+ dan (b) untuk virus ... 14 6 Terapi IL-2 dengan cara intravena. Model persamaan (3)–(4)
dibandingkan dengan data dari [Kovacs, 1996]. Terapi diberikan selama 6 siklus dengan interval dua bulan. Fungsi pengobatan adalah r (t) = 𝑐1𝑡𝑒 −𝑐2𝑡 , dimana c1 dan c2 berbeda untuk 6 siklus,
dimulai dengan dosis besar dan berakhir dengan dosis kecil. Siklus 1: c1 = 0.08, c2 = 0.4 ; siklus 2: c1 = 0.05, c2 = 0.4 ; siklus 3: c1 = 0.04, c2 = 0.4 ; siklus 4: c1 = 0.03, c2 = 0.5 ; siklus 5: c1 = 0.02, c2 =
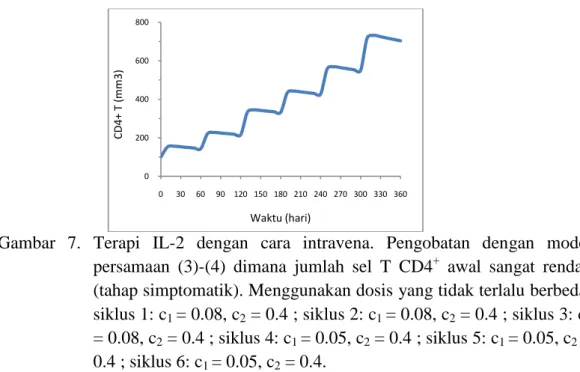
0.5 ; siklus 6: c1 = 0.02, c2 = 0.5 ... 15 7 Terapi IL-2 dengan cara intravena. Pengobatan dengan model
persamaan (3)-(4) dimana jumlah sel T CD4+ awal sangat rendah (tahap simptomatik). Menggunakan dosis yang tidak terlalu berbeda. siklus 1: c1 = 0.08, c2 = 0.4 ; siklus 2: c1 = 0.08, c2 = 0.4 ; siklus 3: c1 = 0.08, c2 = 0.4 ; siklus 4: c1 = 0.05, c2 = 0.4 ; siklus 5:
c1 = 0.05, c2 = 0.4 ; siklus 6: c1 = 0.05, c2 = 0.4 ... 16 8 Terapi subkutan IL-2 pada pasien HIV dengan jumlah T (0) < 200
mm3, V (0) = 10.000 ml dengan menggunakan dosis IL-2 yang berbeda. (a) r(t) = 0.0001 (b) r(t) = 0.003 (c) r(t) = 0.0035 dan (d)
r(t) = 0.006 ... 17 9 Terapi IL-2 dengan cara intravena. Pengobatan dengan model
persamaan (3)-(4) dimana jumlah sel CD4+ T awal rendah (tahap simptomatik). Menggunakan dosis yang sama dengan yang
10 Terapi subkutan IL-2 yang optimal dengan jumlah T (0) < 347 mm3, V (0) = 39000 ml dengan menggunakan dosis IL-2 r(t) =
0.0035 ... 19
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian ... 23
2 Sintak plot grafik dari simulasi Progresi HIV-1 ... 24
3 Sintak plot grafik dari simulasi terapi suntik subkutan ... 25
PENDAHULUAN
Latar Belakang
Pada tahun 1983, sejenis retrovirus yang sekarang disebut human immmunodefeciency virus (HIV), telah diidentifikasikan sebagai agen penyebab AIDS. HIV merupakan pathogen paling mematikan yang pernah diketahui. Terdapat dua galur utama virus itu, yaitu HIV-1 dan HIV-2. HIV-1 adalah galur yang paling luas penyebarannya dan lebih virulen. Kedua galur ini menginfeksi sel-sel yang mengandung permukaan molekul CD4+. Molekul CD4+ pada sel T membantu interaksi antara sel T dengan sel penyaji antigen (APC). Sel-sel yang rentan terhadap pathogenesis HIV adalah sel T CD4+ dan makrofaga. Pada kedua jenis sel itu, masuknya virus tidak hanya memerlukan CD4+, namun juga molekul protein kedua yang disebut koreseptor. Koreseptor fusin ditemukan pada sel T
helper, dan CCR5 yang ditemukan pada makrofaga. Keduanya berfungsi sebagai reseptor untuk berbagai kemokin. Pertama kali, kedua sel itu dikenali sebagai koreseptor HIV, setelah ditemukan beberapa kemokin menekan infeksi HIV-1 karena berikatan dengan kedua sel itu dan menghambat reseptor kemokin pada calon sel inang.
Ketika sudah berada di dalam sel, RNA HIV direkam (diduplikat) balik, dan produk DNA digabungkan ke dalam genom sel inang. Dalam bentuk provirus ini, genom virus itu mengarahkan produksi partikel virus baru. Oleh karena, retrovirus yang ada sebagai provirus selama sel yang terinfeksi itu hidup, maka antibodi akan gagal memberantas dan mengusirnya. Tantangan bagi respon humoral dan respon yang diperantarai sel adalah perubahan mutasi yang sangat sering terjadi pada setiap tingkat replikasi virus. Hal ini disebabkan, sebagian besar partikel HIV yang dihasilkan dalam individu yang terinfeksi akan sedikit berbeda dari virus yang semula menginfeksi.
Penurunan jumlah virus yang jelas terlihat dalam sebagian tubuh menggambarkan suatu respon kekebalan awal terhadap HIV. Akan tetapi, penurunan awal konsentrasi HIV dalam darah adalah menyesatkan. Selama waktu itu, replikasi HIV terus terjadi dalam sel-sel nodus limfa dan menyebabkan kerusakan struktur dan fungsional di sel-sel nodus limfa. Pada waktu yang
bersamaan, konsentrasi HIV dalam darah akan meningkat. Penyebab peningkatan ini adalah proses perombakan dan perusakan jaringan limfatik, pembebasan dari jaringan ini, dan hilangnya CD4 dan sel T helper, sehingga mengakibatkan ambruknya sistem kekebalan tubuh.
Sekarang ini, obat-obatan yang tampaknya memperlambat replikasi virus ketika digunakan dalam berbagai kombinasi adalah inhibitor sintesis DNA, inhibitor diduplikat balik (reserve transcriptase), seperti AZT(Zidovudine) yang diakui untuk pengobatan infeksi HIV pada tahun 1987, dan ada tiga obat lainnya DDC, DDI, dan D4T, serta inhibitor protease yang dapat mencegah suatu langkah kunci dalam sintesis protein HIV. Semua obat yang digunakan hanya bisa memperpanjang hidup, namun tidak untuk mengobati dan menyembuhkan.
Banyak perlakuan kemoterapi yang bertujuan membunuh atau menghentikan pathogen, tetapi pengobatan yang mana yang bisa meningkatkan sistem kekebalan tubuh yang dapat bertindak sebagai pembantu tubuh melawan terhadap infeksinya sendiri. Pada saat ini, terus berkembang usaha untuk menaikkan respon kekebalan tubuh yang cocok untuk mengurangi muatan virus (istilah lain dari obat anti virus). Hal ini membawa harapan baru untuk pengobatan infeksi HIV dan ini adalah tipe pengobatan yang akan kami pelajari pada penelitian ini.
Sitokin adalah protein hormon yang menengahi dua imun (kekebalan tubuh) alami dan imun spesifik. Sitokin sebagian besar dihasilkan dengan mengaktifkan sel (limfosit) selama sel kekebalan menengahi. Interleukin-2 (IL-2) adalah sebagian besar sitokin yang bertanggung jawab untuk mengaktifkan pertumbuhan dan diferensiasi limfosit. IL-2 banyak menghasilkan sel T CD4+, dan menghasilkan sedikit sel T CD8+ (cytotoksit sel T, atau CTLs).
Percobaan klinik memperlihatkan ada efek stimulasi-imun dari pengobatan dengan interleukin-2 (IL-2), meskipun terapi imun ini tidak mendapat izin dari pemerintah di negara maju. IL-2 dapat meningkatkan aktifitas CTL, untuk tingkat penyakit yang berbeda. IL-2 dapat meningkatkan pemulihan aktifitas sel pembunuh alami (NK) yang rusak maupun meningkatkan perbaikan pada poliklonal ekspansi dari sel T CD4+ dan CD8+. Percobaan klinik itu memperlihatkan ada korelasi yang tinggi antara konsentrasi IL-2 rendah dan
penurunan jumlah sel T CD4+ dengan progresi penyakit [Abbas. A, 1994]. Ini adalah petunjuk untuk mengurangi IL-2 pada level yang tidak dapat ditemukan dalam nodus limfa pada semua tingkatan penyakit.
Sejak IL-2 telah memperlihatkan pengembalian beberapa fungsi imun yang menjadi lemah oleh infeksi HIV, maka kami ingin mempelajari dan menganalisa penggunaan sitokin dengan menggunakan model matematika yang sudah ada.
Penelitian ini akan memperkenalkan model matematik yang akan lebih banyak menggunakan pendekatan deterministik untuk membantu pemahaman dinamika penyakit. Sistem dinamika persamaan diferensial parsial biasa (ordinary differential equation (ODE)), yang akan digunakan dalam bentuk proses infeksi HIV.
Perumusan Masalah
a. Bagaimanakah mekanisme dari sistem imun (kekebalan tubuh) yang muncul dari dinamika penyakit HIV ?
b. Bagaimanakah menjelaskan dinamika infeksi HIV ?
c. Apakah simulasi dari model yang digunakan dalam penelitian ini memberikan hasil prediksi yang sesuai dengan kenyataan (eksperimen)?
Tujuan Penelitian Penelitian ini bertujuan:
1. Menganalisa model matematika dari dinamika penyakit HIV.
2. Mempelajari mekanisme dari sistem imun yang muncul dari dinamika penyakit HIV.
3. Mempelajari peranan IL-2 pada immunotherapy.
4. Untuk mengetahui dosis IL-2 yang paling optimal dalam immunotherapy
pada penyakit HIV.
5. Untuk mengetahui pengaruh cara pemberian dosis IL-2 dalam immunotherapy pada penyakit HIV.
Manfaat Penelitian
Penelitian ini menjadi dasar acuan teori biofisika tentang dinamika terapi imun pada infeksi HIV dan bisa digunakan untuk menetapkan atau mengembangkan strategi pengobatan pada infeksi HIV. Selain itu, mekanisme ini dapat digunakan pada penyakit yang memiliki kesamaan dengan sistem infeksi virus lainnya seperti tuberkolosis (TBC) dan sel kanker/tumor.
Ruang lingkup
Ruang lingkup dalam penelitian ini meliputi pemahaman sistem dinamika nonliniear, persamaan diferensial biasa (ODE), teori tentang sistem terapi imun dan tentang mekanisme infeksi HIV.
TINJAUAN PUSTAKA
Model Progresi dari HIV
Dalam model progresi dari HIV, kami menyatakan populasi sel T CD4+ yang tidak terinfeksi dalam satuan T(t)/mm3, dan populasi yang bebas virus dalam satuan V(t)/ml yang berinteraksi di dalam plasma. Dalam [Kirschner, 1996. Kirschner, 1997a. Kirschner, 1997b] mereka memasukkan sel T CD4+ yang terinfeksi, tetapi tujuan kami disini untuk mendemonstrasikan dinamika progresi penyakit HIV dalam plasma, dengan dasar asumsi sederhana yaitu interaksi dari populasi sel T CD4+ yang tidak terinfeksi dengan virus bebas. Persamaan matematika dari model infeksi HIV yang kami gunakan adalah sebagai berikut:
𝑑𝑇(𝑡) 𝑑𝑡 = 𝑠1− 𝑠2𝑉(𝑡) 𝑏1+𝑉(𝑡)− 𝜇𝑇 𝑡 − 𝑘𝑉 𝑡 𝑇 𝑡 , (1) 𝑑𝑉 (𝑡) 𝑑𝑡 = 𝑔𝑉(𝑡) 𝑏2+𝑉(𝑡)− 𝑐𝑉 𝑡 𝑇 𝑡 (2)
dimana𝑑𝑇(𝑡)𝑑𝑡 adalah jumlah populasi sel T CD4+, 𝑠1− 𝑏𝑠2𝑉(𝑡)
1+𝑉(𝑡) adalah
jumlah/replikasi dari populasi sel T CD4+ yang tidak terinfeksi, − 𝜇𝑇 𝑡 adalah kehilangan alami dari sel T CD4+ yang tidak terinfeksi, selain itu − 𝑘𝑉 𝑡 𝑇 𝑡 merupakan jumlah dari sel T CD4+ yang tidak terinfeksi menjadi terinfeksi oleh virus. Ini diasumsikan proporsional dengan hasil dari sel T CD4+ yang tidak terinfeksi dengan virus.
Sedangkan 𝑑𝑉 (𝑡)𝑑𝑡 adalah jumlah dari populasi virus, 𝑏𝑔𝑉(𝑡)
2+𝑉(𝑡) adalah jumlah
dari kontribusi virus ke plasma dan dari bagian luar, seperti sistem limfa maupun virus yang dihasilkan oleh sel yang terinfeksi dalam plasma. Sebagian besar hal ini diketahui dari sisa virus dalam sistem limfa yang mana terjadi dalam fase asimptomatik dari penyakit [Cavert W, 1997. Haase A, 1996. Lafeuillade A,1996]. Model ini memilih hubungan sumber virus dengan batas nilai 𝑔. Persamaan (2) juga terdapat laju kehilangan virus − 𝑐𝑉 𝑡 𝑇 𝑡 , ini merupakan penggabungan dari pemindahan virus, yang disebabkan oleh semua komponen respon imun, maupun virus yang mati. Model ini juga mengasumsikan tingkat jumlah virus bergantung pada level sel T CD4+, hal ini tidak berhubungan dengan
virus yang bebas (terlepas dari proses infeksi itu sendiri), Model ini juga memperlihatkan kapasitas umum dari sistem imun untuk membuang virus dari dalam plasma. Kami asumsikan kapasitas itu berkurang selama progresi penyakit, dan berbanding proporsional dengan level sel T CD4+.
Di dalam Tabel 1, kami memberikan daftar parameter untuk persamaan (1) dan (2). Kami memilih konstanta kelajuan dari referensi. Model ini mengasumsikan penggabungan aspek kunci dari dinamika imun HIV dan stimulasi progresi penyakit.
Tabel 1. Variabel dan Parameter
Variabel terikat Nilai
T = Populasi sel CD4+ T yang tidak terinfeksi 1000/mm3
V = Populasi HIV 103 /ml
Parameter dan konstanta Nilai
s1 = sumber/produksi sel CD4+ T 2,0 mm3 /hari
s2 = sumber/produksi sel CD4+ T 1,5 mm3 /hari µ = Kelajuan kematian dari populasi sel CD4+ T yang
tidak terinfeksi 0,002 /hari
k = kelajuan sel CD4+ T menjadi terinfeksi oleh virus
bebas V 2,5 x 10
-4
mm3 /hari g = kelajuan masuknya dari sumber virus ekternal 30 mm3/hari
c = Kelajuan kematian dari virus 0,007 mm3 /hari
b1 = campuran saturation konstan 14,0 mm3
b2 = campuran saturation konstan 1,0 mm3
r (t) = fungsi pengobatan interleukin 𝑐1𝑡𝑒 −𝑐2𝑡 /ℎ𝑎𝑟𝑖
c1 dan c2 = parameter pengobatan variabel yang dapat diubah-ubah
Pada tahap bebas penyakit 𝑇 =𝑠𝜇1 dan V = 0 Kemudian, hal ini diikuti oleh tingkat bebas penyakit dalam keadaan stabil saat 𝑔 < 𝑐𝑏2𝑇. Jika ketidaksamaan merupakan kebalikannya, maka populasi virus akan selalu berkembang dari level rata-rata yang sangat kecil sampai level yang tidak dapat dihindarkan oleh sel T CD4+. Ketidaksamaan ini termasuk dalam rangka membasmi penyakit atau progresi rata-rata pengobatan penyakit, salah satunya harus cukup dapat menekan semua produksi virus (𝑔), menaikkan jumlah sel T CD4+(T) atau respon imun (c), atau kombinasinya. Nilai parameter dalam tabel 1 digunakan untuk sistem
persaman (1) dan (2) pada tingkat ketidak stabilan V > 0, dan sistem itu mengikuti perilaku waktu t yang meningkat, V(t) meningkat secara eksponensial, T(t)
menurun sampai nol, V’(t) meningkat ke 𝑔 − 𝑐 𝑠1𝑘−𝑠2, T(t) bertemu pada nol, dan
V(t)T(t) bertemu pada 𝑠1−𝑠2
𝑘 , sejak sistem itu tidak bisa stabil pada kesetimbangan positif dalam yang disebabkan oleh kehadiran virus.
Model Immunotherapy
Sitokin adalah protein hormon yang menengahi dua sel imunitas alami dan imunitas khusus. Imuntas alami sering dihasilkan oleh makrofaga/monocytes dalam merespon antigen yang merangsang sel T sebagai bagian dari imun khusus. Kebanyakan sitokin dalam imun khusus dihasilkan oleh limfosit yang diaktifkan.
Interleukin-2 (IL-2) adalah sitokin utama yang bertanggung jawab untuk pengaktifan, pertumbuhan dan diferensiasi limfosit. Interleukin-2 (IL-2) banyak menghasilkan oleh sel T CD4+, sedangkan sel T CD8+ dihasilkan IL-2 dalam jumlah yang sedikit.
IL-2 dalam konsentrasi tinggi dapat merangsang pertumbuhan sel pembunuh alami (NK), dan fungsi dari cytolytic, karena IL-2 menghasilkan limfokinase yang aktif membunuh sel (LAK). IL-2 juga sebagai pengaktif sel T dan makrofaga secara bersama-sama, sehingga seluruh tingkat sel T dan makrofaga dapat meningkat ketika melepaskan sitokin. Dasar pemikiran untuk menggunakan sitokin dalam pengobatan adalah dilihat dari kemampuannya untuk meningkatkan penengah/perantara sel imun.
Ada keterangan/bukti bahwa IL-2 juga mempengaruhi produksi HIV. Hasil efek negatif dari bukti itu menunjukkan bahwa ketika tingkat HIV sudah tinggi, maka jumlah sel T CD4+ dibawah 200/mm3. Pada pasien asimptomatik, IL-2 tidak mendukung replikasi HIV. Ada juga efek samping lain yang bisa dihasilkan dalam penghentian pengobatan, yaitu: sindrom kebocoran pembuluh sebagai efek samping toksik lainnya.
Karena adanya efek pengobatan antivirus dalam kuasi-stabil, maka penggunaan model lain yang secara langsung dapat melibatkan efek dari
pengobatan antivirus pada bagian progresi penyakit [Kirschner, 1997a. Kirschner, 1997b].
Model lain yang memasukkan IL-2 dalam penelitian ini dinyatakan dengan persamaan: 𝑑𝑇(𝑡) 𝑑𝑡 = 𝑠1− 𝑠2𝑉(𝑡) 𝑏1+𝑉(𝑡)− 𝜇𝑇 𝑡 − 𝑘𝑉 𝑡 𝑇 𝑡 + 𝑟 𝑡 𝑇(𝑡), (3) 𝑑𝑉 (𝑡)𝑑𝑡 = 𝑏𝑔𝑉(𝑡) 2+𝑉(𝑡)− 𝑐𝑉 𝑡 𝑇 𝑡 (4)
Persamaan (3) mengasumsikan perbaikan peningkatan dari sistem imun (kekebalan tubuh), karena IL-2 dapat meningkatkan sel T CD4+ yang berbanding dengan populasi sel rata-rata 𝑟 𝑡 = 𝑐1𝑡𝑒 −𝑐2𝑡 /hari, dimana t adalah nol saat
awal dari setiap siklus. Pemilihan persamaan r(t) itu diasumsikan bahwa kerusakan obat terjadi secara ekponensial, tetapi efeknya tidak secara spontan. Parameter c1 dan c2 berkurang, karena siklus yang berturut-turut.
METODOLOGI PENELITIAN
Waktu Dan Tempat Penelitian
Penelitian dilakukan di Laboratorium Fisika Teori, Departemen Fisika, Institut Pertanian Bogor di mulai pada bulan Juli 2009 sampai dengan bulan Febuari 2010. Kegiatan meliputi penelitian pendahuluan, pembuatan program, analisis output, pengolahan data dan penyusunan laporan.
Peralatan
Peralatan yang digunakan dalam penelitian ini adalah berupa komputer AMD Turion X2 Dual-Core (U405D), 4,00 GB of RAM. Software yang digunakan untuk proses komputasi adalah bahasa pemprogaman Matlab R2008b
dari Mathwork, Inc. Untuk mendukung penelitian ini sumber referensi yang digunakan selain buku (literature) juga berbagai informasi yang di peroleh dari internet yang diakses dari Laboratorium.
Studi Pustaka
Studi pustaka diperlukan untuk mengetahui sejauh mana perkembangan yang telah dicapai dalam bidang yang diteliti.
Pembuatan Program
Pembuatan program dengan bahasa pemrograman Matlab R2008b diperlukan untuk memudahkan perhitungan secara numerik dan juga memudahkan dalam pembuatan grafik solusi persamaan baik ruang fasa maupun laju perubahan populasi pada model infeksi HIV-1 yang dibuat.
Analisis Output
Analisis output diperlukan untuk menguji apakah output yang didapat sesuai dengan teori yang ada dalam literatur. Sistematika penelitian secara lengkap dapat di lihat pada Lampiran 1.
HASIL DAN PEMBAHASAN
Dinamika Progresi Penyakit HIV
Validasi model dengan dengan data eksperimen.
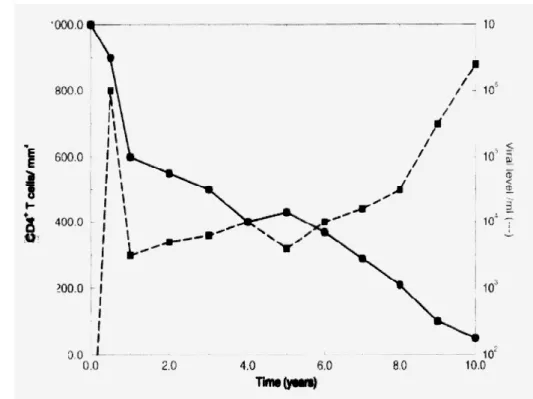
Untuk lebih memahami tipekal dinamika dari progresi penyakit HIV, dalam individu yang tidak diobati, kami perlihatkan dalam Gambar 1.
Gambar 1. Tipe dinamika dari individu yang terinfeksi HIV dari data eksperimen. Data ini diambil dari [Pennisi dan Cohen, 1996].
Dalam gambaran ini sel T CD4+ dinyatakan turun secara linier kira-kira dari 1000/mm3 ke 0/mm3 selama 10 tahun. Pada waktu yang sama berangsur-angsur ada kenaikan dalam jumlah virus selama tahap asimptomatik dari penyakit dan kemudian meningkat cepat pada beberapa golongan dan berlanjut pada tahap selanjutnya yaitu AIDS.
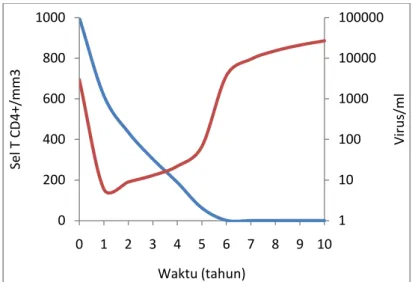
Dengan menggunakan sofware Matlab R2008b melalui solusi numerik dari persamaan (1) dan (2), dengan mensubstitusikan nilai-nilai parameter yang ada pada Tabel 1 maka diperoleh grafik dinamika progresi penyakit HIV dari individu yang tidak diobati pada Gambar 2 dibawah ini
Gambar 2. Progresi penyakit dari individu yang tidak diobati. Simulasi numerik dari model persamaan (1) – (2) dengan nilai parameter dari Tabel 1. Gambar 2 diatas memperlihatkan grafik hubungan antara populasi sel T CD4+(T)
dan populasi virus (V) terhadap waktu (t). Dimana pola yang diberikan sama dengan grafik pada Gambar 1 yang dihasilkan dari data yang diambil dari [Pennisi dan Cohen, 1996]. Penanda dari progresi penyakit HIV yaitu sel T CD4+ mengalami penurunan secara linier selama 6 tahun dari jumlah 1000 mm3 ke 0 mm3 dan jumlah populasi virus terus meningkat sampai tak terhingga.
Solusi numerik untuk Immunotherapy Terapi suntik subkutan
Untuk terapi dengan cara suntik subkutan kami menggunakan dosis
interleukin-2 yang berbeda-beda pada jumlah awal sel T CD4+ dan jumlah awal virus yang sama dalam jangka waktu yang terbatas (selama 360 hari), disini kami mempelajari prediksi dari model persamaan (3) dan (4) dengan menggunakan solusi numerik, untuk melihat efek dan dosis yang tepat dari immunotherapy
dengan menggunakan interleukin-2 pada penyakit HIV.
Prediksi Immunotherapy dosis rendah
Melalui solusi numerik dengan menggunkan software Matlab R2008b, yang dilakukan dengan cara mensubstitusikan nilai-nilai parameter yang terdapat pada Tabel 1 ke dalam persamaan (3) dan (4), sehingga diperoleh grafik hubungan antara populasi sel T CD4+ (T) dan populasi virus (V) terhadap waktu (t)
1 10 100 1000 10000 100000 0 200 400 600 800 1000 0 1 2 3 4 5 6 7 8 9 10 Viru s/m l Se l T CD4+ /m m 3 Waktu (tahun)
(a) (b)
Gambar 3. Model terapi subkutan dari IL-2 dengan dosis rendah dimana r(t) = 0.0001. Model persamaan (3) dan (4) dibandingkan dengan data dari [Jacobson, 1996]. (a) untuk sel T CD4+ dan (b) untuk virus.
Gambar 3 di atas menunjukkan perubahan waktu untuk jumlah sel T CD4+(T) dan jumlah populasi virus (V). Jika dosis IL-2 yang diberikan terlalu rendah dengan jumlah sel T CD4+ (T) awal adalah 347 mm3 dan jumlah populasi virus (V) awal adalah 8547 ml, karena V(0) > 0 dan dengan menghitung nilai 𝑔 < 𝑐𝑏2𝑇, dimana
T adalah jumlah sel T CD4+ pada akhir terapi, maka sistem dalam keadaan tidak stabil yang berarti akan terus menurunkan jumlah sel T CD4+ pada level AIDS dan jumlah virus akan terus meningkat. Dengan dosis IL-2 r(t) = 0.0001 terjadi kenaikan dalam jumlah virus yang cukup tajam yaitu sebesar 5079 ml selama 6 bulan dengan peningkatan rata-rata tiap bulannya sebesar 846.5 ml. Sedangkan untuk jumlah sel T CD4+ selama 6 bulan mengalami penurunan sebesar 54 mm3 dengan rata-rata penurunan untuk tiap bulannya adalah 9 mm3 dan akan mencapai level AIDS (timbulnya infeksi oportunistik) pada saat jumlah jumlah sel TCD4+ < 200 mm3 pada saat t = 501 hari.
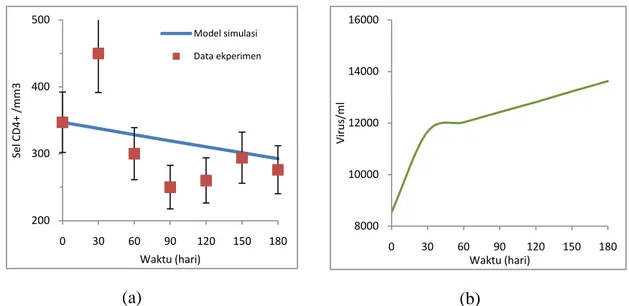
Prediksi Immunotherapy dosis sedang
Untuk dosis IL-2 sedang melalui solusi numerik dengan menggunakan
software Matlab R2008b, yang dilakukan dengan cara mensubstitusikan nilai-nilai parameter ke dalam persamaan (3) dan (4), diperoleh grafik hubungan antara populasi sel T CD4+ (T) dan populasi virus (V) terhadap waktu (t)
200 300 400 500 0 30 60 90 120 150 180 Se l C D 4+ /m m 3 Waktu (hari) Model simulasi Data ekperimen 8000 10000 12000 14000 16000 0 30 60 90 120 150 180 Vi rus /m l Waktu (hari)
(a) (b)
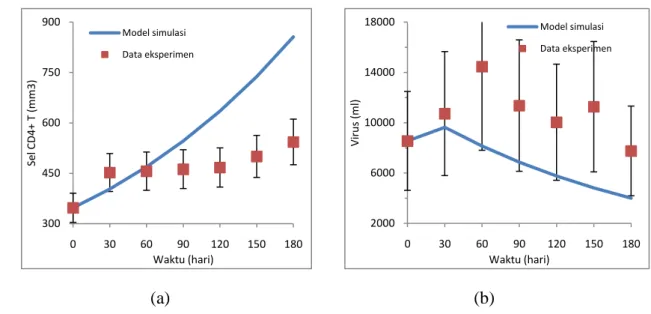
Gambar 4. Model terapi subkutan IL-2 dengan dosis sedang dimana r(t) = 0.003. Model persamaan (3) - (4) dibandingkan dengan data dari [Jacobson, 1996]. (a) untuk sel T CD4+ dan (b) untuk virus.
Dari gambar 4 di atas menunjukkan perubahan waktu terhadap jumlah sel T CD4+ (T) dan jumlah populasi virus (V). Dengan jumlah sel T CD4+(T) awal dan jumlah populasi virus (V) awal adalah sama dengan jumlah yang diberikan pada terapi dosis rendah, karena adanya populasi virus maka sistem dalam keadaan tidak stabil yang berarti akan terus menurunkan jumlah sel T CD4+ dan jumlah virus akan terus meningkat. Dengan menggunakan dosis IL-2 r(t) = 0.003 terjadi kenaikan jumlah sel T CD4+ selama 6 bulan, untuk data eksperimen rata-rata kenaikan untuk tiap bulannya adalah 33 mm3, sedangkan untuk model simulasi rata-rata kenaikan tiap bulannya adalah 26 mm3 dan akan mencapai jumlah normal (jumlah sel T CD4+ < 1000) pada saat t = 530 hari. Sedangkan jumlah populasi virus mengalami penurunan rata-rata tiap bulannya untuk data eksperimen adalah 132 ml sedangkan untuk model simulasi penurunan tiap bulannya adalah 161.58 ml.
Prediksi Immunotherapy dosis tinggi
Pada dosis IL-2 tinggi melalui solusi numerik dengan menggunakan
software Matlab R2008b, dengan cara mensubstitusikan nilai-nilai parameter ke dalam persamaan (3) dan (4), diperoleh grafik hubungan antara populasi sel T CD4+ (T) dan populasi virus (V) terhadap waktu (t) yang dapat dilihat pada Gambar 5. 250 350 450 550 650 0 30 60 90 120 150 180 Se l C D 4+ T ( m m 3) Waktu (hari) Model simulasi Data eksperimen 2000 6000 10000 14000 18000 22000 0 30 60 90 120 150 180 Vi rus ( m l) Waktu(hari) Model simulasi Data eksperimen
Gambar 5 di bawah menunjukkan perubahan waktu terhadap jumlah sel T CD4+ (T) dan jumlah populasi virus (V). Jumlah populasi sel T CD4+ (T) awal dan jumlah populasi virus (V) awal adalah sama dengan yang digunakan pada terapi dosis rendah, karena (V) > 0 maka sistem dalam keadaan tidak stabil yang berarti dalam jangka waktu yang lama akan terjadi penurunan jumlah sel T CD4+ dan jumlah virus akan terus meningkat. Dengan menggunakan dosis IL-2 r(t) = 0.006 terjadi kenaikan jumlah sel T CD4+ yang cukup besar selama 6 bulan dengan rata-rata kenaikan untuk tiap bulannya adalah 84.92 ml. Nilai yang cukup besar jika dibandingkan dengan data eksperimen yang rata-rata perbulannya adalah sebesar 33 ml.
Terapi dengan menggunakan dosis IL-2 yang cukup tinggi memang efektif meningkatkan jumlah populasi sel T CD4+, tetapi penggunaan IL-2 dengan dosis tinggi dapat menimbulkan efek samping yang sangat toksik/beracun terhadap individu tertentu [Jacobson, 1996a].
(a) (b)
Gambar 5. Model terapi subkutan IL-2 dengan dosis tinggi dimana r(t) = 0.006. Model persamaan (3) dan (4) dibandingkan dengan data dari [Jacobson, 1996]. (a) untuk sel T CD4+ dan (b) untuk virus.
Terapi infus intravena
Dalam [Kovacs, 1996] 31 pasien yang terinfeksi HIV di terapi IL-2 dengan cara intravena melalui 6 siklus dengan setiap siklus terdiri atas 5 hari dengan interval setiap siklus adalah dua bulan. Pasien mempunyai sel T CD4+ dengan jumlah rata-rata 427/mm3 (dengan rentang 188 sampai 753/mm3) pada awal
300 450 600 750 900 0 30 60 90 120 150 180 Se l C D 4+ T ( m m 3) Waktu (hari) Model simulasi Data eksperimen 2000 6000 10000 14000 18000 0 30 60 90 120 150 180 Vi rus ( m l) Waktu (hari) Model simulasi Data eksperimen
pengobatan. Rata-rata jumlah virus pada awal pengobatan untuk semua pasien adalah 39 x 103/ml (dengan rentang 9 x 103 – 19.1 x 104/ml). Rata-rata level dosis per siklus menurun dari 76 juta IU untuk siklus pertama menjadi 39 juta IU untuk siklus ke 6. Perubahan jumlah sel T CD4+ dan jumlah virus setelah diberi terapi dilihat selama 12 bulan.
Data dari [Kovacs, 1996] dan simulasi dari persamaan (3) dan (4) diberikan dalam Gambar 6. Dalam simulasi, parameter pengobatan dipilih dari hubungan karakteristik pada pasien dalam [Kovacs, 1996] selama terapi imun. Dalam Gambar 6 memperlihatkan perubahan waktu terhadap jumlah sel T CD4+ selama diberi terapi. Rata-rata kenaikan jumlah sel T CD4+ untuk tiap bulannya pada model simulasi adalah 41.58 mm3 dan 40.75 mm3 untuk data eksperimen. Jumlah sel T CD4+ mencapai jumlah normal pada saat t = 300 hari, tetapi setelah hari ke 330 jumlah sel T CD4+ perlahan-lahan mengalami penurunan lagi. Jumlah virus tidak berubah banyak selama pengobatan dilihat dalam data [Kovacs, 1996], dan model memprediksikan muatan virus akan sedikit menurun selama dilakukannya terapi.
Gambar 6. Terapi IL-2 dengan cara intravena. Model persamaan (3)–(4) dibandingkan dengan data dari [Kovacs, 1996]. Terapi diberikan selama 6 siklus dengan interval dua bulan. Fungsi pengobatan adalah
r (t) = 𝑐1𝑡𝑒 −𝑐2𝑡 , dimana c
1 dan c2 berbeda untuk 6 siklus, dimulai dengan dosis besar dan berakhir dengan dosis kecil. Siklus 1: c1 = 0.08, c2 = 0.4 ; siklus 2: c1 = 0.05, c2 = 0.4 ; siklus 3: c1 = 0.04, c2 = 0.4 ; siklus 4: c1 = 0.03, c2 = 0.5 ; siklus 5: c1 = 0.02, c2 = 0.5 ; siklus 6: c1 = 0.02, c2 = 0.5.
Dalam Gambar 7 kami memberikan simulasi lain dari model persamaan (3) dan (4) dengan menggunakan nilai parameter yang ada dalam Tabel 1, tetapi dengan jumlah sel T CD4+ awal adalah 100/mm3. Dalam simulasi ini, ketika
200 400 600 800 1000 1200 0 30 60 90 120 150 180 210 240 270 300 330 360 C D 4+ T Waktu (hari) Model simulasi Data eksperimen
pengobatan di mulai terlambat (penyakit HIV sudah dalam tingkat simptomatik), kami memberikan terapi IL-2 dengan dosis yang tidak berkurang terlalu banyak (menggunakan dosis besar). Dengan menggunakan dosis yang ada pada Gambar 7, terjadi kenaikan yang cukup signifikan dalam jumlah sel T CD4+ dengan rata-rata kenaikan tiap bulannya adalah 50.25 mm3. Jumlah sel T CD4+ melebihi batas tingkat simptomatik pada saat t = 90 hari.
Gambar 7. Terapi IL-2 dengan cara intravena. Pengobatan dengan model persamaan (3)-(4) dimana jumlah sel T CD4+ awal sangat rendah (tahap simptomatik). Menggunakan dosis yang tidak terlalu berbeda. siklus 1: c1 = 0.08, c2 = 0.4 ; siklus 2: c1 = 0.08, c2 = 0.4 ; siklus 3: c1 = 0.08, c2 = 0.4 ; siklus 4: c1 = 0.05, c2 = 0.4 ; siklus 5: c1 = 0.05, c2 = 0.4 ; siklus 6: c1 = 0.05, c2 = 0.4.
Prediksi Immunotherapy yang gagal
Terapi pada penyakit HIV yang dilakukan dengan cara immunotherapy
menggunakan IL-2 memang dapat meningkatkan jumlah populasi sel T CD4+ dan replikasi virus dapat ditekan atau bahkan berkurang. Tetapi jika pemberian terapi sudah pada tahap simptomatik dengan jumlah awal sel T CD4+ < 200 mm3 maka pemberian terapi dengan IL-2 dengan menggunakan dosis berapa pun tidak akan meningkatkan jumlah sel T CD4+ [kovacs, 1996] bahkan immunologi mengalami penurunan selama terapi [Pahwa, 1998], baik itu terapi dengan cara subkutan maupun dengan cara infus intravena.
Hasil prediksi dengan menggunakan model simulasi dari persamaan (3)–(4) menghasilkan grafik pada Gambar 8 di bawah ini. Gambar 8(a) memperlihatkan terapi subkutan dengan menggunakan dosis IL-2 rendah r(t) = 0.0001. Terlihat dengan menggunakan dosis rendah jumlah sel T CD4+ terus mengalami
0 200 400 600 800 0 30 60 90 120 150 180 210 240 270 300 330 360 C D 4+ T ( m m 3) Waktu (hari)
penurunan sampai hari ke 180. Pada hari ke 180 jumlah sel T CD4+ mencapai jumlah yang sangat rendah yaitu 30 mm3.
(a)
(b)
(c)
(d)
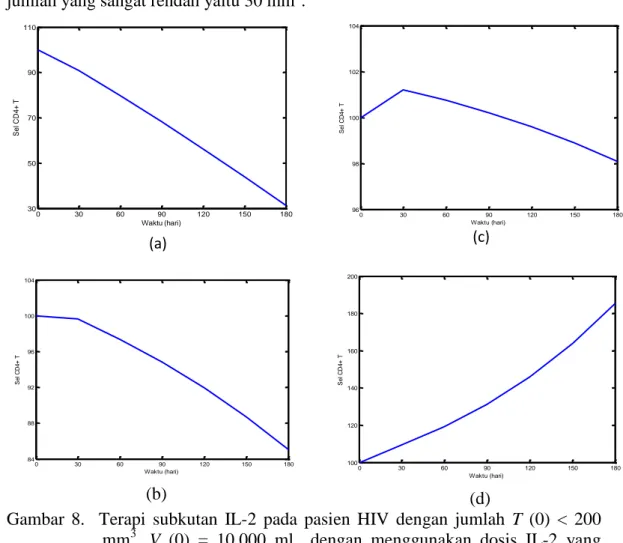
Gambar 8. Terapi subkutan IL-2 pada pasien HIV dengan jumlah T (0) < 200 mm3, V (0) = 10.000 ml dengan menggunakan dosis IL-2 yang berbeda. (a) r(t) = 0.0001 (b) r(t) = 0.003 (c) r(t) = 0.0035 dan (d)
r(t) = 0.006.
Gambar 8(b) memperlihatkan terapi subkutan dengan menggunakan dosis IL-2 sedang r(t) = 0.003. Terlihat dengan menggunakan dosis sedang jumlah sel T CD4+ dapat bertahan selama 30 hari tanpa mengalami penurunan, tetapi setelah hari ke 31 jumlah sel T CD4+ terus mengalami penurunan sampai hari ke 180. Pada hari ke 180 jumlah sel T CD4+ mencapai jumlah 85 mm3. Gambar 8(c) memperlihatkan terapi subkutan dengan menggunakan dosis IL-2 optimal r(t) = 0.0035. Terlihat dengan menggunakan dosis optimal jumlah sel T CD4+ mengalami peningkatan selama 30 hari, tetapi setelah hari ke 31 jumlah sel T CD4+ terus mengalami sedikit penurunan sampai hari ke 180. Pada hari ke 180 jumlah sel T CD4+ mencapai jumlah 98 mm3. Melalui terapi subkutan dengan menggunakan dosis IL-2 tinggi r(t) = 0.006, Gambar 8(d) memang terlihat
0 30 60 90 120 150 180 30 50 70 90 110 Waktu (hari) S e l C D 4 + T 0 30 60 90 120 150 180 84 88 92 96 100 104 Waktu (hari) S e l C D 4 + T 0 30 60 90 120 150 180 96 98 100 102 104 Waktu (hari) S e l C D 4 + T 0 30 60 90 120 150 180 100 120 140 160 180 200 Waktu (hari) S e l C D 4 + T
peningkatan jumlah populasi sel T CD4+, tetapi kenaikannya sangat sedikit sekali bahkan terapi selama 180 hari tidak bisa menaikkan jumlah sel T CD4+ lebih dari 200 mm3. Sedangkan untuk populasi virus mengalami peningkatan.
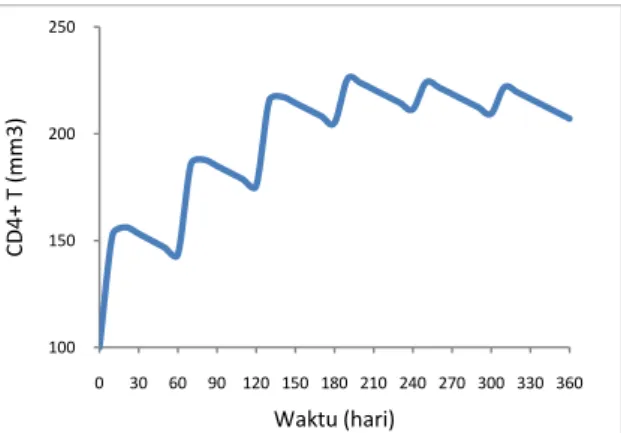
Dalam Gambar 9 kami memberikan simulasi lain dari model persamaan (3) dan (4) dengan menggunakan nilai parameter yang ada dalam Tabel 1, tetapi dengan jumlah sel T CD4+ awal adalah 100/mm3. Dalam simulasi ini, ketika pengobatan di mulai terlambat (penyakit HIV sudah dalam tingkat simptomatik), terapi IL-2 secara infus intravena yang diberikan dengan dosis yang sama pada Gambar 6 tidak akan memberikan hasil yang signifikan. Walaupun jumlah sel T CD4+ mengalami kenaikan tetapi selama 360 hari diberikan terapi jumlah sel T CD4+ tidak bisa melebihi batas tahap penyakit oportunistik (>200 mm3).
Gambar 9. Terapi IL-2 dengan cara intravena. Pengobatan dengan model persamaan (3)-(4) dimana jumlah sel CD4+ T awal rendah (tahap simptomatik). Menggunakan dosis yang sama dengan yang diberikan pada Gambar 6.
Prediksi Immunotherapy optimal
Immunotherapy dengan menggunakan IL-2 pada infeksi HIV memang dapat meningkatkan jumlah sel T CD4+, baik itu dengan cara suntik subkutan maupun melalui cara infus intravena. Tetapi terapi yang optimal bukan hanya bisa menaikkan jumlah sel T CD4+, tapi juga harus bisa menekan replikasi virus dan bersifat tidak toksis [Pahwa, 1998]. Dari data [Pahwa, 1998] terapi dengan cara suntik subkutan lebih aman digunakan dibandingkan dengan cara infus intravena, karena efek samping yang ditimbulkan bisa lebih ditoleransi dibandingkan cara infus intravena. Dengan dosis 187.500 IU – 250.000 IU/m2/hari dari
100 150 200 250 0 30 60 90 120 150 180 210 240 270 300 330 360 C D 4+ T ( m m 3) Waktu (hari)
[Jacobson,1996] merupakan dosis yang tidak menimbulkan replikasi virus dan bersifat tidak toksik/beracun.
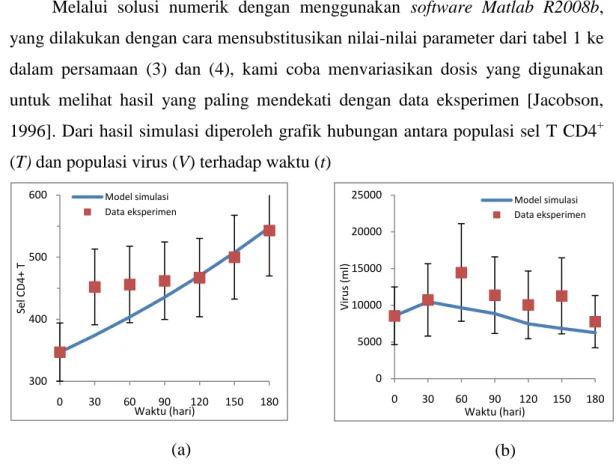
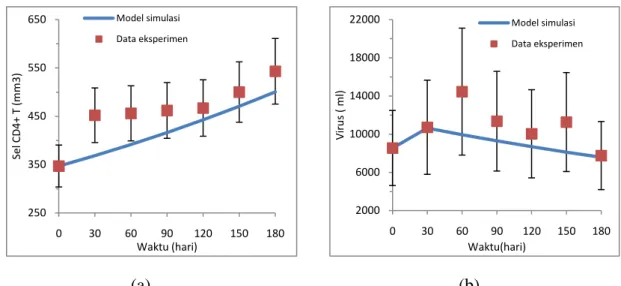
Melalui solusi numerik dengan menggunakan software Matlab R2008b, yang dilakukan dengan cara mensubstitusikan nilai-nilai parameter dari tabel 1 ke dalam persamaan (3) dan (4), kami coba menvariasikan dosis yang digunakan untuk melihat hasil yang paling mendekati dengan data eksperimen [Jacobson, 1996]. Dari hasil simulasi diperoleh grafik hubungan antara populasi sel T CD4+ (T) dan populasi virus (V) terhadap waktu (t)
(a) (b)
Gambar 10. Terapi subkutan IL-2 yang optimal dengan jumlah T (0) < 347 mm3,
V (0) = 39000 ml dengan menggunakan dosis IL-2 r(t) = 0.0035.
Dengan dosis IL-2 r(t) = 0.0035, populasi sel T CD4+ meningkat cepat, pada t = 180 hari mencapai 547.9741 mm3 dengan rata-rata kenaikan jumlah sel T CD4+ untuk tiap bulannya adalah 33.4956 mm3 dan populasi virus HIV pada t = 30 hari mengalami kenaikan dan mulai menurun setelah hari ke 30. Dan jika terapi dilanjutkan maka pada t = 450 hari jumlah populasi sel T CD4+ akan mencapai jumlah normal dalam darah yaitu sebesar 1000 mm3.
300 400 500 600 0 30 60 90 120 150 180 Se l C D 4+ T Waktu (hari) Model simulasi Data eksperimen 0 5000 10000 15000 20000 25000 0 30 60 90 120 150 180 Vi rus ( m l) Waktu (hari) Model simulasi Data eksperimen
KESIMPULAN
Berdasarkan model immunotherapy pada infeksi HIV yang kami sajikan dan dengan pemahaman berbagai aspek efek terapi, maka dapat diambil kesimpulan bahwa:
1. Dari model dapat dilihat dinamika progresi penyakit HIV, nilai dari penurunan jumlah sel T CD4+ sampai batas nol dan peningkatan jumlah virus ke nilai yang tak terhingga dalam kurun waktu kurang lebih 6 tahun dari “set point” yang ditetapkan.
2. Immunotherapy dengan menggunakan interleukin-2 dapat meningkatkan jumlah sel T CD4+, tetapi tidak bisa mengurangi jumlah virus HIV sampai nol (habis), jadi hanya dapat memperlambat penyakit HIV ke tingkatan oportunistik.
3. Dosis interleukin-2 yang optimal antara adalah dosis yang dapat meningkatkan jumlah sel T CD4+ secara signifikan, tetapi bersifat tidak toksik/beracun dan tidak meningkatkan replikasi virus.
4. Immunotherapy dengan interleukin-2 dapat digabung dengan terapi/pengobatan lainnya untuk menghindari mutasi dan resistansi dari virus HIV.
5. Cara pemberian dosis, jumlah dosis yang di berikan dan jumlah sel T CD4+ awal dimulai terapi adalah hal utama yang menentukan hasil terapi yang optimal.
DAFTAR PUSTAKA
Abbas A. K., Lichtman A. H. and Pober J. S., 1994. Cellular and Molecular Immunology. WB Saunders Publ. Co., Philadelphia.
Cavert W., Notermans D.W., Staskus K. et al., 1997. Kineticsof respone in lymphoid tissues to antiretroviral therapy of HIV-1 infection. Science 276, 960-964.
Haase A. T., Henry K., Zupancic M. et al., 1996. Quantitative image analysis of HIV-1 infection in lymphoid tissue. Science 274, 985-989.
Jacobson E. L, Pilaro F. Smith. K. A, 1996. Rational IL-2 therapy for HIV positive individuals: daily low doses enchance immune function without toxicity. Proc. Natl. Acad. Sci USA 93, 10405-10410.
Kirschner D.,Webb G. F., 1996. A model for treatment strategy in the chemotherapy of AIDS. Bull. Math. Biol. 58 (2), 367-391.
Kirschner D.,Webb G. F., 1997a. A mathematical model of combined drug therapy of HIV infection. J. Theor. Med. 1, 25-34.
Kirschner D.,Webb G. F., 1997b. Understanding drug resistence for monotherapy treatment of HIV infection. Bull. Math. Biol. 59 (4), 763-783.
Kirschner D.,Webb G. F., 1998. Immunotherapy of HIV-1 infection. J. Biological Systems. 6, 71-83.
Kovacs J. A.,Vogel S.,Albert J. M., et al., 1996. Controlled trial of IL-2 infusions in patients infected with HIV. New Eng. J. Med. 335, 1350-1356.
Lafeuillade A., Poggi C., Profizi N. et al., 1996. Human immunodeficiency virus type 1 in lymph nodes compared with plasma. J. Infec. Dis. 174, 404-407. Pahwa S., Morales M., 1998. Interleukin-2 therapy in HIV infection. AIDS Patient
Care. 12 (3), 187-197.
Pennisi E. and Cohen J., 1996. Eradicating HIV from a patient: not just a dream?.
Lampiran 2 Sintak plot grafik dari simulasi Progresi HIV-1
Dengan menggunakan persamaan (1) dan (2) berikut akan dibuat solusi grafik dengan menggunakan sofware Matlab R2008b.
𝑑𝑇(𝑡) 𝑑𝑡 = 𝑠1− 𝑠2𝑉(𝑡) 𝑏1+ 𝑉(𝑡)− 𝜇𝑇 𝑡 − 𝑘𝑉 𝑡 𝑇 𝑡 , 𝑑𝑉(𝑡) 𝑑𝑡 = 𝑔𝑉(𝑡) 𝑏2+ 𝑉(𝑡)− 𝑐𝑉 𝑡 𝑇 𝑡
dengan nilai variabel dan parameter yang digunakan terdapat pada Tabel 1.
% Progresi HIV % Rosidah
% Biofisika – IPB 2010
function dydt = Progresi HIV (t,y) dydt = zeros (size(y));
T = 1000; % uninfected sel T CD4 population V = 1000000; % HIV population
s1 = 730; % source/production of sel T CD4 s2 = 547.5; % source/production of sel T CD4 b1 = 14.0; % half saturation constant
b2 = 1.0;% half saturation constant
μ = 0.73;% death rate of uninfected sel T CD4 population k = 0.09125;% rate sel T CD4 becomes infected by free virus V g = 10950;% input rate of external viral source
c = 2.555;% loss rate of virus; T = y(1);
V = y(2);
dydt(1)=s1-(s2*V)/(b1+V)-μ*T-k*V*T; dydt(2)=(g*V)/(b2+V)-c*V*T;
Lampiran 3 Sintak plot grafik dari simulasi terapi suntik subkutan
Dengan menggunakan persamaan (3) dan (4) berikut akan dibuat solusi grafik dengan menggunakan sofware Matlab R2008b.
𝑑𝑇(𝑡)𝑑𝑡 = 𝑠1− 𝑠2𝑉(𝑡) 𝑏1+𝑉(𝑡)− 𝜇𝑇 𝑡 − 𝑘𝑉 𝑡 𝑇 𝑡 + 𝑟 𝑡 𝑇(𝑡), 𝑑𝑉 (𝑡) 𝑑𝑡 = 𝑔𝑉(𝑡) 𝑏2+𝑉(𝑡)− 𝑐𝑉 𝑡 𝑇 𝑡
dengan nilai variabel dan parameter yang digunakan terdapat pada Tabel 1 dan menggunakan dosis IL-2 yang berbeda-beda.
% Terapi Subkutan dosis rendah % Rosidah
% Biofisika – IPB 2010
function dydt = suntik subkutan (t,y) dydt = zeros (size(y));
% T = 1000; % uninfected sel T CD4 population % V = 1000000; % HIV population
s1 = 2.0; % source/production of sel T CD4 s2 = 1.5; % source/production of sel T CD4 b1 = 14.0; % half saturation constant b2 = 1.0;% half saturation constant
μ = 0.002;% death rate of uninfected sel T CD4 population k = 0.00025;% rate sel T CD4 becomes infected by free virus V g = 30;% input rateof external viral source
c = 0.007;% loss rate of virus; r = 0.0001;% doses injection IL2 T = y(1);
V = y(2);
dydt(1)=s1-(s2*V)/(b1+V)-μ*T-k*V*T+r*T; dydt(2)=(g*V)/(b2+V)-c*V*T;
Lampiran 4 Sintak plot grafik dari simulasi terapi infus intravena
Dengan menggunakan persamaan (3) dan (4) berikut akan dibuat solusi grafik dengan menggunakan sofware Matlab R2008b.
𝑑𝑇(𝑡)𝑑𝑡 = 𝑠1− 𝑠2𝑉(𝑡) 𝑏1+𝑉(𝑡)− 𝜇𝑇 𝑡 − 𝑘𝑉 𝑡 𝑇 𝑡 + 𝑟 𝑡 𝑇(𝑡), 𝑑𝑉 (𝑡) 𝑑𝑡 = 𝑔𝑉(𝑡) 𝑏2+𝑉(𝑡)− 𝑐𝑉 𝑡 𝑇 𝑡
dengan nilai variabel dan parameter yang digunakan terdapat pada Tabel 1 dan menggunakan nilai c1 dan c2 yang berbeda-beda untuk tiap siklusnya.
% Terapi intravena siklus 1 % Rosidah
% Biofisika – IPB 2010
function dydt = Infus Intravena (t,y) dydt = zeros (size(y));
% T = 1000; % uninfected sel T CD4 population % V = 1000000; % HIV population
s1 = 2.0; % source/production of sel T CD4 s2 = 1.5; % source/production of sel T CD4 b1 = 14.0; % half saturation constant b2 = 1.0;% half saturation constant
μ = 0.002;% death rate of uninfected sel T CD4 population k = 0.00025;% rate sel T CD4 becomes infected by free virus V g = 30;% input rateof external viral source
c = 0.007;% loss rate of virus; r = c1*t*exp(-c2*t); c1 = 0.08; c2 = 0.4; T = y(1); V = y(2); dydt(1)= s1-(s2*V)/(b1+V)-μ*T-k*V*T+r*T; dydt(2)=(g*V)/(b2+V)-c*V*T;
![Gambar 6. Terapi IL-2 dengan cara intravena. Model persamaan (3)–(4) dibandingkan dengan data dari [Kovacs, 1996]](https://thumb-ap.123doks.com/thumbv2/123dok/2071697.2694192/31.892.304.626.625.852/gambar-terapi-dengan-intravena-model-persamaan-dibandingkan-kovacs.webp)