VALIDASI METODE DAN PENETAPAN KADAR KUERSETIN TOTAL DALAM DAUN TEH SEGAR (Camellia sinensis O.K), TEH HIJAU DAN
TEH HITAM MENGGUNAKAN METODE
KROMATOGRAFI CAIR KINERJA TINGGI (KCKT) FASE TERBALIK
SKRIPSI
Diajukan untuk Memenuhin Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Farmasi
Oleh :
Anastasia Filipa Veritas da Silva
NIM : 088114060
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
i
VALIDASI METODE DAN PENETAPAN KADAR KUERSETIN TOTAL DALAM DAUN TEH SEGAR (Camellia sinensis O.K), TEH HIJAU DAN
TEH HITAM MENGGUNAKAN METODE
KROMATOGRAFI CAIR KINERJA TINGGI (KCKT) FASE TERBALIK
SKRIPSI
Diajukan untuk Memenuhin Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Farmasi
Oleh :
Anastasia Filipa Veritas da Silva
NIM : 088114060
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
iv
HALAMAN PERSEMBAHAN
"Karena itu Aku berkata kepadamu: Janganlah kuatir akan hidupmu, akan apa yang hendak kamu makan atau minum, dan janganlah kuatir pula akan tubuhmu, akan apa yang hendak kamu pakai. Bukankah hidup itu lebih penting dari pada makanan dan tubuh itu lebih penting dari pada pakaian? (Matius 6:25)
Sebab itu janganlah kamu kuatir akan hari besok, karena hari besok mempunyai kesusahannya sendiri. Kesusahan sehari cukuplah untuk sehari." (Matius 6:34)
Serahkanlah segala kekuatiranmu kepada-Nya, sebab Ia yang memelihara kamu. (I Petrus 5:7)
“Aku akan menyertai engkau; Aku tidak akan membiarkan engkau dan tidak akan meninggalkan engkau” (Yos 1:5b)
K upersembahkan karyaku ini untuk :
Papa mama tersayang
K akakku tersayang Advent dan Viany
Adikku tersayang Vano
Sahabat dan teman-temanku
K amu, dia dan mereka
vii
PRAKATA
Puji syukur ke hadirat Tuhan Yesus Kristus atas segala kasih dan
karunianya sehingga penelitian yang berjudul “Validasi Metode dan Penetapan
Kadar Kuersetin Total dalam Daun Teh Segar (Camellia sinensis O.K.), Teh
Hijau, dan Teh Hitam dengan Metode Kromatografi Cair Kinerja Tinggi (KCKT)
Fase Terbalik” dapat terlaksana dengan baik.
Penulis juga mengucapkan terima kasih kepada pihak-pihak yang telah
membantu pelaksanaan penelitian ini:
1. Ipang Djunarko, M. Sc., Apt. selaku Dekan Fakultas Farmasi Sanata
Dharma, Yogyakarta.
2. C. M. Ratna Rini Nastiti, M. Pharm., Apt. selaku Kepala Program Studi
Fakutas Farmasi Sanata Dharma yang telah memberikan ijin penelitian di
dalam lingkungan fakultas farmasi.
3. Prof. Dr. Sri Noegrohati, Apt selaku dosen pembimbing yang telah
memberikan informasi, bimbingan, pengarahan, saran, dan koreksi selama
pelaksanaan penelitian.
4. Dr. Ir. Ngadiman, M. Si selaku dosen pembimbing lapangan atas bimbingan,
saran, dan koreksi selama proses pengambilan sampel.
5. Yohanes Dwiatmaka, M Si dan Dra. M.M. Yetty Tjandrawati, M.Si selaku
dosen penguji atas pengarahan, informasi, saran, dan koreksi selama
pelaksanaan penelitian ini.
6. Mas Bimo, Pak Parlan dan Pak Kethul yang telah banyak membantu selama
viii
7. Semua pihak di PT Pagilaran atas bantuannya dalam proses pengambilan
sampel.
8. Seluruh dosen Fakultas Farmasi Universitas Sanata Dharma yang telah
memberikan ilmu selama masa kuliah.
9. Bapak Sanjaya dan Angelia Puspita, S.Farm, Apt. yang telah banyak
membantu dalam penyusunan skripsi dan sumbangan ilmu yang telah
diberikan selama penulis melakukan penelitian.
10.Gregorius da Silva, Maria Anastasia Iing Susilowati, orang tua yang selalu
memahami dan memberikan motivasi sehingga penulis dapat menyelesaikan
pendidikan sampai menjadi seorang sarjana dengan pribadi yang kuat dan
tegar.
11.Fransiskus Borgias Adventus da Silva, Maria Stella Viany da Silva, dan
Silvester Rosario Valentino da Silva yang selalu memberikan dorongan
semangat dan doa terutama saat kejenuhan datang.
12.Teman seperjuangan Alfonsus Heppy Rosario Dwiyoga, Adi Wirasaputra,
dan Paulus Setya Dharma atas suka duka, bantuan, serta dukungannya selama
ini.
13.Sahabat-sahabat penulis Ayen, Gina, Tia, Paulina, Tiwi, Putri, Arni, Betty ,
Efa, Ida, Vita atas bantuan, semangat, dukungan, dan doanya.
14.Arni, Putri, Betty, Shafiera, Wilda untuk warna-warni pengalaman yang kita
buat dari masa SMF.
15.Teman-teman kelompok antistress Vica, Seco, Dimbek, Usy, Sasa, Ike, Yuni,
ix
16.Teman-teman kost Alma mbak Nia, Tika, Winda, dan Venti atas
keceriaannya dan yang diberikan selama ini.
17.Teman-teman KKN kelompok 19 Anggit, Mas Kresna, Cik Lita, Fany, Sari,
Blesta, Ayu, Gita untuk keceriaan, semangat dan dukungan selama ini.
18.Teman-teman angkatan 2008 khususnya FST A terima kasih atas bantuan,
kenangan, dukungan, dan semua kebersamaan saat kuliah.
19.Kamu, dia, dan mereka yang telah memberikan doa, semangat dan warna
dalam kehidupan penulis.
Penulis menyadari masih terdapat kekurangan dalam penelitian ini. Oleh
karena itu Penulis sangat mengharapkan kritik, saran, dan pendapat dari berbagai
pihak guna penyempurnaan penelitian ini di masa datang. Akhir kata semoga
penelitian ini dapat memberikan manfaat kepada semua pihak. Atas perhatiannya
penulis ucapkan terima kasih.
x
DAFTAR ISI
HALAMAN JUDUL... i
HALAMAN PERSETUJUAN PEMBIMBING... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN... iv
PERNYATAAN KEASLIAN KARYA... v
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA... vi
PRAKATA... vii
C. Keaslian Penelitian... 3
D. Tujuan... 4
E. Manfaat... 4
1. Manfaat Teoritis... 4
2. Manfaat Praktis... 4
xi
A. Kuersetin... 5
B. Teh... 6
1. Keterangan Botani... 6
2. Deskripsi Tanaman... 6
3. Kandungan Kimia... 6
D. Kromatografi Cair Kinerja Tinggi... 17
1. Definisi dan Instrumentasi... 17
2. Analisis Kualitatif dan Kuantitatif... 19
E. Landasan Teori... 19
F. Hipotesis... 21
BAB III METODE PENELITIAN... 22
A. Jenis dan Rancangan Penelitian... 22
B. Variabel Penelitian... 22
C. Definisi Operasional... 22
D. Bahan-bahan Penelitian... 23
xii
F. Tata Cara Penelitian... 23
1. Pengambilan dan Pembuatan Sampel...
2. Penetapan Kadar Air dan Kadar Abu... 24
5. Pembuatan Fase Gerak... 26
6. Pembuatan Larutan Baku Kuersetin... 26
7. Pembuatan Kurva Baku Kuersetin...
8. Penetapan nilai % recovery... 27
27
9. Penetapan Kadar Kuersetin dalam Sampel... 28
G. Analisis Hasil...
BAB IV HASIL DAN PEMBAHASAN...
A. Pengambilan dan Pembuatan Sampel...
B. Penetapan Kadar Air dan Kadar Abu...
C. Ekstraksi dan Hidrolisis...
2. Linearitas dan Limit of Quantitation...
H. Penetapan Kadar Kuersetin dalam Daun Teh Segar, Teh Hijau, dan
xiii
BAB V KESIMPULAN DAN SARAN...
A. Kesimpulan...
B. Saran...
48
48
48
DAFTAR PUSTAKA...
LAMPIRAN...
BIOGRAFI PENULIS...
49
52
xiv
DAFTAR TABEL
Tabel I. Jumlah flavonol teh... 7
Tabel II. Hasil penetapan kadar abu... 32
Tabel III. Hasil penetapan kadar air... 32
Tabel IV. Data peningkatan tinggi peak pada tR Kuersetin... 41
Tabel V. Rata-rata %recovery... 43
Tabel VI. Nilai Koefisien Korelasi... 44
Tabel VII. Nilai Limit of Quantitation (LOQ)... 45
Tabel VIII. Kadar kuersetin dalam daun teh segar, teh hijau dan teh hitam... 46
Tabel IX. Kesalahan random... 47
xv
DAFTAR GAMBAR
Gambar 1. Struktur kuersetin... 5
Gambar 2. Struktur flavonol... 7
Gambar 3. Proses pelayuan... 9
Gambar 4. Proses penggulungan... 9
Gambar 5. Proses pengeringan... 10
Gambar 6. Skematik prosedur SPE... 16
Gambar 7. Peralatan KCKT... 18
Gambar 8. Reaksi hidrolisis dengan HCL... 35
Gambar 9. Kromatogram baku kuersetin dan sampel... 38
Gambar 10. Kromatogram sampel yang telah dispiking... 40
Gambar 11. Gugus polar dan nonpolar kuersetin... 41
xvi
DAFTAR LAMPIRAN
Lampiran 1. Sertifikat analisis kuersetin... 53
Lampiran 2. Surat Determinasi... 54
Lampiran 3. Penimbangan sampel teh segar... 55
Lampiran 4. Penimbangan sampel teh hijau... 56
Lampiran 5. Penimbangan sampel teh hitam... 57
Lampiran 6. Penimbangan kuersetin yang ditambahkan kedalam sampel teh segar dari awal proses... 58
Lampiran 7. Penimbangan kuersetin yang ditambahkan kedalam sampel teh hijau dari awal proses... 58
Lampiran 8. Penimbangan kuersetin yang ditambahkan kedalam sampel teh hitam dari awal proses... 59
Lampiran 9. Penimbangan kuersetin yang ditambahkan kedalam sampel teh segar dari proses clean-up... 60
Lampiran 10. Penimbangan kuersetin yang ditambahkan kedalam sampel teh hijau dari proses clean-up... 61
Lampiran 11. Penimbangan kuersetin yang ditambahkan kedalam sampel teh hitam dari proses clean-up... 61
Lampiran 12. Data kadar air... 62
Lampiran 13. Data kadar abu teh segar... 62
Lampiran 14. Data kadar abu teh hijau... 63
xvii
Lampiran 16. Kromatogram sampel teh segar tanpa adisi... 64
Lampiran 17. Kromatogram sampel teh segar dengan adisi kuersetin
dari awal proses... 67
Lampiran 18. Kromatogram sampel teh segar dengan adisi kuersetin
dari proses clean-up... 71
Lampiran 19. Kromatogram sampel teh hijau tanpa
adisi... 75
Lampiran 20. Kromatogram sampel teh hijau dengan adisi kuersetin
dari awal proses... 78
Lampiran 21. Kromatogram sampel teh hijau dengan adisi kuersetin
dari proses clean-up... 82
Lampiran 22. Kromatogram sampel teh hitam tanpa adisi... 86
Lampiran 23. Kromatogram sampel teh hitam dengan adisi kuersetin
dari awal proses... 88
Lampiran 24. Kromatogram sampel teh hitam dengan adisi kuersetin
dari proses clean-up... 92
Lampiran 25. Data kadar kuersetin teh segar dan contoh perhitungan
kadar kuersetin... 96
Lampiran 26. Data kadar kuersetin teh hijau dan contoh perhitungan
kadar kuersetin... 97
Lampiran 27. Data kadar kuersetin teh hitam dan contoh perhitungan
kadar kuersetin... 99
xviii
kadar kuersetin dalam teh segar... 100
Lampiran 29. Data recovery untuk keseluruhan proses penetapan
kadar kuesetin dalam teh hijau... 101
Lampiran 30. Data recovery untuk keseluruhan proses penetapan
kadar kuesetin dalam teh hitam... 102
Lampiran 31. Data recovery untuk proses clean-up sampel teh
Lampiran 35. Kurva hubungan konsentrasi vs AUC teh hijau untuk
keseluruhan proses... 106
Lampiran 36. Kurva hubungan konsentrasi vs AUC teh hitam untuk
keseluruhan proses... 107
Lampiran 37. Kurva hubungan konsentrasi vs AUC teh segar untuk
proses clean-up... 108
Lampiran 38. Kurva hubungan konsentrasi vs AUC teh hijau untuk
proses clean-up... 108
Lampiran 39. Kurva hubungan konsentrasi vs AUC teh hitam untuk
xix
Lampiran 40. Random error... 109
Lampiran 41. Systematic error... 110
xx
INTISARI
Telah dilakukan penelitian tentang validasi metode dan penetapan kadar kuersetin total dalam daun teh segar, teh hijau dan teh hitam untuk mengetahui kadar kuersetin dalam daun teh segar, teh hijau dn teh hitam.
Ekstraksi dilakukan dengan soxhletasi dilanjutkan proses clean-up yang dilakukan dengan solid phase extraction. Kemudian kuersetin dianalisis dengan metode Kromatografi Cair Kinerja Tinggi (KCKT) Fase Terbalik. Validasi metode dilihat dari parameter % recovery dan penetapan kadar kuersetin total dilakukan berdasarkan analisis data AUC sampel dan kurva baku kuersetin.
Dari penelitian ini diketahui kadar kuersetin dalam teh hijau dan te hitam berturut-turut yakni 1431,8863 µg/g dan 2201,1904 µg/g. Nilai % recovery
keseluruhan proses untuk daun teh segar, teh hijau dan teh hitam berturut-turut yakni 119,79%, 98,57% dan 102,40% dan nilai %recovery untuk proses clean-up
berturut-turut yakni 141,55%, 108,92% dan 135,78%. Berdasarkan hasil tersebut proses clean-up pada daun teh segar dan teh hitam tidak memiliki akurasi yang baik.
xxi
ABSTRACT
Has been done research on validation of analytical procedure and determination of total quercetin in fresh tea leaves, green tea and black tea to determine quercetin in the fresh tea leaves, green tea and black.
Extraction is done by soxhletasi and clean-up process is done by solid phase extraction method. Then analyzed by of High Performance Liquid Chromatography (HPLC) Reversed phase. Seen from the parameter validation method is % recovery and the determination of total quercetin based on AUC data analysis of samples and standard curve of quercetin.
Of this study green tea and black tea containing quercetin total
1431,8863 µg/g and 2201,1904 µg/g. Overall recovery process for fresh tea
leaves, green tea and black tea respectively are 119,79%, 98,57% and 102,40% and recovery for clean-up respectvely are 141,55%, 108,92% and 135,78%. Based on these results the clean-up process for fresh tea leaves and black tea does not have good accuray.
1
BAB I
PENDAHULUAN
A. Latar Belakang
Teh merupakan salah satu minuman yang dekat dengan kehidupan kita
sehari-hari, yang sering dikonsumsi sebagai minuman penyegaran. Tidak hanya
sebagai minuman kesegaran tetapi teh telah lama diyakini khasiatnya bagi
kesehatan tubuh karena kandungan antioksidan di dalamnya. Ada banyak jenis teh
yang diperdagangkan seperti teh wangi, teh hitam dan teh hijau.
Berdasarkan pengolahannya, teh dibedakan menjadi teh hijau dan teh
hitam. Teh hijau dibuat dengan cara non-fermentasi. Pada proses pengolahan
tersebut terjadi inaktivasi enzim oksidase atau fenolase yang ada dalam pucuk
daun teh segar, sehingga oksidasi enzimatik terhadap kandungan fenol dapat
dicegah. Sebaliknya teh hitam dibuat dengan cara fermentasi dengan
memanfaatkan terjadinya oksidasi enzimatik terhadap kandungan polifenol teh.
Di dalam teh terdapat banyak kandungan senyawa aktif yang memiliki
manfaat positif bagi masyarakat. Zat bioaktif yang utama terdapat dalam teh,
adalahgolongan flavonoid. Berdasarkan struktur dan konformasi cincin C molekul
dasarnya, flavonoid dapat digolongkan menjadi 6 kelas, yaitu flavon, flavanon,
isoflavon, flavonol, flavanol dan antosianin. Adapun jenis flavonoid utamayang
ditemukan pada teh adalah flavanol dan flavonol. (Hartoyo, 2003). Flavonol
dalam daun teh terutama kuersetin. Kuersetin dalam tanaman terdapat dalam
Kuersetin memiliki banyak manfaat bagi kesehatan antara lain sebagai
antioksidan, antikanker, antiinflamasi, antiplatelet, dan antihistamin. Menurut
Hartoyo (cit., Septianingrum, dkk 2009) terdapat perbedaan kadar fenol pada teh
hijau dengan teh hitam. Perbedaan ini disebabkan karena terdapat perbedaan
dalam proses pengolahannya. Karena perbedaan inilah maka dilakukan penetapan
kadar kuersetin dalam teh hijau, dan teh hitam untuk mengetahui kadar kuersetin
dalam daun teh segar, teh hijau dan teh hitam serta untuk mengetahui apakah
proses pengeringan memiliki pengaruh terhadap kadar kuersetin.
Saat ini, KCKT merupakan teknik pemisahan yang diterima secara luas
untuk analisis dan pemurnian senyawa tertentu dalam suatu sampel (Gandjar dan
Rohman, 2007). KCKT memiliki kemajuan dalam teknologi kolom, sistem pompa
tekanan tinggi, dan detektor yang sensitif sehingga KCKT menjadi suatu sistem
pemisahan dengan kecepatan dan efisiensi yang tinggi (Direktorat Jenderal
Pengawasan Obat dan Makanan RI, 1995). Metode KCKT bersifat selektif dan
sensitif sehingga cocok digunakan dalam analisis kuantitatif beberapa senyawa
secara simultan (Khopkar, 1990). Kelebihan metode KCKT inilah yang
dimanfaatkan oleh peneliti untuk memisahkan kuersetin dari senyawa-senyawa
yang memiliki kepolaran yang mirip dengan kuersetin di dalam daun teh, teh hijau
B. Rumusan Masalah
Permasalahan yang dapat dirumuskan berdasarkan latar belakang tersebut
yakni berapakah kadar kuersetin dalam daun teh segar, teh hijau dan teh hitam?
C. Keaslian Penelitian
Berbagai penelitian terhadap kuersetin telah banyak dilakukan, mulai dari
proses ekstraksi, isolasi, aktivitas farmakologisnya. Penelitian dengan judul
“HPLC–UV And GC–MS Characterization Of The Flavonol Aglycons Quercetin,
Kaempferol, And Myricetin In Tomato Pastes And Other Tomato-Based Products”
pernah dilakukan untuk mengidentifikasi dan mengkuantifikasi lima flavonoid
dalam tomat (Tokusoglu, 2003). Penetapan kadar flavonoid total terhitung sebagai
kuersetin pernah dilakukan dengan menggunakan metode kolometri dalam teh
hijau dan teh hitam [merk X] (Pertiwi, 2006). Namun penetapan kadar kuersetin
aglikon dalam daun teh segar, teh hijau, dan teh hitam dengan menggunakan
metode kromatografi cair kinerja tinggi (KCKT) fase terbalik belum pernah
D. Tujuan
Mengetahui kadar kuersetin dalam daun teh segar, teh hijau, dan teh hitam.
E. Manfaat 1. Manfaat teoritis
Memberikan informasi mengenai kandungan kuersetin yang memiliki
banyak khasiat dalam tanaman yang telah mengalami pengolahan seperti
proses pengeringan, proses fermentasi.
2. Manfaat praktis
Memberikan informasi mengenai proses penetapan kadar kuersetin
5
BAB II
PENELAAHAN PUSTAKA
A. Kuersetin
Gambar 1. Struktur kuersetin
Kuersetin merupakan senyawa berwarna kuning dan menjadi anhydrat
pada suhu 95 - 97° C. Kuersetin larut dalam asam asetat glasial, dalam larutan
aqueous alkaline dan praktis tidak larut dalam air (The Merck Index, 1989).
Kuersetin memiliki gugus fungsi karbonil dan hidroksil sehingga dapat
membentuk kompleks dengan beberapa ion logam (Makasheva, 2005).Kuersetin
memiliki banyak manfaat bagi kesehatan manusia antara lain antioksidan,
antiinflamasi, antiplatelet, antikanker, antivirus, dan antihistamin (Paulsen, 2003).
Banyak tanaman yang mengandung kuersetin antara lain brokoli, wortel,
bawang merah, bawang putih, paprika, buncis, bunga kol, dan teh (Miean dan
Mohamed, 2000). Kuersetin dalam tanaman terdapat dalam berbagai bentuk
glikosida dan dapat pula bentuk aglikonya (Erlund, 2002). Flavonoid yang secara
umum terdapat sebagai glikosida, jika dihidrolisis dengan asam dalam suasana
B. Teh 1. Keterangan Botani
Menurut Steenis (2002), tanaman teh termasuk dalam famili theaceae dengan
spesies Camellia sinensis O.K.
2. DeskripsiTanaman :
Tanaman teh berbentuk pohon. Tingginya biasanya mencapai belasan
meter. Namun, tanaman teh diperkebunan selalu dipangkas untuk memudahkan
pemetikan sehingga tingginya 70 cm. Mahkota tanaman teh berbentuk jorong atau
agak bulat telur terbalik. Tepi daun bergerigi, daun tunggal dan letaknya hampir
berseling. Tulang daun menyirip, permukaan atas daun muda berbulu halus
sedangkan permukaan bawahnya bulunya hanya sedikit. Permukaan daun tua
halus dan tidak berbulu lagi. Bunga teh berwarna putih dengan serbuk sari
berwarna kuning. Tanaman teh mengalami pertumbuhan tunas yang silih berganti.
Tunas tumbuh pada ketiak atau bekas ketiak daun. Tunas yang tumbuh kemudian
diikuti dengan pembentukan daun. Tunas baru pada teh memiliki daun kuncup
(Nazaruddin dan paimin, 1993).
3. Kandungan Kimia
Daun teh memiliki banyak kandungan senyawa kimia yang merupakan zat
bioaktif. Zat bioaktif yang ada dalam teh, terutama merupakan golongan
flavonoid. Adapun flavonoid yang ditemukan pada teh terutama berupa flavanol
dan flavonol (Hartoyo, 2003). Flavonol utama yang ada di dalam daun teh adalah
bentuk glikosidanya (berikatan dengan molekul gula) dan sedikit dalam bentuk
aglikonnya.
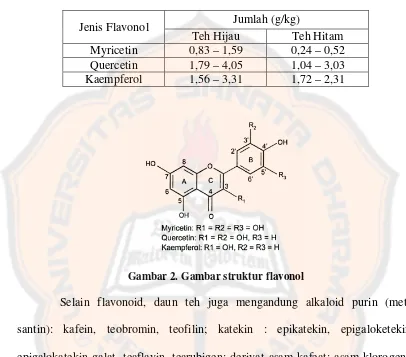
Tabel I. Jumlah Flavonol Teh (Hartoyo, 2003)
Jenis Flavonol Jumlah (g/kg)
Teh Hijau Teh Hitam Myricetin 0,83 – 1,59 0,24 – 0,52 Quercetin 1,79 – 4,05 1,04 – 3,03 Kaempferol 1,56 – 3,31 1,72 – 2,31
Gambar 2. Gambar struktur flavonol
Selain flavonoid, daun teh juga mengandung alkaloid purin (metil
santin): kafein, teobromin, teofilin; katekin : epikatekin, epigaloketekin,
epigalokatekin galat, teaflavin, tearubigen; derivat asam kafeat: asam klorogenat
dan teogalin; minyak atsiri : linalool (Direktorat Jenderal Pengawasan Obat dan
Makanan, 2010).
4. Jenis teh
Ada tiga tipe utama pengolahan teh, yaitu teh hijau, teh oolong, dan teh
hitam. Secara umum teh hijau merupakan teh yang tidak difermentasi, teh oolong
merupakan teh yang mengalami fermentasi sebagian dan teh hitam merupakan teh
a. Teh Hijau.Daun teh di dikeringkan dari daun Camellia sinensis. Teh hijau
dibuat dengan cara menginaktivasi enzim oksidase atau fenolase yang ada dalam
pucuk daun teh segar, dengan cara pemanasan atau penguapan menggunakan uap
panas, sehingga oksidasi enzimatik dapat dicegah. Aktivitas antioksidan teh hijau
enam kali lebih besar dibanding teh hitam (Gruenwald dkk, 2007).
Proses pengolahan teh hijau di kebun PT. PAGILARAN, Samigaluh,
Kulonprogo terdiri dari proses pemetikan, pelayuan, penggulungan, pengeringan,
sortasi dan pengepakan.
1. Pemetikan
Pemetikan adalah pemungutan hasil pucuk tanaman teh yang memenuhi
syarat-syarat pengolahan.Pengambilan pucuk dilakukan dengan sistem p+2
yakni tumbuhnya dua helai daun setelah peko. Proses pemetikan ini
dilakukan jika tanaman sudah berumur 18 bulan karena pada umur ini
dianggap kandungan dalam daun teh sudah optimal.
2. Pelayuan
Pucuk teh yang telah dipetik selanjutnya dilakukan proses pelayuan. Daun teh
yang telah dipetik dilayukan dengan melewatkan daun tersebut pada silinder
panas sekitar 5-8 menit dengan suhu 90-100° C. Tujuan dilakukannya proses
pelayuan yakni untuk menginaktivasi enzim polifenol oksidase yang ada
dalam daun teh itu sendiri, sehingga dapat dicegah terjadinya proses oksidasi
Gambar 3. Proses pelayuan
3. Penggulungan
Pucuk teh yang telah melalui proses pelayuan selanjutnya dilakukan
penggulungan dengan mesin roller press selama 10-14 menit. Lamanya
proses penggulungan ini tergantung dari jenis pucuknya. Proses
penggulungan ini dilakukan untuk memecah sel-sel daun sehingga cairan di
dalam sel keluar di permukaan daun sehingga seduhan teh yang dihasilkan
memiliki rasa yang lebih sepet (Syah, 2006).
4. Pengeringan
Proses ini dilakukan dengan menggunakan alat repeat roll dengan suhu
70-80° C selama 2,5 – 3 jam. Proses pengeringan dilakukan untuk mengurangi
kadar air dalam pucuk teh yang sudah digulung hingga kadar air tersisa
kurang lebih 2%. Selain itu proses pengeringan juga dilakukan untuk
memperkuat bentuk dan aroma dari teh hijau.
Gambar 5. Proses pengeringan
5. Sortasi
Teh yang berasal dari proses pengeringan masih bercampur baik bentuk
maupun ukurannya. Selain itu teh juga masih mengandung debu, tangkai
daun, dan kotoran lain yang akan sangat berpengaruh pada mutu teh nantinya,
sehingga diperlukan proses sortasi. Proses sortasi dilakukan secara manual.
Proses ini dilakukan dengan memisahkan daun teh yang rusak dan tangkai
daunnya.
6. Pengemasan dan pengepakan
Teh Hijau yang telah mengalami sortasi selanjutnya di lakukan proses
b. Teh Hitam. Teh hitam merupakan teh yang berasal dari pucuk daun teh segar
yang dibiarkan sebelum digulung, kemudian daun-daun tersebut dibiarkan selama
beberapa jam sebelum dipanaskan dan dikeringkan. Selama itu, enzim yang
terdapat pada daun-daun teh akan mengkatalisis reaksi oksidasi senyawa-senyawa
yang ada dalam teh sehingga menghasilkan warna, rasa, dan aroma (Hartoyo,
2003).Selama proses oksidasi, adanya enzim pada teh mengubah beberapa
polifenol yang memiliki aktivitas terapetik menjadi senyawa yang kurang aktif
(Gruenwald, 2007).
Proses pengolahan teh hitam di kebun PT. PAGILARAN, Batang terdiri
dari proses pemetikan, pelayuan, penggulungan atau penggilingan , fermentasi,
pengeringan, sortasi dan pengepakan.
1. Pemetikan
Pemetikan adalah pemungutan hasil pucuk tanaman teh yang memenuhi
syarat-syarat pengolahan (Arifin, 2009).
2. Pelayuan
Daun-daun teh yang telah dipetik dari kebun segera dibawa ke pabrik dan
kemudian dimulai proses pelayuan yang dilakukan dalam withering truck
selama 10 – 18 jam. Hal ini dilakukan untuk mengurangi kadar air dari daun
teh serta untuk membantu proses pengeringan agar lebih cepat, serta membuat
daun teh agar lebih lentur dan mudah digulung, sehingga memudahkan proses
penggulungan. Pada proses pelayuan, selama 1 – 2 jam pertama daun teh
yang telah dihamparkan dalam withering truck dialiri dengan udara dingin
(suhu 28° C). Setiap 2 – 3 jam sekali tumpukan daun teh diaduk agar
pelayuan berlangsung sempurna pada setiap petikan daun teh (Haryanto,
2012).
3. Penggulungan dan penggilingan
Proses penggulungan dilakukan dengan menggunakan mesin open top roller
selama ± 40 menit. Tujuan proses penggulungan ini adalah untuk meremas,
menggulung dan merobek sel sehingga cairan didalam sel keluar ke
permukaan daun sehingga air menempel di permukaan. Daun teh yang telah
mengalami tahap sampai tahap penggulungan berwarna hitam
kecoklatan.Kelembapan di ruangan penggulungan ini harus diatur dengan
menggunakan humidifier untuk menghambat proses oksidasi, sehingga proses
oksidasi terjadi dalam waktu yang tepat. Kelembapan diatur sebesar 90 - 95°
dan suhu ruangan 20 - 22° C.Dari hasil penggulungan, selanjutnya
dimasukkan kedalam rotary roll breaker untuk proses pengayakan. Dari
proses ini dihasilkan teh hitam dengan kualitas no. 1. Serbuk yang masih
kasar dimasukkan kembali ke dalam rotorvane untuk dipotong dengan
menggunakan pisau tumpul sehingga cairan yang masih ada dalam sel keluar
ke permukaan.
4. Fermentasi
Proses fermentasi terjadi di ruang oksidasi.Tujuan proses oksidasi ini yakni
untuk menjaga kestabilan dan membentuk rasa asli dari teh hitam. Warna
Ruang oksidasi diatur sedemikian karena pada tahap ini merupakan tahap
pengendali mutu teh hitam yang dihasilkan. Teh hitam didiamkan dalam
ruangan oksidasi selama minimal 2 jam, maksimal 3 jam. Dilakukan selama
2-3 jam karena jika kurang dari 2 jam ataupun lebih dari 3 jam dapat terjadi
kerusakan pada teh hitam.
5. Pengeringan
Tujuan dari proses pengeringan ini adalah untuk mengurangi kadar air hingga
kadar air dalam teh hitam kurang lebih 3%. Proses pengeringan ini dilakukan
selama 22 – 23 menit. Suhu selama proses pengeringan yakni 100 °C pada
waktu dimasukkan ke dalam mesin pengering dan 50 °C pada waktu keluar
dari mesin pengering. Penurunan suhu ini dilakukan agar teh hitam yang
dihasilkan tidak gosong, sehingga hasilnya menjadi tidak baik.
6. Sortasi kering
Proses sortasi ini dilakukan berdasarkan warna, kasar halusnya serbuk teh
hitam yang dihasilkan, berat jenis.
7. Pengepakan
Setelah selesai proses sortasi, dilanjutkan ke tahap pengepakan.
Pada proses pembuatan teh hitam, glikosida kuersetin tidak mengalami
oksidasi, hal ini terjadi karena ketidakmampuan kuersetin untuk mengalami
oksidasi yang mungkin disebabkan karena kelarutan bentuk aglikonnya yang
C. Ekstraksi 1. Ekstrak
Ekstrak adalah sediaan pekat yang diperoleh dengan mengekstraksi zat
aktif dari simplisia nabati atau hewani menggunakan pelarut yang sesuai,
kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang
tersisa diperlakukan sedemikian sehingga memenuhi baku yang telah ditetapkan
(Direktorat Jenderal Pengawasan Obat dan Makanan, 1995).
2. Ekstraksi
Ekstraksi adalah proses pemisahan satu atau lebih komponen dari suatu
campuran homogen menggunakan pelarut cair (solven) sebagai separating agent
(Harborne, 1987).Pemilihan pelarut dan cara ekstraksi yang tepat dapat
dipermudah dengan mengetahui terlebih dahulu zat aktif yang dikandung
simplisia (Direktorat Jenderal Pengawasan Obat dan Makanan, 1986).
3. Soxhlet
Soxhlet adalah ekstraksi menggunakan pelarut yang selalu baru yang
dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinyu dengan jumlah
pelarut relatif konstan dengan adanya pendingin balik. Penyarian dengan
soxhletasi menggunakan larutan yang dipanaskan terus menerus sehingga zat aktif
yang tidak tahan pemanasan kurang cocok (Direktorat Jenderal Pengawasan Obat
4. Cairan Penyari
Senyawa fenolik umumnya diekstraksi menggunakan air, metanol, etanol
aseton, etil asetat maupun kombinasi dari pelarut-pelarut tersebut. Keberadaannya
yang tertempel dengan gula cenderung untuk menyebabkan senyawa fenolik lebih
larut dalam air, dan dengan demikian kombinasi pelarut diatas dengan air cocok
untuk glikosida. Sebaliknya, aglikon yang kurang polar seperti isoflavon,
flavanon, dan flavonol cenderung untuk lebih larut dalam pelarut non-aquaeous
(Escribano dan Santos, 2010).
5. Solid-Phase Extraction
Solid Phase Extraction merupakan alternatif metode yang cepat, mudah,
dan ekonomis karena secara signifikan mngurangi volume pelarut organik yang
dibutuhkan. SPE digunakan untuk mengekstrak senyawa dari cairan matriks dan
dapat juga digunakan sebagai metode pemurnian / fraksinasi(Escribano dan
Santos, 2010).
Keunggulan SPE dibandingkan dengan ekstraksi cair-cair adalah:
a. Proses ekstraksi lebih sempurna
b. Pemisahan analit dari pengganggu yang mungkin ada menjadi lebih efisien
c. Mengurangi pelarut organik yang digunakan
d. Fraksi analit yang diperoleh lebih mudah dikumpulkan (Gandjar dan
Rohman, 2009).
Ada 4 tahap dalam prosedur SPE, yaitu:
a. Pengkondisian. Cartridge (Penjerap) dialiri dengan pelarut sampel untuk
sehingga perubahan-perubahan kimia yang tidak diharapkan ketika sampel
dimasukkan dapat dihindari.
b. Retensi (tertahannya) sampel.Larutan sampel yang dilewatkan ke cartridge
baik untuk menahan analit yang dituju, sementara komponen lain terelusi atau
untuk menahan komponen yang tidak diharapkan sementara analit yang dituju
terelusi.
c. Pembilasan. Tahap ini penting untuk menghilangkan seluruh komponen yang
tidak tertahan oleh penjerap selama tahap retensi.
d. Elusi. Tahap ini merupakan tahap akhir untuk mengambil analit yang dituju
jika analit tersebut tertahan pada penjerap (Rohman, 2009).
Gambar 6. Skematik prosedur SPE
D. Kromatografi Cair Kinerja Tinggi 1. Definisi dan Instrumentasi
Menurut Hendayana (2006), Kromatografi Cair Kinerja Tinggi (KCKT)
diam di bawah aliran fase gerak, dimana fase gerak dialirkan dengan bantuan
tekanan menuju kolom secara cepat dan dideteksi dengan detektor yang sesuai.
Ada dua fase dalam kromatografi yaitu fase normal dan fase terbalik.
Fase normal apabila fase diam lebih polar dari fase gerak, sedangkan fase terbalik
yaitu apabila fase diam lebih non polar dari fase geraknya (Munson, 1991).
Menurut Harris (2011), komposisi pokok dari instrumentasi KCKT yakni
kolom, sistem penghantar pelarut, katup penginjeksian sampel, detektor, dan
perekam atau komputer untuk menampilkan hasil pemisahan.
a. Kolom.Kolom merupakan bagian KCKT yangmana terdapat fase diam untuk
berlangsungnya proses pemisahan solut/analit (Rohman, 2009).
Oktadesil silika (ODS atau C18) merupakan fase diam yang paling
banyak digunakan karena mampu memisahkan senyawa-senyawa dengan
kepolaran yang rendah, sedang, maupun tinggi. Oktil atau rantai alkil yang lebih
pendek lagi lebih sesuai untuk solut yang polar (Rohman, 2009).
Kolom kromatografi dapat dipanaskan untuk mengurangi kekentalan dari
pelarut. Kekentalan pelarut yang berkurang ini mengakibatkan tekanan menurun
atau mempercepat aliran (Harris, 2011).
b. Wadah fase gerak. Wadah fase gerak harus bersih dan lembam (inert). Fase
gerak sebelum digunakan harus dilakukan degassing (penghilangan gas) yang ada
pada fase gerak, sebab adanya gas akan berkumpul dengan komponen lain
terutama di pompa dan detektor sehingga akan mengacaukan analisis. Adanya
pengotor dalam reagen dapat menyebabkan gangguan pada sistem kromatografi.
yang sempit, sehingga dapat mengakibatkan suatu kekosongan pada kolom atau
tabung tersebut. Karenanya, fase gerak sebelum digunakan harus disaring terlebih
dahulu untuk menghindari partikel-partikel kecil ini (Gandjar dan Rohman, 2007).
c. Tempat penyuntikkan sampel.Sampel-sampel cair dan larutan disuntikkan
secara langsung ke dalam fase gerak yang mengalir di bawah tekanan menuju
kolom menggunakan alat penyuntik yang terbuat dari tembaga tahan karat
(Rohman, 2009).
d. Detektor.Idealnya suatu detektor harus mempunyai karakteristik mempunyai
respon terhadap solut yang cepat dan reprodusibel, mempunyai sensitifitas yang
tinggi, stabil dalam pengoperasiannya, signal yang dihasilkan berbanding lurus
dengan konsentrasi solut, tidak peka terhadap perubahan suhu dan kecepatan alir
fase gerak (Gandjar dan Rohman, 2007).
Fase gerak atau eluen biasanya terdiri atas campuran pelarut yang dapat
bercampur yang secara keseluruhan berperan dalam daya elusi dan resolusi. Daya
elusi dan resolusi ini ditentukan oleh polaritas keseluruhan pelarut, polaritas fase
diam, dan sifat komponen–komponen sampel (Gandjar dan Rohman, 2007).
2. Analisis Kualititatif dan Kuantitatif
Analisis kualitatif KCKT berupa pengamatan waktu retensi (tR) senyawa
baku dan senyawa yang tidak diketahui dibandingkan dengan cara kromatografi
(Gandjar dan Rohman, 2007).Masing-masing senyawa memiliki waktu retensi
yang spesifik pada kondisi tertentu seperti kolom, suhu, dan laju sehingga dapat
digunakan sebagai salah satu dasar uji kualitatif (Noergrohati, 1994). Selain itu
analisis kualitatif KCKT juga dilakukan dengan cara spiking. Spiking dilakukan
dengan menambah sampel yang mengandung senyawa tertentu yang akan
diselidiki dengan senyawa baku pada kondisi kromatografi yang sama. Jika pada
puncak tertentu yang diduga mengandung senyawa yang diselidiki terjadi
peningkatan tinggi puncak/luas puncak setelah di-spiking dibandingkan dengan
tinggi puncak /luas puncak yang tidak dilakukan spiking, maka dapat
diidentifikasi bahwa sampel mengandung senyawa yang kita selidiki (Rohman,
2009).
Analisis kuantitatif dengan teknik HPLC didasarkan kepada pengukuran
luas atau area puncak analit dalam kromatogram, dibandingkan dengan luas atau
area larutan standar.(Gandjar dan Rohman, 2007).
E. Landasan Teori
Daun teh merupakan salah satu tanaman yang banyak digunakan sebagai
minuman yang dipercaya memiliki banyak khasiat. Berdasarkan proses
pengolahannya teh dibagi menjadi teh hijau dan teh hitam. Teh hijau diproduksi
sesegera mungkin untuk mencegah terjadinya proses oksidasi. Teh hitam
diproduksi dengan mengoksidasi bagian daun. Selama proses oksidasi, adanya
enzim pada teh mengubah beberapa polifenol yang memiliki aktivitas terapetik
menjadi senyawa yang kurang aktif tetapi senyawa kuersetin tidak mengalami
proses oksidasi karena sifat kuersetin yang sukar larut dalam air sehingga
kuersetin tidak mampu mengalami proses oksidasi.
Kuersetin merupakan senyawa yang berwarna kuning yang larut dalam
asam asetat glasial, etil asetat, sukar larut dalam alkohol dan praktis tidak larut
dalam air. Kuersetin merupakan salah satu senyawa alam yang terdapat dalam
tanaman teh yang merupakan kelompok flavonoida golongan flavonol. Kuersetin
memiliki banyak manfaat bagi kesehatan antara lain antioksidan, antiinflamasi,
antiplatelet, antikanker, antivirus, dan antihistamin. Kebanyakan flavonoid di
alam terdapat sebagai glikosida. Untuk dapat mengetahui kadar kuersetin total
yang terdapat dalam daun teh maka perlu dilakukan proses hidrolisis untuk
memecah ikatan antara kuersetin aglikon dengan gula yang terikat.
Proses ekstraksi dilakukan menggunakan metode soxhletasi dan proses
fraksinasi menggunakan solid-phase extractiondengan cartridge C18.Selanjutnya
dari hasil fraksinasi dilakukan analisis dengan metode KCKT.
Analisis kuersetin dalam daun teh segar, teh hijau,dan teh hitam dapat
dilakukan dengan metode KCKT karena metode ini selektif dalam memisahkan
senyawa multikomponen dengan waktu yang relatif singkat. Penetapan kadar
mengetahui apakah proses pengeringan dan proses fermentasi berpengaruh
terhadap kadar kuersetin pada daun teh.
F. Hipotesis
22
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis penelitian eksperimental deskriptif, karena
terdapat intervensi terhadap subyek uji.
B. Variabel Penelitian
1. Variabel bebas pada penelitian ini adalah jenis teh yang digunakan
2. Variabel tergantung pada penelitian ini adalah kadar kuersetin yang terdapat
dalam daun teh segar, teh hijau, dan teh hitam.
3. Variabel pengacau pada penelitian ini adalah
a. Kemurnian pelarut yang digunakan, sehingga digunakan pelarut pro
analysis yang memiliki kemurnian cukup tinggi.
b. Suhu saat proses ekstraksi, dapat diatasi dengan menentukan suhu yang
akan digunakan dan menjaganya dalam keadaan konstan yakni 90° C.
C. Definisi Operasional
1. Sistem kromatografi cair kinerja tinggi (KCKT) yang digunakan dalam
penelitian ini menggunakan kolom fase diam oktadesil silika (C18) dan
komposisi fase gerak metanol - aqua bidestilata – asam fosfat 5% (54 : 45 :
2. Teh yang digunakan yakni daun teh segar, teh hijau yang diperoleh dari
perkebunan PT. PAGILARAN, Samigaluh dan teh hitam yang diperoleh dari
perkebunan PT. PAGILARAN, Batang.
D. Bahan-bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian ini yakni baku kuersetin
(Sigma Aldrich), metanol pro analysis (E. Merck), Butyl Hidroksi Toluen (E.
(chasing merek Dell B6RDZ1S Connexant System RD01-D850 A03-0382 JP
France S.A.S, printer HP Deskjet D2566 HP-024-000 625 730), degassing
ultrasonikator (Retsch tipe T460 no V935922013 EY), organic solvent membrane
filter Whatman (0,45m), membran filter Whatman ukuran pori 0,5 µm dan
diameter 47 mm, neraca analitik dengan kepekaan 0,001 (Ohaus Carat Series PAJ
1003), milipore, mikropipet, indikator pH, Moisture Balance, Rotary evaporator,
F. Tata Cara Penelitian 1. Pengambilan dan pembuatan sampel
Sampel yang digunakan berupa lembaran pucuk daun teh segar, teh hijau,
dan teh hitam. Teknik pengambilan daun teh segar diambil secara acak mewakili
setiap deret tanaman teh di lahan perkebunan teh PT. PAGILARAN. Sampel teh
hijau dan teh hitam diambil secara acak dari hasil produksi di pabrik PT.
PAGILARAN selanjutnya dilakukan proses pencacahan daun teh segar dan proses
penyerbukan teh hijau dan teh hitam.
2. Penetapan Kadar Air dan Kadar Abu
a. Daun Teh Segar:
a.1. Uji Kadar Air. 5 gram teh segar yang telah di blender ditimbang seksama,
masukkan ke dalam krus yang telah ditara sebelumnya, masukkan ke dalam
alat gravimetri, catat kadar air yang terukur pada alat gravimetri.
a.2. Uji Kadar Abu. 3 gram teh segar yang telah di blender ditimbang
seksama, masukkan ke dalam krus platina yang telah dipijarkan dan ditara.
Ratakan. Pijarkan perlahan-lahan hingga aran habis, dinginkan, timbang. Jika
dengan cara ini arang tidak dapat dihilangkan, tambahkan air panas, saring
melalui kertas saring bebas abu. Pijarkan sisa dan kertas saring dalam krus
yang sama. Masukkan filtrat ke dalam krus, uapkan, pijarkan hingga bobot
tetap, timbang. Hitung kadar abu terhadap bahan yang telah dikeringkan di
b. Teh Hijau dan teh hitam. Dilakukan dengan cara yang sama seperti penetapan
kadar abu dan kadar air dalam daun teh segar.
3. Pembuatan Larutan Penyari
Larutan penyari yang digunakan untuk proses ekstraksi dan fraksinasi
dalam penelitian ini adalah metanol-air (90-10) yang mengandung 1,85 M HCl.
HCl 1,85 M dibuat dengan mengambil sebanyak 163,40 mL HCl 11,32 M dengan
menggunakan buret kemudian dimasukkan ke dalam labu ukur 1000 mL,
kemudian ditambahkan dengan metanol-air (90-10) hingga batas tanda, kocok
homogen.
4. Ekstraksi dan Clean-up
a. Sampel daun teh segar. Masing-masing ditimbang kurang lebih 8 gram
dengan seksama daun teh segar yang telah di blender, teh hijau dan teh hitam
yang telah dihaluskan. Kemudian dimasukkan kedalam teabag dan
dimasukkan dalam tabung soxhlet dengan 240 mL larutan penyari dalam labu
erlenmeyer. Kedalam larutan penyari ditambahkan Butil Hidroksi Toluen
(BHT) sebanyak 240 mg. Proses ekstraksi ini dilakukan pada suhu 90° C
sebanyak sirkulasi yang telah dioptimasi pada proses optimasi ekstraksi yakni
18 kali sirkulasi. Ekstrak yang diperoleh selanjutnya dimasukkan kedalam
labu takar 250 mL dan ditambahkan dengan larutan penyari hingga batas
25 mL ekstrak dipekatkan hingga volume 5 mL. Sebanyak 0,1 mL
dimasukkan kedalam cartridge C-18 yang telah dikondisikan dengan larutan HCl
pH 3. Selanjutnya elusi dengan metanol 6 mL. fraksi yang diperoleh ditampung
dalam flakon.
5. Pembuatan fase gerak
Fase gerak yang digunakan dalam penelitian ini adalah
metanol-aquabidestilata-asam fosfat(54:45:1). Larutan asam fosfat 5% dibuat dengan
mengambil sebanyak 29,4 mL asam fosfat 85% menggunakan buret 50 mL ke
dalam labu takar 500 mL dan ditambahkan dengan akuabides hingga batas tanda.
Kemudian disaring menggunakan anorganic membran filter (Whatman). Fase
gerak ini selanjutnya didegassing selama 15 menit menggunakan ultrasonicator.
6. Pembuatan larutan baku kuersetin
a. Pembuatan larutan stok. Kuersetin baku ditimbang lebih kurang 25 mg dengan
seksama serbuk kuersetin dan dilarutkan dengan metanol p.a dalam labu takar
25,0 mL hingga batas tanda sehingga diperoleh konsentrasi 1000 ppm.
b. Pembuatan seri larutan baku kuersetin. Lima seri larutan baku kuersetin dibuat
dengan konsentrasi10, 20, 30, 40 dan 50 ppm dengan cara mengambil larutan
intermediet kuersetin dengan mikropipet100, 200, 300, 400 dan 500µL kemudian
diencerkan dengan methanol p.a dalam labu takar 10,0 mL hingga batas tanda.
Larutan disaring dengan millipore dan didegassing selama 15 menit dengan
7. Pembuatan kurva baku kuersetin
Seri larutan baku dengan konsentrasi 10, 20, 30, 40, dan 50 ppm,
masing-masing larutan disaring dengan menggunakan millipore kemudian didegassing
dengan ultrasonikator selama 15 menit dan 20 µL dari masing-masing larutan
diinjeksikan pada sistem KCKT fase terbalik dengan fase diam C18 dan fase gerak
metanol-aquabidestilata-asam fosfat (54:45:1) pada kecepatan alir 1,0 mL/menit.
Dari kromatogram diperoleh luas area kuersetin untuk masing-masing
konsentrasi. Luas area ini kemudian diplotkan terhadap konsentrasi kuersetin
untuk memperoleh regresi linier dengan persamaan y = bx + a.
8. Penetuan nilai % recovery
a. % Recovery keseluruhan proses. Kedalam masing-masing sampel
ditambahkan kuersetin baku 5mg, 10mg, 15mg dan 20mg. Masing-masing
sampel yang telah diadisi dengan kuersetin baku kemudian di ekstraksi
dengan metode soxhletasi dan dilakukan proses clean-up dengan
menggunakan SPE cartridge C18. Selanjutnya sampel disaring dengan
milipore dan didegassing selama 15 menit. Sejumlah 20µL diinjeksikan
kedalam sistem KCKT. Nilai AUC yang diperoleh selanjutnya dimasukkan
kedalam persamaan kurva baku sehingga akan diperoleh kadar kuersetin
dalam sampel. Kemudian dihitung nilai % recovery menggunakan rumus
sebagai berikut :
% recovery = x 100%
b. Recovery proses SPE. Kedalam masing-masing ekstrak yang akan dilakukan
Masing-masing sampel yang telah diadisi dengan kuersetin selanjutnya
disaring dengan milipore dan didegassing selama 15 menit. Sejumlah 20µL
diinjeksikan kedalam sistem KCKT. Nilai AUC yang diperoleh selanjutnya
dimasukkan kedalam persamaan kurva baku sehingga akan diperoleh kadar
kuersetin dalam sampel. Replikasi dilakukan 2 kali.
9. Penetapan kadar kuersetin dalam sampel
Sampel yang digunakan yakni fraksi metanol daun teh segar, fraksi
metanol teh hijau dan fraksi metanol teh hitam. Fraksi metanol kemudian disaring
dengan millipore, kemudian didegassing selama 15 menit dengan ultrasonikator.
Sampel yang telah dipreparasi diinjeksikan sebanyak 20 µL ke dalam sistem
KCKT yang telah dioptimasi sehingga didapatkan kromatogram sampel dan
dibaca AUC dari masing-masing replikasi. Masukkan hasil AUC ke persamaan
kurva baku kuersetin dari hasil validasi sehingga diperoleh kadar kuersetin dalam
sampel. Replikasi dilakukan 5 kali.
G. Analisis Hasil
Metode yang valid yang akan digunakan untuk penetapan kadar kuersetin
dalam daun teh segar, teh hijau dan teh hitam dilihat dari parameter akurasi yang
dinyatakan sebagai persen perolehan kembali (% recovery) .
Analisis kualitatif dengan membandingkan waktu retensi sampel dengan
baku kuersetin dan dengan cara spiking, kemudian dilihat terjadinya peningkatan
dengan memasukkan AUC sampel ke dalam persamaan regresi linear yang
diperoleh dari kurva baku kuersetin hasil validasi y = bx + a sehingga di dapat
30
BAB IV
HASIL DAN PEMBAHASAN
Penelitian ini didasarkan pada penelitian yang dilakukan oleh Dharma
(2012) mengenai optimasi proses ekstraksi kuersetin total, Dwiyoga (2012)
mengenai optimasi dan validasi penetapan kadar kuersetin total dalam teh hijau,
Wirasaputra (2012) mengenai optimasi jenis fase diam dan komposisi fase gerak
proses clean-up dengan metode solid phase extraction.
Dari hasil optimasi yang dilakukan oleh Dharma (2012) diperoleh proses
ekstraksi yang optimum yakni menggunakan proses soxhletasi sekaligus dengan
proses hidrolisis dengan menggunakan larutan penyari metanol-air (90-10) yang
mengandung HCl 1,85 M pada suhu 90°C. Proses ekstraksi dengan metode
soxhletasi ini dilakukan hingga tercapai 18 sirkulasi.
Dari hasil optimasi yang dilakukan oleh Wirasaputra (2012) diperoleh
proses clean-up yang optimal yakni tahap conditioning menggunakan air-HCl,
tahap elusi menggunakan metanol 100% sebanyak 6-10 mL
Dari hasil optimasi yang dilakukan oleh Dwiyoga (2012) diperoleh
sistem KCKT yang optimum yakni menggunakan fase diam oktildesilsilan (C-18),
campuran fase gerak metanol:aquabidest:asam fosfat 5% (54:45:1), kecepatan alir
1,0 mL/menit, suhu oven 30° C. Penelitian ini juga didasarkan pada validasi
HPLC yang dilakukan oleh Dwiyoga (2012) yang telah memenuhi persyaratan
A. Pengambilan dan Pembuatan Sampel
Sampel yang digunakan dalam penelitian yakni daun teh segar, teh hijau,
dan teh hitam. Teknik pengambilan sampel untuk daun teh segar dilakukan secara
acak mewakili seluruh tanaman teh perkebunan teh, Kulonprogo, hal ini dilakukan
untuk mendapatkan hasil yang representatif. Sampel teh hijau berupa tanaman
kering, teknik pengambilan sampel dilakukan secara acak mewakili seluruh hasil
produksi teh hijau. Begitu pula pada teknik pengambilan sampel teh hitam. Teh
hijau dan teh hitam diperoleh dari pucuk daun teh segar yang diolah di pabrik PT.
PAGILARAN, selanjutnya diserbukhaluskan dan kemudian diayak untuk
mendapatkan ukuran partikel yang lebih kecil dan seragam.
Daun teh segar yang diperoleh selanjutnya dilakukan sortasi basah untuk
membuang bahan lain yang tidak diinginkan, selanjutnya dilakukantahapan
pencucian. Daun teh yang sudah disortasi dan dicuci selanjutnya diblender untuk
memperkecil ukuran partikel sehingga luas permukaan kontak dengan larutan
penyari semakin besar dengan demikian jumlah senyawa yang tersari semakin
besar. Kemudian ditimbang kurang lebih 8 gram dengan seksama masing-masing
sampel dan dimasukkan kedalam tea bag.
B. Penetapan Kadar air dan Kadar Abu
Daun teh segar, teh hijau, dan teh hitam yang akan ditetapkan kadarnya
harus memenuhi syarat kadar abu dan kadar air yang telah ditetapkan, oleh
mengetahui kelayakan dari daun teh segar, teh hijau dan teh hitam yang akan
dianalisis.
Penetapan kadar abu dilakukan untuk mengetahui tingkat pengotoran
oleh logam dan silikat. Tabel II menyajikan data mengenai kadar abu dari daun
teh segar, teh hitam, dan teh hijau. Sebelum digunakan krus platina dipijarkan
terlebih dahulu untuk menghilangkan logam dan silikat yang mungkin masih
terdapat dalam krus platina sehingga dapat meningkatkan kadar abu dari teh yang
ditetapkan kadar abunya.
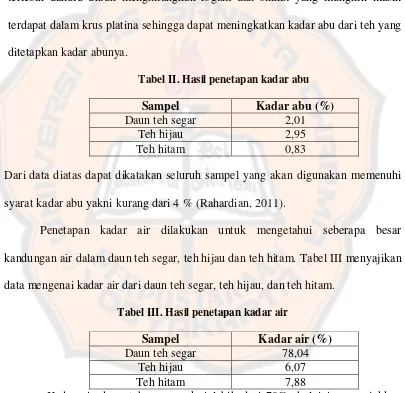
Tabel II. Hasil penetapan kadar abu
Sampel Kadar abu (%)
Daun teh segar 2,01 Teh hijau 2,95 Teh hitam 0,83
Dari data diatas dapat dikatakan seluruh sampel yang akan digunakan memenuhi
syarat kadar abu yakni kurang dari 4 % (Rahardian, 2011).
Penetapan kadar air dilakukan untuk mengetahui seberapa besar
kandungan air dalam daun teh segar, teh hijau dan teh hitam. Tabel III menyajikan
data mengenai kadar air dari daun teh segar, teh hijau, dan teh hitam.
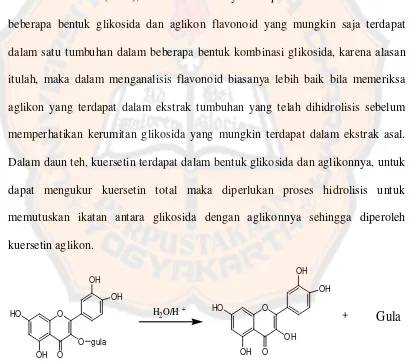
Tabel III. Hasil penetapan kadar air
Sampel Kadar air (%)
Daun teh segar 78,04 Teh hijau 6,07 Teh hitam 7,88
Kadar air daun teh segar yakni lebih dari 70%, hal ini menunjukkan
bahwa sebagian besar kandungan dalam daun teh segar yakni air. Hal ini karena
daun teh segar belum mengalami pengolahan apapun seperti proses pengeringan
air pada teh hijau dan teh hitam, kadar air pada teh hitam yakni 7,88 % dan pada
teh hijau kadar air nya yakni 6,07 %. Menurut Rahardian (2011), jumlah ini masih
memenuhi syarat yakni kurang dari 8,00 %.
Dilihat dari parameter kadar abu dan kadar air, daun teh segar, teh hijau
dan teh hitam memiliki mutu yang baik.
C. Ekstraksi dan Hidrolisis
Ekstraksi merupakan kegiatan penarikan kandungan kimia yang dapat
larut sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair.
Dengan diketahuinya senyawa aktif yang dikandung simplisia akan
mempermudah pemilihan pelarut dan cara ekstraksi yang tepat (Direktorat
Jenderal Pengawasan Obatdan Makanan, 1986). Proses terekstraksinya zat aktif
dari sel tanaman adalah pelarut organik akan berdifusi menembus dinding sel dan
masuk kedalam rongga sel yang mengandung zat aktif, zat aktif akan larut dalam
pelarut organik tersebut sehingga perbedaan konsentrasi antara larutan zat aktif
didalam sel dan pelarut organik diluar sel, maka larutan akan terdisitribusi keluar
sel dan proses ini terulang terus sampai terjadi kesetimbangan antara konsentrasi
cairan zat aktif didalam sel dan diluar sel (List dan Schmidt, 1989).
Metode ekstraksi yang digunakan dalam penelitian ini adalah sokletasi.
Sokletasi adalah ekstraksi menggunakan pelarut yang selalu baru umumnya
dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinyu dengan jumlah
pelarut yang relatif konstan dengan adanya pendingin balik (Direktorat Jenderal
pelarut terkondensasi dari labu menuju pendingin, kemudian jatuh membasahi
sampel dan mengisi bagian tengah alat sokhlet. Tabung sifon juga terisi dengan
larutan penyari dan ketika mencapai bagian atas tabung sifon, larutan tersebut
akan kembali ke dalam labu.
Kebanyakan flavonoid di alam terdapat sebagai glikosida. Flavonoid
glikosida menunjukkan kelarutan yang baik dalam air dibandingkan dengan
aglikonnya. Beberapa senyawa flavonoid seperti flavon dan flavonol, umumnya
tidak tertandai sebagai senyawa utuh, tetapi dalam bentuk aglikonnya. Kuersetin
di dalam daun teh terdapat dalam berbagai bentuk glikosida antara lain
glukosida (isokuersetin), rhamnoside (kuersitrin) dan
kuersetin-3-rutinoside (rutin). Karena alasan tersebut, prosedur hidrolisis diperlukan untuk
memecah ikatan glikosida selama proses ektraksi (Escribano dan Santos, 2010).
Suhu yang digunakan selama proses ekstraksi yakni 90 °C. Dalam proses
sokhletasi dibutuhkan pelarut yang dapat menyari zat yang diinginkan. Dari
proses optimasi ekstraksi yang telah dilakukan sebelumnya, pelarut yang
digunakan selama proses penyarian yakni metanol-air (90-10) yang mengandung
HCL 1,85 M (Dharma, 2012). Menurut Markham (1988), adanya sejumlah gugus
hidroksil atau mempunyai gugus gula, flavonoid juga bersifat polar dan karenanya
cukup larut dalam pelarut polar seperti metanol. Kuersetin memiliki sejumlah
gugus hidroksil, sehingga inilah alasan digunakan metanol sebagai cairan penyari.
Pada suhu 90 °C metanol dalam larutan penyari akan menguap dan
terembunkan kembali membasahi tea bag sehingga dapat menyari daun teh
tersari dalam metanol akan tertampung dalam labu yang berisi larutan penyari
yang mengandung HCl. Senyawa-senyawa tersebut akan mengalami proses
hidrolisis.
Proses hidrolisis ini dilakukan untuk merubah kuersetin bentuk glikosida
menjadi kuersetin bentuk aglikonnya dalam suasana asam. Larutan HCl berfungsi
sebagai katalisator yang dimaksudkan untuk mempercepat terjadinya reaksi
hidrolisis serta untuk mempertahankan kuersetin tetap dalam bentuk molekulnya.
Menurut Harborne (1987), flavonoid umumnya terdapat dalam tumbuhan dalam
beberapa bentuk glikosida dan aglikon flavonoid yang mungkin saja terdapat
dalam satu tumbuhan dalam beberapa bentuk kombinasi glikosida, karena alasan
itulah, maka dalam menganalisis flavonoid biasanya lebih baik bila memeriksa
aglikon yang terdapat dalam ekstrak tumbuhan yang telah dihidrolisis sebelum
memperhatikan kerumitan glikosida yang mungkin terdapat dalam ekstrak asal.
Dalam daun teh, kuersetin terdapat dalam bentuk glikosida dan aglikonnya, untuk
dapat mengukur kuersetin total maka diperlukan proses hidrolisis untuk
memutuskan ikatan antara glikosida dengan aglikonnya sehingga diperoleh
kuersetin aglikon.
Gambar 8. Reaksi hidrolisis dengan HCl
Ekstrak yang diperoleh selanjutnya dilakukan proses clean-up untuk
mendapatkan kuersetin dengan jumlah pengotor yang sedikit. Proses clean-up ini
dilakukan dengan menggunakan kolom solid phase extraction cartridge C-18.
Proses ini dimaksudkan untuk menghilangkan senyawa-senyawa yang bersifat
lebih nonpolar dibandingkan dengan kepolaran kuersetin yang dapat mengganggu
analisis dengan metode KCKT.
Proses clean-up dilakukan dengan menggunakan Solid Phase Extraction
(SPE) yang didasarkan pada polaritas dan keasaman. Secara umum SPE
digunakan untuk menghilangkan senyawa phenolic non polar (Mumper dan Dai,
2010). Sebanyak 25 mL ekstrak metanol-air dipekatkan hingga volume 5 mL.
Sebanyak 0,1 mL sampel dimasukkan kedalam cartridge yang telah dikondisikan
terlebih dahulu dengan larutan HCl yang memiliki pH 3. Larutan HCl yang
digunakan memiliki pH 3 dimaksudkan untuk membuat kuersetin berada dalam
bentuk molekul dimana pada kondisi asam kuersetin berada dalam bentuk
molekul utuh. Sifat kuersetin yang bersifat asam ditunjukkan dari adanya gugus –
OH pada struktur kuersetin.
Pengkondisian dengan larutan HCl ini dilakukan untuk memastikan
interaksi yang terjadi antara analit yakni kuersetin dengan fase diam berlangsung
secara konsisten sehingga memberikan hasil pemisahan yang optimal. Selanjutnya
dilakukan proses elusi dengan metanol. Cartridge C-18 bersifat nonpolar sehingga
akan menahan senyawa-senyawa dalam sampel yang cenderung bersifat nonpolar
akan terelusi keluar dari kolom. Kuersetin merupakan senyawa yang bersifat polar
sehingga akan terelusi dengan metanol.
E. Pembuatan Fase Gerak
Pada tahap analisis dengan KCKT digunakan fase diam C-18 dan fase
gerak metanol : akuabides : asam fosfat 5% (45:54:1). Fase gerak bersifat lebih
polar dibandingkan dengan fase diam sehingga pada penelitian ini digunakan
metode KCKT fase terbalik.
Metanol dipilih sebagai salah satu komposisi fase gerak karena metanol
memiliki viskositas yang lebih kecil dibanding dengan etanol karena jika
viskositas terlalu besar dapat meningkatkan tekanan pompa pada KCKT. Dari
hasil optimasi jenis dan komposisi fase gerak digunakan pula akuabides agar
kuersetin dapat terpisah dari senyawa-senyawa yang bersifat lebih polar dibanding
kuersetin sehingga senyawa-senyawa polar dapat terelusi lebih dulu. Penggunaan
asam fosfat pada komposisi fase gerak dimaksudkan untuk mengurangi tailing
pada puncak kuersetin.
Masing-masing komposisi dari fase gerak disaring dengan menggunakan
kertas Whatman untuk mengilangkan partikel-partikel dalam fase gerak yang
mungkin dapat menyumbat kolom. Selanjutnya larutan didegassing dengan
ultrasonikator untuk menghilangkan gelembung udara yang dapat memperngaruhi
F. Analisis Kualitatif Kuersetin
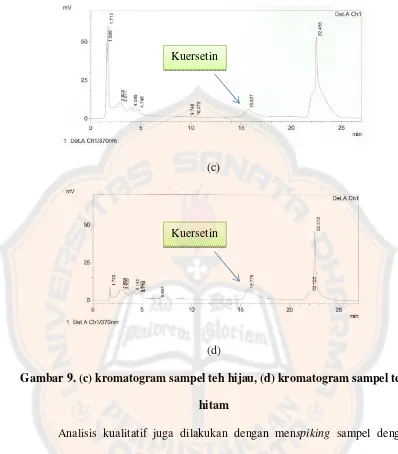
Analisis kualitatif dilakukan dengan membandingkan waktu retensi
kuersetin baku dengan waktu retensi kuersetin dalam sampel. Waktu retensi (tR)
dapat digunakan untuk analisis kualitatif karena masing-masing senyawa memiliki
waktu retensi yang spesifik pada kondisi tertentu (Noegrohati, 2004). Dari hasil
kromatogram menunjukkan tR kuersetin baku, daun teh segar, teh hijau, dan teh
hitam berturut-turut yakni 15,746 ; 15,858 ; 15,775 ; 15,657. Gambar 9.
menunjukkan adanya kemiripan antara waktu retensi kuersetin baku dengan
waktu retensi kuersetin dalam sampel sehingga dapat dikatakan bahwa didalam
sampel daun teh segar, teh hijau dan teh hitam mengandung kuersetin.
(a)
(b)
Gambar 9. (a) kromatogram baku kuersetin 30 ppm, (b) kromatogram sampel teh segar
Kuersetin
(c)
(d)
Gambar 9. (c) kromatogram sampel teh hijau, (d) kromatogram sampel teh hitam
Analisis kualitatif juga dilakukan dengan menspiking sampel dengan
baku kuersetin sehingga terjadi peningkatan tinggi puncak (Rohman, 2007). Dari
kromatogram yang diperoleh dapat dilihat terjadi peningkatan tinggi puncak pada
tR kuersetin. Tabel IV. menunjukkan peningkatan tinggi puncak pada tR kuersetin
sehingga dapat dikatakan bahwa sampel daun teh segar, teh hijau dan teh hitam
mengandung kuersetin.
Kuersetin
(a)
(b)
(c)
Gambar 10. (a) Kromatogram Daun teh segar yang telah dispiking (b) Kromatogram teh hijau yang telah dispiking (c) Kromatogram teh hitam yang telah
dispiking
Kuersetin
Tabel IV. Data peningkatan tinggi peak pada tR kuersetin
Sampel Tinggi puncak sebelum dispiking
Waktu retensi suatu analit dipengaruhi oleh interaksi analit dengan fase
diam dan fase gerak. Pada penelitian ini digunakan fase diam C-18 yang bersifat
non polar dan fase gerak campuran metanol:akuabides:asam fosfat 5% yang
bersifat lebih polar dibandingkan dengan fase diam. Sistem fase gerak bersifat
lebih polar dibanding fase diam maka senyawa-senyawa yang bersifat polar akan
terelusi lebih dulu dibandingkan dengan senyawa yang bersifat lebih non polar
karena senyawa yang bersifat lebih polar akan berinteraksi lebih kuat dengan fase
gerak dibandingkan dengan fase diam, sehingga akan terlelusi lebih dahulu dan
senyawa yang bersifat lebih nonpolar akan terelusi lebih lama. Dilihat dari
kromatogram kuersetin bersifat lebih non polar dibanding dengan
senyawa-senyawa yang bersifat lebih polar sehingga kuersetin lebih lama tertahan di fase
diam dan memiliki tR yang lebih lama dibanding senyawa-senyawa yang bersifat
polar.
Senyawa yang dapat di baca oleh detektor UV harus memiliki gugus
kromofor dan auksokrom. Kuersetin memiliki gugus kromofor dan auksokrom
sehingga dapat memberikan serapan pada panjang gelombang ultraviolet. Gugus
kromofor merupakan gugus yang bertanggung jawab pada penyerapan ultraviolet,
sedangkan gugus auksokrom merupakan gugus yang bertanggungjawab terhadap
pergeseran panjang gelombang dan intensitas serapan maksimum kuersetin.
Gambar 16. menunjukkan gugus auksokrom dan kromofor yang terdapat pada
kuersetin
Gambar 12. Gugus auksokrom dan kromofor pada kuersetin
G. Validasi Prosedur Analisis 1. Akurasi
Validasi merupakan suatu pembuktian terhadap suatu pearameter
berdasarkan hasil laboratorium bahwa parameter tersebut memenuhi syarat untuk
penggunaannya (Gandjar dan Rohman, 2007). Parameter validasi yang digunakan
dalam penelitian ini adalah ketepaatan (akurasi), linieritas dan LOQ (limit of
Quantitation).
Akurasi adalah ketepatan prosedur analisis yang menyatakan kedekatan
antara suatu nilai yang sebenarnya. Dalam penelitian ini akurasi ditentukan
dengan metode penambahan baku (standard addition method). Metode
penambahan baku dilakukan dengan menambahkan sejumlah tertentu
baku/standar ke dalam sampel. Akurasi dinyatakan dengan % recovery.
Recovery merupakan presentase analit yang dapat diekstraksi dan
dianalisis dari sampel yang telah ditambahkan analit pada konsentrasi tertentu
(Anonim, 2003). Penetapan % recovery ini dilakukan untuk mengetahui bahwa
keseluruhan metode maupun metode clean-up yang digunakan untuk penetapan
kadar kuersetin dalam daun teh segar, teh hijau dan teh hitam tidak
menghilangkan kuersetin selama proses analisis. Nilai AUC yang diperoleh dari
sampel yang diadisi selanjutnya dimasukkan kedalam persamaan kurva baku
yakni y = 15390.57648 + 49597.53525x untuk kuersetin yang memiliki nilai
AUC antara 48032 – 235472 dan y = -368905.21654 + 61531.85173x untuk
kuersetin yang memiliki nilai AUC antara 255785 – 2705929. Tabel V.
menunjukkan hasil penetapan % recovery kuersetin untuk keseluruhan proses
analisis dan Tabel VI. menunjukkan hasil penetapan % recovery kuersetin untuk