Adrian Prasetya
Kelas Dual Degree
LAPORAN PRAKTIKUM
INSTRUMENTASI DAN TEKNIK ANALISIS BIOMOLEKULAR
Penggunaan Flowcytometry (7 Maret 2017)
1.
PENDAHULUANFlow cytometry adalah metode untuk mengukur dan menganalisa berbagai karakteristik dari sel secara simultan. Karakteristik sel yang diamati biasanya adalah ukuran relatif partikel, granularitas atau kompleksitas, dan intensitas fluoresensi relatif. Partikel atau sel yang menjadi sasaran analisis biasanya telah terlebih dahulu diikat dengan antibodi berlabel fluorokrom kemudian sel dalam bentuk suspensi kemudian dialirkan dan dilewatkan pada suatu sinar. Prinsip kerja flowcytometry terdiri dari tiga sistem utama yaitu fluidics, optik, dan elektronik.
• Sistem fluidics mengangkut partikel di sungai dengan sinar laser untuk dianalisa • Sistem optik terdiri dari laser untuk menerangi partikel dalam aliran sampel dan filter optik untuk mengarahkan sinyal cahaya yang dihasilkan untuk detektor • Sistem elektronik mengubah sinyal cahaya terdeteksi menjadi sinyal elektronik (Becton,2002).
Fluorokrom merupakan suatu senyawa fluoresein yang dapat berpendar saat mengalami eksitasi oleh sinar dengan panjang gelombang tertentu. Beberapa fluorokrom yang sering digunakan dalam flow cytometry, yaitu fluorescein isothyocyanate (FITC) yang memancarkan sinar hijau-kuning dengan emisi 519 nm, 4,6-Diamidino 2-Phenylinidole (DAPI) dengan emisi 455 nm, propidium iodide (PI) dengan emisi 617 nm dan phycoeritrin (PE) yang memancarkan sinar merah-orange dengan emisi 578 nm.
Dalam praktikum ini, sampel yang diukur yaitu limfosit yang didapat dengan dari isolasi Peripheral Blood Mononuclear Cell (PBMC) kemudian di staining dengan
cell surface marker yaitu FITC anti-human CD4 dan PE anti-human CD8a yang dibeli dari BioLEgend untuk flow cytometry.
2. TUJUAN
a. Mengetahui prinsip kerja dari Flowcytometer
b. Dapat menghitung jumlah sel CD4+ dan CD8+ pada sampel yang didapat dengan
metode Flowcytometry
3. METODE
A. ISOLASI PERIPHERAL BLOOD MONONUCLEAR CELL
Alat:
3. Swing Centrifugated 4. Vacutainer EDTA/Heparin
Bahan:
1. Ficoll-Hipaque d=1.077 g/ml 2. Phospat Buffer Saline (PBS) 3. Sampel Darah
Prosedur Kerja:
1. Semua bahan yang diprlukan dikeluarkan dari lemari pendingin dan dibiarkan sampai suhu ruang
2. Diambil sampel darah sebanyak 3 cc dengan phlebotomy dan masukkan kedalam vacutainer EDTA
3. Disiapkan tabung sentrifus 15 ml dan diisi dengan FIcoll-Hipaque d = 1.077 g/ml (1:1) dengan jumlah sampel darah
4. Sampel darah dalam vacutainer EDTA yang akan diuji, dibolak balik perlahan agar homogen kemudian dicampur 1:1 dengan PBS. Kemudian diambil dengan micropipette dan disalutkan secara perlahan pada dinding tabung sentrifus 15 ml yang sudah diisi ficoll-hipaque d=1.077 g/ml maka akan terbentuk 2 lapisan
5. Kemudian disentrifuge suhu ruang dengan kecepatan 1600 rpm selama 30 menit 6. Setelah disentrifuge, terpisah menjadi 5 lapisan, yaitu plasma, sel PBMC,
Ficoll-Hipaque, granulosit, dan sel darah merah
7. Cincin PBMC yang terbentuk diambil secara perlahan menggunakan micropipette dan diletakkan dalam botol sentrifus 15 ml yang baru
8. Larutan PBMC kemudian dicuci dengan PBS 10 ml dan disentrifus suhu ruang 1200 rpm selama 10 menit, dilakukan dua kali
9. Supernatan dibuang dan pelet sel yang terbentuk dicuci kembali dengan PBS dan disentrifus kembali pada suhu ruang 1200 rpm selama 10 menit, dilakukan dua kali 10. Setelah disentrifuge, terbentuk pelet (sel PBMCs) pada dasar botol sentrifus 15 ml.
B. STAINING DENGAN SEL SURFACE MARKER UNTUK FLOW CYTOMETRY
Alat:
2. Larutan sel staining buffer (2%FBS dalam PBS)
Cara Kerja:
1. Pelet sel dicuci dengan sel staining buffer (2% Fetal Bovine Serum (FBS) dalam PBS) satu kali
2. Kemudian disentrifus pada kecepatan 2500 rpm, 3 menit, suhu 4 derajat
3. Supernatan dibuang dan pelet sel yang terbentuk siap untuk distaining dengan antibodi sel surface marker (yang telah diencerkan dengan sel staining buffer dengan perbandingan tertentu)
5. Pelet sel yang telah diberi antibodi diinkubasi selama 20 menit dalam gelap di suhu ruang
6. Setelah inkubasi ditambahkan sel staining buffer sesuai dengan kebutuhan, dan dihomogenkan kembali
7. Kemudian dipindahkan ke kuvet baca dan siap untuk dibaca dengan flowcytometer
4. HASIL
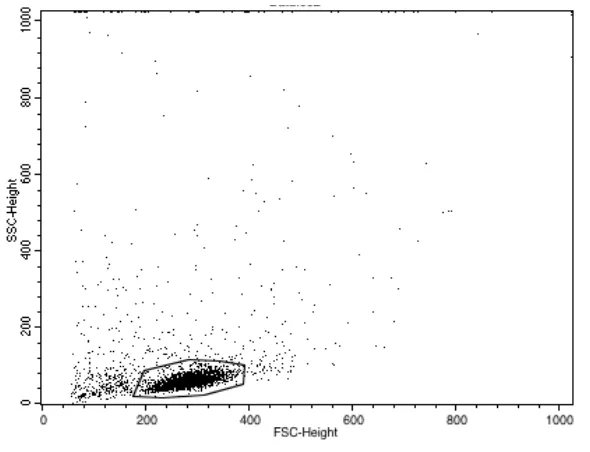
Dari pemeriksaan flowcytometry sampel PBMC, jumlah Limfosit T berdasarkan pada grafik scatter (gambar 2) adalah sebanyak 79,14%.
Gambar 2. Grafik Pencar
(Scatter) Pada Sampel PBMC
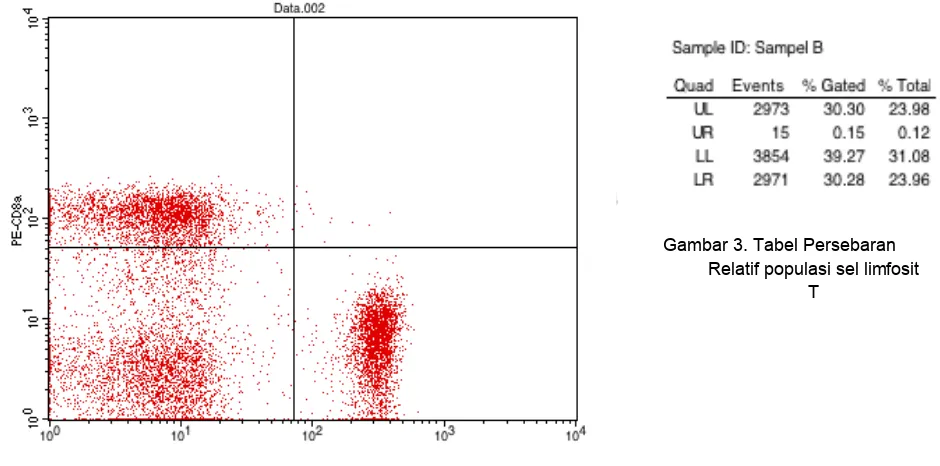
Kemudian dilakukan gating pada kumpulan sel limfosit, untuk identifikasi CD4 dan CD8. Pada grafik scatter (gambar 3) sumbu X menunjukkan penanda permukaan CD4, sedangkan pada sumbu Y menunjukkan penanda permukaan CD8 sehingga terbagi menjadi empat kuadran, yaitu kuadran kiri atas (Upper Left / UL), kanan atas (Upper Right / UR), kiri bawah (Lower Left / LL), serta kanan bawah (Lower Right / LR). Sel yang hanya memiliki CD4 tanpa CD8 ditunjukkan pada persentase kuadran kanan bawah (LR), untuk sel yang hanya memiliki CD8 tanpa CD4 ditunjukkan pada persentase kuadran kiri atas (UL). Sedangkan sel yang memiliki marker CD4 dan CD8 ditunjukkan pada kuadran kanan atas (UR). Sehingga Sel T CD4+ yang di-marker dengan FITC anti-human CD4 diidentifikasi sebanyak
Gambar 3. Tabel Persebaran Relatif populasi sel limfosit
T
5.
PEMBAHASAN
Setiap sel yang melewati berkas sinar laser akan menyebabkan sinar laser terpencar (scattered) ke dua arah, yaitu forward scatter (FSC) yang pararel dengan arah sinar dan side scatter (SSC) yang arahnya tegak lurus pada arah sinar laser. Besarnya FSC (sumbu X) berbanding lurus dengan atau menggambarkan volume atau ukuran sel sehingga semakin ke kanan titik pada sumbu X, maka semakin besar ukuran sel sedangkan SSC (sumbu Y) menunjukkan kompleksitas atau granularitas dari sel sehingga semakin ke atas titik pada sumbu Y, maka semakin tinggi kompleksitas atau granulitas sel yang diperiksa.
Berdasarkan ukuran dan tingkat granularitasnya, sel makrofag memiliki sel yang paling besar dan memiliki banyak granul,kemudian sel monosit lalu limfosit.. Untuk ukuran yang lebih kecil lagi dan tidak bergranul atau kompleksitasnya rendah merupakan sel yang telah mati atau debris – debris (Lewandowski, 2006). Untuk identifikasi CD4 dan CD8 dilakukan gating pada Limfosit. Dari data tersebut dapat diketahui bahwa terdapat 79,14% sel limfosit dari 10.000 event yang direkam pada alat flowcytometry. Dari gate tersebut kita dapat menganalisa banyaknya sel yang memiliki permukaan CD4 dan atau CD8.
Pembagian kuadran pada Grafik pencar (scatter) populasi sel limfosit T (Gambar 3) dilakukan berdasarkan tingginya intensitas warna dari pewarna antibodi yang digunakan. sehingga dapat dimaknai bahwa kuadran LL menunjukkan sel Limfosit yang CD4- dan CD8-. Kemudian pada kuadran LR ditunjukkan sel Limfosit
CD4-. Untuk sel yang memiliki CD8+dan CD4+ ditunjukkan pada persentase kuadran
kanan atas (UR). Sehingga Sel T CD4+ yang di-marker dengan FITC anti-human
CD4 diidentifikasi sebanyak 23,96% dan sel T CD8+ yang di-marker dengan PE anti-human CD8a diidentifikasi sebanyak 23,98%.
Flow cytometry dapat digunakan untuk analisis data berupa kualitatif dan kuantitatif namun hanya dalam bentuk persentase atau relatif saja, untuk mendapatkan data mengenai jumlah absolut dari sel limfosit yang diperiksa perlu dilakukan differential count sel limfosit CD4+ dan/atau CD8
6.
KESIMPULAN
1. Prinsip kerja pemeriksaan flowcytometry adalah mengukur ukuran sel, granulitas sel, dan mengenali warna fluoresence tertentu (antibodi monoklonal yang berlabel fluorokrom) berdasarkan kemampuan hamburan dan intensitas cahaya yang molekul yang dialirkan dalam sebuah tabung melewati seberkas cahaya, untuk karakterisasi dan menentukan perbedaan jenis sel dalam populasi heterogen, serta menganalisis ukuran dan volume sel.
2. Jumlah Limfosit T dalam praktikum ini adalah sebanyak 79,14%. Sel T CD4+ diidentifikasi sebanyak 23,96 %, dan sel T CD8+ diidentifikasi sebanyak 23,98 %.
DAFTAR PUSTAKA
1. Abcam. 2010. Direct Flow cytometry Protocol
2. Becton. 2002. Introduction to Flow Cytometry: A Learning Guide
3. Brown, Michael., Wittwer, Carl. 2000. Flow Cytometry: Principles and Clinical Applications in Hematology
4. Lewandowski, Krzysztof and Andrzej Hellmann. Atlas of Limfopoiesis.Poland : Gdansk. 2006
5. Mandal, Ananya. Flow Cytometry Principles. Available from : http://www.news-medical.net/life-sciences/Flow-Cytometry-Principles.aspx ( diakses 12 Maret 2017)