I. Judul Percobaan
Kinetika Reaksi Saponifikasi Etil Asetat
II. Tanggal Percobaan
Senin, 25 Maret 2013 pukul 11.00-13.15 WIB
III. Tujuan Percobaan
Setelah melakukan kegiatan praktikum diharapkan mahasiswa dapat:
1. Untuk memberikan gambaran bahwa reaksi penyabunan hidroksida adalah reaksi orde 2.
2. Menentukan konstanta kecepatan reaksi pada reaksi tersebut.
IV. Dasar Teori
Kinetika kimia merupakan bagian dari ilmu Kimia Fisika yang mempelajari tentang kecepatan reaksi-reaksi kimia dan mekanisme reaksi-reaksi yang bersangkutan.Tidak semua reaksi kimia dapat dipelajari secara kinetik.Reaksi-reaksi yang berjalan sangat cepat seperti reaksi-reaksi ion atau pembakaran dan reaksi-reaksi yang sangat lambat seperti pengkaratan, tidak dapat dipelajari secara kinetik.Diantara kedua jenis ini, banyak reaksi-reaksi yang kecepatannya dapat diukur.
Ditinjau dari fase zat yang bereaksi, dikenal dua macam reaksi, yaitu : a. Reaksi homogen, yaitu reaksi dimana tidak terjadi perubahan fase. b. Reaksi heterogen, yaitu reaksi dimana terjadi perubahan fase.
Kecepatan reaksi adalah kecepatan perubahan konsentrasi terhadap waktu, jadi
dt dc
, tanda negatif menunjukkan bahwa konsentrasi berkurang bila waktu bertambah. Laju reaksi merupakan laju berkurangnya konsentrasi pereaksi atau bertambahnya hasil reaksi persatuan waktu. Bila laju reaksi dengan persamaan: aA + bB ↔ cC + dD.
Semakin besar konsentrasi zat-zat pereaksi cenderung akan mempercepat laju reaksi, tetapi seberapa cepat menemukan orde reaksi merupakan salah satu cara memperkirakan sejauh mana konsentrasi zat pereaksi mempengaruhi laju reaksi tertentu.
Orde reaksi adalah jumlah pangkat faktor konsentrasi dalam hukum laju bentuk diferensial. Orde reaksi adalah ukuran konstribusi setiap konsentrasi pereaksi atau zat yang berperan dalam laju reaksi. Pada umunya orde reaksi merupakan bilangan bulat dan kecil namun dalam beberapa hal pecahan atau nol. Penentuan orde reaksi adalah hal yang essensial daripada penelitian-penelitian terhadap proses kimia yang menyangkut analisis hubungan konsentrasi dan waktu.
Menurut Hukum Kegiatan Massa, kecepatan reaksi pada temperatur tetap, berbanding lurus dengan konsentrasi pengikut-pengikutnya dan masing-masing berpangkat sebanyak molekul dalam persamaan reaksi.
Orde reaksi 1 : A → hasil Rate = k1.CA. Orde reaksi 2 : 2A → hasil Rate = k2. C2A. A + B → hasil Rate = k2.CA.CB Orde reaksi 3 : A + 2B → hasil Rate = k3.CA.C2B. 2A + B → hasil Rate = k3.C2A.CB.
Untuk memberikan gambaran bahwa reaksi penyabunan etilasetat oleh ion hidroksi adalah orde dua yaitu reaksi dibawah ini :
CH3COOC2H5 + OH- CH3COO- + C2H5OH
t = 0 A b - -
X x X X
t = t (a-x) (b-x) X X
Reaksi bimolekuler tingkat dua dapat dinyatakan sebagai berikut :
A + B Hasil t = 0 A b - t = t a-x b-x X
a x
b x
k dt dx 2 Dimana :a = konsentrasi awal ester (mol/L) b = konsentrasi awal ion OH- (mol/L)
x = jumlah mol/L ester atau basa yang telah bereaksi k2 = tetapan laju reaksi (mmol-1.menit-1)
Intregasi :
a
b x
x a b log b a t 2,303 k x b a x a b ln b a t 1 k 2 2 Untuk dapat menentukan apakah suatu reaksi orde dua atau bukan dapat diselidiki seperti pada reaksi tingkat satu yaitu :
1. Dengan memasukkan harga a, b, t dan x pada persamaan :
b x
a x a b ln b) t(a 1 k2 2. Secara grafik
a b log b a k 2,303 x b a x a b log b a k 2,303 t 2 2 Bila reaksi orde dua maka grafik t terhadap log
b x
x a
merupakan garis lurus tangen atau slope :
a b
slope 2,303 k b a k 2,303 slope 2 2 Untuk konsentrasi sama :
k a 1 b a k 1 t a 1 x a 1 k 2 2 2 Jadi grafik x a 1 harus lurus bila reaksi orde dua.
3. Half life period tidak dapat dipakai untuk menyelidiki tingkat reaksi, dimana konsentrasi A dan B berbeda, karena A dan B akan mempunyai waktu berbeda untuk bereaksinya setengah jumlah zat tersebut.
Reaksi-reaksi orde I adalah reaksi-reaksi yang lajunya berbanding langsung dengan konsentrasi reaktan, yaitu:
C k dt C d yang pada integrasi memberikan
ln [C] = ln [C]0 – kt atau [C] = [C]0 e-kt atau k =
C C ln t 1 0[C]0 adalah konsentrasi reaktan pada t = 0. Untuk reaksi-reaksi orde I, plot ln [C] (atau
log [C]) terhadap t merupakan suatu baris lurus. Intersep memberikan konsentrasi pada t = 0 dan k dapat dihitung dari kemiripan tersebut.
Dalam reaksi orde II, laju reaksi berbanding langsung dengan kuadrat konsentrasi dari satu reaktan atau dengan hasil kali konsentrasi yang meningkat sampai pangkat satu atau dua 1. Kasus I 2A → Produk
2 A k dt A d yang pada integrasi memberikan
kt A 1 A 1 0 dimana [A]0 adalah konsentrasi reaktan pada t=0.
2. Kasus II
aA + bB → Produk
dimana a ≠ b dan [A]0 ≠ [B]0, persamaan laju diferentsial adalah
B A k dt B d b 1 -dt A d a 1 - dan persamaan laju yang diintegrasi adalah
kt A B A B ln B a -A b 1 0 0 0 0 Jika a = b = 1, persamaan diatas menjadi
kt A B A B ln B -A 1 0 0 0 0 Plot kiri dari persamaan diatas terhadap t akan merupakan garis lurus. Konstanta laju dapat dihitung dari kemiripan dan konsentrasi awal reaktan dari intersep tersebut.
Saponifikasi adalah suatu reaksi yang menghasilkan sabun dan gliserol, dengan menghidrolisa dengan basa, suatu lemak atau minyak.Sabun merupakan garam logam alkali dengan rantai asam monocarboxylic yang panjang.Larutan Alkali yang digunakan
dalam pembuatan sabun bergantung pada jenis sabun tersebut.Larutan alkali yang biasanya digunakan pada sabun keras adalah natrium hidroksida dan alkali yang biasanya digunakan pada sabun lunak adalah kalium hidroksida.
Sabun berfungsi untuk mengemulsi kotoran – kotoran berupa minyak ataupun zat pengotor lainnya. Sabun dibuat melalui proses saponifikasi lemak minyak dengan larutan alkali membebaskan gliserol. Lemak minyak yang digunakan dapat berupa lemak hewani, minyak nabati, lilin, ataupun minyak ikan laut.
V. Alat dan Bahan
V.1. Alat Corong kaca Stopwatch Gelas kimia Erlenmeyer Buret
Statif dan klem
Gelas ukur
Thermometer
Pipet tets
V.2. Bahan
Larutan etil asetat 0.02 N
Indikator PP
Larutan NaOH 0.02 N
Aquades
VI. Diagram Alir
125 mL Etil Asetat 0.02 N 100 mL NaOH 0.02 N
Campuran Larutan • Dimasukkan ke dalam gelas kimia
• Diletakkan di dalam thermostat untuk mencapai suhu yang sama dengan 100 mL NaOH 0.02 N
• Dimasukkan ke dalam gelas kimia
• Diletakkan di dalam thermostat untuk mencapai suhu yang sama dengan 125 mL etil asetat 0.02 N
• 125 mL etil asetat 0.02 N dicampurkan dengan cepat ke dalam larutan 100 mL NaOH 0.02 N
• Dikocok dengan baik
• Dijalankan stopwatch pada saat kedua larutan bercampur
10 mL HCl 0.02 N 10 mL HCl 0.02 N 10 mL HCl 0.02 N 10 mL HCl 0.02 N 10 mL HCl 0.02 N 10 mL HCl 0.02 N 10 mL HCl 0.02 N • Setelah 3 menit bereaksi dipipet 5 mL dan dimasukkan ke erlenmeyer yang berisi dengan 10 mL HCl 0.02 N • Setelah 8 menit bereaksi dipipet 5 mL dan dimasukkan ke erlenmeyer yang berisi dengan 10 mL HCl 0.02 N • Setelah 15 menit bereaksi dipipet 5 mL dan dimasukkan ke erlenmeyer yang berisi dengan 10 mL HCl 0.02 N • Setelah 25 menit bereaksi dipipet 5 mL dan dimasukkan ke erlenmeyer yang berisi dengan 10 mL HCl 0.02 N • Setelah 40 menit bereaksi dipipet 5 mL dan dimasukkan ke erlenmeyer yang berisi dengan 10 mL HCl 0.02 N • Setelah 65 menit bereaksi dipipet 5 mL dan dimasukkan ke erlenmeyer yang berisi dengan 10 mL HCl 0.02 N
• Setelah 2 hari bereaksi, • Dipanaskan
• Didinginkan • Dipipet 5 mL dan
dimasukkan ke erlenmeyer yang berisi dengan 10 mL HCl 0.02 N
V NaOH V NaOH V NaOH V NaOH V NaOH V NaOH V NaOH
• Diaduk dengan baik • Dititrasi dengan NaOH 0.2N • Diaduk dengan baik • Dititrasi dengan NaOH 0.2N • Diaduk dengan baik • Dititrasi dengan NaOH 0.2N • Diaduk dengan baik • Dititrasi dengan NaOH 0.2N • Diaduk dengan baik • Dititrasi dengan NaOH 0.2N • Diaduk dengan baik • Dititrasi dengan NaOH 0.2N • Diaduk dengan baik • Dititrasi dengan NaOH 0.2N
Masing-masing dimasukkan ke dalam gelas kimia yang berbeda
Diletakkan di dalam thermostat (sampai suhu keduanya sama)
VII. Hasil Pengamatan
No ALUR KERJA HASIL AWAL HASIL AKHIR DUGAAN (REAKSI) KESIMPULAN
125 mL Etil Asetat 0.02N =
larutan jernih tak berwarna
100 mL NaOH 0.02N = larutan jernih tak berwarna
10 mL HCl 0.02 N = larutan jernih tak berwarna
Indicator PP = larutan jernih tak berwarna
NaOH 0.02 N = larutan jernih tak berwarna
125 mL Etil Asetat 0.02N + 100 mL NaOH 0.02N =
larutan jernih tak berwarna, terbentuk endapan putih 125 mL Etil Asetat 0.02N + 100 mL NaOH 0.02N + 10 mL HCl 0.02 N =
larutan jernih tak berwarna
125 mL Etil Asetat 0.02N + 100 mL NaOH 0.02N + 10 mL HCl 0.02 N + Indikator PP =
larutan jernih tak berwarna
Dititrasi dengan NaOH=
larutan merah muda
Volume NaOH : a. t=3’ → V= 8,1 ml b. t=8’ → V= 8,5 ml c. t=15’ → V= 8,6 ml d. t=25’ → V= 8,8 ml e. t=40’ → V= 9,1 ml f. t=65’ → V= 9,4 ml CH3COOC2H5 + NaOH CH3COONa + C2H5OH
Reaksi berorde dua
Reaksi
saponifikasi etil asetat merupakan reaksi berorde dua
Campuran Larutan
125 mL etil asetat 0.02 N
dicampurkan dengan cepat ke dalam larutan 100 mL NaOH 0.02 N
Dikocok dengan baik
Dijalankan stopwatch pada saat kedua larutan bercampur
125 mL etil asetat 0,02 N 100 mL NaOH 0,02 N
Kedua Suhu Larutan Sama
Campuran Larutan
Setelah 3 menit dipipet 5 mL dan dimasukkan ke Erlenmeyer yang bersi dengan 10 mL HCl 0.02 N
Diulangi pengambilan pada menit 8, 15, 25, 40, dan 65
Diaduk dengan baik
Ditambah indicator PP
Dititrasi dengan NaOH 0.02 N
No ALUR KERJA HASIL AWAL HASIL AKHIR DUGAAN (REAKSI) KESIMPULAN Campuran larutan yang
disimpan selama 2 hari= larutan keruh
Setelah dipanaskan = larutan jernih tak berwarna
Setelah didingnkan= larutan jernih tak berwarna
Campuran + 10 mL HCl 0.02 N =
larutan jernih tak berwarna
Ditambah indicator PP = larutan jernih tak
berwarna
Dititrasi dengan NaOH= larutan merah muda
V NaOH= 9,6 ml Campuran Larutan
Disimpan 2 hari
Dipanskan
Didinginkan
Dipipet 5 mL dan dimasukkan ke Erlenmeyer yang bersi dengan 10 mL HCl 0.02 N
Diaduk dengan baik
Ditambah indicator PP
Dititrasi dengan NaOH 0.02 N
VIII. Analisis dan Pembahasan
Percobaan mengenai kinetika reaksi saponifikasi etil asetat yang bertujuan untuk memberikan gambaran bahwa reaksi penyabunan hidroksida adalah reaksi orde 2, dan menentukan konstanta kecepatan reaksi pada reaksi tersebut. Langkah pertama adalah menyiapkan 125 mL etil asetat 0.02 N dan 100 mL NaOH 0.02 N, keduanya berupa larutan jernih tak berwarna. Selanjutnya 125 mL etil asetat 0.02 N dicampurkan dengan cepat ke dalam larutan 100 mL NaOH 0.02 N, reaksi yang dihasilkan adalah berupa larutan jernih tak berwarna dan terbentuk endapan putih. Persamaan reaksi dari kedua larutan tersebut adalah:
CH3COOC2H5(aq) + NaOH(aq) CH3COONa(aq) + C2H5OH(aq)
Campuran larutan dikocok dengan baik selama selang waktu yang berbeda. Selang waktu pertama campuran larutan dikocok dengan baik selama 3 menit, kemudian diambil dengan menggunakan pipet sebanyak 5 mL yang berupa larutan jernih tak berwarna, dan dimasukkan ke dalam Erlenmeyer yang telah berisi dengan 10 mL HCl 0.02 N, pada penambahan 10 mL HCl 0.02 N tidak terbentuk perubahan yang signifikan, reaksi yang dihasilkan tetap berupa larutan jernih tak berwarna. Larutan yang dihasilkan selanjutnya ditambah dua tets indicator phenoliftalin yang merupakan larutan jernih tak berwarna, reaksi penambahan indicator phenoliftalin tidak terbentuk perubahan yang signifikan. Kemudian campuran larutan yang dihasilkan dititrasi dengan larutan NaOH 0.2 N sampai larutan merah muda. Untuk mendapatkan hasil yang valid, titrasi dilakukan sebanyak tiga kali yang kemudian diambil rata-rata hasil volume NaOH yang didapatkan, yaitu sebesar 8.1 mL.
Selang waktu kedua campuran larutan dikocok dengan baik selama 8 menit, kemudian diambil dengan menggunakan pipet sebanyak 5 mL yang berupa larutan jernih tak berwarna, dan dimasukkan ke dalam Erlenmeyer yang telah berisi dengan 10 mL HCl 0.02 N, pada penambahan 10 mL HCl 0.02 N tidak terbentuk perubahan yang signifikan, reaksi yang dihasilkan tetap berupa larutan jernih tak berwarna. Larutan yang dihasilkan selanjutnya ditambah dua tets indicator phenoliftalin yang merupakan larutan jernih tak berwarna, reaksi penambahan indicator phenoliftalin tidak terbentuk perubahan yang signifikan. Kemudian campuran larutan yang dihasilkan dititrasi dengan larutan NaOH 0.2 N sampai larutan merah muda. Untuk mendapatkan hasil yang valid,
titrasi dilakukan sebanyak tiga kali yang kemudian diambil rata-rata hasil volume NaOH yang didapatkan, yaitu sebesar 8.5 mL.
Selang waktu ketiga campuran larutan dikocok dengan baik selama 15 menit, kemudian diambil dengan menggunakan pipet sebanyak 5 mL yang berupa larutan jernih tak berwarna, dan dimasukkan ke dalam Erlenmeyer yang telah berisi dengan 10 mL HCl 0.02 N, pada penambahan 10 mL HCl 0.02 N tidak terbentuk perubahan yang signifikan, reaksi yang dihasilkan tetap berupa larutan jernih tak berwarna. Larutan yang dihasilkan selanjutnya ditambah dua tets indicator phenoliftalin yang merupakan larutan jernih tak berwarna, reaksi penambahan indicator phenoliftalin tidak terbentuk perubahan yang signifikan. Kemudian campuran larutan yang dihasilkan dititrasi dengan larutan NaOH 0.2 N sampai larutan merah muda. Untuk mendapatkan hasil yang valid, titrasi dilakukan sebanyak tiga kali yang kemudian diambil rata-rata hasil volume NaOH yang didapatkan, yaitu sebesar 8.6 mL.
Selang waktu kedua campuran larutan dikocok dengan baik selama 25 menit, kemudian diambil dengan menggunakan pipet sebanyak 5 mL yang berupa larutan jernih tak berwarna, dan dimasukkan ke dalam Erlenmeyer yang telah berisi dengan 10 mL HCl 0.02 N, pada penambahan 10 mL HCl 0.02 N tidak terbentuk perubahan yang signifikan, reaksi yang dihasilkan tetap berupa larutan jernih tak berwarna. Larutan yang dihasilkan selanjutnya ditambah dua tets indicator phenoliftalin yang merupakan larutan jernih tak berwarna, reaksi penambahan indicator phenoliftalin tidak terbentuk perubahan yang signifikan. Kemudian campuran larutan yang dihasilkan dititrasi dengan larutan NaOH 0.2 N sampai larutan merah muda. Untuk mendapatkan hasil yang valid, titrasi dilakukan sebanyak tiga kali yang kemudian diambil rata-rata hasil volume NaOH yang didapatkan, yaitu sebesar 8.8 mL.
Selang waktu kedua campuran larutan dikocok dengan baik selama 40 menit, kemudian diambil dengan menggunakan pipet sebanyak 5 mL yang berupa larutan jernih tak berwarna, dan dimasukkan ke dalam Erlenmeyer yang telah berisi dengan 10 mL HCl 0.02 N, pada penambahan 10 mL HCl 0.02 N tidak terbentuk perubahan yang signifikan, reaksi yang dihasilkan tetap berupa larutan jernih tak berwarna. Larutan yang dihasilkan selanjutnya ditambah dua tets indicator phenoliftalin yang merupakan larutan jernih tak berwarna, reaksi penambahan indicator phenoliftalin tidak terbentuk
perubahan yang signifikan. Kemudian campuran larutan yang dihasilkan dititrasi dengan larutan NaOH 0.2 N sampai larutan merah muda. Untuk mendapatkan hasil yang valid, titrasi dilakukan sebanyak tiga kali yang kemudian diambil rata-rata hasil volume NaOH yang didapatkan, yaitu sebesar 9.1 mL.
Selang waktu kedua campuran larutan dikocok dengan baik selama 65 menit, kemudian diambil dengan menggunakan pipet sebanyak 5 mL yang berupa larutan jernih tak berwarna, dan dimasukkan ke dalam Erlenmeyer yang telah berisi dengan 10 mL HCl 0.02 N, pada penambahan 10 mL HCl 0.02 N tidak terbentuk perubahan yang signifikan, reaksi yang dihasilkan tetap berupa larutan jernih tak berwarna. Larutan yang dihasilkan selanjutnya ditambah dua tets indicator phenoliftalin yang merupakan larutan jernih tak berwarna, reaksi penambahan indicator phenoliftalin tidak terbentuk perubahan yang signifikan. Kemudian campuran larutan yang dihasilkan dititrasi dengan larutan NaOH 0.2 N sampai larutan merah muda. Untuk mendapatkan hasil yang valid, titrasi dilakukan sebanyak tiga kali yang kemudian diambil rata-rata hasil volume NaOH yang didapatkan, yaitu sebesar 9.4 mL.
Selang waktu kedua campuran larutan dikocok dengan baik selama 2 hari menghasilkan larutan keruh, kemudian campuran larutan dipanaskan untuk menghasilkan larutan jernih tak berwarna, setelah larutan didinginkan selanjutnya diambil dengan menggunakan pipet sebanyak 5 mL yang berupa larutan jernih tak berwarna, dan dimasukkan ke dalam Erlenmeyer yang telah berisi dengan 10 mL HCl 0.02 N, pada penambahan 10 mL HCl 0.02 N tidak terbentuk perubahan yang signifikan, reaksi yang dihasilkan tetap berupa larutan jernih tak berwarna. Larutan yang dihasilkan selanjutnya ditambah dua tets indicator phenoliftalin yang merupakan larutan jernih tak berwarna, reaksi penambahan indicator phenoliftalin tidak terbentuk perubahan yang signifikan. Kemudian campuran larutan yang dihasilkan dititrasi dengan larutan NaOH 0.2 N sampai larutan merah muda. Untuk mendapatkan hasil yang valid, titrasi dilakukan sebanyak tiga kali yang kemudian diambil rata-rata hasil volume NaOH yang didapatkan, yaitu sebesar 9.6 mL.
Dari data hasil pengamatan yang didapatkan, selanjutnya akan didistribusikan dalam sebuah table sebagai berikut:
waktu (s) n HCl sisa (mmol)
n HCl bereaksi
(mmol) (a-x) mmol (b-x) mmol
180 0.162 1.962 0.538 1.962 480 0.17 1.970 0.503 1.970 900 0.172 1.972 0.528 1.972 1500 0.176 1.976 0.524 1.976 2400 0.182 1.982 0.518 1.982 3900 0.188 1.988 0.512 1.988 172800 0.192 0.008 0.508 1.992
Sehingga di dapat nilai ln (a-x) / (b-x) sebagai berikut :
t (menit) ln (a-x) / (b-x) 3 0,22700967 8 0,22618461 15 0,22597928 25 0,22556976 40 0,22495825 65 0,22435007 2880 0,22394644
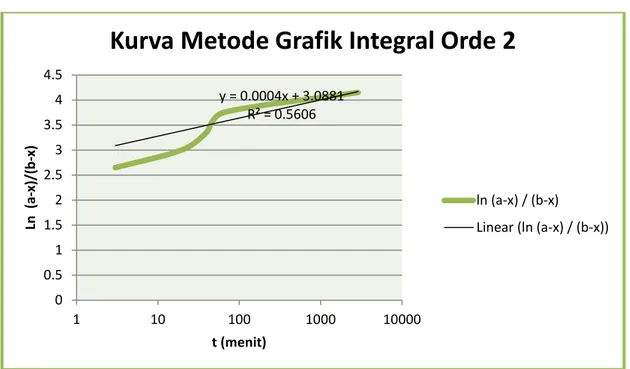
Grafik yang didapatkan:
Dari grafik diatas, maka dapat diketahui bahwa reaksi memiliki orde dua, dimana ciri dari reaksi berorde dua ini adalah dapat dilihat dari grafiknya yang mirirng keatas.
IX. Kesimpulan
Reaksi saponifikasi merupakan reaksi berorde dua dengan nilai laju reaksi pada :
t 3 menit adalah 0,1258 t 8 menit adalah 0,0559 t 15 menit adalah 0,0335 t 25 menit adalah 0,0233 t 40 menit adalah 0,01919 t 65 menit adalah 0,0175 t 2880 menit adalah 0,0014 X. Jawaban Pertanyaan
1. Kenyataan apakah yang membuktikan bahwa reaksi penyabunan etil asetat ini adalah reaksi orde dua?
Jawab:
Yang membuktikan bahwa reaksi penyabunan etil asetat memiliki orde duayaitu dapat dilihat dari grafik di bawah ini:
y = 0.0004x + 3.0881 R² = 0.5606 0 0.5 1 1.5 2 2.5 3 3.5 4 4.5 1 10 100 1000 10000 Ln (a -x)/ (b -x) t (menit)
Kurva Metode Grafik Integral Orde 2
ln (a-x) / (b-x) Linear (ln (a-x) / (b-x))
2. Apakah perbedaan antara orde reaksi dengan kemolekulan reaksi?
Jawab:
a. Orde reaksi adalah banyaknya faktor konsentrasi zat reaktan yang
mempengaruhi kecepatan reaksi.
b. Kemolekulan reaksi merupakan banyaknya molekul zat pereaksi (reaktan)
dalam sebuah persamaan stoikiometri reaksi yang sederhana. Kemolekulan reaksi selalu berupa bilangan bulat positif.
Contoh:
Reaksi: a A + b B c C + d D Kemolekulan reaksinya = a + b
Reaksi: 2 A + B 3 C + 2 D
Kemolekulan reaksinya = 2 + 1 = 3
3. Apakah yang mempengaruhi laju reaksi? Jelaskan!
Jawab:
Laju reaksi dipengaruhi oleh beberapa faktor, antara lain:
a. Luas permukaan sentuh
Luas permukaan sentuh memiliki peranan yang sangat penting dalam jumlah yang besar, sehingga menyebabkan laju reaksi semakin cepat. Begitu juga sebaliknya, apabila semakin kecil luas permukaan bidang sentuh, maka semakin kecil tumbukan yang terjadi antar partikel, sehingga laju reaksi pun semakin kecil.
b. Suhu
Suhu juga turut berperan dalam mempengaruhi laju reaksi. Apabila suhu pada suatu reaksi yang berlangsung dinaikkan, maka menyebabkan partikel semakin aktif bergerak, sehingga tumbukan yang terjadi semakin sering, menyebabkan laju reaksi semakin besar. Sebaliknya, apabila suhu diturunkan, maka partikel semakin tak aktif, sehingga laju reaksi semakin kecil.
c. Katalis
Katalis adalah suatu zat yang mempercepat laju reaksi kimia pada suhu tertentu, tanpa mengalami perubahan atau terpakai oleh reaksi itu sendiri. Suatu katalis berperan dalam reaksi tapi bukan sebagai pereaksi ataupun produk. Katalis memungkinkan reaksi berlangsung lebih cepat atau memungkinkan reaksi pada suhu lebih rendah akibat perubahan yang dipicunya terhadap pereaksi. Katalis menyediakan suatu jalur pilihan dengan energi aktivasi yang lebih rendah. Katalis mengurangi energi yang dibutuhkan untuk berlangsungnya reaksi.
d. Molaritas
Molaritas adalah banyaknya mol zat terlarut tiap satuan volum zat pelarut. Hubungannya dengan laju reaksi adalah bahwa semakin besar molaritas suatu zat, maka semakin cepat suatu reaksi berlangsung. Dengan demikian pada molaritas yang rendah suatu reaksi akan berjalan lebih lambat daripada molaritas yang tinggi.
e. Konsentrasi
Karena persamaan laju reaksi didefinisikan dalam bentuk konsentrasi reaktan maka dengan naiknya konsentrasi maka naik pula kecepatan reaksinya. Artinya semakin tinggi konsentrasi maka semakin banyak molekul reaktan yang tersedia dengan demikian kemungkinan bertumbukan akan semakin banyak juga sehingga kecepatan reaksi meningkat.
4. Apakah yang dimaksud dengan tetapan laju reaksi?
Jawab:
Tetapan laju reaksi (k) adalah perbandingan antara laju reaksi dengan konsentrasi reaktan. Nilai k akan semakin besar jika reaksi berlangsung cepat, walaupun dengan konsentrasi reaktan dalam jumlah kecil. Nilai k hanya dapat diperoleh melalui analisis data eksperimen, tidak berdasarkan stoikiometri maupun koefisien reaksi.
XI. Daftar Pustaka
Anonim. 2011. Saponifikasi. http://id.wikipedia.org/wiki/Saponifikasi. (Diakses pada hari Sabtu, Tanggal 30 Maret 2013, Pukul 13.00 WIB).
Azizah, Utiyah. 2004. LAJU REAKSI. Jakarta: Direktur Jenderal Pendidikan Dasar dan Menengah.
Daniel et at. 1970. Exsperiment Physical Chemistry, 7th Ed. New York: Mc. Graw Hill.
Endah. Soepi dan Suyono. 1990. Kinetika Kimia. Surabaya: University Press IKIP Surabaya.
Findly. 1976. Pratical Physical Chemistry, 8th Ed.
Laidler, Keith. J and Meisle, John H. 1982. Physical Chemistry. California: The Benjamin / Cuming Publithing Compay, Inc.
Sahrun.2010. Laporan Tetap Praktikum Kimia Fisika II. Mataram:Jurusan Kimia, Fakultas MIPA, Universitas Mataram. (Diakses pada hari Sabtu, Tanggal 30 Maret 2013, Pukul 13.30 WIB).
Suyono dan Yonata, Bertha. 2011. Panduan Praktikum Kimia Fisika III. Surabaya: Universitas Negeri Surabaya.
LAMPIRAN PERHITUNGAN
Mol CH3COOC2H5 = M . V = 0,02 M . 125 mL = 2,5 mmol Mol NaOH = M . V = 0,02 M . 100 mL = 2 mmolCH3COOC2H5 + NaOH CH3COONa + C2H5OH
M 2,5 2 R x x x x S (2,5-x) (2-x) x x Mol HCl = M . V = 0,02 M . 10 mL = 0,2 mmol HCl sisa t = 3 menit
mmol HCl = mmol NaOH
= (0,02 N) (8,1 mL) = 0,162 mmol
t = 8 menit
mmol HCl = mmol NaOH
= (0,02 N) (8,5 mL) = 0,17 mmol
t = 15 menit
mmol HCl = mmol NaOH
= (0,02 N) (8,6 mL) = 0,172 mmol
t = 25 menit
mmol HCl = mmol NaOH
= (0,02 N) (8,8 mL) = 0,176 mmol
t = 40 menit
mmol HCl = mmol NaOH
= (0,02 N) (9,1 mL) = 0,182 mmol
t = 65 menit
mmol HCl = mmol NaOH
= (0,02 N) (9,4 mL) = 0,188 mmol
t = 2880 menit
mmol HCl = mmol NaOH
= (0,02 N) (9,6 mL)
= 0,192 mmol
mol NaOH sisa (b-x)
t = 3 menit 0,2 mmol – 0,162 mmol = 0,038 mmol t = 8 menit 0,2 mmol – 0,17 mmol = 0,03 mmol t = 15 menit 0,2 mmol – 0,172 mmol = 0,028 mmol t = 25 menit 0,2 mmol – 0,176 mmol = 0,024 mmol t = 40 menit 0,2 mmol – 0,182 mmol = 0,018 mmol
t = 65 menit 0,2 mmol – 0,188 mmol = 0,012 mmol t = 2880 menit 0,2 mmol – 0,192 mmol = 0,008 mmol
mol HCl yang bereaksi (X) = mol NaOH (b-x)
t = 3 menit b-x = 0,038 mmol x = 2 mmol - 0,038 mmol x = 1,962 mmol t = 8 menit b-x = 0,030 mmol x = 2 mmol - 0,030 mmol x = 1,970 mmol t = 15 menit b-x = 0,028 mmol x = 2 mmol - 0,028 mmol x = 1,972 mmol t = 25 menit b-x = 0,024 mmol x = 2 mmol - 0,024 mmol x = 1,976 mmol t = 40 menit b-x = 0,018 mmol x = 2 mmol - 0,018 mmol x = 1,982 mmol
t = 65 menit b-x = 0,012 mmol x = 2 mmol - 0,012 mmol x = 1,988 mmol t = 2880 menit b-x = 0,008 mmol x = 2 mmol - 0,008 mmol x = 1,992 mmol (a-x)
t = 3 menit 2,5 mmol – 1,962 mmol = 0,538 mmol t = 8 menit 2,5 mmol – 1,970 mmol = 0,503 mmol t = 15 menit 2,5 mmol – 1,972 mmol = 0,528 mmol t = 25 menit 2,5 mmol – 1,976 mmol = 0,524 mmol t = 40 menit 2,5 mmol – 1,982 mmol = 0,518 mmol t = 65 menit 2,5 mmol – 1,988 mmol = 0,512 mmol t = 2880 menit 2,5 mmol – 1,992 mmol = 0,508 mmol
a : mol CH3COOC2H5 mula-mula = 2,5 mmol
b : mol NaOH mula-mula = 2 mmol x : mol yang bereaksi
k1 = = = (1/90) . (11.3263) = 0,1258
k2 = = = (1/240) . (13,4133) = 0,0559 k3 = = = (1/450) . (15,0857) = 0,0335 k4 = = = (1/750) . (17,4667) = 0,0233 k5 = = = (1/1200) . (23,0222) = 0,01919 k6 = = = (1/1950) . (34,1333) = 0,0175
k7 = = = (1/36400) . (50,8000) = 0,0014 Grafik t (menit) ln (a-x) / (b-x) a-x b-x (a-x)/(b-x) 3 0,22700967 2,462 1,962 1,255 8 0,22618461 2,47 1,97 1,254 15 0,22597928 2,472 1,972 1,254 25 0,22556976 2,476 1,976 1,253 40 0,22495825 2,482 2 1,252 65 0,22435007 2,488 1,988 1,252 2880 0,22394644 2,492 1,992 1,251 y = 0.0004x + 3.0881 R² = 0.5606 0 0.5 1 1.5 2 2.5 3 3.5 4 4.5 1 10 100 1000 10000 Ln (a -x)/ (b -x) t (menit)
Kurva Metode Grafik Integral Orde 2
ln (a-x) / (b-x) Linear (ln (a-x) / (b-x))
LAMPIRAN DOKUMENTASI
HCl + NaOH + etil asetat + indikator PP ( sebelum dititrasi ) Menit k-3 setelah titrasi dengan NaOH 0,02 M Menit k-8 setelah titrasi dengan NaOH 0,02 M Menit k-15 setelah titrasi dengan NaOH 0,02 M
Menit k-25 setelah titrasi dengan NaOH 0,02 M Menit k-40 setelah titrasi dengan NaOH 0,02 M Menit k-65 setelah titrasi dengan NaOH 0,02 M