KARAKTERISASI MUTU FISIKA KIMIA GELATIN KULIT
IKAN KAKAP MERAH (Lutjanus sp.) HASIL PROSES
PERLAKUAN ASAM
Oleh :
Ima Hani Setiawati
C34104056
PROGRAM STUDI TEKNOLOGI HASIL PERIKANAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
2009
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa skripsi dengan judul Karakterisasi Mutu Fisika Kimia Gelatin Kulit Ikan Kakap Merah (Lutjanus sp.) Hasil Proses Perlakuan Asam adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau kutipan dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir skripsi.
Bogor, Januari 2009
RINGKASAN
IMA HANI SETIAWATI. C34104056. Karakterisasi Mutu Fisika Kimia Gelatin Kulit Ikan Kakap Merah (Lutjanus sp.) Hasil Proses Perlakuan Asam. Dibimbing oleh WINI TRILAKSANI dan MALA NURILMALA.
Gelatin yang banyak beredar adalah produk yang terbuat dari kulit dan tulang sapi atau babi yang menimbulkan masalah di masyarakat baik kehalalan maupun kesehatan. Kulit ikan kakap merah (Lutjanus sp) dapat dijadikan gelatin karena di dalamnya terdapat protein kolagen. Konversi kulit ikan kakap merah (Lutjanus sp) menjadi gelatin dapat dilakukan menggunakan asam dan basa. Tujuan penelitian ini adalah memanfaatkan limbah kulit ikan kakap merah (Lutjanus sp) sebagai bahan baku gelatin. Perlakuan yang dilakukan pada penelitian ini adalah menggunakan asam asetat dengan lama perendaman 12, 18, dan 24 jam dikombinasikan dengan konsentrasi 1%-5%.
Rendemen gelatin pada penelitian pendahuluan dengan kombinasi lama perendaman 12 jam dan konsentrasi asam asetat 1%-5% berkisar antara 7,78-13,33%; pH 4,34-5,56; viskositas 12-16,2 cP; serta kekuatan gel 150-225 bloom, sedangkan pada kombinasi lama perendaman 24 jam dengan
konsentrasi asam asetat 1%-5% dihasilkan rendemen berkisar antara 5,32-11,7%; pH 4,88-5,32; viskositas 13,8-18,2 cP; serta kekuatan gel 75-285 bloom. Konsentrasi 1%, 2%, dan 3% dipilih sebagai perlakuan pada penelitian utama dikombinasikan dengan perendaman asam asetat selama 12, 18, dan 24 jam
Nilai rendemen gelatin dengan kombinasi lama perendaman 12 jam dan konsentrasi asam asetat 1%-3% berkisar antara 11,8-13,86%; pH 5,01-5,33; viskositas 14,4-15,6, cP; serta kekuatan gel 202,5-230 bloom. Nilai rendemen pada kombinasi lama perendaman 18 jam dengan konsentrasi asam asetat 1%-3% dihasilkan berkisar antara 14,33-16,8%; pH 5-5,45; viskositas 15,44- 17,4 cP; serta kekuatan gel 252,5-312,5 bloom. Nilai rendemen pada kombinasi lama perendaman 24 jam dengan konsentrasi asam asetat 1%-3% dihasilkan berkisar antara 11,04-12,95%; pH 4,98-5,1; viskositas 12,3-15,56 cP; serta nilai kekuatan gel 207,5-285 bloom.
Gelatin terbaik diperoleh dari kombinasi lama perendaman 18 jam dengan konsentrasi asam asetat 3%. Analisis fisika kimia terdiri dari analisis proksimat dengan hasil kadar air 10,19%, kadar abu 0,4%, kadar lemak 0,33%, dan kadar protein 88,88%; kekuatan gel 312,5 bloom; viskositas 17,4 cP; pH 5,45; titik gel 10,15 ºC; titik leleh 27,26 ºC; titik isoelektrik 8; derajat putih 34,7%; sementara logam berat Pb dan Hg tidak terdeteksi. Hasil uji organoleptik gelatin kulit ikan kakap merah masih lebih rendah dibanding gelatin komersial dan gelatin standar laboratorium, terutama dari segi flavor. Tetapi dari segi warna, gelatin kulit ikan kakap merah lebih baik dibanding gelatin komersial dan dari segi penampakan gelatin kulit ikan kakap merah lebih baik dibanding gelatin standar laboratorium.
KARAKTERISASI MUTU FISIKA KIMIA GELATIN KULIT
IKAN KAKAP MERAH (Lutjanus sp.) HASIL PROSES
PERLAKUAN ASAM
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
Oleh :
Ima Hani Setiawati
C34104056
PROGRAM STUDI TEKNOLOGI HASIL PERIKANAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
2009
LEMBAR PENGESAHAN
Judul Skripsi : KARAKTERISASI MUTU FISIKA KIMIA GELATIN KULIT IKAN KAKAP MERAH (Lutjanus sp.) HASIL PROSES PERLAKUAN ASAM
Nama : Ima Hani Setiawati
NRP : C34104056
Menyetujui : Komisi Pembimbing
Pembimbing I Pembimbing II
Ir. Wini Trilaksani, M.Sc Mala Nurilmala, S.Pi, M.Si NIP : 131 578 851 NIP : 132 315 793
Mengetahui :
Dekan Fakultas Perikanan dan Ilmu Kelautan
Prof. Dr. Ir. Indra Jaya, M.Sc NIP : 131 578 799
Tanggal Lulus :
KATA PENGANTAR
Puji dan syukur ke hadirat Allah SWT yang telah melimpahkan rahmat dan hidayah-Nya, sehingga penulis dapat menyelesaikan skripsi ini dengan baik. Skripsi dengan judul ”Karakterisasi Mutu Fisika Kimia Gelatin Kulit Ikan Kakap Merah (Lutjanus sp.) Hasil Proses Perlakuan Asam” merupakan salah satu syarat untuk memperoleh gelar Sarjana di Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Pada kesempatan ini penulis ingin mengucapkan terima kasih kepada : 1) Papa, mama, kakak-kakakku (A’Romi, A’Drajat, A’Syarif & T’ Neng), serta
adik-adikku (Lillah & Annisa) tercinta atas limpahan kasih sayang, doa yang selalu mengalir tanpa henti, serta motivasi dan dukungan yang tak terhingga kepada penulis.
2) Ir. Wini Trilaksani M.Sc dan Mala Nurilmala S.Pi, M.Si. selaku dosen
pembimbing yang telah memberikan arahan, bimbingan, nasihat serta motivasi dalam menyelesaikan tugas akhir ini.
3) Dra. Pipih Suptijah MBA dan Dr. Ir. Agoes Murdiono Jacoeb selaku dosen penguji yang telah memberikan saran dan kritikan yang membangun demi penyempurnaan skripsi ini.
4) Keluarga besar Hari Trilaksono (Bapak, Ibu, Mas Adhi, Mba’ Mia dan Mas
Tomi) yang telah menjadi keluarga kedua atas kasih sayang, doa dan bantuan moril maupun materil yang tak terhingga kepada penulis.
5) Ibu Windy, Ibu Ire, dan mba’ Fanny atas perhatian, semangat, dan bantuan
moril maupun materiil selama penyelesaian skripsi ini.
6) Dr. Tati Nurhayati S.pi, Msi selaku dosen Pembimbing Akademik.
7) Vera, Anez, Syeni, dan Indah atas persahabatan yang tidak akan pernah
terlupakan.
8) Dosen-dosen, staf administrasi (Pak Ade, Mas Ismail, Mas Zaky dan staf
9) Teman-temanku Luh Putu Ari, Alim, An-Nur Crew, Al-demi Crew,
anak-anak di lab. Ombenk dan teman-teman seperjuangan Haris, Dwi, Nuzul, Dhias, Bayhaqi, Bobi, Deslina, Fuji, Ulfa, Nicolas, Yugha serta teman-teman THP’41 yang selalu memberi semangat selama mengerjakan penelitian sehingga skripsi ini dapat diselesaikan.
10) Ibu Rubiah, Pak Sobirin, dan Pak Danu yang telah membantu dalam
penelitian sehingga skripsi ini dapat diselesaikan dengan baik.
11) Teman-teman THP’39, THP’40 dan THP’42 yang tidak bisa disebutkan
satu-persatu.
12) Agung Setiaji atas kasih sayang, perhatian dan waktu yang telah diberikan
kepada penulis.
13) Semua pihak yang telah membantu penulis selama penelitian dan
penyusunan skripsi ini yang tidak dapat disebutkan satu-persatu.
Penulis menyadari bahwa dalam penulisan skripsi ini masih banyak kekurangannya. Oleh karena itu penulis mengharapkan saran dan kritik yang bersifat membangun dari semua pihak demi penyempurnaan skripsi ini. Semoga skripsi ini dapat bermanfaat bagi semua pihak yang memerlukannya.
Bogor, Januari 2009
RIWAYAT HIDUP
Penulis bernama lengkap Ima Hani Setiawati. Dilahirkan pada tanggal 09 November 1986 di Bogor dari pasangan Bapak Soedarman dan Ibu Djubaedah. Penulis merupakan anak ke empat dari enam bersaudara.
Pendidikan formal penulis dimulai pada tahun 1992 di SDN Bantarkemang II dan lulus pada tahun 1998, kemudian dilanjutkan ke SMPN 1 Bogor dan lulus pada tahun 2001. Pendidikan sekolah menengah umum penulis tempuh di SMUN 2 Bogor dan lulus pada tahun 2004, pada tahun yang sama penulis diterima di Program Studi Teknologi Hasil Perairan, Fakultas perikanan dan Ilmu Kelautan, Institut Pertanian Bogor melalui jalur Ujian Seleksi Masuk IPB (USMI).
Selama kuliah penulis aktif sebagai pengurus Himpunan profesi Mahasiswa Teknologi Hasil Perikanan (HIMASILKAN) dan pernah menjadi asisten mata kuliah Diversifikasi Hasil Perikanan dan Teknologi Hasil Samping Perikanan. Penulis juga pernah mengikuti seminar kewirausahaan serta seminar ISO 22000 in Fisheries Industries. Selain itu penulis pernah mengikuti Program Kreatifitas Mahasiswa (PKM) yang diselenggarakan oleh DIKTI pada tahun 2008. Sebagai salah satu syarat memperoleh gelar Sarjana Perikanan pada Program Studi Teknologi Hasil Perikanan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor penulis melakukan penelitian serta penyusunan skripsi dengan judul Karakterisasi Mutu Fisika Kimia Gelatin Kulit Ikan Kakap Merah (Lutjanus sp.) Hasil Proses Perlakuan Asam.
DAFTAR ISI Halaman DAFTAR TABEL ... iv DAFTAR GAMBAR... v DAFTAR LAMPIRAN ... vi 1. PENDAHULUAN ... 1 1.1 Latar Belakang ... 1 1.2 Tujuan... 3 2. TINJAUAN PUSTAKA ... 4
2.1 Deskripsi dan Klasifikasi Ikan Kakap Merah (Lutjanus sp.)... 4
2.2 Kulit Ikan ... 5 2.3 Kolagen... 6 2.4 Gelatin ... 8 2.5 Pembuatan Gelatin ... 11 2.6 Mutu Gelatin ... 13 2.7 Pemanfaatan Gelatin... 13 3. METODOLOGI... 15
3.1 Waktu dan Tempat Penelitian... 15
3.2 Bahan dan Alat Penelitian ... 15
3.3 Metode Penelitian... 15
3.3.1 Penelitian pendahuluan ... 16
3.3.2 Penelitian utama ... 18
3.4 Analisis Fisika dan Kimia Gelatin ... 18
3.4.1 Rendemen (AOAC 1995)... 18
3.4.2 Kekuatan gel (Gaspar 1998)... 18
3.4.3 Viskositas (British Standard 757 1975) ... 19
3.4.4 Derajat putih (Anonimb)... 19
3.4.5 Derajat keasaman (pH) (British Standard 757 1975)... 19
3.4.6 Kadar air (AOAC 1995)... 19
3.4.7 Kadar abu (AOAC 1995) ... 20
3.4.8 Kadar protein (AOAC 1995)... 20
3.4.9 Kadar lemak (AOAC 1995) ... 21
3.4.10 Kandungan logam (Pb dan Hg) (Hutagalung 1997) ... 21
3.4.11 Titik leleh (Suryaningrum dan Utomo 2002)... 21
3.4.12 Titik gel (Suryaningrum dan Utomo 2002)... 22
3.4.14 Asam amino (Muchtadi dkk 1992)... 22
3.4.15 Uji organoleptik (Soekarto dan Hubies 1992)... 23
3.5 Rancangan Percobaan... 23
4. HASIL DAN PEMBAHASAN... 25
4.1 Penelitian Pendahuluan... 25
4.1.1 Rendemen gelatin ... 25
4.1.2 Nilai pH gelatin ... 26
4.1.3 Viskositas gelatin... 28
4.1.4 Kekuatan gel gelatin ... 29
4.2 Penelitian Utama ... 31
4.2.1 Rendemen gelatin ... 31
4.2.2 Nilai pH gelatin ... 32
4.2.3 Viskositas gelatin... 33
4.2.4 Kekuatan gel gelatin ... 35
4.2.5 Analisis komposisi kimia gelatin... 36
a. Kadar air ... 37
b. Kadar abu ... 38
c. Kadar lemak... 38
a. Kadar protein ... 39
4.2.6 Analisis sifat fisika dan kimia gelatin... 40
a. Kekuatan gel gelatin... 40
b. Viskositas gelatin... 41
c. Nilai pH gelatin... 42
d. Titik gel dan titik leleh gelatin... 42
e. Titik isoelektrik gelatin ... 43
f. Derajat putih gelatin ... 45
g. Logam berat Pb dan Hg gelatin ... 45
4.2.7 Analisis asam amino gelatin... 46
4.2.8 Uji organoleptik gelatin ... 48
5. KESIMPULAN DAN SARAN... 50
5.1 Kesimpulan ... 50
5.2 Saran... 50
DAFTAR PUSTAKA... 51
DAFTAR TABEL
No. Halaman
1. Data impor gelatin periode tahun 1995-2003 ... 2
2. Komposisi ikan kakap merah (Lutjanus sp.) ... 5
3. Produksi ikan kakap merah Indonesia tahun 2001-2005 ... 5
4. Penyebaran kolagen dalam jaringan hewan mamalia ... 7
5. Komposisi asam amino berbagai kulit hewan ... 8
6. Sifat gelatin tipe A dan tipe B... 10
7. Komposisi asam amino gelatin... 11
8. Standar mutu gelatin berdasarkan SNI... 13
9. Persyaratan gelatin berdasarkan FAO... 13
10. Penggunaan gelatin dalam industri pangan dan non pangan ... 14
11. Analisis proksimat gelatin hasil perlakuan terbaik (3%, 18 jam) dibandingkan dengan gelatin komersial dan standar laboratorium hasil pengujian Nurilmala (2004) ... 37
12. Sifat fisika kimia gelatin hasil perlakuan terbaik (3%, 18 jam) dibandingkan dengan gelatin komersia dan standar laboratorium hasil pengujian Nurilmala (2004) ... 40
13. Analisis komposisi asam amino gelatin hasil perlakuan terbaik (3%, 18 jam) dibandingkan dengan gelatin komersial dan standar laboratorium hasil pengujian Nurilmala (2004) ... 47
DAFTAR GAMBAR
No Halaman 1. Ikan kakap merah (Lutjanus sp.)... 4 2. Proses pembentukan gel gelatin (deMan 1997)... 9 3. Struktur kimia gelatin (Poppe 1992)... 10 4. Proses pembuatan gelatin kulit ikan kakap merah (Lutjanus sp.)
(Penelitian pendahuluan) (*Modifikasi dari Pelu et al. 1998) ... 17
5. Proses pembuatan gelatin kulit ikan kakap merah (Lutjanus sp.)
(Penelitian utama) (*Modifikasi dari Pelu et al. 1998) ... 24 6. Histogram rendemen gelatin kulit ikan kakap merah pada penelitian
pendahuluan... 25 7. Histogram pH gelatin kulit ikan kakap merah pada penelitian
pendahuluan... 27 8. Histogram viskositas gelatin kulit ikan kakap merah pada penelitian
pendahuluan... 28 9. Histogram kekuatan gel gelatin kulit ikan kakap merah pada penelitian pendahuluan... 30 10. Histogram rendemen gelatin kulit ikan kakap merah pada penelitian
utama ... 32 11. Histogram pH gelatin kulit ikan kakap merah pada penelitian utama ... 33 12. Histogram viskositas gelatin kulit ikan kakap merah pada penelitian
utama ... 34 13. Histogram kekuatan gel gelatin kulit ikan kakap merah pada penelitian utama ... 35 14. Gelatin standar laboratorium (GT-S), gelatin komersial (GT-K), dan
DAFTAR LAMPIRAN
No Halaman 1. Hasil uji organoleptik pasangan segitiga terhadap
gelatin komersial... 57
2. Hasil uji organoleptik pasangan segitiga terhadap gelatin standar laboratorium ... 57
3. Gambar proses pecucian (demineralisasi)... 57
4. Gambar proses ekstraksi... 58
5. Gambar lembaran gelatin ... 58
6. Gambar serbuk gelatin ... 58
7. Gambar Rheoner RE 3305... 59
8. Gambar Brookfield Syncro-Lectric Viskometer... 59
9. Gambar pH meter... 59
10. Sifat gelati tipe A dan B menurut Poppe (1992)... 60
11. Analisis ragam faktorial rendemen (penelitian pendahuluan)... 60
12. Uji lanjut Duncan rendemen (penelitian pendahuluan)... 60
13. Analisis ragam faktorial pH (penelitian pendahuluan) ... 60
14. Uji lanjut Duncan pH (penelitian pendahuluan)... 61
15. Analisis ragam faktorial viskositas (penelitian pendahuluan)... 61
16. Uji lanjut Duncan viskositas (penelitian pendahuluan) ... 61
17. Analisis ragam faktorial kekuatan gel (penelitian pendahuluan) ... 61
18. Uji lanjut Duncan kekuatan gel (penelitian pendahuluan)... 62
19. Analisis ragam faktorial rendemen (penelitian utama) ... 62
20. Uji lanjut Duncan rendemen (penelitian utama)... 62
21. Analisis ragam faktorial pH (penelitian utama)... 63
22. Uji lanjut Duncan pH (penelitian utama)... 63
23. Analisis ragam faktorial viskositas (penelitian utama)... 63
24. Uji lanjut Duncan viskositas (penelitian utama) ... 64
25. Analisis ragam faktorial kekuatan gel (penelitian utama) ... 64
26. Uji lanjut Duncan kekuatan gel (penelitian utama) ... 64
27. Grafik hasil uji asam amino gelatin kuli ikan kakap merah dengan HPLC ... 65
1. PENDAHULUAN 1.1. Latar Belakang
Gelatin merupakan salah satu jenis protein yang diperoleh dari kolagen alami yang terdapat dalam kulit dan tulang (Yi et al. 2006). Gelatin banyak digunakan untuk berbagai keperluan industri, baik industri pangan maupun non-pangan karena memiliki sifat yang khas, yaitu dapat berubah secara reversibel dari bentuk sol ke gel, mengembang dalam air dingin, dapat membentuk film, mempengaruhi viskositas suatu bahan, dan dapat melindungi sistem koloid.
Industri yang paling banyak memanfaatkan gelatin adalah industri pangan. Dalam industri pangan, menurut Poppe (1992) dalam LPPOM MUI (2008) gelatin digunakan sebagai pembentuk busa (whipping agent), pengikat (binder agent), penstabil (stabilizer), pembentuk gel (gelling agent), perekat (adhesive), peningkat viskositas (viscosity agent), pengemulsi (emulsifier), finning agent, crystal modifier, dan pengental (thickener). Industri pangan yang membutuhkan gelatin antara lain industri konfeksioneri, produk jelly, industri susu, margarin dan food suplement.
Gelatin juga digunakan dalam industri non-pangan seperti industri farmasi, fotografi, kosmetik, dan industri kertas. Gelatin dapat digunakan dalam bahan pembuat kapsul, pengikat tablet dan pastilles, gelatin sponge, surgical powder, suppositories, medical research, plasma expander, dan mikroenkapsulasi dalam bidang farmasi. Gelatin dalam industri fotografi digunakan sebagai pengikat bahan peka cahaya, dan pada industri kosmetik, gelatin digunakan untuk menstabilkan emulsi pada produk-produk shampo, penyegar dan lotion, sabun (terutama yang cair), lipstik, cat kuku, busa cukur, krim pelindung sinar matahari (Hermanianto 2004). Dalam industri kertas, gelatin digunakan sebagai sizing paper (Ward and Court 1977).
Penggunaan gelatin yang cukup luas menyebabkan kebutuhannya semakin meningkat dari tahun-ketahun. Penggunaan gelatin dunia diperkirakan adalah 200.000 metrik ton/tahun (Hertz 1995 dalam Choi and Regenstein 2000). Selama ini kebutuhan gelatin di Indonesia dipenuhi melalui impor dari berbagai negara
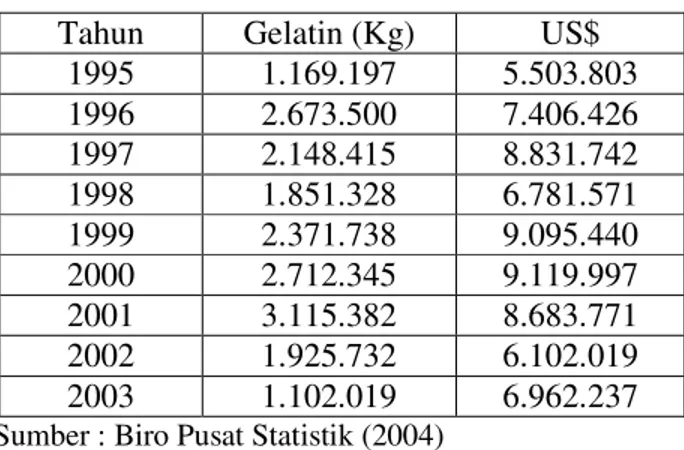
seperti Amerika, Perancis, Jerman, Brazil, Korea, Cina dan Jepang. Data impor gelatin periode tahun 1995-2003 disajikan pada Tabel 1 berikut ini :
Tabel 1. Data impor gelatin periode tahun 1995-2003
Tahun Gelatin (Kg) US$
1995 1.169.197 5.503.803 1996 2.673.500 7.406.426 1997 2.148.415 8.831.742 1998 1.851.328 6.781.571 1999 2.371.738 9.095.440 2000 2.712.345 9.119.997 2001 3.115.382 8.683.771 2002 1.925.732 6.102.019 2003 1.102.019 6.962.237
Sumber : Biro Pusat Statistik (2004)
Sumber bahan baku gelatin impor pada umumnya berasal dari tulang dan kulit sapi, babi, atau dari sumber lain yang tidak jelas informasinya. Menurut data SKW biosystem suatu perusahaan multinasional bahwa produk gelatin dunia pada tahun 1999 sebanyak 254.000 ton terdiri dari kulit jangat sapi sebanyak 28,7%, kulit babi sebanyak 41,4%, serta kontribusi tulang sapi sebesar 29,8%, dan sisanya dari ikan (Wiyono 2001). Hal tersebut menimbulkan keraguan dalam kehalalannya terutama bagi negara yang mayoritas penduduknya beragama Islam seperti Indonesia karena babi merupakan hewan yang diharamkan untuk dikonsumsi, sedangkan penggunaan sapi sebagai bahan baku gelatin menimbulkan kekhawatiran dalam bidang kesehatan karena adanya wabah penyakit yang dibawa oleh ternak seperti penyakit sapi gila dan anthrax (Gudmundsson 2002). Untuk mengatasi masalah tersebut sekaligus mengurangi ketergantungan impor gelatin, dilakukan beberapa percobaan pembuatan gelatin dari kulit dan tulang unggas. Sumber utama lain yang sangat potensial sebagai bahan baku gelatin adalah kolagen yang berasal dari ikan (Haug et al. 2003). Menurut Surono et al. (1994) tulang dan kulit ikan sangat potensial sebagai sumber gelatin karena mencakup 10-20% dari total berat tubuh ikan.
Berdasarkan data Statistik Perikanan Tangkap (DKP 2005), diketahui produksi ikan kakap merah dari tahun 2001-2005 cenderung mengalami peningkatan dari 67.773 ton menjadi 97.044 ton dengan kenaikan rata-rata pertahun adalah 6,25%. Ikan kakap merah yang berukuran 400-1.000 gr dapat
menghasilkan daging fillet sebanyak 41,5% dan limbah 58,5% Diantara limbah tersebut terdapat kulit yang belum dimanfaatkan dengan baik yaitu sekitar 4,0%, oleh karena itu untuk mengoptimalkan pemanfaatan limbah kulit ikan kakap merah perlu dilakukan penelitian gelatin dari kulit ikan kakap merah dan karakterisasinya. Diharapkan gelatin yang dihasilkan bermutu tinggi serta memenuhi standar gelatin komersial.
1.2. Tujuan
Tujuan umum dari penelitian ini adalah memanfaatkan limbah kulit ikan kakap merah (Lutjanus sp.) sebagai bahan baku gelatin. Secara khusus penelitian ini bertujuan untuk :
(1) Mempelajari proses konversi kolagen menjadi gelatin dengan berbagai konsentrasi asam asetat dan lama perendaman.
(2) Karakterisasi gelatin kulit ikan kakap merah (Lutjanus sp.) yang dihasilkan
2. TINJAUAN PUSTAKA
2.1 Deskripsi dan Klasifikasi Ikan Kakap Merah (Lutjanus sp.)
Klasifikasi ikan kakap merah (Lutjanus sp.) (Saanin 1968) adalah sebagai berikut: Kingdom : Animalia Filum : Chordata Subfilum : Vertebrata Kelas : Pisces Subkelas : Teleostei Ordo : Percomorphi Subordo : Percoidea Famili : Lutjanidae Genus : Lutjanus Spesies : Lutjanus sp.
Gambar 1. Ikan kakap merah (Lutjanus sp.) (Ditjen Perikanan 1990) Ikan kakap merah (Lutjanus sp.) mempunyai badan bulat pipih memanjang dengan sirip dipunggung, dapat mencapai 20 cm. Umumnya 25-100 cm, gepeng, batang sirip ekor lebar, mulut lebar, sedikit serong dan gigi-giginya halus. Ikan kakap merah mempunyai bagian bawah penutup insang yang berduri kuat dan bagian atas penutup insang terdapat cuping bergerigi. Bagian punggung warnanya mendekati keabuan, putih perak bagian bawah dengan sirip-sirip berwarna abu-abu gelap. Ikan kakap merah termasuk ikan buas, makanannya ikan-ikan kecil dan crustacea. Ikan kakap merah hidup di perairan pantai, muara sungai, teluk, dan air payau (Ditjen Perikanan 1990).
Daerah penyebaran ikan kakap merah antara lain pantai utara Jawa, sepanjang pantai Sumatera bagian timur, Teluk Benggala, Arafuru Utara Kalimantan, Sulawesi Selatan, Arafuru Utara, pantai India, Teluk Siam, sepanjang pantai Laut Cina Selatan, dan bagian selatan Philipina sampai pantai utara Australia (Ditjen Perikanan 1990).
Ikan kakap merah tergolong ikan demersal, selalu berkelompok dan bersembunyi di karang-karang. Panangkapannya dilakukan dengan pancing kakap, encircling net dengan rumpon, jaring insang dan trawl (Ditjen Perikanan 1990). Ikan kakap merah mengandung protein tinggi yaitu sebesar 18,2%. Komposisi kimia ikan kakap merah dapat dilihat pada Tabel 2.
Tabel 2. Komposisi kimia ikan kakap merah (Lutjanus sp.) Senyawa kimia Jumlah (%)
Air 80,3
Protein 18,2
Karbohidrat 0
Lemak 0,4
Abu 1,1
Sumber : Ditjen Perikanan (1990)
Berdasarkan data Statistik Perikanan Tangkap Indonesia (DKP 2005), diketahui bahwa produksi ikan kakap merah dari tahun 2001-2005 cenderung meningkat dari 67.773 ton menjadi 97.044 ton. Data produksi ikan kakap merah Indonesia tahun 2001-2005 disajikan pada Tabel 3.
Tabel 3. Produksi ikan kakap merah Indonesia tahun 2001-2005
Tahun Jumlah (ton)
2001 67.773 2002 62.303 2003 74.233 2004 91.339 2005 97.044 Kenaikan rata-rata 1992-2002 10,09% Kenaikan rata-rata 2004-2005 6,25% Sumber : DKP (2005) 2.2 Kulit Ikan
Kulit merupakan hasil samping dari pemotongan hewan yang berupa organ tubuh pada saat proses pengulitan. Kulit hewan, berupa tenunan dari tubuh hewan yang terbentuk dari sel-sel hidup. Judoamidjojo et al. (1979) mengemukakan
bahwa struktur dasar kulit hewan terdiri dari tenunan serat protein yang disebut serat kolagen, komponen yang berfungsi sebagai kerangka penguat.
Kulit ikan umumnya terdiri dari dua lapisan utama yaitu epidermis dan dermis. Lapisan dermis merupakan jaringan pengikat yang cukup tebal dan mengandung sejumlah serat-serat kolagen (Lagler et al. 1977). Lapisan dermis adalah bagian pokok tenunan kulit yang diperlukan dalam pembuatan gelatin, karena lapisan ini sebagian besar (berkisar 80%) terdiri atas jaringan serat kolagen yang dibangun oleh tenunan pengikat.
Kulit ikan mengandung air 69,6%, protein 26,9%, abu 2,5% dan lemak 0,7%. Protein pada kulit dapat dibagi dalam dua golongan besar, yaitu (1) protein yang tergolong fibrous protein meliputi kolagen (yang terpenting), keratin, dan elastin; (2) protein yang tergolong globular protein meliputi albumin dan globulin (Judoamidjoyo 1974).
Choi dan Regenstein 2000 mengemukakan bahwa kulit, tulang, dan gelembung renang ikan merupakan limbah yang secara komersial dapat dimanfaatkan sebagai bahan baku industri gelatin karena bahan-bahan tersebut dihasilkan dalam jumlah banyak sehingga dapat memberikan keuntungan dan menambah penghasilan secara ekonomi bagi pengelola limbah industri perikanan. Tulang dan kulit ikan sangat potensial sebagai bahan pembuatan gelatin karena mencakup 10-20% dari berat tubuh ikan (Surono et al. 1994).
2.3 Kolagen
Kolagen merupakan komponen struktural utama dari jaringan pengikat putih (white connective tissue) yang meliputi hampir 30% dari total protein pada jaringan organ tubuh vertebrata dan invertebrata (Poppe 1992). Silva et al. (2005) menyatakan bahwa kolagen adalah protein hewan yang menjadi komponen utama dari semua jaringan penghubung yang terdapat pada kulit, tulang, tendon, dan kartilago. Kolagen berfungsi sebagai elemen penahan tekanan serta pengikat pada tulang hewan vertebrata (Glicksman 1969).
Kolagen adalah protein serabut (fibril) yang mempunyai fungsi kurang larut, amorf, dapat memanjang dan berkontraksi. Protein serabut ini tidak larut dalam pelarut encer, sukar dimurnikan, susunan molekulnya terdiri dari molekul yang panjang dan tidak membentuk kristal (Winarno 1997). Kolagen murni sangat
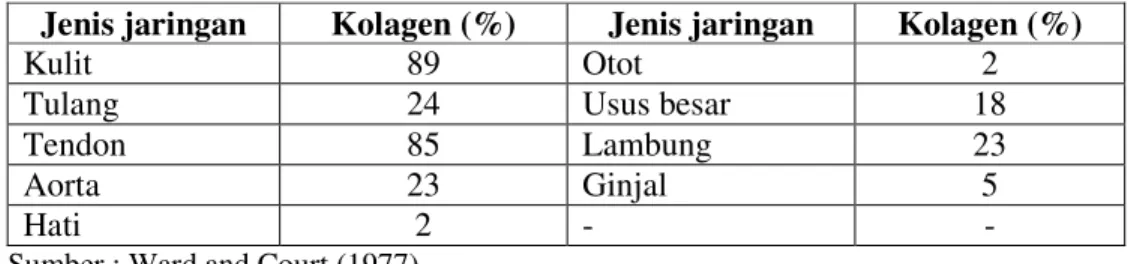
sensitif terhadap reaksi enzim dan kimia. Perlakuan alkali menyebabkan kolagen mengembang dan menyebar, yang sering dikonversi menjadi gelatin. Di samping pelarut alkali, kolegen jega larut dalam pelarut asam (Bennion 1980). Penyebaran kolagen pada jaringan hewan mamalia dapat dilihat pada Tabel 4.
Tabel 4. Penyebaran kolagen dalam jaringan hewan mamalia
Jenis jaringan Kolagen (%) Jenis jaringan Kolagen (%)
Kulit 89 Otot 2
Tulang 24 Usus besar 18
Tendon 85 Lambung 23
Aorta 23 Ginjal 5
Hati 2 - -
Sumber : Ward and Court (1977)
Unit struktural pembentuk kolagen adalah tropokolagen yang berbentuk batang dengan panjang 3000Å, diameter 5Å dan mengandung tiga unit rantai polipeptida yang saling berpilin membentuk struktur heliks yang disebut rantai . Rantai ini mengandung 1000 residu asam amino dengan komposisi yang sangat bervariasi (Bennion 1980). Wong (1989) menambahkan bahwa rantai yang dibentuk oleh tiga unit polipeptida tersebut menahan bersama-sama dengan ikatan hidrogen antara grup NH dari residu glisin pada rantai yang satu dengan grup CO pada rantai lainnya. Cincin pirolidin, prolin, dan hidroksiprolin membantu pembentukan rantai polipeptida dan memperkuat triple heliks (Wong 1989).
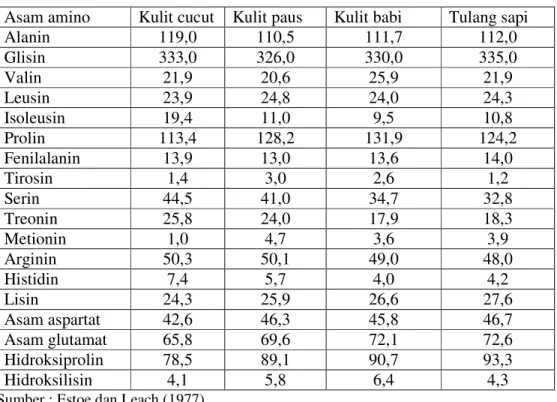
Ada dua tipe ikatan yang merupakan struktur sekunder dan tersier kolagen yaitu 1) Ikatan intramolekul yang terjadi antara rantai-rantai molekul tropokolagen dan 2) Ikatan intermolekul yaitu ikatan antara molekul tropokolagen (Johns 1977). Molekul kolagen tersusun dari kira-kira dua puluh asam amino yang memiliki bentuk agak berbeda tergantung pada sumber bahan bakunya. Asam amino glisin, prolin, dan hidroksiprolin merupakan asam amino utama yang membentuk kolagen. Hidroksiprolin merupakan salah satu asam amino pembatas dalam berbagai protein (Estoe dan Leach 1977). Perbedaan komposisi asam amino dari berbagai sumber dapat dilihat pada Tabel 5.
Tabel 5. Komposisi asam amino kulit hewan
Asam amino Kulit cucut Kulit paus Kulit babi Tulang sapi
Alanin 119,0 110,5 111,7 112,0 Glisin 333,0 326,0 330,0 335,0 Valin 21,9 20,6 25,9 21,9 Leusin 23,9 24,8 24,0 24,3 Isoleusin 19,4 11,0 9,5 10,8 Prolin 113,4 128,2 131,9 124,2 Fenilalanin 13,9 13,0 13,6 14,0 Tirosin 1,4 3,0 2,6 1,2 Serin 44,5 41,0 34,7 32,8 Treonin 25,8 24,0 17,9 18,3 Metionin 1,0 4,7 3,6 3,9 Arginin 50,3 50,1 49,0 48,0 Histidin 7,4 5,7 4,0 4,2 Lisin 24,3 25,9 26,6 27,6 Asam aspartat 42,6 46,3 45,8 46,7 Asam glutamat 65,8 69,6 72,1 72,6 Hidroksiprolin 78,5 89,1 90,7 93,3 Hidroksilisin 4,1 5,8 6,4 4,3
Sumber : Estoe dan Leach (1977)
Konversi kolagen yang bersifat tidak larut dalam air menjadi gelatin yang bersifat larut dalam air merupakan transformasi esensial dalam pembuatan gelatin. Agar dapat diekstraksi kolagen harus diberi perlakuan awal. Ekstraksi ini dapat menyebabkan pemutusan ikatan hidrogen diantara ketiga rantai tropokolagen menjadi tiga rantai bebas, dua rantai saling berikatan dan satu rantai bebas, serta tiga rantai yang masih berikatan (Poppe 1992). Perlakuan alkali menyebabkan kolagen mengembang dan menyebar yang sering dikonversi menjadi gelatin. Disamping pelarut alkali kolagen juga larut dalam pelarut asam (Bennion 1980).
Perlakuan pemanasan atau penambahan zat seperti asam, basa, urea, kalsium, dan permanganat dapat menyebabkan larutan tropokolagen terdenaturasi. Tropokolagen yang terdenaturasi akan terdisosiasi menjadi tiga komponen yaitu , , dan . Komponen merupakan rantai tunggal polipeptida dengan bobot molekul kurang lebih sepertiga dari berat molekul tropokolagen, komponen dan
merupakan dimer dan trimer yang dibentuk dari ikatan silang (Parker 1982). 2.4 Gelatin
Gelatin berasal dari bahasa latin ”gelare” yang berarti membuat beku dan merupakan senyawa yang tidak pernah terjadi secara alamiah (Glicksman 1969).
molekul gelatin yang kompak air air molekul gelatin yang panjang seperti benang
Gelatin merupakan protein dari kolagen kulit, membran, tulang, dan bagian tubuh berkolagen lainnya. Gelatin adalah protein larut yang bisa bersifat sebagai gelling agent (bahan pembuat gel) atau sebagai non-gelling agent (Halal Guide 2007). Gelatin akan mengembang jika direndam dalam air dan berangsur-angsur menyerap air 5-10 kali bobot gelatin. Gelatin larut dalam air panas dan akan membentuk gel jika didinginkan (Anonima 1978).
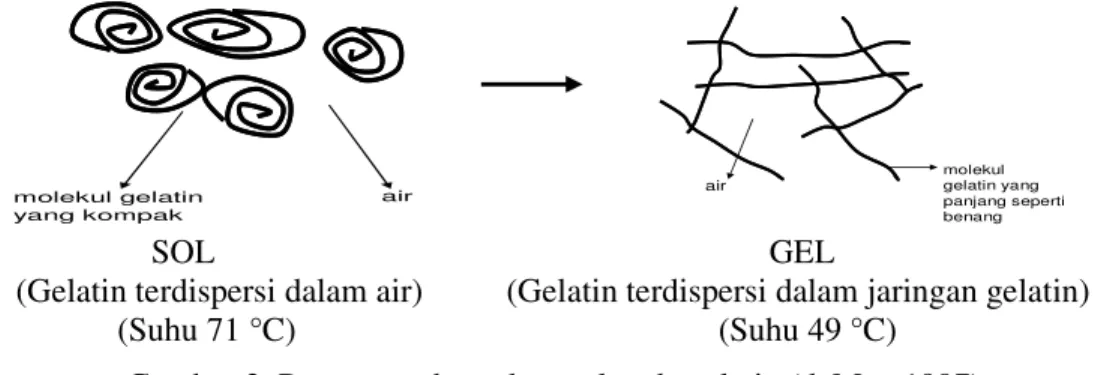
Gelatin didefinisikan sebagai produk yang diperoleh dari jaringan kolagen hewan yang dapat didispersi dalam air dan menunjukkan perubahan sol-gel reversible seiring dengan perubahan suhu (deMan 1997). Proses pembentukan gel pada gelatin berkaitan erat dengan gugus guanidin arginin. Dalam pembentukan gel, gelatin didispersi dalam air dan dipanaskan sampai membentuk sol. Daya tarik menarik antar molekul lemah dan sol tersebut membentuk cairan yang bersifat mengalir dan dapat berubah sesuai dengan tempatnya. Bila didinginkan, molekul-molekul yang kompak dan tergulung dalam bentuk sol mengurai dan terjadi ikatan-ikatan silang antara molekul-molekul yang berdekatan sehingga terbentuk suatu jaringan. Sol akan berubah menjadi gel. Mekanisme pembentukan gel pada gelatin dapat dilihat pada Gambar 2.
SOL GEL
(Gelatin terdispersi dalam air) (Gelatin terdispersi dalam jaringan gelatin) (Suhu 71 °C) (Suhu 49 °C)
Gambar 2. Proses pembentukan gel pada gelatin (deMan 1997).
Komposisi asam amino gelatin bervariasi tergantung pada sumber kolagen tersebut, spesies hewan penghasil, dan jenis kolagen. Penurunan komposisi asam amino tergantung pada metode pembuatannya. Pembuatan dengan proses alkali umumnya lebih banyak mengandung hidroksiprolin dan lebih sedikit mengandung tirosin dibanding dengan proses asam (Ward and Court 1977). Gelatin mengandung 19 asam amino yang dihubungkan dengan ikatan peptida membentuk rantai polimer panjang (Glicksman 1969). Senyawa gelatin
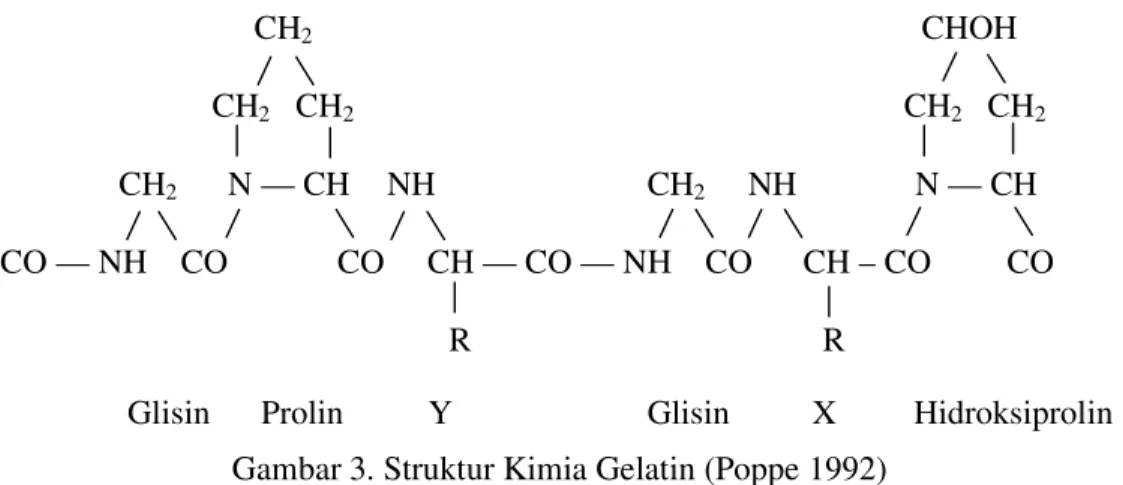
merupakan suatu polimer linier yang tersusun oleh satuan terulang asam amino glisin-prolin-prolin atau glisin-prolin-hidroksiprolin (Binder and Miller 1953 dalam Ward and Court 1977). Struktur kimia gelatin dapat dilihat pada Gambar 3.
CH2 CHOH
CH2 CH2 CH2 CH2
CH2 N — CH NH CH2 NH N — CH
CO — NH CO CO CH — CO — NH CO CH – CO CO
R R
Glisin Prolin Y Glisin X Hidroksiprolin Gambar 3. Struktur Kimia Gelatin (Poppe 1992)
Gelatin termasuk molekul besar. Menurut Ward and Court (1977) berat molekul (BM) gelatin mencapai 90.000 sedangkan pada gelatin komersial berkisar antara 20.000-70.000. Balian dan Bowes (1977) menyatakan bahwa berat molekul (BM) gelatin merupakan kelipatan 768 atau kelipatan C32H52O12N10. Menurut
Bennion (1980), gelatin merupakan produk utama yang berasal dari kolagen dengan pemanasan yang dikombinasi dengan perlakuan asam atau alkali. Gelatin dapat diperoleh dengan cara denaturasi dari kolagen. Pemanasan kolagen secara bertahap akan menyebabkan struktur rusak dan rantai-rantainya terpisah. Berat molekul, bentuk dan konformasi larutan kolagen sensitif terhadap perubahan temperatur yang dapat menghancurkan mikro molekulnya (Wong 1989).
Berdasarkan proses pembuatannya, terdapat dua tipe gelatin. Tipe A dihasilkan melalui proses asam sedangkan tipe B dihasilkan melalui proses basa (Viro 1992). Perbedaan sifat antara gelatin tipe A dan tipe B serta komposisi asam amio dapat dilihat pada Tabel 6 dan 7.
Tabel 6. Sifat gelatin tipe A dan tipe B
Sifat Tipe A Tipe B
Kekuatan gel (g bloom) 50 – 300 50-300
Viskositas (cP) 1,5 – 7,5 2,0 – 7,5
Kadar abu (%) 0,3 – 2,0 0,5 – 2,0
pH 3,8 – 6,0 5,0 – 7,1
Titik isoelektrik 7,0 – 9,2 4,7 – 5,4
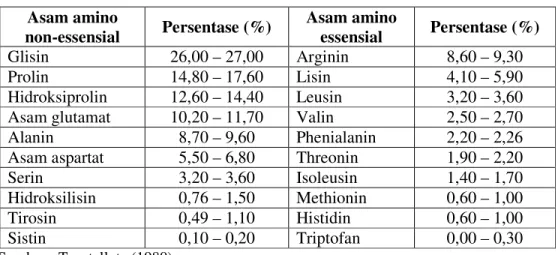
Tabel 7. Komposisi asam amino gelatin Asam amino
non-essensial Persentase (%) Asam amino essensial Persentase (%)
Glisin 26,00 – 27,00 Arginin 8,60 – 9,30
Prolin 14,80 – 17,60 Lisin 4,10 – 5,90
Hidroksiprolin 12,60 – 14,40 Leusin 3,20 – 3,60
Asam glutamat 10,20 – 11,70 Valin 2,50 – 2,70
Alanin 8,70 – 9,60 Phenialanin 2,20 – 2,26
Asam aspartat 5,50 – 6,80 Threonin 1,90 – 2,20
Serin 3,20 – 3,60 Isoleusin 1,40 – 1,70
Hidroksilisin 0,76 – 1,50 Methionin 0,60 – 1,00
Tirosin 0,49 – 1,10 Histidin 0,60 – 1,00
Sistin 0,10 – 0,20 Triptofan 0,00 – 0,30
Sumber : Tourtellote (1980)
Gelatin larut dalam air, asam asetat, dan pelarut alkohol seperti gliserol, propilen glikol, sorbitol, dan manitol (Viro 1992), tetapi tidak larut dalam alkohol, aseton, karbon tetraklorida, benzena, petroleum eter, dan pelarut organik lainnya. Dalam kondisi tertentu gelatin larut dalam campuran aseton-air dan alkohol-air. 2.5 Pembuatan Gelatin
Prinsip pembuatan gelatin dibagi menjadi dua, yaitu proses asam dan proses basa. Perbedaan kedua proses tersebut terletak pada proses perendamannya. Berdasarkan kekuatan ikatan kovalen silang protein dan jenis bahan yang diekstrak, maka penggunaan jenis asam, bahan organik serta metode ekstraksi akan berbeda-beda (Pelu et al. 1998). Menurut Hinterwaldner (1977) terdapat tiga tahapan penting dalam pembuatan gelatin, yaitu 1) persiapan bahan baku, 2) konversi kolagen menjadi gelatin, dan 3) pemurnian serta perolehan gelatin dalam bentuk kering.
Tahap persiapan, dilakukan proses pencucian atau pembersihan pada kulit. Tahap pembersihan ini sangat penting bagi kualitas produk akhir, antara lain pada warna, bau, kadar lemak, dan kadar abu gelatin. Proses pembersihan dilakukan dengan cara membuang kotoran, sisa daging, lemak, dan sisik halus bagian luar. Untuk memudahkan proses pembersihan, dapat dilakukan dengan pemanasan kulit pada air mendidih selama 1-2 menit. Berdasarkan penelitian Pelu et al. (1998) pada proses pembersihan terjadi penurunan kadar abu dari 0,20% (kulit mentah) menjadi 0,14% (kulit bersih) dan penurunan kadar lemak dari 0,5% (kulit mentah) menjadi 0,3% (kulit bersih). Penurunan nilai kadar lemak yang tidak melebihi 5%
merupakan salah satu persyaratan mutu gelatin (Jobling and Jobling 1983 dalam Pelu et al. 1998).
Tahap selanjutnya adalah proses pengembangan (swelling) yang bertujuan untuk menghilangkan kotoran dan mengkonversi kolagen menjadi gelatin (Charley 1982). Tahap ini dilakukan dengan merendam kulit dalam larutan asam organik, asam anorganik, dan alkali. Untuk memudahkan homogenisasi pada swelling dan ekstraksi dilakukan pemotongan kulit.
Asam organik yang biasa digunakan adalah asam asetat, sitrat, fumarat, askorbat, malat, suksinat, tartarat, dan asam lain yang aman serta tidak menusuk hidung. Asam anorganik yang digunakan adalah asam hidroklorat, klorida fosfat, dan sulfat. Pelarut alkali yang dapat digunakan adalah sodium karbonat, sodium hidroksida, potassium karbonat, dan potassium hidroksida. Asam kuat seperti asam sulfat, asam klorida dan asam fosfat tidak layak digunakan untuk mengekstraksi gelatin dari kulit karena akan menghasilkan warna hitam dan bau menusuk pada gelatin yang dihasilkan (Pelu et al. 1998). Untuk menghasilkan kualitas gelatin yang baik, sebaiknya digunakan larutan alkali dan asam anorganik pada kisaran 0,05-0,3% (w/v), sedangkan untuk larutan asam organik pada kisaran 0,5-5% (w/v) (Grossman and Bergman 1991).
Proses produksi gelatin diawali oleh tahap ekstraksi yang dilakukan dengan cara mengekstrak kulit dalam air panas dengan kisaran suhu ekstraksi minimum 40-50 ºC (Grossman and Bergman 1991) sampai 100 ºC (Viro 1992). Ekstraksi merupakan proses denaturasi untuk mengubah serat kolagen yang terlarut dalam air dengan penambahan senyawa pemecah ikatan hidrogen. Tahap selanjutnya adalah proses penyaringan yang bertujuan untuk penghilangan zat-zat lain yang tidak larut yang dapat mengurangi kemurnian gelatin. Proses terakhir adalah pemekatan dan pengeringan gelatin. Pemekatan bertujuan untuk meningkatkan total solid sehingga mempercepat proses pengeringan. Menurut Hinterwaldner (1997), pemekatan dilakukan menggunakan evaporator vakum bersuhu kurang dari 70 ºC agar mencegah kerusakan gelatin. Proses pengeringan dilakukan menggunakan oven bersuhu 40-50 ºC (Grossman and Bergman 1991) hingga 60-70 ºC atau freeze dryer (Pelu et al. 1998).
2.6 Mutu Gelatin
Mutu gelatin ditentukan oleh sifat fisika, kimia, dan fungsional yang menjadikan gelatin sebagai karakter yang unik. Sifat-sifat yang dapat dijadikan parameter dalam menentukan mutu gelatin antara lain kekuatan gel, viskositas, dan rendemen. Kekuatan gel dipengaruhi oleh pH, adanya komponen elektrolit dan non-elektrolit dan bahan tambahan lainnya, sedangkan viskositas dipengaruhi oleh interaksi hidrodinamik, suhu, pH, dan konsentrasi (Poppe 1992). Standar mutu gelatin berdasarkan SNI (1995) dan persyaratan gelatin berdasarkan FAO dapat dilihat pada Tabel 8 dan 9.
Tabel 8. Standar mutu gelatin berdasarkan SNI 1995
Karakteristik Syarat
Warna Tidak berwarna – kuning pucat
Bau, rasa Normal (dapat diterima konsumen)
Kadar air Maksimum 16%
Kadar abu Maksimum 3,25%
Logam berat Maksimum 50 mg/kg
Arsen Maksimum 2 mg/kg
Tembaga Maksimum 30 mg/kg
Seng Maksimum 100 mg/kg
Sulfit Maksimum 1000 mg/kg
Sumber : SNI 06-3735-1995
Tabel 9. Persyaratan gelatin berdasarkan FAO
Parameter Persyaratan
Kadar abu Tidak lebih dari 2%
Kadar air Tidak lebih dari 18%
Belerang dioksida Tidak lebih dari 40 mg/kg
Arsen Tidak lebih dari 1 mg/kg
Logam berat Tidak lebih dari 50 mg/kg
Timah hitam Tidak lebih dari 5 mg/kg
Batas cemaran mikroba Standard plate count E. coli Streptococci Kurang dari 104/gr Kurang dari 10/gr Kurang dari 102/gr Sumber : JECFA (2003) 2.7 Pemanfaatan Gelatin
Gelatin dimanfaatkan terutama untuk mengubah cairan menjadi padatan yang elastis atau mengubah sol menjadi gel. Reaksi pada pembentukan gel ini bersifat reversible karena bila gel dipanaskan akan berbentuk sol dan bila
didinginkan akan berbentuk gel lagi. Keadaan tersebut membedakan gelatin dengan gel dari pektin, alginat, albumin telur, dan protein susu yang gelnya irreversible (Johns 1977).
Gelatin digunakan untuk berbagai keperluan industri, baik industri pangan maupun non-pangan karena memiliki sifat yang khas, yaitu dapat berubah secara reversibel dari bentuk sol ke gel, mengembang dalam air dingin, dapat membentuk film, mempengaruhi viskositas suatu bahan, dan dapat melindungi sistem koloid. King (1969) menyatakan bahwa pada suhu 71 °C gelatin mudah larut dalam air dan membentuk gel pada suhu 49 °C. Gelatin memiliki sifat larut air sehingga dapat diaplikasikan untuk keperluan berbagai industri.
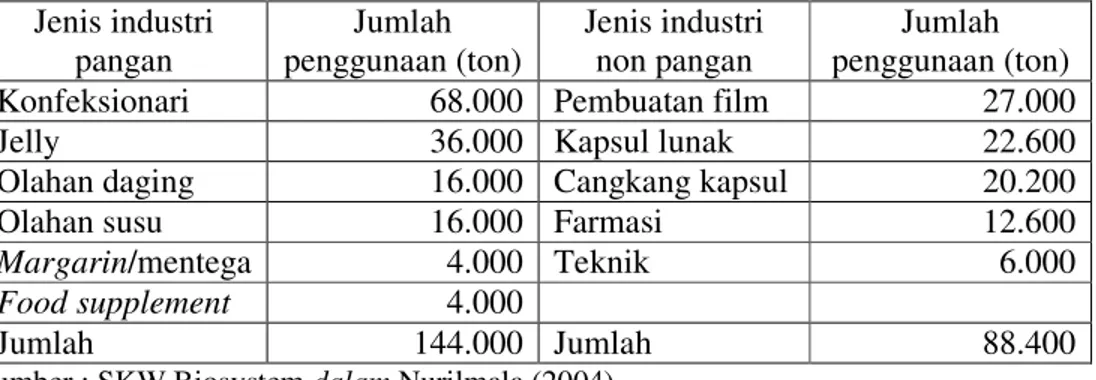
Gelatin sebagai pembentuk gel mempunyai sineresis yang rendah dan mempunyai kekuatan gel antara 220-225 gr bloom sehingga dapat digunakan dalam produk jelly. Sebagai pengemulsi, gelatin bisa diaplikasikan ke dalam sirup lemon, susu, mentega, margarin, dan pasta. Gelatin sebagai penstabil dapat digunakan dalam pembuatan es krim dan yoghurt. Sebagai bahan pengikat, gelatin dapat digunakan dalam produk-produk daging (Johns 1977). Penggunaan gelatin pada industri pangan dan non pangan dapat dilihat pada Tabel 10.
Tabel 10. Penggunaan gelatin dalam industri pangan dan non pangan di dunia tahun 1999
Jenis industri
pangan penggunaan (ton) Jumlah Jenis industri non pangan penggunaan (ton) Jumlah
Konfeksionari 68.000 Pembuatan film 27.000
Jelly 36.000 Kapsul lunak 22.600
Olahan daging 16.000 Cangkang kapsul 20.200
Olahan susu 16.000 Farmasi 12.600
Margarin/mentega 4.000 Teknik 6.000
Food supplement 4.000
Jumlah 144.000 Jumlah 88.400
3. METODOLOGI 3.1 Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Juni-Agustus 2008 bertempat di Laboratorium Pengolahan Hasil Perairan, Laboratorium Biokimia Hasil Perairan Departemen Teknologi Hasil Perikanan, Fakultas Perikanan dan Ilmu Kelautan, Laboratorium Kimia Pangan dan Gizi, Departemen Teknologi Pangan dan Gizi, Fakultas Teknik Pertanian, Institut Pertaian Bogor, serta Balai Pusat Pasca Panen Bogor.
3.2 Bahan dan Alat Penelitian
Bahan baku yang digunakan adalah kulit ikan kakap merah yang diperoleh dari Muara Baru, Jakarta. Bahan lain yang digunakan adalah : aquades, asam asetat teknis 98% yang diperoleh dari toko Setia Guna, dan bahan-bahan yang digunakan untuk pengujian antara lain : Na2CO3, NaOH, Na2S2O3, HCl, K2SO4,
HgO, H2SO4, HClO4, HNO3, air suling, aseton, dan H3BO3, natrium asetat serta
kertas saring whatman 41.
Alat-alat yang digunakan yang digunakan dalam pembuatan dan analisa gelatin kulit ikan kakap merah antara lain wadah tahan asam, pisau, talenan, kain saring, panci kaca, kompor, pengaduk, timbangan digital, pH meter, gelas ukur, loyang kaca, grinder, termometer, waterbath, oven, gelas piala, sentrifuse, grinder, botol film, pipet volumetrik, tabung reaksi, erlenmeyer, tabung soxlet, tanur, cawan, desikator, Rheoner RE 3305, Kett Digital Whitenes Powder C-100, Brookfield Syncro-Lectric Viskometer, magnetic stirrer, atomatic absorption spectrophotmetri, HPLC Water Assosiates dan kjeltec system.
3.3 Metode Penelitian
Penelitian dilakukan dalam dua tahap, yaitu penelitian pendahuluan dan penelitian utama. Penelitian pendahuluan adalah pembuatan gelatin dengan proses lama perendaman asam 12 dan 24 jam serta kombinasi konsentrasi asam 1-5%, sedangkan penelitian tahap utama adalah pembuatan gelatin dengan kombinasi perlakuan konsentratasi dan lama perendaman asam asetat serta analisis sifat fisika kimia produk gelatin yang dihasilkan dibandingkan dengan gelatin komersial dan gelatin standar laboratorium hasil pengujian Nurilmala (2004).
Pembuatan gelatin dari kulit ikan kakap merah (Lutjanus sp.) dilakukan dengan metode asam yang dimodifikasi dari Pelu et al. (1998). Tahap utama proses pembuatan gelatin kulit ikan kakap merah adalah perendaman kulit dalam larutan asam asetat (CH3COOH), dengan perbandingan kulit ikan kakap merah
dan larutan perendaman adalah 1 : 4 serta konsentrasi asam asetat berkisar antara 1%-5% (v/v) dengan lama perendaman 12 jam dan 24 jam; dan terakhir adalah ekstraksi dengan suhu 80 ºC ± 3 ºC selama 3 jam dengan ratio banyaknya kulit ikan dan air (aquades) adalah 1 : 3.
3.3.1 Penelitian Pendahuluan
Penelitian pendahuluan diawali dengan pembuatan gelatin dari kulit ikan kakap merah (Lutjanus sp.). Perlakuan yang diberikan adalah perendaman kulit ikan kakap merah (Lutjanus sp.) dalam larutan asam asetat dengan perbandingan kulit ikan dan asam asetat adalah 1 : 4. Konsentrasi asam asetat yang digunakan adalah 1, 2, 3, 4, dan 5% (v/v) dengan lama perendaman 12 jam dan 24 jam. Kulit ikan kakap merah yang mengalami swellling (pengembangan) kemudian dicuci hingga pH netral (5-6). Kemudian dilakukan ekstraksi pada suhu 80 ºC ± 3 ºC selama 3 jam dengan ratio bobot kulit ikan dan aquades adalah 1 : 3. Filtrat yang diperoleh dari proses ekstraksi selanjutnya disaring dengan menggunakan kain saring, kemudian dikeringkan menggunakan oven pada suhu 50 ºC selama 48 jam (2 hari). Lembaran gelatin yang dihasilkan kemudian digiling dengan menggunakan grinder sehingga didapat gelatin kering berbentuk butiran-butiran halus (tepung gelatin). Selanjutnya untuk mengetahui perbedaan antar perlakuan dilakukan pengamatan berupa uji fisik yang meliputi rendemen, pH, viskositas, dan kekuatan gel. Diagram alir proses pembuatan gelatin kulit ikan kakap merah dapat dilihat pada Gambar 4.
Gambar 4. Skema proses pembuatan gelatin kulit ikan kakap merah (Lutjanus sp.) (*Modifikasi Pelu et al., 1998)
Keterangan :
: Masukan (input) : Proses
: Hasil (output)
Kulit ikan kakap merah
Penyaringan dengan kain saring
Ekstraksi, kulit : akuades = 1 : 3 pada suhu 80 ºC ± 3 ºC, selama 3 jam* Pencucian dengan air hingga pH 5 – 6*
Perendaman CH3COOH 1%, 2%, 3 %, 4% dan 5 % selama 12 jam dan 24 jam*
Pencucian dengan air mengalir Pemotongan kulit dengan ukuran 2 x 4 cm* Pembersihan dari daging, lemak, sisik, dan kotoran lain
Lembaran gelatin
Uji fisik : rendemen, viskositas dan kekuatan gel Serbuk gelatin ikan*
Pengeringan dengan oven, suhu 50 ºC selama 48 jam*
3.3.2 Penelitian Utama
Penelitian utama adalah pembuatan gelatin dengan konsentrasi dan lama perendaman terpilih dari penelitian pendahuluan, dilanjutkan dengan karakterisasi gelatin yang meliputi uji fisik yaitu rendemen, pH, viskositas, dan kekuatan gel serta kombinasi perlakuan konsentrasi asam asetat dan lama perendaman kulit yang efektif untuk menghasilkan gelatin (Gambar 5). Hasil terbaik dari penelitian ini dilanjutkan dengan pengujian analisis proksimat (kadar air, kadar abu, kadar protein, dan kadar lemak), serta sifat fisika-kimia gelatin yaitu viskositas, kekuatan gel, derajat keasaman (pH), derajat putih, titik isoelektrik protein, titik gel, titik leleh, kandungan logam berat (Pb dan Hg), kandungan asam amino yang dibandingkan dengan gelatin komersial dan gelatin standar laboratorium hasil pengujian Nurilmala (2004). Hasil terbaik ini juga dilanjutkan dengan pengujian organoleptik (warna, penampakan, dan bau) yang dibandingkan dengan gelatin komersial dan standar laboratorium.
3.4 Analisis Fisika dan Kimia Gelatin
Sifat fungsional gelatin sangat penting dalam aplikasi terhadap suatu produk. Sifat tersebut merupakan sifat fisika dan kimia yang mempengaruhi perilaku gelatin dalam makanan selama proses, penyimpanan, penyiapan, dan pengkonsumsian (Kinsela 1982). Sifat fisika gelatin antara lain kekuatan gel, titik isoelektrik, titik leleh, titik gel, dan derajat putih, sedangkan sifat kimia gelatin antara lain kadar air, kadar abu, kadar lemak, kadar protein, pH, kandungan asam amino serta kandungan logam berat.
3.4.1 Rendemen (AOAC 1995)
Rendemen diperoleh dari perbandingan antara berat tepung kering gelatin yang dihasilkan dengan berat bahan segar (kulit yang telah dicuci bersih). Besarnya rendemen dapat diperoleh dengan rumus :
Berat bahan kering gelatin
Rendemen (100%) = x 100%
Berat bahan segar 3.4.2 Kekuatan gel (Gaspar 1998)
Kekuatan gel dilakukan secara objektif dengan menggunakan alat Rheoner RE 3305. Tingkat kekuatan gel dinyatakan dengan satuan bloom yang berarti
besarnya gaya tekan untuk memecah deformasi produk. Sebelum digunakan alat disetting agar sesuai dengan jenis produk yang akan diukur gelnya karena standar setting untuk setiap produk berbeda, jarak yang digunakan adalah 400 x 0,01 mm, kecepatan 0,5 mm/s, sensitifitas 0,2 v dan silinder probe 5 mm. Cara kerja alat ini yaitu silinder probe 5 mm tidak bergerak, meja tempat untuk meletakkan contoh yang bergerak ke atas mendekati jarum penusuk, tekanan dilakukan sebanyak satu kali. Hasil pengukuran akan tercetak dalam kertas berbentuk histogram. Pengukuran berdasarkan tingginya histogram.
3.4.3 Viskositas (British Standard 757 1975)
Larutan gelatin dengan konsentrasi 6,67% (b/b) disiapkan dengan aquades (7 gr gelatin ditambah 105 ml aquades) kemudian larutan diukur viskositasnya dengan menggunakan alat Brookfield Syncro-Lectric Viscometer. Pengukuran dilakukan pada suhu 60 ºC dengan laju geser 60 rpm menggunakan spindel. Hasil pengukuran dikalikan dengan faktor konversi. Pengujian ini menggunakan spindel no.1 dengan faktor konversinya adalah 1, nilai viskositas dinyatakan dalam satuan centipoise (cP).
3.4.4 Derajat putih (Anonimb)
Analisis warna dilakukan dengan menggunakan Kett Digital Whiteness Powder C-100. Contoh dalam bentuk tepung dimasukan ke dalam cawan contoh, selanjutnya cawan tersebut dimasukkan dalam alat. Nilai dapat langsung dibaca pada layar dan dinyatakan dalam persentasi derajat putih..
3.4.5 Derajat keasaman (pH) (British Standard 757 1975)
Contoh sebanyak 0,2 gr didispersi dalam 20 ml aquades pada suhu 80 ºC. Contoh dihomogenkan dengan magnetic stirer. Kemudian diukur derajat keasamannya (pH) pada suhu kamar dengan pH meter.
3.4.6 Kadar air (AOAC 1995)
Prosedur penentuan kadar air dilakukan dengan cara menimbang 5 gr contoh dan diletakkan dalam cawan kosong yang sudah ditimbang beratnya, cawan serta tutupnya sebelumnya sudah dikeringkan di dalam oven serta didinginkan di dalam desikator. Cawan yang berisi contoh kemudian ditutup dan dimasukkan ke dalam oven dengan suhu 100-102 ºC selama 6 jam. Cawan
tersebut lalu didinginkan di dalam desikator dan setelah dingin cawan ditimbang. Kadar air dapat ditimbang dengan rumus :
W1 – W2
Kadar air = x 100% Berat sampel
Keterangan : W1 =berat (sampel + cawan) sebelum dikeringkan
W2 = berat (sampel + cawan) setelah dikeringkan
3.4.7 Kadar abu (AOAC 1995)
Prosedur penentuan kadar abu dilakukan dengan cara menimbang sebanyak 5 gr contoh dan dimasukkan ke dalam cawan pengabuan yang telah ditimbang dan dibakar di dalam tanur dengan suhu 600 ºC serta didinginkan dalam desikator.
Cawan yang berisi contoh dimasukkan ke dalam tanur pengabuan dan dibakar sampai didapat abu yang berwarna keabu-abuan. Pengabuan ini dilakukan dalam dua tahap, yaitu pertama pada suhu sekitar 400 ºC selama 1 jam dan kedua pada suhu 550 ºC selama 5 jam. Cawan yang berisi abu tersebut didinginkan dalam desikator dan kemudian ditimbang. Kadar abu dihitung dengan rumus :
Berat abu
Kadar abu = x 100% Berat sampel
3.4.8 Kadar protein (AOAC 1995)
Penentuan kadar protein dilakukan dengan metode mikro-kjeldahl. Contoh ditimbang sebanyak 0,2 gr dan dimasukkan ke dalam labu kjeldahl 30 ml. Kemudian ditambah 2 gr K2SO4, 50 mg HgO dan 2,5 ml H2SO4. Contoh
didestruksi selama 1-1,5 jam sampai cairan berwarna hijau jernih lalu didinginkan dan ditambah air suling perlahan-lahan. Isi labu dipindahkan ke dalam alat destilasi, ditambah 10 ml NaOH pekat sampai berwarna coklat kehitaman lalu didestilasi. Hasil destilasi ditampung dalam erlenmeyer 125 ml yang berisi 5 ml H3BO3 dan dititrasi dengan HCl 0.02N sampai terjadi perubahan warna menjadi
merah muda. Perhitungan kadar protein menggunakan rumus : (ml HCl – ml blanko) x 14.007 x N HCl
% N = x 100% mg sampel
3.4.9 Kadar lemak (AOAC 1995)
Contoh sebanyak 2 gr ditimbang dan dibungkus dengan kertas saring lalu ditutup dengan kapas bebas lemak dan dimasukkan ke dalam labu lemak. Setelah itu diletakkan ke dalam alat ekstraksi soxhlet, dengan posisi alat kondensor berada di atas dan labu lemak di bawahnya. Petroleum benzene ditambahkan ke dalam labu lemak kemudian dilakukan ekstraksi selama ± 6 jam pada suhu 40 °C hingga pelarut yang turun kembali ke labu lemak menjadi jernih. Pelarut yang ada di dalam labu lemak didestilasi sehingga semua pelarut lemak menguap. Selanjutnya labu lemak hasil ekstraksi dikeringkan dalam oven pada suhu 105 °C. Setelah itu labu didinginkan dalam desikator dan ditimbang. Penentuan kadar lemak menggunakan rumus:
(berat labu akhir – berat labu awal)
Kadar lemak = x 100% Berat sampel
3.4.10 Kandungan logam berat (Pb dan Hg) (Hutagalung 1997)
Contoh sebanyak 2 gr dimasukkan ke dalam teflon beker dan ditambahkan 1,5 ml HClO4 dan 3,5 ml HNO3, kemudian teflon beker ditutup dan biarkan
selama 24 jam. Selanjutnya teflon beker dan contoh dipanaskan di atas penangas air dengan suhu 60-70 ºC selama ± 2-3 jam (sampai larutan jernih) (bila contoh tidak semua larut, ditambahkan lagi HClO4 dan 3,5 ml HNO3). Kemudian
ditambahkan ke dalamnya sebanyak 3 ml air suling bebas ion dan dipanaskan kembali hingga larutan hampir kering, selanjutnya didinginkan pada suhu ruang. Kemudian ditambahkan 1 ml HNO3 pekat dan diaduk pelan-pelan. Selanjutnya
ditambahkan 9 ml air suling bebas ion, dan dilakukan pengukuran menggunakan atomic absorption spectrophotometri menggunakan nyala udara esitelin.
3.4.11 Titik leleh ( Suryaningrum dan Utomo 2002)
Larutan gelatin dengan konsentrasi 6,67% (b/b) disiapkan dengan aquades. Contoh diinkubasi pada suhu 10 ºC selama 17 ± 2 jam. Pengukuran titik leleh dilakukan dengan cara memanaskan gel gelatin dalam waterbath. Diatas gel gelatin tersebut diletakkan gotri dan ketika gotri jatuh ke dasar gel gelatin maka suhu tersebut merupakan suhu titik leleh.
3.4.12 Titik gel ( Suryaningrum dan Utomo 2002)
Larutan gelatin dengan konsentrasi 6,67% (b/b) disiapkan dengan aquades dan disimpan dalam tabung reaksi yang dihubungkan dengan termometer digital kemudian diberikan es pada keliling luar bagian tabung reaksi. Titik gel adalah suhu ketika larutan gelatin mulai menjadi gel.
3.4.13 Titik isoelektrik protein (Wainewright 1977)
Sebanyak 0,2 gr contoh ditambah dengan 40 ml aquades sebagai pelarut dengan kisaran pH 4,5-10,5 (interval 0,5). Pengaturan pH dilakukan dengan menambah NaOH 0,5 N untuk menaikkan pH dan HCl 0,5 N untuk manurunkan pH. Setelah kondisi tercapai dilanjutkan dengan pengadukan selama 30 menit untuk menyempurnakan reaksi. Larutan yang dihasilkan dipisahkan dengan bagian yang tidak larut dengan cara disentrifuse, kemudian disaring dengan menggunakan kertas saring whatman 41. Filtrat dianalisis kadar nitrogennya dengan metode mikro-kjeldahl. Kadar nitrogen terlarut yang paling rendah ditentukan sebagai daerah isoelektrik (pl).
3.4.14 Asam amino (Muchtadi dkk 1992)
Sebanyak 0,2 gr contoh disiapkan dalam tabung reaksi tertutup dan ditambahkan sebanyak 5 ml HCL 6 N. Contoh dimasukkan dalam oven dengan suhu 100 ºC selama 18-24 jam. Selanjutnya contoh disaring dengan kertas whatman 41. Hasil hidrolisis dipipet sebanyak 10 µl dan dimasukkan ke dalam tabung reaksi. Kemudian ditambahkan 30 µl larutan pengering, dan dikeringkan dengan pompa vakum bertekanan 50 torr. Contoh yang telah dikeringkan ditambah larutan derivat sebanyak 30 µl dan dibiarkan selama ± 20 menit. Contoh selanjutnya diencerkan dengan 200 µl larutan pengencer natrium asetat 1M. Contoh siap dianalisis dengan menggunakan HPLC Water Associates. Kondisi HPLC pada saat dilakukan analisis :
- Temperatur kolom : 38ºC
- Kolom : pico tag 3,9 x 150 nm coloumb - Kecepatan alir : Sistem linier gradien
- Batas tekanan : 3000 psi - Program : gradien
- Fase gerak : - Asetonitril 60%
- Buffer Natrium asetat 1 M, pH 5,75 - Detektor : UV, panjang gelombang 254 nm
Konsentrasi asam amino dihitung dengan rumus :
Konsentrasi asam amino (%) = x100% Bc
BsxBMxFp x
As Ac Keterangan : Ac = Luas area sampel
As = Luas area standar Bc = Berat sampel (µg) Bs = Berat standar (µg)
BM = Berat molekul masing-masing asam amino Fp = Faktor pengenceran (10)
3.4.15 Uji organoleptik (Soekarto dan Hubeis 1992)
Uji organoleptik dilakukan melalui uji segitiga (Triangle Test). Sejumlah contoh disajikan bersama dengan pembanding. Kemudian sifat mutu produk yang meliputi warna, bau, dan penampakan dinilai apakah lebih baik, sama, atau kurang baik. Panelis yang menilai adalah panelis semi terlatih sebanyak 15 orang.
3.5 Rancangan Percobaan
Rancangan percobaan yang digunakan adalah Racangan Acak Lengkap (RAL) Faktorial dengan dua taraf yaitu konsentrasi asam asetat dan lama waktu perendaman dengan 3 kali ulangan. Model rancangan adalah :
Yij = µ + i + j + ( )ij + ij Dengan i = 1,2,3,...
j = 1,2,3,... Keterangan :
Yij = hasil pengamatan
µ = nilai tengah umum
Ai = pengaruh sebenarnya lama perendaman ke-i (i = 1,2,3)
Bj = pengaruh sebenarnya konsentrasi pelarut ke-j (i = 1,2,3)
BAij = pengaruh sebenarnya interaksi antara lama perendaman ke-i (i = 1,2,3)
dengan konsentrasi pelarut ke-j (i = 1,2,3)
ij = faktor galat
Jika hasil analisis ragam berbeda nyata maka dilakukan uji lanjut manggunakan metode Duncan (Gaspersz 1994). Rumus uji Duncan :
Sy = (KTS/r)
Rp = qa’ x Sy
Keterangan :
Sy = significant range
KTS = jumlah kuadrat sisa
qa’ = significant studentized range (Tabel A7. dalam Steel and Torrie 1998) r = ulangan
Gambar 5. Skema proses pembuatan gelatin kulit ikan kakap merah (Lutjanus sp.) (*Modifikasi Pelu et al., 1998).
Keterangan :
: Masukan (input) : Proses
: Hasil (output)
Kulit ikan kakap merah
Penyaringan dengan kain saring
Ekstraksi, kulit : akuades = 1 : 3 pada suhu ± 80 ºC, selama 3 jam* Pencucian dengan air hingga pH 5 – 6*
Perendaman CH3COOH 1%, 2%, dan 3 % selama 12 jam, 18 jam, dan 24 jam*
Pencucian dengan air mengalir Pemotongan kulit dengan ukuran 2 x 4 cm* Pembersihan dari daging, lemak, sisik, dan kotoran lain
Lembaran gelatin
Uji fisik : rendemen, viskositas, kekuatan gel
Uji kimia : pH, kadar air, abu, protein, lemak, derajat putih, logam berat (Pb dan Hg), titik leleh, titik gel, titik isoelektrik serta asam amino
Uji organoleptik : warna, penampakan, bau Serbuk gelatin ikan*
Pengeringan dengan oven, suhu 50 ºC selama 48 jam*
4. HASIL DAN PEMBAHASAN 4.1 Penelitian Pendahuluan
Pembuatan gelatin pada tahap penelitian pendahuluan dilakukan dari bahan baku kulit ikan kakap merah (Lutjanus sp.) dengan menggunakan larutan asam asetat konsentrasi 1%-5% dan dua taraf lama perendaman yaitu 12 jam dan 24 jam. Perlakuan ini dilakukan untuk mengetahui konsentrasi asam asetat dan lama perendaman yang dapat digunakan untuk menghasilkan gelatin dengan mutu baik.
Parameter uji yang digunakan untuk menentukan karateristik gelatin adalah rendemen, pH, viskositas, dan kekuatan gel. Rendemen merupakan salah satu parameter yang penting dalam menilai baik tidaknya proses pembuatan gelatin sedangkan kekuatan gel, viskositas, dan pH dipilih sebagai parameter karena ketiganya merupakan sifat fisika dan kimia yang sangat penting pada aplikasi gelatin pada berbagai produk.
4.1.1 Rendemen gelatin
Rendemen merupakan salah satu parameter yang penting dalam pembuatan gelatin. Rendemen dihitung berdasarkan perbandingan antara gelatin serbuk yang dihasilkan dengan bobot kulit ikan kakap merah setelah dibersihkan. Hasil rendemen gelatin kulit ikan kakap merah secara lengkap dapat dilihat pada Gambar 6. 11,72c 11,7c 9,13b 10,34b11,75 b 9,85b 13,33b 7,21b 7,78a 5,32a 0 2 4 6 8 10 12 14 (% ) 1 2 3 4 5
Konsentrasi asam asetat (%) 12 jam 24 jam
Angka-angka yang diikuti huruf berbeda (a,b,c) menunjukkan berbeda nyata (sig<0,05)
Gambar 6. Histogram rendemen gelatin kulit ikan kakap merah pada penelitian pendahuluan (n = 3)
Nilai rendemen gelatin hasil penelitian berkisar antara 5,32% sampai 13,33%. Analisis ragam faktorial menunjukkan bahwa konsentrasi asam asetat dan interaksi antara konsentrasi asam asetat dengan lama perendaman memberikan pengaruh yang berbeda nyata (sig<0,05) terhadap rendemen gelatin, sedangkan lama perendaman tidak menunjukkan pengaruh yang berbeda nyata (Lampiran 11). Uji lanjut menggunakan metode Duncan menunjukkan bahwa kombinasi perlakuan memberikan pengaruh yang berbeda nyata (sig<0,05) terhadap hasil rendemen gelatin kulit ikan kakap merah (Lampiran 12).
Nilai rendemen terbesar diperoleh pada gelatin dengan perlakuan perendaman asam asetat 4% dan lama perendaman 12 jam, sedangkan nilai rendemen terkecil dihasilkan pada perlakuan perendaman asam asetat 5% dengan lama perendaman 24 jam. Terlihat kecenderungan bahwa semakin tinggi konsentrasi asam asetat, maka rendemen yang dihasilkan makin tinggi. Tingginya rendemen yang dihasilkan diduga karena pengaruh jumlah ion H+ yang menghidrolisis kolagen dari rantai triple heliks menjadi rantai tunggal. Kecenderungan ini mencapai batasnya apabila ion H+ yang berlebih
menghidrolisis kolagen lebih jauh sehingga terjadi perubahan sifat fisika dan kimia. Konsentrasi asam yang berlebih menimbulkan adanya hidrolisis lanjutan sehingga sebagian gelatin turut terdegradasi dan menyebabkan turunnya jumlah gelatin. Menurut Ward and Court (1977) konversi kolagen menjadi gelatin dipengaruhi oleh suhu, waktu pemanasan, dan pH.
4.1.2 Nilai pH gelatin
Nilai pH gelatin atau derajat keasaman gelatin merupakan salah satu parameter penting dalam standar mutu gelatin. Pengukuran nilai pH larutan gelatin penting dilakukan karena pH larutan gelatin mempengaruhi sifat-sifat yang lainya seperti viskositas dan kekuatan gel, serta akan berpengaruh juga pada aplikasi gelatin dalam produk. Gelatin dengan pH netral akan bersifat stabil dan penggunaannya akan menjadi lebih luas (Astawan 2002).
Nilai pH gelatin berhubungan dengan proses atau perlakuan yang digunakan untuk membuatnya. Proses asam cenderung menghasilkan pH yang rendah. Gelatin dengan pH netral cenderung lebih disukai, sehingga proses penetralan memiliki peran yang penting untuk menetralkan sisa-sisa asam setelah
perendaman (Hinterwaldner 1977). Nilai pH gelatin dengan perlakuan berbeda yang diperoleh pada penelitian disajikan pada Gambar 7.
5,56c 5,32c 5,04b5,15 b 4,78ab5,01 ab 4,82ab4,91 ab 4,34a 4,88a 0 1 2 3 4 5 6 N il ai p H 1 2 3 4 5
Konsentrasi asam asetat (%)
12 jam 24 jam
Angka-angka yang diikuti huruf berbeda (a,b,c) menunjukkan berbeda nyata (sig<0,05)
Gambar 7. Histogram nilai pH gelatin kulit ikan kakap merah pada penelitian pendahuluan (n = 3)
Hasil analisis ragam faktorial menunjukkan bahwa konsentrasi asam asetat dan interaksi antara konsentrasi asam asetat dengan lama perendaman memberikan pengaruh yang berbeda nyata (sig<0,05) terhadap nilai pH gelatin, sedangkan lama perendaman tidak menunjukkan pengaruh yang berbeda nyata (Lampiran 13). Berdasarkan hasil tersebut dapat diketahui bahwa nilai pH gelatin kulit ikan kakap merah dipengaruhi oleh konsentrasi asam asetat yang digunakan. Uji lanjut Duncan menunjukkan bahwa kombinasi perlakuan konsentrasi asam asetat dan lama perendaman memberikan pengaruh yang berbeda nyata (sig<0,05) terhadap hasil rendemen gelatin kulit ikan kakap merah (Lampiran 14).
Berdasarkan hasil pengukuran pH gelatin didapatkan bahwa pH gelatin kulit ikan kakap merah berkisar antara 4,34 sampai dengan 5,56. Nilai ini masih memenuhi standar gelatin tipe A yang disyaratkan Tourtellote (1980) yaitu berkisar antara 3,8-6,0 (Lampiran 10). Nilai pH yang paling mendekati kondisi netral (pH 7) dimiliki oleh perlakuan kulit dengan perendaman asam asetat 1% dan lama perendaman 12 jam yaitu sebesar 5,56 dan nilai pH yang paling jauh dari kondisi netral dimiliki oleh perlakuan kulit dengan perendaman asam asetat 5% dan lama perendaman 12 jam yaitu sebesar 4,34.
Rendahnya nilai pH gelatin kulit ikan kakap merah diakibatkan oleh tingginya konsentrasi asam asetat yang digunakan. Hal ini diduga karena masih
ada sisa-sisa asam asetat yang digunakan pada saat perendaman yang terbawa pada saat ekstraksi, sehingga akan mempengaruhi tingkat keasaman (pH) gelatin yang dihasilkan. Gelatin dengan pH rendah mempunyai keuntungan yaitu akan tahan terhadap kontaminasi mikroorganisme (Saepudin 2003 dalam Hajrawati 2005).
4.1.3 Viskositas gelatin
Viskositas larutan gelatin terutama tergantung pada tingkat hidrodinamik antara molekul-molekul gelatin itu sendiri. Disamping itu juga, viskositas tergantung pada temperatur, pH, dan konsentrasi dari larutan gelatin (Ward and Courts 1977).
Nilai viskositas gelatin kulit ikan kakap merah hasil penelitian berkisar antara 12-18,2 centipoise (cP). Nilai viskositas tertinggi terdapat pada perlakuan kulit dengan perendaman asam asetat 3% dan lama perendaman 24 jam, sedangkan nilai viskositas terendah terdapat pada perlakuan kulit dengan perendaman asam 5% dan lama perendaman 12 jam. Nilai viskositas gelatin kulit ikan kakap merah dengan perlakuan berbeda yang diperoleh pada penelitian disajikan pada Gambar 8.
15,6c 15,35c 16,2 c 14,8c 14,78d 18,2d 14b 14,4b 12a 13,8a 0 2 4 6 8 10 12 14 16 18 20 ce nt ip oi se (c P) 1 2 3 4 5
Konsentrasi asam asetat (%) 12 jam 24 jam
Angka-angka yang diikuti huruf berbeda (a,b,c,d) menunjukkan berbeda nyata (sig<0,05)
Gambar 8. Histogram viskositas gelatin kulit ikan kakap merah pada penelitian pendahuluan (n = 3)
Berdasarkan analisis ragam faktorial, konsentrasi asam asetat dan interaksi antara konsentrasi asam asetat dengan lama perendaman memberikan pengaruh yang berbeda nyata (sig<0,05) terhadap viskositas gelatin, sedangkan lama perendaman tidak menunjukkan pengaruh yang berbeda nyata (Lampiran 15).