PERFORMANS ANTIBODI MONOKLONAL DARI ASCITES YANG DIPANEN SAAT HEWAN COBA MASIH
HIDUP DAN SESAAT SESUDAH MATI
Sulaiman Ngongu Depamede dan Enny Yulianti
Fakultas Peternakan Universitas Mataram, Kelompok Pengajar Ilmu Dasar
ABSTRAK
Penetitian ini bertujuan untuk mengetahui kualitas dan kuantitas ascites dari Balb/c yang dipanen ketika hewan coba masih hidup dan sesaat sesudah mati. Hal ini penting bagi keperluan operasional produksi antibodi monoklonal secara in vivo. Untuk itu digunakan 20 ekor Balb/c yang dibagi sama secara acak ke dalam dua kelompok perlakuan (A dan B). Setiap hewan coba diperlakukan sama, kecuali waktu pemanenan ascites yang berbeda yakni satu kelompok (10 ekor) pada saat hewan masih hidup (Kelompok A), sementara lainnya sesaat sesudah hewan mati (Kelompok B). Untuk menghasilkan ascites, digunakan sel-sel hibridoma K0436 yang menghasilkan antibodi monoklonal terhadap antigen permukaan virus hepatitis B (HBsAg). Sel-sel tersebut diinokulasikan sebanyak 10 juta sel per ekor tikus. Pengamatan dan pemanenan ascites dilakukan 2-3 minggu pasca inokulasi, setiap hari pk. 07.00, 12.00 dan 17.00. Parameter yang diukur adalah volume ascites dan titer antibodi (metode reverse pasive hemagglutination) yang dihasilkan dari setiap individu hewan pada masing-masing kelompok perlakuan. Data yang diperoleh diolah dan dianalisis menggunakan perhitungan statistik sederhana (Mean ± SD). Untuk mengetahui apakah terdapat perbedaan yang bermakna secara statistik antar perlakuan, dilakukan uji beda t (Student's t test). Hasil penelitian menunjukkan bahwa ascites yang dihasilkan dari kedua kelompok tidak berbeda secara berrnakna (p > 0,05) baik kualitas (titer antibodi) maupun kuantitas (volume) ascites. Hasil dari kelompok A dan B berturut-turut 17,83±0,29 dan 15,11±2,56 untuk titer antibodi, dan 6,31±4,56 dan 4,67±2,75 ml untuk volume ascites. Mengingat penelitian ini tidak sarnpai pada tingkat pernurrtian antibodi, maka penelitian lebih lanjut terhadap kualitas dan kuantitas antibodi pasca pemurnian masih diperlukan.
Performans Antibodi Monoklonal…
PENDAHULUAN
Antibodi monoklonal yang dihasilkan dari sel-sel hibrid hasil fusi sel limfosit dan mielorna, pemakaiannya sudah sangat luas (Tizard, 1995: Drew et al. 1995; Weiland et al. 2000), baik untuk kepentingan riset maupun terapan di bidang biomedis, peternakan, maupun industri berbasis bioteknologi, bahkan pada penanganan masalah-masalah kriminal. Hal ini disebabkan karena antibodi monoklonal memiliki spesifisitas dan afinitas pengikatan terhadap determinan antigen target yang tinggi (Mayer and Walker, 1987: Tizard, 1995). Spesifisitas dan afinitas yang tinggi ini dirnungkinkan karena sel-sel hibrid merupakan klon-klon hibridoma yang homogen (Milstein, 1991).
Karena luas dan intensnya pemakaian antibodi monoklonal ini, produksinya kini sudah pada skala industri. Produksinya dapat dilakukan dengan proses kultur jaringan (secara in vitro) atau dengan memanfaatkan hewan-hewan coba (in vivo) (Prabhakar et al. 1984; Zola, 1989; Milstein, 1991). Produksi secara in vivo dilakukan dengan menyuntikkan (menginokulasikan) sel-sel hibridoma hasil kultur ke dalam intra peritoneum (rongga perut) hewan-hewan coba (biasanya mencit putih Balb/c) yang sebelumnya sudah diperlakukan dengan menyuntikan bahan kimia Pristane (2,6,10,14-tetramethylpentadecane) satu kali seminggu, selama 2-3 minggu (Prabhakar et al. 1984). Urnumnya dua hingga empat rninggu setelah penginokuiasian, akan dihasilkan cairan ascites yakni cairan yang mengandung antibodi monoklonal yang disekresikan oleh sel-sel hibridoma yang diinokulasikan di dalam rongga perut hewan coba. Cairan ascites inilah yang diambil (dipanen) dan antibodi yang diperoleh kemudian dimurnikan untuk digunakan lebih lanjut baik untuk keperluan terapi atau untuk pembuatan kit diagnostik. Produksi secara in vivo ini dapat menghasilkan antibodi hingga 20 mg per milliner dibandingkan hasil secara in vitro yang hanya sekitar 10-100 µg per mililiter.
Pemanenan ascites ini dapat dilakukan satu kali yakni pada saat hewan coba hampir mati dengan ciri umum adalah perutnya membesar optimum, hewan sangat lemah dan tidak mampu bergerak lagi. Atau dilakukan beberapa kali pemanenan bergantung pada keadaan hewan coba tersebut (Zola, 1989).
Untuk mengetahui apakah saat pemanenan berpengaruh pada kualitas dan kuantitas antibodi, telah dilakukan penelitian tentang "Kualitas dan kuantitas antibodi monoklonal dari
MATERI DAN METODE
Penelitian ini dilakukan di Laboratorium Imunobiologi Unram. Digunakan 20 ekor tikus Balb/c yang diambil secara acak dari kawanan 50 ekor tikus jantan dan betina dengan umur berkisar 8-10 minggu. Ke duapuluh ekor tikus tersebut dibagi menjadi dua kelompok secara acak masing-masing 10 ekor dan ditangkarkan pada penangkar tikus masing-masing berisi 5 ekor tikus. Setiap tikus diberi kode penomeran dengan cara membuat cukilan kecil pada daun telinga menggunakan gunting seksio, sementara kotak penangkar diberi kode kelompok pengamatan, yakni kelompok pengarnatan saat tikus masih hidup (Kelompok A) dan kelompok pengamatan sesaat sesudah tikus mati (Kelompok B). Seluruh hewan coba mendapat perlakuan yang sama, pakan dan air minum diberikan adlibitum, kandang dan penangkar dibersihkan dua kali seminggu.
Tikus-tikus coba disuntik dengan Pristane: 2,6,10,14-Tetramethylpentadecane (Sigma) pada rongga intraperitoneumnya sebanyak 0,5 ml per ekor. Penyuntikan dilakukan sebanyak tiga kali dengan tenggang waktu satu minggu. Tiga hari setelah penyuntikan Pristane yang terakhir, dilakukan penginokulasian sel-sel hibridoma KO-436 yang mampu mensekresikan antibodi terhadap determinan a dari antigen permukaan virus penyebab hepatitis B (HBsAg). Penginokulasian ini dilakukan dengan metode standar yakni dengan cara menanam 10 juta sel hibridoma KO-436 ke dalam rongga intraperitoneum tikus Balb/c dalam 0,5 ml larutan garam fisiologis (Prabhakar et al: 1984; Zola 1989).
Dalam waktu sekitar tiga hingga empat minggu sesudah penginokulasian, pemanenan ascites dimulai. Pada kelompok pengamatan hewan coba hidup, pemanenan ascites dilakukan ketika perut hewan coba mernbesar optimum berisi ascites dan tikus dalam keadaan lemah dan sulit bergerak. Sementara pada kelompok pengamatan tikus sesudah mati, hewan coba yang perutnya sudah membesar optimum dan tidak mampu bergerak lagi dibiarkan dalam kondisi demikian hingga mati alami, kemudian barulah dilakukan pemanenan ascites. Pengamatan untuk pemanenan ascites dilakukan setiap hari yakni pk. 07.00, 12.00, dan 17.00.
Performans Antibodi Monoklonal…
Parameter yang diukur pada penelitian ini adalah volume ascites per ekor tikus per pemanenan, dan titer antibodi yang dihasilkan. Titer antibodi ditera dengan cara mengencerkan secara serial kelipatan dua (2n) dari 25 mikroliter sampel cairan ascites yang ditampung dari setiap individu mencit per pelakuan, menggunakan mettode reverse passive hemagglutination (RPHA). Reagensia yang digunakan adalah Kit-RPHA "Entebe" produksi Laboratorium Hepatika Bumi Gora NTB. Seluruh pengujian dilakukan sesuai standar pengujian yang tertera pada protokol Kit dan dilakukan duplikasi untuk tiap-tiap sampel.
Data yang diperoleh diolah dan dianalisis menggunakan perhitungan statistik sederhana yakni perhitungan rata-rata (mean) dan simpangan baku (SD). Untuk mengetahui apakah terjadi perbedaan yang bermakna secara statistik, dilakukan uji beda t (Student's t test).
HASIL DAN PENTRATINSAN
Dari hasil penelitian ini diperoleh total volume ascites dari kelompok hewan yang dipanen saat masih hidup dan sesaat sesudah mati masing-masing sebesar 63 dan 47 mililiter. Rataan volume yang diperoleh sebesar 6,31±4,56 ml pada kelompok hewan hidup dan 4,67±2,75 ml pada kelompok hewan yang dipanen sesaat setelah mati. Hasil ini masih dalam kisaran yang noimal, sebab menurut Harlow and Lane (1988), dan Zola (1989) volume ascites Balb/c sangat variatif mulai dari sekitar 1 ml hingga 10 ml per ekor. Hal ini disebabkan oleh banyak faktor antara lain umur, ukuran tubuh dan sifat per individu hewan.
Hasil uji statistik menunjukkan bahwa volume yang diperoleh antar ke dua kondisi percobaan tidak berbeda secara bermakna (p>0,05). Sungguhpun demikian secara kuantitatif volume yang diperoleh dari pemanenen ascites ketika hewan masih hidup mernberikan hasil yang cukup besar yakni sekitar 16 ml dibandingkan dengan pemairmenan di saat hewan telah mati. Hal ini dimungkinkan karena pada pemanenen saat hewan masih hidup masih dapat dilakukan dua hingga tiga kali untuk setiap ekor. Menurut Prabhakar et al. (1984) dan Zola (1989) pemanenan berulang sudah biasa dilakukan secara rutin selama etika kehewanan di lokasi tersebut masih mengijinkan untuk melakukan tindakan yang demikian (lihat juga Rowan, 1997).
kemungkinan akibat adanya kontaminan dari lisisnya sel-sel darah merah disaat hewan-hewan mengalami proses kematian, khususnya ketika rongga perut hewan-hewan coba dipenuhi cairan ascites dan adanya sel-sel tumor dan hibridoma.
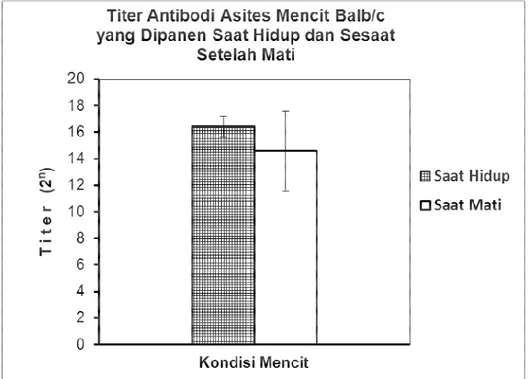
Hasil pengamatan secara kualitatif yakni dari pengujian terhadap titer antibodi asites dipaparkan pada Gambar 1 di bawah ini.
Gambar 1. Titer (2n) antibodi asites mencit Balb/c yang dipanen saat hewan masih hidup dan sesaat setelah mati (n = 10).
Tampak jelas pada Gambar 1 bahwa secara statistik tidak terdapat perbedaan yang bermakna (p>0,05) antara kualitas antibodi dari ascites yang dipanen saat hewan coba masih hidup (17,83±0,29) dan sesaat sesudah hewan coba mati (15,11±2,56). Akan tetapi jika diamati secara seksama tampak bahwa ascites yang diperoleh dari kelompok hewan-hewan yang mati memilik kualitas dengan kisaran titer vang cukup besar yakni antara 12,5 dan 17,6. Variasi yang besar ini kernungkinan sebagai akibat rusaknya antibodi pada beberapa hewan coba sehingga ada individu hewan yang titer antibodinya menjadi rendah. Kerusakan ini kemungkinan ditirnbulkan dari adanya beberapa protease yang muncul ketika hewan-hewan
Performans Antibodi Monoklonal…
tersebut mati. Protease yang merupakan enzim proteolitik terutama yang berasal dari beberapa bakteri saluran pencernaan diketahui dapat merusak imunoglobulin (Austyn and Wood, 1994). Untuk rnemastikan hal ini rnasih diperlukan penelitian-penelitian lebih lanjut.
Mengingat produksi antibodi monoklonal ini ditujukan untuk keperluan riset imunologis, terapi, maupun pengujian-pengujian biologis lainnya, maka produksi yang hanva sebatas pemanenan dan uji kualitas ascites masih belum cukup. Untuk tujuan yang lebih spesifik tersebut, antibodi pada cairan ascites yang diperoleh masih harus dimurnikan lebih lanjut. Ini berarti masih diperlukan penelitian lanjutan yang berkaitan dengan kualitas dan kuantitas antibodi pasca pemurnian ascites yang diperoleh dari hewan coba saat masih hidup dan sesudah mati. Untuk keperluan ekonomi, pengamatan dari aspek ekonomis perlu juga dilakukan.
KESIMPULAN DAN SARAN
Dari hasil penelitian ini dapat disimpulkan bahwa ascites yang diperoleh dari pemanenan pada saat hewan masih hidup maupun sesaat sesudah mati memiliki kualitas dan kuantitas yang tidak berbeda secara bermakna. Akan tetapi dari aspek teknis tampak bahwa pemanenan ascites dari hewan-hewan yang masih hidup tampaknya lebih baik dibandingkan dari hewan-hewan yang suclah mati. Untuk itu untuk keperluan produksi pertimbangan ini perlu diperhatikan. Sungguhpun demikian, secara operasional di lapangan jika ditemukan hewan ascites yang mati, selama kematiannya masih tidak terlalu lama, cairan ascitesnya masih memungkinkan untuk dipanen. Sungguhpun dernikian, untuk memastikan tingkat kualitas antibodinya penelitian lebih lanjut masih sangat diperlukan. Termasuk di sini antara lain pemurnian antibodi dan pengamatan terhadap kemungkinan adanya pengaruh kontaminan protease.
Ucapan Terima Kasih
Penulis mengucapkan terima kasih kepada Kepala UPT-MIPA dan Ketua Laboratorium Imunobiologi Unram yang telah menyediakan fasilitas laboratorium kultur sel hewan. Ucapan terima kasih disampaikan pula kepada Laboratorium Hepatitis NTB yang telah menyediakan sel hybridoma anti-a K0436, reagensia dan kemikalia, serta hewan-hewan percobaan. Penulis juga mengucapkan terima kasih kepada Sdr. Khalid dan Murhaeni tehnisi
DAFTAR PUSTAKA
Austyn J.M., and Wood K.J. (1994). Principles of Cellular and Molecular Immunology. Oxford University Press. Oxford,
Drew T.W., Meulendberg J.J.M., Sands J.J., and Paton D.J. (1995). Production, characterization and reactivity of monoclonal antibodies to porcine reproductive and respiratory syndrome virus, Gen. Viral. 76: 3-41.
Harlow Ed and Lane D. (1988). Antibodies: A Laboratory Manual. Cold Spring Harbor Laboratory. USA. p 121.
Mayer R.J., and Walker J.H. (1987). Immunological Methods in Cell and Molecular Biology Academic Press. London.
Milstein C. (1991). Monoclonal Antibodies. In: immunology-Recognition and Response_ Edited by Paul WE. Reading From Scientific American. WH Freeman and Co. New York. Pp.124-134.
Prabhakar B.S., Haspel M. V, and Notkins A.L. (1984). Monoclonal Antibody: Techniques Applied to Viruses. Methods in Virology. Vol. VII. Pp. 1-18.
Rowan A.N. (1997). The Benefits and Ethics of Animal Research. Scientific American. February Vol. 276.
Tizard I.R. (1995). Immunology: An. Introduction. Saunders College Publishing. Philadelphia. pp 210-212.
Weiland E., Bolz S., Weiland F., :Herbst W, Raamsman M.J.B., Rattier PJ.Ivl, and De Vries A. A.F. (2000). Monoclonal antibodies directed against conserved epi topes on the nucleocapsicl protein and the major envelope glycoprotein of equine arteritis virus. J. Clin. Microbiol. 38:2065-2075
Zola Heddy (1989). Monoclonal Antibodies: A Manual of Techniques. CRC Press, Inc. Boca Raton, Florida.