LAPORAN AKHIR PRAKTIKUM KIMIA ANALISIS PERCOBAAN POTENSIOMETRI (PENGUKURAN pH)
OLEH :
GOLONGAN II KELOMPOK I
(1208505034) Agus Hendra Jaya (1208505035)
Anak Agung Rias Paramita Dewi (1208505036)
Desak Putu Meilinda Asri Swantari (1208505037)
(1208505035) (1208505036) (1208505037)
JURUSAN FARMASI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS UDAYANA
PERCOBAAN POTENSIOMETRI (PENGUKURAN pH)
I. TUJUAN
1.1 Membuat kurva hubungan antara pH dengan volume pentiter. 1.2 Menentukan titik akhir titrasi HCl dengan NaOH.
1.3 Menghitung kadar dari HCl. II. DASAR TEORI
2.1 Potensiometri
Potensiometri merupakan suatu cabang dari ilmu kimia elektroanalisis yang mempelajari pengukuran perubahan potensial dari elektroda untuk mengetahui konsentrasi dari suatu larutan. Reaksi yang terjadi dalam potensiometri adalah penambahan atau pengurangan ion dengan jenis elektrodanya. Potensial reaksi dihitung dengan menambahkan sedikit demi sedikit volume titran secara berturut-turut (Khopkar, 2003). Ion yang dapat dititrasi dan potensial diukur untuk mengetahui titik ekivalen titrasi. Hal ini dapat diterapkan terhadap semua jenis reaksi yang sesuai untuk analisa titrimetrik (Day dan Underwood, 1998). Cara potensiometri ini dapat bermanfaat bila tidak ada indikator yang cocok untuk menentukan titik akhir titrasi, misalnya dalam hal larutan keruh atau bila daerah kesetaraan sangat pendek dan tidak cocok untuk penetapan titik akhir titrasi dengan suatu indikator (Rivai, 1995).
Prinsip dari potensiometri didasarkan pada pengukuran potensial listrik antara elektrode pengukur (elektroda indikator) dengan elektroda pembanding yang dicelupkan pada suatu larutan. Untuk mengukur potensial pada elektroda indikator harus digunakan elektroda standar yaitu berfungsi sebagai pembanding yang mempunyai harga potensial tetap selama pengukuran (Gandjar dan Rohman, 2007).
Potensiometri merupakan aplikasi langsung dari persamaan Nernst yang dilakukan dengan cara pengukuran dua elektroda tidak terpolarisasi
pada kondisi arus nol, yang mana persamaan ini menyatakan adanya hubungan antara potensial relatif suatu elektroda dengan konsentrasi spesies ioniknya yang sesuai dalam larutan (Khopkar, 2003). Adapun persamaan Nernst dibuat dalam persamaan sebagai berikut:
d x a a z E E Re 0 0 log 059 , 0 Keterangan :
E = potensial (V), diperoleh dari elektroda hidrogen normal E0 = potensial normal
Z = jumlah elektron yang terlibat dalam proses redoks aOx = aktivita bentuk teroksidasi
aRed = aktivita bentuk tereduksi
(Roth dan Blaschke, 1994)
2.2 Elektroda Pada Potensiometri
2.2.1 Elektroda Pembanding (Refference Electrode)
Elektroda pembanding adalah elektroda yang potensialnya diketahui dan selama pengukurannya tetap konstan. Elektroda pembanding yang banyak digunakan adalah elektroda kalomel karena potensial yang dihasilkan konstan. Antara elekroda pengukur (elektroda indikator) dan elektroda pembanding terdapat jembatan arus atau garam dengan larutan elektrolit yang di dalamnya terdapat transpor ion arus. Di dalam penggunaan analisis elektrokimia, diperlukan suatu elektrode pembanding (refference electrode) yang memiliki syarat harga potensial setengah sel yang diketahui, konstan, dan sama sekali tidak peka terhadap komposisi larutan yang sedang diselidiki. Pasangan elektrode pembanding adalah elektrode indikator (working electrode) yang potensialnya bergantung pada konsentrasi zat yang sedang diselidiki (Roth dan Blaschke, 1994).
Syarat-syarat dari elektrode pembanding adalah: a. Mematuhi persamaan Nersnt dan bersifat reversibel. b. Memiliki potensial elektroda yang konstan terhadap waktu.
c. Segera kembali ke harga potensial semula apabila dialiri arus yang kecil.
d. Hanya memiliki efek hysterisis yang kecil jika diberi suatu siklus suhu.
e. Merupakan elektroda yang bersifat nonpolarisasi secara ideal. (Day dan Underwood, 1998) Terdapat beberapa macam dari elektroda pembanding, antara lain : a. Elektroda Kalomel Jenuh (Saturated Calomel Electrode, SCE)
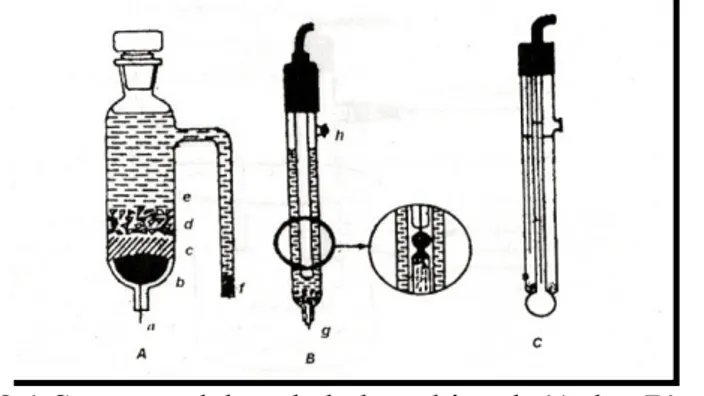
Elektroda kalomel merupakan elektrode yang terdiri dari lapisan Hg yang ditutupi dengan pasta Merkuri (Hg), Merkuri Klorida/Kalomel (Hg2Cl2) dan kalium klorida (KCl). Elektroda kalomel jenuh biasanya banyak digunakan oleh para pakar kimia analitik karena banyak tersedia di pasaran dan konsentrasi klorida tidak mempengaruhi harga potensial elektroda. Harga potensial SCE adalah 0,244 V pada 25o C dibandingkan terhadap elektroda hidrogen standar (Day dan Underwood, 1998). Elektroda kalomel ditunjukan oleh gambar di bawah ini.
Gambar 2.1 Susunan elektroda kalomel jenuh (A dan B); dan elektroda gabungan kalomel jenuh gelas (C) (Gandjar dan
Rohman, 2007)
b. Elektroda perak/perak klorida
Elektroda perak/perak klorida merupakan elektroda yang terdiri dari suatu elektroda perak yang dicelupkan ke dalam larutan
KCI yang dijenuhkan dengan AgCI. Biasanya elektroda ini dibuat dari suatu larutan jenuh atau 3,5 M KCI yang harga potensialnya dalah 0,199 V (jenuh) dan 0.205 V (3,5 M) pada 25o C. Kelebihan elektroda ini dapat digunakan pada suhu yang lebih tinggi sedangkan elektroda kalomel tidak (Day dan Underwood, 1998). 2.2.2 Elektroda Indikator (Indicator Elektrode)
Elektroda indikator (elektroda kerja) adalah suatu elektroda yang potensial elektrodanya bervariasi terhadap konsentrasi (aktivitas) analit yang diukur. Elektroda indikator harus memenuhi beberapa syarat antara lain harus memenuhi tingkat kesensitifan yang terhadap konsentrasi analit. Tanggapan terhadap keaktifan teroksidasi dan tereduksi harus sedekat mungkin dengan yang diramalkan dengan persamaan Nernst sehingga adanya perbedaan yang kecil dari konsentrasi analit akan memberikan perbedaan tegangan (Day dan Underwood, 1998).
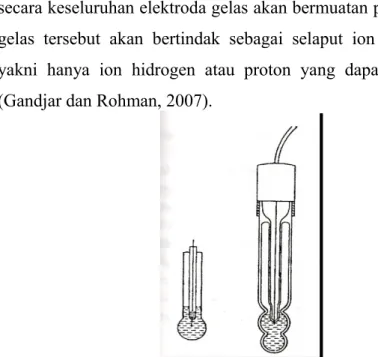
Elektroda yang banyak digunakan untuk pemeriksaan kimia adalah elektroda indikator selektif ion. Elektroda ini biasanya hanya peka terhadap salah satu ion sehingga elektroda ini disebut dengan elektroda selektif ion atau elektroda khas ion. Salah satu jenis elektroda yang penting untuk pemeriksaan kimia adalah indikator gelas yang mempunyai tanggapan yang bolak-balik terhadap ion hidrogen sehingga sering digunakan untuk pengukuran pH (Gandjar dan Rohman, 2007).
Elektroda gelas ini terdiri atas bola gelas khusus berdinding tipis yang didalamnya terdapat elektroda pembanding yang dicelupkan ke dalam larutan penyangga. Bila elektroda gelas dicelupkan ke dalam suatu larutan yang dalam hal ini adalah larutan HCl, maka akan terjadi kesetimbangan antara ion-ion hidrogen yang terdapat di bagian lapisan tipis bola gelas dan ion hidrogen yang terletak dalam larutan yang diuji. Semakin besar kadar ion hidrogen dalam larutan uji maka akan semakin banyak
ion hidrogen yang masuk ke dalam lapisan gelas tadi, karenanya secara keseluruhan elektroda gelas akan bermuatan positif. Lapisan gelas tersebut akan bertindak sebagai selaput ion yang selektif, yakni hanya ion hidrogen atau proton yang dapat melewatinya (Gandjar dan Rohman, 2007).
Gambar 2.2 Elektroda Gelas (Gandjar dan Rohman, 2007) 2.3 Penentuan pH Pada Potensiometri
Pada tahun 1909, sebelum konsep aktivitas dikembangkan, seorang ahli biokimia mengemukakan pH dalam pengertian konsentrasi molar H+.
pH = - log [H+]
Ini memberikan cara yang tepat untuk mengungkapkan nilai [H+] untuk berbagai orde besarnya dan dari persamaan Nernst, secara eksplisit linear dalam tegangan dari sel yang digunakan untuk mengukur H+. Pada tahun 1924, disadari bahwa potensial elektroda mencerminkan aktivitas selain konsentrasi (Gandjar dan Rohman, 2007).
pH = - loga aH+ = - log [H+] fH+
Dimana fH+ pada persamaan di atas adalah koefisien aktivitas. Definisi ini mewakili sudut pandang larutan elektrolit yang lebih canggih, tetapi pada waktu yang sama dapat menarik perhatian ke masalah pokok yang secara prinsip tidak dapat dipecahkan. Dalam istilah termodinamika aktivitas spesies ion tunggal tidak dianggap penting secara operasional
dalam hal percobaan-percobaan yang dapat dilakukan. pH suatu larutan yang berdasarkan pada definisi kedua Sorensen adalah sebanding dengan kerja yang diperlukan untuk memindahkan H+ sebaliknya dari larutan tersebut ke larutan dimana aH+ adalah satu. Sebenarnya tak ada cara lain untuk memindahkan kation tanpa memindahkan anion, dan akan ada cara termodinamika yang berlaku untuk memecahkan seluruh kerja yang diukur menjadi kontribusi ion secara individu (Gandjar dan Rohman, 2007). 2.4 Titrasi Potensiometri
Pada titrasi potensiometri, ion dapat dititrasi dan potensial diukur sebagai fungsi volume titran. Pengukuran ini sering dimanfaatkan untuk mengetahui titik ekuivalen suatu titrasi (Day dan Underwood, 1998).
Skema susunan pengukuran pH untuk potensiometri ditunjukkan oleh gambar di bawah ini :
Gambar 2.3 Alat Pengukur pH dalam Potensiometri (Skoog, dkk, 2007)
Potensiometri merupakan suatu metode elektroanalitik yang menggunakan peralatan listrik untuk mengukur potensial elektroda indikator. Besarnya potensial elektroda indikator ini tergantung pada konsentrasi ion-ion tertentu dalam larutan. Harga potensial yang diperoleh dapat diubah sedemikian rupa sehingga dapat disajikan dalam nilai pH, pM atau pE (Gandjar dan Rohman, 2007).
Titik ekivalen dari titrasi asam basa dapat ditentukan dari reaksi yang terjadi dari jumlah asam atau basa penitrasi sehingga dapat dihitung
jumlah asam atau basa yang dititrasi. Pada titrasi asam basa melibatkan asam maupun basa sebagai titer atau titran. Titran dimasukkan ke dalam buret dan selama titrasi berlangsung, titran ditambahkan sedikit demi sedikit melalui keran ke dalam erlenmeyer yang telah mengandung larutan pereaksi lain atau sampel sampai seluruh reaksi selesai yang ditandai dengan perubahan warna indikator. Perubahan warna ini menandai telah tercapainya titik akhir titrasi (Gandjar dan Rohman, 2007).
Potensiometri memiliki beberapa keuntungan yaitu :
1. Cara potensiometri ini sangat berguna ketika tidak ada indikator yang sesuai untuk menentukan titik akhir titrasi, misalkan ketika sampel yang akan dititrasi keruh atau berwarna dan ketika daerah titik ekivalen sangat pendek sehingga tidak ada indikator yang cocok. 2. Biayanya yang relatif murah dan sederhana.
3. Voltmeter dan elektroda jauh lebih murah daripada instrumen saintifik yang paling modern.
4. Saat potensial sel dibaca pada metode potensiometri, tidak terdapat arus yang mengalir dalam larutan dimana arus residual tahanan sel dan efek polarisasi dapat diabaikan.
(Khopkar, 2003) Manfaat potensiometri secara umum yaitu untuk menetapkan tetapan kesetimbangan. Potensial-potensial yang stabil sering diperoleh dengan cukup cepat dan tegangan yang mudah dicatat sebagai fungsi waktu, sehingga potensiometri kadang juga bermanfaat untuk pemantauan yang kontinyu dan tidak diawasi. Sedangkan manfaat dari metode potensiometri dalam analisis farmasi yaitu potensiometri digunakan untuk penentuan titik akhir titrasi pada titrasi asam basa, titrasi redoks, titrasi pengendapan dan titrasi pembentukan kompleks (Khopkar, 2003).
2.5 Asam Oksalat
Asam oksalat memiliki rumus molekul C2H2O4. Asam oksalat mengandung tidak kurang dari 99,5% C2H2O4. Asam oksalat berbentuk hablur, tidak berwarna, larut dalam air dan etanol (95%) P. Penetapan
kadar asam oksalat dilakukan dengan menimbang asam oksalat kurang lebih 3 gram, dilarutkan dalam 50 mL air bebas CO2 P, dititrasi dengan NaOH 1 N menggunakan indikator fenolftalein P (Depkes RI, 1979).
Gambar 2.4 Struktur Kimia Asam Oksalat (Oxtoby, 2001) 2.6 Natrium Hidroksida
Natrium hidroksida mengandung tidak kurang dari 95,0% dan tidak lebih dari 100,5% alkali jumlah dihitung sebagai NaOH, mengandung Na2CO3 tidak lebih dari 3,0%. Natrium hidroksida berbentuk pelet, serpihan atau batang atau bentuk lain, berwarna putih atau praktis putih, massa melebur, keras, rapuh dan menunjukkan pecahan hablur. Bila dibiarkan di udara akan cepat menyerap karbon dioksida dan lembab, mudah larut dalam air dan dalam etanol netral serta disimpan dalam wadah tertutup rapat (Depkes RI, 1995).
2.7 Asam Klorida
Asam klorida mengandung tidak kurang dari 35 % dan tidak lebih dari 38 % HCl. Pemerian cairan antara lain tidak berwarna, berasap, mudah menguap, bau merangsang. Jika diencerkan dengan dua bagian air asap akan hilang (Depkes RI, 1979).
2.8 Fenolftalein
Fenolftalein tidak mengandung kurang dari 98 % dan tidak lebih dari 101 % C20H14O4 dihitung terhadap zat yang telah diberikan. Pemerian berupa serbuk putih atau putih kekuningan lemak, tidak berbaru, stabil di udara (Depkes RI, 1995).
Gambar 2.5 Struktur Kimia Fenolftalein (Watson, 2007) III.ALAT DAN BAHAN
3.1 Alat
a. Labu takar 25 mL, 100 mL b. Pipet ukur 1 mL dan 5 mL c. Pipet tetes d. Labu erlenmeyer 100 mL e. pH meter f. Buret 25 mL g. Statif h. Ball filler i. Tissue j. Lap k. Elektrode gelas l. Beaker Glass 3.2 Bahan a. Larutan NaOH 0,1 N b. Larutan HCl 0,1 N
c. Larutan Asam Oksalat 0,1 N
d. Aquadest
e. Indikator fenolftalein IV. PERHITUNGAN
4.1 Pembuatan Larutan NaOH 0,1 N
Diketahui : Normalitas NaOH = 0,1 N Volume NaOH = 100 mL
BM NaOH = 40 g/mol Ditanya : Massa NaOH yang ditimbang = …? Jawab : NaOH ⇌Na++ OH
-Ek NaOH = 1 grek/mol M NaOH = N ek = 0,1 grek/L 1 grek/mol = 0,1 M M = massa BM × 1000 V (mL) 0,1 M = massa40 g/mol × 1000100 mL massa = 0,4 gram
4.2 Pembuatan Larutan Asam Oksalat 0,1 N
Diketahui : Normalitas Asam Oksalat = 0,1 N Volume Asam Oksalat = 25 mL BM Asam Oksalat = 126,07 g/mol Ditanya : Massa Asam Oksalat yang ditimbang = …? Jawab : H2C2O4 ⇌ 2H++ C2O4 Ek H2C2O4 = 2 grek/mol M asamoksalatN ek = 0,1 grek/L 2 grek/mol = 0,05 M M = massa BM × 1000 V (mL) 0,05 M = massa 126,07 g/mol× 1000 25 mL massa = 0,1575 gram 4.3 Pembuatan Larutan HCl 0,1 N Diketahui : Normalitas HCl = 0,1 N BM HCl = 36,5 gram/mol BJ HCl = 1,19 gram/mL Volume Asam Oksalat = 25 mL
Ditanya : Volume HCl yang dipipet = ...? Jawab : M asamkloridaNek = 0,1 grek/L1 grek/mol = 0,1 M
M = massa BM × 1000 V (mL) 0,1 M = massa 36,5 g/mol × 1000 25 mL massa = 0,09125 gram
HCl yang tersedia 37% b/b = 37 gram HCl/100 gram air 37 gram/ 100 gram = 0,09125 gram/ X gram
X gram = 0,09125 gram x 100 gram37 gram X gram = 0,25 gram
V = massaBJ = 1,19 grammL = 0,210,25 gram mL
V. PELAKSANAAN PERCOBAAN
5.1 Prosedur Kerja 5.1.1 Penyiapan Larutan
a. Pembuatan Larutan NaOH 0,1 N
Ditimbang sebanyak 0,4 gram NaOH dengan gelas beaker. Ditambahkan akuades secukupnya dan diaduk sampai larut. Larutan dimasukkan ke dalam labu ukur 100 mL. Ditambahkan akuades sampai tanda batas 100 mL kemudian digojog hingga homogen.
b. Pembuatan Larutan HCl 0,1 N
Ditambahkan aquades ke dalam labu ukur 25 mL, kemudian dipipet sebanyak 0,21 mL HCl 37% b/b. Ditambahkan kembali akuades sampai tanda batas 25 mL kemudian di gojog hingga homogen.
Ditimbang sebanyak 0,1575 gram asam oksalat kemudian dimasukan ke dalam gelas beaker. Ditambahkan akuades secukupnya dan diaduk sampai larut. Ditambahkan akuades hingga 25 mL kemudian diaduk hingga larut.
5.1.2 Pengukuran
a. Penyiapan Buret
Buret yang sudah bersih dipasang pada statif dengan baik. Buret diisi dengan NaOH 0,1 N sesuai kebutuhan.
b. Standarisasi NaOH 0,1 N dengan Asam Oksalat 0,1 N
Larutan asam oksalat 0,1 N dipipet sebanyak 10 mL ke dalam erlenmeyer 25 mL. Ditambahkan 15 tetes indikator phenolphthalein ke erlenmeyer. Ke dalam buret dimasukkan larutan NaOH 0,1 N. Larutan asam oksalat kemudian dititrasi hingga terjadi perubahan warna larutan menjadi merah muda stabil. Diulangi titrasi sebanyak 3 kali. Dicatat volume NaOH yang digunakan.
c. Kalibrasi Potensiometer dengan Variasi pH Larutan Baku
Disiapkan larutan baku dengan pH 4 (asam) dan pH 7 (netral). Kemudian pH diukur pada alat potensiometer yang sudah dikalibrasi. Ukur kembali pH-nya pada alat potensiometer yang akan digunakan. Dibandingkan hasilnya, jika hasilnya sama berarti alat yang akan digunakan sudah tepat.
d. Titrasi Asam-Basa Sampel HCl dengan Potensiometer
Larutan HCl 0,1 N dipipet sebanyak 10 ml ke dalam gelas beker 100 ml. Dititrasi dengan NaOH 0,1 N sesuai dengan penambahan pentiter yang ada pada table (buku petunjuk praktikum). pH diukur dengan menggunakan pH meter yang dicelupkan pada titrat. Dicatat pH pada setiap penambahan NaOH. Titrasi hingga terjadi lonjakan pH. Dicatat volume
Ditambahkan akuades sampai tanda batas 100 mL kemudian digojog hingga homogen.
Larutan dimasukkan ke dalam labu ukur 100 mL. Dimasukkan ke dalam gelas beaker, ditambahkan akuades
secukupnya dan diaduk sampai larut. Ditimbang sebanyak 0,4 gram NaOH.
Ditambahkan akuades sampai tanda batas 25 mL kemudian digojog hingga homogen.
Dimasukkan ke dalam labu ukur 25 mL. Dipipet sebanyak 0,21 mL HCl 37% b/b.
Ditambahkan sedikit akuades ke dalam labu ukur 25 mL.
larutan NaOH pada titik akhir titrasi. Dihitung kadar larutan HCl.
5.2 Skema Kerja
5.2.1 Penyiapan Larutan
a. Pembuatan Larutan NaOH 0,1 N
b. Pembuatan Larutan HCl 0,1 N
Ditambahkan akuades sampai tanda batas 25 mL kemudian digojog hingga homogen.
Larutan dimasukkan ke dalam labu ukur 25 mL. Ditambahkan akuades secukupnya dan diaduk sampai larut.
Ditimbang sebanyak 0,1575 gram asam oksalat kemudian dimasukan ke dalam gelas beaker.
Buret diisi dengan NaOH sesuai kebutuhan.
Buret yang sudah bersih dipasang pada statif dengan baik.
Dicatat volume NaOH yang digunakan. Diulangi titrasi sebanyak 3 kali.
Dititrasi dengan NaOH sampai terbentuk warna merah muda stabil. Ditambahkan 15 tetes indikator phenolphtalein.
Dipipet sebanyak 5 mL asam oksalat dan dimasukkan ke dalam labu erlenmeyer.
5.2.2 Pengukuran
a. Penyiapan Buret
b. Standarisasi NaOH 0,1 N
Langkah atas diulangi untuk larutan dengan pH 7 dan jika pH yang diperoleh sesuai maka alat dapat digunakan untuk mengukur pH.
Tekan tombol Cal untuk mengkalibrasi kemudian tekan tombol Ready, dicatat pH pada pH meter.
Elektroda membran gelas dicelupkan pada larutan pH 4. Disiapkan larutan pH 4 dan pH 7
Disiapkan alat potensiometer.
Volume larutan NaOH pada titik akhir titrasi dicatat dan dihitung kadar larutan HCl.
Dititrasi hingga terjadi lonjakan pH.
Dicatat pH larutan pada setiap volume larutan NaOH yang ditambahkan.
Dicek pH dengan menggunakan pH meter yang dicelupkan ke dalam titrat.
Dititrasi dengan NaOH 0,1 N dengan penambahan pentiter sesuai buku petunjuk.
Dimasukkan ke dalam beaker glass 100 mL. Diambil 10 mL HCl.
d. Titrasi Asam-Basa
6.1. Data
6.1.1 Standarisasi NaOH 0,1 N
Titrasi 10 mL Asam Oksalat 0,1 N dengan larutan standar NaOH 0,1 N
Indikator: 15 tetes indikator Phenolphtalein Titrasi Volume
NaOH Pengamatan Kesimpulan I 5,2 mL Merah muda
stabil
Telah dicapai titik akhir titrasi
II 4,9 mL Merah muda stabil
Telah dicapai titik akhir titrasi
III 5,1 mL Merah muda stabil
Telah dicapai titik akhir titrasi
6.1.2 Tabel Volume Pentiter dan pH
Vol. Pentiter pH Vol. Pentiter pH
2 mL 1,26 0,1 mL 1,77 2 mL 1,30 0,1 mL 1,79 1 mL 1,34 0,1 mL 1,80 1 mL 1,39 0,1 mL 1,81 1 mL 1,45 0,1 mL 1,83 1 mL 1,52 0,2 mL 1,86 0,5 mL 1,58 0,2 mL 1,89 0,2 mL 1,62 0,5 mL 1,98 0,2 mL 1,65 1,0 mL 2,28 0,1 mL 1,67 1,0 mL 6,70 0,1 mL 1,69 1,0 mL 11,64 0,1 mL 1,70 0,1 mL 1,72 0,1 mL 1,74 0,1 mL 1,75 6.2. Perhitungan
6.2.1 Penentuan Normalitas NaOH
Diketahui : Volume Asam Oksalat = 10 mL Normalitas Asam Oksalat = 0,1 N Volume NaOH pada titrasi
Titrasi I = 5,2 mL Titrasi II = 4,9 mL Titrasi III = 5,1 mL Ditanya : Normalitas rata-rata NaOH? Jawab : Molaritas Asam Oksalat
H2C2O4 2H+ + C2O4 Valensi H2C2O4 = 2 mol ek M = ek N = mol ek 2 N 0,1 = 0,05 M Titrasi I
M[asam] x V[asam] x valensi[asam] = M[NaOH] x V[NaOH] x valensi[NaOH] 0,05 M x 10 mL x 2 mol ek = M[NaOH] x 5,2 mL x 1 mol ek M[NaOH] = 0,192 M Normalitas NaOH N = M × valensi = 0,192 M × 1 mol ek = 0,192 N
Jadi Normalitas NaOH adalah 0,192 N.
Titrasi II
M[asam] x V[asam] x valensi[asam] = M[NaOH] x V[NaOH] x valensi[NaOH] 0,05 M x 10 mL x 2 mol ek = M[NaOH] x 4,9 mL x 1 mol ek M[NaOH] = 0,204 M Normalitas NaOH N = M × valensi
= 0,204 M × 1 mol ek
= 0,204 N
Jadi Normalitas NaOH adalah 0,204 N.
Titrasi III
M[asam] x V[asam] x valensi[asam]= M[NaOH] x V[NaOH] x valensi[NaOH] 0,05 M x 10 mL x 2 mol ek = M[NaOH] x 5,1 mL x 1 mol ek M[NaOH] = 0,196 M Normalitas NaOH N = M × valensi = 0,196 M × 1 mol ek = 0,196 N
Jadi Normalitas NaOH adalah 0,196 N. Normalitas rata-rata NaOH=
NI + NII NIII 3
= 0,192 + 0,204 + 0,1963 = 0,197 N
Jadi konsentrasi rata-rata asam salisilat adalah 0,197 N.
Menentukan Standar Deviasi Normalitas NaOH Titrasi N NaOH
(x) xrata-rata (x – xrata-rata) (x – xrata-rata) 2 I 0,192 N 0,197 N 0,005 2,5 × 10-5 M2 II 0,204 N 0,197 N 0,007 4,9 × 10-5 M2 III 0,196 N 0,197 N 0,001 1 x 10-6 M2
∑ (x – x)2 = 7,5 × 10-5 M2
Standar deviasi = Σ ( x – xrata-rata )²n - 1 = 7,5 x 10
-5 2
= 6,12 x 10-3 N
Normalitas NaOH = N NaOH rata-rata ± standar deviasi Normalitas NaOH = (0,197 ± 6,12 x 10-3)N
6.2.2 Penentuan Kadar Sampel HCl
Menentukan turunan kedua dari pH - Turunan Pertama:
Dari data ke-1 dan data ke-2: V pH = 1 2 1 2 V V pH pH = 4 2 1,26 1,30 = 2 04 , 0 = 0,02
Dari data ke-2 dan data ke-3: V pH = 2 3 2 3 V V pH pH = 5 4 1,30 1,34 = 1 04 , 0 = 0,04 - Turunan Kedua: 2 2 ΔV pH Δ = 1 2 1 2 V DIV ΔV ΔpH ΔV ΔpH DI = 3 4,5 0,02 0,04 = 5 , 1 02 , 0 = 0,0133
Dengan cara yang sama diperoleh data sebagai berikut: Data Titrasi Derifatif I Derifatif II
V pH V dpH/d V V dpH2/d2V 2 1,26 3 0,02 4 1,30 3,75 0,0133 4,5 0,04 5 1,34 5 0,01 5,5 0,05 6 1,39 6 0,01 6,5 0,06 7 1,45 7 0,01 7,5 0,07 8 1,52 7,875 0,067 8,25 0,12 8,5 1,58 8,425 0,037 8,6 0,133 8,7 1,62 8,7 0,085 8,8 0,15 8,9 1,65 8,875 0,333 8,95 0,2 9 1,67 9 0 9,05 0,2 9,1 1,69 9,1 -1 9,15 0,1 9,2 1,70 9,2 1 9,25 0,2 9,3 1,72 9,3 0 9,35 0,2 9,4 1,74 9,4 -1 9,45 0,1 9,5 1,75 9,5 1 9,55 0,2 9,6 1,77 9,6 0 9,65 0,2 9,7 1,79 9,7 -1 9,75 0,1 9,8 1,80 9,8 1 9,85 0,2 9,9 1,81 9,9 0 9,95 0,2 10 1,83 10,025 -0,333
10,1 0,15 10,2 1,86 10,2 0 10,3 0,15 10,4 1,89 10,475 0,086 10,65 0,18 10,9 1,98 11,025 0,16 11,4 0,3 11,9 2,28 11,9 4,12 12,4 4,42 12,9 6,70 12,9 0,52 13,4 4,94 13,9 11,64 Kurva Titrasi 0 2 4 6 8 10 12 14 16 0 2 4 6 8 10 12 14
Kurva Hubungan pH dan Vol. Pentiter
Volume Pentiter (NaOH) pH Volume ekivalen V ek =
0,52
1mL 12 , 4 12 , 4 9 , 11 = mL 1 6 , 3 12 , 4 9 , 11 = 11,9 + 1,14 = 13,04 mLHal ini berarti bahwa volume NaOH yang diperlukan untuk menetralkan larutan sampel (HCl) tersebut adalah 13,04 mL.
Untuk menghitung kadar sampel dapat digunakan cara perhitungan sebagai berikut :
Reaksi yang terjadi :
NaOH + HCl → NaCl + H2O
Diketahui : Volume NaOH= 13,04 mL Normalitas NaOH = 0,197 N Volume Larutan HCl = 10 mL BM HCl = 36,5
mol gram
Ditanya : a. mol NaOH = ……? b. mol HCl = ……?
c. Kadar HCl atau sampel =……? Jawab :
Reaksi : NaOH + HCl → NaCl + H2O a. Normalitas NaOH = 0,197 N
1 ekivalen NaOH = 1 mol
M NaOH = Valensi N = mol ek 1 N 197 , 0 = 0,197 M
mol NaOH = M NaOH x V NaOH = 0,197 M × 13,04 mL = 2,57 mmol b. mol HCl = NaOH mol 1 1
= mmol 57 , 2 1 1 = 2,57 mmol c. Penentuan Kadar HCl (sampel)
M HCl = HCl V HCl mol = mL 10 mmol 2,57 = 0,257 M dalam 10 mL larutan Reaksi: HCl H+ + Cl
-Diketahui bahwa: 1 ekivalen HCl =1 mol Valensi HCl = 1 ekivalen/mol Maka, N HCl = M HCl x val HCl = 0,257 M × 1 mol ek = 0,257 N
Jadi, Normalitas HCl adalah 0,257 N dalam 10 mL larutan sampel massa HCl (mg) = mol HCl x BM HCl = 2,57 mmol × 36,5 mol gr = 93,8 mg Kadar HCl = HCl Volume HCl massa = mL 10 mg 93,8
= mL 100 g 0,938 = 0,938 % b/v
Jadi, kadar HCl (sampel) adalah sebesar 0,257 N atau 0,938 % b/v dalam 10 mL larutan.
VII. PEMBAHASAN
Dalam penetapan kadar HCl dengan potensiometri, pertama-tama dilakukan penyiapan alat dan bahan. Dilakukan pembuatan 100 mL larutan NaOH 0,1 N dengan cara melarutkan 0,4096 gram NaOH dalam sedikit akuades lalu dipindahkan ke labu ukur 100 mL dan ditambahkan akuades hingga 100 mL. Kemudian dilanjutkan dengan pembuatan larutan asam oksalat 0,1 N dengan melarutkan sebanyak 0,1579 gram asam oksalat dalam sedikit akuades lalu dipindahkan ke labu ukur 25 mL dan ditambahkan akuades hingga 25 mL. Larutan HCl 0,1 N dibuat dengan melarutkan 0,21 ml HCl 37% b/b dengan sedikit air dalam labu ukur lalu ditambah akuades hingga 25 mL. Setelah larutan selesai dibuat, disiapkan alat-alat yaitu potensiometer dan buret 25 mL yang dipasang pada statif untuk menitrasi. Membran gelas potensiometer dicuci terlebih dahulu dengan sedikit akuades menggunakan pipet tetes dan kemudian dilap dengan tisu untuk menghilangkan pengotor yang menempel. Alat dikalibrasi dengan larutan pH 4 kemudian dikalibrasi kembali dengan larutan pH 7. Pada setiap kali penggantian larutan, dilakukan pencucian kembali pada membran gelas potensiometer.
Selanjutnya dilakukan standarisasi NaOH dengan menggunakan larutan baku asam oksalat. Standarisasi merupakan proses pembakuan larutan dengan menggunakan suatu baku primer dengan tujuan untuk memperoleh konsentrasi dari larutan NaOH sehingga dapat digunakan dalam penetapan kadar HCl. Standarisasi larutan baku NaOH menggunakan metode asidimetri yang merupakan bagian dari metode titrimetri dimana
senyawa yang bersifat basa ditetapkan kadarnya dengan menggunakan baku asam (Gandjar dan Rohman, 2007). Pembakuan larutan NaOH dilakukan dengan menggunakan 5 mL asam oksalat 0,1 N dititrasi dengan NaOH hingga mencapai titik akhir titrasi yang ditunjukkan oleh perubahan warna mernjadi merah muda. Reaksi yang terjadi antara asam oksalat dan NaOH yaitu :
C2H2O4 . 2 H2O + 2 NaOH Na2C2O5 + 2 H2O
Indikator yang digunakan pada standarisasi adalah fenolftalein (PP). Penambahan indikator PP dilakukan agar titik akhir titrasi dapat diketahui. Suatu indikator merupakan asam atau basa lemah yang berubah warna diantara bentuk terionisasinya dan bentuk tidak terionisasinya. Kisaran penggunaan indikator adalah 1 unit pH disekitar nilai pKa nya. Indikator PP mempunyai pKa 9,4 (perubahan warna antara 8,4-10,4). Struktur PP akan mengalami penataan ulang pada kisaran pH ini karena proton dipindahkan dari struktur fenol PP sehingga pH-nya meningkat akibatnya akan terjadi perubahan warna (Gandjar dan Rohman, 2007). Pada titik akhir titrasi akan terjadi perubahan warna larutan dari bening menjadi merah muda. Untuk memperoleh hasil yang akurat, standarisasi NaOH dilakukan sebanyak 3 kali, dimana volume NaOH masing-masing 5,2 mL; 4,9 mL dan 5,1 mL. Rata-rata normalitas NaOH yang diperoleh adalah sebesar 0,197 N dengan standar deviasi sebesar 6,12 x 10-3.
Selanjutnya dilakukan penetapan kadar sampel dengan menggunakan potensiometer. Penetapan kadar HCl dilakukan melalui pengukuran pH sampel setelah penambahan NaOH yang telah distandarisasi (sebagai pentiter). Titrasi dimulai dengan penambahan volume pentiter sesuai tabel pada buku petunjuk. Penambahan larutan NaOH menyebabkan naiknya pH larutan.
Agar diperoleh larutan yang homogen pada setiap penambahan pentiter maka dilakukan pengadukan dengan batang pengaduk secara
hati-hati. Setelah itu dilakukan pengukuran pH dengan potensiometer dengan menekan tombol (Read√) dan angka yang ditunjukkan oleh potensiometer dicatat. Titik akhir titrasi dari larutan HCl sampel ditentukan dengan cara melihat lonjakan perubahan pH yang terjadi secara drastis dengan perubahan volume pentiter (larutan NaOH) yang kecil (Widjaja, dkk., 2014). Adapun reaksi yang terjadi :
NaOH + HCl → NaCl + H2O
Di dalam potensiometer terdapat elektroda gelas yang sangat sensitif terhadap perubahan jumlah H+. Ketika elektroda gelas pada pH meter dicelupkan ke dalam larutan, terjadi kesetimbangan antara ion-ion hidrogen yang terdapat di bagian tipis bola gelas dan ion hidrogen yang terletak dalam larutan yang diuji. Elektroda gelas akan membiarkan ion H+ untuk menembusnya, tetapi menahan ion yang lain. Semakin besar konsentrasi ion H+ dalam larutan HCl, semakin banyak ion H+ yang masuk ke dalam lapisan gelas yang menyebabkan pada saat awal titrasi, nilai pH kecil. Semakin banyak pentiter yang ditambahkan, semakin sedikit ion hidrogen yang terdapat dalam larutan HCl, karena ion H+ akan bereaksi dengan ion OH- dan membentuk H2O. Hal ini akan menyebabkan ion H+ yang berada pada lapisan gelas semakin sedikit sehingga muatan elektroda gelas berkurang, maka nilai pH pun semakin meningkat. Hal ini dapat dilihat pada kurva hubungan antara pH dan volume pentiter.
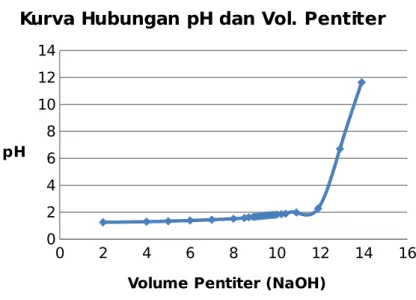
Berdasarkan data pengamatan dibuat kurva antara volume pentiter dengan pH. Berikut kurva hubungan antara pH dan volume pentiter :
0 2 4 6 8 10 12 14 16 0 2 4 6 8 10 12 14
Kurva Hubungan pH dan Vol. Pentiter
Volume Pentiter (NaOH) pH
Gambar 7.1 Kurva hubungan volume pentiter dengan pH
Pada kurva tersebut dapat dilihat adanya lonjakan harga pH secara tiba-tiba, yaitu dari pH 2,28 menjadi 6,70. Setelah ditambah dengan 1 mL NaOH terjadi lonjakan lebih besar yaitu dari pH 6,70 menjadi 11,64. Lonjakan pH tersebut disebabkan karena terjadinya titik ekivalen dimana ion H+ telah habis bereaksi dengan ion OH-, sehingga tidak terdapat lagi ion hidrogen dan jumlah ion OH- menjadi meningkat. Tidak adanya ion hidrogen di dalam elektroda gelas secara tiba-tiba akan membuat arus yang dihasilkan oleh elektroda gelas meningkat secara tiba-tiba dan kemudian turun secara tiba-tiba pula. Hal ini memberi sinyal pada potensiometer yang menimbulkan peningkatan harga pH secara tiba-tiba dari larutan HCl yang dititrasi oleh pentiter (NaOH 0,1 N). Lonjakan harga pH terjadi saat titik akhir titrasi tercapai yaitu pada volume larutan pentiter (NaOH 0,1 N) sebanyak 11,9 mL. Pada titik ekivalen, volume NaOH yang diperlukan untuk menetralkan larutan HCl adalah 11,9 mL. Dari hasil tersebut dapat ditentukan konsentrasi HCl dan kadarnya dalam larutan sampel. Berdasarkan perhitungan diperoleh konsentrasi HCl sebesar 0,257 N atau 0,938 % b/v dalam 10 mL larutan HCl.
VIII.KESIMPULAN
8.1 Dari kurva hubungan antara volume pentiter dan pH terlihat adanya lonjakan harga pH secara tiba-tiba, yaitu dari pH 2,28 menjadi 6,70. Setelah ditambah dengan 1 mL NaOH terjadi lonjakan lebih besar yaitu dari pH 6,70 menjadi 11,64. Lonjakan pH tersebut disebabkan karena terjadinya titik ekivalen dimana ion H+ telah habis bereaksi dengan ion OH-, sehingga tidak terdapat lagi ion hidrogen dan jumlah ion OH- menjadi meningkat.
8.2 Titik akhir titrasi yang diperoleh adalah 11,9 mL, dihitung berdasarkan volume NaOH yang menyebabkan terjadinya lonjakan pH yang drastis.
8.3 Konsentrasi HCl sebesar 0,257 N atau 0,938 % b/v dalam 10 mL larutan HCl.
DAFTAR PUSTAKA
Day R. A dan A. L. Underwood. 1998. Analisis Kimia Kuantitatif. Jakarta: Penerbit Erlangga.
Depkes RI. 1979. Farmakope Indonesia, Edisi III. Jakarta: Departemen Kesehatan Republik Indonesia.
Depkes RI. 1995. Farmakope Indonesia, Edisi IV. Jakarta: Departemen Kesehatan Republik Indonesia.
Gandjar, I. G., dan A. Rohman. 2007. Kimia Farmasi Analisis. Yogyakarta: Pustaka Pelajar.
Khopkar, S. M. 2003. Konsep Dasar Kimia Analitik. Jakarta: Penerbit UI Press. Oxtoby, D. W. 2001. Prinsip-Prinsip Kimia Modern Edisi Keempat. Jakarta:
Penerbit Erlangga.
Rivai, Harrizul. 1995. Asas Pemeriksaan Kimia. Jakarta: Penerbit UI Press.
Roth, H. J. Dan G. Blaschke. 1994. Analisis Farmasi. Yogyakarta: Universitas Gajah Mada.
Skoog, Douglas A., F. James Holler, dan Stanley R. Crouch. 2007. Principles of Instrumetal Analysis, Sixth Edition. California: Thomson Brooks/Cole. Watson, David G. 2007. Analisis Farmasi : BA Untuk Mahasiswa Farmasi dan
Praktisi Kimia Farmasi, Edisi 2. Jakarta: Penerbit Buku Kedokteran EGC. Widjaja, I. N. K., dkk. 2014. Petunjuk Praktikum Kimia Analisis. Jimbaran:
.
Gambar 1. Standarisasi Larutan NaOH 0,1 N dengan Asam Oksalat 0,1 N