BAB I PENDAHULUAN
1.1. Tujuan
1. Memahami cara melakukan uji sterilitas pada sediaan steril. 2. Mampu melakukan proses uji sterilisasi pada sediaan steril. 3. Menjaminkesterilan sediaan.
1.2. Dasar Teori
Sterilisasi adalah suatu proses untuk membunuh semua jasad renik yang ada, sehingga jika ditumbuhkan di dalam suatu medium tidak ada lagi jasad renik yang dapat berkembang biak. Sterilisasi harus dapat membunuh jasad renik yang paling tahan panas yaitu spora bakteri. Steril menunjukkan kondisi yang memungkinkan terciptanya kebebasan penuh dari mikroorganisme dengan keterbatasan tertentu sedangkan aseptis menunjukkan proses atau kondisi terkendali di mana tingkat kontaminasi mikroba dikurangi sampai suatu tingkat tertentu di mana mikroorganisme dapat ditiadakan pada suatu produk. Aseptis menunjukkan keadaan steril yang “tampak” (Lachman dkk., 2008).
Uji sterilitas dilakukan terhadap produk dan bahan yang sebelumnya telah mengalami proses pensterilan yang telah diberlakukan. Hasilnya membuktikan bahwa prosedur sterilisasi dapat diulang secara efektif. Tetapi umumnya disetujui bahwa kontrol yang dilaksanakan selama proses validasi memberikan jaminan lebih efektifnya proses sterilisasi. Uji ini dilakukan terhadap sampel yang dipilih untuk mewakili keseluruhan lot bahan tersebut. Sampel bisa diambil dari kemasan atau wadah akhir suatu produk, atau sebagai bagian dari tangki bulk cairan atau dari bahan bulk lainnya (Lachman dkk., 2008).
Tidak seperti syarat banyak sediaan yang lain, syarat sterilitas adalah nilai yang mutlak. Secara historis, pertimbangan sterilitas bersandar pada uji sterilitas lengkap yang resmi, namun sediaan akhir pengujian sterilitas mengalami banyak batasan.Batasan yang paling nyata adalah sifat dasar dari uji sterilitas.Ini adalah uji yang dekstruktif; sehingga, hal ini tergantung pemilihan statistik sampel acak dari keseluruhan lot. Ketidakpastian akan selalu ada selama sampel secara tegas mewakili keseluruhan. Jika diketahui bahwa satu unit dari 1000 unit terkontaminasi (yakni, angka kontaminasi = 0,1%) dan 20 unit disampel secara acak dari 1000
unit, kemungkinan unit yang terkontaminasi dari 20 sampel itu adalah 0,02. Dengan kata lain, hanya 2% peluang dari yang unit yang terkontaminasi akan dipilih sebagai bagian 20 wakil sampel dari keseluruhan 1000 unit. Bahkan jika unit yang terkontaminasi satu dari 20 sampel dipilih untuk uji sterilitas, kemungkinan uji sterilitas akan gagal masih ada untuk mendeteksi kontaminasi. Konsentrasi kontaminan mikroba mungkin saja terlalu rendah untuk terdeteksi selama periode inkubasi atau dapat saja tidak cukup berkembang cukup cepat atau tidak sama sekali karena ketidakcukupan media dan inkubasi (Zinda, 2008).
Syarat suatu sediaan dikatakan steril, apabila Sterility Assurance Level dengan probabilitas sama atau lebih baik dari 10 -6, artinya dalam satu juta sediaan steril hanya boleh maksimum 1 yang tidak steril. Uji sterilitas dilakukan dengan berdasarkan ada tidaknya pertumbuhan mikroba pada media Fluid Thioglycollate(FTM) dan Soybean Casein Digest(SCD)pada 30-35°C (bakteri) dan 20-25°C (fungi) selama 7 dan 14 hari (Zinda, 2008).
Media berfungsi untuk menumbuhkan mikroba, isolasi, memperbanyak jumlah, menguji sifat-sifat fisiologi dan perhitungan jumlah mikroba, dimana dalam proses pembuatannya harus disterilisasi dan menerapkan metode aseptis untuk menghindari kontaminasi pada media.Dalam Farmakope Edisi IV, disebutkan terdapat 3 media yang dapat digunakan dalam uji sterilitas sediaan, yaitu media tioglikolat cair, media tioglikolat alternatif (untuk alat yang mempunyai lumen kecil), dan Soybean Casein Digest Medium. Sebelum media digunakan untuk uji sterilitas, pada media dilakukan terlebih dahulu uji fertilitas untuk mengetahui kemampuan media untuk menumbuhkan bakteri. Uji fertilitas dilakukan dengan cara menginokulasi duplo wadah tiap media secara terpisah dengan 10 mikroba hingga 100 mikroba viable dari tiap galur yang tertera dalam tabel, dan diinkubasi pada kondisi yang sesuai.Media uji memenuhi syarat jika terjadi pertumbuhan yang nyata dalam semua wadah media yang diinokulasi dalam kurun waktu 7 hari. Uji sterilitas dinyatakan tidak absah, jika media uji menunjukkan respon pertumbuhan yang tidak memadai.
Selain 3 media yang telah disebutkan diatas, pada uji sterilitas dapat juga digunakan media nutrient agar (NA). Nutrien agar adalah medium umum untuk uji air dan produk dairy.NA juga digunakan untuk pertumbuhan mayoritas dari mikroorganisme yang tidak selektif, dalam artian mikroorganisme heterotrof.Media ini merupakan media sederhana yang dibuat dari ekstrak beef, pepton, dan agar. Na merupakan salah satu media yang umum digunakan dalam prosedur bakteriologi seperti uji biasa dari air, sewage, produk pangan, untuk membawa stok kultur, untuk
pertumbuhan sampel pada uji bakteri, dan untuk mengisolasi organisme dalam kultur murni. Untuk komposisi nutrien adar adalah eksrak beef 10 g, pepton 10 g, NaCl 5 g, air desitilat 1.000 ml dan 15 g agar/L. Agar dilarutkan dengan komposisi lain dan disterilisasi dengan autoklaf pada 121°C selama 15 menit. Kemudian siapkan wadah sesuai yang dibutuhkan (Zinda, 2008).
Media segar tidak digunakan dalam waktu 2 hari, simpan dalam tempat yang gelap, lebih baik pada suhu 2o hingga 25o. Jika media siap pakai disimpan dalam wadah yang tidak tertutup kedap, dapat digunakan selama tidak lebih dari 1 bulan, dengan ketentuan media uji dalam kurun waktu 7 hari sebelum penggunaan dan indikator warna memenuhi syarat. Jika disimpan dalam wadah tertutup kedap, media dapat digunakan selama tidak lebih dari 1 tahun, dengan ketentuan fertilitas media uji setiap 3 bulan dan indicator warna memenuhi syarat (Depkes RI, 1995).
Uji sterilitas dilakukan untuk menetapkan apakah bahan atau produk farmasi yang harus steril memenuhi syarat berkenaan dengan uji sterilitas seperti yang tertera pada masing-masing monografi bahan atau produk.
BAB II
PROSEDUR KERJA
2.1 Alat dan Bahan Alat Cawan petri Lampu Bunsen Ose Corong gelas Gelas beaker Kertas saring Batang pengaduk Inkubator Autoklaf Pipet tetes Bahan Air / Aquades Alkohol 70%
Tissue / Lap / Aluminium Foil Heavy Duty Medium instant Nutrient Agar
Sediaan yang akan diuji
No. Jenis Sediaan Nama Sediaan Volume Sediaan
Volume Sampel 1. Infus Dextrose 5% PENA D-5 100 mL 10 mL 2. Infus Normal Salin SALNA 100 mL 10 mL 3. Tetes mata Kloramfenikol TEMARAM 10 mL 5 mL 4. Salep mata Kloramfenikol SACHLO 10 g 100 mg 5. Injeksi Aminophilin N-SHEOF 10 mL 5 mL
2.2 Komposisi Media dan Cara Pembuatan (Untuk Jamur dan Bakteri) A. Media Tioglikolat Cair
L-Sistin P 0,5 g
Natrium klorida P 2,5 g
Glukosa P (C6H12O6.H2O) 5,5 g
Agar P, granul (kadar air tidaklebih dari 15 %) 0,75 g Ekstrak ragi P (larut dalam air) 5,0 g
Digesti pancreas kasein P 15,0 g
Natrium tioglikolat P atau 0,5 g
Asam tioglikolat P 0,3 mL
Larutan natrium resazurin P (1 dalam 1000) dibuat segar 1,0 mL
Air 1000 mL
pH setelah sterilisasi 7,1 ± 0,2
(Depkes RI, 1995) Cara Pembuatan:
Campur dan panaskan hingga larut. Atur pH larutan hingga setelah sterilisasi 7,1 ± 0,2, menggunakan natrium hidroksida 1 N. Jika perlu saring selagi panas menggunakan kertas saring. Tempatkan media dalam tabung yang sesuai, yang memberikan perbandingan permukaan dengan kedalaman media sedemikian rupa sehingga tidak lebih dari setengah bagian atas media yang mengalami perubahan warna sebagai indikasi masuknya oksigen pada akhir masa inkubasi.Sterilisasi dalam autoklaf.Jika lebih dari sepertiga bagian atas terjadi warna merah muda, media dapat diperbaiki satu kali dengan pemanasan di atas tangas air atau dalam uap yang mengalir bebas hingga warna merah muda hilang.Media siap digunakan jika tidak lebih dari sepersepuluh bagian atas media berwarna merah muda.Gunakanlah media Tioglikolat Cair untuk inkubasi dalam kondisi aerob (Depkes RI, 1995).
B. Soybean-Casein Digest Medium
Digesti pankreas kasein P 17,0 g Digesti papaik tepung kedele 3,0 g
Natrium klorida P 5,0 g
Kalium fosfat dibasa P 2,5 g Glukosa P (C6H12O6.H2O) 2,5 g Air 1000 mL pH setelah sterilisasi 7,3 ± 0,2 (Depkes RI, 1995) Cara Pembuatan:
Larutkan semua bahan padat dalam air, hangatkan hingga larut. Dinginkan larutan hingga suhu kamar, dan jika perlu atur pH larutan hingga setelah sterilisasi 7,3 ± 0,2 menggunakan natrium hidroksida 1 N. Saring jika perlu, dan bagikan dalam tabung yang sesuai. Sterilisasi dengan uap air.
Gunakan Soybean-Casein Digest Medium untuk inkubasi dalam kondisi aerob (Depkes RI, 1995).
2.3 Cara Kerja
a. Cara Pembuatan Medium Agar (Untuk pembuatan 1 L Nutrient Agar) 1. Ditimbang sebanyak 23,5 gram medium instan
2. Disuspensikan dalam aquades dan volume akhir dibuat 1000ml 3. Dipanaskan suspensi tersebut sampai agar-agar menjadi matang
4. Agar cair dimasukkan ke dalam medium tegak dan dibiarkan membeku.
b. Cara Uji Mikroba pada Sediaan (menggunakan LAF) 1. LAFC disiapkan terlebih dahulu,
2. Semua peralatan yang dibutuhkan dan sediaan yang akan diuji dimasukkan dalam LAFC dan bunsen dinyalakan,
3. Sebelumnya, medium NA (nutrient agar) yang telah dibuat dalam cawan petri dibagi menjadi 5 area yang sama besar dan diberi nomer 1-5,
4. Diambil sampel dari sediaan sedikit saja,
5. Jarum ose dibakar pada nyala api bunsen hingga membara, kemudian dicelupkan pada sampel sediaan,
7. Sediaan pertama yang diuji adalah sediaan salep mata,kemudian Infus normal saline, indextra, injeksi Aminophilin, dan yang terakhir adalah tetes mata.
8. Untuk sediaan yang mengandung pengawet, terlebih dahulu dilakukan pengenceran, sedangkan untuk sediaan salep mata, terlebih dahulu dilarutkan dengan air steril kemudian baru districk menggunakan ose sesuai prosedur di atas.
9. Selanjutnya diinkubasi pada suhu 37°C selama 3 hari.
10. Diamati dan dihitung ada atau tidaknya pertumbuhan mikroba pada sekitar daerah strick yang telah dilakukan.
2.4 Penafsiran Hasil a. Tahap Pertama
Pada interval waktu tertentu dan pada akhir periode inkubasi, amati isi semua wadah akan adanya pertumbuhan mikroba seperti kekeruhan dan atau pertumbuhan pada permukaan. Jika tidak terjadi pertumbuhan, maka bahan uji memenuhi syarat.
Jika ditemukan pertumbuhan mikroba, tetapi peninjauan dalam pemantauan fasilitas pengujian sterilitas, bahan yang digunakan, prosedur pengujian dan kontrol negatif menunjukkan tidak memadai atau teknik aseptik yang salah digunakan dalam pengujian, tahap pertama dinyatakan tidak absah dan dapat diulang.
Jika pertumbuhan mikroba teramati tetapi tidak terbukti uji tahap pertama tidak absah, lakukan tahap kedua.
b. Tahap Kedua
Jumlah spesimen uji yang diseleksi minimum dua kali jumlah Tahap pertama. Volume minimum tiap specimen yang diuji dan media dan periode inkubasi sama seperti yang tertera pada Tahap pertama. Jika tidak ditemukan pertumbuhan mikroba, bahan yang diuji memenuhi syarat.Jika ditemukan pertumbuhan, hasil yang diperoleh membuktikan bahwa bahan uji tidak memenuhi syarat. Jika dapat dibuktikan bahwa uji pada Tahap kedua tidak abash karena kesalahan atau teknik aseptik tidak memadai, maka Tahap kedua dapat diulang.
BAB III
HASIL DAN PEMBAHASAN
3.1 Data Pengamatan
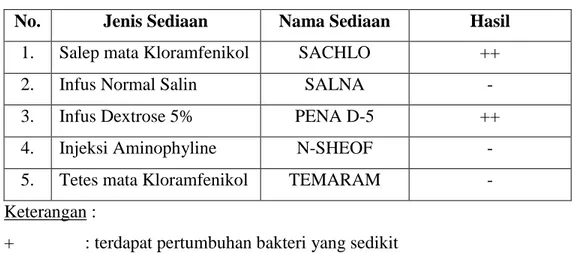
Tabel 3. Hasil Data Pengamatan
No. Jenis Sediaan Nama Sediaan Hasil
1. Salep mata Kloramfenikol SACHLO ++
2. Infus Normal Salin SALNA -
3. Infus Dextrose 5% PENA D-5 ++ 4. Injeksi Aminophyline N-SHEOF - 5. Tetes mata Kloramfenikol TEMARAM - Keterangan :
+ : terdapat pertumbuhan bakteri yang sedikit ++ : terdapat pertumbuhan bakteri yang sedang +++ : terdapat pertumbuhan bakteri yang banyak - : tidak terdapat pertumbuhan bakteri
Gambar 1. Hasil Uji Sterilitas setelah Inkubasi 5 hari
3.2 Pembahasan
Pada praktikum ini dilakukan uji sterilitas terhadap sediaan-sediaan steril yang telah dibuat pada praktikum-praktikum sebelumnya, sediaan tersebut antara lain : salep mata kloramfenikol, infuse normal salin, infuse dextrose, injeksi aminophyline, dan tetes mata kloramfenikol. Setiap jenis sediaan yang dibuat sebanyak 2 buah dimana 1 sediaan telah digunakan untuk uji fisik sesaat setelah sediaan selesai dibuat untuk memastikan sediaan telah memenuhi persyaratan yang ditentukan. Satu sediaan lagi tetap disimpan dalam keadaan tertutup rapat dan digunakan dalam pengujian sterilitas.
Metode serta media yang digunakan dalam pengujian telah dicantumkan dalam Farmakope Indonesia IV. Menurut FI IV, pengujian sterilitas dapat dilakukan dengan dua metode yaitu
inokulasi langsung dan filtrasi membran. Pada pengujian ini metode yang dipilih adalah metode inokulasi langsung, mengingat tidak tersedianya membran yang dipersyaratkan untuk uji sterilitas. Dalam pengujian sterilitas sediaan yang dipersyaratkan dalam FI IV, digunakan dua media untuk menguji bakteri dan jamur yang terdapat dalam sediaan. Untuk menguji keberadaan jamur di dalam sediaan digunakan media soybean-casein digest, sedangkan untuk bakteri aerob digunakan media tioglikolat cair. Namun di dalam praktikum kedua membran ini tidak digunakan. Media yang digunakan dalam pengujian adalah Natrium Agar (NA) yang merupakan media universal untuk menumbuhkan mikroba. Media Natrium Agar ini dibuat dengan melarutkan sejumlah nutrient agar dalam bentuk serbuk dengan aquadest, kemudian dilakukan sterilisasi dengan autoklaf sebelum dituangkan dalam cawan petri. Media digunakan setelah memadat.
Selanjutnya cawan petri tempat menyimpan media tersebut dibagi menjadi lima bagian yang kurang lebih memiliki luas yang sama untuk masing-masing bagian. Pada bagian ini diberi nomor I, II, III, IV dan V, dimana pada daerah pertama (I) akan diinokulasikan sampel dari salep mata Kloramfenikol, pada daerah kedua (II) sampel dari infus Normal Salin, pada daerah ketiga (III) sampel dari infus Dextrose 5%, pada daerah keempat (IV) sampel dari injeksi Aminophyline, dan pada daerah kelima (V) sampel dari tetes mata Kloramfenikol. Proses inokulasi ini dilakukan di dalam ruang kelas A atau Laminar Air Flow Cabinet (LAFC) dengan teknik aseptik. Sebelum LAFC digunakan, bagian dinding dan lantai didisenfeksi menggunakan alkohol 70 % dan lap bersih. Kemudian lampu UV dinyalakan selama 15 menit . Lampu bunsen dimasukkan ke dalam LAFC dan dinyalakan selama beberapa menit sebelum memasukkan alat-alat yang digunakan meliputi beaker glass, pipet tetes, ose, corong gelas yang telah dilapisi kertas saring dan masing-masing sediaan yang akan diuji. Beaker glass, pipet tetes dan ose yang dimasukkan adalah alat-alat yang telah disterilisasi. Dalam LAFC udara bersih dari blower akan dihembuskan dari dalam menuju personil, hal ini untuk mencegah masuknya kontaminan dari luar menuju LAFC.
Sediaan pertama yang diuji adalah sediaan salep mata (Sachlo®) agar bisa diinokulasi terlebih dahulu salep mata di larutkan dalam air steril. Tidak dilakukan penimbangan terhadap salep yang mengalami pengenceran, hanya dilakukan perkiraan terhadap massa salep yang keluar pertama kali dari tube. Air steril ditambahkan secukupnya hingga mampu melarutkan salep. Beaker digoyangkan untuk membantu pelarutan, hingga sejumlah massa salep larut di dalam air
steril. Ose yang telah dipanaskan dicelupkan ke dalam air steril yang melarutkan salep dan dinokulasikan dengan cara ose yang telah dicelupkan di gesekkan pada media yang telah dibagi. Salep mata digesekkan pada media yang ditandai I. Saat membuka tutup salep mata, dilakukan dekat api bunsen untuk mecegah masuknya kontaminan ke dalam sediaan. Begitu pula ketika membuka dan menutup petri yang telah berisi media.
Selanjutnya sediaan NaCl dan dektrosa. NaCl (Salna®) dan dektrosa (Pena D-5®) adalah sediaan-sediaan dengan volume besar, sebenarnya sediaan tersebut tidak seharusnya diuji menggunakan metode inokulasi langsung, mengingat sampel yang harus digunakan adalah semua volume sediaan (100 mL) yang tidak mungkin mampu diinokulasikan semuanya di dalam media (DepKes RI, 1995). Namun dalam pengujian ini dilakukan sedikit modifikasi untuk memungkinkan dilakukan pengujian dengan metode inokulasi langsung. Ose yang akan digunakan dibakar terlebih dahulu di atas api bunsen hingga membara. Setelah bara mati, ose dicelupkan ke dalam dektrosa. Ose yang telah dicelupkan di gesekkan pada media yang telah dibagi. NaCl digesekkan pada media yang ditandai II. Saat membuka tutup NaCl, dilakukan dekat api bunsen untuk mecegah masuknya kontaminan ke dalam sediaan. Begitu pula ketika membuka dan menutup petri yang telah berisi media. Dilakukan langkah yang sama untuk menginokulasi dektrosa, hanya saja dektrosa diinokulasi pada media III.
Untuk sediaan injeksi aminophyline (N-Sheof®), sediaan dinokulasikan dengan cara yang sama dengan sediaan yang lain pada media IV. Ose yang akan digunakan dibakar terlebih dahulu di atas api bunsen hingga membara. Setelah bara mati, ose dicelupkan ke dalam sediaan injeksi aminophyline. Ose yang telah dicelupkan di gesekkan pada media yang telah dibagi. Aminophyline digesekkan pada media yang ditandai IV. Saat membuka tutup Aminophyline, dilakukan dekat api bunsen untuk mecegah masuknya kontaminan ke dalam sediaan.
Sediaan terakhir yang diinokulasi adalah sediaan tetes mata (Temaram®), sebelum dinokulasi dilakukan pengenceran terlebih dahulu. Sediaan-sediaan yang mengandung bahan pengawet sebaiknya diencerkan terlebih dahulu atau dilakukan penyaringan sebelum dilakukan uji sterilitas sediaan (DepKes RI, 1995). Pengenceran dilakukan karena sediaan ini mengandung pengawet metil paraben sebanyak 0,02 %. Metil paraben digunakan sebagai pengawet sediaan mata pada konsentrasi 0,015-0,2 % (Rowe et al, 2006). Inokulasi dilakukan dengan mencelupkan ose yang telah dibakar di atas api bunsen dan digesekkan pada media bagian V. Penggesekan ose dilakukan dari tengah media secara zigzag hingga ke pinggir media secara perlahan-lahan, agar
tidak merobek media. Sama seperti langkah sebelumnya pekerjaan ini dilakukan sedekat mungkin dengan api bunsen. Setelah keseluruhan sediaan di inokulasi pada media, proses selanjutnya adalah inkubasi di dalam oven dengan suhu 370C.
Pengamatan dilakukan setelah inkubasi selama 5 hari. Pada pengamatan hari ke-5 ditemukan koloni mikroba pada media I (Salep mata) dan III (infuse dextrose). Pada media I dan III koloni yang ditemukan berjumlah sedang. Koloni pada media I berada pada perbatasan garis media I (tetes mata) dan II (infus normal saline). Tidak dilakukan perhitungan terhadap jumlah koloni bakteri yang terdapat di dalam masing-masing media. Perlu dilakukan pengujian lebih lanjut mengenai jumlah mikroba yang terdapat di dalamnya apakah sudah memenuhi persyaratan. Banyaknya koloni yang ditemukan pada media I (Salep Mata Kloramfenikol) disebabkan karena dalam formulasi sediaan ini tidak digunakan pengawet. Selain itu dapat juga disebabkan karena sterilisasi yang dilakukan hanya sterilisasi terhadap alat-alat yang digunakan dan tidak dilakukan sterilisasi akhir, dimana hal ini dapat menyebabkan bakteri tidak mati secara keseluruhan.
Sedangkan untuk sediaan infus dektrosa banyaknya koloni mikroba yang terdapat di dalamnya dikarenakan dekstrosa merupakan nutrisi yang sangat baik bagi pertumbuhan mikroba, sedangkan pada proses pembuatannya hanya dilakukan dengan teknik aseptik mengingat sifat bahan aktif sediaan yang tidak tahan terhadap pemanasan karena dapat terurai menjadi senyawa furfuran yang bersifat hepatotoksik. Sterilisasi filtrasi yang digunakan sepertinya tidak mampu membatasi mikroba yang terdapat dalam sediaan, karena kertas saring yang digunakan tidak memiliki pori yang cukup kecil untuk menyaring mikroba sehingga pada pengujian masih ditemukan banyak mikroba di dalamnya.
BAB IV
KESIMPULAN DAN SARAN
4.1 Kesimpulan
Berdasarkan hasil praktikum, maka dapat ditarik kesimpulan sebagai berikut :
1. Pengujian sterilitas sediaan steril dapat dilakukan dengan metode inokulasi langsung menggunakan media nutrient agar.
2. Dari hasil pengujian didapatkan bahwa sediaan yang memenuhi persyaratan steril adalah sediaan infus NaCl, injeksi Aminophyline, dan tetes mata Kloramfenikol. Sementara sediaan lainnya ditemukan adanya pertumbuhan mikroba.
DAFTAR PUSTAKA
Departemen Kesehatan Republik Indonesia.1995. Farmakope Indonesia Edisi IV. Jakarta :Dirjen POM.
Lachman, L., H. A. Lieberman, dan J. L. Kanig. 2008. Teori dan Praktek Farmasi Industri, Edisi Ketiga. Jakarta: UI Press.
Rowe, Raymond C., Paul J. S., Paul J. W. 2006. Handbook of Pharmaceutical Exipients sixth edition.Pharmaceutical Press. London.
Zinda, R. 2008. Validasi Sterilisasi Sediaan Steril : Dasar-Dasar (cited 2010 Dec, 05) Available from :
LAPORAN AKHIR PRAKTIKUM FORMULASI SEDIAAN STERIL
UJI STERILITAS SEDIAAN STERIL
Oleh: Kelompok III
Gusti Ayu Mira Semarawati (0808505016) Ni Putu Parwatininghati (0808505017) Enny Laksmi Artiwi (0808505018) A.A Agustia Sinta Dewi (0808505019) Ni Luh Putu Ariasih (0808505020) Ni Luh Gede Lisniawati (0808505021) Made Surya Wedana J.S (0808505022)
Ni Putu Martiari (0808505023)
JURUSAN FARMASI
FAKULTAS MATEMETIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS UDAYANA