OLEH:
FATIMAH ARNIS NIM 092410027
PROGRAM STUDI DIPLOMA III ANALIS FARMASI DAN MAKANAN FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
KATA PENGANTAR
Puji syukur penulis ucapkan kepada Allah SWT atas segala limpahan rahmat dan karunia-Nya yang telah memberikan pengetahuan, kekuatan, kesehatan dan kesempatan kepada penulis sehingga penulis dapat menyelesaikan tugas akhir ini, serta sholawat beriring salam untuk Rasulullah Nabi Muhammad SAW sebagai contoh tauladan dalam kehidupan.
Tugas akhir ini berjudul ”UJI DISOLUSI TABLET GLISERIL GUAIAKOLAT YANG DIPRODUKSI OLEH PT. KIMIA FARMA (PERSERO) TBK. PLANT MEDAN”. Tugas akhir ini disusun untuk memenuhi salah satu syarat untuk menyelesaikan pendidikan pada Program Studi Diploma III Analis Farmasi dan Makanan di Fakultas Farmasi Universitas Sumatera Utara.
Penulis menyadari sepenuhnya bahwa tanpa bantuan dari berbagai pihak, penulis tidak akan dapat menyelesaikan tugas akhir ini sebagaimana mestinya. Untuk itu penulis mengucapkan terima kasih yang sebesar-besarnya kepada berbagai pihak antara lain:
1. Bapak Dr. M. Pandapotan Nasution, M.P.S., Apt., sebagai Dosen Pembimbing Tugas Akhir yang telah memberikan bimbingan dan pengarahan kepada penulis dalam penyusunan tugas akhir ini.
3. Bapak Prof. Dr. Jansen Silalahi, M.App.Sc., Apt., sebagai Ketua Program Studi Diploma III Analis Farmasi dan Makanan Fakultas Farmasi Universitas Sumatera Utara.
4. Ibu Dra. Nurmadjuzita, M.Si., Apt., sebagai Dosen Penasehat Akademis yang telah memberikan nasehat dan pengarahan kepada penulis dalam hal akademis setiap semester.
5. Bapak dan Ibu dosen staf pengajar Fakultas Farmasi Universitas Sumatera Utara atas semua ilmu, didikan dan bimbingan kepada penulis selama di perguruan tinggi ini.
6. Staf administrasi Fakultas Farmasi yang telah membantu kemudahan administrasi selama ini.
7. Kedua orang tua penulis yaitu Ayahanda Sakino A.Ma.Pd., dan Ibunda Muliati serta juga untuk seluruh keluarga besar yang telah mencurahkan perhatian serta memberikan dukungan baik moril maupun materil dan segenap doa kepada penulis sehingga penulis dapat menyelesaikan tugas akhir ini. 8. Sahabat-sahabat yang satu kelompok dalam Praktek Kerja Lapangan yaitu,
Saprida, Rahayu, dan F. Dadang Dalimunthe, yang telah saling membantu dalam Praktek Kerja Lapangan.
10. Serta pihak-pihak yang telah ikut membantu penulis meskipun tidak tercantum namanya namun tidak mengurangi arti keberadaannya.
Penulis menyadari sepenuhnya dalam penyusunan tugas akhir ini, masih banyak terdapat kekurangan dan kelemahan yang dimiliki penulis baik itu sistematika penulisan maupun penggunaan bahasa. Untuk itu penulis mengharapkan kritik dan saran dari berbagai pihak yang bersifat membangun demi penyempurnaan tugas akhir ini. Semoga tugas akhir ini berguna bagi pembaca secara umum dan penulis secara khusus. Akhir kata penulis mengucapkan banyak terima kasih.
Medan, Mei 2012
Penulis,
Fatimah Arnis
Uji Disolusi Tablet Gliseril Guaiakolat Yang Diproduksi Oleh PT. Kimia Farma (Persero) Tbk. Plant Medan
Abstrak
Tablet gliseril guaiakolat atau disebut juga guaifenesin adalah derivat-guaiakol yang banyak digunakan sebagai ekspektoran. Tablet gliseril derivat-guaiakolat harus melalui serangkaian pengujian untuk menentukan kualitas tablet tersebut. Salah satunya adalah uji disolusi. Tujuan pengujian ini adalah untuk mengetahui apakah tablet gliseril guaiakolat yang diproduksi oleh PT. Kimia (Persero) Tbk. Plant Medan memenuhi persyaratan uji disolusi sesuai dengan yang ditetapkan oleh Farmakope Indonesia Edisi IV.
Sampel terdiri dari 6 tablet yang diambil dari satu bets. Uji disolusi dilakukan dengan menggunakan alat tipe 2 (metode dayung) dan penetapan kadar zat terlarut dilakukan dengan menggunakan metode spektrofotometri UV sesuai dengan prosedur dan alat spektrofotometer UV-Vis merk Agilent type 8453 E yang digunakan di laboratorium PT. Kimia Farma (Persero) Tbk. Plant Medan.
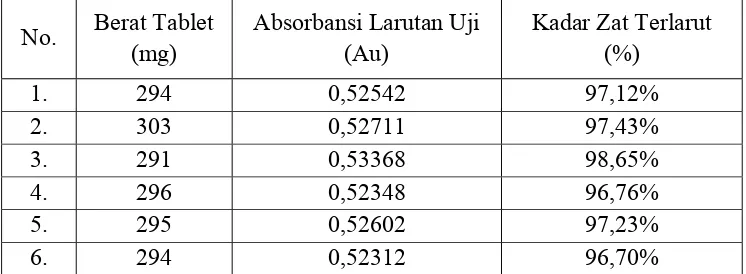
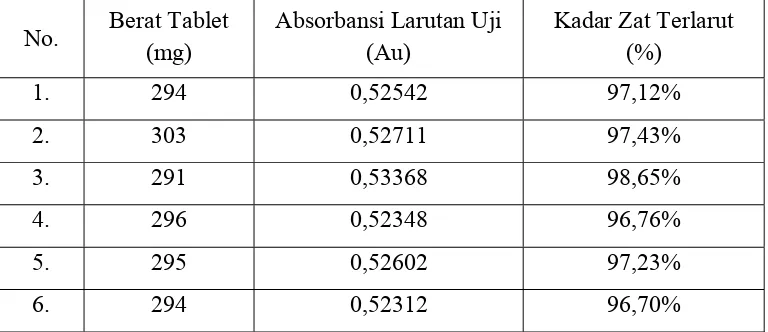
Hasil pengujian menunjukkan bahwa kadar zat terlarut dari ke-6 tablet, yaitu 97,12%, 97,43%, 98,65%, 96,76%, 97,23%, 96,70%, sesuai dengan batas yang ditetapkan dalam Farmakope Indonesia, dimana jumlah ke-6 tablet yang diuji pada tahap 1 (S1) memenuhi kriteria penerimaan hasil uji disolusi, yaitu tidak satupun kadar yang diperoleh kurang dari ketentuan (Q + 5%) yakni (75% + 5% = 80%).
DAFTAR ISI
2.5.1 Indikasi ... 9
2.5.2 Farmakologi ... 10
2.6 Uji Disolusi ... 10
2.6.1 Alat Uji Disolusi ... 11
2.6.2 Kriteria Sediaan Tablet yang Diuji dan Tidak Diuji Disolusi ... 12
3.4.3 Penetapan Kadar Secara Spektrofotometri UV ... 20
3.5 Perhitungan ... 21
4.2 Pembahasan ... 22 BAB V KESIMPULAN DAN SARAN
DAFTAR TABEL
Halaman
DAFTAR GAMBAR
Halaman
DAFTAR LAMPIRAN
Uji Disolusi Tablet Gliseril Guaiakolat Yang Diproduksi Oleh PT. Kimia Farma (Persero) Tbk. Plant Medan
Abstrak
Tablet gliseril guaiakolat atau disebut juga guaifenesin adalah derivat-guaiakol yang banyak digunakan sebagai ekspektoran. Tablet gliseril derivat-guaiakolat harus melalui serangkaian pengujian untuk menentukan kualitas tablet tersebut. Salah satunya adalah uji disolusi. Tujuan pengujian ini adalah untuk mengetahui apakah tablet gliseril guaiakolat yang diproduksi oleh PT. Kimia (Persero) Tbk. Plant Medan memenuhi persyaratan uji disolusi sesuai dengan yang ditetapkan oleh Farmakope Indonesia Edisi IV.
Sampel terdiri dari 6 tablet yang diambil dari satu bets. Uji disolusi dilakukan dengan menggunakan alat tipe 2 (metode dayung) dan penetapan kadar zat terlarut dilakukan dengan menggunakan metode spektrofotometri UV sesuai dengan prosedur dan alat spektrofotometer UV-Vis merk Agilent type 8453 E yang digunakan di laboratorium PT. Kimia Farma (Persero) Tbk. Plant Medan.
Hasil pengujian menunjukkan bahwa kadar zat terlarut dari ke-6 tablet, yaitu 97,12%, 97,43%, 98,65%, 96,76%, 97,23%, 96,70%, sesuai dengan batas yang ditetapkan dalam Farmakope Indonesia, dimana jumlah ke-6 tablet yang diuji pada tahap 1 (S1) memenuhi kriteria penerimaan hasil uji disolusi, yaitu tidak satupun kadar yang diperoleh kurang dari ketentuan (Q + 5%) yakni (75% + 5% = 80%).
BAB I PENDAHULUAN
1.1 Latar Belakang
Obat memiliki cakupan makna yang cukup luas, bukan hanya terbatas pada zat-zat yang digunakan untuk menyembuhkan seseorang dari sakit. Zat-zat yang berfungsi untuk menetapkan diagnosa (mengetahui penyakit), mencegah, mengurangi, menghilangkan penyakit atau gejala penyakit, luka atau kelainan, baik jasmani maupun rohani pada manusia dan hewan juga disebut obat (Widodo, 2004). Obat dapat digolongkan dalam beberapa sediaan, seperti tablet, kapsul, suspensi, dan berbagai larutan sediaan farmasi.
Tablet adalah sediaan padat yang berbentuk rata atau cembung rangkap, umumnya bulat, dibuat dengan mengempa atau mencetak obat atau campuran obat dengan atau tanpa zat tambahan (Anief, 1986). Sediaan tablet mempunyai beberapa persyaratan antara lain uji disolusi yaitu untuk mengetahui seberapa banyak persentase zat aktif dalam obat, yang terlarut ke dalam peredaran darah untuk memberikan efek terapi.
Faktor yang harus diperhatikan dalam uji disolusi yaitu ukuran dan bentuk yang akan mempengaruhi laju dan tingkat kelarutan, selain itu sifat media pelarutan juga akan mempengaruhi uji kelarutan. Beberapa kegunaan uji disolusi antara lain menjamin keseragaman satu bets, menjamin bahwa obat akan memberikan efek terapi yang diinginkan dan diperlukan dalam rangka pengembangan suatu obat baru (Ditjen POM, 1995).
Berdasarkan hal tersebut diatas, penulis tertarik untuk memilih judul tentang ”Uji Disolusi Tablet Gliseril Guaiakolat yang diproduksi oleh PT. Kimia Farma (Persero) Tbk. Plant Medan” dengan menggunakan metode Spektrofotometri UV dalam penetapan kadar zat terlarut karena analisis dengan metode ini cepat, teliti dan penyiapan sampelnya mudah.
1.2 Tujuan dan Manfaat 1.2.1 Tujuan
Untuk mengetahui apakah tablet gliseril guaiakolat yang diproduksi oleh PT. Kimia Farma (Persero) Tbk. Plant Medan memenuhi persyaratan uji disolusi sesuai dengan yang ditetapkan oleh Farmakope Indonesia edisi IV.
1.2.2 Manfaat
BAB II
TINJAUAN PUSTAKA
2.1 Pengertian Obat
Obat adalah zat aktif berasal dari nabati, hewani, kimiawi alam maupun sintetis dalam dosis atau kadar tertentu dapat dipergunakan untuk preventif (profilaksis), rehabilitasi, terapi, diagnosa terhadap suatu keadaan penyakit pada manusia maupun hewan. Namun zat aktif tersebut tidak dapat dipergunakan begitu saja sebagai obat, terlebih dahulu harus dibuat dalam bentuk sediaan pil, tablet, kapsul, sirup, suspensi, supositoria, salep, dan lain-lain (Jas, 2007).
Meskipun obat dapat menyembuhkan penyakit, tapi banyak kejadian yang mengakibatkan seseorang menderita akibat keracunan obat. Oleh karena itu, dapat dikatakan bahwa obat dapat bersifat sebagai obat dan dapat juga bersifat sebagai racun. Obat itu akan bersifat sebagai obat apabila tepat digunakan dalam pengobatan suatu penyakit dengan dosis dan waktu yang tepat. Jadi, apabila obat salah digunakan dalam pengobatan atau dengan dosis yang berlebih maka akan menimbulkan keracunan. Dan bila dosisnya kecil maka kita tidak akan memperoleh penyembuhan (Anief, 2007).
2.2 Pengertian Tablet
massa serbuk lembab dengan tekanan rendah ke dalam lubang cetakan. Tablet kempa dibuat dengan memberikan tekanan tinggi pada serbuk atau granul menggunakan cetakan baja. Tablet dapat dibuat dalam berbagai ukuran, bentuk dan penandaan permukaan tergantung pada desain cetakan (Ditjen POM, 1995).
Komposisi utama dari tablet adalah zat berkhasiat yang terkandung di
dalamnya, sedangkan bahan pengisi yang sering digunakan dalam pembuatan tablet
yaitu bahan penghancur, bahan penyalut, bahan pengikat, bahan pemberi rasa dan
bahan tambahan lainnya (Ansel, 1989).
Tablet merupakan bahan obat dalam bentuk sediaan padat yang biasanya dibuat dengan penambahan bahan tambahan farmasetika yang sesuai. Tablet dapat berbeda-beda ukuran, bentuk, berat, kekerasan, ketebalan, daya hancur, dan aspek lainnya tergantung pada cara pemakaian tablet dan metode pembuatannya. Umumnya tablet digunakan pada pemberian obat secara oral (Ansel, 1989).
2.2.1 Syarat-Syarat Tablet
Syarat-syarat tablet adalah sebagai berikut:
1. Keseragaman bobot dan keseragaman kandungan
Tablet harus memenuhi uji keseragaman bobot jika zat aktif merupakan bagian terbesar dari tablet dan cukup mewakili keseragaman kandungan. Keseragaman bobot bukan merupakan indikasi yang cukup
dari keseragaman kandungan jika zat aktif merupakan bagian terkecil dari
tablet atau jika tablet bersalut gula. Oleh karena itu, umumnya farmakope
mensyaratkan tablet bersalut dan tablet mengandung zat aktif 50 mg atau
memenuhi syarat uji keseragaman kandungan yang pengujiannya
dilakukan pada tiap tablet (Syamsuni, 2007).
2. Uji kekerasan
Kekerasan tablet dan ketebalannya berhubungan dengan isi die dan gaya kompresi yang diberikan. Bila tekanan ditambahkan, maka kekerasan tablet meningkat sedangkan ketebalan tablet berkurang. Selain itu metode granulasi juga menentukan kekerasan tablet. Umumnya kekuatan tablet berkisar 4 - 8 kg, bobot tersebut dianggap sebagai batas minimum untuk menghasilkan tablet yang memuaskan. Alat yang digunakan untuk uji ini adalah hardness tester, alat ini diharapkan dapat mengukur berat yang diperlukan untuk memecahkan tablet (Lachman, 1994).
3. Uji keregasan
4. Waktu hancur
Waktu hancur penting dilakukan jika tablet diberikan peroral, kecuali tablet yang harus dikunyah sebelum ditelan. Uji ini dimaksudkan untuk menetapkan kesesuaian batas waktu hancur yang ditetapkan pada masing-masing monografi. Uji waktu hancur tidak menyatakan bahwa sediaan atau bahan aktifnya terlarut sempurna.
Pada pengujian waktu hancur, tablet dinyatakan hancur jika tidak ada bagian tablet yang tertinggal di atas kasa, kecuali fragmen yang berasal
dari zat penyalut. Kecuali dinyatakan lain, waktu yang diperlukan untuk
menghancurkan keenam tablet tidak lebih dari 15 menit untuk tablet tidak
bersalut dan tidak lebih dari 60 menit untuk tablet bersalut (Syamsuni,
2007).
5. Disolusi
Disolusi adalah suatu proses perpindahan molekul obat dari bentuk padat ke dalam larutan suatu media. Uji ini dimaksudkan untuk mengetahui banyaknya zat aktif yang terlarut dan memberikan efek terapi di dalam tubuh. Kecepatan absorbsi obat tergantung pada pemberian yang dikehendaki dan juga harus dipertimbangkan frekuensi pemberian obat (Syamsuni, 2007).
6. Penetapan kadar zat aktif
maka obat tersebut tidak akan memberikan efek terapi dan juga tidak layak untuk dikonsumsi (Syamsuni, 2007).
2.3 Batuk
Batuk merupakan mekanisme pertahanan tubuh dalam menghadapi penyakit atau gangguan pada saluran pernafasan. Batuk dapat disebabkan oleh rangsangan, radang, atau ganguan pada saluran pernafasan yang disebabkan oleh lendir (Sartono, 1993).
Batuk terjadi secara reflektoris karena rangsangan pada reseptor batuk yang dialirkan melalui serabut aferen (serabut sensorik) ke pusat batuk dan kemudian diteruskan ke serabut eferen (serabut motorik). Batuk terdapat baik pada orang sakit maupun pada orang sehat dan sering merupakan gejala berbagai keadaan patologis yang ringan sampai berat (Munaf, 1994).
Menurut Munaf (1994), terdapat dua jenis batuk, antara lain:
a. Batuk produktif atau batuk yang bermanfaat, yaitu batuk yang menghasilkan pengeluaran sekret/dahak.
b. Batuk tidak produktif atau batuk kering dan disebut juga batuk tidak bermanfaat karena batuk tidak menghasilkan apa-apa.
Menurut Anief (2007), obat yang digunakan untuk mengobati penyakit batuk dibagi dalam dua golongan besar, yaitu:
1. Ekspektoransia, yaitu mempertinggi sekresi dari saluran pernapasan dan atau mencairkan riak sehingga mudah dikeluarkan.
2. Zat–zat pereda batuk (antitusif), yaitu zat–zat ini mengerem rangsangan batuk, dan titik tangkapnya dapat sentral, dapat perifer.
2.4 Ekspektoran
Menurut Sartono (1993), Ekspektoran adalah obat yang bekerja dengan cara meningkatkan jumlah cairan sehingga lendir menjadi encer, dan juga merangsang pengeluaran lendir dari saluran pernafasan.
2.5 Gliseril Guaiakolat
Menurut Ditjen POM (1995), sifat fisika dan kimia gliseril guaiakolat adalah sebagai berikut:
3-(o-Metoksifenoksi)-1,2-propanadiol [93-14-1]
Sinonim : Guaifenesin Rumus molekul : C10H14O4
Berat molekul : 198,22
Pemerian : Serbuk hablur, putih sampai agak kelabu; bau khas lemah; rasa pahit
Kelarutan : Larut dalam air, dalam etanol, dalam kloroform, dan dalam propilen glikol; agak sukar larut dalam gliserin. 2.5.1 Indikasi
Gliseril guaiakolat termasuk jenis obat batuk basah. Obat batuk ini digunakan untuk batuk yang memiliki ciri berlendir, dahak mudah dikeluarkan dan terasa ringan dan tidak begitu sering intensitas batuknya. Khasiat obat ini adalah mengeluarkan lendir batuk agar jalan napas terbebas dari zat asing (Widodo, 2004).
OCH3 OH
Menurut Widodo (2004), hal-hal yang perlu diperhatikan pada penggunaan gliseril guaiakolat:
a. Jangan gunakan lebih dari 7 hari tanpa izin dokter. b. Minumlah 1 gelas air setiap minum obat ini. c. Tidak diperbolehkan untuk alergi.
2.5.2 Farmakologi
Guaifenesin (gliseril guaiakolat, toplexil) adalah derivat guaiakol yang banyak digunakan sebagai ekspektoran dalam berbagai jenis sediaan batuk populer. Pada dosis tinggi bekerja merelaksasi otot, seperti mefenesin (Tjay, 2007).
Gliseril guaiakolat penggunaan obat ini hanya didasarkan tradisi dan kesan subjektif pasien dan dokter. Belum ada bukti bahwa obat bermanfaat pada dosis yang diberikan. Efek samping yang mungkin timbul dengan dosis besar, berupa kantuk, mual dan muntah (Setiabudy, 2007).
2.6 Uji Disolusi
2.6.1 Alat Uji Disolusi
Alat uji disolusi berfungsi melepaskan dan melarutkan zat aktif dari sediaannya. Pada dasarnya alat ini berfungsi mengekstraksi zat aktif dari sediaannya dalam satuan waktu di bawah antar permukaan cairan solid, suhu, dan komposisi media yang dibakukan (Siregar, 2010).
Pada prinsipnya, alat uji disolusi terdiri atas bejana dan tutup, yang berfungsi sebagai wadah yang mendisolusi zat aktif; pengaduk, motor pemutar pengaduk; termometer; penangas air yang dilengkapi dengan thermostat (Siregar, 2010).
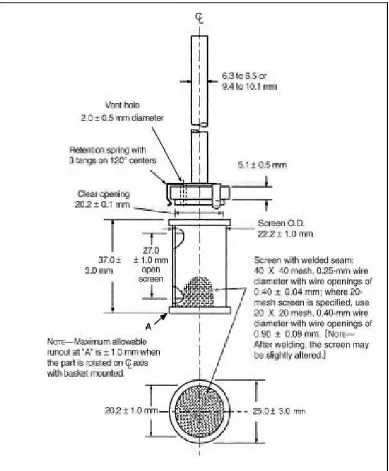
Menurut Ditjen POM (1995), ada dua tipe alat uji disolusi sesuai dengan yang tertera dalam masing-masing monografi:
a. Alat 1 (Tipe Keranjang)
gerakan air halus dan tetap. Pada bagian atas wadah ujungnya melebar, untuk mencegah penguapan digunakan suatu penutup yang pas.
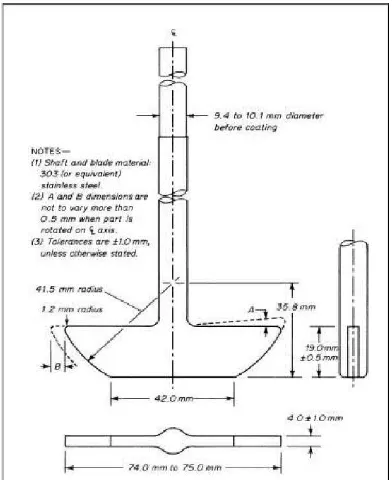
b. Alat 2 (Tipe Dayung)
Alat ini sama dengan alat 1, bedanya pada alat ini digunakan dayung yang terdiri dari daun dan batang logam sebagai pengaduk. Daun melewati diameter batang sehingga dasar daun dan batang rata. Dayung memenuhi spesifikasi dengan jarak 25 mm ± 2 mm antara daun dan bagian dasar wadah yang dipertahankan selama pengujian berlangsung. Sediaan obat dibiarkan tenggelam ke bagian dasar wadah sebelum dayung mulai berputar. Gulungan kawat berbentuk spiral dapat digunakan untuk mencegah mengapungnya sediaan.
2.6.2 Kriteria Sediaan Tablet yang Diuji dan Tidak Diuji Disolusi
Menurut Farmakope Indonesia Ed. IV (FI. Ed. IV), suatu sediaan tablet diuji disolusinya jika dinyatakan dalam monografinya. Hal ini berarti prosedur dan persyaratan uji disolusi hanya berlaku untuk sediaan tablet yang tertera dalam monografi tersebut. Sediaan tablet yang tidak tertera dalam FI. Ed. IV tentu saja dapat diuji disolusinya dengan prosedur dan persyaratan yang ditetapkan sendiri oleh pabriknya atau laboratorium pengendalian mutu pabrik tersebut (Siregar, 2010).
2.6.3 Prosedur Pengujian Disolusi
Pada tiap pengujian, dimasukkan sejumlah volume media disolusi (seperti yang tertera dalam masing-masing monografi) ke dalam wadah, pasang alat dan dibiarkan media disolusi mencapai temperatur 37oC. Satu tablet dicelupkan dalam keranjang atau dibiarkan tenggelam ke bagian dasar wadah, kemudian pengaduk diputar dengan kecepatan seperti yang ditetapkan dalam monografi. Pada interval waktu yang ditetapkan dari media diambil cuplikan pada daerah pertengahan antara permukaan media disolusi dan bagian atas dari keranjang berputar atau daun dari alat dayung tidak kurang 1 cm dari dinding wadah untuk analisis penetapan kadar dari bagian obat yang terlarut. Tablet harus memenuhi syarat seperti yang terdapat dalam monografi untuk kecepatan disolusi (Ditjen POM, 1995).
2.6.4 Kriteria Penerimaan Hasil Uji Disolusi
Tabel 1. Tabel Penerimaan Hasil Uji Disolusi
Harga Q adalah jumlah zat aktif yang terlarut, seperti yang tertera dalam masing-masing monografi, dinyatakan dalam persen dari jumlah yang tertera pada etiket. Angka 5% dan 15% adalah persen dari jumlah yang tertera pada etiket sehingga mempunyai arti yang sama dengan Q. Kecuali ditetapkan lain dalam masing-masing monografi, persyaratan umum untuk penetapan satu titik tunggal ialah terdisolusi 75% dalam 45 menit dengan menggunakan Alat 1 pada 100 rpm atau Alat 2 pada 50 rpm (Siregar, 2010).
Tahap Jumlah Sediaan
yang diuji Kriteria Penerimaan
S1 6 Tiap unit sediaan tidak kurang dari Q + 5%
S2 6
Rata-rata dari 12 unit (S1+ S2) adalah sama dengan atau lebih besar dari Q dan tidak satu unit sediaan yang lebih kecil dari Q – 15%
S3 12
2.6.5 Faktor yang Mempengaruhi Disolusi Zat Aktif
Menurut Siregar (2010), faktor-faktor yang mempengaruhi disolusi zat aktif antara lain:
1. Faktor yang berkaitan dengan sifat fisikokimia zat aktif meliputi karakteristik fase solid, polimorfisa, karakteristik partikel, kelarutan zat aktif dan pembentukan garam.
2. Faktor yang berkaitan dengan formulasi sediaan meliputi eksipien atau zat tambahan, zat pengisi, desintegran, pengikat, lubrikan, antiadherent, glidan, pengaruh surfaktan dan pengaruh zat pewarna larut-air pada laju disolusi.
3. Faktor yang berkaitan dengan bentuk sediaan meliputi metode granulasi/ prosedur pembuatan, ukuran granul, interaksi zat aktif-eksipien, pengaruh gaya kempa, dan pengaruh penyimpanan pada laju disolusi.
4. Faktor yang berkaitan dengan alat disolusi meliputi eksentrisitas gerakan pengaduk, vibrasi/getaran, intensitas pengadukan, dan kesejajaran unsur pengadukan.
5. Faktor yang berkaitan dengan parameter uji disolusi yaitu pH media disolusi, suhu media disolusi, viskositas media disolusi dan tegangan permukaan media disolusi.
2.7 Penetapan Kadar
zat aktif dan sampel uji disolusi mencakup titrasi asam-basa, titrasi kompleksometri, titrasi iodometri, spektrofotometri, spektrofluorometri, dan kromatografi cair kinerja tinggi (Siregar, 2010). Dalam hal ini, metode yang dipilih dalam penetapan kadar sampel uji disolusi yaitu Spektrofotometri UV.
Spektrofotometri UV-Vis adalah pengukuran berapa banyak radiasi yang diserap oleh sampel. Metode ini biasanya digunakan untuk molekul dan ion anorganik atau kompleks di dalam larutan. Spektrum UV-Vis mempunyai bentuk yang lebar dan hanya sedikit informasi tentang struktur yang didapatkan, tetapi spektrum ini sangat berguna untuk pengukuran secara kuantitatif (Dachriyanus, 2004).
BAB III METODOLOGI
3.1 Tempat
Uji disolusi tablet gliseril guaiakolat 100 mg dilakukan di PT. Kimia Farma (Persero) Tbk. Plant Medan.
3.2 Alat-alat
Alat-alat yang digunakan adalah Dissolution Tester merk Hanson type SR-2, Spektrofotometer UV merk Agilent type 8453 E, Ultrasonic Digital, Digital balance merk Satorius type ep 224 5, kertas saring, kertas perkarmen, spatula dan alat-alat gelas (beaker gelas, corong, gelas ukur, labu tentukur dan pipet volume).
3.3 Bahan-bahan
a. Sediaan tablet gliseril guaiakolat 100 mg b. Akuades
3.4 Prosedur
3.4.1 Pembuatan Larutan baku
a. Ditimbang seksama sejumlah gliseril guaiakolat BPFI sebanyak 44,4 mg. b. Dimasukkan ke dalam labu tentukur 100 ml, ditambahkan akuades 20 ml,
c. Dicukupkan sampai garis tanda, kemudian dihomogenkan, lalu disaring. d. Dibuang 5 ml filtrat pertama, dan filtrat selanjutnya ditampung.
e. Dipipet 1 ml filtrat ke dalam labu tentukur 10 ml, dicukupkan sampai garis tanda, lalu dihomogenkan.
f. Dimasukkan larutan ke dalam kuvet.
g. Diukur serapan larutan baku pada panjang gelombang 273 nm, menggunakan akuades sebagai blanko.
3.4.2 Uji Disolusi Sampel
Cara pengujian disolusi dengan metode pengaduk bentuk dayung: a. Ditimbang masing-masing 6 tablet, dicatat hasilnya. b. Disiapkan alat, pastikan alat siap pakai.
c. Dimasukkan 900 ml akuadest ke dalam wadah (media disolusi), dipasang alat dengan pengaduk bentuk dayung (alat 2).
d. Dimasukkan 6 tablet gliseril guaiakolat 100 mg ke dalam masing-masing wadah secara serentak. Segera jalankan alat pada suhu 37oC ± 0,5oC dengan laju kecepatan 50 rpm dan tunggu selama 45 menit.
e. Setelah 45 menit dipipet 10 ml larutan pada daerah pertengahan antara permukaan media disolusi dan bagian atas dari dayung berputar, dimasukkan ke dalam labu tentukur 25 ml lalu dicukupkan sampai garis tanda kemudian dihomogenkan.
3.4.3 Pembuatan Kurva Absorbansi
Pembuatan kurva absorbansi bertujuan untuk mendapatkan panjang gelombang absorbsi maksimum dari sampel. Berhubung protap yang digunakan di PT. Kimia Farma telah ditentukan maka pembuatan kurva absorbansi tidak dilakukan lagi. Sesuai dengan protap yang telah ditentukan maka panjang gelombang maksimum yang digunakan untuk sampel adalah 273 nm.
3.4.4 Pembuatan Kurva Kalibrasi Pembuatan kurva kalibrasi bertujuan untuk:
1. Melihat hubungan antara absorbansi (A) dengan konsentrasi (C). 2. Membuat persamaan garis regresi.
3. Untuk menentukan konsentrasi pengukuran zat uji.
Pembuatan kurva kalibrasi diupayakan menghasilkan harga absorbansi (A) dalam rentang 0,4 – 0,6. Tetapi, biasanya harga absorbansi (A) yang diperoleh berkisar antara 0,2 – 0,8. Namun pembuatan kurva kalibrasi tidak dilakukan lagi karena:
1. Protap itu sudah merupakan kegiatan rutin yang dilakukan di PT. Kimia Farma sehingga cukup menggunakan kurva kalibrasi yang sudah ada. 2. Perhitungan kadar tidak menggunakan persamaan regresi melainkan
3.4.5 Penetapan Kadar Secara Spektrofotometri UV
Tahapan kerja penetapan kadar yang dilakukan adalah sebagai berikut: a. Hidupkan alat spektofotometer ultra violet (UV).
b. Klik program spektofotometer ultra violet (UV) yang terdapat di komputer.
c. Klik menu Quantification, masukkan panjang gelombang maksimum (273 nm) serta jarak batas atas dan batas bawah panjang gelombang (200 nm dan 400 nm).
d. Masukkan akuades (blanko) ke dalam kuvet. e. Letakkan kuvet di tempat pengukuran. f. Klik blank, lalu spektrum keluar.
g. Masukkan larutan A (Larutan baku pembanding/BPFI) ke dalam kuvet. h. Letakkan kuvet di tempat pengukuran.
i. Klik standard, keluar 1 absorbansi di dalam tabel, klik 3 kali sehingga diperoleh 3 buah absorbansi. Dalam perhitungan kadar yang digunakan adalah nilai absorbansi yang terdapat di tengah.
j. Masukkan larutan B (Larutan uji) ke dalam kuvet. k. Letakkan kuvet di tempat pengukuran.
3.5 Perhitungan
Perhitungan kadar zat terlarut tablet gliseril guaiakolat dapat dilakukan dengan menggunakan rumus:
Keterangan: K = Kadar zat terlarut Au = Absorbansi larutan uji Ab = Absorbansi larutan baku
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil
Berdasarkan uji disolusi tablet gliseril guaiakolat 100 mg yang dilakukan, diperoleh hasil sebagai berikut:
Tabel 2. Data Hasil Uji Disolusi
No. Berat Tablet
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari hasil uji disolusi yang dilakukan, maka dapat disimpulkan bahwa tablet gliseril guaiakolat 100 mg yang diproduksi oleh PT. Kimia Farma (Persero) Tbk. Plant Medan telah memenuhi persyaratan uji disolusi sesuai dengan yang ditetapkan oleh Farmakope Indonesia edisi IV. Dimana persyaratan uji disolusi tiap unit sediaan tidak satupun kadar kurang dari ketentuan (Q + 5%) yaitu (75% + 5%= 80%). Berarti hasil uji disolusi memenuhi persyaratan.
5.2 Saran
DAFTAR PUSTAKA
Anief, M. (1986). Ilmu Farmasi. Cetakan Kedua. Jakarta: Ghalia Indonesia. Hal. 61.
Anief, M. (2007). Apa Yang Perlu Diketahui Tentang Obat. Cetakan Kelima. Yogyakarta: Gadjah Mada University Press. Hal. 3.
Ansel, H.C. (1989). Pengantar Bentuk Sediaan Farmasi. Cetakan Pertama. Jakarta: Penerbit Universitas Indonesia (UI-Press). Hal. 244, 246, 247. Dachriyanus. (2004). Analisis Struktur Senyawa Organik Secara Spektroskopi.
Padang: Andalas University Press. Hal. 1.
Ditjen POM. (1995). Farmakope Indonesia. Edisi IV. Jakarta: Departemen Kesehatan. Hal. 4, 422, 423, 1084, 1085.
Jas, A. (2007). Perihal Obat dengan Berbagai Jenis dan Bentuk Sediaannya. Medan: USU Press. Hal. 2, 3.
Lachman, L., Lieberman, H.A., dan Kanig, J.L. (1994). Teori dan Praktek Farmasi Industri II. Edisi III. Jakarta: Penerbit Universitas Indonesia (UI-Press). Hal. 658, 661, 662.
Munaf, S. (1994). Catatan Kuliah Farmakologi Bagian II. Jakarta: Penerbit Buku Kedokteran EGC. Hal. 235, 236.
Sardjoko. (1993). Rancangan Obat. Cetakan Pertama. Yogyakarta: Gadjah Mada University Press. Hal. 162.
Sartono. (1993). Apa Yang Sebaiknya Anda Ketahui Tentang Obat-Obat Bebas dan Bebas Terbatas. Cetakan Pertama. Jakarta: Gramedia Pustaka Utama. Hal. 36, 37.
Setiabudy, R. (2007). Farmakologi dan Terapi. Edisi V. Jakarta: Penerbit FKUI. Hal. 531.
Siregar, C.J.P. (2010). Teknologi Farmasi Sediaan Tablet. Dasar-Dasar Praktis. Jakarta: Penerbit Buku Kedokteran EGC. Hal 84 – 86, 90, 96.
Syamsuni, A.H. (2007). Ilmu Resep. Jakarta: Penerbit Buku Kedokteran EGC. Hal. 61.
Tjay, T.H., dan Rahardja, K. (2002). Obat-Obat Penting. Khasiat, Penggunaan,
dan Efek-Efek Sampingnya. Edisi V. Jakarta: Penerbit PT. Elex Media
Lampiran 1.
Data Uji Disolusi dan Perhitungan Kadar
Nama sediaan : Tablet gliseril guaiakolat
Zat berkhasiat : 100 mg gliseril guaiakolat tiap tablet No. Bets : 051 168 T
Media Disolusi : 900 ml Akuades
Tipe Alat : Tipe 2 Dayung (Paddle) Waktu : 45 menit
Kecepatan Rotasi : 50 rpm Panjang Gelombang : ± 273 nm
Persyaratan (Q) : Harus larut tidak kurang dari 75% dari jumlah yang tertera pada etiket
Bobot Baku (Bb) : 44,4 mg
Tabel 3. Data Uji Disolusi
Kadar Zat Terlarut (K):
Keterangan: K = Kadar zat terlarut Au = Absorbansi larutan uji Ab = Absorbansi larutan baku
Kb = Kadar baku
Untuk Au1 = 0,52542
Untuk Au3 = 0,53368
Untuk Au4 = 0,52348
Untuk Au5 = 0,52602
Lampiran 2.
Gambar Alat Uji Disolusi