i
EFEK NEFROPROTEKTIF PEMBERIAN JANGKA PANJANG EKSTRAK ETANOL BIJIPersea americanaMill. TERHADAP KADAR KREATININ DAN GAMBARAN HISTOLOGIS GINJAL PADA TIKUS
TERINDUKSI KARBON TETRAKLORIDA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh :
Rotua Winata Nopelia Silitonga
NIM : 108114013
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
HALAMAN PERSEMBAHAN
“Sebab TUHAN, Dia sendiri akan berjalan di depanmu, Dia sendiri akan menyertai engkau, Dia tidak akan membiarkan engkau dan tidak akan meninggalkan engkau ; janganlah takut dan janganlah patah hati.”
Ulangan 31: 8
Hati raja seperti batang air dalam tangan TUHAN, dialirkan-Nya ke mana Ia ingini (Amsal 21:1)
vii PRAKATA
Puji dan syukur kepada Tuhan Yang Maha Pemurah atas segala
penyertaan, kasih dan berkatNya sehingga penulis dapat menyelesaikan skripsi
yang berjudul “Efek Nefroprotektif Pemberian Jangka Panjang Ekstrak Etanol
Biji Persea americana Mill. terhadap Kadar Kreatinin dan Gambaran Histologis
Ginjal pada Tikus Terinduksi Karbon Tetraklorida ” dengan baik. Skripsi ini
disusun untuk memenuhi salah satu syarat memperoleh gelar Sarjana Farmasi
(S.Farm) program studi Farmasi Universitas Sanata Dharma.
Penulis menyadari bahwa dalam pembuatan skripsi ini tidak terlepas dari
bantuan dan dukungan dari berbagai pihak. Oleh sebab itu, penulis mengucapkan
terima kasih kepada :
1. Ibu Phebe Hendra, M.Si., Ph.D., Apt. selaku Dosen Pembimbing skripsi atas
perhatian, kesabaran, bimbingan, masukan dan motivasi kepada penulis
dalam proses penyusunan skripsi ini.
2. Ibu dr. Fenti, M.Kes., Sp.K sebagai dosen penguji yang telah memberikan
kritik dan saran yang membangun selama proses pembuatan skripsi.
3. Bapak Yohanes Dwiatmaka, M.Si. sebagai dosen penguji yang telah
memberikan kritik dan saran yang membangun selama proses pembuatan
skripsi.
4. Ibu Rini Dwiastuti, M.Si., Apt. selaku Kepala Penanggungjawab
Laboratorium Fakultas Farmasi yang telah memberikan ijin dalam
viii
5. Bapak Yohanes Dwiatmaka, M.Si. yang telah menyediakan waktu untuk
memberikan bantuan dalam determinasi tanamanP.americana.
6. Pak Kayat, Pak Heru, Pak Parjiman, Pak Wagiran, Pak Parlan, Pak Kunto,
dan Pak Bimo selaku laboran laboratorium Fakultas Farmasi yang telah
membantu penulis dalam proses pelaksanaan penelitian di laboratorium.
7. Keluargaku Bapak Dolok Silitonga, Mama Masdiana Sirait, Irna Marsaulina
dan Angri Jwita, yang selalu memberikan doa, perhatian, dan menjadi
motivasi terbesar penulis.
8. Beasiswa Unggulan Kementrian Pendidikan dan Kebudayaan Republik
Indonesia atas kontribusinya dalam membiayai proses perkuliahan dan
penelitian ini.
9. Teman-teman seperjuangan dalam tim alpukat Ayu, Ita, Cilla, Ike kiting,
Lydia, Ike Kum, Dian, Dion, Iren, Liana, Obet, Angel, Dara dan Yudhita atas
kerjasama, bantuan, dan semangat yang selalu di bagikan dalam proses
penyusunan skripsi ini dari awal hingga akhir.
10. Kawan-kawan “sariayuers” Kak Sari Tambunan, Devi Sinaga, Jolina Bitti,
Mauryn Marpaung, Yoestenia, Metta Maurilla, Mariana, Novie Imoliana,
Melisa Dharmawan dan Anna Sofiana atas kebersamaan, kecerian,
dukungan, semangat dan masukan yang diberikan selama pembuatan skripsi
ini.
11. Yudi Theo Lumy yang selalu memberikan dukungan doa dan semangat
x
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA
xi
1. Anatomi dan fisiologi ginjal...
2. Fungsi ginjal...
A. Jenis dan Rancangan Penelitian...
xii
B. Variabel dan Definisi Operasional...
1. Variabel utama...
D. Alat dan Instrumen Penelitian...
1. Alat ekstraksi...
2. Alat uji nefroprotektif...
E. Tata Cara Penelitian
1. Determinasi serbuk bijiP. americana...
2. Pembuatan serbuk...
3. Pengumpulan bahan...
4. Penetapan kadar air serbukP. americana...
5. Pembuatan ekstrak etanol bijiP. americana...
6. Penetapan konsentrasi pekat ekstrak...
7. Penetapan dosis ekstrak etanol bijiP. americana...
8. Pembuatan larutan karbon tetraklorida...
9. Pembuatan suspending agent CMC-Na 1%...
10. Uji Pendahuluan...
11. Pengelompokan dan perlakuan hewan uji...
xiii
13. Penetapan kadar serum kontrol, kadar kreatinin serum...
F. Tata Cara Analisis Hasil...
BAB IV. HASIL DAN PEMBAHASAN...
A. Penyiapan Bahan ... 1. Hasil determinasi serbuk bijiP.americana...
2. Penetapan kadar air serbuk bijiP. americana......
3. Hasil pembuatan dan penimbangan ekstrak etanol bijiP. americana...
B. Uji Pendahuluan... 1. Penentuan dosis nefrotoksik karbon tetraklorida...
2. Penentuan waktu pencuplikan darah...
3. Penetapan lama pemejanan ekstrak etanol bijiP. americana...
4. Penetapan dosis ekstrak etanol bijiP. americana...
C. Hasil Uji Efek Nefroprotektif Ekstrak Etanol BijiP.americana...
1. Kontrol negatifolive oil dosis 2 mL/kgBB ...
2. Kontrol nefrotoksin karbon tetraklorida dosis 2 mL/kgBB...
3. Kontrol ekstrak etanol bijiP. americanadosis 1400mg/kgBB...
4. Perlakuan ekstrak etanol biji P.americana dosis 350, 700 dan 1400mg/kgBB
pada tikus terinduksi karbon tetraklorida dosis 2 mL/kgBB………..
D. Rangkuman Pembahasan... BAB V. KESIMPULAN DAN SARAN...
xiv
LAMPIRAN...
BIOGRAFI PENULIS...
70
xv
Komposisi dan konsentrasi reagen serum kreatinin...
Purata kadar kreatinin tikus pada jam ke 0, 24, 48
dan 72...
Hasil ujiScheffekadar kreatinin serum tikus
pada jam ke 0,24, 48 dan 72 setelah pemberian
karbon tetraklorida dosis 2mL/kgBB...
Kadar kreatinin serum tikus pada enam kelompok...
Hasil ujiScheffe kadar kreatinin serum tikus
pada enam kelompok...
Hasil pemeriksaan histologis ginjal pada
keenam kelompok perlakuan...
Purata kadar kreatinin serum tikus setelah pemejanan
olive oildosis 2 mL/kgBB pada selang waktu
0 dan 48 jam...
Hasil rendemen ekstrak etanol biji
P.americana...
Pengeringan ekstrak etanol bijiP.americana
xvi
Sel-sel tubulus kontortus proksimal dan distal...
Perbedaan bentuk sel tubulus proksimal dan distal...
Gambaran mikroskopikductus colligens...
Mekanisme biotransformasi dan oksidasi karbon
tetraklorida...
Diagram batang rata-rata kadar kreatinin
tikus padajam ke 0, 24, 48 dan 72 setelah pemberian
karbon tetraklorida dosis 2 mL/kgBB...
Diagram batang rata-rata kadar kreatinin serum tikus
pada enam kelompok...
Diagram batang kadar kreatinin setelah pemejanan
olive oilpada selang waktu 0 dan 48 jam...
Gambaran mikroskopis ginjal pada kelompok perlakuan
kontrol negatifolive oil yang mengalami Intratubular
Hialin Cast (ITC)...
Gambaran mikroskopis ginjal pada kelompok
perlakuan kontrol negatif olive oil yang mengalami
Degenerasi Hidropik Epitel Tubulus (DHET)...
Gambaran mikroskopis ginjal pada kelompok
xvii
Gambar 13.
perlakuan nefrotoksin karbon tetraklorida 2mL/kgBB
dengan kondisi ginjal yang normal...
Gambaran mikroskopik ginjal pada kelompok
perlakuan ekstrak etanol bijiP.americana dosis
350mg/kgBB yang mengalami perivaskulitis... 52
xviii
Foto ekstrak kental bijiP.americana...
Foto larutan ekstrak etanol biji P.americana...
Surat pengesahan determinasi serbuk bijiP.americana...
Hasil determinasi serbuk bijiPersea americanaMill...
Surat pengesahan Medical and Health Research Ethics
Committee (MHREC)...
Analisis statistik kadar kreatinin serum pada
uji penentuan waktu pencuplikan darah tikus
setelah diinduksi karbon tetraklorida 2mL/kgBB...
Analisis statistik kadar kreatinin serum pada enam
kelompok perlakuan ekstrak etanol biji P.americana
setelah induksi karbon tetraklorida 2mL/kgBB...
Analisis statistik kadar kreatinin serum pada
perlakuan kontrol negatifolive oildosis 2mL/kgBB...
Perhitungan efek nefroprotektif(%)...
Perhitungan penetapan peringkat dosis
ekstrak etanol bijiP.americanakelompok
perlakuan...
Perhitungan konversi dosis untuk manusia...
Penetapan kadar air serbuk bijiP.americana...
xix
Lampiran 14.
Lampiran 15.
Lampiran 16
Lampiran 17.
Hasil rendemen ekstrak etanol biji
P.americana...
Bobot pengeringan ekstrak etanol bijiP.americana hingga
terbentuk ekstrak kental...
Pengukuran validitas dan reliabilitas...
Surat pengesahan hasil pemeriksaan histologis...
89
89
90
xx INTISARI
Penelitian ini bertujuan membuktikan adanya efek nefroprotektif pemberian jangka panjang ekstrak etanol biji Persea americana Mill. (P.americana) terhadap penurunan kadar kreatinin serum dan gambaran histologis ginjal pada tikus terinduksi karbon tetraklorida dan memperoleh besar dosis efektifnya.
Penelitian ini merupakan penelitian eksperimental murni dengan rancangan acak lengkap pola searah. Dalam penelitian ini digunakan tiga puluh ekor tikus jantan galur Wistar, umur 2-3 bulan, berat badan ±150-250 gram. Tikus dibagi dalam enam kelompok yaitu kelompok kontrol negatif diberi olive oil
dosis 2 mL/kgBB, kelompok kontrol nefrotoksin diberikan karbon tetraklorida 2 mL/kgBB secara ip, kontrol ekstrak etanol biji P.americana dengan dosis 1400 mg/kgBB, dan kelompok empat hingga enam merupakan kelompok perlakuan yang diberi ektrak etanol biji P.americana dosis 350, 700, dan 1400mg/kgBB. Pemberian ekstrak etanol bijiP. americanadilakukan secara peroral, sekali sehari selama enam hari berturut-turut kemudian pada hari yang ketujuh semua tikus pada kelompok perlakuan diberi karbon tetraklorida dosis 2 mL/kgBB secara ip. Empat puluh delapan jam setelah diberikan karbon tetraklorida, darah diambil melalui sinus orbitalis mata tikus untuk diukur kadar kreatinin serum dan pengambilan organ ginjal untuk pemeriksaan histologis. Data kadar kreatinin dianalisis dengan analisis ANOVA satu arah dan dilanjutkan dengan uji Scheffe
atau uji T-berpasangan untuk dua kelompok sampel berpasangan.
Hasil penelitian menunjukkan bahwa ekstrak etanol biji P.americana
memiliki efek nefroprotektif dengan penurunan kadar kreatinin serum dan gambaran mikroskopis ginjal yang normal pada tikus yang terinduksi karbon tetraklorida. Tidak terdapat kekerabatan antara dosis dan respon yang dihasilkan. Ekstrak etanol bijiP.americanadosis 350, 700, dan 1400 mg/kgBB memiliki efek nefroprotektif berturut-turut sebesar 133,3; 133,3; dan 85,7%. Dosis efektifnefroprotektif ekstrak etanol bijiP.americanaadalah 350 mg/kgBB.
xxi ABSTRACT
The aim of this research wasto determine about nephroprotective effect of ethanol extract Persea americana Mill. (P.americana) seeds by reducing creatinine serum level in rats induced by carbon tetrachloride and get the effective dose.
This research was an experimental research with direct sampling design. This research used Wistar male rats, age 2-3 months, and weight ± 150-250 g. The rats were divided into six treatment groups. The first group (negative control) was givenolive oil 2 mL/kgBW. Then, the second group (nephrotoxin control) was given carbon tetrachloride 2 mL/kgBW i.p. Third group (extract control) was given ethanol extract of P.americanaseed 1400mg/kgBW.The fourth until sixth group (treatment) were given ethanol extract ofP. americanaseed dose 350, 700 and 1400mg/kgBW orally once a days for six days successively and then in the seventh day all of the treatments group were given carbon tetrachloride 2 mL/kgBW by i.p. Fourty eight hours later, blood was collected from the orbital sinus eye to be measured creatinine serum level and examined the histological figure of kidney. It was analyzed statistically with One Way Anova and Scheffe
test or T-test for paired sample.
Based of the result of the research, ethanol extract P. americana seed gave nephroprotective effects by reducing creatinine serum level and a relatively normal histological figure of kidney in rats induced by carbon tetrachloride. There was no relation between dose and response which were seen from the greater dose of ethanol extract P. americana seed given, thus the nephroprotective was not higher. Nephroprotective effect with dose of 350, 700 and 1400mg/kgBW successively were 133.3; 133.3; and 85.7%. The effective dose of ethanol extract
P.americanaseed was 350mg/kgBW.
1 BAB I PENGANTAR A. Latar Belakang
Ginjal merupakan sepasang organ bersimpai yang berfungsi menyaring
darah dan terletak di daerah retroperitoneum pada dinding posterior abdomen.
Ginjal menyaring darah untuk membersihkan zat-zat sisa terutama urea dan
senyawa yang mengandung nitrogen serta mengatur elektrolit ekstravaskular dan
volume intravaskular.Kategori penyakit ginjal didasarkan pada letak lesi,
misalnya glomerulopati dan penyakit tubulo interstisium atau berdasarkan sifat
faktor yang menyebabkan penyakit ginjal, misalnya imunologik, metabolik,
infiltratif, infeksi, hemodinamik, atau toksik (McPhee dan Ganong, 2007). Fungsi
homeostatik pada keadaan gagal ginjal kronik atau gagal ginjal akut akan
terganggu yang kemudian menyebabkan terjadinya abnormalitas komposisi dan
volume cairan tubuh yang berat dan cepat (Guyton dan Hall, 2006).
Penyakit ginjal menjadi masalah kesehatan, baik di negara maju maupun
negara berkembang. Selama satu dekade terakhir terjadi peningkatan insidensi dan
prevalensi penyakit ginjal di seluruh dunia (Hamer dan Nahas, 2006). Menurut
laporan World Health Report (WHO) (2002) dan proyek Global Burden of
Disease (GDB), penyakit ginjal dan saluran kemih telah menjadi salah satu
penyakit global yang mematikan. Penyakit ini menyebabkan rata-rata 850.000
kematian setiap tahun dan 15.010.167 mengalami kecacatan seumur hidup
Insidensi dan prevalensi gagal ginjal kronik terminal di Indonesia belum
diketahui dengan pasti. Namun diperkirakan besarnya insidensi gagal ginjal
kronik terminal di Indonesia adalah sebesar 100-150 orang tiap 1 juta penduduk
pertahun. Sedangkan besarnya prevalensi gagal ginjal kronik terminal di
Indonesia diperkirakan sebesar 200–250 orang tiap 1 juta penduduk pertahun
(Bakri,2005). Berdasarkan tingginya angka kejadian gagal ginjal, maka
dibutuhkan adanya alternatif pengobatan untuk penyakit ini.
P. americanamerupakan tanaman yang dikenal mempunyai kemampuan
mengobati hipertensi (Anaka, Ozolua, dan Okpo, 2009), juga sebagai anti radang
dan menghilangkan rasa sakit (Haryanto,2009). Biji P.americana mengandung
antioksidan larut air dan dapat menangkap radikal bebas yaitu flavonoid (Arukwe,
Amadi, Duru, Agomuo, Adindu, dan Odika, 2012). Flavonoid mampu mencegah
kerusakan oksidatif sel, memiliki aktifitas perlindungan dan anti kanker yang kuat
dalam melawan tahap-tahap karsinogenesis (Salah, Miller, Pangauga, Bolwell,
Rice, dan Evans, 1995). Selain itu, Malangngi, Sangi, dan Paendong (2012)
melaporkan ekstrak etanol biji P. americana menunjukkan aktivitas antioksidan
melalui penangkapan radikal bebas DPPH.
Karbon tetraklorida merupakan salah satu senyawa model yang dapat
menginduksi terjadinya kerusakan oksidatif sel pada beberapa fungsi fisiologis
hewan uji (Ivor dan Schneider, 2005). Karbon tetraklorida akan mengalami
metabolisme oleh enzim sitokrom P-450 membentuk radikal bebas triklorometil
(•CCl3) dan triklorometilperoksida (•OOCCl3) yang lebih reaktif. Radikal bebas
jaringan ginjal (Manna, Sinha, dan Sil, 2006). Terbentuknya ikatan kovalen antara
radikal bebas dengan makromolekul jaringan ginjal terutama menimbulkan
kerusakan pada bagian tubulus proksimal ginjal (Cotran dan Robbins, 1997).
Kosinska, Karamac, Estrella, Hernandez, Bartolome, dan Dykes (2012)
melaporkan kandungan fenolik yang tinggi serta kapasitas antioksidan dari
ekstraksi biji P.americana dengan menggunakan pelarut metanol. Aktivitas
antioksidan in vitro diperoleh dari hasil ekstraksi biji P.americana menggunakan
pelarut etil asetat, asetone dan metanol (Javier, David, María, Petri, dan Mario,
2011). Pada penelitian ini digunakan sediaan dalam bentuk ekstrak menggunakan
pelarut etanol. Hal ini didasarkan pada penelitian Marlinda, Sangi, dan Wuntu
(2012) yang memperoleh kandungan metabolit sekunder P. americanayaitu
alkaloid, triterpenoid, tanin, flavonoid dan saponin melalui ekstraksi dengan
pelarut etanol 70%. Selain itu, pemilihan pelarut etanol dilakukan untuk
memperoleh senyawa yang dapat berperan sebagai antioksidan menggunakan
pelarut yang memiliki tingkat kepolaran berbeda dengan metanol.
Penelitian mengenai khasiat bagian buah maupun daun tanaman P.
americana telah banyak dilakukan. Namun penelitian terkait biji P. americana
yang umumnya dianggap kurang bermanfaat atau hanya sebagai limbah masih
terbatas terutama terkait kemampuannya sebagai nefroprotektif. Berdasarkan hal
tersebut maka perlu dilakuan penelitian untuk membuktikan kemampuan
nefroprotektif ekstrak etanol biji P. americana pada tikus terinduksi karbon
1. Perumusan masalah :
Berdasarkan latar belakang diatas, dapat diuraikan permasalahan sebagai
berikut :
a. Apakah pemberian jangka panjang ekstrak etanol bijiP.americanamempunyai
efek nefroprotektif terhadap kadar kreatinin dan gambaran histologis organ
ginjal pada tikus jantan galur Wistar yang terinduksi karbon tetraklorida?
b. Berapa besar dosis efektif nefroprotektif ekstrak etanol biji P. americanapada
tikus jantan galur Wistar yang terinduksi karbon tetraklorida?
2. Keaslian penelitian
Sejauh pengamatan penulis, penelitian terhadap P. americana pernah
dilakukan oleh Idris, Ndukwe, dan Gimba (2009) yang melaporkan kemampuan
bijiP. americana sebagai antimikroba. Penelitian Anaka, dkk. (2009) melaporkan
pengaruh ekstrak biji P.americana sebagai penurun tekanan darah pada tikus
Sprague-Dawley. Arukwe, dkk. (2012) melaporkan kandungan kimia biji P.
americana yaitu saponin, flavonoid, alkaloid dan fenol. Malangngi, dkk.(2012)
juga melaporkan kandungan tanin dan aktivitas antioksidan ekstrak etanol biji P.
americana dalam menangkap radikal bebas DPPH. Kosinska, dkk. (2012)
melaporkan kandungan fenolik yang tinggi serta kapasitas antioksidan pada
ekstrak metanol kulit dan biji P. americana terhadap radikal bebas DPPH dan
ABST.
Sepanjang pengetahuan peneliti, efek nefroprotektif ekstrak etanol biji P.
tikus jantan galur Wistar terinduksi karbon tetraklorida belum pernah
dilakukan.
3. Manfaat penelitian
a. Manfaat teoritis. Penelitian ini diharapkan dapat memberikan
sumbangan ilmu pengetahuan mengenai pengaruh pemberian jangka panjang
ekstrak etanol biji P. americana terhadap fungsi ginjal dengan parameter kadar
kreatinin dan gambaran histologis organ ginjal tikus yang terinduksi karbon
tetraklorida.
b. Manfaat praktis. Penelitian ini dapat dijadikan bahan pertimbangan
masyarakat untuk menggunakan biji P.americana sebagai proteksi terhadap
organ.
B. Tujuan Penelitian 1. Tujuan umum
Membuktikan adanya efek nefroprotektif pemberian jangka panjang
ekstrak etanol biji P.americanapada tikus yang terinduksi karbon
tetraklorida.
2. Tujuan khusus
Mengetahui dosis efektif ekstrak etanol biji P.americana sebagai
6 BAB II
PENELAAHAN PUSTAKA A. Persea americanaMill.
1. Taksonomi
Kingdom : Plantae (Tumbuhan)
Subkingdom : Tracheobionta (Tumbuhan berpembuluh)
Super Divisi : Spermatophyta (Menghasilkan biji)
Divisi : Magnoliophyta (Tumbuhan berbunga)
Kelas : Magnoliopsida (berkeping dua / dikotil)
Sub Kelas : Magnoliidae
Ordo : Laurales
Famili : Lauraceae
Genus :Persea
Spesies :Persea americanaMill. (Proseanet, 2012)
2. Sinonim
Laurus persea L, Persea drymifolia Schlecht. and cham, Persea
gratissimaC.F. Gaertn. Persea edulisRaf.,Persea nubigena, Persea steyermarkii
C.K. Allen(Lim, 2012).
3. Nama lain
Adpukat, avokad (Indonesia), avocado (Filipina), Avocado (Amerika),
alligator pear, avocado, avocado-pear, butter fruit (Inggris), avocat, avocatier,
apukado, avokado, buah mentega (Malaysia), aguacate, pagua (Spanyol),
awokado (Thailand) (World Agroforestry Centre, 2002).
4. Morfologi
P.americana merupakan jenis pohon berkayu menahun (perennial) dan
memiliki ukuran sedang sampai besar, dengan tinggi mencapai 20 m. Tumbuhan
ini memiliki daun tunggal dan memiliki tepi daun rata. Daun berbentuk elips
hingga lanset, bulat telur hingga bulat telur sungsang, dengan panjang daun 5-40
cm dan lebar 3-15 cm, permukaan atas daun terdapat selaput lilin. Bentuk bunga
berupa tongkol majemuk yang muncul di ujung cabang. Bunga dari P.americana
ini tergolong bunga banci tersusun atas 3 daun mahkota. Buah besar berdaging
dan berair, berbiji tunggal, permukaan buah halus, panjang 7-20 cm. Buah besar
dan bulat, dilapisi dua lapisan dan dua kotiledon besar yang melindungi embrio
kecil (Proseanet, 2012).
5. Kandungan kimia
Kandungan fitokimia pada tanaman alpukat (P.americana) memiliki
kadar yang berbeda-beda pada setiap bagiannya. Beberapa kandungan fitokimia
penting yang ditemukan dalam tanaman ini antara lain, kandungan saponin,
flavonoid, tanin, alkaloid, glikosida sianogenik, steroid dan fenol (Arukwe dkk,
2012).
6. Khasiat dan kegunaan
Di Nigeria, ekstrak biji P. americana digunakan untuk mengobati
hipertensi. Penelitian Anaka, dkk. (2009) melaporkan bahwa ekstrak biji P.
digunakan secara tradisional sebagai pengobatan penyakit kulit yang disebabkan
oleh parasit di Nigeria (Owolabi, Jaja, dan Coker, 2005). Penelitian Idris, dkk.
(2009) melaporkan ekstrak biji P. americana memiliki kemampuan sebagai
antimikrobia. Daun P. americanamemiliki kemampuan menyembuhkan penyakit
diabetes melitus, sedangkan biji P. americanasebagai anti radang dan
menghilangkan rasa sakit (Haryanto, 2009). Menurut penelitian yang dilakukan
Malangngi, dkk. (2012), dilaporkan ekstrak etanol biji P.americana memiliki
kandungan antioksidan yang dapat menangkap radikal bebas DPPH. Alpukat
diketahui memiliki kegunaan sebagai tanaman obat yaitu untuk menyembuhkan
luka dan menstimulasi pertumbuhan rambut, sebagai aprodisiaka, dan mengobati
disentri serta diare (DerMarderosin dan Beutler, 2002).
B. Ginjal 1. Anatomi dan fisiologi ginjal
Ginjal merupakan sepasang organ bersimpai yang berfungsi menyaring
darah dan terletak di daerah retroperitoneum pada dinding posterior abdomen.
Ginjal dialiri sekitar 25% curah jantung. Ekskresi produk sisa metabolisme,
pengendalian air dan garam, pemeliharaan keseimbangan asam dan basa, serta
sekresi berbagai hormon dan autokoid merupakan fungsi penting dari ginjal
(Robbins dan Cotran, 2007).
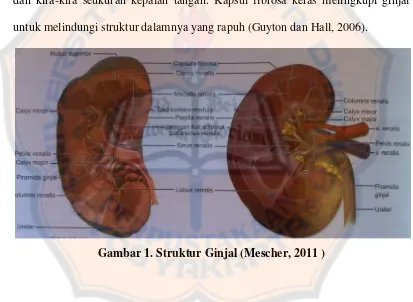
Ginjal memiliki sisi medial cekung, yaituhilusyang memiliki permukaan
lateral cembung yang dilapisi oleh suatu simpai fibrosa tipis. Hilus berfungsi
pembuluh darah dan pembuluh limfe. Ginjal memiliki korteks di bagian luar dan
medula di bagian dalam. Medula ginjal terdiri dari 8-15 struktur berbentuk
kerucut yang disebut piramida ginjal. Piramida ginjal ini dipisahkan oleh
penjuluran korteks yang disebut columna renalis. Setiap piramida medula dan
jaringan korteks di dasarnya dan sepanjang sisinya membentuk suatu lobus
(Gambar 1) (Mescher, 2011). Pada orang dewasa berat ginjal mencapai 150 gram
dan kira-kira seukuran kepalan tangan. Kapsul fibrosa keras melingkupi ginjal
untuk melindungi struktur dalamnya yang rapuh (Guyton dan Hall, 2006).
Gambar 1. Struktur Ginjal (Mescher, 2011 )
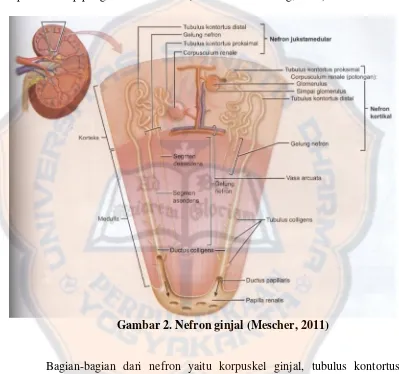
Satuan anatomis fungsi ginjal adalah nefron. Nefron tersusun atas
korpuskulus ginjal, tubulus kontortus proksimal, segmen tebal dan tipis ansa
Henle, tubulus kontortus distal, serta ductus colligens (Gambar 2) (Junqueira,
Carneiro, dan Kelley, 2005). Glomerulus berfungsi sebagai tempat darah disaring,
sedangkan tubulus ginjal berfungsi sebagai tempat air dan garam dalam filtrat
merupakan tempat dimana sekitar 80% elektrolit dan air diserap kembali. Ansa
henle dan tubulus kontortus distal serta ductus colligens merupakan tempat
pemekatan urin dan tempat terjadinya perubahan pada elektrolit dan air sebagai
respon terhadap pengaturan hormonal (McPhee dan Ganong, 2007).
Gambar 2. Nefron ginjal (Mescher, 2011)
Bagian-bagian dari nefron yaitu korpuskel ginjal, tubulus kontortus
proksimal, segmen tebal dan tipis ansa Henle, tubulus kontortus distal, serta
ductus colligens,akan dijelaskan sebagai berikut :
a. Kospuskel ginjal dan filtrasi darah. Pada setiap nefron terdapat sebuah
korpuskel ginjal dengan diameter sekitar 200µm dan mengandung seberkas
kapiler yang disebut glomerulus. Glomerulus ini dikelilingi oleh simpai
Glomerulus tersusun atas arteriol aferen dan eferen serta suatu berkas
kapiler diantaranya yang dilapisi oleh sel endotel. Glomerulus ini dibungkus oleh
sel epitel yang membentuk suatu lapisan yang berhubungan dengan lapisan yang
membentuk simpai Bowman dan tubulus ginjal. Ruang antara kapiler-kapiler di
glomerulus disebut mesangium. Di antara sel epitel dan kapiler terdapat zat yang
membentuk suatu membran basal (McPhee dan Ganong, 2007). Glomerulus
berhubungan dengan kapsula Bowman di bagian dalam melalui lapisan viseral.
Lapisan viseral ini tersusun oleh modifikasi sel-sel epitel yang disebut podosit.
Ruang Bowman dikelilingi oleh dinding luar yang tersusun oleh sel-sel epitel
skuamous simpleks yang membentuk lapisan parietal (Gartner dan Hiatt, 2007).
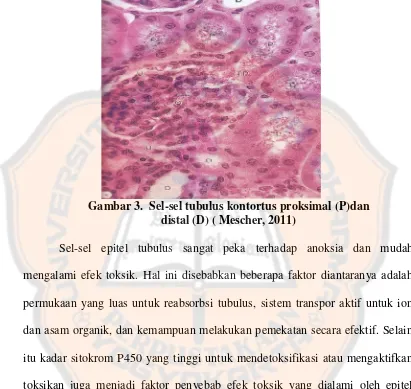
b. Tubulus kontortus proksimal. Epitel skuamosa pada lapisan parietal simpai
Bowman berhubungan langsung dengan epitel kuboid pada tubulus kontortus
proksimal (Gambar 3). Tubulus berlekuk ini lebih sering tampak pada potongan
korteks ginjal karena berukuran lebih panjang dari tubulus kontortus distal. Sel
tubulus proksimal berfungsi mereabsorpsi sebanyak 60-65% air yang disaring
dalam korpuskel ginjal, beserta hampir semua nutrien, ion, vitamin dan protein
plasma kecil. Dinding tubulus akan mengangkut air dan dan zat terlarut secara
langsung dan segera diambil olehkapiler peritubular( Mescher, 2011).
Adanya sejumlah besar mitokondria pada tubulus proksimal
menyebabkan sel-sel pada tubulus proksimal memiliki sitoplasma asidofilik.
Kemampuan mereabsorbsi dari tubulus kontortus proksimal didukung oleh adanya
banyak mikrovili berukuran panjang, yang membentuk suatu brush border. Pada
tampak terisi serabut. Kapiler dan komponen mikrovaskular lain banyak dijumpai
pada jaringan ikat sekitar ( Mescher, 2011).
Gambar 3. Sel-sel tubulus kontortus proksimal (P)dan distal (D) ( Mescher, 2011)
Sel-sel epitel tubulus sangat peka terhadap anoksia dan mudah
mengalami efek toksik. Hal ini disebabkan beberapa faktor diantaranya adalah
permukaan yang luas untuk reabsorbsi tubulus, sistem transpor aktif untuk ion
dan asam organik, dan kemampuan melakukan pemekatan secara efektif. Selain
itu kadar sitokrom P450 yang tinggi untuk mendetoksifikasi atau mengaktifkan
toksikan juga menjadi faktor penyebab efek toksik yang dialami oleh epitel
tubulus(Robbins dan Cotran, 2007; Katzung, 2002).
c. Gelung nefron (ansa Henle). Setelah tubulus kontortus proksimal akan
tampak adanya tubulus lurus yang lebih pendek dan memasuki medula
membentuk gelung nefron. Ansa Henle merupakan struktur berbentuk U dengan
epitelkuboid di dekat korteks, namun berupa epitel skuamosa di dalam medula
(Mescher, 2011).
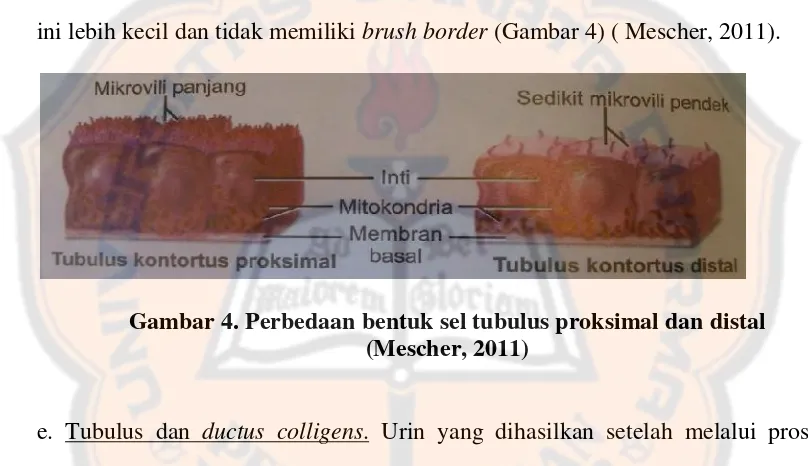
d. Tubulus kontortus distal dan aparatus jukstaglomerulari. Saat memasuki
korteks, segmen tebal asendens gelung nefron menjadi lurus dan kemudian
berkelok-kelok membentuk tubulus kontortus distal. Selapis sel kuboid tubulus
kontortus distal berbeda dengan tubulus kontortus proksimal. Sel kuboid tubulus
ini lebih kecil dan tidak memilikibrush border(Gambar 4) ( Mescher, 2011).
Gambar 4. Perbedaan bentuk sel tubulus proksimal dan distal (Mescher, 2011)
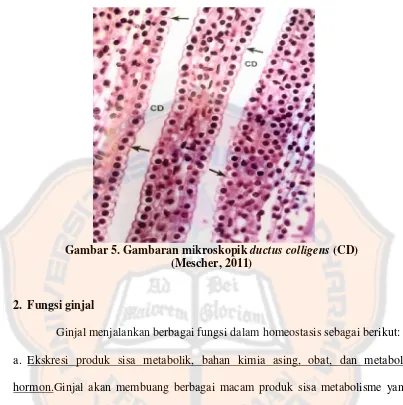
e. Tubulus dan ductus colligens. Urin yang dihasilkan setelah melalui proses
filtrasi dan reabsorbsi akan diekskresikan. Urin tersebut mengalir melalui tubulus
kontortus distal hingga sampai ke tubuluscolligens. Tubuluscolligensmerupakan
bagian akhir setiap nefron yang saling bergabung membentuk ductus colligens
yang berukuran lebih besar dan lebih lurus, berjalan di tepi piramidal ginjal dan
bermuara ke dalamcalyx minor (Gambar 2). Epitel kuboid berdiameter sekitar 40
µm melapisi tubulus colligens. Sel-sel ductus colligens yang berkonvergensi
berbentuk kolumnar dan diameter ductus mencapai 200µm di dekat puncak
Gambar 5. Gambaran mikroskopikductus colligens(CD) (Mescher, 2011)
2. Fungsi ginjal
Ginjal menjalankan berbagai fungsi dalam homeostasis sebagai berikut:
a. Ekskresi produk sisa metabolik, bahan kimia asing, obat, dan metabolit
hormon.Ginjal akan membuang berbagai macam produk sisa metabolisme yang
tidak dibutuhkan lagi oleh tubuh. Produk-produk tersebut antara lain urea (dari
metabolisme asam amino), kreatinin (dari kreatin otot), asam urat (dari asam
nukleat), produk akhir pemecahan hemoglobin (seperti bilirubin), dan metabolit
berbagai hormon.
b. Pengaturan keseimbangan air dan elektrolit.Fungsi homeostatis tubuh diatur
oleh ginjal dengan mengatur ekskresi air dan elektrolit sesuai dengan asupannya.
Asupan air dan banyak elektrolit terutama ditentukan oleh kebiasaan makan
seseorang. Dengan demikian ginjal harus mengatur kecepatan ekskresi sesuai
dalam tubuh, maka ginjal akan mengatasinya dengan meningkatkan ekskresi
sampai keseimbangan antara asupan dan keluaran natrium tercapai kembali.
c. Pengaturan tekanan arteri. Ginjal mengatur tekanan arteri jangka panjang
dengan mengekskresikan sejumlah natrium dan air. Selain itu ginjal juga turut
mengatur tekanan arteri jangka pendek dengan mengekskresikan faktor atau zat
vasoaktif, seperti renin, yang menyebabkan pembentukan vasoaktif lainnya,
misalnya angiotensin II.
d. Pengaturan keseimbangan asam-basa. Pengaturan keseimbangan asam-basa
oleh ginjal dilakukan bersama dengan paru dan sistem dapar cairan tubuh, dengan
cara mengekskresikan asam dan mengatur penyimpanan dapar cairan tubuh.
e. Pengaturan produksi eritrosit. Ginjal berperan dalam sekresi eritropoetin, yang
merangsang pembentukan sel darah merah. Hipoksia merupakan salah satu
rangsangan yang penting untuk sekresi eritropoetin oleh ginjal .
f. Sintesis glukosa. Ginjal mensintesis glukosa dari asam amino dan prekursor
lainnya selama masa puasa yang panjang, proses ini disebut glukoneogenesis.
Kapasitas ginjal untuk menambahkan glukosa pada darah selama masa puasa yang
panjang dapat menyaingi hati.
g. Pengaturan produksi 1,25-dihidroksivitamin D3.Ginjal menghasilkan bentuk
aktif vitamin D, yaitu 1,25-dihidroksivitamin D3(kalsitriol). Kalsitriol penting
untuk deposit kalsium yang normal dalam tulang dan reabsorpsi kalsium oleh
3. Kerusakan ginjal
Penyakit yang terjadi pada ginjal sangat kompleks, sehingga untuk
memahaminya dapat disederhanakan dengan membagi penyakit ginjal
berdasarkan empat komponen morfologik dasar ginjal yaitu glomerulus, tubulus,
interstisium dan pembuluh darah. Sebagian besar penyakit pada glomerulus
disebabkan oleh proses imunologik, sedangkan penyakit pada tubulus dan
interstisium sering disebabkan oleh bahan toksik atau infeksi.
a. Penyakit glomerulus. Glomerulonefritis kronis merupakan penyebab tersering
gagal ginjal kronik. Glomerulus dapat mengalami cedera sebagai akibat berbagai
faktor dalam suatu perjalanan penyakit sistemik, misalnya lupus eritematosus,
hipertensi, diabetes melitus. Penyakit glomerulonefritis dibagi menjadi sindrom
nefrotik akut, glomerulonefritis progresif cepat, sindrom nefrotik, gagal ginjal
kronik dan hematuria atau proteinuria asimtomatik.
b. Penyakit yang mengenai tubulus dan interstisium. Penyakit yang mengenai
kedua komponen ini yaitu cedera tubulus iskemik atau toksik yang menyebabkan
Nekrosis Tubulus Akut (NTA) dan gagal ginjal akut serta reaksi peradangan di
tubulus dan interstisium (nefritis tubulointerstisium).
c. Penyakit pembuluh darah. Adanya penyakit vaskular sistemik dapat
mengenai pembuluh darah ginjal. Penyakit yang menyerang bagian pembuluh
darah ginjal yaitu nefrosklerosis jinak, hipertensi maligna dan nefrosklerosis
akseleratif, steanosis arteri renalis, serta mikroangiopati trombolitik (Robbin dan
Gagal ginjal akut ditandai oleh naiknya kreatinin serum dengan cepat.
Penyebab gagal ginjal akut dibagi menjadi prerenal, renal, dan postrenal. Aliran
darah cukup tinggi terjadi pada ginjal yaitu 20% curah jantung, namun ginjal
rentan terhadap iskemia. Faktor-faktor yang menyebabkan kerusakan sel ginjal
iskemik atau akibat toksin termasuk kekurangan adenosin trifosfat seluler dan
pembentukan radikal bebas. Penyebab gagal ginjal akut lainnya yaitu
glomerulonefritis dan obat-obatan nefrotoksik (Rubenstein, Wayne, dan Bradley
2007).
Pada penyakit gagal ginjal kronik atau gagal ginjal akut, fungsi
homeostatik ginjal terganggu, dan kemudian terjadi abnormalitas komposisi dan
volume cairan tubuh yang berat dan cepat. Dalam beberapa hari saja dapat terjadi
akumulasi kalium, asam, cairan, dan zat-zat lainnya dalam tubuh sehingga
menyebabkan kematian, kecuali ada intervensi klinis seperti hemodialisis untuk
memulihkan (paling tidak sebagian) keseimbangan cairan tubuh dan elektrolit
(Guyton dan Hall, 2006).
C. Kreatinin
Kreatinin merupakan hasil metabolisme kreatin. Setiap hari kreatin
disintesis terutama oleh hati dan sedikit oleh pankreas serta ginjal. Kreatin
terdapat dalam hampir semua otot rangka dan terikat secara reversibel pada fosfat
dalam bentuk fosfokreatin. Fosfokreatin ini merupakan senyawa penyimpan
energi. Sebagian kecil dari kreatin secara irreversibel berubah menjadi kreatinin
yang tidak mempunyai fungsi dan akan diangkut ke ginjal untuk diekskresikan
Kreatinin akan dilepaskan secara konstan dari otot dan ekskresi utamanya
melalui filtrasi glomerulus. Pada kegagalan ginjal kronis, ketika terjadi penurunan
kecepatan filtrasi glomerulus, kadar kreatinin akan meningkat berbanding terbalik
dengan kecepatan ekskresi (Huether, McCance, Brashers, dan Rote, 2008).
Setelah mengalami filtrasi pada glomerulus, kreatinin tidak akan direabsorpsi oleh
tubulus ginjal. Serum kreatinin dapat digunakan sebagai metode untuk
menentukan Glomerulus Filtration Rate (GFR) dan luasnya kerusakan ginjal
secara tidak langsung pada kerusakan ginjal kronis (Porth dan Matfin, 2009).
Macam metode pemeriksaan kreatinin darah yaitu :
a.Jaffe reaction.Metode ini didasarkan pada adanya reaksi antara kreatinin dan
asam pikrat dalam suasana basa akan membentuk senyawa kuning jingga. Warna
yang dihasilkan akan dibaca oleh alat photometer.
b. Kinetik. Prinsip dasar penggunaan metode ini relatif sama dengan metode
Jaffe reaction, hanya dalam pengukuran dibutuhkan sekali pembacaan. Alat
yang digunakanautoanalyzer.
c. Enzimatik. Penggunaan metode ini didasarkan pada adanya substrat dalam
sampel bereaksi dengan enzim membentuk senyawa enzim substrat dengan
menggunakan alat photometer (Price and Wilson, 1985).
D. Nefrotoksisitas 1. Faktor penyebab nefrotoksisitas
Beberapa faktor yang berkontribusi terhadap kerentanan ginjal pada
a. Tingginya aliran darah pada ginjal.Aliran darah pada sebuah organ hanya
kurang dari 1% dari berat tubuh, tetapi ginjal menerima sekitar 25% aliran darah
dari jantung. Oleh sebab itu ginjal akan menerima konsentrasi toksikan yang lebih
tinggi (per gram jaringan) dibanding jaringan yang diperfusi lambat oleh darah
seperti otot skelet, kulit dan lemak. Distribusi aliran darah renal tidak merata,
dimana korteks menerima aliran darah tidak proporsional dengan yang diterima
oleh medula dan papila. Karena itu, toksikan yang terbawa oleh darah akan lebih
banyak tertuju pada bagian korteks dan berpotensi mempengaruhi fungsi kortikal
lebih besar daripada medula dan papila.
b. Konsentrasi senyawa kimia di cairan intraluminal. Proses pemekatan urin pada
ginjal berpotensi menyebabkan terjadinya pemekatan senyawa toksik pada filtat
glomerular. Proses reabsorpsi sepanjang nefron dapat meningkatkan konsentrasi
intraluminal toksikan dari 10mM menjadi 50mM pada bagian tubulus proksimal
ginjal, 66mM pada lengkung henle, 200mM pada tubulus distal, dan sebesar 2000
mM pada duktus pengumpul. Untuk senyawa toksik yang memiliki kelarutan
rendah akan mengalami presipitasi intraluminal sehingga menyebabkan gagal
ginjal akut sekunder bahkan obstruksi. Gradien konsentrasi berpotensi
menimbulkan terjadinya difusi pasif toksikan kedalam sel-sel tubulus.
c. Reabsorpsi dan /atau sekresi senyawa kimia melalui sel-sel tubulus. Proses
transpor aktif di tubulus proksimal dapat menyebabkan peningkatan konsentrasi
intraseluler dari suatu toksikan yang aktif untuk ditransportasikan. Selama proses
tubulus proksimal dengan kadar yang sangat tinggi dibanding dengan yang berada
di cairan luminal atau daerah peritubular.
d. Biotransformasi dari pro-toksikan menjadi intermediet yang reaktif.Nefron
memiliki kapasitas untuk memetabolisme pada segmen tertentu. Tubulus
kontortus proksimal dan tubulus kontortus distal mengandung isoenzim dari
sistem sitokrom P450 monooksigenase yang dapat memediasi bioaktivasi
intrarenal dari beberapa pro-toksikan. Ditambah lagi aktivitas sintesis
prostaglandin di sel interstitial medula dan papila dapat turut andil dalam
menyebabkan oksidasimenghasilkan kerusakan yang selektif pada papiler
(Hodgson, 2010).
2. Nefrotoksikan
Banyak senyawa memiliki implikasi sebagai nefrotoksikan seperti
terlihat pada Tabel I.
Tabel I.Senyawa-senyawa yang bersifat nefrotoksikan (Hodgson, 2010)
E. Karbon Tetraklorida
Karbon tetraklorida merupakan suatu senyawa model nefrotoksik yang
dapat menyebabkan Nekrosis Tubuler Akut (NTA). Radikal bebas yang
dihasilkan dapat mengakibatkan kerusakan pada tubulus proksimal ginjal
(Robbins dan Cotran, 1997). Kerusakan yang terjadi pada tubulus proksimal ginjal
tidak disertai dengan kerusakan membran basalis sehingga memungkinkan untuk
terjadinya regenerasi sel epitelnya. Karena itu, Nekrosis Tubular Akut (NTA)
yang disebabkan karbon tetraklorida bersifat reversibel (dapat balik) (Underwood,
2000; Cotran dan Robbin, 1994).
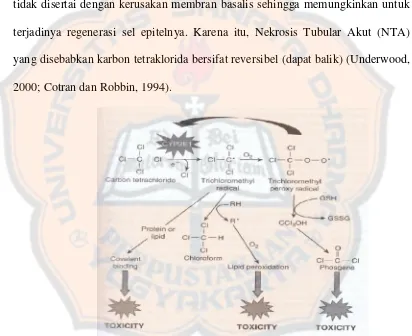
Gambar 6. Mekanisme biotransformasi dan oksidasi karbon tetraklorida (Timbrell, 2008)
Dalam tubuh karbon tetraklorida akan mengalami proses metabolisme
oleh enzim sitokrom P450 khususnya isoenzim CYP2E1. Enzim pemetabolisme
ini dapat mempengaruhi aktivasi metabolit dari senyawa yang terbentuk, sehingga
metabolisme karbon tetraklorida, isoenzim CYP2E1 berfungsi sebagai agen
pereduksi dan mengkatalis adisi elekron yang mengakibatkan hilangnya satu ion
klorin sehingga terbentuk radikal bebas triklorometil (•CCl3) (Gambar 6) yang
merupakan metabolit reaktif. Radikal bebas triklorometil ini akan berubah
menjadi radikal bebas triklorometilperoksi (•OOCCl3) dengan adanya O2
(oksigen), dimana radikal bebas dalam bentuk ini menjadi lebih reaktif (Gregus
dan Klaaseen, 2001). Phosgen yang terbentuk dari reaksi pada gambar 2
merupakan suatu intermediet yang sangat reaktif dan dapat bereaksi dengan
makromolekul seluler untuk menginduksi terjadinya kerusakan sel (Hodgson,
2010).
Karbon tetraklorida juga dapat mempengaruhi fungsi mitokondria ginjal,
termasuk menyebabkan efluks kalsium melintasi membran mitokondria
(Natarajan, Basivireddy, Ramachandran, Thomas, Ramamoorthy, dan Pulimood,
2006). Radikal reaktif yang terbentuk dapat berikatan kovalen dengan dengan
makromolekul jaringan, yang menyebabkan jaringan mengalami kerusakan
(Eaton, Gallogher, Bammler, dan Kunze, 1995).
F. Antioksidan
Antioksidan merupakan suatu senyawa kimia yang dapat mencegah
oksidasi suatu substrat misalnya sel pada konsentrasi yang rendah (Halliwell,
1990). Berdasarkan sumbernya antioksidan dibagi dua yaitu antioksidan endogen
dan antioksidan eksogen. Antioksidan endogen merupakan antioksidan yang
dihasilkan oleh tubuh yang terdiri atas enzim-enzim superoksida dismutase,
antioksidan non enzimatik seperti glutation (GSH) dan transferin. Antioksidan
eksogen adalah antioksidan yang dibutuhkan dan diperoleh dari luar seperti
senyawa-senyawa flavonoid, vitamin C, vitamin E dan karotenoid yang banyak
ditemukan dalam sayur-sayuran dan buah-buahan (Heinonen dan Albanes,1994).
G. Ekstraksi
Ekstrak adalah sediaan kering, kental atau cair yang dibuat dengan
menyari simplisia, diluar cahaya matahari langsung. Cairan penyari yang dapat
digunakan dalam pembuatan ekstrak yaitu air, eter, etanol, atau campuran etanol
dan air (Badan Pengawas Obat dan Makanan RI, 2010). Pada akhir proses
ekstraksi semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang
tersisa diperlakukan sedemikian rupa hingga memenuhi baku yang telah
ditetapkan (Badan Pengawasan Obat dan Makanan Republik Indonesia, 2005).
Istilah maserasi berasal dari bahasa latin ”macerare” yang artinya
mengairi, melunakkan (Voigt, 1994). Metode maserasi adalah salah satu metode
ekstraksi sederhana yang dilakukan dengan cara merendam serbuk simplisia
dalam cairan penyari selama beberapa hari pada temperatur kamar dan terlindung
dari cahaya sambil diaduk (Badan Pengawasan Obat dan Makanan Republik
Indonesia, 2010). Rendaman tersebut disimpan dan harus terlindungi dari cahaya
langsung untuk mencegah reaksi yang dikatalisis cahaya atau perubahan warna,
sambil sesekali digojog. Penggojogan dilakukan untuk mencegah terjadinya
keseimbangan antara larutan zat aktif yang terdapat dalam sel dengan larutan zat
aktif yang terdapat diluar butir sel, sehingga perpindahan bahan aktif dapat terus
Indonesia, 1986). Keadaan diam tanpa penggojokan selama maserasi
menyebabkan turunnya perpindahan bahan aktif. Semakin besar perbandingan
simplisia yang diekstraksi terhadap cairan ekstraksi, akan semakin baik hasil yang
diperoleh (Voight, 1994).
Dengan metode ini, cairan penyari akan masuk ke dalam sel melewati
dinding sel sehingga isi sel akan larut akibat perbedaan konsentrasi antara larutan
di dalam sel dengan di luar sel. Larutan dengan konsentrasi tinggi akan terdesak
keluar dan diganti oleh cairan penyari dengan konsentrasi rendah (proses difusi).
Peristiwa tersebut terjadi secara berulang hingga terjadi keseimbangan konsentrasi
antara larutan di luar sel dan di dalam sel. Selanjutnya endapan dipisahkan dan
filtrat dipekatkan (Direktorat Jenderal Pengawasan Obat dan Makanan Republik
Indonesia, 1986).
Lamanya proses maserasi adalah berbeda-beda. Farmakope
mencantumkan 4-10 hari, namun pada umumnya 5 hari. Setelah waktu tersebut
keseimbangan antara bahan yang diekstraksi pada bagian dalam sel dengan luar
sel telah tercapai. Remaserasi merupakan metode ekstraksi dengan melakukan
pengulangan penambahan pelarut setelah dilakukan penyaringan maserat pertama,
dan seterusnya. Pelarut kedua ditambahkan sebanyak penambahan pelarut pertama
(Depkes RI, 2000).
Etanol dipertimbangkan sebagai penyari karena lebih selektif, kapang
dan bakteri sulit tumbuh dalam etanol 20% ke atas, tidak beracun, netral,
absorbsinya baik. Etanol dapat dicampur dengan air pada berbagai perbandingan.
akan lebih sedikit. Untuk meningkatkan penyarian, biasanya digunakan campuran
antara etanol dan air dalam berbagai perbandingan tergantung pada bahan yang
akan disari (Voight, 1994).
H. Landasan Teori
Ginjal merupakan organ yang berfungsi menyaring darah. Fungsi
penting ginjal antara lain dalam ekskresi produk sisa metabolisme, pengendalian
air dan garam, pemeliharaan keseimbangan asam dan basa, serta sekresi berbagai
hormon dan autokoid (Robbins dan Cotran, 2007).Ginjal menerima sekitar 20%
aliran darah dari jantung, namun ginjal rentan terhadap iskemia. Beberapa
penyebab kerusakan sel ginjal yaitu terjadinya iskemik, adanya toksin,
kekurangan adenosin trifosfat seluler(ATP seluler), dan pembentukan radikal
bebas. Penyebab gagal ginjal akut lainnya yaitu glomerulonefritis dan obat-obatan
nefrotoksik (Rubenstein dkk., 2007). Pengukuran kuantitatif kerusakan ginjal
dapat dilakukan dengan mengukur kadar kreatinin yang pada kegagalan ginjal
akan ditahan bersama unsur nitrogen non-protein darah (Baron,1992).
Karbon tetraklorida akan dimetabolisme oleh enzim sitokrom P-450
menjadi radikal bebas triklorometil (•CCl3) dan triklorometilperoksida
(•OOCCl3) yang lebih reaktif. Radikal reaktif yang terbentuk dapat berikatan
kovalen dengan makromolekul jaringan, yang menyebabkan jaringan mengalami
kerusakan (Eaton dkk.,1995).
Pemberian antioksidan dapat melindungi jaringan dari pengaruh radikal
memperlambat proses perjalanan penyakit kronis seperti gagal ginjal kronis (Lai,
Chou dan Chao, 2001 ; Gulcin, Oktay, Kirecci dan Aslam, 2003). Senyawa tanin
yang yang diperoleh dari ekstraksi biji P. americana dengan pelarut etanol oleh
Malangngi dkk. (2012) menunjukkan kemampuan sebagai antioksidan yang dapat
menangkap radikal bebas DPPH. Selain itu, pada penelitian yang dilakukan
Kosinka dkk. (2012) dengan melakukan ekstraksi biji P. americana dengan
pelarut metanol diperoleh aktivitas antioksidan dari kandungan fenolik dalam
menangkap radikal bebas DPPH dan ABST. Penelitian ini dilakukan untuk
membuktikan kemampuanproteksi P. americanaterhadap kerusakan ginjal akibat
adanya radikal bebas yang dihasilkan oleh karbon tetraklorida.
I. Hipotesis
Pemberian jangka panjang ekstrak etanol bijiP. americanamemiliki efek
sebagai nefroprotektif dengan menurunkan kadar kreatinin serum dan gambaran
27 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk jenis penelitian eksperimental murni dengan
rancangan acak lengkap pola searah.
B. Variabel dan Definisi Operasional 1. Variabel utama
a. Variabel bebas. Variabel bebas dalam penelitian ini adalah dosis
ekstrak etanol biji P. americana.
b. Variabel tergantung. Variabel tergantung penelitian ini adalah kadar
kreatinin serum dan gambaran histologis ginjal akibat pemberian jangka panjang
ekstrak etanol biji P.americanapada tikus jantan galur Wistar terinduksi karbon
tetraklorida.
2. Variabel pengacau
a. Variabel pengacau terkendali. Variabel pengacau terkendali dalam
penelitian ini adalah kondisi hewan uji, yaitu tikus jantan galur Wistar dengan
berat badan 150-250 gram dan umur 2-3 bulan. Frekuensi pemberian ekstrak
etanol biji P. americanasatu kali sehari selama enam hari berturut-turut dengan
waktu pemberian yang sama, cara pemberian senyawa pada tikus dilakukan secara
P.americana yang diperoleh dari daerah Padang, Sumatera Barat, diambil pada
bulan Januari 2013.
b. Variabel pengacau tak terkendali. Variabel pengacau tak terkendali
dalam penelitian ini adalah kondisi patologis dari tikus jantan galur Wistar yang
digunakan. .
3. Definisi operasional
a. BijiP.americana. Biji yang diambil dari tanaman P.americanaadalah
yang berwarna kuning segar, tidak bercacat dan diambil dari buah yang telah
matang.
b. Ekstrak etanol biji P.americana. Ekstrak etanol biji P.americana
adalah ekstrak kental yang diperoleh secara maserasi dengan merendam serbuk
kering biji P.americana seberat 40,0 g dalam 200 mL pelarut etanol 70% selama
lima hari, lalu diremaserasi selama dua hari. Kemudian disaring menggunakan
corongBuchner, dievaporasilalu diuapkan dengan waterbath selama 10 jam pada
suhu 800C, hingga diperoleh selisih bobot penimbangan adalah 0.
c. Dosis ekstrak etanol biji P. americana.Didefinisikan sebagai jumlah
(mg) ekstrak kental tiap kilogram (kg) berat badan tikus.
d. Kadar kreatinin(mg/dL). Didefinisikan sebagai jumlah kreatinin (mg)
dalam tiap satu desiliter (dL) darah subjek uji.
e. Penurunan kadar kreatinin serum. Didefinisikan sebagai kemampuan
ekstrak etanol biji P. americanapada dosis tertentu untuk menurunkan kadar
f. Pemberian jangka panjang. Didefinisikan sebagai pemberian ekstrak
etanol biji P. americana satu kali sehari selama enam hari berturut-turut secara
peroral.
g. Gambaran histologis ginjal. Didefinisikan sebagai gambaran
mikroskopik sel-sel ginjal tikus setelah perlakuan.
C. Bahan Penelitian 1. Bahan utama
a. Hewan uji yang digunakan yaitu tikus jantan galur Wistar dengan umur 2-3
bulan dan berat badan 150-250 gram yang diperoleh dari Laboratorium
Imono Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
b. Serbuk biji P.americanayang diperoleh dari daerah Padang, Sumatera Barat
pada bulan Januari 2013.
2. Bahan kimia
a. Bahan nefrotoksin yang digunakan adalah karbon tetraklorida yang diperoleh
dari laboratorium Kimia Analisis Fakultas Farmasi Universitas Sanata
Dharma Yogyakarta.
b. Etanol 70% yang digunakan sebagai cairan penyari dalam proses ekstraksi
serbuk bijiP.americanayang diperoleh daritoko kimia Aldrich.
c. Bahan untuk pembuatan preparat histologis ginjal adalah larutan fisiologis
d. Aqua bidestilata untuk blanko pengujian kadar kreatinin, yang diperoleh
dari Laboratorium Kimia Analisis Instrumental Fakultas Farmasi
Universitas Sanata Dharma Yogyakarta.
e. Kontrol serum Kreatinin Cobas® (PreciControl ClinChem Multi 2)
Roche/Hitachi analyzer
f. Reagen serum kreatinin
Komposisi dan konsentrasi dari reagen serum kreatinin adalah sebagai
berikut :
Tabel II.Komposisi dan konsentrasi reagen serum kreatinin
g. Olive oilBertolli ®
D. Alat atau Instrumen Penelitian 1. Alat ekstraksi
Seperangkat alat gelas berupa bekker glass, erlenmeyer, gelas ukur, labu
ukur, cawan porselen, corong Buchner, pipet tetes, batang pengaduk (Pyrex Iwaki
Glass®). Ayakan No. 40 Electric Sieve Shaker Indotest 28 Multi Lab®, alumunium foil, timbangan analitik Mettler Toledo®, rotary vacuum evaporator IKAVAC®, waterbathdan desikator.
2. Alat uji nefroprotektif
Seperangkat alat gelas berupa Bekker glass, tabung reaksi, labu ukur,
batang pengaduk (Pyrex Iwaki Glass®), pipet gondok, glass firn. Timbangan
elektrik Mettler Toledo®, sentrifuge Centurion Scientific®, vortex Genie Reagen I Sodium Hidroxide 0,2mol/L
Wilten®, spuit per oral dan syringe 3 mL Terumo®, spuit ip. dan syringe 1 mL
Terumo®, pipa kapiler, tabungEppendorf, Microlab 200 Merck®.
E. Tata Cara Penelitian
1. Determinasi serbuk bijiP. americana
Determinasi serbuk bijiP. americana dilakukan dengan mencocokan
ciri-ciri organoleptis dan mikrokopis serbuk biji yang diperoleh dari Padang dengan
serbuk biji dari sampel otentik tanaman P. americanayang dibuat secara mandiri
di Laboratorium Farmakognosi Fitokimia.
2. Pembuatan serbuk
Biji P. americana dicuci bersih menggunakan air mengalir dan bagian
kulit ari biji alpukat tersebut dibuang. Biji yang telah dicuci kemudian dipotong
kecil-kecil dan diangin-anginkan hingga biji tidak tampak basah. Kemudian
dilanjutkan dengan pengeringan menggunakan oven pada suhu 50˚C selama 24
jam, lalu diblender. Serbuk inilah yang akan dibandingkan dengan serbuk yang
diperoleh dari daerah Padang.
3. Pengumpulan bahan
Bahan uji yang digunakan adalah biji P. americana yang sudah dalam
bentuk serbuk berwarna kecoklatan, diperoleh dari wilayah Padang,Sumatera
Barat.
4. Penetapan kadar air serbuk bijiP. americana
Penetapan kadar air dilakukan dengan alat moisture balance Halogen
ditimbang dan dihitung sebagai bobot sebelum pemanasan. Sebanyak 5 g serbuk
bijiP.americanadimasukkan ke dalam alatmoisture balance, kemudian diratakan.
Serbuk dipanaskan pada suhu 1050C selama 15 menit. Kemudian serbuk ditimbang ulang dan dihitung sebagai bobot sesudah pemanasan. Selisih bobot
sebelum pemanasan dan sesudah pemanasan merupakan kadar air dari serbuk
yang diteliti.
5. Pembuatan ekstrak etanol bijiP. americana
Ekstraksi dilakukan dengan metode maserasi yaitu dengan merendam 40
g serbuk biji P. americana dalam 200 mL pelarut etanol 70 % selama 5 hari
terlindung dari cahaya matahari, sambil sesekali digojog. Lalu hasil maserasi
disaring untuk memisahkan maserat dari serbuk dengan menggunakan corong
Buchner yang dilapisi kertas saring. Kemudian serbuk hasil penyaringan tersebut
diremaserasi dengan pelarut baru sebanyak 200 mL selama 2 hari lalu disaring
kembali ( Badan Pengawas Obat dan Makanan RI, 2010). Maserat kemudian
dicampur dan dievaporasi dengan rotary evaporator. Prinsip kerja alat vaccum
evaporator adalah menguapkan pelarut pada suhu rendah dengan adanya tekanan
yang menyebabkan titik didih pelarut menjadi lebih rendah dan mudah diuapkan.
Ekstrak yang sudah diuapkan pada vaccum evaporator lalu ditempatkan dalam
cawan petri dan diuapkan kembali di atas waterbath selama 10 jam dengan suhu
80oC hingga diperoleh selisih bobot penimbangan adalah 0. Kemudian ekstrak kental yang diperoleh disimpan di dalam desikator.
Menghitung rata-rata rendemen lima replikasi ekstrak etanol biji P.americana
Rendemen ekstrak = berat cawan ekstrak kental–berat cawan kosong
− = . 1 + . 2 + . 3 + . 4 + . 5
5
6. Penetapan konsentrasi pekat ekstrak
Konsentrasi yang dapat digunakan adalah konsentrasi pekat yang dapat
dibuat, dimana pada konsentrasi tersebut suspensi ekstrak dapat dimasukkan serta
dikeluarkan dari spuit oral dengan mudah. Cara pembuatannya adalah dengan
melarutkan ekstrak kental dengan CMC Na 1%, dengan melakukan kenaikan
konsentrasi secara bertahap hingga pada konsentrasi dimana campuran ekstrak
dengan CMC Na% sudah tidak dapat dikeluarkan dengan mudah dari spuit oral.
7. Penetapan dosis ekstrak etanol bijiP. americana
Penetapan peringkat dosis didasarkan pada perhitungan dengan bobot
tikus paling besar yaitu 250 gram, konsentrasi ekstrak etanol biji P.americana
yang dapat dimasukkan dan dikeluarkan melalui spuit oral yaitu 7% atau 70
mg/mL, serta volume maksimal pemberian oral yaitu 5 mL.
Maka dosis tertinggi dapat ditentukan sebagai berikut :
BB x D = C x V
Berat badan (kg) x dosis(mg/kgBB) = konsentrasi (mg/mL) x volume pemberian
(mL)
0,250 kg x D = 70mg/mL x 5 mL
D = 1400 mg/kgBB
Dosis tengah dan dosis rendah ditentukan dengan menurunkan dua dan empat
8. Pembuatan larutan karbon tetraklorida
Karbon tetraklorida dibuat dalam konsentrasi 50%, dengan cara
memasukkan 50 mL karbon tetraklorida ke dalam labu ukur 100 mL, lalu
ditambahkanolive oilhingga tanda batas (Janakat dan Al-Merie, 2002).
9. Pembuatan suspending agent CMC-Na 1%
Suspending agent CMC-Na 1% dibuat dengan cara mendispersikan lebih
kurang 1,0 g CMC-Na yang telah ditimbang seksama ke dalam air sampai volume
100,0 mL. CMC-Na 1% ini akan digunakan untuk membuat suspensi ekstrak
etanol bijiP.americana.
10. Uji pendahuluan
a. Penetapan dosis nefrotoksin karbon tetraklorida dan waktu
pencuplikan darah. Pemilihan dosis karbon tetraklorida dilakukan untuk
mengetahui pada dosis berapa karbon tetraklorida mampu menyebabkan
kerusakan ginjal tikus yang ditandai dengan peningkatan kadar kreatinin dalam
serum darah. Dosis nefrotoksik yang digunakan dalam penelitian ini mengacu
pada penelitian yang dilakukan oleh Moneim dan El-Deib (2012) dan hasil
orientasi, dimana pada dosis karbon tetraklorida 2 mL/kgBB dapat menyebabkan
kerusakan ginjal dengan kenaikan kadar kreatinin serum. Penentuan waktu
pencuplikan darah didasarkan pada hasil orientasi yaitu pada jam ke 48 setelah
induksi karbon tetraklorida, dimana terjadi peningkatan kreatinin paling tinggi.
11. Pengelompokan dan perlakuan hewan uji
Sejumlah tiga puluh ekor tikus dibagi secara acak ke dalam enam
(kontrol negatif) diberi olive oil dosis 2 mL/kgBB secara i.p. Kelompok II
(kontrol nefrotoksik) diberi larutan karbon tetraklorida : olive oil (1:1) dosis 2
mL/kgBB secara i.p. Kelompok III (kontrol ekstrak) diberi ekstrak etanol biji P.
americana dosis 1400 mg/kgBB selama enam hari berturut-turut secara per oral,
tanpa diinduksi karbon tetraklorida. Kelompok IV, V dan VI merupakan
kelompok perlakuan yang diberi ekstrak etanol biji P. americana dengan dosis
350, 700 dan 1400mg/kgBB. Pada hari ke tujuh kelompok IV-VI diberi larutan
karbon tetraklorida dosis 2 mL/kgBB secarai.p. Setelah 48 jam diambil darahnya
melaluisinus orbitalismata, lalu diukur kadar kreatinin serum.
Setelah pengambilan darah untuk pengukuran kadar kreatinin serum,
tikus dikorbankan dan diambil organ ginjalnya. Organ ginjal tersebut kemudian
dicuci pada larutan saline (NaCl 0,9%) dan diawetkan dengan direndam dalam
formalin 10% untuk dibuat preparat histologis lalu diamati penampakan
mikroskopisnya. Pemeriksaan histologis dilakukan di Laboratorium Patologi
Kedokteran Hewan Universitas Gadjah Mada Yogyakarta. Hasil pemeriksaan
dibuat fotomikroskopik sebagai data kualitatif penunjang.
12. Pembuatan serum
Darah diambil melalui bagian sinus orbitalis mata tikus lalu ditampung
dalam tabung Eppendorf. Darah didiamkan selama kurang lebih 15 menit,
kemudian disentrifugasi selama 15 menit dengan kecepatan 10000 rpm dan bagian
supernatannya diambil. Supernatan yang diambil adalah serum yang akan diukur
13. Penetapan kadar serum kontrol, serum kreatinin
Alat yang digunakan untuk menganalisis kadar kreatinin serum adalah
Mikrolab 200 Merck®. Kadar kreatinin dinyatakan dalam satuan mg/dL.
Pengukuran kadar kreatinin serum dilakukan di Laboratorium Biokimia-Fisiologi
Manusia, Fakultas Farmasi, Universitas Sanata Dharma, Yogyakarta.
a. Penetapan kadar serum kontrol. Analisis dilakukan dengan cara
mencampur 1000 μ L reagen I dengan 50 μ L serum kontrol, divorteks selama lima
detik lalu didiamkan selama dua menit. Setelah itu, ditambahkan 250 μ L reagen
II, divorteks selama lima detik dan dibaca resapan setelah satu menit.
b. Penetapan kadar kreatinin serum. Analisis serum kreatinin dilakukan
dengan cara mencampur 1000 μ L reagen I dengan 50μ L serum darah tikus,
divorteks selama lima detik, lalu didiamkan selama dua menit. Setelah itu,
ditambahkan 250μ L reagen II, divorteks selama lima detik dan dibaca resapan
setelah satu menit.
F. Tata Cara Analisis Hasil
Data kadar kreatinin serum diuji dengan Kolmogorov-Smirnov untuk
mengetahui distribusi data dan analisis variansi dengan Levene’s Testuntuk
melihat homogenitas antar kelompok perlakuan sebagai syarat analisis parametrik.
Data terdistribusi normal dan variansi homogen maka dilanjutkan dengan analisis
variansi pola searah (ANOVA one way) dengan taraf kepercayaan 95% untuk
mengetahui perbedaan masing-masing kelompok. Kemudian dilanjutkan dengan
uji Scheffe untuk melihat perbedaan antar kelompok bermakna (signifikan)
normal dan terdiri dari dua kelompok yang berpasangan, maka dilakukan uji
t-berpasangan untuk melihat kebermaknaan perbedaan pada dua kelompok tersebut.
Penentuan % efek nefroprotektif dilakukan melalui perhitungan dengan rumus
sebagai berikut :
( ) – (
38 BAB IV
HASIL DAN PEMBAHASAN
Penelitian ini bertujuan untuk membuktikan adanya efek nefroprotektif
pada pemberian jangka panjang ekstrak etanol biji P. americana terhadap
penurunan kadar kreatinin serum dan gambaran histologis ginjal pada tikus
terinduksi karbon tetraklorida serta memperoleh besar dosis efektifnya. Dalam
penelitian ini dilakukan beberapa tahapan yaitu determinasi serbuk P.americana,
penetapan kadar air serbuk, pembuatan ekstrak, penetapan dosis ekstrak etanol biji
P. americana, pengukuran kadar kreatinin serum, dan pemeriksaan histologis
ginjal.
A. Penyiapan Bahan 1. Hasil determinasi serbuk bijiP.americana
Tujuan dilakukan determinasi serbuk P.americana adalah untuk
memastikan bahwa serbuk yang digunakan adalah benar berasal dari biji tanaman
P.americana. Determinasi dilakukan dengan mencocokkan ciri-ciri organoleptis
dan mikrokopis serbuk biji P.americana yang diperoleh dari daerah Padang
dengan serbuk biji yang dibuat secara mandiri di Laboratorium Farmakognosi
Fitokimia (Lampiran 5). Hasil determinasi yang dilakukan menunjukkan bahwa
P.americana berdasarkan kemiripan secara organoleptis yaitu kemiripan
warna, rasa dan aroma serbuk yang dibandingkan. Selain itu juga berdasarkan
pengamatan mikroskopik serbuk, diperoleh adanya kemiripan
fragmen-fragmen antara kedua serbuk yang dibandingkan yaitu amilum dan parenkim
endosperm.
2. Penetapan kadar air sebuk bijiP.americana
Penetapan kadar air serbuk biji P.americana bertujuan mengetahui
kadar air dalam serbuk yang akan digunakan. Kadar air dalam serbuk harus
kurang dari 10% untuk memenuhi persyaratan kadar air serbuk yang baik
(Direktorat Jenderal Pengawasan Obat dan Makanan, 1995). Kadar air dalam
serbuk penting dilakukan dan harus memenuhi persyaratan untuk menjamin
serbuk bebas dari kemungkinan pertumbuhan mikroorganisme karena air
merupakan media pertumbuhan yang baik bagi mikroorganisme.
Penetapan kadar air serbukP.americana dilakukan menggunakan alat
moisture balance dengan metode gravimetri. Pada penetapan kadar air ini
digunakan suhu 1050 C selama 15 menit. Hasil perhitungan rata-rata selisih bobot sebelum dan sesudah pemanasan pada ketiga replikasi menunjukkan
bahwa kadar air dalam serbuk bijiP.americana yaitu sebesar 7,40%. Kadar air
pada serbuk yang digunakan telah memenuhi persyaratan kadar air serbuk yang
baik.
3. Hasil pembuatan dan penimbangan ekstrak etanol bijiP.americana Pembuatan ekstrak etanol biji P.americana dilakukan dengan metode