PENETAPAN KANDUNGAN FENOLIK TOTAL FRAKSI AIR EKSTRAK ETANOLIK BIJI TREMBESI (Samanea saman (Jacq.) Merr.) DAN
AKTIVITAS ANTIOKSIDAN MENGGUNAKAN RADIKAL 1,1-DIFENIL-2-PIKRILHIDRAZIL (DPPH)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh :
Ignasius Angrenaldo
NIM: 098114030
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
PENETAPAN KANDUNGAN FENOLIK TOTAL FRAKSI AIR EKSTRAK ETANOLIK BIJI TREMBESI (Samanea saman (Jacq.) Merr.) DAN
AKTIVITAS ANTIOKSIDAN MENGGUNAKAN RADIKAL 1,1-DIFENIL-2-PIKRILHIDRAZIL (DPPH)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh :
Ignasius Angrenaldo
NIM: 098114030
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
HALAMAN PERSEMBAHAN
SERVUS, SERVUORUM DEI
HAMBA BAGI PARA HAMBA
Skripsi ini kupersembahkan untuk :
Tuhanku Yesus Kristus atas segala berkat dan penyertaan-Nya
Bapak, Ibu dan adik-adikku atas kasih sayang
dan segala hal yang diberikan
vii PRAKATA
Puji syukur kami panjatkan ke hadirat Allah yang telah memberikan rahmat
serta karunia-nya kepada penulis sehingga penulis berhasil menyelesaikan skripsi
yang berjudul ”PENETAPAN KANDUNGAN FENOLIK TOTAL FRAKSI AIR EKSTRAK ETANOLIK BIJI TREMBESI (Samanea saman (Jacq.) Merr.) DAN
AKTIVITAS ANTIOKSIDAN MENGGUNAKAN RADIKAL 1,1-DIFENIL-2-PIKRILHIDRAZIL (DPPH)”.
Skripsi ini dibuat sebagai tugas akhir yang menjadi syarat kelulusan wajib
untuk mendapatkan gelar Sarjana Farmasi (S.Farm.). Penulis menyusun skripsi ini
dalam jangka waktu yang cukup panjang melalui penelitian dan pengamatan yang
dilakukan sendiri bersama teman-teman satu tim dan juga dibawah bimbingan dosen
pembimbing skripsi.
Penulis ingin menyampaikan terima kasih kepada:
1. Ipang Djunarko, M.Sc., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata
Dharma.
2. Prof. Dr. C. J. Soegihardjo, Apt. selaku Dosen Pembimbing yang telah
memberikan bimbingan selama pengusulan skripsi, saat penelitian dan
selama penulisan skripsi dengan kesabaran dan penuh perhatian.
3. Yohanes Dwiatmaka, M.Si. selaku Dosen Penguji yang memberikan banyak
viii
4. Enade Perdana Istyastono, Ph.D., Apt. selaku Dosen Penguji yang telah
memberikan kritikan dan saran yang sangat bermanfaat bagi skripsi ini.
5. C. M. Ratna Rini Nastiti, M.Pharm., Apt. sebagai Kaprodi Fakultas Farmasi yang
telah memberi masukan dan saran yang baik selama penulis berkuliah.
6. Dr. Sri Hartati Yuliani, M.Si, Apt. sebagai Kepala Laboratorium Fakultas
Farmasi Universitas Sanata Dharma Yogyakarta.
7. Segenap laboran Laboratorium Farmakognosi Fitokimia (Mas Wagiran),
Laboratorium Farmasi Fisika (Mas Agung), Laboratorium Kimia Analisis
Instrumental (Mas Bimo) dan Laboratorium Kimia Organik (Pak Parlan) atas
segala bantuan yang telah diberikan selama penulis menyelesaikan skripsi ini
Keluarga yang senantiasa mendukung di rumah, papa, mama dan adik tercinta.
8. Teman seperjuanganku Fendy terima kasih atas kerjasamanya, kepercayaan,
kesabaran, canda, saling memberikan semangat serta suka maupun duka yang
telah kita lewati bersama. Tanpa adanya hal-hal tersebut skripsi ini tidak akan
berjalan dengan baik.
9. Teman-temanku Aldo Chritian, Willigis Danu, Anthony Felix, James Wekin, Jen
Wekin, Meli Sampe, Donna Daniel dan Widiya Palionan yang sudah menjadi
teman-teman ngobrol yang baik dan selalu berbagi cerita, canda dan tawa
bersama.
10.Teman- teman kelas 2009 A bantuannya yang tidak dapat penulis sebutkan satu
ix
11. Teman- teman anging mammiri dan K2KAMSY yang sering memberikan
dukungan dan semangat.
12.Semua pihak yang telah memberi dukungan dan bantuan yang tidak dapat
disebutkan satu persatu.
Penulis menyadari, masih banyak kesalahan dan kekurangan dalam
penulisan skripsi ini. Oleh sebab itu penulis sangat mengharapkan bantuan dan
masukkan untuk membuat laporan skripsi ini menjadi bermanfaat.
Yogyakarta, 30 Oktober 2013
Penulis
Ignasius Angrenaldo
x DAFTAR ISI
HALAMAN JUDUL…. ... i
HALAMAN PERSETUJUAN PEMBIMBING.. ... ii
HALAMAN PENGESAHAN… ... iii
HALAMAN PERSEMBAHAN… ... iv
PERNYATAAN KEASLIAN KARYA.. ... v
LEMBAR PERSETUJUAN PUBLIKASI KARYA… ... vi
KATA PENGANTAR.. ... vii
DAFTAR ISI……….. ... x
DAFTAR TABEL…….. ... xiv
DAFTAR GAMBAR.. ... xv
DAFTAR LAMPIRAN.. ... xvi
INTISARI… ... xviii
ABSTRACT.. ... xix
BAB I. PENGANTAR….. ... 1
A. Latar Belakang ... 1
1. Permasalahan… ... 3
2. Keaslian penelitian….. ... 4
3. Manfaat penelitian……. ... 5
xi
BAB II. PENELAAH PUSTAKA……. ... 6
A. Uraian tanaman……….. ... 6
1. Nama tumbuhan (Plantamor , 2012)…..…. ... 6
2. Klasifikasi berdasarkan Plantamor (2012)….. ... 6
3. Morfologi trembesi… ... 7
4. Manfaat trembesi ... 7
B. Senyawa Fenolik Total ... 7
C. Antioksidan ... 10
D. Metode DPPH… ... 12
E. Spektofotometri… ... 14
F. Ekstraksi…... 15
G. Validasi Metode Analisis….. ... 16
H. Landasan teori…. ... 20
I. Hipotesis………. ... 21
BAB III. METODE PENELITIAN.. ... 22
A. Jenis dan Rancangan Penelitian.. ... 22
B. Variabel Penelitian.. ... 22
1. Variabel bebas.. ... 22
2. Variabel tergantung.. ... 22
3. Variabel pengacau terkendali.. ... 22
4. Variabel pengacau tak terkendali.. ... 22
xii
D. Bahan dan Alat Penelitian… ... 23
1. Bahan penelitian… ... 23
2. Alat penelitian… ... 23
E. Tata Cara Penelitian.. ... 24
1. Determinasi biji trembesi… ... 24
2. Pengumpulan tanaman.. ... 24
3. Preparasi sampel… ... 24
4. Pembuatan fraksi air.. ... 24
5. Pembuatan larutan DPPH, pembanding dan uji.. ... 25
6. Uji pendahuluan…. ... 26
7. Optimasi metode penentuan kandungan fenolik total…… ... 27
8. Penetapan kandungan fenolik total… ... 27
9. Optimasi metode uji aktivitas antioksidan.. ... 28
10.Pengujian antivitas antioksidan…. ... 29
F. Analisis Hasil… ... 30
BAB IV. HASIL DAN PEMBAHASAN…… ... 31
A. Determinasi Tanaman… ... 31
B. Pengumpulan Bahan.. ... 31
C. Hasil Ekstraksi.. ... 33
D. Hasil Fraksinasi.. ... 35
E. Hasil Uji Pendahuluan.. ... 37
xiii
2. Hasil uji kualitatif antioksidan.. ... 39
F. Hasil Optimasi Metode Penetapan Kandungan Fenolik Total… ... 40
1. Penentuan operating time (OT).. ... 40
2. Penentuan panjang gelombang maksimum.. ... 41
G. Hasil Validasi Metode Penetapan Kandungan Fenolik Total… ... 43
1. Linearitas metode penetapan kandungan fenolik total.. ... 43
2. Presisi metode penetapan kandungan fenolik total.. ... 44
3. Spesifisitas metode penetapan kandungan fenolik total……... 45
H. Hasil Penetapan Kandungan Fenolik Total.. ... 45
I. Hasil Optimasi Metode Uji Aktivitas Antioksidan… ... 49
1. Penentuan panjang gelombang maksimum…. ... 49
2. Penentuan operating time (OT).. ... 50
J. Hasil Validasi Metode Uji Aktivitas Antioksidan…... 53
1. Linearitas metode uji antioksidan.. ... 53
2. Presisi metode uji antioksidan.. ... 55
3. Spesifisitas metode uji antioksidan…. ... 56
K. Hasil Pengukuran Aktivitas Antioksidan.. ... 57
BAB V. KESIMPULAN DAN SARAN… ... 64
DAFTAR PUSTAKA.. ... 65
LAMPIRAN… ... 71
xiv
DAFTAR TABEL
Halaman
Tabel I. Nilai presisi yang dapat diterima menurut Kingston
(2004)..…… ...20
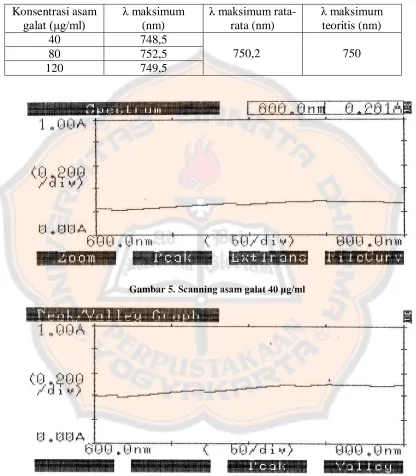
Tabel II. Hasil scanning panjang gelombang penetapan kandungan fenolik total ...42
Tabel III. Hasil CV kurva asam galat ...45
Tabel IV. Nilai r penetapan kandungan fenolik total ...47
Tabel V. Hasil Perhitungan kandungan fenolik total …. ...48
Tabel VI. Scanning panjang gelombang maksimum DPPH …. ...50
Tabel VII. Hasil CV dari sampel rutin ….. ...55
Tabel VIII. Hasil CV dari sampel fraksi air………. ...56
Tabel IX. Hasil aktivitas antioksidan rutin dengan menggunakan metode DPPH …. ...59
Tabel X. Hasil pengukuram IC50 Rutin ...59
Tabel XI. Hasil aktivitas antioksidan fraksi air ekstrak etanol dengan menggunakan metode DPPH …. ...59
Tabel XII. Hasil pengukuram IC50 fraksi air …. ...60
xv
DAFTAR GAMBAR
Halaman
Gambar 1. Reaksi Antioksidan dengan DPPH (Kikukazaki ,2002)..…… ...13
Gambar 2. Hasil uji kualitatif fenolik total..…… ...37
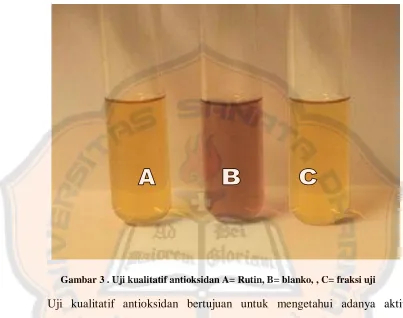
Gambar 3. Hasil uji kualitatif antioksidan..…… ...39
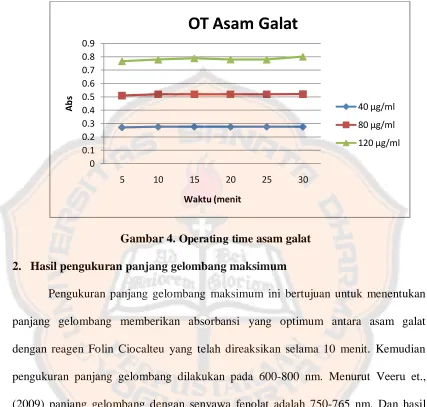
Gambar 4. Operating Time Asam galat..…… ...41
Gambar 5. Scanning asam galat 40 g/ml..…… ...42
Gambar 6. Scanning asam galat 80 g/ml..…… ...42
Gambar 7. Scanning asam galat 120 g/ml..…… ...43
Gambar 8. Kurva seri asam galat..…… ...44
Gambar 9. Kurva persamaan regresi linier asam galat (replikasi 2)..…… ...47
Gambar 10. Scanning rutin 0,016 mM..…… ...50
Gambar 11. Scanning rutin 0,048 mM..…… ...51
Gambar 12. Scanning rutin 0,080 mM..…… ...51
Gambar 13. Operating time dari baku rutin..…… ...52
Gambar 14. Operating time dari fraksi air..…… ...52
Gambar 15. Kurva Seri Baku Rutin..…… ...54
Gambar 16. Kurva Seri Baku Fraksi Air..…… ...54
Gambar 17. Reaksi Antioksidan dengan DPPH (Nishiza wa ,2005)..…… ...57
xvi
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Surat Determinasi..…… ...71
Lampiran 2. Gambar daun trembesi..…… ...72
Lampiran 3. Gambar biji dan buah trembesi..…… ...72
Lampiran 4. Data penimbangan rendemen..…… ...73
Lampiran 5. Penimbangan uji kandungan fenolik total..…… ...74
Lampiran 6. Scanning kontrol asam galat..…… ...75
Lampiran 7. Optimasi Penentuan kandungan fenolik total..…… ...75
Lampiran 8. Penentuan kandungan fenolik………... 78
Lampiran 9. Data penimbangan untuk pengujian aktivitas antioksidan (DPPH) ..…… ...83
Lampiran 10. Data Konsentrasi bahan untuk pengujian aktivitas antioksidan..…… ...84
Lampiran 11. Scanning Larutan Untuk Pengujian Aktivitas Antioksidan..…… ... 87 Lampiran 12. Penentuan Operating Time (OT) dan maksimum..…… ...91
Lampiran 13. Uji aktivitas antioksidan menggunakan radikal DPPH..…… ...96
xvii
Lampiran 15. Perhitungan uji stastistik dengan menggunakan program
xviii
INTISARI
Trembesi (Samanea saman (Jacq.) Merr.) adalah salah satu jenis dari famili Fabaceae yang banyak ditemukan tumbuh di daerah tropis. Tujuan penelitian ini adalah menentukan kadar senyawa fenolik total dan aktivitas antioksidan fraksi air ekstrak etanol biji trembesi. Ekstrak tanaman diperoleh dengan metode maserasi menggunakan etanol 70%. Ekstrak selanjutnya difraksinasi dengan cara ekstraksi cair-cair sehingga menghasilkan fraksi air. Kadar fenolik total ditetapkan menggunakan metode spektrofotometri visibel dengan pereaksi Folin-Ciocalteau.
Penentuan fenolik total menunjukkan jumlah senyawa fenolik yang mempengaruhi aktivitas antioksidan yang dinyatakan dengan nilai massa ekuivalen asam galat per massa fraksi (mg ekuivalen asam galat per g fraksi air esktrak etanol). Pengujian aktivitas antioksidan dilakukan dengan metode DPPH (1,1-difenil-2-pikrilhidrazil) berdasarkan nilai IC50nya. Hasil penelitian menunjukkan bahwa kandungan fenolik total fraksi air ekstrak etanolik biji trembesi adalah 44,67±0,53 mg ekivalen asam galat per gram fraksi air ekstrak etanolik biji trembesi. Nilai IC50 rutin adalah 19,05±0,23 µg/mL dan IC50 fraksi air ekstrak etanolik adalah 411,9 ± 13,02 µg/mL.
xix
ABSTRACT
Rain tree (Samanea saman (Jacq.) Merr) is a member of Fabaceae family which is found in the tropics. The purpose of this study was to determine total phenolic compounds and antioxidant activity of the water fraction from rain tree
seeds ethanol extract. The plant extract with maceration method using 70% ethanol, then the extract was fractionated by liquid-liquid extraction to obtain water fraction. Total phenol level was determined using visible spectrophotometry with Folin-Ciocalteau reagent. Determination of total phenol was showed total phenolic compound which is affected antioxidant activity. It was showed by gallic acid equivalent per mass fraction (mg gallic acid equivalents per g of ethanol extracts water fraction). The determination of antioxidant activity described use DPPH method based on the value of IC50. The result showed that total phenolic which is
contained in the water fraction from ethanolic extracts of rain tree seeds was 42.93±4.21 mg gallic acid equivalents per gram water fraction from ethanolic extract of rain tree seeds. The IC50 value of rutin was 19.05±0.23 µg/mL and the IC50 value
of the water fraction from rain tree seeds ethanol extract was 411.9 ± 13.02 µg/mL.
1
BAB I
PENGANTAR
A. Latar Belakang
Akhir-akhir ini radikal bebas dan antioksidan menjadi perhatian dunia medis
karena radikal bebas dapat menyebabkan kerusakan sel dan mendasari berbagai
macam keaadan patologis seperti penyakit jantung, inflamasi dan kanker (Caillet, Cote, Doyon, Sylvian, Lacroix, 2011). Pola hidup terutama dalam pola makan, radiasi, polusi udara akibat perkembangan industri, asap kendaraan bermotor ataupun
asap rokok yang menyebabkan manusia semakin sering terpapar dengan berbagai
sumber radikal bebas. Tubuh sebenarnya memiliki mekanisme pertahanan
antioksidan dalam bentuk enzim antioksidan untuk menetralisir radikal bebas. Tetapi
bila radikal bebas berlebih dalam tubuh, maka antioksidan tubuh tidak dapat melawan
radikal bebas sepenuhnya karena itu dibutuhkan tambahan antioksidan
(Chanwitheesuk, Teerawutgulrag, Rakariyatham, 2004; Silalahi, 2000).
Antioksidan merupakan suatu zat kimia yang mencegah oksidasi zat kimia
lain. Pada sistem biologis, proses oksidasi dapat menghasilkan radikal bebas yang
reaktif sehingga dengan adanya antioksidan diharapakan dapat menghambat aktivitas
radikal bebas yang pada akhirnya dapat mencegah terjadinya penyakit-penyakit yang
dipicu oleh radikal bebas (Molyneux, 2004). Sumber-sumber antioksidan dapat
tokoferol, katekin dan asam askorbat merupakan contoh antioksidan alami.
Antioksidan sintetik antara lain Butylated Hydroxytoluena (BHT), (Butylated
Hydroxyanisol (BHA), Propil Galat (PG ), dan etoksiquin (Cahyadi, 2006). Namun
penggunaan antioksidan sintetik ini mulai dibatasi. Hasil penelitian menunjukkan
bahwa antioksidan sintetik seperti BHT dan BHA bukan merupakan antioksidan yang
baik karena dapat meracuni binatang percobaan dan pada pemaparan yang lama dapat
meningkatkan resiko karsinogenesis (Hosseinimehr and Shahabimajd, 2006).
Adanya kekhawatiran terhadap efek samping antioksidan sintetik menyebabkan
antioksidan alami menjadi alternatif pilihan (Rohdiana, 2001).
Penelitian yang dilakukan lebih mengarah kepada konsep antioksidan alami
karena senyawa antioksidan sintesik ternyata dapat menyebabkan pembengkakan
hati (Windono, 2001). Terlebih lagi Indonesia merupakan salah satu pusat
keanekaragaman hayati dunia sangat kaya akan tumbuhan obat dan masih kurang di
manfaatkan termasuk familia Fabaceae. Padahal berdasarkan data yang ada pada
kebun raya Purwodadi yang memiliki koleksi sekitar 10.605 spesies dan sebanyak di
antara 3 spesies anggota familia Fabaceae yakni Acacia auriculiformis, Albizia
saman and Milletia xycarpa (Rindyastuti and Darmayanti, 2010).
Tumbuhan yang digunakan dalam penelitian ini adalah Samanea sama n
(Jacq.) Merr. karena berdasarkan penelusuran literatur, tumbuhan jenis Samanea
saman (Jacq.) Merr. tersebut belum banyak diteliti. Padahal tanaman biji trembesi
sebagai obat tambahan saat mandi air hangat untuk mencegah kanker (Hartwell,
1971). Daun trembesi dapat digunakan untuk obat tradisional antara lain demam,
diare, sakit kepala dan sakit perut (Duke,1983). Ekstrak daun trembesi memiliki
kandungan antimikroba terhadap Escherichia coli, Staphyloccus aureus, Candida
albican dan Xanthomonas. Dari hasil penelitian sebelumnya diperoleh data bahwa trembesi mengandung tannin, flavonoid, saponin dan terpenoid (Prasad,
Viswanathan, Nayak, Swetha, Archna, Parathasarathy and Rajkumar, 2008 ;
Raghavendra, Satish and Raveesha, 2008). Pada penelitian ini yang diuji adalah biji,
karena jumlahnya yang tersedia relatif banyak, mudah diperoleh dan dapat dimakan
khusus dibuat tempe sebagai pengganti kedelai (Solikhah, 2009). Oleh karena itu
penulis merasa perlu untuk melakukan pengukuran fenolik total dari ekstrak etanol
fraksi air dari biji trembesi dan aktivitas antioksidan. Sebab fenolik total memiliki
korelasi yang baik dengan aktivitas antioksidan sehingga dapat dilakukan penelitian
terhadap keduanya.
1. Permasalahan
a. Berapakah nilai kadar fenolik total berdasarkan nilai ekivalen asam galat dari
fraksi air ekstrak etanol biji trembesi ?
b. Berapakah nilai aktivitas antioksidan dari fraksi air ekstrak etanol biji
2. Keaslian penelitian
Penelitian mengenai tanaman trembesi telah beberapa kali ditemukan
diantaranya:
“Compartive Phytochemical and Antimicrobial Screening of Some Solvent
Extracts of Samanea saman (fabaceae or mimosaceae) pods (Obasi , Egbuonu,
Ukoha, and Ejikeme, 2010)”. Penelitian ini dilakukan dengan cara skrinning fitokimia dan antimikrobia.
“Invitro Antioxidant Testing of The Extracts of Samanea saman (Jacq.)
Merr” (Arulpriy, Latith, and Hemalatha, 2010). Penelitian ini dilakukan dengan cara
uji invitro antioksidan ekstrak Samanea saman (Jacq.) Merr tapi yang diteliti akar,
kulit dan daunnya.
“Evaluation of Antioxidant Activity of Ethyl Acetate of Samanea saman
(Jacq.) Merr by Cyclic Voltammetry (Arulpriya et al, 2010). Penelitian ini
dilakukan dengan cara evaluasi aktivitas antioksidan dengan etil asetat dengan
menggunakan voltametri.
Penelitian ini berbeda karena menggunakan uji antioksidan metode radikal
scavenger DPPH dan sampel yang digunakan dari ekstrak etanol fraksi air biji
trembesi yang diambil dari taman Universitas Sanata Dharma. Berdasarkan
penelusuran yang telah dilakukan penelitian: “Penetapan Kandungan Fenolik Total
Ekstrak Etanol Fraksi Air Biji Trembesi (Samanea saman (Jacq.) Merr.) dan
Aktivitas Antioksidan dengan Menggunakan Radikal 1,1-difenil-2-pikrilhidrazil
3. Manfaat penelitian
a. Manfaat metodologis
Memperoleh metode pengukuran kadar fenolik total serta aktivitas
antioksidan dari fraksi air ekstrak etanol yang murah dan praktis.
b. Manfaat teoritis
Mendapatkan kadar fenolik total dan nilai IC50 atau aktivitas antioksidan
dari biji trembesi.
c. Manfaat praktis
Dapat memberikan informasi tentang aktivitas antioksidan biji trembesi
sehingga dapat digunakan untuk pemeliharaan kesehatan manusia dan
dapat untuk membuat suatu produk kesehatan.
B. Tujuan Penelitian
Tujuan dari penelitian ini adalah:
a. Mengetahui nilai kadar fenolik total fraksi air ekstrak etanol biji
trembesi berdasarkan nilai ekivalen asam galat.
6
BAB II
PENELAAHAN PUSTAKA
A. Uraian Tanaman
1. Nama tumbuhan (Plantamor, 2012)
Nama latin : Samanea saman (Jacq.) Merr
Nama Indonesia : saman, trembesi, munggur,
Nama Inggris : rain tree, monkey pod,saman
Nama Filipina : Acacia
2. Klasifikasi berdasarkan Plantamor (2012)
Kingdom : Plantae (Tumbuhan)
Subkingdom : Tracheobionta (Tumbuhan berpembuluh)
Super Divisi : Spermatophyta (Menghasilkan biji)
Divisi : Magnoliophyta (Tumbuhan berbunga)
Kelas : Rosidae
Ordo : Fabales
Famili : Fabaceae (suku polong-polongan)
Genus : Samanea
3. Morfologi trembesi
Trembesi dapat mencapai tinggi maksimum 15-25 m dan diameter mencapai
1-2 m. Pohon trembesi dapat berbunga sepanjang tahun. Bunga berbentuk umbel
(12-25 perkelompok) berwarna pink dengan stamen panjang dalam dua warna (putih
dibagian bawah dan kemerahan dibagian atas) yang berserbuk. Penyerbukan
dilakukan oleh serangga pada umumnya hanya satu bunga perkelompok yang
dibuahi. Biji dalam polong terbentuk dalam 6-8 bulan dan setelah tua akan segera
jatuh. Polong berukuran 15-20 cm berisi 5-20 biji. Biji berwarna coklat kemerahan.
Biji memiliki cangkang yang keras (Staples and Elevitch, 2006).
4. Manfaat trembesi
Trembesi merupakan jenis pohon yang memiliki kemampuan menyerap
karbondioksida dari udara yang sangat besar. Pohon ini mampu menyerap 28.488,39
kg CO2/ pohon setiap tahunnnya . Berdasarkan penelitian (1967-1971) di Venezuela,
akar trembesi dapat digunakan sebagai obat tambahan saat mandi air hangat. Fungsi
untuk mencegah kanker. Ekstrak daun trembesi memiliki kandungan antimikroba
terhadap Escherichia coli, Staphyloccus aureus, Candida albican dan Xanthomonas.
Dari hasil penelitian sebelumnya diperoleh data bahwa trembesi mengandung tannin,
flavonoid, saponin dan terpenoid (Prasad et al, 2008 ; Raghavendra et al, 2008).
B. Senyawa Fenolik
Senyawa fenolik umumnya ditemukan pada tanaman, baik yang dapat
dimakan ataupun yang tidak dapat di makan dan dilaporkan mempunyai sejumlah
memproduksi efek yang menguntungkan sebagai penangkap radikal. Telah banyak
senyawa fenolik mempunyai aktivitas antioksidan dan dapat melindungi sel dari
kerusakan oksidatif akibat radikal bebas ( Wada and Ou 2002; Chun and Lee, 2003).
Ekstrak buah, sayuran dan bahan-bahan lain yang kaya senyawa fenolik menarik bagi
kalangan industri makanan karena ekstrak ini mampu menunda kerusakan oksidatif
senyawa-senyawa lemak dan mampu meningkatkan nilai nutrisi suatu makanan
(Khakonen, Hopia, Vourela, Raula, Pihlaja, kujala, and Heinonen, 1999 ).
Senyawa fenolik atau polifenol merupakan metabolit sekunder yang
mempunyai cincin aromatik yang terikat dengan satu atau lebih substituent gugus
hidroksi (OH) yang berasal dari jalur metabolisme asam sikimat. Termasuk dalam
kelompok senyawa fenolik atau polifenol adalah fenol sederhana, kumarin, tannin
dan flavonoat. Dalam tanaman senyawa ini biasa dalam bentuk glikosida atau ester
(Proestos, 2003). Senyawa fenolik tanaman paling banyak terdapat dalam bentuk
aglikon, glikosida atau ester dan biasanya terdapat dalam vakuola sel (Harborne,
1987).
Metode penetapan fenolik total dengan pereaksi Folin-Ciocalteu ini pertama
kali dikembangkan pada tahun 1927 untuk analisis asam amino tirosin. Metode ini
berdasarkan prinsip redoks dalam suasana basa yakni adanya senyawa fenolik akan
dioksidasi oleh reagen asam fosfomolibdat-tungstat menghasilkan senyawa berwarna
yang dapat diukur absorbansinya pada panjang gelombang maksimal 745 sampai 750
nm. Metode penambahan natriun karbonat pada metode Folin-Ciocalteu ini
golongan fenolik yang terdapat dalam sampel. Kandungan fenoliknya dapat
distandarisasi antara lain dengan asam galat, katekin, asam tanat dan asam kafeat
(Prior, Ronald, Wu and Scharch, 2005).
Senyawa-senyawa flavonoid merupakan senyawa alami dengan berbagai
macam struktur fenolik lebih dari 4.000 telah diindetifikasi dan kelompokkan sesuai
struktur molekulnya (Wilmsen, Spada, and Salvador, 2005). Klasifikasi flavonoid
ditemukan oleh pola substitusi dan hidroksi pada atom C3. Klasifikasi tersebut
meliputi flavon, flavanon, flavonol, flavonolol, isoflavon aouron dan khalkon
(Robinson, 1995). Senyawa polifenol banyak dijumpai hampir semua tanaman mulai
dari fungi sampai angiospermae dan terdapat pada semua bagian tumbuhan termasuk
daun, akar, kayu, kulit bunga, buah dan biji (Markham, 1970). Aktivitas senyawa
flavonoid yang bermanfaat untuk kesehatan antara lain efek antioksidan,
antikarsinogenik, antiproliferatif, antiangoiogenik, antiinflamasi dan antiestrogenik.
Berdasarkan sifat di atas banyak suplemen makanan atau produk herbal yang
mengandung flavonoid dapat diterima secara komersial pada saat ini (Zhang and
Morris, 2003).
Sifat digunakan untuk menggambarkan flavonoid, salah satunya adalah
kemampuan flavonoid untuk beraksi sebagai antioksidan dengan menangkap radikal
bebas dan spesies oksigen reaktif lainnya. Aktivitas antioksidan dimiliki oleh
sebagian besar flavonoid disebabkan oleh adanya gugus hidroksil fenolik dalam
struktur molekulnya. Ketika senyawa-senyawa ini bereaksi dengan radikal bebas,
Dengan demikian fase profagasi yang meliputi reaksi radikal berantai dapat dihambat
(Wilmsen et al, 2005). Selain itu, flavonoid dapat berfungsi sebagai penangkap
radikal hidroksil yang merupakan radikal yang paling reaktif. Flavonoid dapat
beraksi sebagai antioksidan dengan menangkap radikal bebas melalui pemberian
atom hidrogen pada radikal tersebut. Kemampuan flavonoid untuk menangkap
radikal DPPH (Pokorny, Yanishlieva, and Gordon, 2001).
Ekstraksi flavonoid dari dalam simplisia tumbuhan dapat dilakukan dngan
menggunakan pelarut polar, semi polar maupun non polar sesuai dengan kelarutan
flavonoid yang diekstraksi. Kelarutan flavonoid berbeda sesuai dengan golongan dan
subsitusinya (Robinson, 1995). Pelarut kurang polar digunakan untuk mengekstraksi
aglikon flavonoid, sedangkan pelarut yang lebih polar digunakan untuk flavonoid
atau antosianin. Flavonoid merupakan senyawa polar karena mempunyai gugus
hidroksi yang tidak tersubstitusi atau suatu gula. Oleh karena itu, umumnya flavonoid
cukup larut dalam pelarut polar seperti etanol, metanol, butanol, aseton dan air
(Markham, 1970).
C. Antioksidan
Antioksidan merupakan senyawa yang mampu menghambat oksidasi molekul
lain. Senyawa antioksidan ini akan menyerahkan satu atau lebih elektronnya kepada
radikal bebas sehingga dapat menghentikan kerusakan yang disebabkan oleh radikal
bebas. Di dalam tubuh terdapat mekanisme antioksidan endogenik. Tetapi bila jumlah
radikal bebas dalam tubuh berlebih maka dibutuhkan antioksidan yang berasal dari
berfungsi sebagai penangkal radikal bebas dalam tubuh kita. Berdasarkan sumbernya
antioksidan dibagi dalam dua kelompok, yaitu (Droge, 2002):
(1). Antioksidan alami adalah antioksidan dapat diperoleh dari hasil ekstraksi bahan
alam yang diisolasi dari tumbuhan. Antioksidan alami tersebar pada bagian kayu,
kulit kayu, akar, daun, buah, bunga, biji dan serbuk sari. Antioksidan alami umumnya
merupakan senyawa fenolik/polifenolik yang dapat berupa golongan flavonoid,
turunan asam sinamat, kumarin, tokoferol dan asam-asam organik polifungsional.
Golongan flavonoid yang memiliki efek antioksidan meliputi flavon, flavonol,
flavanon, isoflavon, katekin dan kalkon.
(2). Antioksidan sintetik adalah antioksidan ini merupakan antioksidan buatan dari
sintetis reaksi kimia. Senyawa-senyawa yang termasuk antioksidan sintetik yaitu
butylhidroksianisol (BHA), butylhidroksitoluene (BHT), propil galat, ter-butyl
hidroksi quinon (TBHQ) dan tokoferol.
Berdasarkan mekanisme kerjanya, antioksidan dibagi menjadi antioksidan
primer, sekunder dan tersier (Droge, 2002):
a. Antioksidan primer
Antioksidan yang bekerja untuk mencegah terbentuknya senyawa radikal
bebas yang baru dengan mengubah radikal bebas yang ada menjadi molekul yang
efek radikalnya berkurang sebelum radikal bebas ini bereaksi. Contoh antioksidan
primer adalah Superoksida dismutase (SOD), glutation peroksidase dan protein
pengikat logam. Kerja dari antioksidan ini membutuhkan bantuan zat mineral seperti
b. Antioksidan sekunder
Antioksidan yang bekerja dengan pemutus rantai, berfungsi menangkap
radikal bebas dan mencegah reaksi berantai. Contoh dari antioksidan golongan
sekunder adalah Vitamin C, Tokoferol, Betakaroten, golongan fenol, amin aromatik,
asam urat, bilirubin dan albumin.
c. Antioksidan tersier
Antioksidan golongan tersier memperbaiki kerusakan sel-sel dan jaringan
(biomolekular) yang disebabkan radikal bebas. Contoh dari antioksidan tersier yaitu
enzim metionin sulfoksida reduktase.
D. Metode 1,1-difenil 2 pikrilhidrazil (DPPH)
Metode yang umum digunakan untuk menguji aktivitas antioksidan suatu
bahan adalah dengan menggunakan radikal bebas DPPH (1,1-difenil 2 pikrilhidrazil),
DPPH adalah radikal bebas yang bersifat stabil dan beraktivitas dengan cara
mendelokasi elektron bebas pada suatu molekul, sehingga molekul tersebut tidak
reaktif sebagaimana radikal bebas yang lain. Proses delokalisasi ini ditunjukkan
dengan adanya warna ungu pekat yang dapat dikaraterisasi pada absorbansi
(Molyneux, 2004).
Metode DPPH (1,1-difenil 2 pikrilhidrazil) memberikan informasi reaktivitas
senyawa yang diuji dengan suatu radikal stabil. Uji peredaman radikal DPPH
merupakan uji dekolorisasi untuk mengukur kemampuan antioksidan yang secara
langsung bereaksi dengan (meredam) radikal DPPH dengan memantau absorbansi
merupakan radikal bebas dengan pusat nitrogen organik yang stabil berwarna ungu
tua yang ketika tereduksi menjadi bentuk non radikal oleh antioksidan menjadi tidak
berwarna (Sashikumar, Maheshu, and Jayadev, 2009).
Metode DPPH merupakan sederhana dan hanya membutuhkan
spektrofotometer UV-Vis. Adanya hidrogen /elektron donor (antioksidan penangkap
radikal ) membuat intensitas absorpsi menurun dan larutan radikal kehilangan warna
yang sebanding dengan jumlah elektron yang berhasil ditangkap. Mekanisme
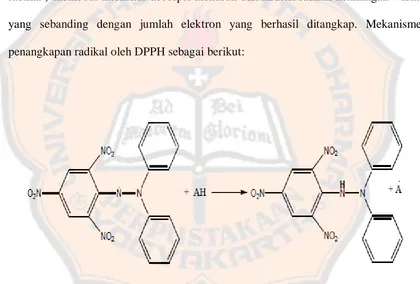
penangkapan radikal oleh DPPH sebagai berikut:
Gambar I. Reaksi antioksidan dengan DPPH (Kikuzaki, Hisamoto, Hirose, Akiyama, and
Taniguchi, 2002,)
Metode penangkapan radikal DPPH memiliki beberapa keuntungan
diantaranya dapat bereaksi dengan banyak sampel dengan waktu yang cukup
memungkinkan DPPH dapat bereaksi dengan lambat bahkan dengan antioksidan
dan dapat digunakan untuk menguji antioksidan hidrofilik maupun lipofilik (Kedare
and Singh, 2011).
Uji penangkapan radikal DPPH mempunyai beberapa keterbatasan antaranya,
radikal DPPH dapat berinteraksi dengan radikal lain dan kurva respons untuk
mencapai kondisi tidak linier dengan rasio antioksidan/DPPH yang berbeda. Selain
itu DPPH sensitif terhadap basa lewis dan solven seperti oksigen. Absorbansi DPPH
dalam metanol dan aseton menurun dibawah sinar matahari. DPPH juga memiliki
keterbatasan dalam hal merefleksikan antioksidan dalam sistem emulsi dan tidak
bermanfaat untuk mengukur antioksidan (Kedare and Singh, 2011).
E. Spektrofotometri
Spektrofotometer sesuai dengan namanya adalah alat yang terdiri dari
spektrometer dan fotometer. Spektrometer menghasilkan sinar dari spektrum dengan
panjang gelombang tertentu dan fotometer adalah alat pengukur intensitas cahaya
yang ditransmisikan atau diabsorbsi. Jadi spektrofotometer digunakan untuk
mengukur energi secara relatif jika energi tersebut ditransmisikan atau direflesikan
sebagai fungsi dari panjang gelombang (Khopkar, 2002).
Suatu spektrofotometer tersusun dari sumber spektrum tampak yang kontinyu,
monokromator, sel pengabsorsi untuk larutan sampel atau blanko dan suatu alat untuk
mengukur perbedaan absorbsi antara sampel dan blanko ataupun pembanding
F. Ekstraksi
Ekstraksi adalah proses penarikan komponen atau zat aktif suatu simplisia
dengan dengan pelarut tertentu. Faktor yang menjadi pertimbangan dalam memilih
metode esktraksi adalah sifat jaringan tanaman, sifat kandungan zat aktif serta
kelarutan zat aktif dalam pelarut yang digunakan. Secara umum, ekstraksi secara
berturut-turut mulai dari dengan pelarut non polar , kepolarannya menegah kemudian
pelarut polar (Depkes RI, 2000). Pada saat ekstraksi terjadi perpisahan massa
komponen atau zat aktif dalam tanaman dari dalam sel kemudian ditarik oleh cairan
penyari sehingga terlarut dalam cairan penyari tersebut. Pada umumnya penyarian
akan bertambah baik bila permukaan serbuk simplisia yang bersentuh dengan penyari
semakin luas (Harborne, 1987).
Perbedaan stuktur kimia dari bahan akan mempengaruhi kelarutan serta
stabilitas senyawa-senyawa tersebut terhadap pemanasan, udara, cahaya, logam berat
dan derajat keasaman. Pengetahuan mengenai kandungan senyawa aktif dalam
simplisia akan mempermudah pemilihan pelarut dan cara ekstraksi secara tepat
(Depkes RI, 2000). Pelarut yang baik mempunyai persyaratan antara lain murah, non
toksik, tidak mudah terbakar, tidak bereaksi dengan zat yang disari, tidak bercampur
dengan air dan mudah didapatkan.
Ekstraksi digolongkan menjadi ke dalam macam berdasarkan fase yang
ekstraksi, yaitu ekstraksi cair-cair dan ekstraksi cair-padat (Snyder and Kirkldan,
1997). Ekstraksi terdiri dari beberapa metode yakni maserasi, perkolasi dan ekstraksi
penyarian dengan alat yang sering digunakan . Metode ekstraksi dingin dapat
dilakukan dengan cara maserasi atau perkolasi karena tanpa disertai pemanasan
sedangkan soxhletasi merupakan metode ekstraksi panas karena dalam proses disertai
pemanasan (Depkes RI, 2000).
Maserasi adalah proses ekstraksi simplisia menggunakan pelarut dengan
beberapa kali pengocokan atau pengadukan pada temperature kamar. Maserasi
termasuk ekstraksi dengan prinsip metode pencapaian konsentrasi pada
kesetimbangan. Keuntungan metode ini adalah lebih mudah dan untuk senyawa yang
bersifat termolabil. Kelemahan maserasi adalah jika konsentrasi senyawa aktif pada
cari penyari telah jenuh maka senyawa zat aktif di dalam simplisia tidak dapat
terekstraksi seluruhnya sehingga perlu diganti penyari baru (Depkes RI, 2000).
Pemisah senyawa aktif dalam ekstrak dapat dilakukan dengan partisi. Proses
partisi sangat tergantung pada daya larut solut dalam dalam pelarut (solven yang
tidak saling campur dan berbeda polaritasnya). Prinsip partisi adalah melarutkan
senyawa polar dalam pelarut polar dan senyawa non polar larut dalam senyawa non
polar. Senyawa aktif tersebut terpisah berdasarkan kelarutannya dalam dua macam
pelarut yang tidak saling campur dan berbeda polaritasnya berdasarkan prinsip like
dissolves like (Snyder and Kirkldan, 1997).
G.Validasi Metode Analisis
Validasi metode analisis merupakan penilaian terhadap metode tertentu secara
laboratorium untuk membuktikan bahwa metode tersebut memenuhi persyaratan
menvalidasi metode adalah linieritas, ketepatan (a ccurary ) dan ketelitian (precision)
(Harmita, 2004). Tujuan akhir validasi metode analisis adalah untuk memastikan
bahwa pengukuran dalam analisis yang akan dilakukan dapat memberikan hasil yang
mendekati accepted true value untuk tiap penetapan analisis dalam sampel.
Kesalahan dapat didefinisikan sebagai perbedaan antara hasil pengukuran (nilai
perhitungan) dengan nilai sebenarnya. Namun pada dasarnya nilai kuantitas dari suatu
pengukuran tidak dapat diketahui secara pasti (Rohman, 2007).
Validasi metode analisis digunakan untuk membuktikan bahwa metode
analisis memenuhi spesifikasi kualitas data yang ditentukan dan kesalahan (error)
berada dalam batas yang diijinkan. Pada dasarnya kesalahan dalam analisis terbagi
menjadi tiga, yaitu:
1. Kesalahan nyata (gross error)
Kesalahan nyata merupakan yang jelas dilakukan dan melibatkan kesalahan
yang besar. Kesalahan ini tidak dapat ditolerir sehinnga untuk mengatasinya adalah
dengan mengulang kembali percobaan yang dilakukan. Contoh kesalahan nyata
adalah sampel tumpah, larutan pereaksi salah dan salah mengambil sampel (Rohman,
2007).
2. Kesalahan sistemik (Systematic error)
Kesalahan sistematik merupakan kesalahan dengan nilai definitif (nilai
tertentu), di mana hasil analisis yang mengandung kesalahan dapat mengarah ke arah
yang lebih kecil atau ke arah yang lebih besar dari rata-rata (Rohman, 2007).
diprediksi. Kesalahan sistematik tidak tergantung pada jumlah pengukuran sehingga
dapat dikurangi dengan memperbanyak jumlah pengukuran. Kesalahan sistemik
dinyatakan dengan nilai fungsi perolehan kembali (recovery function). Kesalahan ini
masih diperbolehkan apabila memenuhi syarat yang ditentukan.
3. Kesalahan acak (random error)
Kesalahan acak disebut juga kesalahan yang tidak tergantung (intermediate
error) yang tidak dapat diprediksi sehingga nilainya fluktuatif (Rohman, 2007).
Kesalahan ini kesalahan berhubungan dengan ketelitian yang berasal dari sumber
yang tidak dapat diprediksi. Kesalahan acak berhubungan dengan nilai presisi dari
suatu metode di mana dalam parameter koefisien variasi (CV) atau simpangan baku
relatif (RSD). Kesalahan ini masih diterima apabila nilai koefisien variasi atau
simpangan baku masih di bawah batas yang diijinkan.
Parameter untuk validasi sebagai berikut :
1. Linieritas
Linieritas merupakan kemampuan suatu metode analisis untuk membuktikan
bahwa metode korelasi yang baik dan proporsional terhadap respon instrument dan
konsentrasi dalam sampel (Harmita, 2004), lininearitas dapat ditentukan dengan
melakukan pengukuran pada beberapa analit. Nilai slope atau kemiringan (b),
intersep (a) dan kofisien korelasi dengan nilai mendekati 1 menunjukkan korelasi
yang baik antara konsentrasi analit dan respon (Harmita, 2004). Menurut Kingston
(2004) suatu analisis dikatakan memiliki korelasi yang baik jika baik jika koefisien
2. Presisi
Presisi adalah kedekatan hasil uji dengan memperoleh pengukuran dari
berbagai contoh dalam kondisi normal. Presisi menunjukkan ukuran derajat
kesesuaian antara hasil uji yang diukur melalui hasil penyebaran hasil uji rata-rata
yang ditetapkan secara berulang pada sampel yang diambil dari campuran yang
homogen. Presisi dapat didapat tiga tingkatan, yaitu keterulangan (repeatability),
intermediate precision, dan reproducibility (Ermer and Miller, 2005).
Pada umumnya nilai presisi dihitung menggunakan standar deviasi (SD)
untuk menghasilkan Relative Standard Deviasion (RSD atau Coeficient Variation
(CV). Presisi yang baik dinyatakan dengan semakin kecil persen RSD maka nilai
presisi yang didapatkan semakin bagus
SD = − 2
�−1
x = nilai dari masing-masing pengukuran
x mean = rata-rata (mean) dari pengukuran
N = frekuensi penetapan
N-1 = derajat kebebasan
RSD = SD
x mean x100%
RSD = Standar deviasi relatif (%)
SD = Standar deviasi
Tabel I. Nilai presisi yang dapat diterima menurut Kingston (2004)
Kadar zat aktif (%)
Nilai RSD yang masih dapat diterima (%)
>10 < 2
1-10 < 5
0, 1-1 < 10
<0, 1 < 20
3. Spesifisitas
Selektivitas atau spesifisitas suatu metode adalah kemampuannya yang hanya
mengukur zat tertentu saja secara cermat dan seksama dengan adanya komponen lain
yang mungkin ada dalam sampel atau sering juga diartikan spesifisitas adalah
kemampuan untuk mengukur yang dituju secara tepat dan spesifik dengan adaya
komponen-komponen lain. Dalam artian metode preparasi sampel tidak boleh hanya
membawa jumlah yang terukur dari sampel tetapi komponen yang bersama-sama
dengan analit tidak boleh mengganggu dalam analisis (Ohanesian et al, 2002).
H. Landasan Teori
Antioksidan merupakan sebutan untuk zat yang berfungsi melindungi tubuh
dari serangan radikal bebas. Yang termasuk ke dalam golongan zat ini antara lain
vitamin, polifenol, karotin dan mineral. Secara alami, zat ini sangat besar peranannya
pada manusia untuk mencegah terjadinya penyakit. Antioksidan melakukan semua ini
Pada tanaman trembesi mengandung flavonoid dan senyawa fenolik yang
kemampuan menangkap radikal bebas. Tanaman trembesi telah digunakan sebagai
pengobatan tradisional di Venezuala dan biji trembesi biasa digunakan sebagai tempe
untuk mengganti kedelai.
Kadar fenolik pada sampel ditentukan oleh kemampuan sampel mereduksi
reagen Folin-Ciocalteu yang mengandung senyawa asam fosfomolibdat-fosfotungstat
berwarna kuning yang akan membentuk senyawa kompleks berwarna biru. Warna ini
dapat diukur intesitasnya dengan spektrofotometri visible.
I. Hipotesis
Fraksi air ekstrak etanol biji trembesi memiliki kandungan senyawa fenolik
yang dinyatakan sebagai massa ekivalen asam galat pergram fraksi air ekstrak etanol
22
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian yang dilakukan termasuk eksperimental dengan rancangan acak
sederhana karena subjek uji diberi perlakuan.
B.Variabel Penelitian
1. Variabel bebas berupa konsentrasi fraksi air ekstrak etanolik biji trembesi.
2. Variabel tergantung berupa aktivitas antioksidan fraksi air ekstrak etanolik biji
trembesi.
3. Variabel pengacau terkendali berupa tempat tumbuh tanaman, waktu pemanenan,
umur tanaman, dan cara panen.
4. Variabel pengacau tidak terkendali berupa cahaya matahari, iklim dan cuaca.
C.Definisi Operasional
1. Ekstrak etanolik biji trembesi adalah sari hasil proses maserasi biji trembesi
dengan penyari etanol 70 %.
2. Fraksi air adalah hasil fraksi ekstrak etanolik biji trembesi dengan menggunakan
air yang telah difraksinasi menggunakan washbensin dan etil asetat.
3. Persen inhibition concentration (%IC ) adalah persen yang menyatakan
kemampuan fraksi air ekstrak etanolik biji trembesi untuk menangkap radikal
4. Inhibition concentration 50 ( IC50) adalah nilai konsentrasi fraksi air ekstrak
etanolik biji trembesi yang menghasilkan penangkapan 50% radikal DPPH.
D. Bahan dan Alat Penelitian 1. Bahan penelitian
Bahan yang digunakan dalam penelitian ini adalah: biji trembesi (Sa manea
saman (Jacq.) Merr ) yang terdapat di taman Universitas Sanata Dharma, kampus
III, Paingan (Yogyakarta); akuades (Laboratorium Kimia Analisis Instrumental
Fakultas Farmasi Universitas Sanata Dharma); bahan kualitas p.a. E. Merck, yaitu:
metanol, bahan kualitas p.a. Sigma Chem. Co., USA, yaitu: DPPH, reagen
Folin-Ciocalteu, asam galat, dan rutin; bahan kualitas teknis Brataco Chemica, yaitu:
wasbensin dan etil asetat; bahan kualitas teknis CV. General Laboratorium, yaitu:
etanol 70%; dan aluminium foil.
2. Alat penelitian
Alat yang digunakan dalam penelitian ini adalah: neraca analitik (Scaltec SBC
22, BP 160P), vacuum rotary evaporator (Junke & Kunkel), waterbath (labo-tech,
Heraeus), vortex (Janke & Kunkel), spektrofotometer UV-Vis (Perkin Elmer Lamda
20), blender, corong Buchner, oven, mikropipet 10-1000 L; 1-10 mL (Acura 825, Socorex), tabung reaksi bertutup, dan alat-alat gelas yang lazim digunakan di
E. Tata Cara Penelitian 1. Determinasi tanaman
Determinasi tanaman trembesi dilakukan di Laboratorium Farmakognosi
Fitokimia, Fakultas Farmasi USD menurut Plantamor dan Ntbg (2013).
2. Pengumpulan bahan
Tanaman trembesi diperoleh dari koleksi tanaman milik Universitas Sanata
Dharma. Pengambilan biji dengan kriteria berwarna hitam.
3. Preparasi sampel
Buah trembesi dikupas dan biji dipisahkan dari daging buahnya kemudian bijinya
dibersihkan dengan air mengalir lalu dikeringkan di bawah sinar matahari dengan
ditutupi kain hitam. Sampel kemudian diblender untuk mengecilkan ukuran partikel.
4. Pembuatan fraksi air
Simplisia yang telah dihaluskan ditimbang sebanyak 30 g dan dituang
kedalam bejana maserasi, ditambah etanol sampai terendam sempurna, dan dicampur
homogen. Campuran dimaserasi pada suhu ruangan selama dua hari. Filtrat diperoleh
melalui penyaringan dengan corong Buchner. Ampas penyaringan diremaserasi
dengan etanol secukupnya selama 2 hari, kemudian disaring. Lalu filtrat diuapkan
pelarutnya hingga diperoleh ekstak etanol biji trembesi.
Ekstrak etanol biji trembesi ditambah 300 mL air hangat dan diekstraksi
cair-cair menggunakan wasbensin dengan perbandingan larutan ekstrak wasbensin (1:1
v/v), kemudian didiamkan hingga terpisah sempurna. Fase air akan berada pada
Dari hasil partisi diperoleh dua fraksi, yaitu fraksi wasbensin dan fraksi air.
Selanjutnya, fraksi air diekstraksi cair-cair lagi menggunakan etil asetat dengan
perbandingan larutan fraksi air-etil asetat (1:1 v/v) sehingga didapatkan fraksi air dan
etil asetat. Setelah dipisahkan fraksi air diuapkan dengan va cum rotary evaporator
hingga didapakan ekstrak kental. Lalu hasil fraksi tersebut digunakan analisis lebih
lanjut.
5. Pembuatan larutan DPPH,pembanding dan uji
a. Larutan uji untuk penentuan kandungan fenolik total
Sebanyak 10 mg fraksi air ditimbang, kemudian diencerkan dengan metanol p.a
sampai 10 ml sehingga didapatkan konsentrasi sebesar 1000 g/ml. b. Pembuatan larutan asam galat
Sebanyak 25 mg asam galat ditimbang dan diencerkan dengan metanol p.a :
aquadest (1μ1) sampai 50 ml sehinggga didapatkan konsentrasi 500 g/ml. Diambil
sebanyak 2; 3; 4; 5; 6 ml larutan tersebut kemudian diencerkan dengan metanol p.a :
aquadest (1:1) hingga 25 ml kemudian akan diperoleh larutan asam galat dengan
konsentrasi 40; 60; 80; 100; 120 g/ml.
c. Pembuatan larutan DPPH
Sejumlah DPPH dilarutkan ke dalam metanol p.a sehingga diperoleh larutan
DPPH dengan konsentrasi 0,4 mM. Larutan tersebut ditutup dengan alumunium foil
dan dibuat selalu baru.
Sebanyak 2,5 mg stok rutin ditimbang dan ditambah metanol p.a hingga 10
ml.
e. Pembuatan larutan seri
Diambil 0,5; 1,0; 1,5; 2, dan 2,5 larutan stok rutin dan diencerkan dengan
metanol p.a hingga 25 mL pada labu ukur, sehingga akan diperoleh larutan dengan
konsentrasi 5; 10; 15; 20; 25 g/ml.
f. Pembuatan larutan uji aktivitas antioksidan dari ekstrak biji trembesi
Sebanyak 25 mg ekstrak ditimbang dan dilarutkan dengan metanol p.a
sampai 25 ml dan didapatkan konsentrasi 1 mg /ml. Dari larutan tersebut diambil
sebanyak 1; 2; 3; 4 dan 5 ml lalu di add dengan metanol p.a hingga 10 ml sehingga
didapat konsentrasi 100; 200; 3000; 400; 500 g/ml.
6. Uji pendahuluan
a. Uji fenolik
Sejumlah 0,5 ml larutan uji 1000 g/ml dan larutan pembanding asam galat
120 g/ml dimasukkan masing-masing dalam tabung reaksi dan ditambah 2,5 ml
larutan reagen Folin-Ciocalteu yang diencerkan dengan aquadest (1:10 v/v). Larutan
tersebut kemudian ditambah dengan 7,5 ml natrium bikarbonat 1 M. Setelah 10 menit
warna larutan diamati.
b. Uji pendahuluan aktvitas antioksidan
Sebanyak 1 ml larutan DPPH dimasukkan dalam masing-masing 3 tabung
reaksi. Pada masing-masing tabung reaksi kemudian ditambahakan dengan 1ml
larutan uji konsentrasi 120 µg/ml. Selanjutnya diencerkan dengan 3 ml metanol p.a.
Larutan tersebut divortex 30 detik. Setelah 30 menit diamati perubahan warna yang
terjadi.
7. Optimasi metode penentuan kandungan fenolik total
a. Penentuan OT (Operating Time)
Dibuat larutan baku asam galat konsentrasi 40; 80; dan 120 µg/ml dan
masing-masing larutan diambil 0,5 ml dan ditambah dengan 5 ml reagen
Folin-Ciocalteu yang diencerkan dengan aquadest (1:1). Kemudian larutan tersebut
ditambah dengan 4 mL larutan natrium bikarbonat 1 M. Absorbansinya diukur pada
panjang gelombang 750 nm selama 30 menit. Pengerjaan dilakukan 3 kali replikasi.
Operating time tercapai ketika absorbansi larutan telah stabil.
b. Penentuan panjang gelombang maksimum
Dibuat larutan baku asam galat dengan konsentrasi 40; 80; dan 120 µg/ml
dan masing-masing diambil sebanyak 0,5 ml dan ditambah dengan 5 ml reagen
Folin-Ciocalteu yang telah diencerkan dengan air (1:1) kemudian larutan ditambah 4 ml
larutan natrium karbonat 1M. Didiamkan selama OT kemudian diukur absorbansinya
pada panjang gelombang 600-800 nm.
8. Penetapan kandungan fenolik total
a. Pembuatan kurva baku asam galat
Sebanyak 0,5 mL larutan asam galat 40; 60; 80; 100; dan 120 µg/ml
v/v). Larutan selanjutnya ditambah dengan 4,0 ml natrium bikarbonat1M. larutan
didiamkan selama OT, absorbansinya dibaca pada panjang gelombang maksimum
terhadap blanko yang terdiri atas akuades : metanol p.a. (1:1), reagen Folin-Ciocalteu,
dan larutan natrium bikarbonat 1M. Pengerjaan dilakukan 3 kali.
b. Validasi metode penetapan kandungan fenolik total
Hasil dari prosedur 10 a divalidasi berdasarkan parameter presisi (%CV),
linieritas (nilai r) serta spesifisitas (spektra kontrol).
c. Estimasi kandungan fenolik total larutan uji
Diambil 0,5 mL larutan uji 1000 µg/mL, lalu dimasukkan ke dalam labu
ukur 10 ml, dan dilanjutkan sebagaimana perlakuan pada pembuatan kurva baku
asam galat. Kandungan fenolik total dinyatakan sebagai massa ekivalen asam galat
(mg ekivalen asam galat per gram fraksi air). Dilakukan 3 kali replikasi.
9. Optimasi metode uji aktivitas antioksidan
a. Penentuan panjang gelombang maksimum
Pada 3 labu ukur 10 mL, dimasukkan masing- masing 0,4; 1,2; dan 2 ml
larutan DPPH 0,4 mM. Tiap labu ukur tersebut ditambah metanol p.a hingga tanda
batas sehingga didapatkan konsentrasi DPPH sebesar0,016; 0,048; dan 0,080 mM.
Larutan tersebut divortex 30 detik. Larutan kemudian didiamkan selama 30 menit.
Lalu dilakukan pengukuran absorbansinya dengan spektrofotometer visible pada
panjang gelombang antara 400-600 nm.
Sejumlah larutan DPPH 0,4 mM dimasukkan ke dalam labu ukur sebanyak
3 buah berukuran 5 ml.Kemudian masing-masing labu ukur ditambahkan dengan 1
ml larutan pembanding rutin 5; 15; dan 25 µg/ml kemudian ditambah metanol p.a
hingga tanda batas. Larutan tersebut divortex selama 30 detik. Setelah itu dibaca
absorbansinya dengan spektrofotometri visible pada panjang gelombang hasil
pengukuran selama 1 jam. Perlakuan ini juga dilakukan untuk mencari OT dari
larutan uji fraksi fraksi air pada konsentrasi 100, 300, dan 500 µg/ml.
10. Pengujian aktivitas antioksidan
a. Pengukuran absorbansi larutan kontrol
Pada labu takar 5,0 ml, dimasukkan sebanyak 1,0 ml larutan DPPH 0,4 mM
kemudian ditambah metanol p.a hingga tanda batas. Larutan tersebut dibaca
absorbansinya pada saat OT dan panjang gelombang serapan maksimum. Pengerjaan
dilakukan sebanyak tiga kali. Larutan ini digunakan sebagai larutan kontrol untuk
menguji larutan pembanding dan larutan uji.
b. Pengukuran absorbansi larutan pembanding dan uji
Sebanyak 1,0 ml larutan DPPH 0,4 mM dimasukkan ke dalam
masing-masing labu ukur 5,0 ml kemudian ditambah dengan 1,0 ml larutan pembandingan 5;
10; 15; 20; 25 g/ml dan larutan uji 100; 200; 300; 400; 500 g/ml. Selanjutnya
tambahkan metanol p.a hingga tanda batas. Larutan tersebut kemudian divortex
selama 30 detik dan diamkan selama OT. Larutan dibaca absorbansinya dengan
spektrofotometer visibel pada panjang gelombang maksimum. Pengerjaan dilakukan
c. Validasi metode uji aktivitas antioksidan
Hasil dari prosedur 7 a dan b divalidasi berdasarkan parameter presisi (%
RSD), linieritas (nilai r) serta spesifisitas (spektra kontrol).
d. Prosedur 8 a dan b kemudian dihitung % IC dan IC50 untuk rutin dan
fraksi air ekstrak etanol biji trembesi.
F. Analisis hasil
Kandungan fenolik total dalam fraksi air ekstrak etanol biji trembesi
dihitung sebagai massa ekivalen asam galat per gram fraksi air. Nilai absorbansi
larutan uji dimasukkan ke dalam persamaan kurva baku asam galat sehingga
diperoleh nilai ekivalensi larutan uji terhadap asam galat. Kemudian dilakukan
perhitungan lebih lanjut berdasarkan rumus di bawah.
Kandungan fenolik total =� �
Aktivitas penangkapan radikal DPPH (% IC) dihitung dengan rumus :
% IC = − 100%
Data aktivitas dianalisis dan dihitung nilai IC50 melalui persamaan
regresi linier dengan sumbu x adalah konsentrasi larutan uji maupun larutan
pembanding dan y adalah % IC. Untuk menentukan ada atau tidaknya perbedaan
bermakna antara IC50 antara larutan pembanding dan larutan uji kemudian dilakukan
31
BAB IV
HASIL DAN PEMBAHASAN
A. Determinasi Tanaman
Determinasi tanaman dilakukan untuk memastikan bahwa tanaman yang
digunakan dalam penelitin sesuai dengan pustaka dan menghindari kekeliruan dalam
pengambilan bahan penelitian. Determinasi tanaman dilakukan di Laboratorium
Farmakognosi Fitokimia, Fakultas Farmasi, Universitas Sanata Dharma, Yogyakarta,
pada tanggal 4 September 2013 berdasarkan acuan dari Plantamor dan Ntbg (2013).
Hasil ( lampiran 1) determinasi menunjukkan bahwa memang benar tanaman yang
digunakan adalah Samanea saman (Jacq.) Merr.
B. Pengumpulan Bahan
Bahan biji trembesi diperoleh pada tanggal 23 November 2012 dari
tanaman inventaris milik Universitas Sanata Dharma, Kampus III, Paingan,
Yogyakarta. Tanaman yang digunakan merupakan tanaman yang sengaja ditanam
dilingkungan Kampus III, Universitas Sanata Dharma, Paingan, Yogyakarta yang
berfungsi sebagai penyerapan karbon dioksida, suasana menjadi teduh dan asri.
Pemilihan sumber tanaman dengan tumbuhan trembesi didalam lingkungan kampus
Universitas Sanata Dharma dan mudah ditemukan serta dirawat secara khusus
sebagai tanaman taman. Selain itu, spesies tanaman lebih mudah dipastikan karena
Waktu pemanenan yang tepat akan menghasilkan simplisia yang mengandung
bahan yang optimal. Kandungan kimia dalam tumbuhan tidak sama sepanjang waktu.
Kandungan kimia akan mencapai kadar optimum pada waktu tertentu. Ketentuan
pemanenan buah yang baik yakni pada saat buah telah matang. Buah telah matang
dipeti . Kemudian dikupas kulit buahnya dengan pisau kemudian biji dikumpulkan
dan dicuci.
Setelah dilakukan pencucian biji trembesi selanjutnya dilakukan proses
pengeringan. Pengeringan merupakan proses pengawetan simplisia sehingga
simplisia tahan lama dalam penyimpanan. Selain itu pengeringan akan menghindari
penguraian kandungan kimia karena pengaruh enzim. Pengeringan yang cukup akan
mencegah pertumbuhan mikroorganisme atau jamur (kapang). Proses pengeringan
dilakukan sampai diperoleh simplisia kering . Menurut persyaratan OT pengeringan
dilakukan sampai kadar air tidak lebih dari 10% (Agoes, 2007) .
Pengeringan untuk bahan yang akan terekstraksi harus dalam keadaan
terawasi untuk mencegah terjadinya perubahan kimia yang terlalu banyak. Bahan
harus dikeringkan secepat-cepatnya, tanpa menggunakan suhu tinggi, lebih baik
dalam aliran udara yang baik (Harborne,1987).
Biji trembesi yang sudah kering diserbuk halus penyerbukan bertujuan untuk
memperluas permukaan simplisia sehingga proses ekstrasi lebih efektif. Permukaan
yang luas memungkinkan interaksi yang lebih banyak antara simplisia dengan cairan
C.Hasil Ekstraksi
Ekstrak etanolik biji trembesi dibuat dari maserasi serbuk menggunakan
etanol 70% dalam bejana tertutup. Proses dianggap paling tepat karena simpilsia
yang sudah halus memungkinkan untuk direndam dalam cairan penyari sampai
meresap dan melunakkan susunan sel. Hal ini memungkinkan zat-zat yang mudah
larut akan melarut .
Etanol digunakan sebagai cairan penyari karena berapa kelebihan antara lain
tidak beracun, netral dan merupakan pelarut universal artinya baik senyawa polar dan
non polar dapat tersari di dalamnya. Hal ini berkaitan dengan gugus fungsi yang
dimiliki etanol yaitu polar (gugus OH) dan non polar (gugus R), sehingga flavonoid
,saponin dan tannin berdasarkan sifat kepolaran masing-masing dapat tersari dalam
etanol 70%. Etanol 70 % sangat efektif dalam menghasilkan jumlah bahan aktif yang
optimal (Voigt, 1995).
Dalam biji trembesi terkandung berbagai macam senyawa yang beberapa
diantaranya dapat membantu kelarutan senyawa lain (bertindak sebagai co-solvent).
Hal ini dapat menyebabkan hampir semua bahan dapat terekstraksi ke dalam etanol.
Penyari simplisia biji trembesi menggunakan metode maserasi karena metode
ini mempunyai beberapa kelebihan dibandingkan metode ekstraksi yang lain. Metode
ini sangat sederhana, mudah dilakukan dan cepat pelaksanaannya. Maserasi
dilakukan dalam bejana tertutup agar etanol tidak menguap karena etanol mudah
menguap pada suhu kamar. Di samping itu, juga untuk mencegah masuknya
tertentu yang mudah teroksidasi oleh oksigen dari udara seperti fenol yang dapat
teroksidasi sehingga membentuk polimer.
Maserasi dilakukan dalam bejana tertutup dibungkus dengan alumunium foil
agar tidak kena cahaya dan terhindar dari paparan sinar matahari untuk menghindari
penguapan etanol dan menghindari oksidasi terhadap senyawa aktif. Pada penelitian
ini maserasi dilakukan pada serbuk biji trembesi dalam etanol 70% selama 2 hari,
sambil sekali diaduk setiap harinya. Pengadukan penting dilakukan agar sel yang
kontak dengan cairan penyari lebih banyak sehingga difusi senyawa cairan dalam
penyari juga banyak dan penyarian dapat berjalan optimal. Setelah 2 hari dilakukan
penyaringan dengan menggunakan vakum, kemudian dimaserasi kembali
menggunakan etanol 70 % lalu didiamkan selama 2 hari. Filtrat kemudian disaring
dan dicampurkan dengan filtrat sebelumnya.
Penyaringan dilakukan dengan bantuan pompa vakum karena jumlah bahan
yang banyak sehingga akan membutuhkan waktu yang lama jika disaring secara
biasa. Filtrat etanol dapat diendapkan dengan tujuan untuk mengendapkan zat-zat
yang tidak larut etanol, yang ikut lolos dalam proses penyaringan. Ada beberapa zat
tidak larut dalam etanol seperti amilum, lipid, organel-organel sel, zat tersebut dapat
menjadi senyawa pengganggu. Penelitian ini menggunakan serbuk simplisia kering.
Dalam proses penyerbukan kemungkinan dapat terjadi pemecahaan vakuola sel dan
Ekstrak etanol hasil pengendapan selanjut disaring dan maserat
diuapkan menggunakan vaccuum rotary evaporator. Dalam penguapan larutan penyari digunakan vaccuum rotary evaporator dengan tujuan untuk menghindari kontak dengan panas berlebihan yang dapat merusak sebagian komponen senyawa
kimia yang terkandung didalamnya. Tekanan rendah, etanol akan menguap pada suhu
dibawah titih didih normalnya. Penguapan dilakukan sampai tidak menetes lagi
pelarut etanol dalam vaccuum rotary evaporator, diperoleh ekstrak kental (diasumsikan tidak terdapat lagi pelarut etanol). Hasil dari penguapan ini diperoleh
ekstrak etanolik kental biji trembesi, kemudian dihitung persen rendemen. Hal ini
bertujuan untuk mengetahui perbandingan berat ekstrak yang tersari dengan berat
bahan mula-mula. Hasil proses maserasi dari serbuk kering biji trembesi, diperoleh
rendemen ekstrak sebesar 13,9885 g.
D.Hasil Fraksinasi
Dari hasil ekstrak dilakukan partisi ekstrak etanol dengan beberapa pelarut.
Proses partisi sangat diperlukan mengingat senyawa aktif dalam tanaman sangat
bervariasi struktur sesuai dengan golongan dan subsituennya. Perbedaan golongan
dan subsituen inilah yang menyebabkan perbedaan polaritas. Akibatnya kelarutan
senyawa aktif dalam tanaman sulit ditentukan kelarutannya secara umum dan
diperlukaan pelarut bertingkat polaritasnya untuk menekstrasksi senyawa aktif dalam
tanaman. Partisi bertingkat akan memisahkan komponen aktif ke dalam fraksi non
Dalam penelitian ini, fraksi yang diteliti adalah fraksi air. Sebelum fraksi,
ekstrak etanol kental dilarutkan dengan air hangat agar mudah difraksi. Fraksi diawali
dengan pencucian ekstrak dengan washbensin 1:1 untuk mengekstraksi senyawa non
polar seperti lemak, minyak, vitamin dan aglikon flavonoid yang non polar misalnya
aglikon isofalvon dan termetoksilasi (Harborne,1987). Kemudian wasbensin dan
ekstrak menggunakan prinsip ekstraksi cair-cair. Ekstraksi cair-cair prinsip like
dissolve like sehingga zat yang nonpolar akan terbawa dalam pelarut nonpolar dan
pelarut polar akan terbawa dalam pelarut polar. Fraksi air dan fraksi washbensin
akan terpisah dalam corong pisah itu terjadi karena perbedaan berat jenis antar
cairan. Dimana washbensin memiliki berat jenis lebih kecil dibandingkan air,
sehingga akan berada diatas permukaan air. Fase air kemudian diambil dan fase
washbensin dibuang, dan fase air siap difraksi dengan etil asetat.
Dengan menggunakan proses yang sama seperti pada proses diatas
kemudian difraksinasi kembali dengan etil asetat. Fraksi air dan etil asetat dicampur
dengan corong pisah. Etil asetat berada diatas permukaan air karena berat jenis yang
lebih kecil. Senyawa polar yang larut air seperti antosianin, fenolik dan glikosida
akan terbawa dalam fase air sedangkan senyawa yang semipolar larut dalam etil
asetat seperti isoflavon, flavonon dan flonol. Fraksi air yang dihasilkan berupa
cairan. .Fraksi air yang diperoleh diuapkan dengan vacuum rotary evaporator. Fraksi
E.Uji Pendahuluan
Uji pendahuluan bertujuan untuk menentukan ada tidaknya keberadaan suatu
aktivitas antioksidan dan senyawa fenolik dalam fraksi air dengan mereaksikan suatu
sampel uji dengan reaktan tertentu sehingga menunjukkan sifat fisik berupa warna
tertentu sebagai indikator. Uji pendahuluan yang dilakukan disebut juga uji tabung
karena uji kualitatif dilakukan dengan tabung reaksi.
1. Hasil uji kualitatif fenolik
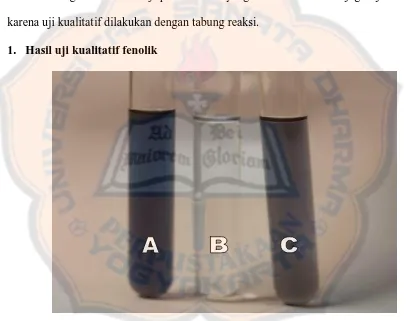
Gambar 2 . Uji kualitatif fenolik. A= asam galat, B= blanko, C= fraksi uji
Uji kualitatif fenolik bertujuan untuk mengetahui kandungan senyawa fenolik
dalam fraksi air ekstrak etanol biji trembesi. Pengujian kualitatif sangat penting
untuk menentukan langkah selanjutnya, yakni uji kuantitatif kandungan senyawa
dengan fraksi air biji trembesi maka akan terjadi perubahan warna menjadi biru.
Intensitas warna biru ditentukan dengan banyaknya kandungan fenolik dalam fraksi
air biji termbesi. Semakin banyak konsentrasi senyawa fenolik dalam fraksi air biji
trembesi maka akan semakin biru yang terlihat. Menurut Singleton dan Rossi
(1965), warna biru yang teramati berbanding lurus dengan konsentrasi ion fenolat
yang terbentuk. Semakin besar konsentrasi senyawa fenolik maka semakin banyak
fenolat yang terbentuk sehingga warna biru yang dihasilkan semakin pekat. Fenolat
hanya terdapat dalam larutan basa, tetapi dengan pereaksi Folin-Ciocalteu dan produk
tidak stabil pada kondisi basa. Penambahan natrium karbonat pada uji fenolik
bertujuan untuk membentuk suasana basa agar terjadi reaksi reduksi Folin-Ciocalteu
oleh gugus hidroksi dari fenolik di dalam fraksi air biji trembesi.
Pengujian ini menggunakan pembanding berupa asam galat dan metanol.
metanol sebagai kontrol negatif dan asam galat sebagai kontrol positif. Hasil yang
diperoleh dari uji kualitatif menunjukkan terjadi perubahan warna menjadi biru tua
dalam fraksi air biji trembesi, setelah ditambahkan reagen Folin Ciocalteu dan
natrium karbonat, perubahan yang sama juga terjadi pada kontrol positif asam galat,
dan pada metanol tidak terjadi perubahan warna. Dari uji kualitatif yang telah
dilakukan disimpulkan bahwa fraksi air ekstrak etanol biji trembesi memiliki